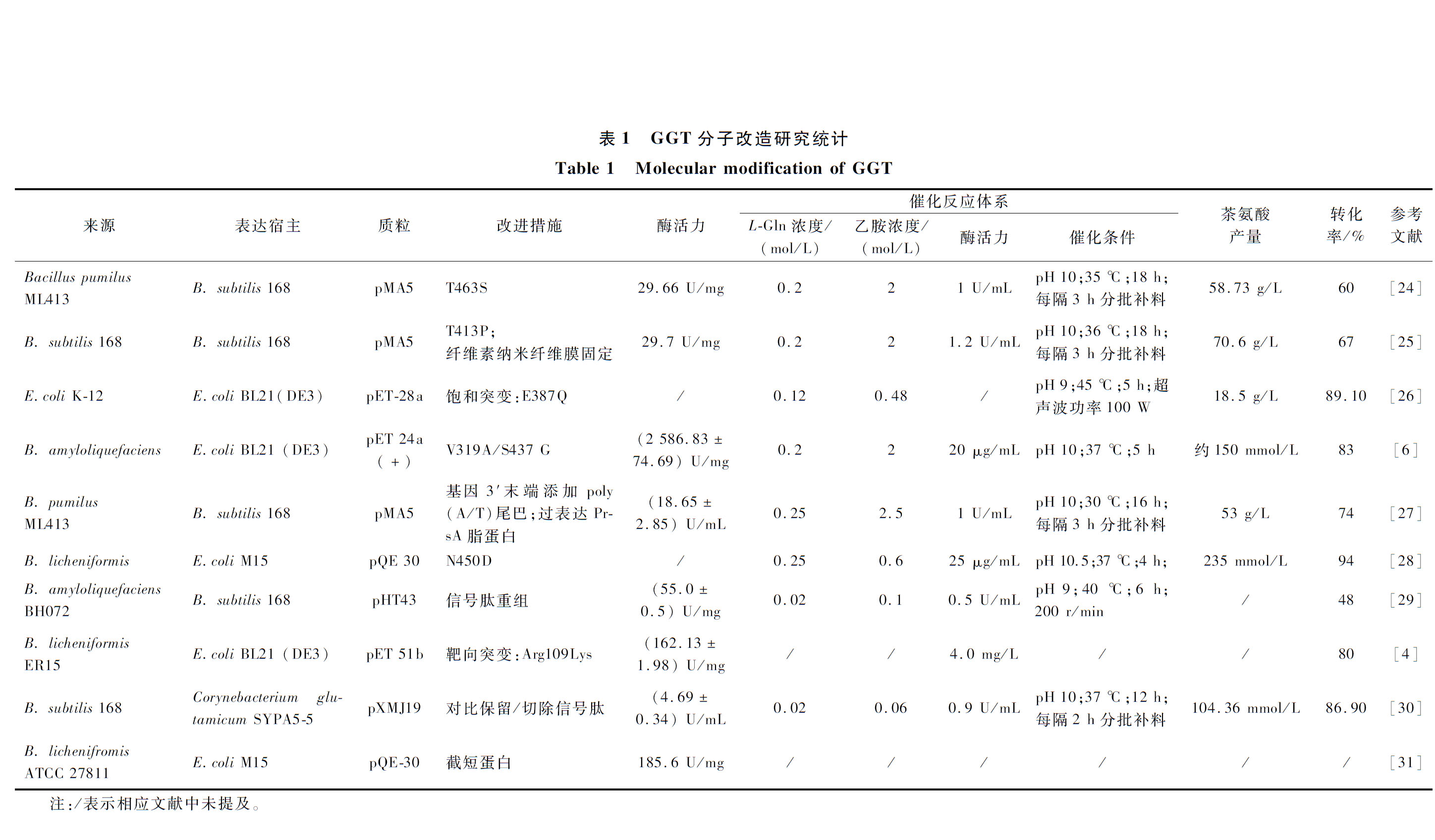
γ-谷氨酰转肽酶(γ-glutamyl-transpeptidase, GGT, EC 2.3.2.2)属于N-端亲核氨基水解酶类(N-terminal nucleophile aminohydrolases superfamily),广泛存在于动物、植物和微生物等生物体中,具有高度保守性。GGT一般以异源二聚体的形式在生物体内发挥作用,其特异性作用于γ位肽键,能够催化断裂γ-谷氨酰基化合物中的谷氨酰胺键,并将γ-谷氨酰基转移到其他受体(如氨基酸、肽、胺等)上。由于GGT催化专一性强且不消耗ATP,在食品功能因子绿色生物制造领域具备突出优势。目前,GGT已在合成茶氨酸等各种生物活性γ-谷氨酰化合物方面显示出较大的工业应用潜力。本文主要综述了GGT的分子结构、催化特性及其在食品工业领域应用的研究进展。
1 GGT的来源和分布
GGT作为一种重要的生物体内代谢酶,分布较为广泛。其中哺乳动物GGT在谷胱甘肽(L-glutathione,GSH)代谢和γ-谷氨酰基循环中起着重要作用,被认为是人体许多生理疾病的诊断标志物。在酶工程应用领域,目前已报道的GGT催化功能及应用研究以微生物源最为多见,对于结构与功能研究较多的是来源于大肠杆菌(Escherichia coli)[1]和枯草芽孢杆菌(Bacillus subtilis)的GGT[2]。此外,一些地衣芽孢杆菌(Bacillus licheniformis)[3-4]、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[5-6]和幽门螺杆菌(Helicobacter pylori)[7]等微生物来源的GGT也具有一定的应用潜力。
GGT的分布在真核生物与原核生物体内具有一定差异性。真核生物中,GGT通常被糖类物质修饰形成糖蛋白,分布于质膜,其活性位点位于质膜外部。例如,在人体和其他一些高等哺乳动物中,GGT主要结合于肾、胰、肝、脾和小肠等组织的微绒毛膜上,其中肾脏GGT含量最高[8];在昆虫体内GGT则主要结合在线粒体膜上。而原核生物中,GGT通常是一种以可溶性形式表达的非糖基化蛋白,其分布位置因其所属菌属而异,主要以游离态存在,通过N端信号肽定位于细胞周质空间或分泌到细胞外。如大肠杆菌GGT一般是周质空间蛋白质,而芽孢杆菌GGT基本全部分泌到细胞外,属于胞外酶[9]。因此原核生物来源的GGT更易于酶的分离纯化和大规模提取制备,在食品工业中主要利用微生物来源的GGT进行茶氨酸等γ-谷氨酰基化合物的催化合成研究及应用。
2 GGT的结构及催化机制
2.1 GGT前体自催化裂解成熟机制
目前已报道的GGT蛋白质晶体结构研究表明,不同来源的GGT分子结构总体保守,属于N末端亲核水解酶超家族[10]。该超家族成员具有一个共同特点,其基因先经过转录和翻译生成无活性前体蛋白,由活化的N端丝氨酸或苏氨酸进行自催化裂解后才能产生相应的酶活力。
HASHIMOTO等[11]对大肠杆菌GGT的定位进行分析,发现在细胞周质空间中仅含成熟形式GGT,细胞质膜中只含有其前体,细胞质中不存在前体。这表明GGT成熟过程中存在蛋白水解过程。如图1所示,GGT由单个基因编码合成为一条多肽链,其N端带有引导蛋白分泌至细胞外的信号肽序列。GGT前体形成后首先结合至细胞质膜,在信号肽引导下从膜上释放并定位到周质空间,随后信号肽被酶切割去除,前体再经过自催化反应形成具有活性的成熟酶。GGT前体本身具有催化该自剪切反应的活性中心,无需其他催化剂,催化的关键氨基酸为小亚基N端高度保守的苏氨酸,前体蛋白水解成为二聚体,得到的C端和N端分别形成大亚基和小亚基,其中该苏氨酸残基成为小亚基的N端残基,成为后续酶促反应的活性中心(亲核试剂)[12]。
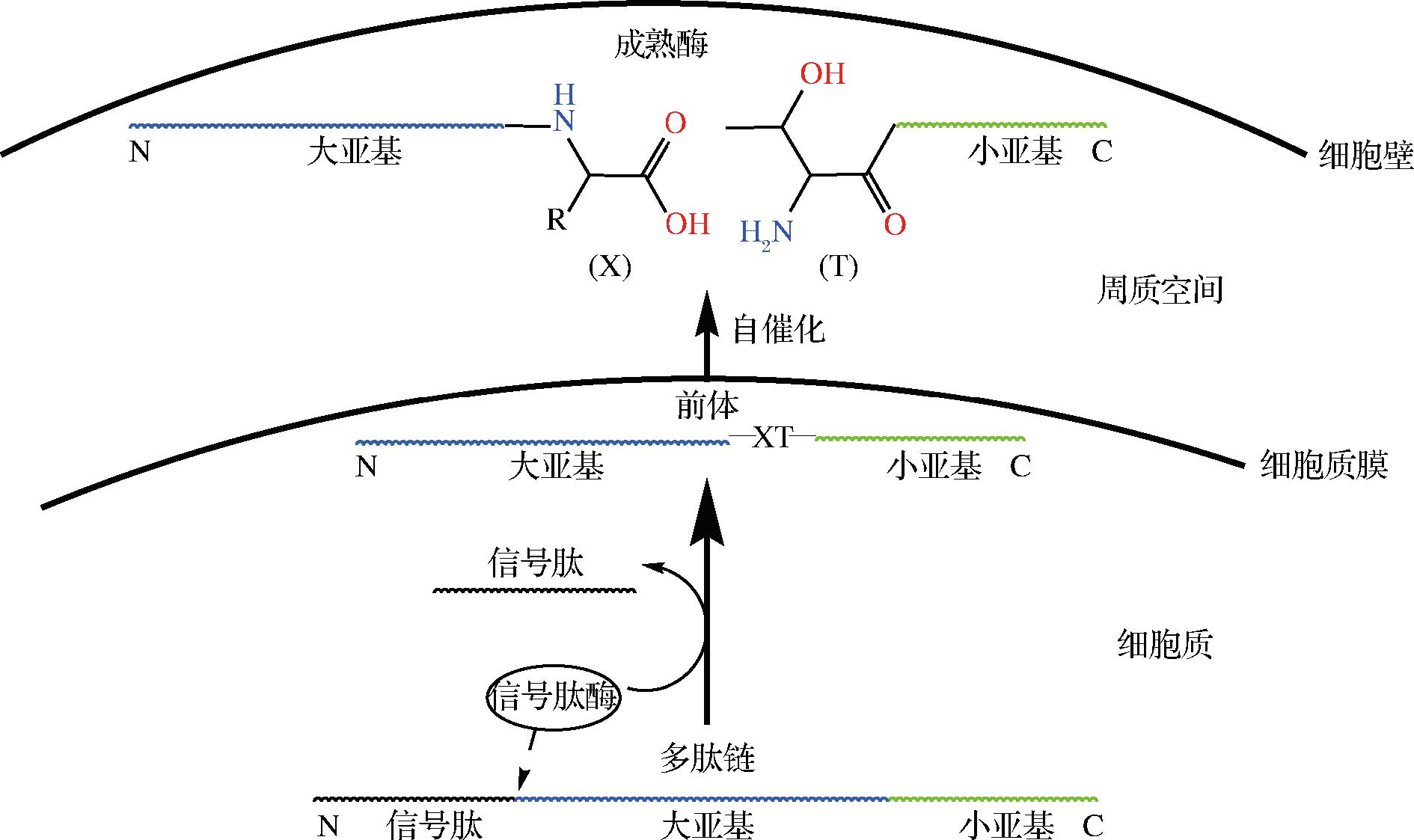
图1 GGT的两步成熟机制
Fig.1 Two-step maturation mechanism of GGT
2.2 成熟GGT的分子结构
成熟GGT在微生物体内以异二聚体酶的形式发挥作用。根据已报道的GGT晶体结构[13-15],GGT整体结构类似于肾形,具有4层夹心(α/β/β/α)的核心结构,来自大小2个亚基的β链反向平行排列形成位于α-螺旋层之间的β-折叠夹心层,如图2所示。该核心结构在N-端亲核水解酶超家族成员中是保守的。在β折叠下方有一个浅槽区域,其中的活性中心包含能够与半胱氨酰基、甘氨酰基和γ-谷氨酰基结合的3个亚位点。前两者结合位点决定该酶的反应受体只能是L-氨基酸或二肽,进一步证实不同来源的GGT具有相似的催化特性和底物特异性,其只对含γ-谷氨酰残基的化合物有光学和立体专一性催化作用[16]。
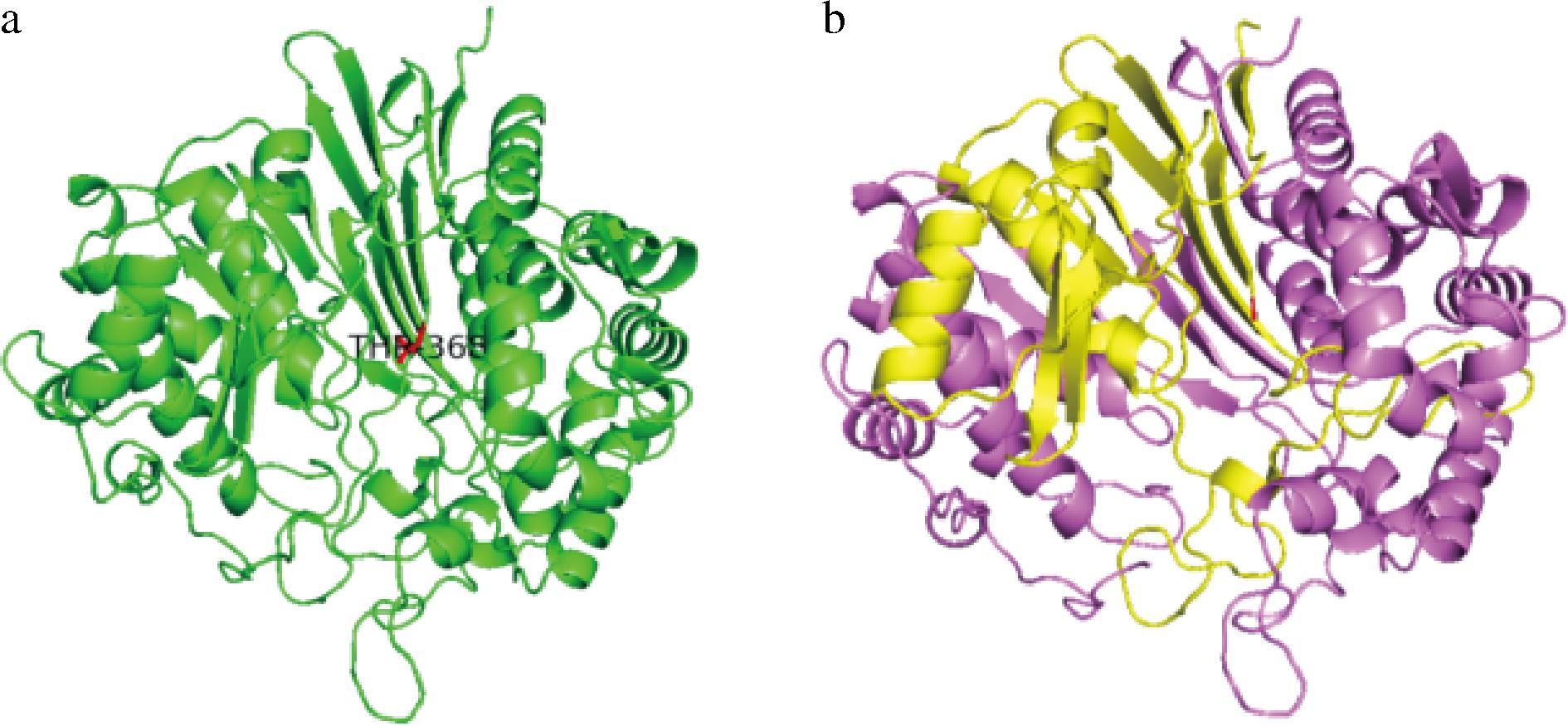
a-前体;b-成熟
图2 枯草芽孢杆菌来源BsGGT的前体和成熟形式示意图
Fig.2 Schematic diagram of precursor and mature forms of BsGGT 注:B中大亚基以紫色标识,小亚基以黄色标识。
位于底物结合口袋底部的γ-谷氨酰基结合位点如图3所示,GGT发挥催化活性所必需的氨基酸残基在微生物和哺乳动物中高度保守。

图3 E.coli GGT的γ-谷氨酰基结合位点[17]
Fig.3 The γ-glutamyl binding sites of E.coli GGT[17] 注:T391为活性中心(Helicobacter pylori GGT中为T380,Bacillus licheniformis GGT中为T399);G483和G484有助于形成氧阴离子空穴;R114、S462、S463、T409、N411、Q430、D433等参与γ-谷氨酰底物的识别与结合(除R114外,所有参与γ-谷氨酰结合的残基都属于 小亚基)。
小亚基N端高度保守的苏基酸残基除了负责前体蛋白自催化水解外,也是GGT催化反应中作为亲核试剂进攻底物的关键催化位点[17]。
根据活性中心是否存在盖环(lid-loop)结构序列,可以将GGT分为带有“活性开关装置”和“开放式”活性中心两类,如图4所示。
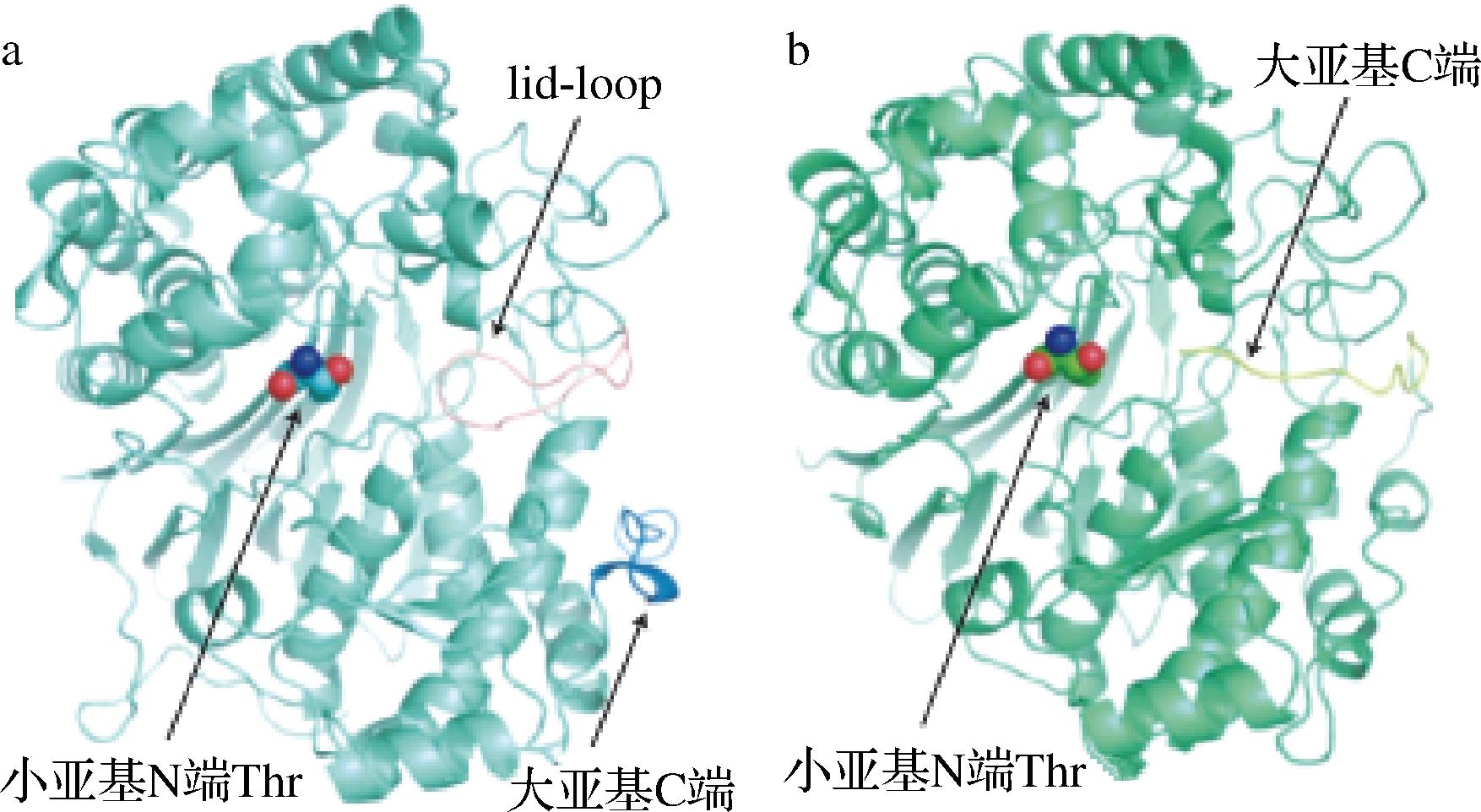
a-EcGGT;b-BlGGT
图4 EcGGT和BlGGT的三维结构[18]
Fig.4 Three-dimensional structure of EcGGT and BlGGT[18]
来自真核生物和革兰氏阴性菌为盖环阳性GGT;来自芽孢杆菌、古生菌和极端微生物的为盖环阴性GGT[19]。盖环的存在与否与组成差异影响催化反应的底物结合及反应速率。在GGT催化反应过程中,盖环作为底物和产物进出的开关,能够根据分子大小影响供体底物的选择[20];同时其将活性中心与外部环境隔离,使γ-谷氨酰酶中间体免受大体积溶剂分子攻击,从而抑制水解反应,有利于转肽反应发生[21]。此外,盖环中芳香残基等性质差异影响其流动性和转肽反应速率,如哺乳动物GGT的酶活力高于原核生物来源GGT[22]。而无盖环GGT活性中心开放,其底物结合口袋暴露于溶剂中,更利于催化大型聚合物底物的水解[23]。GGT盖环结构与功能研究有助于结合目标反应底物对不同来源GGT进行筛选,同时也为理性设计具有特异性催化活性的GGT突变体提供了参考。
2.3 GGT的催化机制
虽然不同来源GGT的分子结构较为保守,但不同生物体来源的GGT之间仍存在一定的底物特异性等催化功能差异。例如,所有GGT都对γ-谷氨酰供体化合物的构型表现出宽松的立体特异性,可以接受L-型和D-型的γ-谷氨酰衍生物[21]。哺乳动物及大肠杆菌GGT对L-氨基酸受体表现出严格的立体特异性,而枯草芽孢杆菌GGT具有更广泛的底物立体特异性。与哺乳动物GGT不同,微生物GGT倾向于接受谷氨酰胺作为供体底物。
如图5所示,GGT的催化反应是基于γ-谷氨酰基团从供体底物向受体底物的转移过程。催化反应遵循两步进行:1)GGT小亚基N端苏氨酸的γ位氧原子进攻γ-谷氨酰化合物的羰基碳原子,与其共价连接形成γ-谷氨酰-酶中间体;2)γ-谷氨酰受体作为亲核试剂进入活性中心,进攻中间体的羰基,断键生成新的γ-谷氨酰化合物,同时释放酶。实验结果表明,反应的第二步即中间体的水解,比第一反应步骤更慢[17],为催化反应的限速步骤。
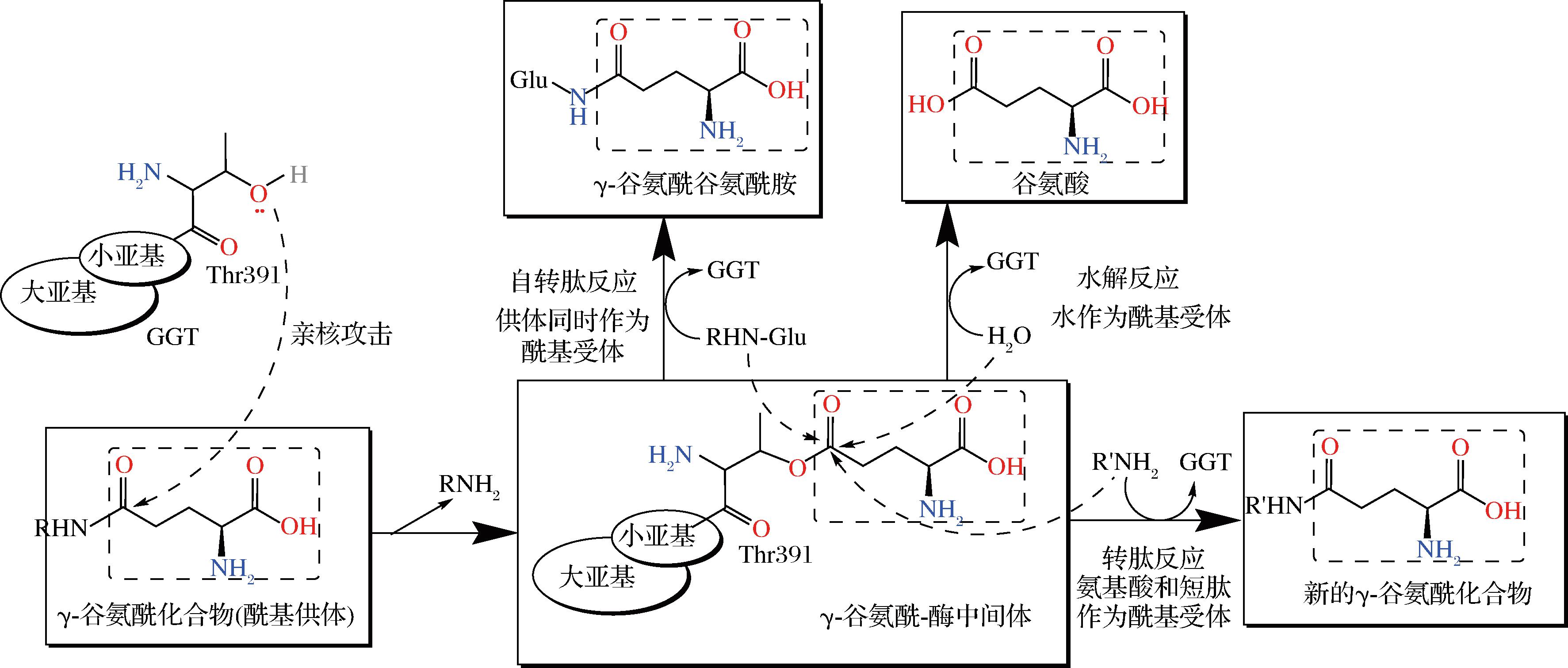
图5 GGT催化机制示意图
Fig.5 Schematic diagram of the GGT catalytic mechanism
根据受体的不同,GGT可以催化3类反应:
1)转肽反应:当氨基酸和短肽作为γ-谷氨酰胺受体时,GGT催化转移GSH等γ-谷氨酰化合物的γ-谷氨酰基,形成新的γ-谷氨酰化合物。方程式为γ-Glu-R+R′H→γ-Glu-R′+AH。
2)水解反应:水分子作为γ-谷氨酰胺受体时,GGT催化转移供体底物分子中的γ-谷氨酰基到水分子上形成谷氨酸。方程式为γ-Glu-R+H2O![]() γ-Glu+RH。
γ-Glu+RH。
3)自转肽反应:γ-谷氨酰基化合物同时作为γ-谷氨酰基的供体和受体。方程式为γ-Glu-R![]() γ-Glu-Glu-R+AH。
γ-Glu-Glu-R+AH。
3 GGT的分子改造
目前针对GGT的研究主要侧重于酶的克隆、表达、结构分析和应用,对其有关应用的酶学性质及酶分子改造研究尚有待进一步开展。已有研究表明GGT的关键氨基酸残基对于高效率发挥转肽作用至关重要,对其关键位点进行优化改造是提高酶的催化效率的重要手段。通过分子改造技术对野生GGT进行理性设计改造,突破上述瓶颈对GGT作为生物催化剂的工业化应用具有重要意义。
对酶的分子改造主要有2种途径:理性设计与定向进化。理性设计基于酶结构与催化功能之间的关系,将经过分析、改造的GGT基因在大肠杆菌或枯草芽孢杆菌等宿主中重组表达,从而提高酶的催化活性、底物适应性、耐热性或稳定性等催化特性。定向进化法则通过模拟自然进化机制,无需提前了解酶的空间结构及催化机理,通过引入随机突变,同时结合高通量筛选技术以确定进化方向,从而实现酶的体外改造。近年来,为更好地满足GGT工业化生产应用需求,研究者们一直致力于提高GGT的表达量以及催化效率(表1)。鉴于GGT催化机制的保守性,现有研究结果可为GGT的进一步酶工程改造提供参考思路,从而为酶法合成茶氨酸等γ-谷氨酰化合物提供性能优良、具有工业应用价值的生物催化剂。
目前,结构生物学研究已经解析了GGT供体结合位点的详细空间细节,但受体结合位点的氨基酸残基鉴定仍不明确。因此未来应进一步尝试在受体底物存在的情况下进行共结晶研究,以明确有关受体结合位点空间构造及氨基酸残基信息。此外,目前有关GGT的定点突变研究主要集中在具有重要催化作用的小亚基氨基酸残基上,为更好地理解GGT结构与功能关系、对GGT进行针对性的分子改造,未来还需要对这些突变体的蛋白质结构进行解析。
4 GGT的酶学特性
尽管具有相似的催化功能,由于不同来源的酶在蛋白质序列、空间构象以及在生物体内的分布等方面存在差异,导致其酶学特性也表现出一定差异。通过反应条件优化(供体/受体比、pH、时间、温度和酶量),可以选择性地增强GGT的活性。
不同来源的GGT催化反应时所需的最适pH不同。真核生物GGT催化所需的最适pH值为8.0~11.0。原核生物中,芽孢杆菌属GGT最适pH值为7.0~10.0[32]。此外,GGT 在反应体系中的催化反应类型也受环境pH值影响,通常酸性或中性条件(pH 6~8)利于水解反应;碱性条件(pH 8~9)下具有较高的催化转肽反应活性,其中原核生物来源GGT催化转肽反应的pH值范围相对较宽,为6.0~10.5[33]。催化转肽反应合成γ-谷氨酰基化合物时,GGT在pH>9.0条件下仍能保持酶活性,且可有效抑制水解反应[8],提高转肽反应效率。因此可以通过调节反应体系的pH值使酶进行选择性催化,也可以根据不同酶的pH稳定性选择特定耐酸或耐碱的酶种。但KEILLOR等[34]发现在碱性条件下利用GGT催化转肽反应时还存在自转肽反应,对产量和纯度造成不良影响。因此在GGT工业化进程中,设法降低自转肽反应发生率和提升转肽效率是提高产量的关键问题。
不同来源的GGT最适反应温度和对温度的耐受性存在差异,微生物来源GGT的最适催化温度范围为37~60 ℃。房鑫等[35]通过比较大肠杆菌和枯草芽孢杆菌GGT热稳定性差异,发现大肠杆菌GGT由于存在大量疏水键维持其多亚基四级结构,在低温条件下具有更高的稳定性;而在高温条件下,二级结构的改变导致其酶活性低于枯草芽孢杆菌GGT。
此外金属离子及盐浓度对GGT活性也有一定的影响。金属离子的加入会使溶液离子强度产生不同程度的变化,影响蛋白质链上氨基酸的电离,从而改变蛋白质的高级结构,部分金属离子甚至会影响酶活性中心的空间结构。对地衣芽孢杆菌C12菌株GGT的实验表明[8],在金属离子浓度为5 mmol/L的条件下,Ba2 +、Mg2+、Ca2+能够促进酶活力,但一价金属离子K+和Na+以及三价金属离子Al3+的加入对酶活力有一定的抑制作用。KIMANI等[32]对枯草芽孢杆菌168同源过量表达得到的GGT进行分析,证明Cu2+和Zn2+对GGT活力具有明显抑制作用,NH4+有显著促进作用,同时首次发现镧系元素(La3+)对GGT活力具有促进作用。LIN等[31]发现CoCl2最终浓度为1 mmol/L时对酶活性没有影响,而Hg2+、Zn2+、Pb2+、Ni2+离子的氯化盐对GGT活性有抑制作用。Mg2+、K+、Na+离子的氯化盐对酶活性有很强的增强作用,特别是当这些离子的浓度超过10 mmol/L时。
一些微生物来源的GGT具有较强的耐盐性,如枯草芽孢杆菌和地衣芽孢杆菌来源的BsGT和BlGT。BsGT耐盐机制可能是由于其蛋白质表面有强酸补丁,可以使其保持水合状态,即使在高盐条件下也能够避免自聚集[14]。这与TATE等[36]的研究结果相一致,即嗜盐酶比其非嗜盐同源酶表面的酸性残基所占比例更高。
5 GGT的检测方法
5.1 分光光度法
在有受体和无受体情况下,γ-谷氨酰对硝基苯胺(L-γ-glutamyl-p-nitroanilide,γ-GpNA)的转肽反应或水解程度可分别反映GGT转肽和水解活性。
5.1.1 GGT的转肽活性测定
一般采用以γ-GpNA为供体、双甘二肽为受体的酶反应体系测定GGT的转肽活力,如图6所示。构建含有一定终浓度的γ-GpNA、双甘二肽、NaCl、缓冲液和酶液的反应体系,恒温水浴37 ℃反应一定时间,加入醋酸溶液终止反应,于分光光度计(λ=410 nm)测定吸光值。1个转肽酶活力单位定义为该条件下每分钟生成 1 μmol 对硝基苯胺的酶量。
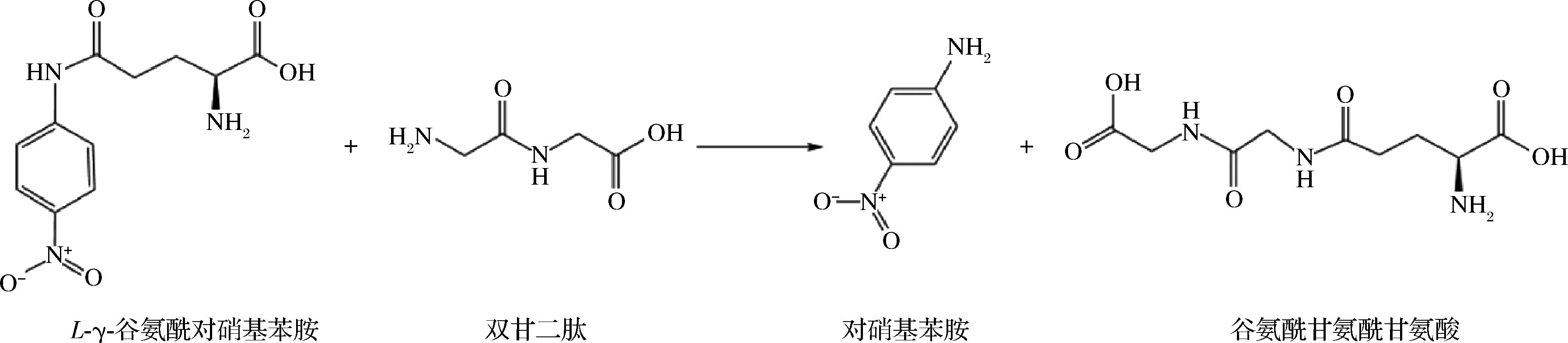
图6 转肽酶活力测定体系中发生的反应
Fig.6 The reaction occurred in the assay system of transpeptidase activity
5.1.2 GGT的水解活性测定
GGT的水解活性的测定可参照TATE等[36]描述的测定方法:在1 mL的酶活力测定体系中加入一定终浓度的 γ-GpNA、Tris-HCl(pH 7.0)和适当稀释的酶液,于最佳温度下反应一段时间后,以乙酸溶液终止反应,测定吸光值(λ=410 nm)。一个水解酶活力单位定义为每分钟水解生成1 μmol对硝基苯胺所需的酶量。
5.2 高效液相色谱法
高效液相色谱可定量测定GGT反应中的底物消耗量或产物生成量,因此可以用于定量测定GGT催化活性。GGT酶法合成L-茶氨酸的催化体系中,一般采用高效液相色谱法测定L-茶氨酸产物的生成量,用于表征GGT活力[37]。分别以L-谷氨酰胺和乙胺为供体和受体底物,GGT作为催化剂构建转化体系,添加硼酸-NaOH缓冲液,在pH 10、37 ℃下反应一定时间,加入三氯乙酸终止反应。反应液经离心,滤膜过滤后,采用高效液相色谱对催化反应液中的L-茶氨酸含量进行测量,进而可以准确表征GGT活力。
6 GGT在食品工业领域的应用
利用GGT生物催化合成目标产物与化学法相比具有显著优势,在食品、医药等领域应用广泛。细菌GGT通过酶促氨基酸与相关胺类化合物的γ-谷氨酰化反应,可生成一系列γ-谷氨酰化合物,具有增强食品风味、改善溶解度和提高蛋白酶抗性等用途,在食品工业中具有重要意义[38]。近年来,得益于酶工程技术的发展,生物催化与转化技术在食品工业生产中逐渐受到重视,利用GGT制备一系列γ-谷氨酰化合物已成为生物催化领域的热门研究方向之一。
6.1 催化合成茶氨酸
茶氨酸(L-theanine,γ-N-乙基谷氨酰胺)是茶叶中特有的一种非蛋白游离氨基酸,属于酰胺类化合物。L-茶氨酸具有焦糖味及类似味精的鲜爽味,其不仅对茶叶的品质与风味有重要影响,还具有丰富的生理活性,能够调节人体情绪,影响记忆和学习能力,在稳定情绪、缓解压力、提高睡眠质量、预防肥胖、预防心血管疾病等方面具有一定作用。L-茶氨酸不但可以作为食品添加剂,还可作为新型食品功能因子。
化学法制备L-茶氨酸反应时间长、收率较低、易产生DL-型消旋体等副产物,在实际生产中纯化复杂、成本较高,也对产品安全性和生态环境具有潜在危害。而酶促合成法中催化反应具有立体结构专一性,不产生消旋体副产物;反应体系易建立,无需对谷氨酸等底物侧链进行保护与脱保护;转化率较高,反应时间较短且无需ATP供能,具有较高的应用潜力。
GGT是酶促合成L-茶氨酸途径中的关键酶,其可催化谷氨酰胺的γ-谷氨酰胺基团转移到乙胺上实现茶氨酸的合成。SUZUKI等[39]首先报道了大肠杆菌K-12 SH642来源的GGT能够催化L-谷氨酰胺与乙胺生成L-茶氨酸。CHI等[28]利用地衣芽孢杆菌来源的GGT突变体N450A催化茶氨酸的合成,在37 ℃、pH 10.5条件下反应4 h,底物转化率达到94%。HUNG等[40]使用固定化重组大肠杆菌制备L-茶氨酸,发现EcGGT固定化的最适海藻酸盐质量浓度为20 g/L,实验转化率为23%。上述固定化GGT在循环使用5次后仍然表现出稳定性。YANG等[27]表达了B.pumilus来源的GGT,以此为催化剂合成茶氨酸,在37 ℃、pH 10.0 条件下反应16 h,底物转化率为63%。杨套伟等[41]通过聚腺苷酸化修饰提高重组GGT产量,再过表达脂蛋白PrsA以促进GGT分泌表达,发酵48 h后,重组菌B.subtilis pMA5-ggt-HapⅡ-prsA胞外GGT活力达到18.65 U/mL,优化反应条件并采用流加补料策略催化16 h,茶氨酸产量可达 65 g/L。刘栓英[24]将 B.pumilus ML413 来源的GGT基因成功在 B.subtilis 168 宿主细胞中成功克隆表达,优化以L-Gln和乙胺为底物的催化合成体系转化条件,在35 ℃、pH 10.0条件下,分批补料扩大体系催化合成茶氨酸,最终产率达60%。
尽管国内外已有众多学者对GGT在催化茶氨酸方面的应用进行研究,茶氨酸的产量相对于传统合成来说已有较大提升,但生产成本仍然较高。未来应筛选和表征更多具有潜在应用价值的GGT,优化其酶学特性和产茶氨酸能力;利用理性设计、定向进化,结合高通量筛选方法获得具有理想特性的分子改造GGT,开发出可满足工业生产L-茶氨酸需求的高效催化剂。
6.2 催化合成其他谷氨酰化合物
通过研究不同氨基酸受体对GGT转肽活性的影响,结果显示相较于双甘二肽,GGT能更好地接受一些天然氨基酸作为γ-谷氨酰胺受体,如苏氨酸、精氨酸、缬氨酸等[42],这也拓展了该酶在制备重要的γ-谷氨酰胺化合物方面的应用潜力。
6.2.1 浓厚味γ-谷氨酰肽的合成
浓厚味γ-谷氨酰肽是一类能够赋予食物浓厚感、丰富度、协调性等综合性味觉感受(kokumi特性)的γ-谷氨酰肽,主要是二肽或三肽,能够改善食品风味。近年来,浓厚味γ-谷氨酰肽对奶酪[43]、芝士[44]、豆酱[45]等食品浓厚味的贡献作用陆续得到证实。以肽类食品风味增强剂为产品导向,进一步开发基于浓厚味γ-谷氨酰肽的新型产品逐渐成为食品研究者关注的方向之一。研究人员已经成功以L-谷氨酰胺为供体,不同类型氨基酸为受体,利用细菌GGT作为生物催化剂酶促合成多种浓厚感肽[44-47]。同时结合酶工程技术以及酶复配优化策略,有效提高了GGT的催化效能,为酶法合成浓厚味γ-谷氨酰肽的规模化应用提供了基础。
6.2.2 GSH合成
GSH是由谷氨酸、半胱氨酸和甘氨酸构成的三肽,在所有生物细胞中均有分布,具有抗氧化作用。GSH作为一种重要的氨基酸衍生物。不仅可用于医药领域,也可作为功能性食品的原料,在增强免疫力、抗肿瘤、延缓衰老等功能性食品中广泛应用。沈继朵等[48]利用GGT和谷胱甘肽合成酶(GSH-Ⅱ)经两步反应合成GSH,解决了GSH对γ-谷氨酰半胱氨酸合成酶(GSH-Ⅰ)反馈控制的作用,创新了生产GSH的新线路。张鲁嘉[49]利用B. subtilis NX-2的GGT催化L-谷氨酰胺和S-苯甲基-半胱氨酰甘氨酸甲酯(S-phenylmethyl-cysteinylglycinate methyl ester, SBCGM)获得了GSH的前体γ-谷氨酰SBCGM。韦光绪等[50]通过GGT催化和进一步还原,得到了体内合成GSH的中间产物γ-谷氨酰半胱氨酸,实现其合成工艺的简化。
6.2.3 γ-谷氨酰肽衍生物
一些C端具有γ-谷氨酰残基的功能性γ-谷氨酰肽衍生物可通过GGT催化大规模合成,如γ-L-谷氨酰-L-3,4-二羟基苯丙氨酸(γ-glutamyl DOPA)[51]、γ-L-谷氨酰-牛磺酸(γ-Glu-Tau)和β-N-[γ-l(+)谷氨酰基]苯肼[52]。杨娟[53]首次报道了解淀粉芽孢杆菌源GGT在催化合成一类小分子γ-谷氨酰肽中的应用。大蒜中一些天然风味增强剂,如γ-L-谷氨酰-S-烯丙基-L-半胱氨酸[54]和γ-谷氨酰S-甲基-L-半胱氨酸也可以GSH为底物经 GGT催化合成。GGT还可通过修饰和改性氨基酸来改善不良风味。如催化L-苯丙氨酸形成γ-谷氨酰苯丙氨酸[55],从而降低某些人体必需氨基酸的苦味。
6.2.4 酱油发酵中的应用
GGT的水解活性也被用于酱油发酵,以赋予其独特的鲜味[56],也起到一定改善不良风味的作用。GGT在大豆发酵过程中稳定存在,特别是耐盐型GGT,能够在高盐浓度环境下保留较高的活性。其能够将大豆蛋白分解所得的谷氨酰胺进一步水解成为谷氨酸,减少谷氨酰胺向焦谷氨酸的转化,抑制酱油产品不良风味和口感的出现。
6.2.5 乳制品中的应用
在牛乳加工行业中,热处理是提高乳制品安全性和延长产品保质期的常用手段。为检验乳制品热处理强度是否合格,需选定相应指标进行判定。GGT因其较为稳定的活性,在作为巴氏杀菌热处理标志物方面也具有一定应用价值[39]。
7 总结与展望
γ-谷氨酰转肽酶的研究近年来在食品工业领域受到了广泛关注。结构生物学、酶工程等技术的发展进一步揭示了GGT的分子结构与催化机制,也为分子改造GGT以提高其酶学特性提供了更多途径。微生物来源的GGT目前已被广泛发掘、重组表达、性质分析及应用[19],然而目前还尚缺乏高效、稳定的商品化GGT酶制剂,大多数文献报道的GGT酶法催化应用还处于实验室级生产水平。为解决上述问题,未来还需从不同来源定向筛选高活性GGT基因;利用酶工程方法改造酶分子结构以改善GGT酶学特性、减少副反应(水解和自转肽反应)的发生;通过计算机辅助设计、定向进化结合高通量筛选获得稳定性、催化特性增强的人工进化酶;结合吸附、包埋、交联和共价结合等酶固定化手段[57]提高酶的稳定性和耐受性;选择适宜的发酵工程策略提高酶的产量。从而为茶氨酸等γ-谷氨酰肽产物高产量、低成本的绿色生物制造提供基础。
[1] 吕晶晶, 张天缘, 杨仕梅, 等. 大肠杆菌茶氨酸合成酶基因γ-GGT的生物信息学分析[J]. 山地农业生物学报, 2019, 38(1):74-78. LV J J, ZHANG T Y, YANG S M, et al. Bioinformatics analysis of Escherichia coli γ-GGT gene theanine synthase[J]. Journal of Mountain Agriculture and Biology, 2019, 38(1):74-78.
[2] 傅嘉懿. Bacillus subtilis γ-谷氨酰转肽酶的发酵及其在L-茶氨酸制备中的应用[D]. 无锡: 江南大学, 2014. FU J Y. Expression of γ-glutamyltranspeptidase from Bacillus subtilis and its application on L-theanine production[D]. Wuxi: Jiangnan University, 2014.
[3] BINDAL S, GUPTA R. L-Theanine synthesis using γ-glutamyl transpeptidase from Bacillus licheniformis ER-15[J]. Journal of Agricultural and Food Chemistry, 2014, 62(37):9151-9159.
[4] BINDAL S, SHARMA S, SINGH T P, et al. Evolving transpeptidase and hydrolytic variants of γ-glutamyl transpeptidase from Bacillus licheniformis by targeted mutations of conserved residue Arg109 and their biotechnological relevance[J]. Journal of Biotechnology, 2017, 249:82-90.
[5] LEE J M, LEE J, NAM G H, et al. Heterologous expression and enzymatic characterization of γ-glutamyltranspeptidase from Bacillus amyloliquefaciens[J]. Journal of Microbiology, 2017, 55(2):147-152.
[6] LI Z L, ZHU R T, LIU Y Q, et al. γ-Glutamyltranspeptidase from Bacillus amyloliquefaciens: Transpeptidation activity enhancement and L-theanine production[J]. Enzyme and Microbial Technology, 2020, 140:109644.
[7] LING S S M, YEOH K G, HO B. Helicobacter pylori γ-glutamyl transpeptidase: A formidable virulence factor[J]. World Journal of Gastroenterology, 2013, 19(45):8203-8210.
[8] 蒋敏丽. γ-谷氨酰转肽酶酶学性质及其催化应用研究[D]. 广州: 广东药学院, 2011. JIANG M L. Enzymology properties and the biosynthesis application of the γ-glutamyltranspeptidase[D]. Guangzhou: Guangdong Pharmaceutical University, 2011.
[9] MINAMI H, SUZUKI H, KUMAGAI H. Salt-tolerant γ-glutamyltranspeptidase from Bacillus subtilis 168 with glutaminase activity[J]. Enzyme and Microbial Technology, 2003, 32(3-4):431-438.
[10] OINONEN C, ROUVINEN J. Structural comparison of ntn-hydrolases[J]. Protein Science: a Publication of the Protein Society, 2000, 9(12):2329-2337.
[11] HASHIMOTO W, SUZUKI H, YAMAMOTO K, et al. Effect of site-directed mutations on processing and activity of γ-glutamyltranspeptidase of Escherichia coli K-12[J]. The Journal of Biochemistry, 1995, 118(1):75-80.
[12] OKADA T, SUZUKI H, WADA K, et al. Crystal structure of the γ-glutamyltranspeptidase precursor protein from Escherichia coli[J]. Journal of Biological Chemistry, 2007, 282(4):2433-2439.
[13] BOANCA G, SAND A, OKADA T, et al. Autoprocessing of Helicobacter pylori γ-glutamyltranspeptidase leads to the formation of a threonine-threonine catalytic dyad[J]. Journal of Biological Chemistry, 2007, 282(1):534-541.
[14] KEI W, MACHIKO I, HIDEYUKI S, et al. Crystal structure of the halotolerant gamma-glutamyltranspeptidase from Bacillus subtilis in complex with glutamate reveals a unique architecture of the solvent-exposed catalytic pocket[J]. The FEBS Journal, 2010, 277(4):1000-1009.
[15] TAKAO H, MASASHI I, YOICHIRO S, et al. Crystal structure analysis and enzymatic characterization of γ-glutamyltranspeptidase from Pseudomonas nitroreducens[J]. Bioscience, Biotechnology, and Biochemistry, 2018, 83(2):1-8.
[16] 熊爱英. C.glutamicum γ-谷氨酰转肽酶的重组表达、酶学性质及其在谷氨酸发酵中应用的研究[D]. 南京: 南京师范大学, 2016. XIONG A Y. C. recombinant expression of C.glutamicum γ-glutamyltranspeptidase, its enzymatic properties and its application in glutamic acid fermentation[D].Nanjing: Nanjing Normal University, 2016.
[17] OKADA T, SUZUKI H, WADA K, et al. Crystal structures of γ-glutamyltranspeptidase from Escherichia coli, a key enzyme in glutathione metabolism, and its reaction intermediate[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(17):6471-6476.
[18] 伍圆明, 伍伦杰, 王莉, 等. γ-kokumi肽及其合成酶γ-谷氨酰转肽酶的研究进展[J]. 食品科学, 2020, 41(5):256-265. WU Y M, WU L J, WANG L, et al. Recent advances in γ-kokumi peptide and its synthetase γ-glutamyl transpeptidase[J]. Food Science, 2020, 41(5):256-265.
[19] SAINI M, KASHYAP A, BINDAL S, et al. Bacterial gamma-glutamyl transpeptidase, an emerging biocatalyst: Insights into structure-function relationship and its biotechnological applications[J]. Frontiers in Microbiology, 2021, 12:641251.
[20] CALVIO C, ROMAGNUOLO F, VULCANO F, et al. Evidences on the role of the lid loop of γ-glutamyltransferases (GGT) in substrate selection[J]. Enzyme and Microbial Technology, 2018, 114:55-62.
[21] MASSONE M, CALVIO C, RABUFFETTI M, et al. Effect of the inserted active-site-covering lid loop on the catalytic activity of a mutant B. subtilis γ-glutamyltransferase (GGT)[J]. RSC Advances, 2019, 9(60):34699-34709.
[22] HU X, LEGLER P M, KHAVRUTSKII I, et al. Probing the donor and acceptor substrate specificity of the γ-glutamyl transpeptidase[J]. Biochemistry, 2012, 51(6):1199-1212.
[23] WU R Y, RICHTER S, ZHANG R G, et al. Crystal structure of Bacillus anthracis transpeptidase enzyme CapD[J]. Journal of Biological Chemistry, 2009, 284(36):24406-24414.
[24] 刘栓英. γ-谷氨酰转肽酶分子改造及其应用[D]. 无锡: 江南大学, 2021. LIU S Y. Molecular modification of γ-glutamyl-transpeptidase and its application[D]. Wuxi: Jiangnan University, 2021.
[25] YANG T W, LIU S Y, LIU H L, et al. Semi-quantitative activity assays for high-throughput screening of higher activity gamma glutamyl transferase and enzyme immobilization to efficiently synthesize L-theanine[J]. Journal of Biotechnology, 2021, 330:9-16.
[26] XU L S, HAN F K, ZHANG X T, et al. Ultrasound enhanced biosynthesis of L-theanine from L-glutamine and ethylamine by recombinant γ-glutamyltranspeptidase[J]. Bioresource Technology, 2020, 307:123251.
[27] YANG T W, IRENE K, LIU H L, et al. Enhanced extracellular gamma glutamyl transpeptidase production by overexpressing of PrsA lipoproteins and improving its mRNA stability in Bacillus subtilis and application in biosynthesis of L-theanine[J]. Journal of Biotechnology, 2019, 302:85-91.
[28] CHI M C, LIN M G, HUANG Y F, et al. Enzymatic synthesis of L-theanine from L-glutamine and ethylamine by Bacillus licheniformis γ-glutamyltranspeptidase and its mutants specialized in transpeptidase activity[J]. Biocatalysis and Agricultural Biotechnology, 2019, 22:101393.
[29] MU D D, LI H W, CHEN Q, et al. Secretion of Bacillus amyloliquefaciens γ-glutamyltranspeptidase from Bacillus subtilis and its application in enzymatic synthesis of L-theanine[J]. Journal of Agricultural and Food Chemistry, 2019, 67(51):14129-14136.
[30] 和斐, 杨套伟, 徐美娟, 等. 利用重组钝齿棒杆菌高效合成L-茶氨酸[J]. 微生物学报, 2016, 56(10):1595-1605. HE F, YANG T W, XU M J, et al. Efficient synthesis of L-theanine by recombinant strain Corynebacterium glutamicum SYPA5-5[J]. Acta Microbiologica Sinica, 2016, 56(10):1595-1605.
[31] LIN L L, CHOU P R, HUA Y W, et al. Overexpression, one-step purification, and biochemical characterization of a recombinant γ-glutamyltranspeptidase from Bacillus licheniformis[J]. Applied Microbiology and Biotechnology, 2006, 73(1):103-112.
[32] Bernard Gitura Kimani, 杨套伟, 饶志明, 等. 一种碱性γ-谷氨酰转肽酶在Bacillus subtilis 168中的分泌表达与酶学性质分析[J]. 食品与生物技术学报, 2017, 36(2):149-155. KIMANI B, YANG T W, RAO Z M, et al. Homologous cloning and characterization of Bacillus subtilis 168 γ-glutamyltranspeptidase[J]. Journal of Food Science and Biotechnology, 2017, 36(2):149-155.
[33] 胡永彬, 徐礼生, 孙玥, 等. γ-谷氨酰转肽酶基因工程菌的研究进展[J]. 山东化工, 2019, 48(12):62-64. HU Y B, XU L S, SUN Y, et al. Research progress of gamma-glutamyl transpeptidase gene engineering bacteria[J]. Shandong Chemical Industry, 2019, 48(12):62-64.
[34] KEILLOR J W, CASTONGUAY R, LHERBET C. Gamma-glutamyl transpeptidase substrate specificity and catalytic mechanism[J]. Methods in Enzymology, 2005, 401:449-467.
[35] 房鑫, 田思思, 姚忠, 等. 大肠杆菌和枯草芽孢杆菌来源γ-谷氨酰转肽酶的克隆表达和性质比较[J]. 高校化学工程学报, 2014, 28(2):282-289. FANG X, TIAN S S, YAO Z, et al. Cloning, expression and characterization of γ-glutamyltranspeptidase from Escherichia coli and Bacillus subtilis[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(2):282-289.
[36] TATE S S, MEISTER A. γ-glutamyl transpeptidase from kidney[J]. Methods in Enzymology, 1985, 113:400-419.
[37] KOMERA Irene, 杨套伟, 张显, 等. 利用重组枯草芽孢杆菌产Bacillus pumilus来源的γ-谷氨酰转肽酶及其在L-茶氨酸合成中的应用[J]. 食品与生物技术学报, 2019, 38(10):67-71. IRENE K, YANG T W, ZHANG X, et al. Efficient production of Bacillus pumilus γ-glutamyl transferase in B. subtilis and its application of biosynthesis of L-theanine[J]. Journal of Food Science and Biotechnology, 2019, 38(10):67-71.
[38] 孟佩佩, 刘冬英, 蒋敏丽, 等. γ-谷氨酰转肽酶的性质及其应用进展[J]. 食品与发酵工业, 2009, 35(9):105-110. MENG P P, LIU D Y, JIANG M L, et al. Properties and applications progress of γ-glutamyltranspeptidase[J]. Food and Fermentation Industries, 2009, 35(9):105-110.
[39] SUZUKI H, IZUKA S, MIYAKAWA N, et al. Enzymatic production of theanine, an “umami” component of tea, from glutamine and ethylamine with bacterial γ-glutamyltranspeptidase[J]. Enzyme and Microbial Technology, 2002, 31(6):884-889.
[40] HUNG C P, LO H F, HSU W H, et al. Immobilization of Escherichia coli novablue γ-glutamyltranspeptidase in Ca-alginate-k-carrageenan beads[J]. Applied Biochemistry and Biotechnology, 2009, 152(1):169.
[41] 杨真伟, 刘栓英, 刘会灵, 等. 通过过表达脂蛋白PrsA和提高mRNA稳定性强化枯草芽孢杆菌分泌合成γ-谷氨酰胺转肽酶[C]//第十二届中国酶工程学术研讨会论文摘要集. 长春, 2019:166. YANG T W, LIU S Y, LIU H L, et al. Enhances the secretion and synthesis of gamma glutamyltranspeptidase by overexpressing of PrsA lipoproteins and improving its mRNA stability in Bacillus subtilis[C]. Abstracts of the 12th National Symposium on Enzyme .Engineering, Changchun, 2019: 166.
[42] MURTY N A R, TIWARY E, SHARMA R, et al. γ-Glutamyl transpeptidase from Bacillus pumilus KS 12: Decoupling autoprocessing from catalysis and molecular characterization of N-terminal region[J]. Enzyme and Microbial Technology, 2012, 50(3):159-164.
[43] TOELSTEDE S, HOFMANN T. Kokumi-active glutamyl peptides in cheeses and their biogeneration by Penicillium roquefortii[J]. Journal of Agricultural and Food Chemistry, 2009, 57(9):3738-3748.
[44] HILLMANN H, BEHR J, EHRMANN M A, et al. Formation of kokumi-enhancing γ-glutamyl dipeptides in Parmesan cheese by means of γ-glutamyltransferase activity and stable isotope double-labeling studies[J]. Journal of Agricultural and Food Chemistry, 2016, 64(8):1784-1793.
[45] TERZYAN S S, BURGETT A W G, HEROUX A, et al. Human γ-glutamyl transpeptidase 1[J]. Journal of Biological Chemistry, 2015, 290(28):17576-17586.
[46] VAN HO T, SUZUKI H. Increase of “umami” and “kokumi” compounds in miso, fermented soybeans, by the addition of bacterial γ-glutamyltranspeptidase[J]. International Journal of Food Studies, 2013, 2(1): 39-47.
[47] FUKAO T, SUZUKI H. Enzymatic synthesis of γ-glutamylvalylglycine using bacterial γ-glutamyltranspeptidase[J]. Journal of Agricultural and Food Chemistry, 2021, 69(27):7675-7679.
[48] 沈继朵, 胡晓川, 卞筱泓, 等. 催化合成谷胱甘肽的基因工程菌的构建及表达[J]. 西北药学杂志, 2010, 25(4):288-291. SHEN J D, HU X C, BIAN X H, et al. Construction of recombinant bacteria for glutathione biosynthesis and expression of recombinant gene[J]. Northwest Pharmaceutical Journal, 2010, 25(4):288-291.
[49] 张鲁嘉. γ-谷氨酰转肽酶的制备、酶学性质及其在小肽合成中应用的研究[D]. 南京: 南京工业大学, 2004. ZHANG L J. Study on preparation, enzymology characters and applications in the peptides synthesize of γ-glutamyltranspeptidase[D]. Nanjing: Nanjing University of Technology, 2004.
[50] 韦光绪, 唐毅, 殷志敏. GGT酶法合成γ-谷氨酰半胱氨酸[J]. 南京师大学报(自然科学版), 2018, 41(2):78-82;88. WEI G X, TANG Y, YIN Z M. Enzymatic synthesis of γ-glutamyl cysteine with GGT[J]. Journal of Nanjing Normal University (Natural Science Edition), 2018, 41(2):78-82;88.
[51] SUZUKI H, FUKUYAMA K, KUMAGAI H. Bacterial γ-glutamyltranspeptidases, physiological function, structure, catalytic mechanism and application[J]. Proceedings of the Japan Academy. Series B, Physical and Biological Sciences, 2020, 96(9):440-469.
[52] 杨娟, 廖剑洪, 郭晶, 等. 微生物γ-谷氨酰转肽酶分子改造合成γ-谷氨酰化合物的研究进展[J]. 中国调味品, 2022, 47(9):214-220. YANG J, LIAO J H, GUO J, et al. Research progress on synthesis of γ-glutamyl compounds by molecular modification of microbial γ-glutamyl transpeptidase[J]. China Condiment, 2022, 47(9):214-220.
[53] 杨娟. γ-谷氨酰肽的酶法合成及其应用[D]. 广州: 华南理工大学, 2018. YANG J. The enzymatic synthesis and application of γ-glutamyl peptides[D]. Guangzhou: South China University of Technology, 2018.
[54] CHEN Y Y, LO H F, WANG T F, et al. Enzymatic synthesis of γ-L-glutamyl-S-allyl-L-cysteine, a naturally occurring organosulfur compound from garlic, by Bacillus licheniformis γ-glutamyltranspeptidase[J]. Enzyme and Microbial Technology, 2015, 75-76:18-24.
[55] 刘栓英, 刘会灵, 龙梦飞, 等. γ-谷氨酰转肽酶高效表达及其催化合成γ-谷氨酰苯丙氨酸[J]. 食品与发酵工业, 2021, 47(18):23-29. LIU S Y, LIU H L, LONG M F, et al. Optimized expression of γ-glutamyltranspeptidase for efficient biosynthesis of γ-glutamylphenylalanine[J]. Food and Fermentation Industries, 2021, 47(18):23-29.
[56] KIJIMA K, SUZUKI H. Improving the umami taste of soy sauce by the addition of bacterial γ-glutamyltranspeptidase as a glutaminase to the fermentation mixture[J]. Enzyme and Microbial Technology, 2007, 41(1-2):80-84.
[57] 徐礼生, 王梦婷, 高贵珍, 等. 酶固定化技术及其在γ-谷氨酰转肽酶中的应用[J]. 基因组学与应用生物学, 2018, 37(6):2438-2442. XU L S, WANG M T, GAO G Z, et al. Enzyme immobilization technology and its application in gamma glutamyltranspeptidase[J]. Genomics and Applied Biology, 2018, 37(6):2438-2442.