沙门氏菌(Salmonella)作为一种可引起动物肠胃炎、伤寒、败血症等症状的食源性致病菌,在不同宿主体内由于环境和压力的不同,引发的病症也存在着广泛的差异[1]。目前对于沙门氏菌主要的治疗方法是抗生素抗菌疗法,随着大量抗生素的使用,沙门氏菌不断提升自身的适应性和致病性,出现了耐药性和毒力等方面的表型异质性,甚至是多重耐药和泛耐药性的出现[2],对于当下的公共健康安全造成了严重威胁。
作为沙门氏菌等微生物在复杂多变的环境下的一种特性,表型异质性使不同环境和食品中分离出的沙门氏菌细胞有了不同的基因调控和表达,造成细胞群体间的差异,衍生出不同的表型特征。沙门氏菌进入宿主体内后,克服宿主的免疫防御系统,与原肠道微生物进行竞争才能够引起感染。目前国内关于沙门氏菌表型异质性的研究相对甚少,本文总结了表型异质性的产生机制,从发现、宿主、策略和表型特征4个方面进行阐述,为将来寻找更优方法控制沙门氏菌以及其他致病菌的研究提供思路,深入了解沙门氏菌表型异质性的发展及其在发病机制中的作用,以便开发新的和更强大的治疗方法。
1 表型异质性的产生
沙门氏菌群体间的表型异质性拥有着一系列复杂的来源,例如基因、细胞、细胞周期状态以及环境等因素。异质性所指是在相同宏观条件下个体同基因之间的变异性,这种变异性源于操纵子的调节以及随机性,而产生的主要原因则是来自基因表达的噪声和突变[3]。产生噪音以及突变的可能原因有:不同细胞对不同的组织微环境反应的结果;由部分转录因子的波动与正反馈回路相结合,共同形成基因表达所引起的结果。当病原体与宿主接触时,个体细胞间可以通过相互抵触和/或协同作用来提高整个群体的适应能力,引发不同程度的宿主反应,能够有助于提高亚群群体对抗生素疗法的耐受能力[4-6]。
不同的分子机制也可以引起表型异质性,分子因素产生的主要机制分为2种:一种是环境波动或者不同浓度;另一种是遗传差异,由同源重组产生的遗传区域的多种遗传表现,这也可以解释部分细胞之间表型差异的观察结果[7]。当异质性涉及到遗传机制,则分为2种:一种是沙门氏菌自身的进化遗传机制,在没有基因突变的情况下发生变异,例如,启动子调控区DNA重复序列的扩张和收缩以随机或可逆的方式对基因表达进行打开或者关闭[8];另一种是肠道沙门氏菌特异性位点重新组合的DNA片段倒位产生开/关转录状态,为了控制位点特异性重组酶,DNA重排也可以被视为一种引起异质性的随机机制,但这种机制极易受到生理或环境的影响[9]。
当沙门氏菌进入宿主体内后,其基因的不同表现有助于沙门氏菌的持久性、增殖、入侵和传播等方面。面对环境的变化,某个基因的正反馈回路而产生的不同状态形成了双稳态,而双稳态表达可以帮助沙门氏菌成功感染宿主,2个基因之间的相互激活或者抑制是维持异质性机制的根源,因此也赋予了沙门氏菌种群在不同宿主下更多的表型多样性[10]。研究表明,双稳态表达导致鼠伤寒沙门氏菌在感染期间为了成功定殖感染,其沙门氏菌致病岛1(Salmonella pathogenicity island 1,SPI-1)分化出2种亚群:有毒性表型和无毒性表型[11]。有毒亚群生长缓慢,无毒亚群则增长快速。尽管大部分基因的表达受到严格调控,但仍然有部分基因可以进行异质表达,并且使基因分为“开/关”(ON/OFF)2种亚群的状态[12]。
2 宿主作用
沙门氏菌感染宿主期间,因为宿主环境的多样化与宿主敏感性和特异性的不同,形成具有不同程度炎症的区域。免疫系统检测到入侵的病原体,宿主通过调节基因表达、药源检测和免疫记忆等方式建立适当的防御反应[6]。先天免疫反应的强度因宿主组织、细胞类型和感染阶段形成了不同强度的免疫系统,导致毒力基因表达差异显著。肠道内的微生物群在面对沙门氏菌的“入侵”时,首先限制了沙门氏菌从肠道获得的营养供应,用来阻止病原体生长,构成免疫防御,为了适应宿主体内限制造成的波动环境,突破免疫带来的局限,最大程度达到致病性,沙门氏菌病原体只能转变出更具有适应性的代谢能力,用来规避由宿主介导的对营养物摄取的限制[13]。
同样由于宿主自身的敏感性与特异性,营养供应也表现出相应地异质性,这一特征使沙门氏菌在宿主体内的营养限制和应激蛋白的不同亚群同样也产生了异质性。作为在沙门氏菌病感染期间造成抗生素治疗失败多样化原因之一,异质性能够帮助部分病原体逃避针对性治疗。大多数抗生素在进行治疗时,只有单一靶点对沙门氏菌进行灭杀,而产生了异质性变化的沙门氏菌亚群也可能会导致治疗效果的靶点发生变化,抗生素治疗对于靶点的作用也可能会因为靶点的变化使疗效效果折损甚至失效[14],这一特点可以通过蛋白质组学和代谢组学进行验证。
3 表型异质性策略体现
从目前的部分动物感染实验中发现,往往只能观察到感染中某个节点的整体表型和基因型。而观察异质性对于毒力、耐药、生长等表型的影响却是一个长期观察的结果,还需比较群体中个体的变化,通过增殖和存活等特征才能明确其生物学意义[15]。在这样的长期研究中,发现“赌注对冲”和“分工”2种模式是沙门氏菌异质性发生作用的主要策略。
3.1 “赌注对冲”策略
沙门氏菌在被摄入宿主体内之后,部分细胞将因为双稳态表达产生不同作用的2种表型亚群,一部分亚群表达优化当前环境形成的表型,另一部分亚群的表达用于承受环境波动带来的压力。病原体从外部进入宿主从肠道转移到更深的组织中,当受到免疫系统的攻击时,由承受压力的那一部分亚群进行“牺牲”来完成对冲策略完成生态优势[16]。在面对抗生素的治疗或者免疫系统的攻击时,有一部分细胞种群无法被根除,这部分细胞叫做持久性细胞,它们生长缓慢,对抗生素具有表型耐受性,但无法遗传耐药性,更能在面对来自抗生素的威胁时存活下来,等待治疗结束后重新再次生长繁殖[17]。如图1所示,当细胞群体面临抗生素的威胁,正常生长细胞在“对冲”模式下被杀死,持久性细胞则会存活下来直到抗生素胁迫结束。抗生素治疗结束后,持久性细胞恢复正常生长,又会重新建立由持久细胞和正常生长细胞组成的种群。
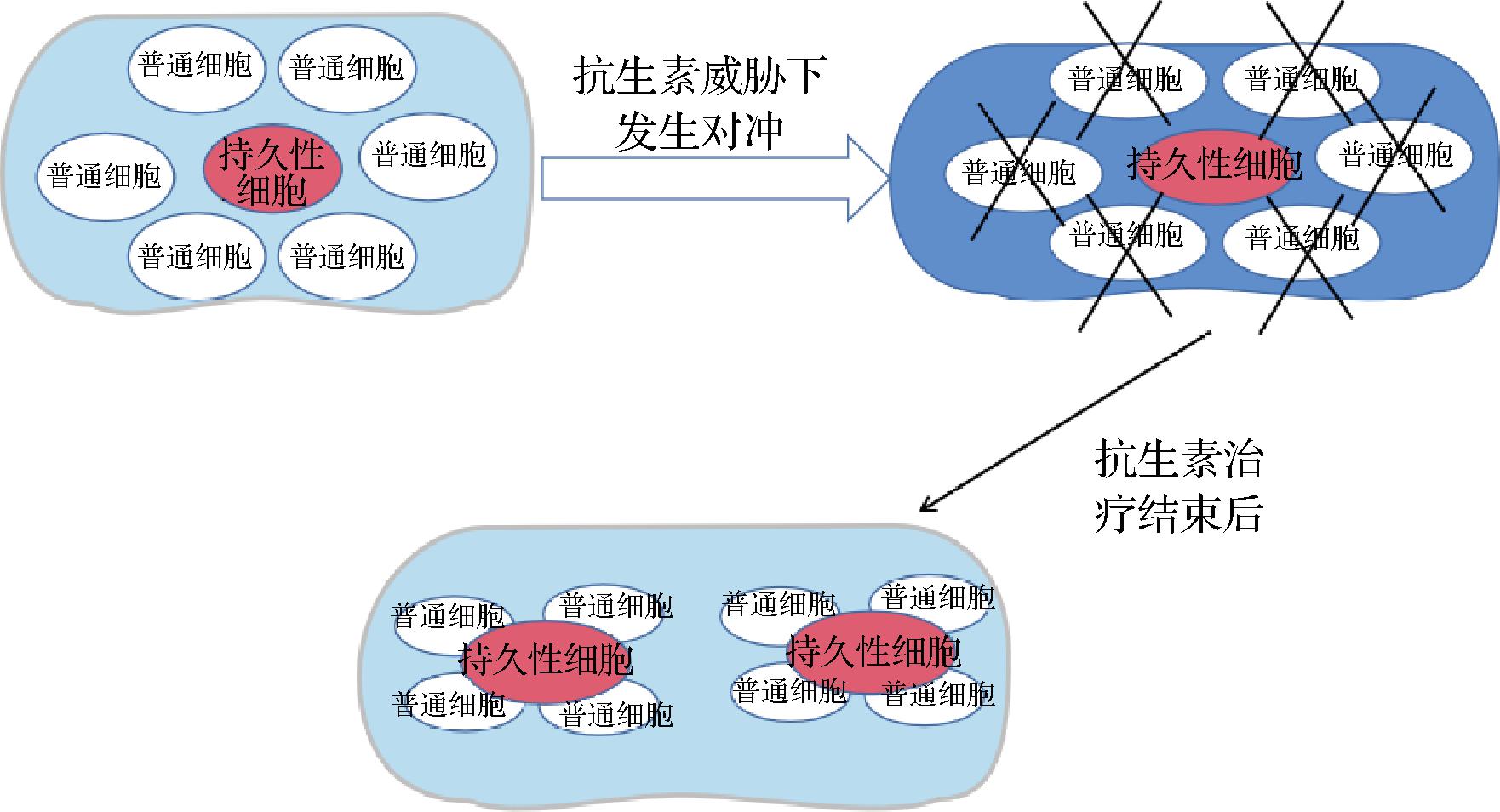
图1 持久性细胞与正常生长细胞“对冲”模型
Fig.1 The “hedging” model of persistent cells vs. normal growth cell
3.2 “分工”策略
当单个细胞不能同时执行多种功能时,分工策略使得相关的表型在群体中划分出不同的职能[18]。通过分工合作增强了沙门氏菌群体的适应度,每个亚群同时按需分工,提高了群体的适应性。例如,感染功能通常对于单个细菌来执行是不可能的,但当沙门氏菌在亚群中划分职能分工合作时,就可以提升效率完成感染[19]。分工的优势在于不需要过分考虑环境波动带来的颠覆性影响,需要的是各亚群的相互协作确保沙门氏菌在环境中能够顺利存活。如图2所示,SPI-1ON亚群侵入盲肠黏膜,在“牺牲”部分的自己使肠道发生炎症,抑制肠道原微生物群的生长,SPI-1OFF沙门氏菌亚群则进入肠道不断生长,形成分工策略的典型例子[20]。
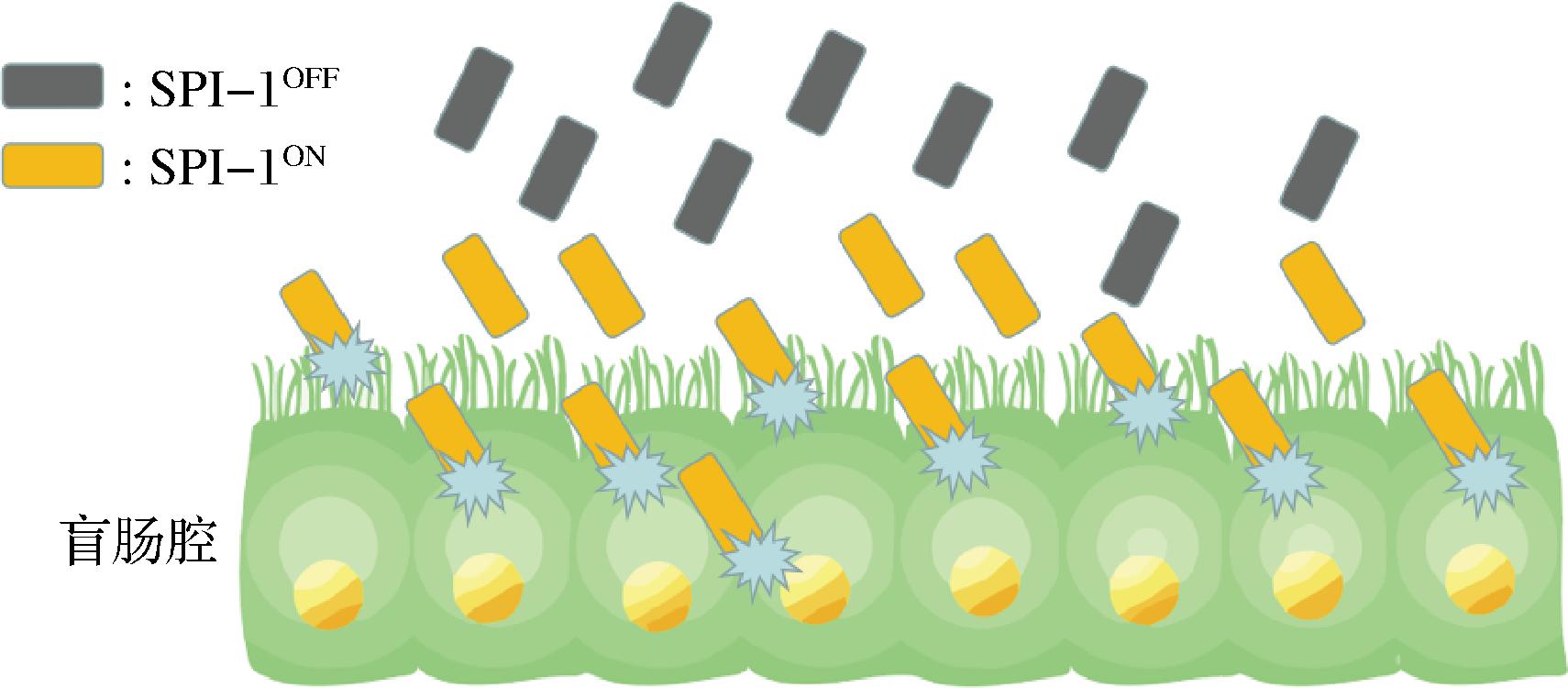
图2 SPI-1“分工”模型
Fig.2 A model of “division of labor” for SPI-1
对于赌注对冲,“牺牲”部分细胞来成全整个病原体的稳定性,毒力基因就可能支持病原体在通过肠道并到达新宿主或者占据宿主体内新生态位。分工也是如此,因为2种亚群会有一种适合造成宿主体内慢性感染,可能无法被免疫系统或者药物检测出来,负责生长;而另一种由于具有侵袭的能力,负责感染[21]。赌注对冲的作用体现在波动的环境中提供耐受性,分工的作用体现于亚群之间的相互作用,大多数产生表型异质性的细胞并不是严格意义上的只使用一种策略去生存,而是将“赌注对冲”与“分工”结合,而这将最大限度的提升沙门氏菌在宿主体内的生存能力。
4 表型异质性基本特征
沙门氏菌进入宿主体内就开始了毒力因子的表达。进入肠道后,沙门氏菌首先面对的就是来自肠道低pH值的灭杀,耐酸反应之后进入小肠开始定殖[22]。进入小肠之后,沙门氏菌的鞭毛开始进行表达,鞭毛的结构细长并且弯曲,能对肠上皮细胞进行黏附和侵袭,将沙门氏菌推向其他营养更为富集的地方。随后,利用SPI-1编码的Ⅲ型分泌系统1(type Ⅲ secretion system 1,T3SS-1)将效应蛋白易位到上皮细胞中,这些效应蛋白使上皮细胞的DNA进行重排,导致膜皱褶和病原体被含沙门氏菌的液泡(Salmonella containing vacuole,SCV)吞噬。SCV中的低pH酸性液泡将会酸化自身的细胞质,而后打开了沙门氏菌致病性岛2(SPI-2)的开关,SPI-2编码的Ⅲ型分泌系统2(type Ⅲ secretion system 2,T3SS-2)将效应蛋白易位到SCV膜上并进行易位[23]。生物被膜的主要调节因子CsgD作为沙门氏菌的生物被膜主要组成与控制基因,可以调节沙门氏菌生物被膜相关基质化合物的表达,也利用着自身的双稳态表达形成表型异质性的一部分[24]。脂多糖层能够防止抗生素或其他对沙门氏菌不利的小分子进入沙门氏菌的细胞质中[25],也将展开异质表达。具有双稳态表达的沙门氏菌毒力基因及其表型机制,见表1。
表1 双稳态表达的沙门氏菌毒力基因
Table 1 Salmonella genes with bistable expression

细胞基因/操纵子表型特征分子机制主导基因鞭毛[26]FljBA、fliC运动、黏附、致病特定位点重组hin、fliA菌毛[27-31]Lpf黏附调控定殖侵袭/Std黏附DNA甲基化模式hdfRPef黏附DNA甲基化模式lrp、pefFim黏附相位易变fimZYT3SS[32-37]SPI-1侵袭相位易变FliZSPI-2侵袭相位易变ssrB生物被膜[38]CsgD形成生物膜调节与编码c-di-GMP脂多糖[25,39]gtr脂多糖o-抗原糖基化DNA甲基化模式oxyROpvABo-抗原链长度的修饰DNA甲基化模式oxyR肌醇[40]iol抑制表达肌醇降解iolR
注:未查到相关研究。
4.1 鞭毛
鞭毛拥有着复杂的结构和表达的调控系统。鞭毛结构中的fliC是构成鞭毛丝的主要结构亚基,参与了沙门氏菌鞭毛蛋白一系列致病过程。鞭毛基因在转录和转录后水平受到环境和鞭毛发育信号的调节[41]。
由于鞭毛基因的双稳态表达,fliC和fljBA基因可以交替表达,鞭毛蛋白的合成就有了2种表型的变化[26]。当fljBA处于“开”状态时,fljA基因与fljB共同转录,fljBA启动子允许转录fljB,编码fljB鞭毛蛋白,以及fljA、fliC的转录和翻译阻遏。当fljAB处于“关”状态时,即使没有产生fljB或fljA,也会转录fliC基因。对于沙门氏菌来说,相较于fljB的表达,fliC的表达在肠道定殖方面更具有优势[42]。鞭毛蛋白产生差异表达的是由hin转化酶介导的DNA倒位的结果,当启动子朝向fljBA操纵子时,合成了FljB鞭毛蛋白,fljA和fljC 直接相互作用发生转录之后抑制fliC表达。由于hin介导的基因倒置,fljB和fljA都不会被转录,因此会解除对fljC抑制并且允许合成FljC鞭毛蛋白[43](图3)。因此,沙门氏菌在鞭毛细胞做侵袭时做了2个亚群用来应对环境压力:用作侵袭准备的表达 FliC的亚群和促进生存的 FljB 亚群。
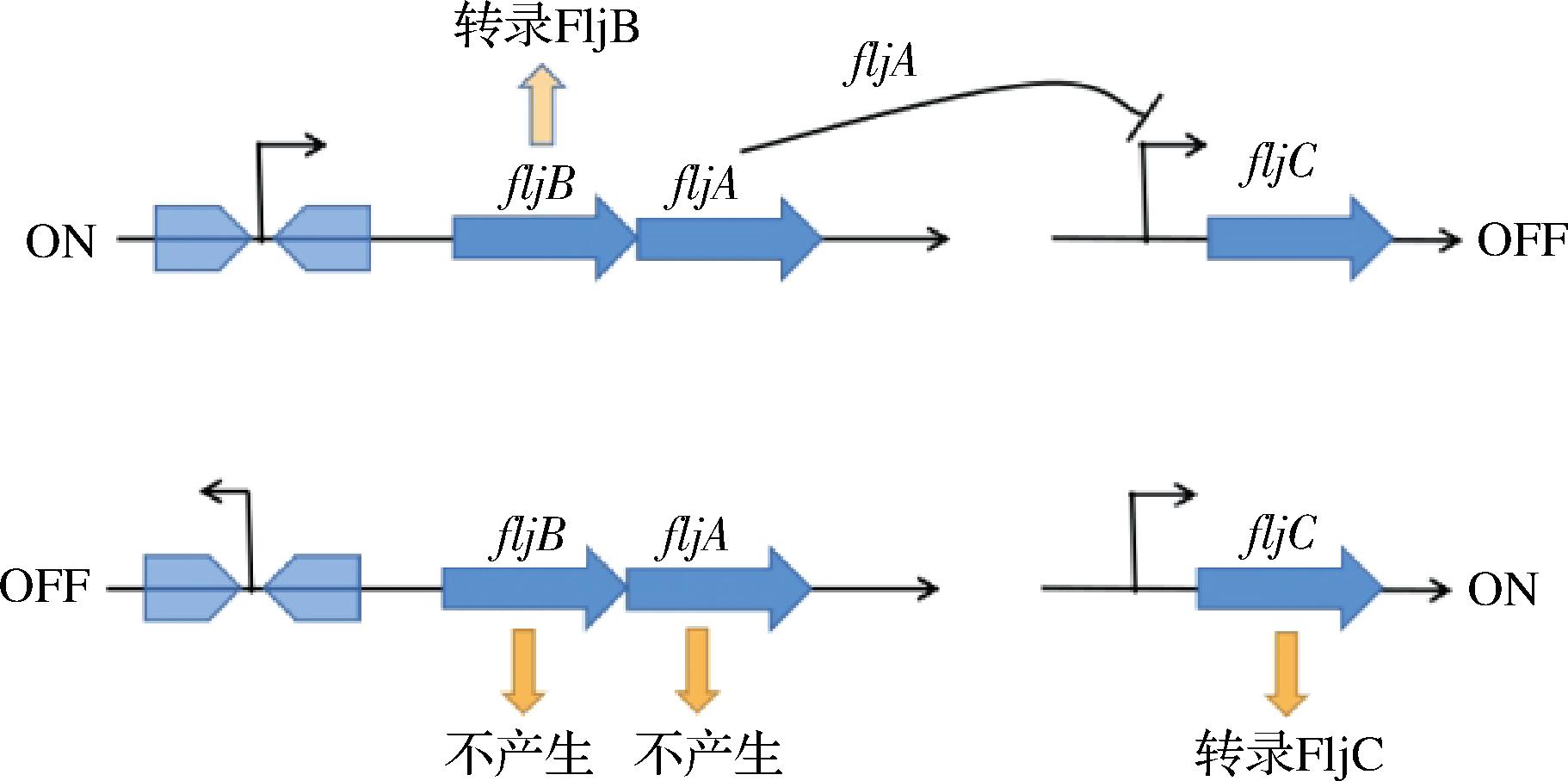
图3 肠炎沙门氏菌的fljB-fliC相位变化机制图
Fig.3 Mechanism of the phase change of fljB-fliC in Salmonella enteritidis
4.2 菌毛
菌毛是从细菌细胞表面延伸出来的蛋白质结构,有利于黏附到非生物和生物表面在病原体中,所以菌毛能够帮助沙门氏菌定殖宿主组织[44]。菌毛中包含:与Peyer补丁连接的Lpf操纵子、与肠上皮细胞结合Pef操纵子、用于附着于盲肠上皮的std操纵子和编码I型菌毛的fim操纵子[27]。这些纤维操纵子在受到相变的影响作用下,能够同时有着各自的机制维持着沙门氏菌的表型异质性。
fimOFF和fimON亚群的形成是驱动fim操纵子转录的启动子的 DNA 片段倒置控制而形成的。在Fim基因簇中含有fimZ、fimY和fimW 三个调节基因和一个由fimU编码的tRNA组成,另外一个对I型菌毛起负调节作用调控基因stm0551位于fimY和fimW之间。FimZ和FimY都能单独地正向激活fimA启动子(PfimA),并且FimY-FimZ 可以产生蛋白复合物用来调节其他菌毛基因,FimW可以抑制fimZ的转录,用于下调fim基因表达。而fimU的缺失可以抑制FimY的翻译,抑制Ⅰ型菌毛的产生[28,44]。
pef操纵子位于沙门氏菌毒力质粒上,PefI抑制pef表达,pef的转录受Dam甲基化和转录因子Lrp的控制[29]。在位于pef启动子上游调节区内的3个GATC位点形成不同的甲基化模式决定了基因表达谱。HdfR蛋白是std操纵子表达的重要原料,HdfR以依赖于Dam甲基化的方式结合std启动子,从而阻断std上游调节区域2个GATC位点的甲基化。当GATC处于非甲基化状态时,会加强与HdfR结合从而激活转录[30]。Lpf操纵子的双稳态表达是因为细胞在不同位置、不同组织造成的相变引起的,因此形成了不同的表达调控而引起异质性。特别是LpfA与宿主细胞的交互作用,是控制开/关转换的重要因素[31]。
4.3 SPI-1,SPI-2
沙门氏菌的致病岛是其重要的毒力特征,沙门氏菌通过SPI-1编码的T3SS-1,将特定的作用蛋白转移到上皮细胞[32]。在功能上,SPI-1构成了沙门氏菌的侵袭功能,尤其是SPI-1ON亚群入侵上皮细胞,因为生长缓慢,同时也具有更高的耐受性。SPI-1ON能够将效应子转移到上皮细胞上,使他们被SCV吞噬后便开始裂解,从而将自身释放到受感染的上皮细胞中的细胞质中,使SPI-1OFF在这种炎症反应中受益[18]。SPI-1的双稳态表达将SPI-1视作感染期间的“分工”,同时也是抗生素威胁下的“对冲”。有研究表明,鞭毛调节系统中的FliZ可能有助于SPI-1的双稳态,同时也是SPI-1表达的激活剂[33]。由于鞭毛表达是有着双稳态表达产生的相位变化,因此 SPI-1分成2种亚群:SPI-1ON,具有运动性和侵入性的沙门氏菌细胞亚群;SPI-1OFF,亚群是非运动和非侵入性的。
SPI-2与SPI-1的侵袭能力与异质性表达并不一样,但是SPI-2编码的Ⅲ型分泌系统T3SS-2与T3SS-1部分功能却一样,同样能够将编码在SPI-2之外进行易位。T3SS-2表达由SPI-2编码的双组分调节系统SsrA/SsrB进行调节,易位的效应子以及双组分调节系统负责将效应蛋白输送到宿主细胞种,该系统不仅控制其自身的表达,还控制分泌装置和分泌效应子的表达[34],它们可以大致分为ssa基因、ssr基因、ssc基因和sse基因四类[35]。SsrB结合并调节自身启动子和与上游SsrA基因对应的启动子的转录[36],并且SsrB可以通过解除H-NS抑制激活基因,也可以直接刺激转录[37]。
2种T3SS都分泌单独的效应蛋白库,在功能上,T3SS-1与SPI-1构成沙门氏菌的侵入性,T3SS-2与SPI-2则构成细胞内的致病性与耐受性。
4.4 生物被膜
生物被膜是微生物的组织结构,往往黏附在生物或非生物表面上并包裹在自己生产的细胞外基质中。沙门氏菌的生物被膜由卷曲纤维、纤维素、蛋白质和细胞外DNA的基质组成,包裹着细菌簇[45]。而CsgD作为鼠伤寒沙门氏菌的生物被膜主要组成与控制基因,可以调节沙门氏菌生物被膜相关基质化合物的表达,也利用着自身的双稳态表达形成表型异质性的一部分[38]。
即便处于相同的应激条件下,CsgDON和CsgDOFF也能产生差异表达,形成生物被膜的异质性[46]。主要通过转录差异会形成了2种不同细胞谱系:第一种是聚集细胞,由c-di-GMP,氨基酸和碳水化合物代谢途径基因形成的转录,对环境的变化具有更高的抵抗力;第二种是浮游细胞,浮游细胞具有侵袭性,毒性以及高活动性。形成的2种特殊细胞类型,浮游细胞适应毒力,聚集细胞则适应持久性,而这也正是体现了对冲策略[47]。CsgD激活csgBA操纵子,然后该操纵子编码产生所需的蛋白质[48]。由于CsgD的表达和活性受c-di-GMP的直接控制,因此细胞内c-di-GMP细胞略微不同的差异都可能会导致生物膜形成显着差异。
4.5 脂多糖
脂多糖是介导沙门氏菌生物膜形成的关键组分,与生物被膜和鞭毛一样,脂多糖分子是鼠伤寒沙门氏菌用来触发炎症反应的病原相关分子模式。单个脂多糖分子由外膜的外小叶中的类脂A、核心寡糖、o-抗原共价连接组成[49]。o-抗原的修饰可以帮助沙门氏菌逃避宿主免疫系统,opvAB由细胞的2个质膜蛋白组成,是o-抗原的操纵子之一[25],opvAB操纵子前面的调节区域包含4个OxyR 蛋白结合位点和4个GATC甲基化位点,OxyR和Dam甲基转移酶调控了opvAB的表达。在“打开”状态下,OxyR蛋白在第2和第4个GATC位点进行结合,而第1和第3位点则形成甲基化;在“关闭”状态下,观察到相反的甲基化模式,第2和第4 GATC位点被甲基化。利用赌注对冲的策略,opvON种群可以在噬菌体的威胁下存活,威胁解除之后则再次产生opvOFF种群[25,40]。
与opvAB操纵子在调控中的相似是噬菌体P22的gtrABC(糖转移酶)操纵子,它也能够在细胞溶原化时修饰鼠伤寒沙门氏菌的o-抗原。在“打开”状态下,第1和第2 GATC位点的甲基化,而切换到“关闭”状态时,第3和第4个位点则发生甲基化[50]。
4.6 肌醇作用
肌醇是土壤中丰富的多元醇,其磷酸化形式被植物利用作为储磷分子[51]。肌醇降解途径由酶、转运蛋白和调节剂组成,受其影响,鼠伤寒沙门氏菌能够在以肌醇为唯一碳源的培养基中生长[52]。肌醇的降低是一种特殊的适应手段,它能够帮助鼠伤寒沙门氏菌通过突破肠道中的营养限制来完成自身健康的生长。因此,这种方法有助于鼠伤寒沙门氏菌在其宿主生物中的存活、定殖、增殖和持久性。此外,肌醇的双稳态表达产生2个亚群,其中一个可以增殖,而另一个亚群则不生长。
控制肌醇双稳定性的主要参与者可能是IolR,它是在没有肌醇的情况下iol基因的转录抑制因子[41]。有研究表明,IolR作为降解途径的主要调节因子,在没有肌醇的情况下可以抑制表达;如果存在碳酸氢盐,或者不存在IolR,或者是细胞已经适应肌醇的最小介质的情况下,滞后期会极大的缩短,最终双稳态表型被消除[53]。最近的一项研究表明,双稳态主要与IolR和iol基因启动子之间的相互作用有关[52]。因此,iol基因的表达是对于沙门氏菌的“抑制”,因为“打开”状态下的细胞在竞争性生长中并不具有优势。
5 结语
因为表型异质性的存在,由沙门氏菌引起的疾病治疗方法变得多样化,不同表型有不同的治疗方案,目前的治疗方法是广泛使用抗生素,但是效果不断下降,耐药性却得到了提升,甚至形成了多重耐药性。随着不断适应高抗菌药物浓度的亚群进化,如不及时进行干预,沙门氏菌对抗菌药物耐药性及适应性将不断增加,届时就会严重影响用药选择及治疗效果,而沙门氏菌自身的进化机制使得我们需要更进一步的了解单细胞在群体中的作用。基因表达的异质性作为大部分细菌的本身特征,是可以由细菌自行选择的。对于目前的研究来说,表型异质性可能是一种本身固有且未被充分认知的毒力特性,对于毒力因子来说,不同表达是否会影响到各毒力因子之间的关系以及是否影响到沙门氏菌繁殖后代细胞的生存仍然是一个未知数。感染过程中产生的异质性是由宿主免疫反应引起的还是它预先存在于亚群中以阻止环境压力,这些问题仍值得探索研究。继续研究异质性将对充分了解体内细菌种群动态,鼓励开发快速清除感染的抗菌疗法至关重要。未来单细胞技术的发展将使我们对异质性有更加全面的认识,也方便学者更好地、深入地解析异质性带来的影响。
[1] GAL-MOR O, BOYLE E C, GRASSL G A.Same species, different diseases:How and why typhoidal and non-typhoidal Salmonella enterica serovars differ[J].Frontiers in Microbiology, 2014, 5:391.
[2] 赵伟, 王扬眉, 潘迎捷, 等.人工模拟胃肠道模型在食源性致病菌异质性研究中的应用进展[J].食品科学, 2021, 42(23):268-274. ZHAO W, WANG Y M, PAN Y J, et al.Progress in the application of simulated gastrointestinal models to study the heterogeneity of foodborne pathogens[J].Food Science, 2021, 42(23):268-274.
[3] BAL ZSI G, VAN OUDENAARDEN A, COLLINS J J.Cellular decision making and biological noise:From microbes to mammals[J].Cell, 2011, 144(6):910-925.
ZSI G, VAN OUDENAARDEN A, COLLINS J J.Cellular decision making and biological noise:From microbes to mammals[J].Cell, 2011, 144(6):910-925.
[4] BUMANN D.Heterogeneous host-pathogen encounters:Act locally, think globally[J].Cell Host &Microbe, 2015, 17(1):13-19.
[5] ACKERMANN M.A functional perspective on phenotypic heterogeneity in microorganisms[J].Nature Reviews Microbiology, 2015, 13(8):497-508.
[6] WEIGEL W A, DERSCH P.Phenotypic heterogeneity:A bacterial virulence strategy[J].Microbes and Infection, 2018, 20(9-10):570-577.
[7] EVANS C R, FAN Y Q, WEISS K, et al.Errors during gene expression:Single-cell heterogeneity, stress resistance, and microbe-host interactions[J].mBio, 2018, 9(4):e01018.
[8] SILVERMAN M, ZIEG J, HILMEN M, et al.Phase variation in Salmonella:Genetic analysis of a recombinational switch[J].Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(1):391-395.
[9] GARC A-PASTOR L, PUERTA-FERN
A-PASTOR L, PUERTA-FERN NDEZ E, CASADES
NDEZ E, CASADES S J.Bistability and phase variation in Salmonella enterica[J].Biochimica et Biophysica Acta (BBA)—Gene Regulatory Mechanisms, 2019, 1862(7):752-758. [10] ARNOLDINI M, VIZCARRA I A, PE
S J.Bistability and phase variation in Salmonella enterica[J].Biochimica et Biophysica Acta (BBA)—Gene Regulatory Mechanisms, 2019, 1862(7):752-758. [10] ARNOLDINI M, VIZCARRA I A, PE A-MILLER R, et al.Bistable expression of virulence genes in Salmonella leads to the formation of an antibiotic-tolerant subpopulation[J].PLoS Biology, 2014, 12(8):e1001928.
A-MILLER R, et al.Bistable expression of virulence genes in Salmonella leads to the formation of an antibiotic-tolerant subpopulation[J].PLoS Biology, 2014, 12(8):e1001928.
[11] SAINI S, ELLERMEIER J R, SLAUCH J M, et al.The role of coupled positive feedback in the expression of the SPI1 type three secretion system in Salmonella[J].PLoS Pathogens, 2010, 6(7):e1001025.
[12] BUMANN D, CUNRATH O.Heterogeneity of Salmonella-host interactions in infected host tissues[J].Current Opinion in Microbiology, 2017, 39:57-63.
[13] KREIBICH S, HARDT W D.Experimental approaches to phenotypic diversity in infection[J].Current Opinion in Microbiology, 2015, 27:25-36.
[14] MILLS E, AVRAHAM R.Breaking the population barrier by single cell analysis:One host against one pathogen[J].Current Opinion in Microbiology, 2017, 36:69-75.
[15] HARE P J, LAGREE T J, BYRD B A, et al.Single-cell technologies to study phenotypic heterogeneity and bacterial persisters[J].Microorganisms, 2021, 9(11):2277.
[16] NUSS A M, SCHUSTER F, ROSELIUS L, et al.A precise temperature-responsive bistable switch controlling Yersinia virulence[J].PLoS Pathogens, 2016, 12(12):e1006091.
[17] GOLLAN B, GRABE G, MICHAUX C, et al.Bacterial persisters and infection:Past, present, and progressing[J].Annual Review of Microbiology, 2019, 73:359-385.
[18] ZHANG Z R, CLAESSEN D, ROZEN D E.Understanding microbial divisions of labor[J].Frontiers in Microbiology, 2016, 7:2070.
[19] WEST S A, COOPER G A.Division of labour in microorganisms:An evolutionary perspective[J].Nature Reviews Microbiology, 2016, 14(11):716-723.
[20] ACKERMANN M, STECHER B, FREED N E, et al.Self-destructive cooperation mediated by phenotypic noise[J].Nature, 2008, 454(7207):987-990.
[21] COOPER G A, LIU M, PE A J, et al.The evolution of mechanisms to produce phenotypic heterogeneity in microorganisms[J].Nature Communications, 2022, 13:195.
A J, et al.The evolution of mechanisms to produce phenotypic heterogeneity in microorganisms[J].Nature Communications, 2022, 13:195.
[22] RYAN D, PATI N B, OJHA U K, et al.Global transcriptome and mutagenic analyses of the acid tolerance response of Salmonella enterica serovar typhimurium[J].Applied and Environmental Microbiology, 2015, 81(23):8054-8065.
[23] STEELE-MORTIMER O.The Salmonella-containing vacuole:Moving with the times[J].Current Opinion in Microbiology,2008,11(1):38-45.
[24] CHEN S J, FENG Z, SUN H L, et al.Biofilm-formation-related genes csgD and bcsA promote the vertical transmission of Salmonella enteritidis in chicken[J].Frontiers in Veterinary Science, 2021, 7:625049.
[25] WANG X Y, QUINN P J.Endotoxins:Lipopolysaccharides of Gram-negative Bacteria[M]//Subcellular Biochemistry.Dordrecht:Springer Netherlands, 2010:3-25.
[26] BONIFIELD H R, HUGHES K T.Flagellar phase variation in Salmonella enterica is mediated by a posttranscriptional control mechanism[J].Journal of Bacteriology, 2003, 185(12):3567-3574.
[27] LEDEBOER N A, FRYE J G, MCCLELLAND M, et al.Salmonella enterica serovar Typhimurium requires the Lpf, Pef, and Tafi fimbriae for biofilm formation on HEp-2 tissue culture cells and chicken intestinal epithelium[J].Infection and Immunity, 2006, 74(6):3156-3169.
[28] 丁雪燕, 王思权, 庞胜美, 等.细菌长极性菌毛的研究进展[J].中国兽医学报, 2021, 41(2):373-380. DING X Y, WANG S Q, PANG S M, et al.A review of bacterial long polar fimbriae[J].Chinese Journal of Veterinary Science, 2021, 41(2):373-380.
[29] B UMLER A J, TSOLIS R M, BOWE F A, et al.The pef fimbrial operon of Salmonella typhimurium mediates adhesion to murine small intestine and is necessary for fluid accumulation in the infant mouse[J].Infection and Immunity, 1996, 64(1):61-68.
UMLER A J, TSOLIS R M, BOWE F A, et al.The pef fimbrial operon of Salmonella typhimurium mediates adhesion to murine small intestine and is necessary for fluid accumulation in the infant mouse[J].Infection and Immunity, 1996, 64(1):61-68.
[30] GARC A-PASTOR L, S
A-PASTOR L, S NCHEZ-ROMERO M A, JAKOMIN M, et al.Regulation of bistability in the std fimbrial operon of Salmonella enterica by DNA adenine methylation and transcription factors HdfR, StdE and StdF[J].Nucleic Acids Research, 2019, 47(15):7929-7941.
NCHEZ-ROMERO M A, JAKOMIN M, et al.Regulation of bistability in the std fimbrial operon of Salmonella enterica by DNA adenine methylation and transcription factors HdfR, StdE and StdF[J].Nucleic Acids Research, 2019, 47(15):7929-7941.
[31] HUMPHRIES A D, RAFFATELLU M, WINTER S, et al.The use of flow cytometry to detect expression of subunits encoded by 11 Salmonella enterica serotype Typhimurium fimbrial operons[J].Molecular Microbiology, 2003, 48(5):1357-1376.
[32] QUE F X, WU S Y, HUANG R.Salmonella pathogenicity island 1(SPI-1) at work[J].Current Microbiology, 2013, 66(6):582-587.
[33] CLARK L, PERRETT C A, MALT L, et al.Differences in Salmonella enterica serovar Typhimurium strain invasiveness are associated with heterogeneity in SPI-1 gene expression[J].Microbiology, 2011, 157(Pt 7):2072-2083.
[34] JENNINGS E, THURSTON T L M, HOLDEN D W.Salmonella SPI-2 type Ⅲ secretion system effectors:Molecular mechanisms and physiological consequences[J].Cell Host &Microbe, 2017, 22(2):217-231.
[35] HELAINE S, CHEVERTON A M, WATSON K G, et al.Internalization of Salmonella by macrophages induces formation of nonreplicating persisters[J].Science, 2014, 343(6167):204-208.
[36] KARZAI A W, ROCHE E D, SAUER R T.The SsrA-SmpB system for protein tagging, directed degradation and ribosome rescue[J].Nature Structural Biology, 2000, 7(6):449-455.
[37] WALTHERS D, LI Y, LIU Y J, et al.Salmonella enterica response regulator SsrB relieves H-NS silencing by displacing H-NS bound in polymerization mode and directly activates transcription[J].The Journal of Biological Chemistry, 2011, 286(3):1895-1902.
[38] AHMAD I, CIMDINS A, BESKE T, et al.Detailed analysis of c-di-GMP mediated regulation of csgD expression in Salmonella typhimurium[J].BMC Microbiology, 2017, 17(1):1-12.
[39] MIKO AJCZYK A, Z
AJCZYK A, Z OTKOWSKA D.Neuroimmunological implications of subclinical lipopolysaccharide from Salmonella enteritidis[J].International Journal of Molecular Sciences, 2018, 19(10):3274.
OTKOWSKA D.Neuroimmunological implications of subclinical lipopolysaccharide from Salmonella enteritidis[J].International Journal of Molecular Sciences, 2018, 19(10):3274.
[40] KRÖGER C, STOLZ J, FUCHS T M.Myo-inositol transport by Salmonella enterica serovar Typhimurium[J].Microbiology, 2010, 156(1):128-138.
[41] 郭志燕, 周明旭, 段强德, 等.细菌鞭毛的致病性及其免疫学应用的研究进展[J].微生物学报, 2014, 54(3):251-260. GUO Z Y, ZHOU M X, DUAN Q D, et al.Advance on the pathogenicity and immunological application of bacterial flagella: A review[J].Acta Microbiologica Sinica, 2014, 54(3):251-260.
[42] HORSTMANN J A, LUNELLI M, CAZZOLA H, et al.Methylation of Salmonella typhimurium flagella promotes bacterial adhesion and host cell invasion[J].Nature Communications, 2020, 11(1):2013.
[43] HORSTMANN J A, ZSCHIESCHANG E, TRUSCHEL T, et al.Flagellin phase-dependent swimming on epithelial cell surfaces contributes to productive Salmonella gut colonisation[J].Cellular Microbiology, 2017, 19(8):e12739.
[44] 王思权, 丁雪燕, 朱国强.沙门氏菌Ⅰ型菌毛研究进展[J].生命科学, 2021, 33(2):231-237. WANG S Q, DING X Y, ZHU G Q.The research progress of Salmonella type Ⅰ fimbriae[J].Chinese Bulletin of Life Sciences, 2021, 33(2):231-237.
[45] 闫玉卿, 董鹏程, 张一敏, 等.沙门氏菌生物被膜的结构、调控因子与控制措施研究进展[J].生物加工过程, 2021, 19(6):676-685. YAN Y Q, DONG P C, ZHANG Y M, et al.Research progress on the structures, regulators and control measures of Salmonella biofilm:A review[J].Chinese Journal of Bioprocess Engineering, 2021, 19(6):676-685.
[46] GUPTA P, SARKAR S, DAS B, et al.Biofilm, pathogenesis and prevention:A journey to break the wall:A review[J].Archives of Microbiology, 2016, 198(1):1-15.
[47] AHMAD I, LAMPROKOSTOPOULOU A, LE GUYON S, et al.Complex c-di-GMP signaling networks mediate transition between virulence properties and biofilm formation in Salmonella enterica serovar Typhimurium[J].PLoS One, 2011, 6(12):e28351.
[48] 董洪燕, 张小荣, 潘志明, 等.转座子随机插入鉴定肠炎沙门氏菌生物膜形成相关基因[J].微生物学报, 2008, 48(7):869-873. DONG H Y, ZHANG X R, PAN Z M, et al.Identification of genes for biofilm formation in a Salmonella enteritidis strain by transposon mutagenesis[J].Acta Microbiologica Sinica, 2008, 48(7):869-873.
[49] 代勤龙, 孔庆科, 刘青, 等.肠道沙门氏菌O-抗原多糖的研究进展[J].微生物学通报, 2016, 43(8):1829-1835. DAI Q L, KONG Q K, LIU Q, et al.Research advances in O-antigen polysaccharide of Salmonella enterica[J].Microbiology China, 2016, 43(8):1829-1835.
[50] DAVIES M R, BROADBENT S E, HARRIS S R, et al.Horizontally acquired glycosyltransferase operons drive salmonellae lipopolysaccharide diversity[J].PLoS Genetics, 2013, 9(6):e1003568.
[51] HELLINCKX J, FUCHS T M.Hysteresis in myo-inositol utilization by Salmonella typhimurium[J].MicrobiologyOpen, 2017, 6(2):e00431.
[52] HELLINCKX J, HEERMANN R, FELSL A, et al.High binding affinity of repressor IolR avoids costs of untimely induction of myo-inositol utilization by Salmonella typhimurium[J].Scientific Reports, 2017, 7:44362.
[53] KRÖGER C, FUCHS T M.Characterization of the myo-inositol utilization island of Salmonella enterica serovar Typhimurium[J].Journal of Bacteriology, 2009, 191(2):545-554.