进入21世纪以来,我国经济高速发展,人民生活水平不断提高,人们对食品安全的意识也在不断提升。党的十九大报告明确提出要实施食品安全战略,让人民吃得安心,这对于食品行业的质量监控和安全检测提出了更高的要求和期望。近十几年来,食品安全事故给人民群众的生命和健康带来了严重危害,通过行之有效的方法检测食品中的有毒有害物质具有重要意义。当前,食品安全领域常用的传统检测方法主要包括高效液相色谱法[1]、气相色谱法[2]、气相色谱-质谱法[3]和比色分析法[4]等,这些检测方法的测量结果准确、灵敏度高且已具备成熟的系统理论支撑,但仍存在成本高、检测过程复杂、耗时长、检测不便利等缺点。近年来,纳米材料如分子印迹聚合物、金纳米粒子、适配体、铁蛋白纳米颗粒等因具有独特的结构和特性从而被广泛应用于新型传感器的构建,并展现出良好的灵敏度、分辨率和生物相容性,已逐渐成为检测领域的热点关注对象。
铁蛋白(ferritin)作为一种天然的笼形蛋白纳米颗粒,其天然的纳米空腔结构、良好的水溶性、稳定性和生物相容性使其在构建检测传感器方面具有独特优势。自1937年LAUFBRERGER[5]采用镉盐对铁蛋白进行提纯以来,科研工作者对其结构、功能和应用进行了广泛且深入的研究。铁蛋白是由24个亚基自组装成分子质量约为450~500 kDa的中空笼形结构蛋白,内、外直径分别约为8 nm和12 nm,其内部空腔可容纳4 500个铁原子,在体内主要参与铁代谢平衡[6]。值得注意的是,铁蛋白独特的纳米尺度内部空腔可以有效地装载过渡金属、荧光分子、纳米颗粒等物质[7],并且铁蛋白的外壳还可以很容易地进行化学或生物修饰从而引入特定功能基团[8-10],因此,通过物理、化学或生物的方法可以赋予铁蛋白独特的功能特性,进而用于传感元件的构建和有毒有害物质的检测。比如,AKANDA等[11]使用Ru(NH3)63+作为OSR-亲氧氧化还原介质,H2O2作为ISR-亲氧氧化剂,在玻碳(glassy carbon,GC)电极上构建了由铁蛋白介导的氧化还原循环免疫传感器,通过检测发现,此方法对于食源性大肠杆菌抗原表现出优异的检测性能。目前,越来越多的研究表明,对铁蛋白进行修饰来构建传感器从而应用于检测食品中的有害物质已展现出良好的测试效果。
本文首先对铁蛋白的结构及其性质进行了简要介绍,总结了铁蛋白制备传感器元件的常用策略,并重点综述了铁蛋白纳米颗粒在食品有毒有害物质检测方面的应用,以期为构建灵敏度好、分辨率高、携带方便和生物相容性好的食品检测传感器研究提供新的视角。
1 铁蛋白的结构和性质
1.1 铁蛋白的结构
天然的铁蛋白主要包含铁核和蛋白质外壳两部分。铁蛋白外壳通常称为铁蛋白或脱铁铁蛋白,其结构是由24个亚基自组装而成的中空笼形结构,内部铁核是由氢氧化铁和磷酸盐组成的非均匀的无机铁颗粒结构,一般情况下,铁核结构中含有2 500个以上的三价铁离子[12]。对于铁蛋白外壳而言,其结构在动物、植物和微生物中高度保守,通常是由24个相同或者相似的蛋白质亚基以F432对称的方式自组装而成,内外径分别约为8 nm和12 nm[13]。由于其高度的对称性,铁蛋白分子包含3个C4旋转轴,4个C3旋转轴和6个C2旋转轴,并形成了6个四重轴通道,8个三重轴通道,这些通道的直径介于0.3~0.5 nm(如图1所示)。并且,它们是离子或者分子进出铁蛋白内部空腔的重要路径,在合成无机纳米颗粒以及装载小分子等方面发挥着重要作用。铁蛋白每个亚基的外形呈圆柱体,主要由α螺旋结构构成,包含A、B、C和D长螺旋结构和C末端一个较短E螺旋结构,B螺旋和C螺旋之间由一段被称为BC-loop的氨基酸链连接,E螺旋位于C端并与α螺旋簇成60°夹角[14]。植物铁蛋白的N端还包含一个EP肽段,位于铁蛋白的外表面。最近的研究表明,该EP肽段是植物铁蛋白具有高热稳定(Tm,108 ℃)的重要原因。
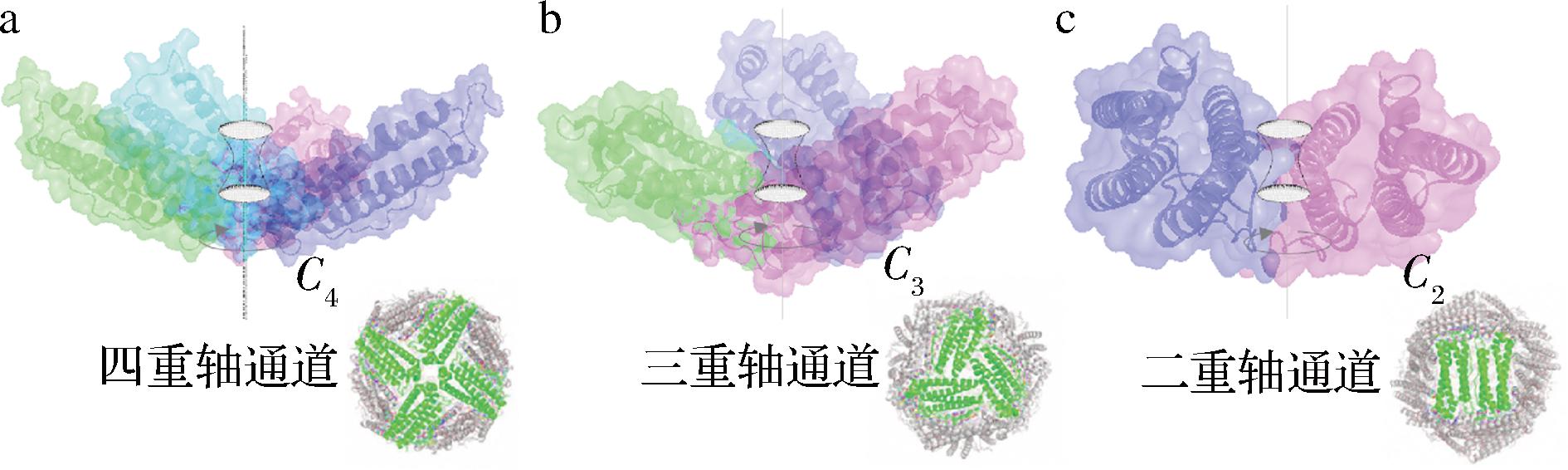
a-铁蛋白的四重轴通道;b-铁蛋白的三重轴通道; c-铁蛋白的二重轴通道
图1 铁蛋白的三种通道结构示意图
Fig.1 Diagram of the three channels of ferritin
1.2 铁蛋白的理化性质
铁蛋白在自然界中分布十分广泛,不同来源的铁蛋白均具有较好的水溶性,而且,动物铁蛋白的水溶性普遍优于植物铁蛋白。另外,大多数铁蛋白具有较好的热稳定性,可耐受80 ℃加热30 min而不发生结构变性。其中,日本对虾来源的铁蛋白热变性温度高达100 ℃,植物铁蛋白H2亚基的变性温度高达106 ℃。不仅如此,铁蛋白对尿素、盐酸胍等变性剂也具有良好的耐受性[15-16]。此外,铁蛋白还具有pH值响应的可逆组装性质,即在pH≤2.0或pH≥11.0的条件下,铁蛋白纳米笼能解离成单亚基状态,当溶液pH恢复至中性时,解离的亚基又自发地重新组装,形成中空球状结构[17]。对于铁蛋白的笼形结构,其包含了3个典型的界面,即内表面、外表面和亚基间界面,这3个界面的化学性质不尽相同,但可通过化学或生物的方式进行修饰从而实现铁蛋白结构和功能的调控[18]。
2 基于铁蛋白传感器的构建策略
铁蛋白作为一种天然的生物大分子蛋白质,通常情况下并不具备光、电、磁等可用于检测信号传导的物理化学性质,但是其独特的纳米笼形结构和优良的结构稳定性,为构建具有光、电等特殊理化性质的铁蛋白复合纳米颗粒提供了便利。目前,利用铁蛋白构建传感元件主要有两种途径[19]:(1)模板合成法;(2)表面修饰法。
2.1 模板合成法
铁蛋白通过铁转运、氧化、成核等步骤将铁离子以铁核的形式储存在内部空腔,从而调节体内的铁代谢平衡。20世纪90年代,科研工作者利用生物矿化的思路在马脾铁蛋白腔内合成了氧化铁纳米颗粒,随后又合成了50多种金属纳米颗粒,如Fe3O4[20],Gd2O3[21]、Co3O4[22]、CdS[23]等,这使得铁蛋白纳米笼已经成为一种优良的生物模板可以用来合成各种各样的纳米材料,并用于检测领域。目前,利用铁蛋白合成无机纳米颗粒的方法主要分为以下两类:
(1)共沉淀法,即两种不同的物质在铁蛋白腔内发生特异性吸附、静电作用或化学反应等从而形成纳米颗粒(如图2-a所示)。XING等[24]利用乙二胺四乙酸介导Cd2+和Se2-进入脱铁蛋白,通过这种方法得到的CdSe量子点的水溶性大大提高,潜在的细胞毒性得到有效预防。与此类似,LI等[25]将水性Na2CO3/气态CO2添加到由脱铁蛋白、聚甲基丙烯酸(polymethacrylic acid,PMAA)和CaCl2组成的混合物中,TEM图像证实,PMAA抑制了CaCO3在混合物溶液中形成,而充分在铁蛋白内成核。这种策略为以铁蛋白为模板调控无机纳米材料的尺寸和范围具有普遍意义。LIU等[26-27]在pH 2.0的磷酸盐缓冲液中解离脱铁铁蛋白,继而引入金属离子并提高环境的pH值(pH≥5),使解离的亚基重组恢复成笼状结构。因此,捕获的金属离子和H2PO4-在其内表面形成金属磷酸盐沉淀。通过以上方法制得的金属(镉和铅)磷酸盐铁蛋白可作为传感元件,采用生物素标记后可用于检测肿瘤坏死因子(tumor necrosis factor-α,TNF-α),检测限约为2 pg/mL。
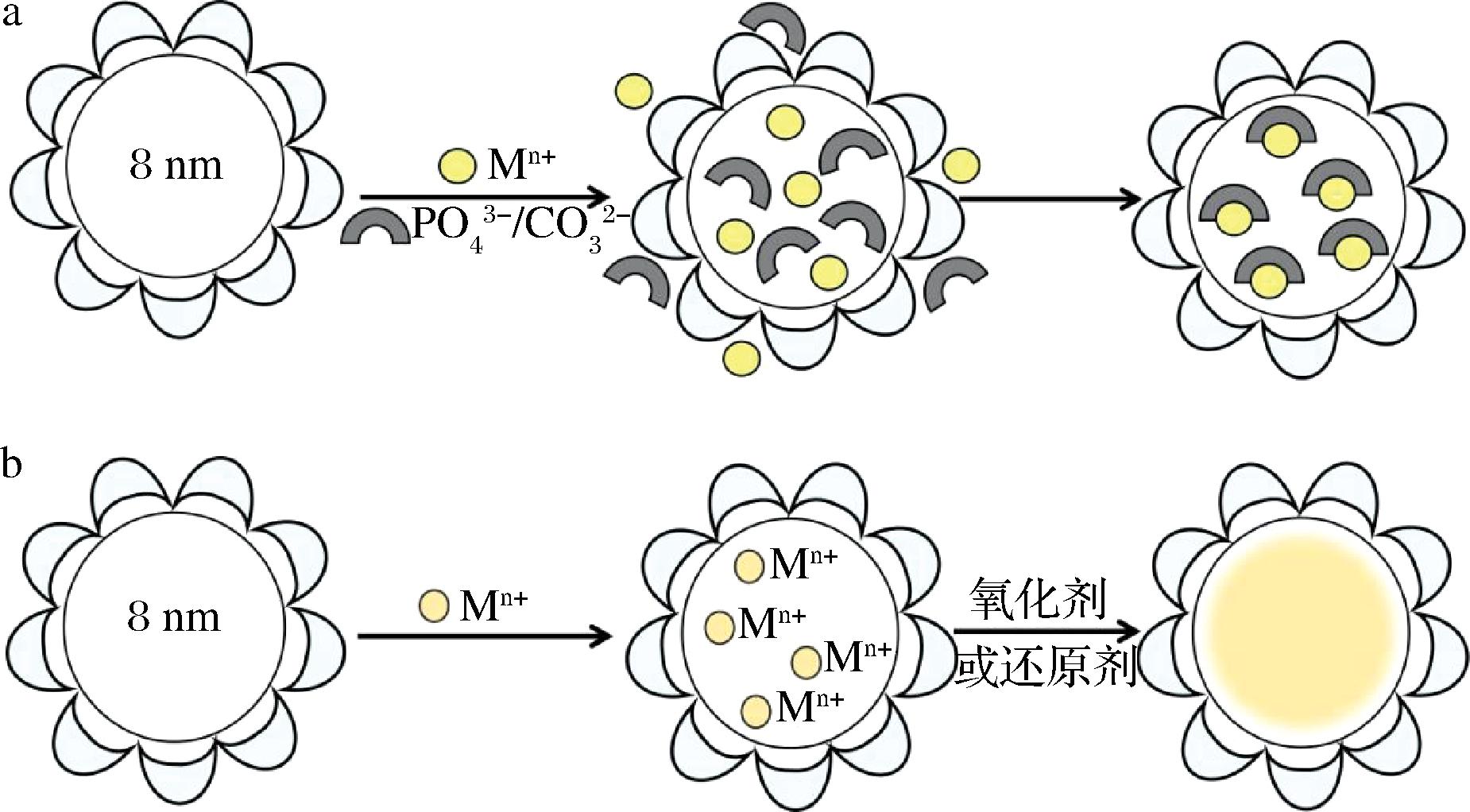
a-共沉淀法;b-氧化还原法
图2 基于铁蛋白纳米笼合成纳米颗粒示意图
Fig.2 The schematical illustration of inorganic nanoparticle synthesis by using ferritin nanocages
(2)氧化还原法,即利用氧化或者还原反应将游离的金属离子或金属氧化物转化成金属纳米颗粒,从而形成尺度均一的纳米颗粒[28] (如图2-b所示)。KLEM等[29]用氙弧灯照射高氧化态金属柠檬酸盐,在氧气存在的条件下,金属离子在铁蛋白空腔中发生氧化反应,这种利用光化学还原技术和铁蛋白的纳米空腔结构优势,成功合成了纳米尺度的Eu、Ti和Fe羟基氧化纳米颗粒,并且矿化后铁蛋白的性质仍然完好。另外,铁蛋白是一种天然的铁氧化酶,可以催化Fe2+在铁氧化中心被O2或H2O2快速氧化为Fe3+,然后将产物转移到中心空腔形成具有模拟酶活性的铁纳米核,此纳米核可以在H2O2存在的情况下催化许多底物的氧化[30]。TANG等[31]发现合成的脱铁蛋白-金纳米簇(Au-Ft)具有过氧化物酶活性,将其与葡萄糖氧化酶结合,通过联用3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)建立了一种检测葡萄糖的比色传感器。JIANG等[32]将氯化血红素封装到铁蛋白(Ftn)的空腔中,构建了一种具有模拟纳米酶性质的复合物(hemin@Ftn),与HRP相似,hemin@Ftn在H2O2存在下可有效催化TMB氧化,分别生成蓝色和棕色产物,可用作比色传感元件。
2.2 表面修饰法
铁蛋白的表面修饰即在铁蛋白表面多肽链上引入某些分子,就可以在保持其主要生物功能的同时,赋予其传感的能力。自20世纪70年代科研工作者就已经开始对铁蛋白进行化学修饰。例如,KISHIDA等[33]将铁蛋白标记在抗体上并与抗原相互结合,从而可以对抗原抗体结合的部位进行特异检测。而且,随着基因工程技术的快速发展,基于生物修饰途径改造铁蛋白纳米笼也逐步拉开序幕。例如KRAMER等[34]在铁蛋白L亚基C端插入一段功能肽段,报道了一种基于铁蛋白将银离子转换成金属银的方法,据此得到的银纳米颗粒可用于检测领域。本文将对铁蛋白的化学修饰和生物修饰应用于传感器的制备进行介绍[35]。
(1)化学修饰,铁蛋白纳米笼的外表面含有丰富的氨基、羟基和羧基等,因此将生物分子,如染料分子、抗体片段、DNA、蛋白质等功能性小分子与铁蛋白上活性基团进行化学偶联(如图3所示),从而赋予铁蛋白独特的功能特性[36-37]。TERASHIMA等[38]在重链铁蛋白(H-Fn)纳米笼外表面共价连接上荧光染料(Cy5.5),制备了一种用于血管巨噬细胞成像的笼状蛋白(HFn-Cy5.5),通过观察其荧光信号强度,可用于体内血管炎症的无创成像。2013年,ZHAO等[39]通过将磁性纳米颗粒与核酸适体1(Apt1)偶联,核酸适体2(Apt2)和被标记的脱铁蛋白相融合,依据亲和作用制成了一种三明治式复合物(Apt1/凝血酶/Apt2-脱铁蛋白NPs-HRP)。应用差分脉冲伏安法(differential pulse voltammetry,DPV)监测电极响应,发现此复合物可以在0.5~100 pM对凝血酶浓度产生线性电流响应,检测限低至0.07 pmol/L(S/N=3)。FERN NDEZ 等[40]在pH 2.0 的条件下将分别连有供体荧光分子(AF350)和受体荧光分子(AF430)的铁蛋白解离后,在pH 7.4 条件下重组。当同一铁蛋白连接荧光供体和受体分子时可产生荧光共振,因此研发了一款通过调节两种荧光分子的比例可产生不同光的铁蛋白探针,此探针在生物标记应用中具有良好的潜力。通过以上化学修饰方法制备的复合物,具有粒径均一、可靶向成像、有较大的比表面积和低免疫排斥等特点,这些属性为铁蛋白在疾病检测领域带来了极大的优势。
NDEZ 等[40]在pH 2.0 的条件下将分别连有供体荧光分子(AF350)和受体荧光分子(AF430)的铁蛋白解离后,在pH 7.4 条件下重组。当同一铁蛋白连接荧光供体和受体分子时可产生荧光共振,因此研发了一款通过调节两种荧光分子的比例可产生不同光的铁蛋白探针,此探针在生物标记应用中具有良好的潜力。通过以上化学修饰方法制备的复合物,具有粒径均一、可靶向成像、有较大的比表面积和低免疫排斥等特点,这些属性为铁蛋白在疾病检测领域带来了极大的优势。
(2)生物修饰,采用基因工程的方法,将特定的序列插入到铁蛋白基因序列中,可得到兼具多种功能的铁蛋白,再通过细菌表达出所需求的新型铁蛋白,从而实现对铁蛋白的精确修饰。目前科研工作者利用基因重组技术已经实现对铁蛋白的许多部位进行修饰。KANG等[41]在超嗜热菌铁蛋白(Pf_Fn)亚基表面引入抗体的Fc结合肽段(FcBP),得到的融合表达产物(FcBP-ferritin)与兔抗叶酸受体抗体形成非共价复合物,由荧光成像得知这种复合体可以分别与乳腺癌细胞和叶酸受体过度表达细胞特异性结合,可作为分子成像探针。KIM等[42]通过将hFTN-H19的C端与增强型荧光蛋白[eGFP(或DsRed)]的N端结合,利用大肠杆菌作为细菌表达宿主,制备出重组荧光铁蛋白纳米粒子(FFNP),制备的FFNP具有放大荧光强度的显著效果,并且稳定性好,可用作生物分子检测中的指示剂。

图3 铁蛋白的化学修饰法
Fig.3 Chemical modification of ferritin
3 在食品检测中的应用
3.1 重金属离子
重金属离子极难被生物所降解,从而会随着食物链在人体内富集,这不仅使内脏器官发生病变,还会严重损害神经系统[43]。目前,电感耦合等离子体质谱法[44]、原子吸收光谱法[45]、原子荧光光谱[46]等常规方法可以精确测定重金属含量,但因分析运行成本高,操作繁琐等缺点受到限制。研究表明,铁蛋白具有铁氧化沉淀的生物学特性,可以将外界Fe2+氧化为Fe3+并在内部形成铁矿核,同时其内部的Fe3+也可以被还原成Fe2+并释放到外界中,氧化还原的过程使铁蛋白表现出传递电子的能力。张涛等[47]重组表达了泥蚶(Tegillarca granosa)铁蛋白,首先探究了其对Cd2+和Pb2+的富集能力,进而将泥蚶铁蛋白固定在羧基修饰的丝网印刷电极表面,制备出可检测Cd2+和Pb2+的生物传感器。室温下溶出伏安法测定的电化学信号表明,Cd2+和Pb2+在10~100 μg/L表现出良好的线性关系,检测限均能达到10 μg/L。近几年来,由于荧光探针检测技术具有灵敏度高、选择性好、应用方便等优势逐渐受到了研究人员的关注[48]。WANG等[49]基于汞离子与GMTCAAC(MBP)肽段具有较强亲和力的特点,将特异性MBP肽段的氨基酸序列融合在铁蛋白(HuHF)的N端,构建了(MBP-HuHF)铁蛋白突变体,并采用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记MBP-HuHF。在没有Hg2+的情况下,淬灭剂氧化石墨烯的加入可以通过荧光共振能量转移很大程度上淬灭FITC的荧光。当加入Hg2+后,Hg2+与MBP-HuHF突变体的特异性结合会导致蛋白质构象变化,使得荧光以剂量依赖的方式得到一定程度的恢复,据此构建了金属Hg2+检测生物传感器。该传感器对水中的汞离子表现出较高的选择性和敏感性,Hg2+浓度检测限为1.08 nmol/L。
3.2 真菌毒素
真菌毒素是真菌在一定条件下产生的二次代谢产物,是食品原料及饲料的主要污染物之一。根据联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)统计,每年全球大约25%的粮油作物受到真菌毒素的污染[50]。并且真菌毒素对人体危害极大,即使低剂量摄入也可能导致人体肝脏、肾脏损伤,甚至死亡。
细交链孢菌酮酸(tenuazonic acid,TeA)是由链格孢霉产生的有毒含氮代谢产物,是毒性最高的链格孢霉毒素[51]。TeA广泛存在于水果、谷物、蔬菜及农作物中,给食品安全带来极大隐患[52]。最近,WANG等[53]以TeA为目标分析物,利用铁蛋白纳米笼成功构建了一种增强型无毒免疫检测方法。首先采用酶联免疫吸附试验(enzyme-linked immunosorbnent assay,ELISA)评价方法从噬菌体展示库中筛选出具有TeA“内影像”的3种特异性β型抗独特型纳米体(β-AIds-Nbs),并选取对TeA具有最佳特异性识别的AId-Nb 2D作为无毒免疫检测的抗独特型纳米体。在此基础上,充分利用铁蛋白纳米笼的多聚体放大效应、高表达产量等优点,将筛选获得的AId-Nb 2D和荧光素酶(Nluc)基因融合到铁蛋白的N端和C端,从而构建了增强型生物发光酶免疫传感器。采用间接竞争酶联免疫分析(icELISA)评估了铁蛋白融合表达产物(2D-Nluc(F))的特异性结合活性,与未融合铁蛋白的对照组(2D-Nluc)相比,2D-Nluc(F)表现出增强的反应活性,IC50值为23.7 ng/mL,比2D-Nluc高2.9倍,该方法的检测限(LOD)为0.7 ng/mL。此研究通过利用铁蛋白的多聚效应提高了免疫分析的灵敏度,建立了一种新型高效的无毒免疫分析方法,为食品中微量有毒污染物的检测提供了一种新思路。
3.3 病毒
传染性胰腺坏死病毒(infectious pancreatic necrosis virus,IPNV)是一种引起鳟鱼、蛙鱼等多种鱼类患病的病毒病原体,能够给鱼类养殖行业带来巨大的经济损失,是各国进出口鱼的重要检测对象。CHAVAN等[54]报道了一种针对鱼类IPNV的即时检测生物传感器,该研究者通过基因融合技术在人源重链脱铁蛋白(H-AFN)的C端连接了Protein G;同时在C端进一步融合表达了His肽段,通过具有桥连作用的Ni-NTA将融合表达产物固定在金电极上。利用抗体抗原的结合特异性,并通过DPV和电化学阻抗谱进行电化学分析,从而可以对鱼样本IPNV进行快速定量化检测,检测限为2.69 TCID50/mL。
高致病禽流感H5N1是一种禽类烈性传染病,可以跨越种属障碍感染人类,曾在亚洲、欧洲等多个国家流行并造成巨大的经济损失[55]。目前,从非免疫合成文库中获取的纳米抗体对其目标抗原表现出较低的亲和力;而且该类型纳米抗体具有较短的血清半衰期,极大限制了在生物分析或治疗中的应用。近年来的研究表明,纳米抗体的低聚化是提高其亲和能力的有效途径。最近,FAN等[56]将铁蛋白C端的第五螺旋(即E螺旋结构)替换为纳米抗体,从而得到了一种新型纳米抗体,命名为Fenobody。透射电子显微镜分析显示Fenobody在铁蛋白四重轴通道表面形成了4聚体纳米抗体束,酶联免疫吸附试验表明Fenobody能够以最大限度地暴露抗原结合位点,相比于单体状态的纳米抗体,Fenobody对H5N1病毒的亲和力增加了约360倍,并且热稳定性极强,采用FITC标记 Fenobody和纳米抗体,发现Fenobody在体内的半衰期延长了近10倍,更为重要的是,ELISA双抗体夹心法表明Fenobody比普通的纳米抗体的敏感性高100倍。由此可见,此研究对于养禽业和人类公共安全具有重要意义。
3.4 其他有毒有害物质
H2O2具有高效杀菌、漂白与防腐的作用,被作为食品添加剂广泛地用于食品加工中。相关研究表明过量H2O2进入人体后可能会引起细胞氧化应激和损伤,导致人体遗传物质损伤、加快衰老、癌症、神经性退行疾病等问题产生。利用电化学传感器是高效、快速检测H2O2的方法之一,RAFIPOUR等[57]以铁蛋白纳米笼模板在其内部空腔合成钴纳米颗粒,并将其共价修饰在金电极表面,构建出H2O2电化学传感器。相比于裸金电极而言,钴纳米颗粒-铁蛋白复合颗粒(CoNP-Fn)修饰后的电极表现出更好的电催化活性。该传感器对H2O2的响应在2.49×10-9~1.91×10-8 mol/L具有良好的线性关系,检测限为2.48×10-9 mol/L。最近,TAMLEH等[58]将钴纳米颗粒-铁蛋白复合颗粒(CoNP-Fn)共价连接在多壁碳纳米管/壳聚糖(MWCNTS/CS)复合物修饰的玻璃碳电极表面,构建了CoNP-Fn/MWCNTS/CS电化学传感器,并通过DPV和循环伏安法评价了该传感器的性能,结果表明CoNP-Fn/MWCNTS/CS电化学传感器对H2O2检测的检测具有良好的线性响应,检测限为1.29 nmol/L,具有较好的稳定性、灵敏度和选择性。除此之外,铁蛋白内部空腔还可以合成其他金属纳米颗粒,并用于构建电化学传感器。例如,WANG等[59]利用铁蛋白纳米笼模板合成优势,在其内部空腔合成了双金属Au-Ag纳米颗粒(Au-Ag-Fn),将其修饰在石墨烯纳米片(GN)上,从而构建了可检测H2O2的GN/Au-Ag-Fn生物传感器。相比于单独的GN/Au和GN/Ag,基于GN/Au-Ag-Fn构建的生物传感器对H2O2具有更高的电催化活性。
基于H2O2参与过氧化物酶的催化过程,因而可以通过ABTS、TMB等底物的颜色变化来测定H2O2的浓度。2007年,阎锡蕴团队报道了铁磁性纳米颗粒具有辣根过氧化物酶相似的催化活性,并可以用于H2O2的检测。随后,该研究团队利用铁蛋白纳米笼合成了Fe3O4-铁蛋白纳米颗粒,并证实其具备良好的过氧化物酶活性。最近,WANG等[59]利用铁蛋白自身的铁氧化沉淀活性,外源制备了holoferritin,并证实holoferritin具有类似的过氧化物酶活性;而且,其过氧化物酶活性与铁离子装载量呈现正比关系,该研究进一步利用TMB为底物实现了H2O2的快速检测,H2O2的检测范围为4.85×103~14.71×103 nmol/L(如图4所示)。除此之外,JIANG等[31]发现利用铁蛋白纳米笼合成的金纳米簇-铁蛋白复合颗粒也具有过氧化物酶催化活性,可以有效地催化H2O2氧化TMB,从而实现H2O2的检测。
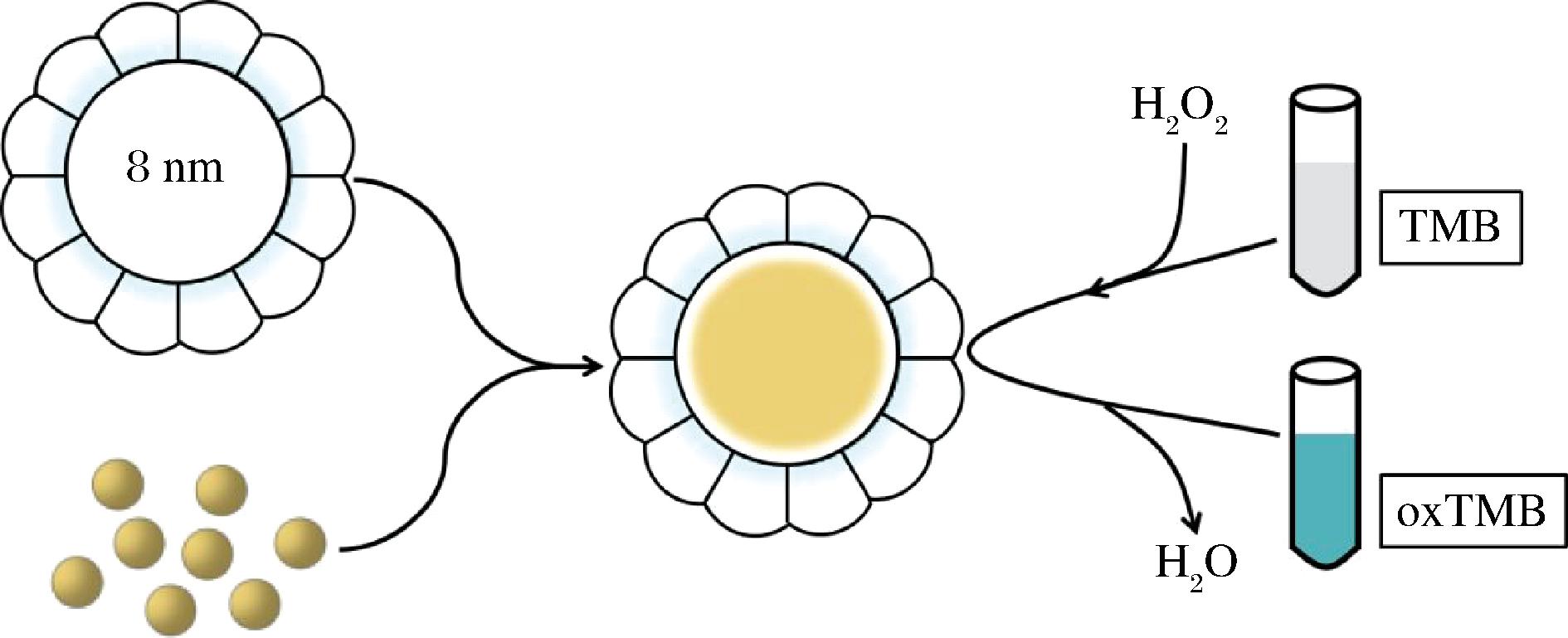
图4 含铁铁蛋白的合成及其过氧化物活性
Fig.4 Schematic illustration of the preparation of reconstituted ferrihydrite nanoparticles within ferritin cavity and its mimetic peroxidase activity
4 结论与讨论
铁蛋白具有独特的纳米笼形结构,而且结构稳定。同时,其天然的空腔结构可以作为模板合成各种具有特殊理化性质的无机纳米颗粒,使其成为一种独具优势的生物纳米材料,并广泛地应用于检测传感器的构建和有害物质成分分析检测。本文系统介绍了利用铁蛋白纳米笼在传感元件构建中的常见策略,即模板合成法和表面修饰法。目前,利用铁蛋白纳米颗粒构建的检测传感器可以用于食品毒素、重金属离子、病毒、过氧化氢等有毒有害物质的检测,并且在检测信号放大、模拟酶催化活性、易于改造等方面展现出独特优势。
然而,尽管铁蛋白纳米笼在各种传感元件构建及各类污染物的检测中都有报道,仍还面临着一些问题。这些问题主要包括:(1)目前利用铁蛋白制备传感元件应用于食品检测仍处于实验室研究阶段且对于食品中有害物质检测不够充分,如农药、兽药残留、致病菌检测等仍有待研究者给予关注;(2)利用铁蛋白构建传感元件的成本仍然较高,如何进一步解决原料获取、简化合成途径仍然是未来迫切需要解决的问题;(3)铁蛋白的化学修饰虽具有独特优势,但存在一定程度的不确定性。另外,铁蛋白的生物修饰可通过定向改造从而实现精准控制,但对可行的修饰基团仍然具有局限性。总之,食品安全是民生大计,相信铁蛋白纳米颗粒会随着研究水平和科技发展的进步,未来在食品安全检测领域发挥出更大的潜能。
[1] 鄢雷娜, 吴鑫, 段和祥, 等.高效液相色谱法同时测定抗疲劳功能食品中4种功效成分的研究[J].食品安全质量检测学报, 2020, 11(1):170-174. YAN L N, WU X, DUAN H X, et al.Determination of 4 functional compositions in antifatigue health foods by high performance liquid chromatography[J].Journal of Food Safety &Quality, 2020, 11(1):170-174.
[2] 石勤艳, 姚颖辉, 侯义德, 等.气相色谱法测定保康茶叶中有机氯农药残留[J].食品安全质量检测学报, 2020, 11(1):158-164. SHI Q Y, YAO Y H, HOU Y D, et al.Determination of organochlorine pesticide residues in Baokang tea samples by gas chromatography[J].Journal of Food Safety &Quality, 2020, 11(1):158-164.
[3] 李泽冉, 荣维广, 陈蓓, 等.气相色谱-质谱法同时测定鲜猪肉中氟乙酰胺和毒鼠强[J].江苏预防医学, 2021, 32(6):679-681. LI Z R, RONG W G, CHEN B, et al.Simultaneous determination of fluoracetamide and tetramine infresh pork by gas chromatography-mass spectrometry[J].Jiangsu Journal of Preventive Medicine, 2021, 32(6):679-681.
[4] TANG Y, HUANG X H, WANG X L, et al.G-quadruplex DNAzyme as peroxidase mimetic in a colorimetric biosensor for ultrasensitive and selective detection of trace tetracyclines in foods[J].Food Chemistry, 2022, 366:130560.
[5] LAUFBRERGER V.Sur la cristallisation de la ferritin[J].Bulletin de la Societe de Chimie, 1937, 19:1575-1582.
[6] NGUYEN T H A, NGUYEN V C, PHAN T N H, et al.Novel biogenic silver and gold nanoparticles for multifunctional applications:Green synthesis, catalytic and antibacterial activity, and colorimetric detection of Fe(III) ions[J].Chemosphere, 2022, 287:132271.
[7] MADANODAYA S, AGNIHOTRA SRIKANTH R, BRENT A, et al.An electrochemical molecularly imprinted polymer sensor for rapid and selective food allergen detection[J].Food Chemistry, 2020, 344:128648.
[8] HARRISON P M, AROSIO P.The ferritins:Molecular properties, iron storage function and cellular regulation[J].Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1996, 1275(3):161-203.
[9] AROSIO P, INGRASSIA R, CAVADINI P.Ferritins:A family of molecules for iron storage, antioxidation and more[J].Biochimica et Biophysica Acta (BBA) - General Subjects, 2009, 1790(7):589-599. [10] BRIAT J F, CELLIER F, GAYMARD F.Ferritins and Iron Accumulation in Plant Tissues[M].Iron Nutrition in Plants and Rhizospheric Microorganisms.Dordrecht:Springer Netherlands, 2006:341-357.
[11] AKANDA M R, JU H X.Ferritin-triggered redox cycling for highly sensitive electrochemical immunosensing of protein[J].Analytical Chemistry, 2018, 90(13):8028-8034.
[12] ZHEN Z P, TANG W, GUO C L, et al.Ferritin nanocages to encapsulate and deliver photosensitizers for efficient photodynamic therapy against cancer[J].ACS Nano, 2013, 7(8):6988-6996.
[13] LIN X, XIE J, NIU G, et al.Chimeric ferritin nanocages for multiple function loading and multimodal imaging[J].Nano Letters, 2011, 11(2):814-819.
[14] MING T H, HUAN H S, SU C, et al.Structural comparison of two ferritins from the marine invertebrate Phascolosoma esculenta[J].FEBS Open Bio, 2021, 11(3):793-803.
[15] YANG R, TIAN J, LIU Y Q, et al.Interaction mechanism of ferritin protein with chlorogenic acid and iron ion:The structure, iron redox, and polymerization evaluation[J].Food Chemistry, 2021, 349:129144.
[16] ZHAO G H.Phytoferritin and its implications for human health and nutrition[J].Biochimica et Biophysica Acta (BBA) - General Subjects, 2010, 1800(8):815-823.
[17] MAITY B, LI Z P, NIWASE K, et al.Single-molecule level dynamic observation of disassembly of the apo-ferritin cage in solution[J].Physical Chemistry Chemical Physics:PCCP, 2020, 22(33):18562-18572.
[18] UCHIDA M, KANG S, REICHHARDT C, et al.The ferritin superfamily:Supramolecular templates for materials synthesis[J].Biochimica et Biophysica Acta (BBA) - General Subjects, 2010, 1800(8):834-845.
[19] ZHANG Z J, ZAWOROTKO M J.Template-directed synthesis of metal-organic materials[J].Chemical Society Reviews, 2014, 43(16):5444-5455.
[20] SONG N N, ZHANG J L, ZHAI J, et al.Ferritin:A multifunctional nanoplatform for biological detection, imaging diagnosis, and drug delivery[J].Accounts of Chemical Research, 2021, 54(17):3313-3325.
[21] S NCHEZ P, VALERO E, G
NCHEZ P, VALERO E, G LVEZ N, et al.MRI relaxation properties of water-soluble apoferritin-encapsulated gadolinium oxide-hydroxide nanoparticles[J].Dalton Transactions, 2009(5):800-804.
LVEZ N, et al.MRI relaxation properties of water-soluble apoferritin-encapsulated gadolinium oxide-hydroxide nanoparticles[J].Dalton Transactions, 2009(5):800-804.
[22] JIANG B, YAN L A, ZHANG J L, et al.Biomineralization synthesis of the cobalt nanozyme in SP94-ferritin nanocages for prognostic diagnosis of hepatocellular carcinoma[J].ACS Applied Materials &Interfaces, 2019, 11(10):9747-9755.
[23] NAITO M, IWAHORI K, MIURA A, et al.Circularly polarized luminescent CdS quantum dots prepared in a protein nanocage[J].Angewandte Chemie, 2010, 49(39):7006-7009.
[24] XING R M, WANG X Y, YAN L L, et al.Fabrication of water soluble and biocompatible CdSe nanoparticles in apoferritin with the aid of EDTA[J].Dalton Transactions, 2009(10):1710-1713.
[25] LI M, VIRAVAIDYA C, MANN S.Polymer-mediated synthesis of ferritin-encapsulated inorganic nanoparticles[J].Small, 2007, 3(9):1477-1481.
[26] LIU G D, WANG J, WU H, et al.Versatile apoferritin nanoparticle labels for assay of protein[J].Analytical Chemistry, 2006, 78(21):7417-7423.
[27] LIU G D, WU H, DOHNALKOVA A, et al.Apoferritin-templated synthesis of encoded metallic phosphate nanoparticle tags[J].Analytical Chemistry, 2007, 79(15):5614-5619.
[28] ZHANG J L, CHENG D F, HE J Y, et al.Cargo loading within ferritin nanocages in preparation for tumor-targeted delivery[J].Nature Protocols, 2021, 16(10):4878-4896.
[29] KLEM M T, MOSOLF J, YOUNG M, et al.Photochemical mineralization of europium, titanium, and iron oxyhydroxide nanoparticles in the ferritin protein cage[J].Inorganic Chemistry, 2008, 47(7):2237-2239.
[30] CHEN H, MA L, ZHANG Y. Ferritin-catalyzed synthesis of ferrihydrite nanoparticles with high mimetic peroxidase activity for biomolecule detection[J]. RSC advances, 2021, 11(42): 26211-26217.
[31] TANG Z, WU H, ZHANG Y, et al. Enzyme-mimic activity of ferric nano-core residing in ferritin and its biosensing applications[J]. Analytical Chemistry, 2011, 83(22): 8611-8616.
[32] JIANG X, SUN C J, GUO Y, et al.Peroxidase-like activity of apoferritin paired gold clusters for glucose detection[J].Biosensors and Bioelectronics, 2015, 64:165-170.
[33] KISHIDA Y, OLSEN B R, BERG R A, et al.Two improved methods for preparing ferritin-protein conjugates for electron microscopy[J].The Journal of Cell Biology, 1975, 64(2):331-339.
[34] KRAMER R M, LI C, CARTER D C, et al.Engineered protein cages for nanomaterial synthesis[J].Journal of the American Chemical Society, 2004, 126(41):13282-13286.
[35] LIU M M, ZHU Y, JIN D, et al.Hemin-caged ferritin acting as a peroxidase-like nanozyme for the selective detection of tumor cells[J].Inorganic Chemistry, 2021, 60(19):14515-14519.
[36] 刘博, 张晨曦, 臧佳辰, 等.铁蛋白纳米载体在营养与健康领域的应用研究进展[J].食品科学, 2022, 43(15):302-311. LIU B, ZHANG C X, ZANG J C, et al.Review of ferritin nanocarrier applications in the field of nutrition and health[J].Food Science, 2022, 43(15):302-311.
[37] JUTZ G, BÖKER A.Bionanoparticles as functional macromolecular building blocks: A new class of nanomaterials[J].Polymer, 2011, 52(2):211-232.
[38] TERASHIMA M, UCHIDA M, KOSUGE H, et al.Human ferritin cages for imaging vascular macrophages[J].Biomaterials, 2011, 32(5):1430-1437.
[39] ZHAO J, LIU M L, ZHANG Y Y, et al.Apoferritin protein nanoparticles dually labeled with aptamer and horseradish peroxidase as a sensing probe for thrombin detection[J].Analytica Chimica Acta, 2013, 759:53-60.
[40] FERN NDEZ B, G
NDEZ B, G LVEZ N, S
LVEZ N, S NCHEZ P, et al.Fluorescence resonance energy transfer in ferritin labeled with multiple fluorescent dyes[J].JBIC Journal of Biological Inorganic Chemistry, 2008, 13(3):349-355.
NCHEZ P, et al.Fluorescence resonance energy transfer in ferritin labeled with multiple fluorescent dyes[J].JBIC Journal of Biological Inorganic Chemistry, 2008, 13(3):349-355.
[41] KANG H J, KANG Y J, LEE Y M, et al.Developing an antibody-binding protein cage as a molecular recognition drug modular nanoplatform[J].Biomaterials, 2012, 33(21):5423-5430.
[42] KIM S E, AHN K Y, PARK J S, et al.Fluorescent ferritin nanoparticles and application to the aptamer sensor[J].Analytical Chemistry, 2011, 83(15):5834-5843.
[43] 杨婷婷, 严艺琳, 石文婷, 等.粮食中重金属污染的快速检测研究进展[J].粮食与食品工业, 2019, 26(2):56-60. YANG T T, YAN Y L, SHI W T, et al.Research progress on rapid detection of heavy metals in grain[J].Cereal &Food Industry, 2019, 26(2):56-60.
[44] MIZANUR RAHMAN G M, WOLLE M M, FAHRENHOLZ T, et al.Measurement of mercury species in whole blood using speciated isotope dilution methodology integrated with microwave-enhanced solubilization and spike equilibration, headspace-solid-phase microextraction, and GC-ICP-MS analysis[J].Analytical Chemistry, 2014, 86(12):6130-6137.
[45] RUIZ-DE-CENZANO M, ROCHINA-MARCO A, CERVERA M L, et al.Speciation of methylmercury in market seafood by thermal degradation, amalgamation and atomic absorption spectroscopy[J].Ecotoxicology and Environmental Safety, 2014, 107:90-96.
[46] ARANDA P R, GIL R A, MOYANO S, et al.Slurry sampling in serum blood for mercury determination by CV-AFS[J].Journal of Hazardous Materials, 2009, 161(2-3):1399-1403.
[47] 张涛, 苏倡, 刘艳, 等.泥蚶(Tegillarca granosa)重组铁蛋白富集重金属离子的特性及化学传感器的研究[J].海洋与湖沼, 2017, 48(4):870-876. ZHANG T, SU C, LIU Y, et al.Research of characteristics of enrichment of heavy metals by recombinant ferritin from Tegillarca granosa[J].Oceanologia et Limnologia Sinica, 2017, 48(4):870-876.
[48] 沈洋, 胡继文, 刘婷婷, 等.纳米光学传感器用于检测汞离子[J].化学进展, 2019, 31(4):536-549. SHEN Y, HU J W, LIU T T, et al.Colorimetric and fluorogenic chemosensors for mercury ion based on nanomaterials[J].Progress in Chemistry, 2019, 31(4):536-549.
[49] WANG Y J, CHEN H, ZANG J C, et al.Re-designing ferritin nanocages for mercuric ion detection[J].The Analyst, 2019, 144(19):5890-5897.
[50] 白艺珍, 李培武, 丁小霞, 等.我国粮油作物产品真菌毒素风险评估现状与对策探讨[J].农产品质量与安全, 2015(5):54-58. BAI Y Z, LI P W, DING X X, et al.Present situation and countermeasures of mycotoxin risk assessment of grain and oil crops in China[J].Quality and Safety of Agro-Products, 2015(5):54-58.
[51] 周晓文. 细交链孢菌酮酸单克隆抗体的制备及其icELISA方法的建立[D].广州:华南农业大学, 2017. ZHOU X W.Development of monoclonal antibody against tenuazonic acid[D].Guangzhou:South China Agricultural University, 2017.
[52] 吴希, 邢家溧, 郑睿行, 等.超高效液相色谱-串联质谱法快速检测麦类中典型链格孢霉毒素[J].食品科学, 2022, 43(12):317-324. WU X, XING J L, ZHENG R X, et al.Rapid determination of typical Alternaria toxins in wheat by ultra-high performance liquid chromatography tandem mass spectrometry[J].Food Science, 2022, 43(12):317-324.
[53] WANG F, LI Z F, WAN D B, et al.Enhanced non-toxic immunodetection of Alternaria mycotoxin tenuazonic acid based on ferritin-displayed anti-idiotypic nanobody-nanoluciferase multimers[J].Journal of Agricultural and Food Chemistry, 2021, 69(16):4911-4917.
[54] CHAVAN S G, YAGATI A K, MOHAMMADNIAEI M, et al.Robust bioengineered apoferritin nanoprobes for ultrasensitive detection of infectious pancreatic necrosis virus[J].Analytical Chemistry, 2019, 91(9):5841-5849.
[55] 赵国有, 林滢, 于维森.高致病性禽流感病毒H5N1核酸检测的风险评估[J].中国卫生检验杂志, 2021, 31(19):2431-2433. ZHAO G Y, LIN Y, YU W S.Risk assessment of H5N1 nucleic acid detection of highly pathogenic avian influenza virus[J].Chinese Journal of Health Laboratory Technology, 2021, 31(19):2431-2433.
[56] FAN K L, JIANG B, GUAN Z, et al.Fenobody:A ferritin-displayed nanobody with high apparent affinity and half-life extension[J].Analytical Chemistry, 2018, 90(9):5671-5677.
[57] RAFIPOUR R, KASHANIAN S, ABASI TARIGHAT F.Sensitive electrochemical biosensing of H2O2 based on cobalt nanoparticles synthesised in iron storage protein molecules, ferritin[J].IET Nanobiotechnology, 2014, 8(4):196-200.
[58] TAMLEH Z, RAFIPOUR R, KASHANIAN S.Protein-based nanobiosensor for electrochemical determination of hydrogen peroxide[J].Russian Journal of Electrochemistry, 2019, 55(10):962-969.
[59] WANG L, WANG J K, NI P J, et al.Ferritin-mediated biomimetic synthesis of bimetallic Au-Ag nanoparticles on graphene nanosheets for electrochemical detection of hydrogen peroxide[J].Functional Materials Letters, 2015, 8(4):1550044.