饮食不健康、体力活动不足、空气污染等因素严重威胁着人类的健康。其中,《全球疾病负担研究2017》报道全球有1 100万人因不健康饮食而死亡,过多摄入含糖饮料是重要的饮食危险因素[1]。在许多慢性疾病的预防与治疗中,控制糖的摄入也尤为重要。《中国2型糖尿病防治指南》中提出,对于糖尿病患者而言,适量摄入糖醇和非营养性甜味剂(non-nutritive sweeteners, NNSs)是较为安全的日常糖摄入模式[2]。同时,《国民营养计划(2017—2030年)》、《食品甜味剂科学共识》等政策也指出了适量食用甜味剂代替蔗糖、果葡糖浆等添加糖,以实现国民健康生活方式中的“减糖”行动[3-4]。因此,近年来糖醇和NNSs作为糖替代品受到学者们的关注。针对NNSs,有研究显示其会影响体重、糖耐量、食欲和味觉敏感性,导致代谢功能障碍,甚至增加癌症风险[5-6],NNSs似乎不是最佳的糖替代品。
糖醇是含有2个以上羟基的多元醇,在食品工业中常被用作甜味剂、冷却剂、保湿剂和增稠剂[7]。其中,赤藓糖醇是一种C4多元醇,已由美国食品药品管理局批准用作甜味剂[8]。以往研究显示赤藓糖醇不仅可以改善过量摄入糖分所导致的肥胖及其引发的一系列代谢性疾病,还可以作为疾病预测的生物标志物[9]。因此,为清楚地了解赤藓糖醇的生物学效应,本文从其基本特征、代谢途径、毒副作用、生物学功能及疾病预测方面入手,全面梳理并归纳了现有研究结果,以指导其在大众健康人群及肥胖和代谢功能障碍人群中的应用。
1 赤藓糖醇概述
1.1 结构与性质
赤藓糖醇为白色结晶的C4多元醇类化合物,化学名称为1,2,3,4-丁四醇,分子式为C4H10O4(图1),具有热量低、甜味纯正、口感清爽等独特优点。与蔗糖相比,赤藓糖醇的热量仅有0.4 kcal/g,但甜度则达蔗糖的60~80%[10]。其较高的溶解热带来的降温效果也赋予其独特的清爽口感[11]。与人工甜味剂相比,赤藓糖醇没有后苦感,风味更佳[12]。同时,在酸性和碱性pH下也很稳定,不会发生影响食品色泽的美拉德反应[13]。因此,赤藓糖醇作为一种能量低、口感佳的天然甜味剂广受大众欢迎。

图1 赤藓糖醇的分子式
Fig.1 Molecular formula for erythritol
1.2 来源与合成
人体内的赤藓糖醇一方面来自外源性食物摄入,另一方面也可由内源性葡萄糖代谢途径产生。赤藓糖醇天然存在于水果(如葡萄和西瓜)、真菌(如海藻和蘑菇)以及发酵食品(如清酒和酱油)等食物中[12]。目前,赤藓糖醇的生产方法主要有3种,即生物提取法、化学合成法和微生物发酵法。相较而言,微生物发酵法因其生产条件温和、产品质量稳定、食品安全性高而成为最理想的赤藓糖醇生产方法,并主要通过酵母菌或酵母样真菌生物转化富含葡萄糖底物的生物工艺技术实现[13-14]。
作为一种内源性葡萄糖代谢物,赤藓糖醇的表达具有一定的时空特征。首先,赤藓糖醇主要在肝脏和肾脏处产生[15],存在于动物体液中,如人体眼球、血清、尿液、胎液等[11,14]。人体稳定同位素示踪试验揭示了赤藓糖醇是由葡萄糖通过磷酸戊糖途径(pentose phosphate pathway, PPP)产生的中间代谢物-赤藓糖-4-磷酸(erythrose-4-phosphate, E4P)还原而成(图2),具体途径为:E4P生成赤藓糖,赤藓糖通过乙醇脱氢酶1和山梨醇脱氢酶生成赤藓糖醇,烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)为赤藓糖醇还原提供辅助因子,其中,催化E4P生成赤藓糖的酶还未确定[16]。在全生命周期过程中,胎儿时期的PPP非常活跃[17]。研究发现包括赤藓糖醇在内的大多数多元醇在羊水和体腔液内的浓度显著高于母体血清,而出生后赤藓糖醇的浓度则开始下降,并在第一年达到相对较低的稳定状态[18-20]。这提示PPP相关的赤藓糖醇可能在胎儿发育过程中具有重要的代谢功能。
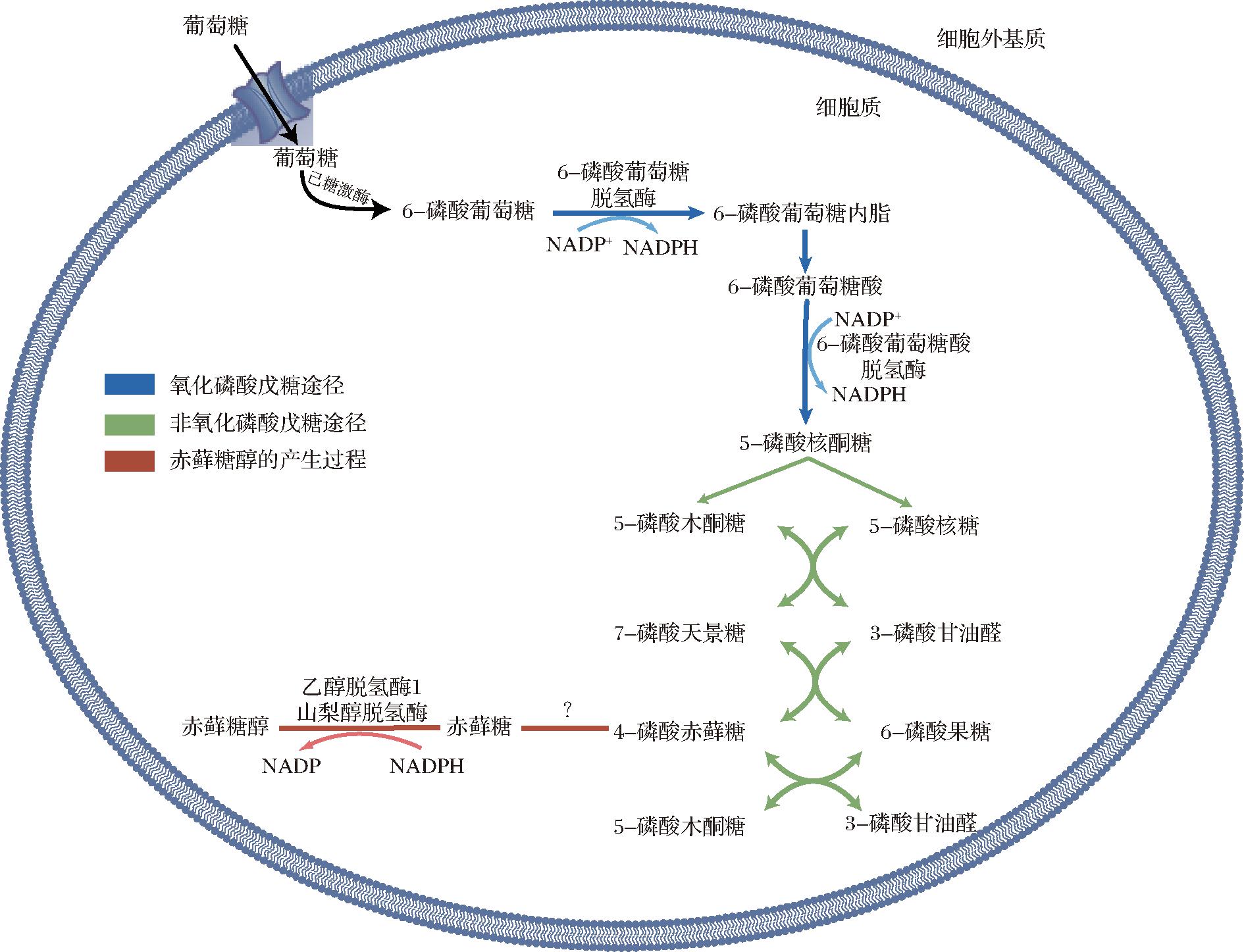
图2 赤藓糖醇的内源性产生过程[15]
Fig.2 Endogenous production of erythritol[15]
1.3 吸收与代谢
赤藓糖醇是一种4碳化合物,分子质量小、亲水性强[21]。当人体摄入赤藓糖醇后,约80%~90%通过被动扩散被小肠吸收,剩余的10%则进入大肠作为碳源发酵(图3)。并且随着赤藓糖醇摄入剂量的增加,进入到大肠的赤藓糖醇比率也会增加[22]。其中,经小肠被人体吸收的赤藓糖醇在组织中广泛分布,约5%~10%的赤藓糖醇在血液中被氧化成赤藓糖,随后迅速地被进一步氧化生成赤藓糖酯,最后从尿液中排出[9, 15, 23-25]。其余未被氧化的赤藓糖醇因不能被机体内的酶系统所分解,只能透过肾脏从血液中滤过,经尿液排出体外[23-24,26]。而进入大肠的赤藓糖醇则会经过肠道菌群的发酵转化为短链脂肪酸(short-chain fatty acids, SCFAs)[22, 27],SCFAs被吸收入肠道后可以通过其抗炎效应改善饮食诱导代谢紊乱,对肥胖和炎症性肠道疾病具有保护作用[22, 28-29]。
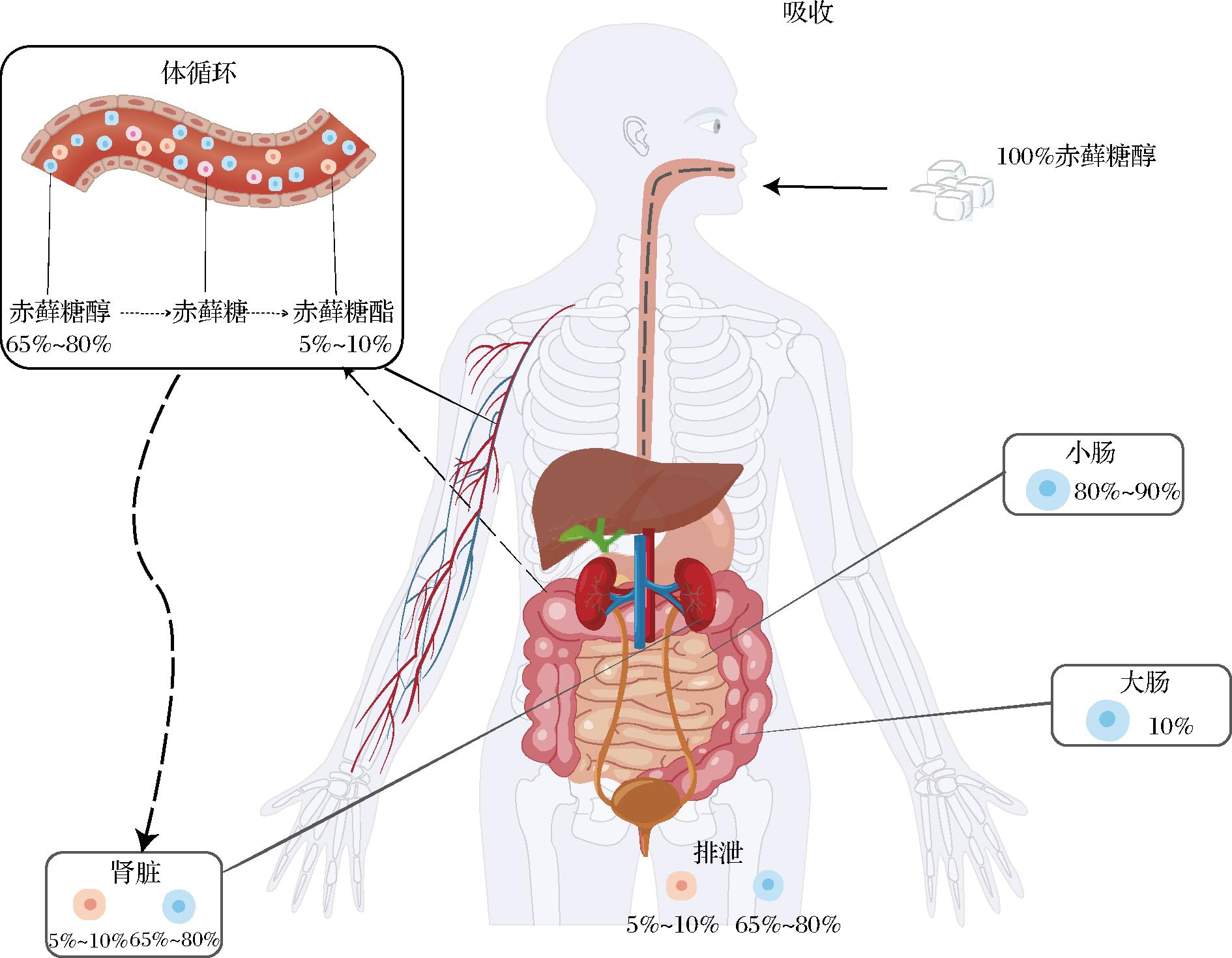
图3 赤藓糖醇的吸收与代谢过程
Fig.3 Absorption and metabolism of erythritol
1.4 推荐剂量与毒副作用
许多研究证明0.6~0.8 g/kg是赤藓糖醇的安全剂量范围[30-33],建议单次服用剂量不宜超过35 g,否则会出现恶心、腹鸣等不良反应[30, 32-35]。若要补充大剂量的赤藓糖醇,逐步增加剂量的长期适应性摄入模式可减少胃肠道不耐受的症状[36]。在补充赤藓糖醇时,还应注意尽量避免与等浓度的果糖同时摄入,否则会导致肠道对于碳水化合物的吸收不良[37]。此外,在以人、鼠和犬为研究对象的口服毒性实验中,赤藓糖醇的推荐摄入量不会造成任何器官的功能受损或组织病理学变化,对血液学和临床化学参数也没有任何与治疗相关的不良影响,因此推荐剂量范围内的赤藓糖醇无致畸毒性[38-43]。此外,赤藓糖醇也不会诱导或促进肿瘤恶化[39]。但是,目前研究报道有5例因口服含赤藓糖醇的食物、饮料后出现过敏反应的事件,而这可能是由免疫球蛋白E和血浆中的某些物质(如血清白蛋白)所介导的嗜碱粒细胞活化而引起[44-48]。口服免疫治疗可作为赤藓糖醇过敏治疗的一种选择[49]。有研究发现赤藓糖醇可能会加重由于内皮祖细胞损害和缺血脑中血管生成减少所导致的脑缺血损伤[50]。因此赤藓糖醇的摄入剂量、频率及模式还需要进一步深入的研究,以确定赤藓糖醇对于机体各系统的安全剂量范围。
2 外源性赤藓糖醇补充的生物学功能
2.1 赤藓糖醇与糖脂代谢
糖脂代谢是细胞及机体能量与物质来源的重要生命过程,糖脂代谢失衡会引起多种疾病,影响人类健康[51]。目前已在不同模型中开展广泛研究,探讨赤藓糖醇对糖脂代谢的影响及可能机制。
在健康人群中,不论是单次还是多次摄入赤藓糖醇,血糖血脂和糖耐量都不会受到影响。具体有单次口服推荐剂量的赤藓糖醇(0.3~0.8 g/kg)不会影响人体血糖、血脂、胰岛素和胰高血糖素水平[10,32-33]。即使较高剂量的赤藓糖醇(1 g/kg)也没有引起血浆胰岛素和血糖水平的上升[25,35]。在动物实验中开展的长期研究也发现,连续8周、每天摄入含40 g/kg赤藓糖醇的低脂饮食或高脂饮食对小鼠的葡萄糖耐量、身体成分没有影响[52]。但是在与糖尿病相关的研究中却发现赤藓糖醇不仅能够维持2型糖尿病(type 2 diabetes mellitus, T2DM)患者、糖耐量异常患者的血糖、血脂稳态,还具有降血糖的潜力。糖尿病患者单次服用20 g赤藓糖醇后血糖和胰岛素水平没有显著变化,但是随着摄入次数的增加,空腹血糖和糖化血红蛋白(hemoglobin A1c, HbA1C)下降[53]。在动物实验中,YOKOZAWA等[54]连续10 d、每天给予糖尿病大鼠100、200或400 mg/kg的赤藓糖醇,其血清、肝脏和肾脏的葡萄糖水平下降,且具有剂量效应。然而有一项研究显示摄入赤藓糖醇会导致游离脂肪酸和3-羟基丁酸水平增加,但是在进食后上述指标出现下降,这个现象可能是因为赤藓糖醇几乎不为机体提供能量,测试中的受试者处于饥饿状态所致[53]。
针对赤藓糖醇上述的降糖效应,研究人员进一步利用动物和细胞实验开展了大量机制研究。研究人员在对T2DM大鼠注射葡萄糖加赤藓糖醇和苯酚红或只注射葡萄糖和苯酚红后,测定其血清和胃肠道组织中葡萄糖和酚红的含量,结果显示赤藓糖醇显著减少了正常和T2DM动物小肠前1/4段对葡萄糖的吸收[55]。然而,BORDIER等[56]的研究表明长期摄入赤藓糖醇不会影响肥胖人群的肠道葡萄糖吸收。结论的不一致可能与摄入频率、实验对象的不同有关。在细胞实验中,CHUKWUMA等[55]证明赤藓糖醇能使离体肌细胞的葡萄糖摄取呈剂量依赖性地增加,并且这种效应不依赖于胰岛素。值得注意的是,该团队还在一项体内研究中发现赤藓糖醇可显著改善糖尿病动物的糖耐量,明显增加由于糖尿病引起的血清胰岛素耗竭,尤其是在摄入葡萄糖后30和60 min,但对正常动物的血清胰岛素水平没有显著影响。此外,赤藓糖醇还可增加糖尿病引起的肌肉己糖激酶和肝葡萄糖激酶活力的降低,降低糖尿病引起的肝葡萄糖-6-磷酸酶活力的升高,上调糖尿病大鼠肌肉葡萄糖转运体4(glucose transporter type 4, GLUT-4)和胰岛素受体底物1(insulin receptor substrate 1, IRS-1)表达[55]。与此同时,WEN等[57]发现赤藓糖醇的降糖机制也可能是通过竞争性抑制α-葡萄糖苷酶,进而阻止多糖水解来实现。
综上所述,赤藓糖醇具有降糖的生物学效应,其机制可能与机体葡萄糖吸收减少、肌细胞葡萄糖摄取增加和胰岛素信号通路上调有关。
2.2 赤藓糖醇与氧化应激
氧化应激是细胞与组织中氧化和抗氧化系统之间不平衡的结果,主要原因为机体内活性氧(reactive oxygen species, ROS)的生成增加和(或)清除能力降低[58],许多疾病的发生与机体抗氧化系统紊乱密切相关。研究显示赤藓糖醇是一种具有抗氧化特性的物质。YOKOZAWA等[54]采用糖尿病动物模型来检测赤藓糖醇的抗氧化作用,结果显示连续10 d补充100、200或400 mg/kg的赤藓糖醇在显著降低血糖水平的同时,呈剂量依赖性地降低了血清、肝脏和肾脏中的肌酐、硫代巴比妥酸活性物质和5-羟甲基呋喃甲醛的水平。这表明赤藓糖醇可以影响葡萄糖代谢,减少脂质过氧化,改善机体氧化应激[54]。在细胞实验中,DEN HARTOG等[59]以红细胞为模型的研究显示赤藓糖醇与羟自由基反应转化为赤藓糖和赤藓酮糖,在喂食赤藓糖醇的糖尿病大鼠尿液中检测出了赤藓糖,提示羟自由基已经被赤藓糖醇清除。
赤藓糖醇不仅是一种极好的自由基清除剂和抑制剂,还具有内皮保护功能。赤藓糖醇可以抑制2,20-偶氮-2-氨基丙烷二盐酸盐引起的溶血,对减轻高血糖症引起的血管损伤起到积极作用[59]。BOESTEN等[60]通过对内皮细胞的研究发现赤藓糖醇在高血糖条件下有很强的血管保护作用,这很可能是由于它的抗氧化特性。此外,赤藓糖醇的内皮保护作用也进一步在人体试验中得到验证[61]。然而,ALAMRI等[62]在细胞实验中研究了赤藓糖醇对THP-1巨噬细胞的生理作用,发现在赤藓糖醇干预后促炎症的M1型巨噬细胞丰度增加,而抗炎的M2型巨噬细胞丰度减少。同时,赤藓糖醇增加ROS生成,激活Akt通路,使细胞内钙超载和细胞周期停滞在G1期,导致了氧化平衡、钙稳态和细胞周期进程的失调,从而造成坏死性巨噬细胞的数量增加。
综上所述,赤藓糖醇是一种具有抗氧化活性的生物分子,对生物膜氧化损伤具有保护作用,同时还可以保护血管,显著改善小血管内皮功能,降低中央主动脉僵硬。但是赤藓糖醇诱导了THP-1来源的巨噬细胞致炎表型的极化,干扰巨噬细胞氧化还原动态平衡和增殖能力。因此,未来还需要对不同细胞类型开展全面的体内(外)研究,以确定赤藓糖醇对机体氧化应激的影响。
2.3 赤藓糖醇与胃肠激素
胃肠激素是一类由存在于胃肠道黏膜层及胰腺内的内分泌细胞和旁分泌细胞分泌、由胃肠壁的神经末梢所释放的一组小分子高效能生物活性物质[63]。除了对消化系统的生理功能起着重要的调节作用外,胃肠激素对肿瘤、免疫与炎症以及某些神经系统疾病的发生也起着重要的调节作用[64]。
大量研究证实摄入赤藓糖醇可以促进胃肠激素中胆囊收缩素(cholecystokinin, CCK)、酪酪肽(peptide tyrosine tyrosine, PYY)、胰高血糖素样肽1(glucagon-like peptide-1, GLP-1)的分泌,延缓胃排空。在人体实验中,WÖLNERHANSSEN等[35]研究了单次口服75 g赤藓糖醇对健康的受试者胃肠道影响,结果表明赤藓糖醇可显著增加CCK和GLP-1的释放,延缓胃排空。低剂量的赤藓糖醇(10、25或50 g)同样可以诱导GLP-1、PPY和CCK的释放,并延缓胃排空[32]。研究显示赤藓糖醇导致的胃排空延缓可能是由胰岛素刺激,特别是CCK介导的[35]。此外,与蔗糖相比,赤藓糖醇对胃肠激素分泌以及能量摄入和能量偏好的影响无显著差异[65]。这提示赤藓糖醇可以作为蔗糖的有效替代剂。谈及其激素分泌的机制,最近研究证明赤藓糖醇刺激人体CCK、GLP-1和PYY胃肠激素释放的机制与糖类和NNSs不同,并不是通过肠道中的1型味觉受体2和1型味觉受体3介导[66-67]。因此,赤藓糖醇刺激胃肠激素释放的具体作用机制还有待进一步研究。
2.4 赤藓糖醇与其他生物学功能
目前也有部分研究探讨了赤藓糖醇与骨代谢、食欲和心血管系统的关系。在骨骼系统中,饮食中的赤藓糖醇不会对骨吸收产生影响[68]。摄入赤藓糖醇可剂量依赖性地增加空肠、回肠、盲肠和结肠的钙转运,提高钙吸收[69]。此外,摄入赤藓糖醇还可以加强大脑内食欲调节稳态和奖赏相关区域网络中功能连接,不改变下丘脑正常活动,增加了满足感,对食欲也不会造成负面的影响[70]。还有研究显示,包括赤藓糖醇在内的营养甜味剂对餐后血压的影响很小,甚至没有影响。因此,将葡萄糖、果糖和蔗糖等添加糖替换为赤藓糖醇,可能是一种简单而有效的餐后低血压治疗策略[71]。有关赤藓糖醇在人体中生物学功能的文献资料详见表1,在动物中生物学功能的文献资料详见表2。
表1 赤藓糖醇在人体中的生物学功能
Table 1 Biological functions of erythritol in humans
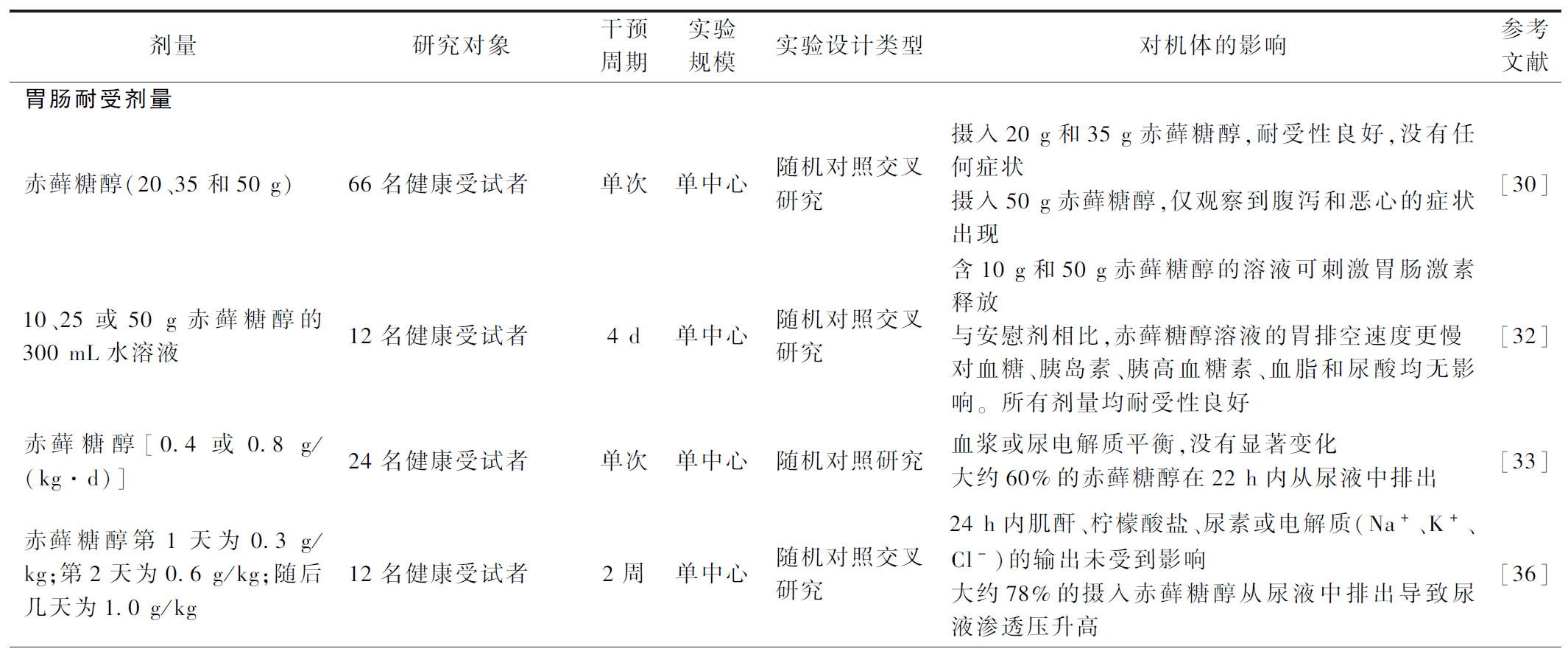
剂量研究对象干预周期实验规模实验设计类型对机体的影响参考文献胃肠耐受剂量赤藓糖醇(20、35和50 g)66名健康受试者单次单中心随机对照交叉研究摄入20 g和35 g赤藓糖醇,耐受性良好,没有任何症状摄入50 g赤藓糖醇,仅观察到腹泻和恶心的症状出现[30]10、25或50 g赤藓糖醇的300 mL水溶液12名健康受试者4 d单中心随机对照交叉研究含10 g和50 g赤藓糖醇的溶液可刺激胃肠激素释放与安慰剂相比,赤藓糖醇溶液的胃排空速度更慢对血糖、胰岛素、胰高血糖素、血脂和尿酸均无影响。所有剂量均耐受性良好 [32]赤藓糖醇[0.4或0.8 g/(kg·d)]24名健康受试者单次单中心随机对照研究血浆或尿电解质平衡,没有显著变化大约60%的赤藓糖醇在22 h内从尿液中排出[33]赤藓糖醇第1天为0.3 g/kg;第2天为0.6 g/kg;随后几天为1.0 g/kg12名健康受试者2周单中心随机对照交叉研究24 h内肌酐、柠檬酸盐、尿素或电解质(Na+、K+、Cl-)的输出未受到影响大约78%的摄入赤藓糖醇从尿液中排出导致尿液渗透压升高 [36]
续表1
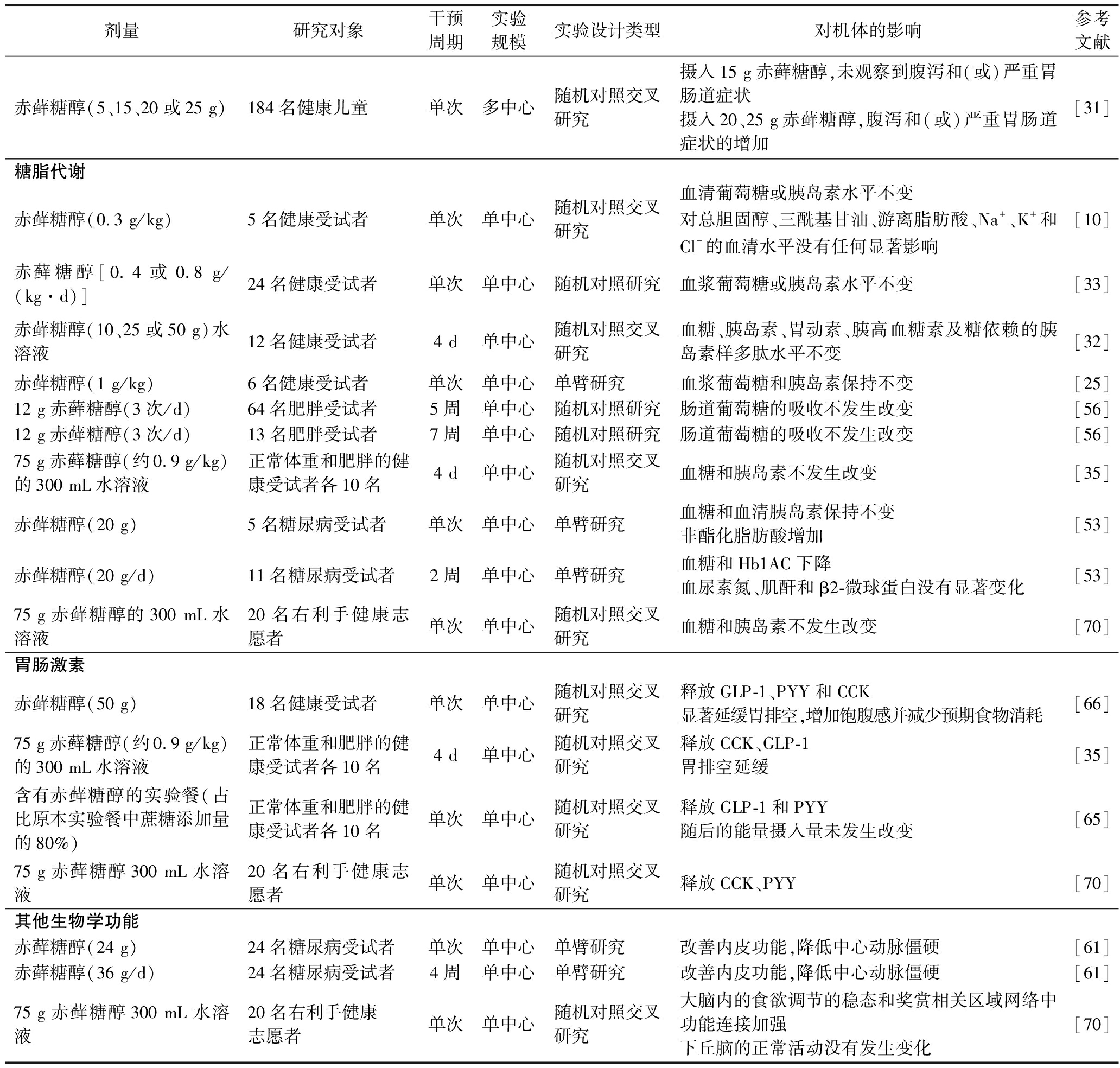
剂量研究对象干预周期实验规模实验设计类型对机体的影响参考文献赤藓糖醇(5、15、20或25 g)184名健康儿童单次多中心随机对照交叉研究摄入15 g赤藓糖醇,未观察到腹泻和(或)严重胃肠道症状摄入20、25 g赤藓糖醇,腹泻和(或)严重胃肠道症状的增加[31]糖脂代谢赤藓糖醇(0.3 g/kg)5名健康受试者单次单中心随机对照交叉研究血清葡萄糖或胰岛素水平不变对总胆固醇、三酰基甘油、游离脂肪酸、Na+、K+和Cl-的血清水平没有任何显著影响[10]赤藓糖醇[0.4或0.8 g/(kg·d)]24名健康受试者单次单中心随机对照研究血浆葡萄糖或胰岛素水平不变[33]赤藓糖醇(10、25或50 g)水溶液12名健康受试者4 d单中心随机对照交叉研究血糖、胰岛素、胃动素、胰高血糖素及糖依赖的胰岛素样多肽水平不变[32]赤藓糖醇(1 g/kg)6名健康受试者单次单中心单臂研究血浆葡萄糖和胰岛素保持不变[25]12 g赤藓糖醇(3次/d)64名肥胖受试者5周单中心随机对照研究肠道葡萄糖的吸收不发生改变[56]12 g赤藓糖醇(3次/d)13名肥胖受试者7周单中心随机对照研究肠道葡萄糖的吸收不发生改变[56]75 g赤藓糖醇(约0.9 g/kg)的300 mL水溶液正常体重和肥胖的健康受试者各10名4 d单中心随机对照交叉研究血糖和胰岛素不发生改变[35]赤藓糖醇(20 g)5名糖尿病受试者单次单中心单臂研究血糖和血清胰岛素保持不变非酯化脂肪酸增加[53]赤藓糖醇(20 g/d)11名糖尿病受试者2周单中心单臂研究血糖和Hb1AC下降血尿素氮、肌酐和β2-微球蛋白没有显著变化[53]75 g赤藓糖醇的300 mL水溶液20名右利手健康志愿者单次单中心随机对照交叉研究血糖和胰岛素不发生改变[70]胃肠激素赤藓糖醇(50 g)18名健康受试者单次单中心随机对照交叉研究释放GLP-1、PYY和CCK显著延缓胃排空,增加饱腹感并减少预期食物消耗[66]75 g赤藓糖醇(约0.9 g/kg)的300 mL水溶液正常体重和肥胖的健康受试者各10名4 d单中心随机对照交叉研究释放CCK、GLP-1胃排空延缓[35]含有赤藓糖醇的实验餐(占比原本实验餐中蔗糖添加量的80%) 正常体重和肥胖的健康受试者各10名单次单中心随机对照交叉研究释放GLP-1和PYY随后的能量摄入量未发生改变[65]75 g赤藓糖醇300 mL水溶液20名右利手健康志愿者单次单中心随机对照交叉研究释放CCK、PYY[70]其他生物学功能赤藓糖醇(24 g)24名糖尿病受试者单次单中心单臂研究改善内皮功能,降低中心动脉僵硬[61]赤藓糖醇(36 g/d)24名糖尿病受试者4周单中心单臂研究改善内皮功能,降低中心动脉僵硬[61]75 g赤藓糖醇300 mL水溶液20名右利手健康志愿者单次单中心随机对照交叉研究大脑内的食欲调节的稳态和奖赏相关区域网络中功能连接加强下丘脑的正常活动没有发生变化[70]
表2 赤藓糖醇在动物中的生物学功能
Table 2 Biological functions of erythritol in animals

剂量研究对象干预周期实验设计类型对机体的影响参考文献毒副作用0%、5%和10%的赤藓糖醇饮食60只健康大鼠4周随机对照研究两性10%剂量对血液学和临床化学参数无任何与治疗相关的影响两性10%剂量组盲肠壁或胃肠道其他部分无组织病理学变化男性5%和10%剂量组无肾功能受损或组织病理学肾脏变化女性10%剂量组无脾脏的组织病理学变化[38]0%、2%、5%和10%的赤藓糖醇饮食700只健康大鼠104~107周随机对照研究以约5 g/(kg·d)的量不会导致特定肿瘤的诱导或影响肿瘤的发病率、多样性和发病时间除了雌性大鼠的盆腔肾钙质沉着症发病率增加代表(一种多元醇通用的相关作用)外,赤藓糖醇治疗不会导致任何组织发生任何前或非肿瘤性变化未检测到对肾脏形态和功能完整性的特定不良影响[39]
续表2
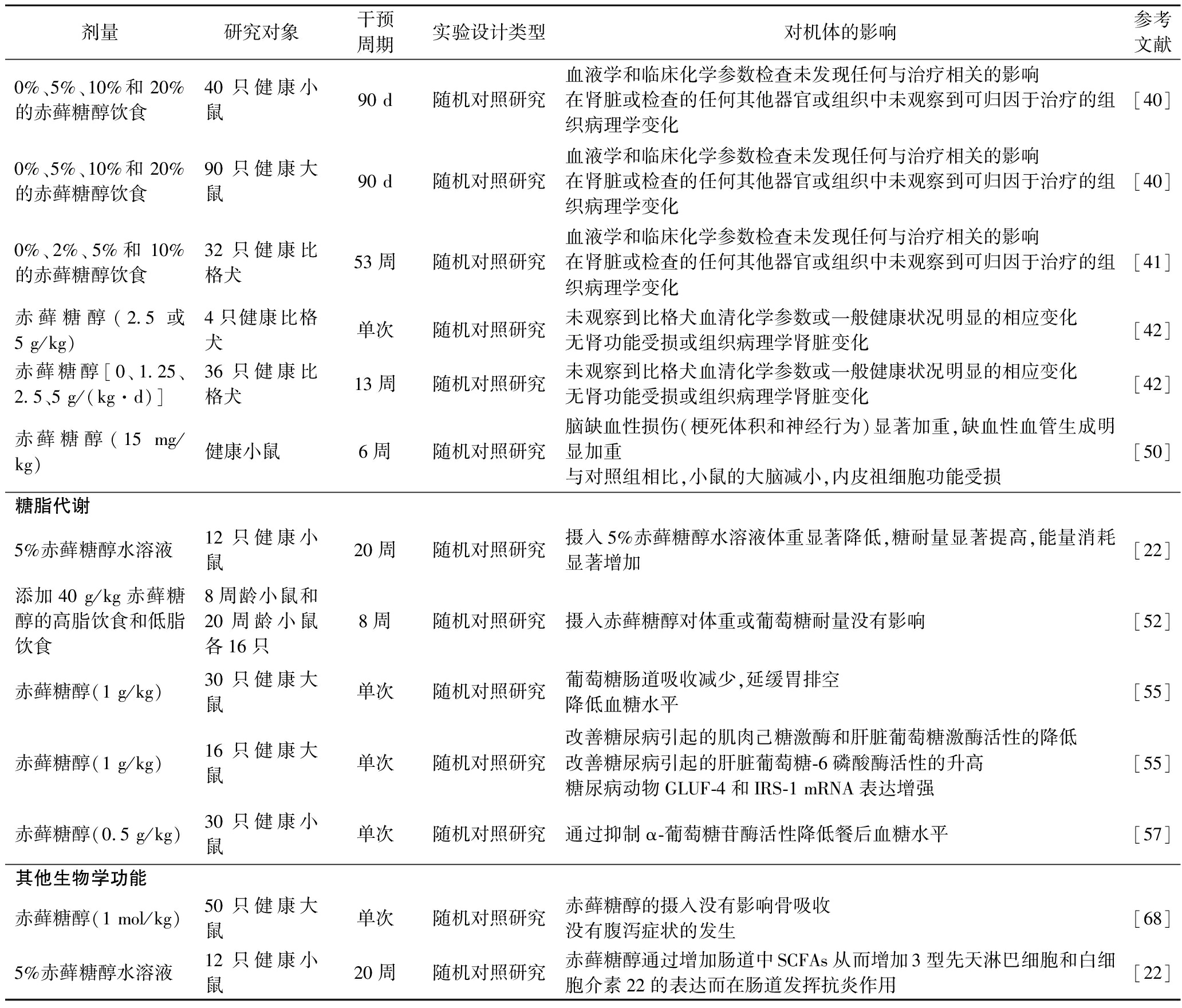
剂量研究对象干预周期实验设计类型对机体的影响参考文献0%、5%、10%和20%的赤藓糖醇饮食40只健康小鼠90 d随机对照研究血液学和临床化学参数检查未发现任何与治疗相关的影响在肾脏或检查的任何其他器官或组织中未观察到可归因于治疗的组织病理学变化[40]0%、5%、10%和20%的赤藓糖醇饮食90只健康大鼠90 d随机对照研究血液学和临床化学参数检查未发现任何与治疗相关的影响在肾脏或检查的任何其他器官或组织中未观察到可归因于治疗的组织病理学变化[40]0%、2%、5%和10%的赤藓糖醇饮食32只健康比格犬53周随机对照研究血液学和临床化学参数检查未发现任何与治疗相关的影响在肾脏或检查的任何其他器官或组织中未观察到可归因于治疗的组织病理学变化[41]赤藓糖醇(2.5或5 g/kg)4只健康比格犬单次随机对照研究未观察到比格犬血清化学参数或一般健康状况明显的相应变化无肾功能受损或组织病理学肾脏变化[42]赤藓糖醇[0、1.25、2.5、5 g/(kg·d)]36只健康比格犬13周随机对照研究未观察到比格犬血清化学参数或一般健康状况明显的相应变化无肾功能受损或组织病理学肾脏变化[42]赤藓糖醇(15 mg/kg)健康小鼠6周随机对照研究脑缺血性损伤(梗死体积和神经行为)显著加重,缺血性血管生成明显加重与对照组相比,小鼠的大脑减小,内皮祖细胞功能受损[50]糖脂代谢5%赤藓糖醇水溶液12只健康小鼠20周随机对照研究摄入5%赤藓糖醇水溶液体重显著降低,糖耐量显著提高,能量消耗显著增加[22]添加40 g/kg赤藓糖醇的高脂饮食和低脂饮食8周龄小鼠和20周龄小鼠各16只8周随机对照研究摄入赤藓糖醇对体重或葡萄糖耐量没有影响[52]赤藓糖醇(1 g/kg)30只健康大鼠单次随机对照研究葡萄糖肠道吸收减少,延缓胃排空降低血糖水平[55]赤藓糖醇(1 g/kg)16只健康大鼠单次随机对照研究改善糖尿病引起的肌肉己糖激酶和肝脏葡萄糖激酶活性的降低改善糖尿病引起的肝脏葡萄糖-6磷酸酶活性的升高糖尿病动物GLUF-4和IRS-1 mRNA表达增强[55]赤藓糖醇(0.5 g/kg)30只健康小鼠单次随机对照研究通过抑制α-葡萄糖苷酶活性降低餐后血糖水平[57]其他生物学功能赤藓糖醇(1 mol/kg)50只健康大鼠单次随机对照研究赤藓糖醇的摄入没有影响骨吸收没有腹泻症状的发生[68]5%赤藓糖醇水溶液12只健康小鼠20周随机对照研究赤藓糖醇通过增加肠道中SCFAs从而增加3型先天淋巴细胞和白细胞介素22的表达而在肠道发挥抗炎作用[22]
3 赤藓糖醇作为一种新型的疾病生物标志物
随着高通量代谢组学研究手段的普及,多项研究证实赤藓糖醇可以作为内源性生物标志物预测转醛醇酶(transaldolase, TALDO)缺陷病、代谢性疾病、心血管疾病和癌症的发生。
TALDO缺陷病是一种罕见的先天性PPP缺陷累及多系统的常染色体隐性遗传病[17]。临床表现为严重的、早期发病的多系统疾病,受累机体的体液尤其是尿液中多元醇浓度异常[72]。TALDO是非氧化PPP途径中第二个酶,与PPP和糖酵解途径紧密联系。研究推测TALDO缺乏导致的7-磷酸景天庚酮糖堆积会作为毒性产物降低体内糖磷酸化水平,从而导致细胞毒性反应,如赤藓糖醇水平升高[72]。在临床上,采集新生儿尿样,检测其中赤藓糖醇的浓度是预测TALDO缺陷病的标志之一。
在代谢性疾病领域,HOOTMAN等[15]首次证实血清赤藓糖醇升高先于人类中心性肥胖的发生。通过9个月的前瞻性队列研究,发现在同一时间段内,中心性肥胖增加的参与者基线血清赤藓糖醇水平是稳定肥胖者的15倍,并且在样本HbA1C值的前25%范围内,参与者的血清赤藓糖醇水平也要高出21倍,这提示赤藓糖醇有可能在肥胖发生发展的某一阶段发挥重要作用。同时也有研究证明,血清赤藓糖醇极大地提高了传统危险因素对糖尿病发生的预测能力[73]。此外,血清赤藓糖醇还可以预测糖尿病肾病的风险。与临床标记物相比,血清赤藓糖醇水平与2种额外的代谢物相结合,显著提高了微量白蛋白尿发生的预测[74]。此外,在进行代谢组范围冠心病风险分析的研究中,发现血清赤藓糖醇与冠心病发生的风险呈显著相关性[75]。在癌症领域,肺癌患者血清样本中赤藓糖醇水平显著增加[76],并且血浆中的赤藓糖醇与小细胞肺癌患者的预期寿命相关[77]。利用气相色谱-质谱法筛选肺癌患者中差异表达的代谢物,并通过结合代谢组学和转录组学图谱,确定了赤藓糖醇为重要的代谢物,可以作为肺癌的生物标志物[76]。
综上所述,血清和尿液中的赤藓糖醇水平在一定程度上与TALDO缺陷病、代谢性疾病、心血管疾病和癌症发生呈明显的相关性,可提示疾病发病前的早期代谢变化。赤藓糖醇生物效应及疾病预测功能如图4。
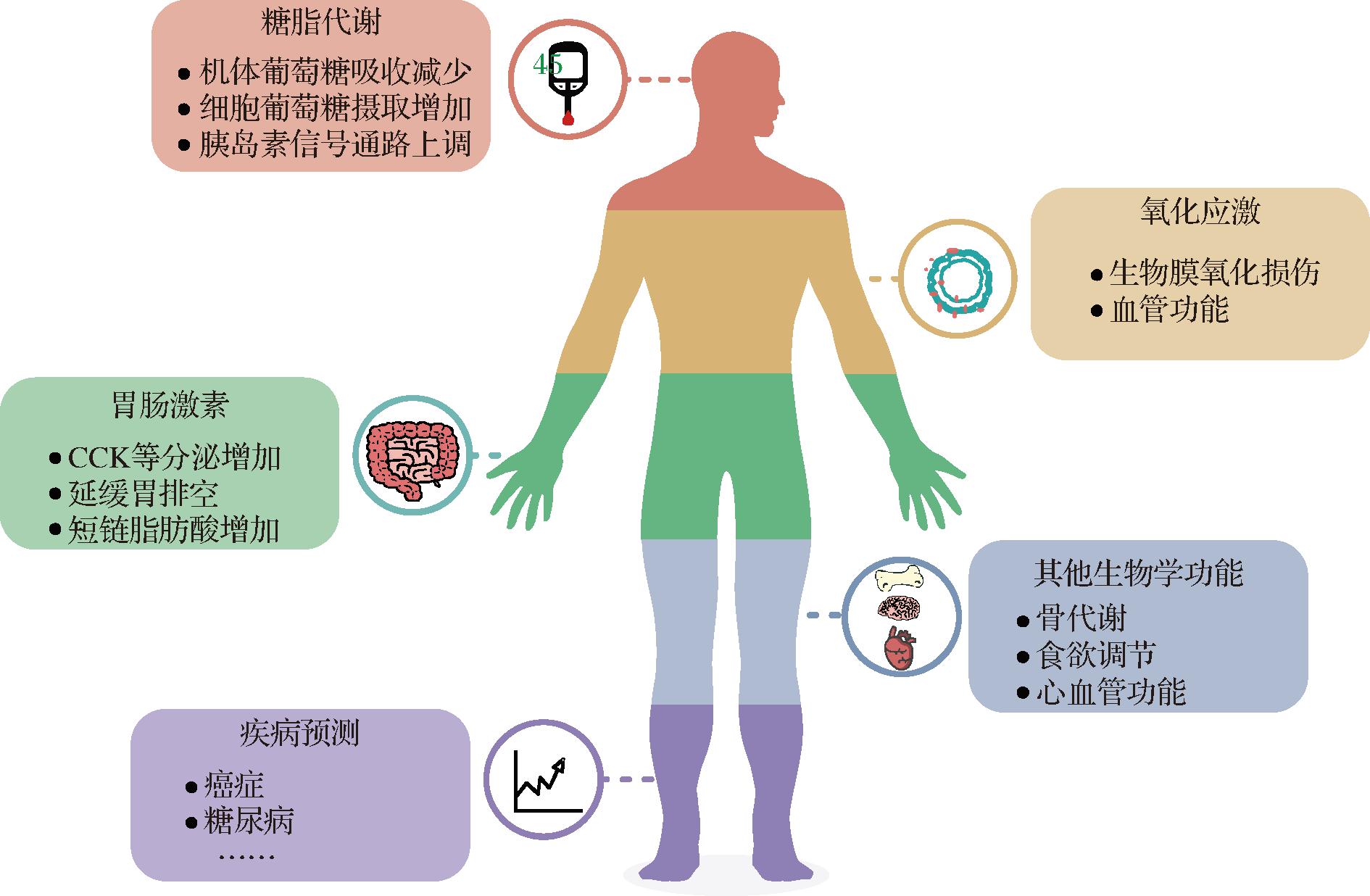
图4 赤藓糖醇的生物效应及疾病预测功能
Fig.4 Biological effects and disease prediction functions of erythritol
4 总结与展望
综上所述,外源性的赤藓糖醇在糖脂代谢、氧化应激、胃肠激素等方面有多种生物学功能,并具有潜在的预防糖尿病和肥胖作用。此外,内源性的赤藓糖醇也可以预测代谢性疾病、心血管疾病、癌症等多种疾病,且对于胎儿时期的发育具有生理意义。
虽然赤藓糖醇作为日常生活中的糖替代品已经得到了广泛认可。但目前其对机体影响机制尚不清楚,对于机体整体和各组织器官的健康效应还有待进一步完善。此领域目前还存在以下问题有待进一步研究:(1)对于赤藓糖醇的最适口服剂量与频次还需进行进一步研究,以确保其对于机体心血管系统及其他器官系统的安全性;(2)赤藓糖醇虽然可以维持机体血糖、血脂稳态,还具有潜在的降血糖特性并减轻由于高血糖症引起的血管损伤,但是赤藓糖醇对于机体的脂质代谢障碍和氧化应激的影响需要进一步研究,以便它们作为更加安全的食品添加剂;(3)赤藓糖醇作为一种新型疾病生物标志物,需要进一步的研究证明饮食和内源性赤藓糖醇之间的关系,并需进一步对内源性赤藓糖醇生物合成调控进行更全面的研究以作为生物标志物。因此,开发赤藓糖醇为主要功能成分的糖尿病营养制剂,深入探索赤藓糖醇的生物学功能和对于各疾病预测作用具有广泛的社会价值和科学意义。
[1] ZHOU M G, WANG H D, ZENG X Y, et al.Mortality, morbidity, and risk factors in China and its provinces, 1990-2017:A systematic analysis for the Global Burden of Disease Study 2017[J].The Lancet, 2019, 394(10204):1145-1158.
[2] Chinese Diabetes Society.中国2型糖尿病防治指南(2020年版)(上)[J].中国实用内科杂志, 2021, 41(8):668-695. Chinese Diabetes Society.Guidelines for prevention and treatment of type 2 diabetes in China (2020 edition) (Ⅰ)[J].Chinese Journal of Practical Internal Medicine, 2021, 41(8):668-695.
[3] 丁钢强. 国民营养计划(2017—2030年)[C]//中国营养学会第十次特殊营养学术会议论文集.温州,2017:6-13. DING G Q.National nutrition plan (2017—2030)[C]// Proceedings of the 10th Special Nutrition Academic Conference of the Chinese Nutrition Society.Wenzhou, 2017:6-13.
[4] 张妍.《食品甜味剂科学共识》正式发布[J].江苏卫生保健,2018(9):51. ZHANG Y.Scientific consensus on food sweeteners officially released[J].Jiangsu Health Care,2018(9):51.
[5] WANG Q P, BROWMAN D, HERZOG H, et al.Non-nutritive sweeteners possess a bacteriostatic effect and alter gut microbiota in mice[J].PLoS One, 2018, 13(7):e0199080.
[6] DEBRAS C, CHAZELAS E, SROUR B, et al.Artificial sweeteners and cancer risk:Results from the NutriNet-Santé population-based cohort study[J].PLoS Medicine, 2022, 19(3):e1003950.
[7] ERIAN A M, SAUER M.Utilizing yeasts for the conversion of renewable feedstocks to sugar alcohols: A review[J].Bioresource Technology, 2022, 346:126296.
[8] RZECHONEK D A, DOBROWOLSKI A, RYMOWICZ W, et al.Recent advances in biological production of erythritol[J].Critical Reviews in Biotechnology, 2018, 38(4):620-633.
[9] ORTIZ S R, FIELD M S.Mammalian metabolism of erythritol:A predictive biomarker of metabolic dysfunction[J].Current Opinion in Clinical Nutrition and Metabolic Care, 2020, 23(5):296-301. [10] NODA K, NAKAYAMA K, OKU T.Serum glucose and insulin levels and erythritol balance after oral administration of erythritol in healthy subjects[J].European Journal of Clinical Nutrition, 1994, 48(4):286-292.
[11] PARK Y C, LEE D Y, LEE D H, et al.Proteomics and physiology of erythritol-producing strains[J].Journal of Chromatography B, 2005, 815(1-2):251-260.
[12] REGNAT K, MACH R L, MACH-AIGNER A R.Erythritol as sweetener—Wherefrom and whereto?[J].Applied Microbiology and Biotechnology, 2018, 102(2):587-595.
[13] RICE T, ZANNINI E, ARENDT E K, et al.A review of polyols-biotechnological production, food applications, regulation, labeling and health effects[J].Critical Reviews in Food Science and Nutrition, 2020, 60(12):2034-2051.
[14] 徐莹, 李景军, 何国庆.赤藓糖醇研究进展及在食品中的应用[J].中国食品添加剂, 2005(3):92-95;54. XU Y, LI J J, HE G Q.Research progress on erythritol and application in food science[J].China Food Additives, 2005(3):92-95;54.
[15] HOOTMAN K C, TREZZI J P, KRAEMER L, et al.Erythritol is a pentose-phosphate pathway metabolite and associated with adiposity gain in young adults[J].Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(21):E4233-E4240.
[16] SCHLICKER L, SZEBENYI D M E, ORTIZ S R, et al.Unexpected roles for ADH1 and SORD in catalyzing the final step of erythritol biosynthesis[J]. Journal of Biological Chemistry, 2019, 294(44):16095-16108.
[17] WAMELINK M M C, STRUYS E A, VALAYANNOPOULOS V, et al.Retrospective detection of transaldolase deficiency in amniotic fluid:Implications for prenatal diagnosis[J].Prenatal Diagnosis, 2008, 28(5):460-462.
[18] JAUNIAUX E, HEMPSTOCK J, TENG C, et al.Polyol concentrations in the fluid compartments of the human conceptus during the first trimester of pregnancy:Maintenance of redox potential in a low oxygen environment[J].The Journal of Clinical Endocrinology &Metabolism, 2005, 90(2):1171-1175.
[19] BRUSATI V, J
 WIK M, J
WIK M, J
 WIK M, et al.Fetal and maternal non-glucose carbohydrates and polyols concentrations in normal human pregnancies at term[J].Pediatric Research, 2005, 58(4):700-704.
WIK M, et al.Fetal and maternal non-glucose carbohydrates and polyols concentrations in normal human pregnancies at term[J].Pediatric Research, 2005, 58(4):700-704.
[20] KOY A, WALDHAUS A, HAMMEN H W, et al.Urinary excretion of pentose phosphate pathway-associated polyols in early postnatal life[J].Neonatology, 2008, 95(3):256-261.
[21] CLARK M R, ROSSI M E.Permeability characteristics of deoxygenated sickle cells[J].Blood, 1990, 76(10):2139-2145.
[22] KAWANO R, OKAMURA T, HASHIMOTO Y, et al.Erythritol ameliorates small intestinal inflammation induced by high-fat diets and improves glucose tolerance[J].International Journal of Molecular Sciences, 2021, 22(11):5558.
[23] NODA K, NAKAYAMA K, MODDERMAN J.Fate of erythritol after single oral administration to rats and dogs[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S206-S213.
[24] NODA K, OKU T.Metabolism and disposition of erythritol after oral administration to rats[J].The Journal of Nutrition, 1992, 122(6):1266-1272.
[25] BORNET F R J, BLAYO A, DAUCHY F, et al.Plasma and urine kinetics of erythritol after oral ingestion by healthy humans[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S280-S285.
[26] HIELE M, GHOOS Y, RUTGEERTS P, et al.Metabolism of erythritol in humans:Comparison with glucose and lactitol[J].The British Journal of Nutrition, 1993, 69(1):169-176.
[27] MAHALAK K K, FIRRMAN J, TOMASULA P M, et al.Impact of steviol glycosides and erythritol on the human and Cebus apella gut microbiome[J].Journal of Agricultural and Food Chemistry, 2020, 68(46):13093-13101.
[28] GAO Z G, YIN J, ZHANG J, et al.Butyrate improves insulin sensitivity and increases energy expenditure in mice[J].Diabetes, 2009, 58(7):1509-1517.
[29] LIN H V, FRASSETTO A, KOWALIK E J Jr, et al.Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms[J].PLoS One, 2012, 7(4):e35240.
[30] STOREY D, LEE A, BORNET F, et al.Gastrointestinal tolerance of erythritol and xylitol ingested in a liquid[J].European Journal of Clinical Nutrition, 2007, 61(3):349-354.
[31] JACQZ-AIGRAIN E, KASSAI B, CORNU C, et al.Gastrointestinal tolerance of erythritol-containing beverage in young children:A double-blind, randomised controlled trial[J].European Journal of Clinical Nutrition, 2015, 69(6):746-751.
[32] WÖLNERHANSSEN B K, DREWE J, VERBEURE W, et al.Gastric emptying of solutions containing the natural sweetener erythritol and effects on gut hormone secretion in humans:A pilot dose-ranging study[J].Diabetes, Obesity &Metabolism, 2021, 23(6):1311-1321.
[33] BORNET F R J, BLAYO A, DAUCHY F, et al.Gastrointestinal response and plasma and urine determinations in human subjects given erythritol[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S296-S302.
[34] LEE A, WILS D, ZUMBÉ A, et al.The comparative gastrointestinal responses of children and adults following consumption of sweets formulated with sucrose, isomalt and lycasin HBC[J].European Journal of Clinical Nutrition, 2002, 56(8):755-764.
[35] WÖLNERHANSSEN B K, CAJACOB L, KELLER N, et al.Gut hormone secretion, gastric emptying, and glycemic responses to erythritol and xylitol in lean and obese subjects[J].American Journal of Physiology.Endocrinology and Metabolism, 2016, 310(11):E1053-E1061.
[36] TETZLOFF W, DAUCHY F, MEDIMAGH S, et al.Tolerance to subchronic, high-dose ingestion of erythritol in human volunteers[J].Regulatory Toxicology and Pharmacology:RTP, 1996, 24(2 Pt 2):S286-S295.
[37] KIM Y, PARK S C, WOLF B W, et al.Combination of erythritol and fructose increases gastrointestinal symptoms in healthy adults[J].Nutrition Research, 2011, 31(11):836-841.
[38] TIL H P, MODDERMAN J.Four-week oral toxicity study with erythritol in rats[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S214-S220.
[39] LINA B A R, BOS-KUIJPERS M H M, TIL H P, et al.Chronic toxicity and carcinogenicity study of erythritol in rats[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S264-S279.
[40] TIL H P, KUPER C F, FALKE H E, et al.Subchronic oral toxicity studies with erythritol in mice and rats[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S221-S231.
[41] DEAN I, JACKSON F, GREENOUGH R J.Chronic (1-year) oral toxicity study of erythritol in dogs[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S254-S260.
[42] EAPEN A K, DE COCK P, CRINCOLI C M, et al.Acute and sub-chronic oral toxicity studies of erythritol in Beagle dogs[J].Food and Chemical Toxicology, 2017, 105:448-455.
[43] LOEB W F, DAS S R, TROUT J R.The effect of erythritol on the stability of γ-glutamyl transpeptidase and N-acetyl glucosaminidase in human urine[J].Toxicologic Pathology, 1997, 25(3):264-267.
[44] YUNGINGER J W, JONES R T, KITA H, et al.Allergic reactions after ingestion of erythritol-containing foods and beverages[J].The Journal of Allergy and Clinical Immunology, 2001, 108(4):650.
[45] SHIRAO K, INOUE M, TOKUDA R, et al.“bitter sweet”:A child case of erythritol-induced anaphylaxis[J].Allergology International, 2013, 62(2):269-271.
[46] KIM S, YOO W, PARK H K, et al.The first case of erythritol-induced anaphylaxis in Korea[J].Journal of Korean Medical Science, 2022, 37(10):e83.
[47] MORI S, KURIHARA K, INUO C.Case of a 6-year-old boy with anaphylaxis induced by erythritol with positive skin prick test and negative basophil activation test[J].Allergy, Asthma, and Clinical Immunology:Official Journal of the Canadian Society of Allergy and Clinical Immunology, 2022, 18(1):28.
[48] HINO H, KASAI S, HATTORI N, et al.A case of allergic urticaria caused by erythritol[J].The Journal of Dermatology, 2000, 27(3):163-165.
[49] SUGIURA S, KONDO Y, TSUGE I, et al.IgE-dependent mechanism and successful desensitization of erythritol allergy[J].Annals of Allergy, Asthma &Immunology, 2016, 117(3):320-321.e1.
[50] DONG X H, SUN X, JIANG G J, et al.Dietary intake of sugar substitutes aggravates cerebral ischemic injury and impairs endothelial progenitor cells in mice[J].Stroke, 2015, 46(6):1714-1718.
[51] CHEN L G, CHEN X W, HUANG X, et al.Regulation of glucose and lipid metabolism in health and disease[J].Science China.Life Sciences, 2019, 62(11):1420-1458.
[52] ORTIZ S R, FIELD M S.Chronic dietary erythritol exposure elevates plasma erythritol concentration in mice but does not cause weight gain or modify glucose homeostasis[J].The Journal of Nutrition, 2021, 151(8):2114-2124.
[53] ISHIKAWA M, MIYASHITA M, KAWASHIMA Y, et al.Effects of oral administration of erythritol on patients with diabetes[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S303-S308.
[54] YOKOZAWA T, KIM H Y, CHO E J.Erythritol attenuates the diabetic oxidative stress through modulating glucose metabolism and lipid peroxidation in streptozotocin-induced diabetic rats[J].Journal of Agricultural and Food Chemistry, 2002, 50(19):5485-5489.
[55] CHUKWUMA C I, MOPURI R, NAGIAH S, et al.Erythritol reduces small intestinal glucose absorption, increases muscle glucose uptake, improves glucose metabolic enzymes activities and increases expression of GLUT-4 and IRS-1 in type 2 diabetic rats[J].European Journal of Nutrition, 2018, 57(7):2431-2444.
[56] BORDIER V, TEYSSEIRE F, SCHLOTTERBECK G, et al.Effect of a chronic intake of the natural sweeteners xylitol and erythritol on glucose absorption in humans with obesity[J].Nutrients, 2021, 13(11):3950.
[57] WEN H X, TANG B W, STEWART A J, et al.Erythritol attenuates postprandial blood glucose by inhibiting α-glucosidase[J].Journal of Agricultural and Food Chemistry, 2018, 66(6):1401-1407.
[58] NEWSHOLME P, CRUZAT V F, KEANE K N, et al.Molecular mechanisms of ROS production and oxidative stress in diabetes[J].The Biochemical Journal, 2016, 473(24):4527-4550.
[59] DEN HARTOG G J M, BOOTS A W, ADAM-PERROT A, et al.Erythritol is a sweet antioxidant[J].Nutrition, 2010, 26(4):449-458.
[60] BOESTEN D M P H J, BERGER A, DE COCK P, et al.Multi-targeted mechanisms underlying the endothelial protective effects of the diabetic-safe sweetener erythritol[J].PLoS One, 2013, 8(6):e65741.
[61] FLINT N, HAMBURG N M, HOLBROOK M, et al.Effects of erythritol on endothelial function in patients with type 2 diabetes mellitus:A pilot study[J].Acta Diabetologica, 2014, 51(3):513-516.
[62] ALAMRI H S, AKIEL M A, ALGHASSAB T S, et al.Erythritol modulates the polarization of macrophages:Potential role of tumor necrosis factor-α and Akt pathway[J].Journal of Food Biochemistry, 2022, 46(1):e13960.
[63] 王欢, 黄永坤, 刘梅.胃肠激素与胃肠道功能及疾病的关系[J].医学综述, 2013, 19(15):2735-2738. WANG H, HUANG Y K, LIU M.Relationship between gastrointestinal hormones and gastrointestinal tract function and diseases[J].Medical Recapitulate, 2013, 19(15):2735-2738.
[64] 李景南, 钱家鸣.胃肠激素与消化系疾病[J].中华消化杂志, 2005, 25(4):253-254. LI J N, QIAN J M.Gastrointestinal hormones and digestive diseases[J].Chinese Journal of Digestion, 2005, 25(4):253-254.
[65] OVERDUIN J, COLLET T H, MEDIC N, et al.Failure of sucrose replacement with the non-nutritive sweetener erythritol to alter GLP-1 or PYY release or test meal size in lean or obese people[J].Appetite, 2016, 107:596-603.
[66] TEYSSEIRE F, BORDIER V, BUDZINSKA A, et al.The role of D-allulose and erythritol on the activity of the gut sweet taste receptor and gastrointestinal satiation hormone release in humans:A randomized, controlled trial[J].The Journal of Nutrition, 2022, 152(5):1228-1238.
[67] LEE A, OWYANG C.Sugars, sweet taste receptors, and brain responses[J].Nutrients, 2017, 9(7):653.
[68] MATTILA P T, SVANBERG M J, M KINEN K K, et al.Dietary xylitol, sorbitol and D-mannitol but not erythritol retard bone resorption in rats[J].The Journal of Nutrition, 1996, 126(7):1865-1870.
KINEN K K, et al.Dietary xylitol, sorbitol and D-mannitol but not erythritol retard bone resorption in rats[J].The Journal of Nutrition, 1996, 126(7):1865-1870.
[69] MINEO H, HARA H, TOMITA F.Sugar alcohols enhance calcium transport from rat small and large intestine epithelium in vitro[J].Digestive Diseases and Sciences, 2002, 47(6):1326-1333.
[70] MEYER-GERSPACH A C, WINGROVE J O, BEGLINGER C, et al.Erythritol and xylitol differentially impact brain networks involved in appetite regulation in healthy volunteers[J].Nutritional Neuroscience, 2022, 25(11):2344-2358.
[71] PHAM H, PHILLIPS L K, JONES K L.Acute effects of nutritive and non-nutritive sweeteners on postprandial blood pressure[J].Nutrients, 2019, 11(8):1717.
[72] 张琰, 林彩梅, 周峻荔, 等.转醛醇酶缺陷病[J].肝脏, 2017, 22(10):942-945;974. ZHANG Y, LIN C M, ZHOU J L, et al.Transaldolase deficiency disease[J].Liver, 2017, 22(10):942-945;974.
[73] REBHOLZ C M, YU B, ZHENG Z H, et al.Serum metabolomic profile of incident diabetes[J].Diabetologia, 2018, 61(5):1046-1054.
[74] HAUKKA J K, SANDHOLM N, FORSBLOM C, et al.Metabolomic profile predicts development of microalbuminuria in individuals with type 1 diabetes[J].Scientific Reports, 2018, 8:13853.
[75] WANG Z, YU B.Response letter regarding article, “metabolomic pattern predicts incident coronary heart disease”[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2019, 39(8):1475-1482.
[76] SUN Q A, ZHAO W, WANG L, et al.Integration of metabolomic and transcriptomic profiles to identify biomarkers in serum of lung cancer[J].Journal of Cellular Biochemistry, 2019, 120(7):11981-11989.
[77] WEDGE D C, ALLWOOD J W, DUNN W, et al.Is serum or plasma more appropriate for intersubject comparisons in metabolomic studies? an assessment in patients with small-cell lung cancer[J].Analytical Chemistry, 2011, 83(17):6689-6697.