亚麻是亚麻科亚麻属的一年或多年生草本植物,可分为纤维用亚麻、油用亚麻和油纤兼用亚麻3种类型,在我国至少有1 000年的栽培历史,主要种植于北方和西南地区,也被称作胡麻。亚麻的皮和茎最早被用作天然纤维的原料,亚麻的种子称作亚麻籽(Linum usitatissimum L.),是可食用的最古老油料作物之一[1]。日常生活中亚麻籽既可加工成亚麻籽粉食用,也可榨成亚麻籽油食用。
早年,我国对于亚麻籽的研究主要在饲料方面,从2000年开始,研究学者关注到亚麻籽中的营养和功能性成分。亚麻籽中的主要营养成分约包括40%的油脂、28%的总膳食纤维、20%的蛋白质、10%的水分和2%的灰分,主要功能活性成分有脂肪酸、亚麻籽胶、木酚素和环肽等[2]。相关报道显示,亚麻籽具有抗炎、抗癌、抗高血压和预防心血管疾病等多种功效[3]。本文将对亚麻籽中的主要功能成分及生物活性,特别是亚麻籽中独特结构的环肽作主要论述,以期为亚麻籽在功能食品领域的深入研究和开发利用提供参考。
1 不饱和脂肪酸
亚麻籽油中多不饱和脂肪酸含量最高(73%),其次是单不饱和脂肪(18%)和饱和脂肪酸(9%)。其中α-亚麻酸(alpha-linolenic acid,ALA)含量高达53%,亚油酸含量为17%。以α-亚麻酸为母体的ω-3多不饱和脂肪酸在人体内可通过特定的脱氢酶和碳链延长酶代谢产生二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),以亚油酸为母体的ω-6多不饱和脂肪酸可代谢出γ-亚麻酸(gamma-linolenic acid,GLA)、花生四烯酸(arachidonic acid,AA)等,AA又会衍生出前列腺素、血栓烷和白三烯[4]。饮食中高比例的ω-6多不饱和脂肪酸会导致包括心血管疾病、炎症和自身免疫等各种疾病的产生,而高比例的ω-3多不饱和脂肪酸可以抑制这些疾病的发展[4]。因此,在日常饮食中,应该摄入比例均衡的ω-3和ω-6必需脂肪酸,膳食推荐比例为1∶1~1∶4[4]。大多数植物油中ω-6脂肪酸含量较多,ω-3脂肪酸含量较低,如核桃油、菜油、大豆油,这些油中ω-3脂肪酸的含量远远低于亚麻籽油(53%),所以对于素食者来说,亚麻籽是获取ω-3多不饱和脂肪酸的一个重要途径,这也是为什么近年来亚麻籽备受关注的原因之一[2]。
ω-3多不饱和脂肪酸有降低胆固醇和心血管疾病风险的作用,GONÇALVES等[5]采用高脂饲料喂养小鼠,发现膳食补充α-亚麻酸可减少小鼠胰岛素抵抗、炎症和内质网应激,并且可有效预防肝脏脂肪变性。BUCKNER等[6]研究了亚麻籽油的抗癌作用,发现被亚麻籽油处理的癌细胞生长被抑制,而非恶性细胞生长增加;α-亚麻酸、DHA、EPA混合脂肪酸和木脂素也能抑制癌细胞生长。此外,亚麻籽油处理还可使B16-BL6和MCF-7细胞的线粒体功能紊乱。以上研究结果表明,亚麻籽油能够特异性的抑制癌细胞生长,并诱导某些癌细胞凋亡。
对于ω-6多不饱和脂肪酸对机体健康的影响仍存在许多争议,主要是对心血管疾病、2型糖尿病带来的影响。其下游的花生四烯酸可能会导致患炎症疾病的风险增加,环氧合酶催化的花生四烯酸及其代谢产物前列腺素可能会促进癌症的发生[7]。RUTTING等[8]分别评估了ω-3、ω-6多不饱和脂肪酸、饱和脂肪酸或肥胖相关肿瘤坏死因子TNF-α对患有慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)和不患病的人肺细胞炎症和特异性的反应,结果表明ω-6脂肪酸花生四烯酸增加了COPD疾病的炎症反应,但抑制细胞外基质蛋白的表达。此外,来自澳大利亚的研究团队评估了亚油酸和其代谢物花生四烯酸作为生物标志物与2型糖尿病发病的关系,结果表明,亚油酸生物标志物占总脂肪酸比例较高时,患2型糖尿病的总体风险较低,而花生四烯酸的水平与疾病发生没有明显的关联[9]。针对目前存在的争议,需要更多的研究来评估ω-6多不饱和脂肪酸与炎症及癌症的相关性。
2 亚麻籽胶
亚麻籽中含有约28%左右的可溶性纤维和不可溶性纤维[2],两者的比例主要在20∶80~40∶60,不同的种子和提取方法会导致这两种纤维的比例存在一定的差异[10]。可溶性纤维也被称作亚麻籽胶,由两种不同类型的多糖组成,即酸性的类果胶物质和中性的阿拉伯木聚糖,酸性部分由L-半乳糖、L-鼠李糖、L-岩藻糖和D-半乳糖醛酸组成,中性部分又分别由D-半乳糖、D-木糖和L-阿拉伯糖组成[11]。
YANG等[12]以亚麻籽胶为原料,采用酶解法制备亚麻籽低聚糖,发现亚麻籽低聚糖比亚麻籽胶的抗氧化活性更好,且对HepG2和HeLa癌细胞表现出显著的剂量依赖性活性,这表明亚麻籽低聚糖具有作为抗氧化剂和抗肿瘤药物的可能性,然而其结构及体内的抗肿瘤机制有待进一步研究。BONGARTZ等[13]评估了两种剂量的亚麻籽胶在减轻超重和中度肥胖者体重方面的益处和耐受性,发现服用亚麻籽胶高剂量(2 560 mg)和低剂量(1 280 mg)的两组患者体重均比服用安慰剂组的患者体重减轻幅度大,且腰围和臀围均显著减少。这项研究中,总胆固醇和甘油三酯水平略有下降,摄入亚麻籽胶对体重和体脂减少的积极影响可能会改善血脂状况、降低血压和减少患2型糖尿病的风险,结果表明服用亚麻籽胶对超重和中度肥胖者均有安全有效的减肥作用。
作为一种亲水性胶体,亚麻籽胶的流变性和保水能力较好,具有黏稠性、乳化性、胶凝性、抗氧化等特性,常被用作食品添加剂来改善食品品质[14]。还能够延缓胃排空、改善血糖和胆固醇水平,并且对胃肠道黏膜也有保护作用[15]。BASIRI等[16]在搅拌的酸奶中分别添加了亚麻籽胶和亚麻籽胶与羧甲基纤维素(carboxymethyl cellulose,CMC)的组合后,两种添加方式均可增加酸奶的黏稠度和弹性,降低酸奶的脱水程度,且对酸奶的感官品质有一定影响,由此可得出亚麻籽胶有作为天然稳定剂的潜能来改善搅拌型酸奶的质构。此外,亚麻籽胶还被广泛应用于食品涂料和食品包装材料中,DE PAIVA等[17]将亚麻籽胶和聚乙烯醇混合制成薄膜,产生的膜阻力和刚性较小,柔韧性更强,具有较高的热稳定性且与纯胶膜相比不改变水蒸气阻隔性能。亚麻籽胶作为一种从农业产品中提取的天然产物,无毒、无刺激性且具有良好的生理活性调节作用,将亚麻籽胶用作食品添加剂或食品包装材料方面的应用值得更多的研究。
3 木酚素
木酚素是一种植物雌激素,也称为木脂素,主要存在于植物的木部和树脂中,亚麻籽中的木酚素含量为6.1~13.3 mg/g,是谷物的75~800倍[10],开环异落叶松脂酚二糖苷(secoisolariciresinol diglycoside,SDG)是其中最主要的一类,木酚素具有抗氧化活性,还可以预防骨质疏松、心脏和肝脏疾病以及癌症,特别是乳腺癌,对于体内的激素水平也有调控效果[18]。
AQEEL等[19]研究了SDG对醋酸铅肾毒性的保护作用,发现与对照组相比,SDG治疗后大鼠肾脏的相对重量有明显变化,醋酸铅在肾脏的蓄积明显减少,且SDG治疗可显著降低血尿素和肌酐水平,恢复白蛋白水平。此项研究表明SDG对醋酸铅所致的肾病模型具有保护作用。HAJIBABAIE等[20]发现从亚麻籽中提取的SDG和α-亚麻酸可以逆转糖尿病心脏功能障碍,并可为心血管疾病提供新的潜在治疗方法。GUO等[21]研究了96.1%的SDG和50%的SDG聚合物对大鼠高胆固醇血症的治疗作用,发现SDG及其聚合物具有降脂作用,脂肪变性和非酒精性脂肪性肝病的发生程度降低,且SDG聚合物具有潜在的替代高纯度SDG治疗高胆固醇血症的作用,且成本更低。ROM等[22]发现SDG可直接抑制血脑屏障与炎症细胞的相互作用,降低白细胞的炎症状态,具有潜在的治疗神经炎症性疾病的能力。目前已经发现SDG具有治疗几种疾病的功能活性,不过其调控机制还需要更进一步研究。
SDG在肠道中被代谢为两种木酚素衍生物enterodiol(END)和enterolactone(ENL),TANNOUS等[23]研究了亚麻籽木酚素SDG、END和ENL在体外对急性髓系白血病细胞的影响,发现随着浓度的增加,ENL通过促进DNA的断裂和诱导细胞凋亡起到抗癌的作用。木酚素可以改变机体中的性激素水平,从而对乳腺癌的发展起到影响。加拿大多伦多一团队对99名绝经妇女进行了试验,干预组持续7周每天摄入15 g磨碎的亚麻籽,对照组维持正常的饮食。通过对血清中木酚素生物标志物和14种性激素监测,发现食用亚麻籽的妇女与对照组相比,血清中木酚素标志物水平的变化与2-羟雌酮和2-羟雌酮与16α-羟雌酮比例的变化呈正相关,与催乳素的变化呈负相关。这表明亚麻籽会影响某些性激素的水平,可能有预防乳腺癌的作用[24]。DI等[25]研究发现,亚麻籽木酚素可以显著增强化疗药物对SKBR3和MDA-MB-231乳腺癌细胞的抑制作用。结果表明通过亚麻籽木酚素的辅助治疗可以提高乳腺癌的化疗效果。现有研究表明,亚麻籽及其木酚素提取物对大多数成年人群是安全的,但孕妇应该限制摄入量。
4 环肽
亚麻籽中还存在着一类特殊的生物活性物质——亚麻籽环肽,不同于其他种类的多肽,提取后往往需要水解才能得到肽段,亚麻籽环肽是一类天然存在于亚麻籽中的环状多肽。根据TAN等[26]综述,高等植物中共发现了属于26科、65属、120种的共约455个环肽,特别是石竹科和鼠李科的植物普遍含有环肽。他们根据植物环肽的结构骨架和在植物中的分布情况,提出了植物环肽的系统结构分类,将其分为两大类、5个亚类和8个类型。根据骨架结构的不同,环肽可分为杂环肽和均环肽两大类;根据环数可将其分为杂单环肽、杂双环肽、均单环肽、均双环肽和均多环肽5个亚类;最后,根据环和来源可将其分为8种类型,详细分类如图1所示。亚麻籽环肽属于Ⅵ型石竹科环肽[26]。
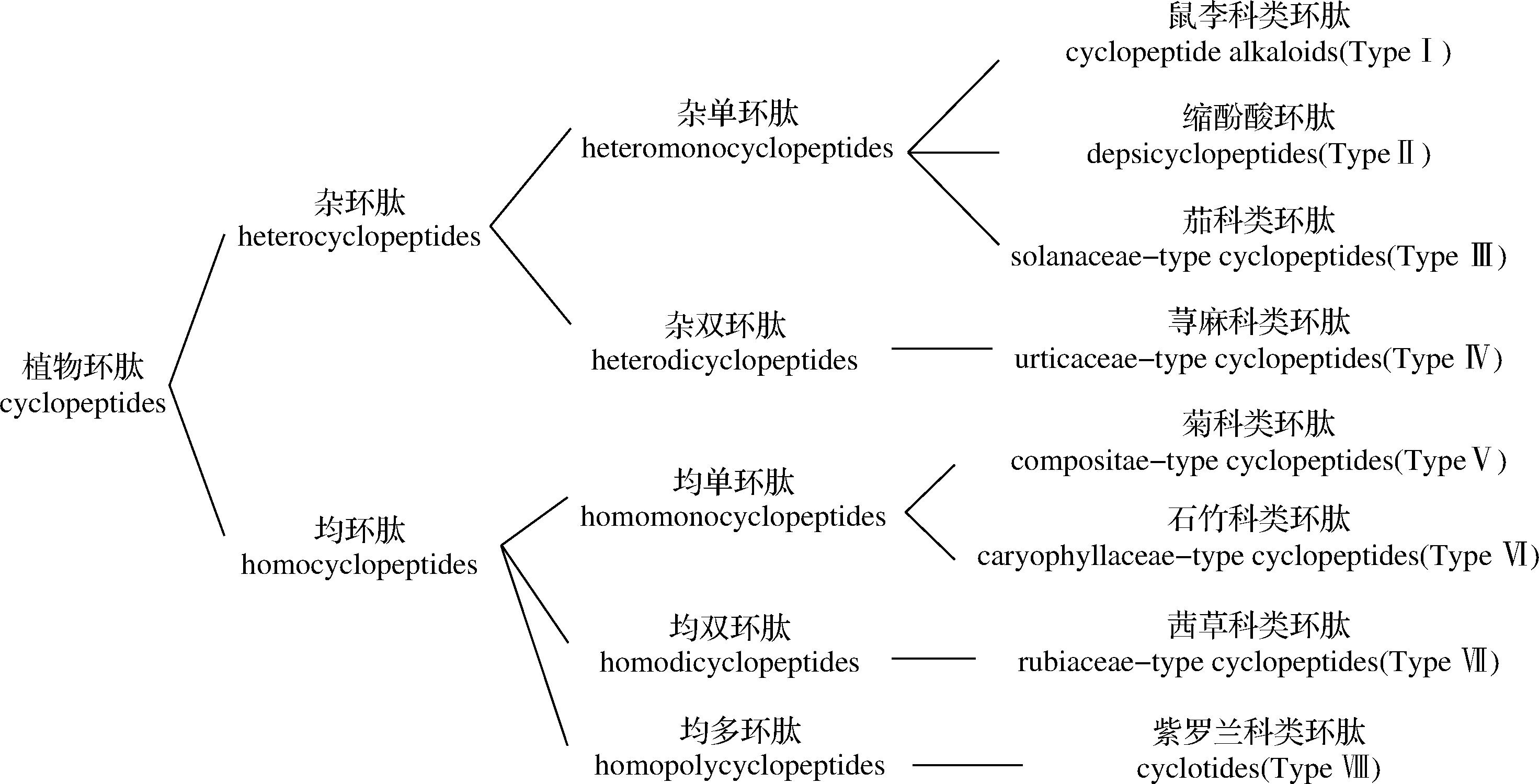
图1 TAN等[26]对植物环肽的分类
Fig.1 Classification of plant cyclopeptides by TAN et al[26]
第一个亚麻籽环肽[1-9-NαC]-linusorb B3(CLA)是KAUFMANN等[27]在1959年从亚麻油料中发现的,此后,陆续有人从亚麻籽油、根和种子中分离出其他环肽。亚麻籽环肽具有免疫抑制、抗疟疾、抗炎和抗癌的活性作用,且不同种类的环肽作用功能不同[28]。亚麻籽环肽容易被氧化,这也是亚麻籽油放置时间久后产生苦味的原因,正是这种苦味在一定程度上影响了消费者的接受度[29]。
4.1 环肽的结构及命名级标题
亚麻籽环肽是一类由8~10个氨基酸组成具有特殊环状结构的天然疏水性物质,其特点是N-和C-连接而不是二硫键相连,分子质量约为1 kDa,现在已发现的亚麻籽环肽有30多个不同结构类型。起初是将脯氨酸残基(Pro)作为环肽序列中第一个氨基酸开始编号的;后来DNA序列揭示了异亮氨酸(Ile)是环肽[1-9-NαC]-linusorb B3(CLA)的第一个残基;甘氨酸(Gly)是环肽[1-9-NαC]-linusorb D1(CLS)、[1-9-NαC]-linusorb E1(CLX)、[1-10-NαC]-linusorb E2(CLV)、[1-10-NαC]-linusorb E3(CLU)的第一个氨基酸;蛋氨酸(Met)或其氧化产物是其余环肽的第一个氨基酸残基[30]。此前,环肽被简单地以3个大写字母命名,也有文献用加粗的数字来表示不同的环肽,后来,SHIM等[31]根据国际理论与应用化学家联合会(International Union of Pure and Applied Chemistry,IUPAC)系统命名有机化合物的方法和蛋白质数据库(UniProt)对亚麻籽环肽进行了系统命名,如下(1)所示。
[1-#-NαC],[#-Xaa,#-Xaa]-linusorb#
(1)
其中[1-#-NαC]表示在第1个氨基酸和第 # 个氨基酸之间通过α-氨基,即N-C环化相连接;[#-Xaa,#-Xaa]为前缀表示,它代表了修饰氨基酸在多肽中的位置和类型;-linus为分类名缩写,根据UniPot物种名单,用其属名称的前3个字母和种名称的前两个字母来表示环肽的起源;通用后缀-orb是环状化合物(orbitide)的缩写;最后的 # 代表了氨基酸残基的编号,残基编号从环肽的N-末端的氨基酸残基开始。
根据IUPAC对于蛋氨酸及其硫化产物的表示方法,将蛋氨酸硫氧化物(methionine S-oxide)称为蛋氨酸亚砜(methionine sulfoxide),英文缩写表示为MetO,而将蛋氨酸二硫氧化物(methionine S,S-dioxide)称为蛋氨酸砜(methionine sulfone),英文缩写表示为 MetO2[2]。
具体对于环肽的旧称及系统命名法如表1所示。
表1 亚麻籽环肽的种类及命名
Table 1 The species and nomenclature of flaxseed cyclolinopeptides
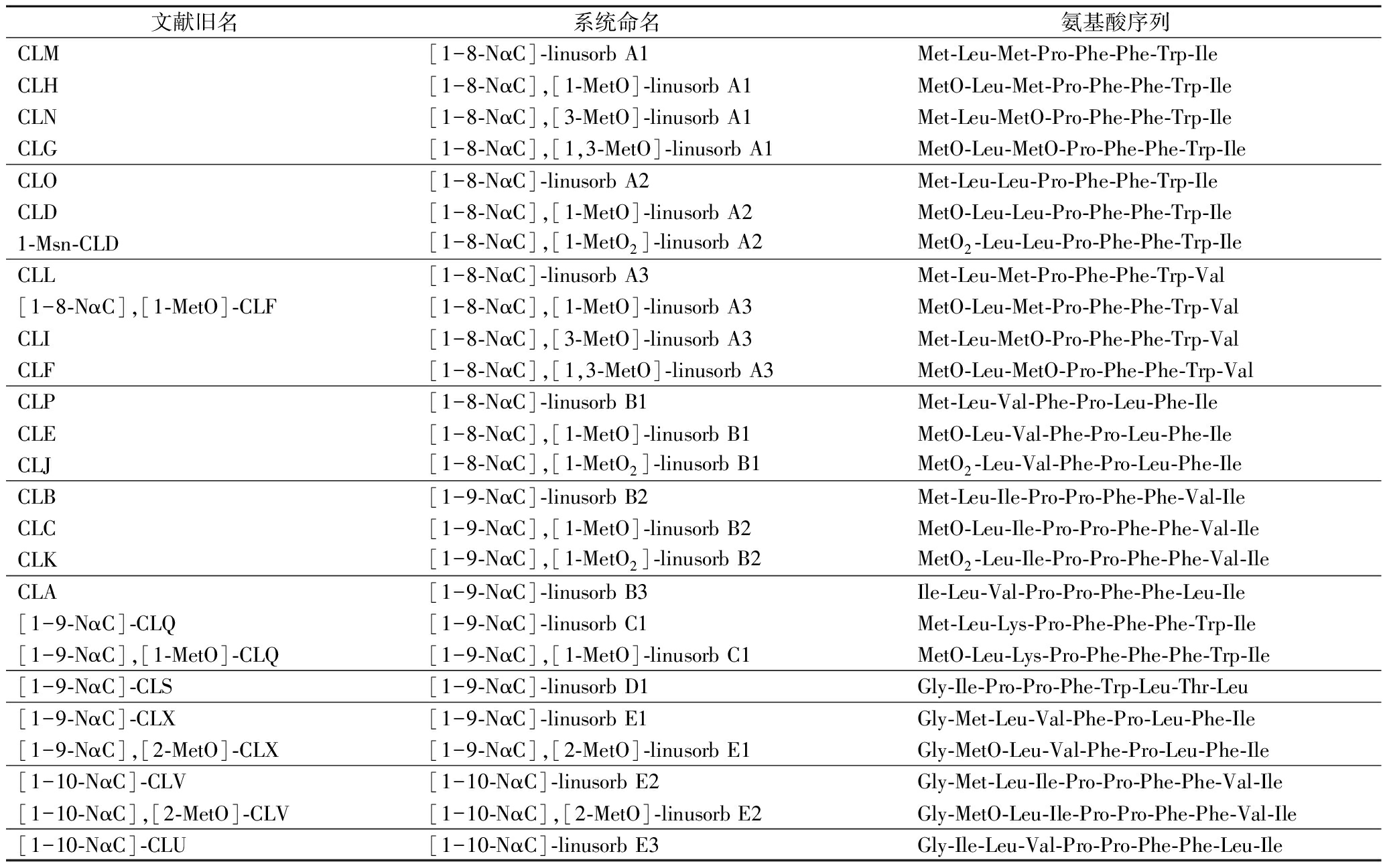
文献旧名系统命名氨基酸序列CLM[1-8-NαC]-linusorb A1Met-Leu-Met-Pro-Phe-Phe-Trp-IleCLH[1-8-NαC],[1-MetO]-linusorb A1MetO-Leu-Met-Pro-Phe-Phe-Trp-IleCLN[1-8-NαC],[3-MetO]-linusorb A1Met-Leu-MetO-Pro-Phe-Phe-Trp-IleCLG[1-8-NαC],[1,3-MetO]-linusorb A1MetO-Leu-MetO-Pro-Phe-Phe-Trp-IleCLO[1-8-NαC]-linusorb A2Met-Leu-Leu-Pro-Phe-Phe-Trp-IleCLD[1-8-NαC],[1-MetO]-linusorb A2MetO-Leu-Leu-Pro-Phe-Phe-Trp-Ile1-Msn-CLD[1-8-NαC],[1-MetO2]-linusorb A2MetO2-Leu-Leu-Pro-Phe-Phe-Trp-IleCLL[1-8-NαC]-linusorb A3Met-Leu-Met-Pro-Phe-Phe-Trp-Val[1-8-NαC],[1-MetO]-CLF[1-8-NαC],[1-MetO]-linusorb A3MetO-Leu-Met-Pro-Phe-Phe-Trp-ValCLI[1-8-NαC],[3-MetO]-linusorb A3Met-Leu-MetO-Pro-Phe-Phe-Trp-ValCLF[1-8-NαC],[1,3-MetO]-linusorb A3MetO-Leu-MetO-Pro-Phe-Phe-Trp-ValCLP[1-8-NαC]-linusorb B1Met-Leu-Val-Phe-Pro-Leu-Phe-IleCLE[1-8-NαC],[1-MetO]-linusorb B1MetO-Leu-Val-Phe-Pro-Leu-Phe-IleCLJ[1-8-NαC],[1-MetO2]-linusorb B1MetO2-Leu-Val-Phe-Pro-Leu-Phe-IleCLB[1-9-NαC]-linusorb B2Met-Leu-Ile-Pro-Pro-Phe-Phe-Val-IleCLC[1-9-NαC],[1-MetO]-linusorb B2MetO-Leu-Ile-Pro-Pro-Phe-Phe-Val-IleCLK[1-9-NαC],[1-MetO2]-linusorb B2MetO2-Leu-Ile-Pro-Pro-Phe-Phe-Val-IleCLA[1-9-NαC]-linusorb B3Ile-Leu-Val-Pro-Pro-Phe-Phe-Leu-Ile[1-9-NαC]-CLQ[1-9-NαC]-linusorb C1Met-Leu-Lys-Pro-Phe-Phe-Phe-Trp-Ile[1-9-NαC],[1-MetO]-CLQ[1-9-NαC],[1-MetO]-linusorb C1MetO-Leu-Lys-Pro-Phe-Phe-Phe-Trp-Ile[1-9-NαC]-CLS[1-9-NαC]-linusorb D1Gly-Ile-Pro-Pro-Phe-Trp-Leu-Thr-Leu[1-9-NαC]-CLX[1-9-NαC]-linusorb E1Gly-Met-Leu-Val-Phe-Pro-Leu-Phe-Ile[1-9-NαC],[2-MetO]-CLX[1-9-NαC],[2-MetO]-linusorb E1Gly-MetO-Leu-Val-Phe-Pro-Leu-Phe-Ile[1-10-NαC]-CLV[1-10-NαC]-linusorb E2Gly-Met-Leu-Ile-Pro-Pro-Phe-Phe-Val-Ile[1-10-NαC],[2-MetO]-CLV[1-10-NαC],[2-MetO]-linusorb E2Gly-MetO-Leu-Ile-Pro-Pro-Phe-Phe-Val-Ile[1-10-NαC]-CLU[1-10-NαC]-linusorb E3Gly-Ile-Leu-Val-Pro-Pro-Phe-Phe-Leu-Ile
4.2 环肽的提取、分离及检测方法
环肽在亚麻籽中的含量低,约为0.1%,所以通常采用溶剂提取结合柱层层析的方法来分离环肽[28]。KAUFMANN等[27]通过溶剂萃取法在亚麻籽油沉淀物中获得[1-9-NαC]-linusorb B3(CLA)。MORITA等[32]将亚麻籽甲醇提取物经柱层析洗脱,收集甲醇洗脱部分得到环肽[1-9-NαC]-linusorb B2(CLB)。接着MORITA等[33]又用热甲醇和硅胶柱层析从亚麻籽的根部提取得到CLA至CLE五种环肽。MATSUMOTO等[34]用热甲醇结合硅胶柱的方法,从亚麻籽油中提取得到了CLF、CLG、CLH、CLI四种环肽。STEFANOWICZ[35]通过丙酮提取磨碎的亚麻籽,然后混合物溶于甲醇,用100 g/L的KOH水解,最后用乙酸乙酯萃取含有肽的部分,得到了两种新的环肽CLF和CLG,此方法无需进一步纯化。BRÜHL等[36]将亚麻籽在低于60 ℃的温度下冷榨获得亚麻籽油,然后将其溶于庚烷,用甲醇/水(6∶4,体积比)提取,通过感官鉴定将亚麻籽油中呈苦味的部分分离出来,然后用硅胶进行分离,接着用制备型HPLC纯化了馏分中更强烈的苦味物质,经鉴定为环肽CLE,CLE正是使亚麻籽油产生苦味的原因之一,也将其称为苦味肽。JADHAV等[37]将含老化亚麻籽油的二氧化硅与正己烷混合后用不同级分的洗脱剂洗脱,得到了环肽CLJ和CLK。OKINYO-OWITI等[38]提出了一种模拟移动床技术,用于分离环肽CLC和CLE,但该方法应用了8个制备柱,成本较高,可重复性较低。BURNETT等[39]将亚麻籽油先经硅胶吸附再用溶剂洗脱回收,从中提取并鉴定到5个新的环肽,分别命名为环肽U、V、W、X和Y。由于环肽种类多、含量少,以上的提取方法往往需要大量的操作,通过纯化才能够获得单一种类的环肽,且得率较低。LIU等[40]建立了一种新型的同时分离12种环肽的方法,该方法采用制备型高效液相色谱法制备亚麻籽环肽,通过MS/MS检测到12个纯度为95.5%以上的环肽。这些环肽的纯化方法主要采用制备液相、中高压液相等,然而这些方法对仪器的要求和经济成本都较高,我们研究了一种通过生成环肽晶体制备高纯度环肽单体的方法,以纯度不高的粗环肽为原料,特定质量体积比的热纯甲醇为溶剂溶解粗环肽,冷却静置后可得到纯度≥96%的环肽晶体,且无任何有机溶剂残留[41]。
目前已经有多种方法可以检测和鉴定亚麻籽提取物中的环肽,主要有质谱法(ESI-MS、ESI-MS-MS、ESI-TOF-MS、LC-MS)、圆二色谱(CD)、红外光谱(IR、FTIR)、高分辨率快速原子轰击质谱仪(HR-FABMS)、核磁共振(13C NMR,1HNMR)以及用高效液相分析氨基酸。ESI-MS和ESI-MS-MS具有样品制备简单、灵敏度高、动态范围大等优点,是分析环肽的首选方法。虽然MS和MS/MS的应用范围十分广泛,但这些方法只能提供未知化合物的分子质量信息,不能提供结构分析,并且确定氨基酸序列的能力可能有限。HR-FABMS可获得准分子离子峰用于分子式的测定。CD和NMR可以提供环肽在不同溶液中的构象。红外光谱确定了化合物中的某些官能团[30]。BREWSTER等[42]用核磁研究了CLA的构象,发现该环肽的主链为[1-9-NαC]-Ile-Leu-Val-Pro-Pro-Phe-Phe-Leu-Ile,溶液不含分子内氢键,他们测量了NH质子的交换及NH化学位移随温度的变化,发现7个NH质子中有5个暴露在溶剂中,其余2个交换速度较慢的质子可能位于环的内部。TANCREDI等[43]研究了环肽CLA在乙腈溶液中的离子络合能力,发现CLA具有与金属离子(Ba2+、K+、Na+、Mg+、Ca+)形成络合物的能力,其中与Ba2+的结合更紧密,这一发现表明环肽具有成为离子输送载体的潜力。MORITA等[33]和MATSUMOTO等[34]分别用二维核磁共振结合HR-FABMS、IR和氨基酸分析的方法鉴定了环肽B、C、D、E、F、G、H、I的结构。STEFANOWICZ[44]采用电喷雾电离质谱仪和中性损耗电喷雾串联质谱联用技术直接对亚麻籽提取物进行了分析,检测到CLA和CLB,此外,在三重四极杆质谱仪上进行中性损失扫描可以有效检测蛋氨酸氧化物和含蛋氨酸的环肽,该研究中还检测到少量含有蛋氨酸氧化物的环肽CLC、CLD、CLE和CLG。BRÜHL通过FT-IR、LC-MS、核磁共振和氨基酸分析确定了亚麻籽油中的苦味物质为含蛋氨酸亚砜的环状八肽CLE[36]。JADHAV等[37]通过HPLC-MS/MS、一维和二维核磁共振对从老化亚麻籽油中分离到的CLJ和CLK进行了表征。OKINYO-OWITI等[38]经HPLC-ESI-MS和LC-ESI-MS/MS鉴定了通过模拟移动床分离的环肽CLC和CLE。FOJNICA等[45]首次将Q Exactive混合型四级轨道质谱仪与反相高效液相色谱联用用于环肽的鉴定,共鉴定出15个环肽。现有环肽结构的鉴定方法较为成熟,但亚麻籽、亚麻籽油和亚麻籽粕中的亚麻籽环肽尚未完全发现。
4.3 环肽的功能活性
目前对于环肽的结构和理化特性方面的研究较多,关于其功能活性的研究也逐步增多。不同种类的环肽因其结构和氨基酸组成不同,其功能活性也不尽相同,主要集中在免疫抑制、抗炎、抗癌、抗疟疾等方面。
对于环肽的活性研究最早在免疫抑制方面。MORIA等[32-33]发现从亚麻籽中分离到的环肽CLB和CLE均对刀豆蛋白A诱导的淋巴细胞(IC50:44 ng/mL)生长有中等程度的抑制作用,且与环孢菌素A的作用相当。ZIMECKI等[46]将亚麻籽环肽CLA及其线性前体进行肽链的截断、氨基酸替换或多肽键的修饰等,将修饰后的多肽与环孢素A和CLA进行比较,发现与环孢素A和母体CLA相比,CLA类似物具有更好的溶解性和更低的毒性,且在改善自身免疫性和炎症性疾病方面可能具有治疗的潜力。KATARZY SKA等[47]合成了CLA的新类似物,对CLA结构的修饰形成了具有各种性质的免疫抑制物,其中合成的8号多肽具有很强的抗增殖活性,但与母肽CLA相比失去了抑制脂多糖诱导的肿瘤坏死因子TNF-α的能力。以上研究表明,改性后的亚麻籽源环肽在治疗免疫紊乱疾病和控制肿瘤的发展方面具有潜在的应用价值。不过这些研究仍然处于初步阶段,还需要进行更多的体外和体内的免疫学评估。
SKA等[47]合成了CLA的新类似物,对CLA结构的修饰形成了具有各种性质的免疫抑制物,其中合成的8号多肽具有很强的抗增殖活性,但与母肽CLA相比失去了抑制脂多糖诱导的肿瘤坏死因子TNF-α的能力。以上研究表明,改性后的亚麻籽源环肽在治疗免疫紊乱疾病和控制肿瘤的发展方面具有潜在的应用价值。不过这些研究仍然处于初步阶段,还需要进行更多的体外和体内的免疫学评估。
环肽具有抑制破骨细胞增殖和分化的作用。KANEDA等[48]发现环肽具有抑制破骨细胞分化的活性,尤其是环肽CLF、H和I的活性较强。随后他对这一作用机制进行了研究,发现CLF对抑制RANKL诱导的破骨细胞生成具有剂量依赖性,且无细胞毒性作用,具体机制为CLF通过下调c-fos基因的表达抑制破骨细胞的生成,从而导致巨噬细胞刺激因子诱导的破骨细胞中RANKL的受体RANK的下调表达。
环肽对癌细胞具有抑制作用。我们研究了亚麻籽环肽[1-9-NαC]-linusorb B3(CLA)和含有蛋氨酸残基的[1-9-NαC]-linusorb B2(CLB)对抗肿瘤活性,发现两种环肽均对人胃癌细胞有抑制作用,具体表现为细胞存活率下降、凋亡率增加,细胞形态改变和细胞凋亡相关蛋白的调控[49]。而[1-9-NαC]-linusorb B3比[1-9-NαC]-linusorb B2有更强的抑制作用,这两种环肽诱导胃癌细胞凋亡的机制可能也不同,[1-9-NαC]-linusorb B3诱导的细胞凋亡可能涉及内源性(线粒体)和外源性(死亡受体)途径的激活,而[1-9-NαC]-linusorb B2诱导的细胞凋亡可能依赖于外源性(死亡受体)途径的激活[48]。TANIGUCHI等[50]研究了抑制核因子受体激活剂κB配体信号通路的环肽对骨巨细胞瘤的抑制作用,发现环肽对建立的GCTB细胞系具有体外抗肿瘤作用。SUNG等[51]探究了[1-9-NαC]-linusorb B3(CLA)在胶质母细胞瘤细胞中的抗癌作用及其机制,发现CLA通过抑制抗凋亡基因的表达,以及促进促凋亡基因的激活,来诱导C6细胞的凋亡且抑制其增殖。此外,CLA还延缓了C6细胞的迁移和C6细胞中原癌基因及其下游信号的激活。以上研究表明,环肽在治疗癌症疾病方面将大有可为。
环肽具有抗炎作用,且不同结构的环肽作用效果不同。ALMOUSA等[52]发现环肽[1-9-NαC]-linusorb B3和[1-8-NαC],[1-MetO2]-linusorb B1(CLJ)可降低炎症细胞的跨膜电阻;环肽[1-9-NαC]-linusorb B3可显著增加PPAR- 基因和蛋白表达水平,而[1-8-NαC],[1-MetO2]-linusorb B1对这一基因和蛋白表达影响不明显。ALMOUSA等[52]还发现环肽混合物可抑制RAW264.7细胞ROS水平的增加,降低LPS诱导氧化应激产生的MDA。环肽及其类似物具有抗疟疾的活性,在BELL等[53]的研究中发现,环肽的疏水性有助于抑制人类疟原虫的生存,CLA对细胞膜的影响会产生抗疟活性,将其中的L-Phe替换成D-Phe其活性有所降低。
基因和蛋白表达水平,而[1-8-NαC],[1-MetO2]-linusorb B1对这一基因和蛋白表达影响不明显。ALMOUSA等[52]还发现环肽混合物可抑制RAW264.7细胞ROS水平的增加,降低LPS诱导氧化应激产生的MDA。环肽及其类似物具有抗疟疾的活性,在BELL等[53]的研究中发现,环肽的疏水性有助于抑制人类疟原虫的生存,CLA对细胞膜的影响会产生抗疟活性,将其中的L-Phe替换成D-Phe其活性有所降低。
LIU等[54]发现亚麻籽环肽还具有抗菌活性,CLB和CLF通过破坏细菌细胞膜从而对单核细胞增生性李斯特氏菌具有很强的抗菌活性,他们将环肽应用于牛肉的微生物污染研究中,发现环肽可以有效抑制核细胞增生性李斯特氏菌的生长从而延长牛肉的货架期。刘尊等[55]向宛氏拟青霉和黄曲霉的培养基中添加亚麻籽环肽混合物,发现环肽对霉菌的生长起到抑制作用,且对高温处理较为稳定,具有良好的热加工适应性,优于现有的抗菌肽,表明环肽有成为天然防腐剂的潜力。
对于亚麻籽环肽活性的研究主要集中在[1-9-NαC]-linusorb B3(CLA)和[1-9-NαC]-linusorb B2(CLB)中,且关于其免疫抑制及抗癌活性的研究较多,对于其他种类的环肽的活性作用也有待进一步的深入研究,尤其是环肽的抑菌活性是较为新颖的研究方向。
5 总结与展望
亚麻籽具有极高的营养保健价值。国内外对亚麻籽的研究主要集中于亚麻籽油及其不饱和脂肪酸、亚麻籽胶、木酚素,发现具有抗炎、抗癌、抗氧化、抗高血压和心血管疾病等多种功效。其中具有独特结构的亚麻籽环肽的研究也日益增多,然而现有对亚麻籽环肽的提取及纯化方法繁琐,得率较低,因此,亟需开发一种简单快速的亚麻籽环肽提取分离方法。亚麻籽环肽具有显著的抗肿瘤和抗炎功效,但发挥功效的具体作用机制尚未完全阐明。线性肽在进入机体后很快被胃肠道消化酶降解,在小肠中更多的以降解产物形式被吸收,而环肽在机体中经历了怎样的消化过程,是否能被机体吸收尚不清楚,与对应的线性肽相比,环肽的环状结构对肽的消化吸收有何影响,这些都值得进一步探究。
[1] SALEEM M H, ALI S, HUSSAIN S, et al.Flax (Linum usitatissimum L.):A potential candidate for phytoremediation? biological and economical points of view[J].Plants, 2020, 9(4):496.
[2] SHIM Y Y, GUI B, ARNISON P G, et al.Flaxseed (Linum usitatissimum L.) bioactive compounds and peptide nomenclature:A review[J].Trends in Food Science &Technology, 2014, 38(1):5-20.
[3] PARIKH M, NETTICADAN T, PIERCE G N.Flaxseed:Its bioactive components and their cardiovascular benefits[J].American Journal of Physiology-Heart and Circulatory Physiology, 2018, 314(2):H146-H159.
[4] PATEL A K, CHAUHAN A S, KUMAR P, et al.Emerging prospects of microbial production of omega fatty acids:Recent updates[J].Bioresource Technology, 2022, 360:127534.
[5] GONÇALVES N B, BANNITZ R F, SILVA B R, et al.α-Linolenic acid prevents hepatic steatosis and improves glucose tolerance in mice fed a high-fat diet[J].Clinics, 2018, 73:e150.
[6] BUCKNER A L, BUCKNER C A, MONTAUT S, et al.Treatment with flaxseed oil induces apoptosis in cultured malignant cells[J].Heliyon, 2019, 5(8):e02251.
[7] MAKI K C, EREN F, CASSENS M E, et al.ω-6 polyunsaturated fatty acids and cardiometabolic health:Current evidence, controversies, and research gaps[J].Advances in Nutrition, 2018, 9(6):688-700.
[8] RUTTING S, PAPANICOLAOU M, XENAKI D, et al.Dietary ω-6 polyunsaturated fatty acid arachidonic acid increases inflammation, but inhibits ECM protein expression in COPD[J].Respiratory Research, 2018, 19(1):1-12.
[9] WU J H Y, MARKLUND M, IMAMURA F, et al.Omega-6 fatty acid biomarkers and incident type 2 diabetes:Pooled analysis of individual-level data for 39 740 adults from 20 prospective cohort studies[J].The Lancet Diabetes &Endocrinology, 2017, 5(12):965-974. [10] SINGH K K, MRIDULA D, REHAL J, et al.Flaxseed:A potential source of food, feed and fiber[J].Critical Reviews in Food Science and Nutrition, 2011, 51(3):210-222.
[11] 张志颖, 张琳璐, 白英, 等.提取方法对亚麻籽胶提取率及理化性质的影响[J].食品与发酵工业, 2022, 48(18):219-226. ZHANG Z Y, ZHANG L L, BAI Y, et al.Effect of extraction methods on extraction rate and physical and chemical properties of flaxseed gum[J].Food and Fermentation Industries, 2022, 48(18):219-226.
[12] YANG C, HU C, ZHANG H, et al.Optimation for preparation of oligosaccharides from flaxseed gum and evaluation of antioxidant and antitumor activities in vitro[J].International Journal of Biological Macromolecules, 2020, 153:1107-1116.
[13] BONGARTZ U, HOCHMANN U, GRUBE B, et al.Flaxseed mucilage (IQP-LU-104) reduces body weight in overweight and moderately obese individuals in a 12-week, three-arm, double-blind, randomized, and placebo-controlled clinical study[J].Obesity Facts, 2022, 15(3):395-404.
[14] 禹晓, 黄沙沙, 聂成镇, 等.亚麻籽胶结构及功能应用研究进展[J].食品研究与开发, 2020, 41(1):212-217. YU X, HUANG S S, NIE C Z, et al.Research progress of the structure and functional application of flaxseed gum[J].Food Research and Development, 2020, 41(1):212-217.
[15] PULIGUNDLA P, LIM S.A review of extraction techniques and food applications of flaxseed mucilage[J].Foods, 2022, 11(12):1677.
[16] BASIRI S, HAIDARY N, SHEKARFOROUSH S S, et al.Flaxseed mucilage:A natural stabilizer in stirred yogurt[J].Carbohydrate Polymers, 2018, 187:59-65.
[17] DE PAIVA P H E N, CORREA L G, PAULO A F S, et al.Film production with flaxseed mucilage and polyvinyl alcohol mixtures and evaluation of their properties[J].Journal of Food Science and Technology, 2021, 58(8):3030-3038.
[18] 王维义, 许帅强, 何宏燕, 等.亚麻籽的营养成分及功能研究进展[J].中国油脂, 2020, 45(4):83-85. WANG W Y, XU S Q, HE H Y, et al.Progress in nutrients and function of flaxseed[J].China Oils and Fats, 2020, 45(4):83-85.
[19] AQEEL T, GURUMALLU S C, BHASKAR A, et al.Protective role of flaxseed lignan secoisolariciresinol diglucoside against lead-acetate-induced oxidative-stress-mediated nephrotoxicity in rats[J].Phytomedicine Plus, 2021, 1(3):100038.
[20] HAJIBABAIE F, ABEDPOOR N, SAFAVI K, et al.Natural remedies medicine derived from flaxseed (secoisolariciresinol diglucoside, lignans, and α-linolenic acid) improve network targeting efficiency of diabetic heart conditions based on computational chemistry techniques and pharmacophore modeling[J].Journal of Food Biochemistry, 2022, 46(12):e14480.
[21] GUO Y J, YANG X L, TSE T J, et al.Hypocholesterolemic efficacy of secoisolariciresinol diglucoside and its polymer in rat[J].Journal of Natural Products, 2021, 84(11):2845-2850.
[22] ROM S, ZULUAGA-RAMIREZ V, REICHENBACH N L, et al.Secoisolariciresinol diglucoside is a blood-brain barrier protective and anti-inflammatory agent:Implications for neuroinflammation[J].Journal of Neuroinflammation, 2018, 15(1):25.
[23] TANNOUS S, HAYKAL T, DHAINI J, et al.The anti-cancer effect of flaxseed lignan derivatives on different acute myeloid leukemia cancer cells[J].Biomedicine &Pharmacotherapy, 2020, 132:110884.
[24] CHANG V C, COTTERCHIO M, BOUCHER B A, et al.Effect of dietary flaxseed intake on circulating sex hormone levels among postmenopausal women:A randomized controlled intervention trial[J].Nutrition and Cancer, 2019, 71(3):385-398.
[25] DI Y Y, DE SILVA F, KROL E S, et al.Flaxseed lignans enhance the cytotoxicity of chemotherapeutic agents against breast cancer cell lines MDA-MB-231 and SKBR3[J].Nutrition and Cancer, 2018, 70(2):306-315.
[26] TAN N H, ZHOU J.Plant cyclopeptides[J].Chemical Reviews, 2006, 106(3):840-895.
[27] KAUFMANN H P, TOBSCHIRBEL A.Über ein oligopeptid aus leinsamen[J].Chemische Berichte, 1959, 92(11):2805-2809.
[28] 邹仙果. 亚麻籽环肽组成、氧化结构变化及其体外抗肿瘤抗炎活性研究[D].南昌:南昌大学, 2019. ZOU X G.Study on composition, oxidation structure and anti-tumor and anti-inflammatory activity of flaxseed cyclic peptide in vitro antitumor and anti-inflammatory activities of linusorbs in flaxseed(Linum usitatissimum L.)[D].Nanchang:Nanchang University, 2019.
[29] LANG T, FRANK O, LANG R, et al.Activation spectra of human bitter taste receptors stimulated with cyclolinopeptides corresponding to fresh and aged linseed oil[J].Journal of Agricultural and Food Chemistry, 2022, 70(14):4382-4390.
[30] SHIM Y Y, SONG Z L, JADHAV P D, et al.Orbitides from flaxseed (Linum usitatissimum L.):A comprehensive review[J].Trends in Food Science &Technology, 2019, 93:197-211.
[31] SHIM Y Y, YOUNG L W, ARNISON P G, et al.Proposed systematic nomenclature for orbitides[J].Journal of Natural Products, 2015, 78(4):645-652.
[32] MORITA H, SHISHIDO A, MATSUMOTO T, et al.A new immunosuppressive cyclic nonapeptide, cyclolinopeptide B from Linum usitatissimum L.[J].Bioorganic &Medicinal Chemistry Letters, 1997, 7(10):1269-1272.
[33] MORITA H, SHISHIDO A, MATSUMOTO T, et al.Cyclolinopeptides B - E, new cyclic peptides from Linum usitatissimum[J].Tetrahedron, 1999, 55(4):967-976.
[34] MATSUMOTO T, SHISHIDO A, MORITA H, et al.Cyclolinopeptides F-I, cyclic peptides from linseed[J].Phytochemistry, 2001, 57(2):251-260.
[35] STEFANOWICZ P.Detection and sequencing of new cyclic peptides from linseed by electrospray ionization mass spectrometry[J].Acta Biochimica Polonica, 2001, 48(4):1125-1129.
[36] BRÜHL L, MATTH US B, FEHLING E, et al.Identification of bitter off-taste compounds in the stored cold pressed linseed oil[J].Journal of Agricultural and Food Chemistry, 2007, 55(19):7864-7868.
US B, FEHLING E, et al.Identification of bitter off-taste compounds in the stored cold pressed linseed oil[J].Journal of Agricultural and Food Chemistry, 2007, 55(19):7864-7868.
[37] JADHAV P D, OKINYO-OWITI D P, AHIAHONU P W K, et al.Detection, isolation and characterisation of cyclolinopeptides J and K in ageing flax[J].Food Chemistry, 2013, 138(2-3):1757-1763.
[38] OKINYO-OWITI D P, BURNETT P G G, REANEY M J T.Simulated moving bed purification of flaxseed oil orbitides:Unprecedented separation of cyclolinopeptides C and E[J].Journal of Chromatography B, 2014, 965:231-237.
[39] BURNETT P G G, JADHAV P D, OKINYO-OWITI D P, et al.Glycine-containing flaxseed orbitides[J].Journal of Natural Products, 2015, 78(4):681-688.
[40] LIU X, CAI Z, LEE W J, et al. A practical and fast isolation of 12 cyclolinopeptides (linusorbs) from flaxseed oil via preparative HPLC with phenyl-hexyl column[J]. Food Chemistry, 2021, 351:129318.
[41] 李红艳, 邓泽元, 邹仙果.一种通过生成环肽晶体制备高纯度环肽单体的方法:CN109438562B[P].2021-09-28. LI H Y, DENG Z Y, ZOU X G.A method for preparing high-purity cyclolinopeptide monomers by generating cyclolinopeptide crystals:CN109438562B[P].2021-09-28.
[42] BREWSTER A I, BOVEY F A.Conformation of cyclolinopeptide a observed by nuclear magnetic resonance spectroscopy[J].Proceedings of the National Academy of Sciences of the United States of America, 1971, 68(6):1199-1202.
[43] TANCREDI T, BENEDETTI E, GRIMALDI M, et al.Ion binding of cyclolinopeptide A:An NMR and CD conformational study[J].Biopolymers, 1991, 31(6):761-767.
[44] STEFANOWICZ P.Electrospray mass spectrometry and tandem mass spectrometry of the natural mixture of cyclic peptides from linseed[J].European Journal of Mass Spectrometry, 2004, 10(5):665-671.
[45] FOJNICA A, LEIS H J, MURKOVIC M.Identification and characterization of the stability of hydrophobic cyclolinopeptides from flaxseed oil[J].Frontiers in Nutrition, 2022, 9:903611.
[46] ZIMECKI M, KACZMAREK K.Effects of modifications on the immunosuppressive properties of cyclolinopeptide A and its analogs in animal experimental models[J].Molecules, 2021, 26(9):2538.
[47] KATARZY SKA J, ARTYM J, KOCHANOWSKA I, et al.4-Methylpseudoproline analogues of cyclolinopeptide A:Synthesis, structural analysis and evaluation of their suppressive effects in selected immunological assays[J].Peptides, 2020, 132:170365.
SKA J, ARTYM J, KOCHANOWSKA I, et al.4-Methylpseudoproline analogues of cyclolinopeptide A:Synthesis, structural analysis and evaluation of their suppressive effects in selected immunological assays[J].Peptides, 2020, 132:170365.
[48] KANEDA T, NAKAJIMA Y, KOSHIKAWA S, et al.Cyclolinopeptide F, a cyclic peptide from flaxseed inhibited RANKL-induced osteoclastogenesis via downergulation of RANK expression[J].Journal of Natural Medicines, 2019, 73(3):504-512.
[49] ZOU X G, HU J N, LI J, et al.iCellular uptake of[1-9-NαC]-linusorb B2 and[1-9-NαC]-linusorb B3 isolated from flaxseed, and their antitumor activities in human gastric SGC-7901 cells[J].Journal of Functional Foods, 2018,48:692-703.
[50] TANIGUCHI Y, YAMAMOTO N, HAYASHI K, et al.Anti-tumor effects of cyclolinopeptide on giant-cell tumor of the bone[J].Anticancer Research, 2019, 39(11):6145-6153.
[51] SUNG N Y, JEONG D, SHIM Y Y, et al.The anti-cancer effect of linusorb B3 from flaxseed oil through the promotion of apoptosis, inhibition of actin polymerization, and suppression of src activity in glioblastoma cells[J].Molecules, 2020, 25(24):5881.
[52] ALMOUSA A A, MEURENS F, KROL E S, et al.Linoorbitides and enterolactone mitigate inflammation-induced oxidative stress and loss of intestinal epithelial barrier integrity[J].International Immunopharmacology, 2018, 64:42-51.
[53] BELL A, MCSTEEN P M, CEBRAT M, et al.Antimalarial activity of cyclolinopeptide A and its analogues[J].Acta Poloniae Pharmaceutica, 2000, 57:134-136.
[54] LIU Y J, LIU Y, LI P P, et al.Antibacterial properties of cyclolinopeptides from flaxseed oil and their application on beef[J].Food Chemistry, 2022, 385:132715.
[55] 刘尊, 汪勇, MARTIN J T REANEY, 等.亚麻籽环肽混合物抑制霉菌生长繁殖活性[J].食品与发酵工业, 2018, 44(3):30-34. LIU Z, WANG Y, REANEY M J T, et al.Antifungal activity of flaxseed cyclolinopeptides mixtures[J].Food and Fermentation Industries, 2018, 44(3):30-34.