糖尿病是由胰腺分泌功能缺陷或胰岛素作用缺陷引起的,以糖升高、糖代谢紊乱为特征的内分泌代谢性疾病,也是继心血管、肿瘤、艾滋病之后第四大易致死性疾病。据《国际糖尿病联盟》统计,2021年全球糖尿病约达到5.37亿成年人(20~79岁),其中有670万人死亡(每5 s就有1人死亡),预计2045年成年糖尿病患者数将上升到7.83亿[1]。近年来,为适应新的糖尿病防治形式,进一步优化糖尿病的治疗策略,众多医学研究者在开发防治糖尿病的新药方面进行了较为深入的研究,基于患病人群对天然植物成分接受程度较高,一些具有显著降糖活性的天然产物成为目前医学研究的关注对象。
辣木(Moringa oleifera),又称鼓槌树,为辣木科辣木属多年生植物,是印度北部喜马拉雅山南麓的速生树种,其根、茎、叶、种子等既可作为蔬菜食用,又极具药用价值,有“奇迹之树”之称[2]。20世纪60年代,我国云南以药用植物的身份引种辣木,随后台湾、广东、广西以及福建等地陆续设立辣木种植基地。随着辣木营养价值和药用价值的凸显,国家对辣木的引种培育以及研究开发表现出高度的重视。2006年10月,我国“十一五”规划将辣木作为“商品林定向培育及高效利用关键技术研究”重点研究对象之一;2012年11月,辣木被我国卫生部批准为新资源食品[3]。至此,辣木产业逐渐兴起,而与之相关的科学研究也逐渐开展。研究表明,辣木叶提取物药理作用广泛,在降脂降糖、抗癌保肝、抗氧化等方面均有显著活性,尤其在防治糖尿病方面具有显著作用[4-6]。较多的动物实验表明辣木叶提取物能够通过改善糖代谢、修复损伤的肝脏和胰腺组织结构、改善糖尿病大鼠的肝肾功能等,进而改善血液中胰岛素、甘油三酯(triglyceride,TG)、胆固醇(total cholesterol,TC)和丙二醛(malondialdehyde,MDA)水平,最终达到降低血糖的目的[7-9]。同时,也有研究表明辣木叶的抗糖尿病效果源于其所含的黄酮、蛋白或多糖等活性成分,均能显著降低糖尿病小鼠的血糖水平[10-13],董笑克等[14]和陈逸鹏等[15]也对辣木叶的抗糖尿病效果及相关机制进行了综述,但目前尚无针对辣木叶中具体活性成分抗糖尿病效果及作用机制的系统综述。基于此,为进一步评估辣木叶中各活性成分的抗糖尿病潜力,从其改善胰岛素抵抗、保护胰岛β细胞、抑制肝脏糖异生、促进肝糖原合成、增强抗氧化作用以及降低血脂和TC等方面进行系统阐述,对其抗糖尿病效果、作用途径及相关机制进行综述,以期为进一步研究开发降糖新药或辅助药物提供理论参考。
1 辣木叶及其活性成分抗糖尿病效果
1.1 辣木叶抗糖尿病效果
1.1.1 动物及细胞实验
大量动物实验表明辣木叶粉或其提取物具有显著降糖作用,通过对链脲佐菌素(streptozotocin,STZ)或四氧嘧啶诱导的糖尿病大鼠灌胃治疗,该糖尿病大鼠的糖耐量、血清胰岛素以及糖原水平显著增加,TC水平降至正常值,胰岛β细胞得到一定修复,且其降糖效果甚至优于一些降糖药物(格列本脲和格列吡嗪)[16]。WATERMAN 等[17]以高脂饮食诱导的小鼠为模型,饲喂5%(质量分数)辣木叶浓缩液(66 mg/kg BW)发现其胰岛素信号蛋白水平更高,表明辣木叶浓缩液不但能增加胰岛素信号,也能提高胰岛素敏感性,改善胰岛素抵抗;TOMA等[7]通过辣木叶提取物给予STZ诱导的糖尿病大鼠,14 d后发现辣木叶提取物能够显著降低糖尿病大鼠的血糖水平,改善其肝肾功能,且对损伤的胰岛也具有逆转作用;也有研究表明,辣木叶提取物能够改善四氧嘧啶诱导的糖尿病大鼠血清中的葡萄糖、TG、TC和MDA水平,增加血液中胰岛素水平,并能够对损伤的肝脏和胰腺的组织结构具有一定的修复作用[8-9]。
1.1.2 临床实验
相关临床试验表明,辣木叶粉或其提取物能够明显降低Ⅱ型糖尿病患者的餐后血糖浓度以及糖化血红蛋白(glycosylated hemoglobin,HbA1c)的水平[18]。国外研究者将辣木叶粉制备为药片或胶囊,通过对II型糖尿病患者的持续治疗后发现,受试患者的空腹血糖(fasting blood glucose,FBG)和HbA1c均有显著下降[19];KUMARI等[20]让55名40岁以上的Ⅱ型非胰岛素依赖型糖尿病(non-insulin-dependent diabetes mellitus,NIDDM)患者每天分别口服8 g的辣木叶粉和6 g印度苦楝树籽粉,持续服用40 d后发现辣木叶粉可使受试者的FBG和血脂水平降低1%,并能改善胰岛素依赖型糖尿病和NIDDM患者的糖耐量和糖尿病症状,且其效果明显优于印度苦楝树种子;ANGRAINIS等[21]将16例II型糖尿病患者分为干预组(8人)和对照组(8人),干预组给与辣木叶汤剂250 mL,持续一周后发现干预组血糖水平下降显著,效果优于常规降糖药物。与此同时,国内学者也相继开展了关于辣木叶粉降糖作用的研究,如彭亮等[22]将辣木叶与桑叶、西洋参按比例复配,研究此药剂对 45~65 岁中老年人群血糖的影响,结果表明此复合药剂对高血糖各项临床症状均有改善作用,FBG、餐后2 h血糖及HbA1c均显著降低,此现象表明作为主要成分的辣木叶或起到关键作用,但不能排除其他配伍成分的功效,辣木叶的降糖功效仍然需要进一步确定。
除针对糖尿病患者影响的研究,相关研究同时也调查了辣木叶粉对健康人群相关糖尿病指标的影响。如KUSHWAHA等[23]通过一项针对无糖尿病的绝经后妇女进行的研究发现,绝经女性在3个月内每天口服7 g辣木叶粉可显著降低FBG水平并增加HbA1c值,但不排除背景饮食对该实验结果的影响;此外,一些研究者将辣木叶添加在饮料、曲奇饼干和保健软糖等食品中研究其抗糖尿病效果,如AHMAD等[24]研究了辣木叶粉饼干对餐后血糖的影响,结果表明该辣木叶饼干在30和45 min时可显著降低餐后血糖浓度,且不会对受试者的胃肠健康产生任何不利影响。但此类研究在样本数量、设计方案和持续时间等方面均有一定的局限性,仍需更加科学和系统的研究体系对上述结果进行论证。
1.2 辣木叶活性成分抗糖尿病效果
随着研究的逐渐深入,辣木叶中所含活性成分也成为相关学者关注的重点。如陈瑞娇等[10]的研究表明辣木叶中的黄酮能产生与药物磷酸西格列汀相似的作用,通过减少β细胞的调亡,保护胰岛β细胞,糖尿病大鼠胰岛素分泌量增加,达到降低血糖的效果,其降血糖效果优于消渴丸药物,并且发现该黄酮对正常小鼠的血糖水平无显著作用;同样,辣木叶中的蛋白具有显著降低四氧嘧啶诱导的糖尿病小鼠血糖的效果[13];汪芳等[25]的研究结果也表明辣木叶多糖具有降血糖的作用,能够改善胰岛素抵抗现象且无明显的毒副作用。
综上,大量的动物实验和临床实验均表明辣木叶粉或其提取物具有抗糖尿病作用,具备作为降糖药物或辅助药物的潜力,一些研究进一步探究表明其降糖效果或源于辣木叶中所含的黄酮、多糖或蛋白等活性成分。综合现有研究(如表1所示),较多文献均表明辣木叶显著的抗糖尿病作用或来源于其中所含的黄酮物质,少量的文献表明辣木蛋白或多糖同样具有改善糖代谢和降血糖效果,或起到辅助治疗糖尿病的作用,推测辣木叶黄酮或为优势降糖成分。
表1 辣木叶及其活性成分降糖作用
Table 1 Hypoglycemic effect of Moringa oleifera leaf and its active ingredient

类型功效作用作用对象参考文献辣木叶粉改善糖耐量,促进胰岛素分泌以及肝糖原合成,改善胰岛素抵抗,且能够修复受损的肝脏和胰腺组织STZ或四氧嘧啶诱导的糖尿病大鼠[8-9, 16-17]降低血糖水平,改善胰岛素抵抗,增加总抗氧化能力,上调过氧化氢酶及其mRNA的表达STZ诱导的糖尿病兔[26]提高SD大鼠血液及肝脏的抗氧化活性,调节甲状腺激素分泌以及肝脂的过氧化作用SD大鼠[27]显著降低糖尿病患者FBG、餐后血糖以及HbA1c水平,改善糖耐量和糖尿病相关症状II型糖尿病患者(胰岛素依赖型和非胰岛素依赖型)[18-21]血浆葡萄糖水平均下降,但其血浆胰岛素含量却未发生变化NIDDM患者[28]显著降低FBG、餐后血糖水平,但却会增加HbA1c水平无糖尿病的绝经后妇女[23-24]血浆胰岛素水平显著增加,与辣木叶服用剂量正相关,血糖水平显著下降健康人群[29]辣木叶水提物修复受损或退化的胰岛β细胞,并能减少丙酮酸羧化酶的表达,刺激胰岛素分泌,抑制肝脏糖异生和肝糖原分解,抑制蛋白质氧化和蛋白质交联STZ或四氧嘧啶诱导的糖尿病大鼠[30-31]辣木叶非水提物(甲醇、乙醇、石油醚等溶剂)血清胰岛素分泌量、糖原合成酶活性和肝糖原合成显著增加,胰岛素敏感性增强,血糖值、胆固醇和低密度脂蛋白胆固醇(low-density lipoprotein choles-terol, LDL-C)含量降低,保护其胰岛和肝脏组织,并增加肠道菌群多样性,调节大鼠肠道菌群的种类、结构分布,从而延缓肠道对葡萄糖的吸收STZ或四氧嘧啶诱导的糖尿病大鼠[32-36]辣木叶黄酮显著降低血清中TC、TG、LDL-C的含量,提高超氧化物歧化酶(superoxide dismutase,SOD)的活力来激发抗氧化酶的活力,恢复以及维持肝功能的稳定,改善高血脂症,并能刺激胰岛素分泌,阻止β细胞的调亡,促进β细胞的增殖,降血糖效果优于消渴丸药物,但对正常小鼠的血糖水平无显著作用正常小鼠、STZ诱导糖尿病大鼠和高脂膳食诱导小鼠[10-11, 32, 37-38]辣木叶多糖改善机体葡萄糖耐受量,调控机体胰岛素抵抗,促进肝糖原合成,抑制肝糖原分解,拮抗机体氧化应激,调控机体脂质代谢以及保护并修复胰岛组织,且降血糖活性可与二甲双胍相媲美体外抗氧化试验,STZ诱导糖尿病大鼠[12, 25, 39]辣木叶蛋白降低血糖水平四氧嘧啶诱导糖尿病小鼠[13]辣木叶多酚具有较强的抗氧化活性(还原力、对DPPH自由基、超氧阴离子自由基的清除能力均高于维生素C),降低小鼠体内脂质过氧化物的含量,减少谷胱甘肽浓度,并增加肝肾SOD和过氧化物酶(peroxisome,POD)的活性,并能够降低血浆低密度脂蛋白的浓度,抑制TC的吸收,增加血清TC以中性类固醇的方式从粪便中排出体外试验、健康小鼠[40]
2 辣木叶降糖机制
2.1 改善胰岛功能
2.1.1 修复受损胰岛β细胞及促进胰岛素分泌
糖尿病的发病机制可归纳为不同病因导致胰岛β细胞分泌缺陷及(或)周围组织胰岛素作用不足。胰岛素分泌缺陷可由于胰岛β细胞组织内兴奋胰岛素分泌,及合成的信号在传递过程中的功能缺陷,亦可由于自身免疫、感染、化学毒物等因素导致胰岛β细胞破坏,数量减少。研究表明,胰岛β细胞的损伤主要是由于机体内氧化应激作用失衡,产生过多的氧自由基攻击胰岛β细胞,以及环境中有毒物质的摄入所致,进而导致Ⅰ型糖尿病或者Ⅱ型糖尿病的发生[41-42]。YASSA等[43]通过辣木叶提取物治疗糖尿病大鼠,降糖作用显著,且对糖尿病大鼠受损或退化的胰岛β细胞具有显著的修复效果,并能减少丙酮酸羧化酶的表达,用Gomori染色法观察得到被修复后的胰岛β细胞的形态、大小和密度等与正常的大鼠相差无几。但辣木叶如何降低胰岛细胞损伤的机制尚不明确,可能与辣木叶总黄酮中的主要成分之一山奈酚有关,相关研究表明山奈酚具有改善慢性高血糖受损的胰岛β细胞活力和胰岛素分泌功能,其机制可能与Akt信号通路(刺激胰岛素分泌)、cAMP/PKA和PI3K/Akt信号通路(阻止β细胞的调亡)的激活,以及上调FoxO1信号通路中胰岛素受体2(insulin receptor substrate 2,IRS2)的表达(促进β细胞的增殖)相关,且通过阳性对照得出山奈酚的降糖作用与格列本脲相当的结论[11,29,44-45]。
此外,辣木叶对胰岛素的分泌也具有促进作用,如OLAYAKI等[32]发现辣木叶可以增加四氧嘧啶腹腔注射诱导糖尿病大鼠的血清胰岛素水平,认为辣木叶具有增加胰岛素释放的作用;ANTHANONT等[30]招募10名健康志愿者,连续口服一周以上的辣木叶粉剂,发现受试者的平均血浆胰岛素水平显著增加,且与辣木叶服用剂量呈正相关,表明辣木叶促进胰岛素分泌或为其降糖的作用机制之一。但也有一些研究结论与此相悖,WILLIAM等[28]通过在NIDDM病人的早餐中加入 50 g辣木叶粉(试验餐),并与食用标准餐的病人对照,发现试验组病人的餐后1和2 h的血浆葡萄糖水平均下降,但其血浆胰岛素含量却未发生变化,这一结果又表明辣木叶粉的降糖作用与胰岛素分泌量的增加无关,其原因或许能用辣木叶在健康和患病人群中存在不同的作用机制进行部分解释,又或者尚存在其他未知机制。
2.1.2 改善胰岛素抵抗
Ⅱ型糖尿病约占糖尿病总数的90%以上,如何降低Ⅱ型糖尿病人发病率成为防治糖尿病的关键,而胰岛素抵抗在Ⅱ型糖尿病发病中起着至关重要的作用,改善胰岛素抵抗有助于改善血糖控制,从而降低糖尿病及其并发症发生的风险。现代胰岛素抵抗的概念是泛指胰岛素在周围组织摄取和清除葡萄糖的作用减弱,糖尿病患者体内需要分泌超过正常量的胰岛素,才能在胰岛素的效应器官产生正常的生理效应,其主要的效应器官是肝脏、骨骼肌及脂肪组织。有胰岛素抵抗时,效应器官需要更多的胰岛素才能产生正常的生理效应,所以改善胰岛素抵抗,提高其敏感性无疑是改善Ⅱ型糖尿病的重要手段。
相关报道表明辣木叶及其提取物具有改善胰岛素抵抗、增加胰岛素分泌,并能提高酵母细胞葡萄糖耐量和葡萄糖摄取率的作用,推测辣木叶中所含的酚酸、黄酮、蛋白质及多糖等活性物质或为主要降糖成分,其主要机制可能是由于上述活性成分对葡萄糖稳态造成显著影响,改善了胰岛β细胞的数量和功能,从而提高胰岛素对外周组织的影响[46-47]。如WATERMAN等[17]研究发现高脂饮食中加喂5%(质量分数)辣木叶浓缩液的小鼠与单喂高脂饮食的小鼠相比,其胰岛素信号的蛋白水平显著升高,表明辣木叶能增强胰岛素信号,提高胰岛素敏感性;SHAAT等[26]研究发现在高脂饲料中添加5%~10%(质量分数)辣木叶可以显著降低STZ(35 mg/kg BW)与高脂饮食联合诱导的糖尿病模型兔的血糖值、胰岛素抵抗指数和MDA含量,增加总抗氧化能力、过氧化氢酶(catalase, CAT)及其mRNA的表达;一些研究者利用乙醇提取辣木叶中的活性成分,饲喂STZ诱导糖尿病模型大鼠发现高剂量辣木叶乙醇提取物(500 mg/kg BW,2周)可影响患病大鼠的摄食行为,保护其胰岛和肝脏组织,改善胰岛素抵抗[33];HIDAYATI等[34]研究发现不同剂量的辣木叶乙酸乙酯提取物(12.5、25和50 mg/kg)可以显著降低STZ(65 mg/kg BW)诱导的2型糖尿病大鼠血糖值、TC和LDL-C含量,显著增加骨骼肌和肝脏中葡萄糖转运蛋白4(glucose transporter 4,GLUT4)的表达,表明其可以提高GLUT4表达增强胰岛素敏感性,进一步验证了适量辣木叶提取物可显著增强胰岛素敏感性。
此外,相关研究表明辣木叶中分离出来的多酚、黄酮和多糖等多种活性成分均可调控胰腺、肝脏、骨骼肌、白色脂肪等主要效应器官中的信号通路,提高周围组织对胰岛素的敏感性,进而起到治疗糖尿病的作用,也可充当抗氧化剂、酶抑制剂、受体激动剂或拮抗剂发挥作用[48-49]。
2.2 调控糖代谢
糖尿病是以糖代谢紊乱为主要表现的内分泌代谢性疾病,调控糖代谢也成为防治糖尿病的关键途径之一,辣木叶活性成分对糖异生、糖原合成以及肠道对碳水化合物吸收的影响成为众多医学研究者所关注的话题。肝脏是糖异生的主要器官,肝糖原的分解与合成是调节血糖的重要途径之一,当机体内胰岛素分泌下降或出现胰岛素抵抗时,此时肝糖原的合成水平下降,抑制肝糖原分解作用减弱,从而导致肝糖原含量下降,血糖水平上升[50]。研究表明辣木叶提取物能下调磷酸烯醇型丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)和葡萄糖-6-磷酸酶(glucose-6-phosphates,G6Pase)mRNA表达,通过阻断肝脏糖异生过程中的限速酶发挥作用,且提取物中含有的绿原酸及异硫氰酸盐可以减少肝脏糖异生和肝糖原分解,从而降低机体的血糖水平[17],其阻断细胞中的葡萄糖产生作用显著,效果甚至优于二甲双胍[51-52];OLAYAKI等[32]使用2种不同剂量的辣木叶乙醇提取物(300和600 mg/kg BW)对四氧嘧啶诱导的糖尿病大鼠(120 mg/kg BW)进行治疗,灌胃6周后发现糖尿病大鼠的血清胰岛素显著提高(1.3~1.7倍),糖原合成酶活性和肝糖原合成显著增加,从而推测辣木叶提取物的降糖作用机制可能是通过上调肝脏中葡萄糖转运蛋白2(glucose transporter 2,GLUT2)的表达,刺激胰岛素的释放,从而增加葡萄糖的摄取和糖原的合成,最后达到降糖目的。相关报道表明山奈酚可通过调控糖酵解酶和糖异生酶,进而改善STZ糖尿病组织中的葡萄糖稳态,并且在100 mg/kg BW的剂量时,山奈酚可达到与降糖药物(格列本脲)等同的降糖效果,而辣木叶中恰恰含有丰富的此种黄酮类物质——山奈酚[45],其可能是上述作用的主要活性成分。
此外,辣木叶活性成分还可以通过以下几种途径来调控肠道对碳水化合物的吸收,从而达到降低血糖的作用:(1)增加肠道菌群多样性,调节大鼠肠道菌群的种类结构分布,并能显著抑制肠道α-葡萄糖苷酶,延缓肠道对碳水化合物的消化吸收,从而降低餐后血糖,防止糖尿病患者出现餐后的血糖急剧上升[35];(2)促进胰岛素抵抗细胞(IR-HepG2)对葡萄糖的吸收,其意义在于能够有效缓解胰岛素抵抗,从而起到降低血糖的作用[53];(3)抑制人类的唾液α-淀粉酶,通过抑制淀粉的分解,进而减少葡萄糖在肠道的吸收,降低血糖水平[54];(4)辣木叶提取物中的酚类、黄酮类、鞣质可能通过抑制小肠蔗糖酶、胰α-淀粉酶的活性起到降糖的作用[14]。
2.3 抗氧化作用
氧化应激是糖尿病及其相关并发症发病的主要致病机制之一,抑制氧化应激过程则能有效防止糖尿病及其并发症的发生发展,较多的体内外实验研究证实了辣木叶及其提取物具有较强的抗氧化活性[11]。如RENGARAJAN等[36]研究发现口服辣木叶乙醇提取物(200 mg/kg BW)可增强SOD、谷胱甘肽过氧物酶(glutathione peroxidase,GSH-Px)和CAT活性,抑制白细胞介素-1、天然肿瘤坏死因子α和细胞介素-6炎症因子表达,暗示糖尿病治疗效应与增强抗氧化水平和抑制炎症因子表达有关。相关动物实验也验证了这一结果,如NUNTHANAWANICH 等[31]通过体外实验表明辣木叶水提物能够有效抑制糖化反应中还原性单糖诱导的晚期糖基化终末产物的形成,以及抑制蛋白质氧化和蛋白质交联;张幸怡等[27]发现辣木叶粉可明显提高SD大鼠血液及肝脏的抗氧化活性,调节甲状腺激素分泌以及肝脂的过氧化作用,其作用机理是辣木叶中含有CAT和SOD两种抗氧化酶,SOD能高效清除小鼠体内的氧自由基,CAT则通过催化小鼠体内的脂类过氧化物分解,防止羟自由基的产生,降低MDA含量,从而达到抗氧化的目的。
随着研究的进一步深入,辣木叶中所含的黄酮、多糖以及多酚类的抗氧化作用也被相续报道。如孙朦等[37]通过FRAP法、Feton法、邻苯三酚法等对辣木叶中总黄酮的抗氧化能力进行测定,得出黄酮不仅能够提高构成抗氧化剂防御系统有关酶的生物活性,而且清除羟自由基的能力比维生素C更强,将该黄酮作用于正常小鼠和四氧嘧啶诱导的糖尿病小鼠后发现,正常小鼠的血糖水平不受影响,但糖尿病小鼠的血糖水平却显著下降,推测其作用机理可能是辣木叶中黄酮的抗氧化作用导致SOD活力提高以及MDA含量减少,使胰岛β细胞免于氧化应激和凋亡的损伤且对受损的胰岛β细胞进行修复,增强胰岛素的分泌而达到降糖的目的;梁鹏等[39]从辣木茎叶干粉中提取出水溶性多糖并对其体外抗氧化能力进行了评估,发现辣木多糖在低浓度(0.1~6 mg/mL)下对羟自由基和超氧阴离子的清除作用效果显著;裴斐等[40]通过体外试验对比辣木叶多酚与维生素C的抗氧化作用,充分地证明了辣木叶多酚具有较强的抗氧化活性,其还原力,以及对DPPH自由基、超氧阴离子自由基的清除能力均高于维生素C,并通过动物实验进一步验证辣木叶中的多酚类物质可以降低小鼠体内脂质过氧化物的含量,减少谷胱甘肽浓度,并增加肝肾SOD和POD的活性。
2.4 降血脂和降胆固醇
高脂血症是代谢综合征的高危因素之一,Ⅱ型糖尿病患者常见的血脂异常为TG和TC的升高并伴随高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)水平的下降,较高的TC、TG、LDL-C含量与较低的HDL-C含量可导致高血脂症的发生,继而又会诱发脂肪肝的产生,因此改善高脂血症和脂肪肝在防治糖尿病方面具有重要意义[55-57]。辣木叶提取物在抗高脂血症以及改善脂质代谢方面效果显著,如沙子珺等[58]研究证实了辣木叶水提物能够显著降低高脂饲料诱导的高脂血症金黄地鼠血脂水平,改善肝脏病理变化,发挥抗高脂血症作用;ATTAKPA等[59]以高脂饮食诱导的肥胖小鼠为模型,验证了辣木叶提取物可以通过提高小鼠的肝脏过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptor α,PPAR-α)水平、降低固醇调节元件结合蛋白-1(sterol regulatory element binding protein-1,SREBP-1)水平,使脂肪酸氧化增加、肝脏脂质储存减少,从而改善肝脏脂肪变性,降低血糖水平,但究竟是辣木叶提取物中的何种成分起到上述作用,相关研究者也对此进行了深入探究。如孙朦等[38]利用辣木叶黄酮治疗高脂膳食小鼠,结果表明小鼠血清中TC、TG、LDL-C的含量显著降低,HDL-C含量和SOD的活性得到显著提升,血液黏稠及TC的积累均显著降低,高血脂症得到很好的改善。
上述研究表明辣木叶提取物具有显著的降低血脂和TC的作用,对糖尿病患者高血脂并发症的预防和改善具有重要的研究意义,黄酮或为主要调控物质,其相关调控机制可能与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、腺苷酸激活蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)及JAK激酶(janus kinase,JAK)-STAT等信号通路相关,推测癌基因PIK3CB、PIK3CA、AKT1、细胞凋亡相关半胱氨酸肽酶(CASP3)、B淋巴细胞瘤-2基因(BCL2)可能为其关键靶点,但具体的作用机制尚未明确。
3 结论
综上,辣木叶活性成分降糖效果显著,对糖尿病及其并发症兼具预防和改善的功效,其作用机制具有多途径、多靶点、多环节的特点,且对糖尿病患者和健康人群的作用机制或有所不同。结合现有文献,归纳辣木叶活性成分的抗糖尿病作用机理如图1所示,辣木叶活性成分(黄酮、蛋白和多糖等)通过3条作用途径体现其抗糖尿病效果:(1)作用于胰腺,通过调控Akt信号通路(刺激胰岛素分泌)、cAMP/PKA和PI3K/Akt信号通路(阻止β细胞的调亡)和上调FoxO1信号通路中胰岛素受体2(insulin receptor substrate 2,IRS2)的表达(促进β细胞的增殖)改善胰岛功能;(2)作用于肝脏,通过上调PPAR-α(改善肝脏病变)和GLUT2 mRNA表达(促进糖原合成),下调SREBP-1(改善脂肪变性)、PEPCK和G6Pase mRNA表达(抑制糖异生),从而改善肝功能及糖代谢;(3)作用于肠道,通过抑制唾液α-淀粉酶、胰α-淀粉酶、肠道α-葡萄糖苷酶和蔗糖酶活性,进而抑制淀粉的分解和肠道对糖吸收,并通过增加菌群多样性以及调控菌群紊乱的作用改善肠道功能。最终,通过上述3条作用途径达到抗糖尿病的目的。
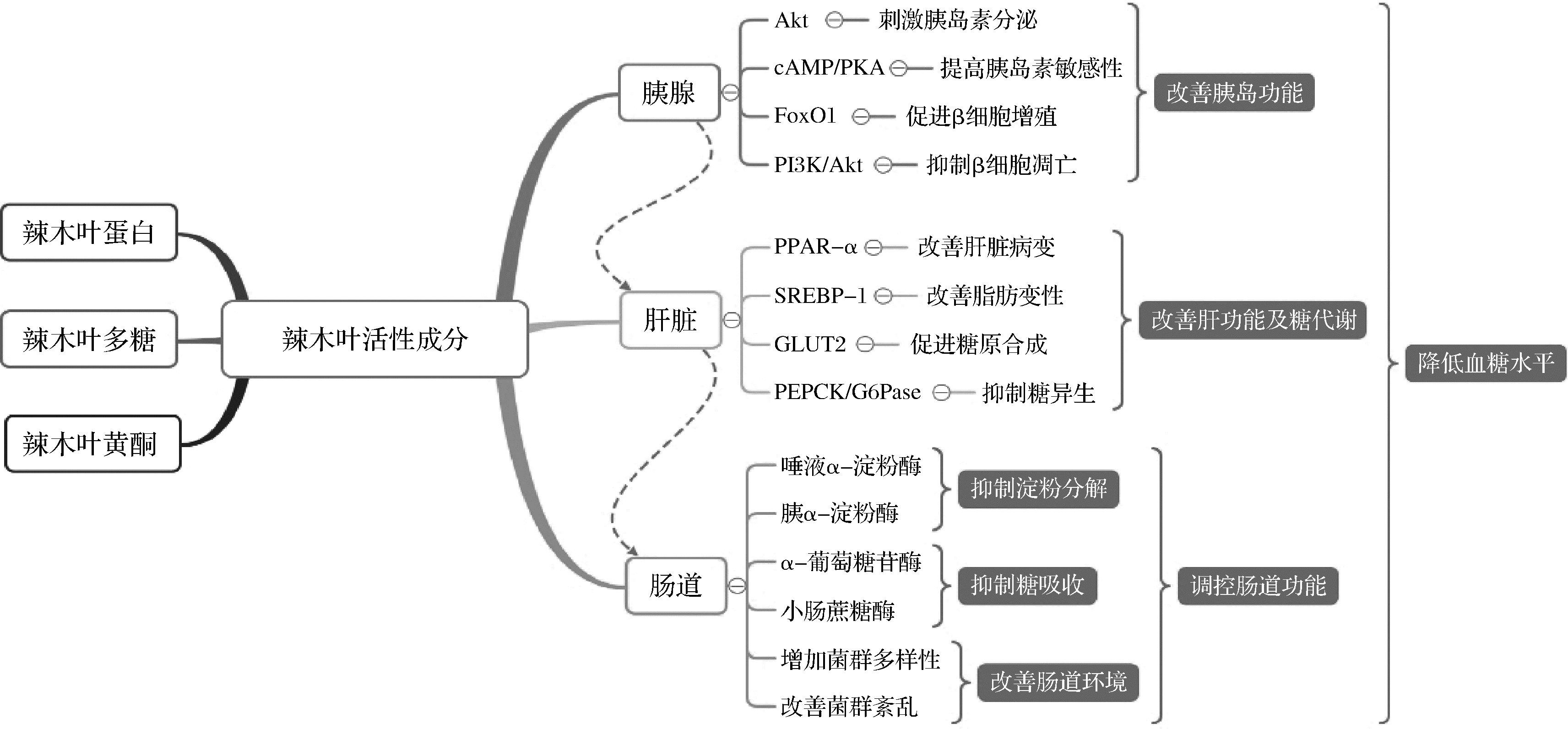
图1 辣木叶抗糖尿病作用机理路线图
Fig.1 The hypoglycemic mechanism roadmap of M. oleifera leaf
目前,随着辣木资源的开发利用及其相关的研究愈发深入,其降糖效果也被市场所看好,具有降糖功效的辣木叶茶、辣木叶胶囊以及辣木叶精片等产品陆续进入市场,彰显了辣木叶在抗糖尿病以及缓解其并发症中的防治潜力,但仍然存在几个关键问题有待进一步研究:(1)基于糖尿病患者以及健康人群服用辣木叶的实验结果,是否针对2种人群分别存在不同的作用机制尚未可知;(2)辣木叶降糖途径繁多,各途径之间是否存在互作效应(增益或拮抗作用);(3)较多文献侧重于对辣木叶抗糖尿病的研究,从宏观指标方面证明了辣木叶显著的降糖作用,但具体作用途径和机制尚未探明,仅有少量文献对辣木叶活性成分(黄酮、蛋白和多糖等)进一步挖掘研究,但3种成分究竟何为优势降糖成分,目前仍缺乏同维度的抗糖尿病效果比较(相同剂量、相同饲养时间和相同实验对象等),目前尚无研究定论,仅能依据现有研究推测辣木叶黄酮或为主要降糖成分。因此,明确辣木叶的优势降糖成分,并解析其具体降糖机制对糖尿病研究和辣木资源的有效利用均具有重要的现实意义。
[1] FAROOQ M D, AHMAD TAK F, ARA F, et al.Vitamin B12 deficiency and clinical neuropathy with metformin use in type 2 diabetes[J].Journal of Xenobiotics, 2022, 12(2):122-130.
[2] LEONE A, FIORILLO G, CRISCUOLI F, et al.Nutritional characterization and phenolic profiling of Moringa oleifera leaves grown in Chad, sahrawi refugee camps, and Haiti[J].International Journal of Molecular Sciences, 2015, 16(8):18923-18937.
[3] 中华人民共和国卫生部. 关于批准蛋白核小球藻等4种新资源食品的公告(卫生部公告2012年第19号).[EB/OL].[2012.11.12].http://www.gov.cn/gzdt/2012-12/14/content_2290840.htm. Ministry of Health of the People’s Republic of China.Announcement on approval of 4 new resource foods such as Chlorella proteinosa (Ministry of Health Bulletin No.19, 2012).[EB/OL].[2012.11.12].http://www.gov.cn/gzdt/2012-12/14/content_2290840.htm.
[4] HAMZA A A.Ameliorative effects of Moringa oleifera Lam seed extract on liver fibrosis in rats[J].Food and Chemical Toxicology, 2010, 48(1):345-355.
[5] GHASI S, NWOBODO E, OFILI J O.Hypocholesterolemic effects of crude extract of leaf of Moringa oleifera Lam in high-fat diet fed wistar rats[J].Journal of Ethnopharmacology, 2000, 69(1):21-25.
[6] MOMOH M A, CHIME S A, KENECHUKWU F C.Novel drug delivery system of plant extract for the management of diabetes:An antidiabetic study[J].Journal of Dietary Supplements, 2013, 10(3):252-263.
[7] TOMA A, MAKONNEN E, MEKONNEN Y, et al.Antidiabetic activities of aqueous ethanol and n-butanol fraction of Moringa stenopetala leaves in streptozotocin-induced diabetic rats[J].BMC Complementary and Alternative Medicine, 2015, 15:242.
[8] ABD EL LATIF A, EL BIALY B E, MAHBOUB H D, et al.Moringa oleifera leaf extract ameliorates alloxan-induced diabetes in rats by regeneration of β cells and reduction of pyruvate carboxylase expression[J].Biochemistry and Cell Biology=Biochimie et Biologie Cellulaire, 2014, 92(5):413-419.
[9] AL-MALKI A L, EL RABEY H A.The antidiabetic effect of low doses of Moringa oleifera Lam.seeds on streptozotocin induced diabetes and diabetic nephropathy in male rats[J].BioMed Research International, 2015, 2015:381040. [10] 陈瑞娇, 朱必凤, 王玉珍, 等.辣木叶总黄酮的提取及其降血糖作用[J].食品与生物技术学报, 2007, 26(4):42-45. CHEN R J, ZHU B F, WANG Y Z, et al.Extraction and hypolycemic effect of the total flavonoid from leaves of Moringa oleifera[J].Journal of Food Science and Biotechnology, 2007, 26(4):42-45.
[11] ZHANG Y L, LIU D M.Flavonol kaempferol improves chronic hyperglycemia-impaired pancreatic beta-cell viability and insulin secretory function[J].European Journal of Pharmacology, 2011, 670(1):325-332.
[12] 李巧琳. 辣木叶提取物的制备、降血糖活性评价及降糖功效因子结构解析[D].广州:华南理工大学, 2019:28-48. LI Q L.Preparation of Moringa oleifera leaf extract, evaluation of its hypoglycemic effect and structure characterization of the main hypoglycemic ingredient[D].Guangzhou:South China University of Technology, 2019:28-48.
[13] PAULA P C, SOUSA D O B, OLIVEIRA J T A, et al.A protein isolate from Moringa oleifera leaves has hypoglycemic and antioxidant effects in alloxan-induced diabetic mice[J].Molecules, 2017, 22(2):271.
[14] 董笑克, 胡玉立, 洪明昭, 等.辣木叶的降糖作用及其机制研究进展[J].环球中医药, 2019, 12(2):315-320. DONG X K, HU Y L, HONG M Z, et al.Research progress of hypoglycemic effect and mechanism of Moringa oleifera leave[J].Global Traditional Chinese Medicine, 2019, 12(2):315-320.
[15] 陈逸鹏, 梁建芬.辣木叶功效及相关成分研究进展[J].食品研究与开发, 2016, 37(14):201-205. CHEN Y P, LIANG J F.Active compounds and functions of Moringa oleifera Lam.leaves[J].Food Research and Development, 2016, 37(14):201-205.
[16] JAISWAL D, KUMAR RAI P, KUMAR A, et al.Effect of Moringa oleifera Lam.leaves aqueous extract therapy on hyperglycemic rats[J].Journal of Ethnopharmacology, 2009, 123(3):392-396.
[17] WATERMAN C, ROJAS-SILVA P, TUMER T B, et al.Isothiocyanate-rich Moringa oleifera extract reduces weight gain, insulin resistance, and hepatic gluconeogenesis in mice[J].Molecular Nutrition &Food Research, 2015, 59(6):1013-1024.
[18] GHIRIDHARI V A, MALHATI D, GEETHA K.Anti diabetic property of drumstick (Moringa oleifera) leaf tablets[J].International Journal of Health &Nutrition, 2011, 2(1):1-5.
[19] TAWEERUTCHANA R, LUMLERDKIJ N, VANNASAENG S, et al.Effect of Moringa oleifera leaf capsules on glycemic control in therapy-Naïve type 2 diabetes patients:A randomized placebo controlled study[J].Evidence-Based Complementary and Alternative Medicine:ECAM, 2017, 2017:6581390.
[20] KUMARI D J.Hypoglycemic effect of Moringa oleifera and Azadirachta indica in type-2 diabetes[J].The Bioscan, 2010, 5(2):211-214.
[21] ANGRAINIS S, IBRAHIM I, JESICA F, et al.The effect of decoction of moringa leaves (Moringa Oleifera) on blood sugar levels in type ii diabetes mellitus patients[J].International Journal of Plant Research, 2010, 24(2):114-116.
[22] 彭亮, 温平镜, 洪玉梅, 等.某种辣木叶合剂辅助改善中老年人群高血糖状况的实验研究[J].应用预防医学, 2019, 25(6):449-453. PENG L, WEN P J, HONG Y M, et al.An experimental study on the assistant effect of compound Moringa oleifera leaves on hyperglycemia in middle aged and elderly people[J].Applied Preventive Medicine, 2019, 25(6):449-453.
[23] KUSHWAHA S, CHAWLA P, KOCHHAR A.Effect of supplementation of drumstick (Moringa oleifera) and amaranth (Amaranthus tricolor) leaves powder on antioxidant profile and oxidative status among postmenopausal women[J].Journal of Food Science and Technology, 2014, 51(11):3464-3469.
[24] AHMAD J, KHAN I, JOHNSON S K, et al.Effect of incorporating Stevia and Moringa in cookies on postprandial glycemia, appetite, palatability, and gastrointestinal well-being[J].Journal of the American College of Nutrition, 2018, 37(2):133-139.
[25] 汪芳, 包伊凡, 张羽, 等.辣木叶多糖的分离纯化及其体外降糖活性研究[J].食品安全质量检测学报, 2018, 9(7):1592-1598. WANG F, BAO Y F, ZHANG Y, et al.Isolation and purification of polysaccharides from Moringa oleifera leaves and in vitro hypoglycemic activity[J].Journal of Food Safety &Quality, 2018, 9(7):1592-1598.
[26] SHAAT A R, SADEK K M, EL-FAR A H, et al.Evaluation of antioxidant and hepatoprotective activities of moringa (Moringa oleifera) leaves in diabetic rabbits[J].European Journal of Pharmaceutical and Medical Research, 2017, 4(7):154-162.
[27] 张幸怡, 李洋, 林聪, 等.辣木叶粉对大鼠生长性能、血液与肝脏抗氧化及免疫指标的影响[J].天然产物研究与开发, 2016, 28(11):1724-1731. ZHANG X Y, LI Y, LIN C, et al.Effects of Moringa oleifera leaves on growth performance, antioxidant and immunity function of blood and liver in sprague dawley rats[J].Natural Product Research and Development, 2016, 28(11):1724-1731.
[28] WILLIAM F, LAKSHMINARAYANAN S, CHEGU H.Effect of some Indian vegetables on the glucose and insulin response in diabetic subjects[J].International Journal of Food Sciences and Nutrition, 1993, 44(3):191-195.
[29] LI H, JI H S, KANG J H, et al.Soy leaf extract containing kaempferol glycosides and pheophorbides improves glucose homeostasis by enhancing pancreatic β-cell function and suppressing hepatic lipid accumulation in db/db mice[J].Journal of Agricultural and Food Chemistry, 2015, 63(32):7198-7210.
[30] ANTHANONT P, LUMLERDKIJ N, AKARASEREENONT P, et al.Moringa oleifera leaf increases insulin secretion after single dose administration:A preliminary study in healthy subjects[J].Journal of the Medical Association of Thailand=Chotmaihet Thangphaet, 2016, 99(3):308-313.
[31] NUNTHANAWANICH P, SOMPONG W, SIRIKWANPONG S, et al.Moringa oleifera aqueous leaf extract inhibits reducing monosaccharide-induced protein glycation and oxidation of bovine serum albumin[J].SpringerPlus, 2016, 5(1):1098.
[32] OLAYAKI L A, IREKPITA J E, YAKUBU M T, et al.Methanolic extract of Moringa oleifera leaves improves glucose tolerance, glycogen synthesis and lipid metabolism in alloxan-induced diabetic rats[J].Journal of Basic and Clinical Physiology and Pharmacology, 2015, 26(6):585-593.
[33] OLAIDE A O, CHINEDU A A, ALANI S O. Effect of the ethanolic leaf extract of Moringa oleifera on insulin resistance in streptozotocin induced diabetic rats[J].Journal of Plant Sciences, 2015, 2(6-1):5-12.
[34] HIDAYATI S, SULISTYAWATI R, NURANI L H.Regulation of ethyl acetate fraction from Moringa oleifera leaves to improve lipid metabolism and insulin sensitivity in type 2 diabetes[J].International Journal of Pharmacy and Pharmaceutical Sciences, 2018, 10(10):78.
[35] 洪明昭. 基于肠道菌群探讨辣木叶醇提物降糖作用机制[D].北京:北京中医药大学, 2017:54-56. HONG M Z.Discussion on hypoglycemic mechanism of alcohol extract from Moringa oleifera leaves based on intestinal flora[D].Beijing:Beijing University of Chinese Medicine, 2017:54-56.
[36] RENGARAJAN T, BAMAGOUS G, AL GHAMDI S, et al.Antidiabetic and antioxidant activity of ethyl acetate extract fraction of Moringa oleifera leaves in streptozotocin-induced diabetes rats via inhibition of inflammatory mediators[J].Asian Pacific Journal of Tropical Biomedicine, 2018, 8(6):320.
[37] 孙朦, 王鸿飞, 李艳霞, 等.辣木叶总黄酮提取工艺优化及抗氧化能力研究[J].核农学报, 2018, 32(9):1772-1780. SUN M, WANG H F, LI Y X, et al.Optimization of extraction and antioxidant activities of total flavonoids from leaves of Moringa oleifera Lam[J].Journal of Nuclear Agricultural Sciences, 2018, 32(9):1772-1780.
[38] 孙朦, 王鸿飞, 王凯凯, 等.辣木叶黄酮对小鼠血脂调节作用研究[J].核农学报, 2018, 32(8):1597-1602. SUN M, WANG H F, WANG K K, et al.Effects of flavonoids from Moringa oleifera leaves on the blood lipid metabolism in mice[J].Journal of Nuclear Agricultural Sciences, 2018, 32(8):1597-1602.
[39] 梁鹏, 甄润英.辣木茎叶中水溶性多糖的提取及抗氧化活性的研究[J].食品研究与开发, 2013, 34(14):25-29. LIANG P, ZHEN R Y.Study on extraction and antioxidant activity of water-soluble polysaccharides from Moringa oleifera[J].Food Research and Development, 2013, 34(14):25-29.
[40] 裴斐, 陶虹伶, 蔡丽娟, 等.响应面试验优化辣木叶多酚超声辅助提取工艺及其抗氧化活性[J].食品科学, 2016, 37(20):24-30. PEI F, TAO H L, CAI L J, et al.Optimization of polyphenols from Moringa oleifera Lam.leaves by ultrasound-assisted extraction using response surface methodology and their antioxidant activities[J].Food Science, 2016, 37(20):24-30.
[41] BARAZZONI R, CAPPELLARI G G, RAGNI M, et al.Insulin resistance in obesity:An overview of fundamental alterations[J].Eating and Weight Disorders - Studies on Anorexia, Bulimia and Obesity, 2018, 23(2):149-157.
[42] KIM S Y, ENGLAND L, WILSON H G, et al.Percentage of gestational diabetes mellitus attributable to overweight and obesity[J].American Journal of Public Health, 2010, 100(6):1047-1052.
[43] YASSA H D, TOHAMY A F.Extract of Moringa oleifera leaves ameliorates streptozotocin-induced diabetes mellitus in adult rats[J].Acta Histochemica, 2014, 116(5):844-854.
[44] ATTAKPA E S, SANGARÉ M M, BÉHANZIN G J, et al.Moringa olifeira Lam.stimulates activation of the insulin-dependent Akt pathway.antidiabetic effect in a diet-induced obesity (DIO) mouse model[J].Folia Biologica, 2017, 63(2):42-51.
[45] AL-NUMAIR K, ALSAIF M, GOVINDASAMY C.Kaempferol, a dietary flavonoid improves glucose homeostasis in streptozotocin diabetic tissues by altering glycolytic and gluconeogenic enzymes[A].Endocrine Abstracts[C].Bioscientifica, 2014, 36.
[46] OH Y S, JUN H S.Role of bioactive food components in diabetes prevention:Effects on beta-cell function and preservation[J].Nutrition and Metabolic Insights, 2014, 7:51-59.
[47] OBOH G, AGUNLOYE O M, ADEFEGHA S A, et al.Caffeic and chlorogenic acids inhibit key enzymes linked to type 2 diabetes (in vitro):A comparative study[J].Journal of Basic and Clinical Physiology and Pharmacology, 2015, 26(2):165-170.
[48] BABU P V A, LIU D M, GILBERT E R.Recent advances in understanding the anti-diabetic actions of dietary flavonoids[J].The Journal of Nutritional Biochemistry, 2013, 24(11):1777-1789.
[49] BAHADORAN Z, MIRMIRAN P, AZIZI F.Dietary polyphenols as potential nutraceuticals in management of diabetes:A review[J].Journal of Diabetes &Metabolic Disorders, 2013, 12(1):43.
[50] DEFRONZO R A, NORTON L, ABDUL-GHANI M.Renal, metabolic and cardiovascular considerations of SGLT2 inhibition[J].Nature Reviews Nephrology, 2017, 13(1):11-26.
[51] LACROIX I M E, LI-CHAN E C Y.Food-derived dipeptidyl-peptidase IV inhibitors as a potential approach for glycemic regulation-Current knowledge and future research considerations[J].Trends in Food Science &Technology, 2016, 54:1-16.
[52] ABDERRAZAK A, SYROVETS T, COUCHIE D, et al.NLRP3 inflammasome:From a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases[J].Redox Biology, 2015, 4:296-307.
[53] 包伊凡, 沈新春, 韩欣然, 等.基于谱效关系的辣木叶降糖活性物质研究[J].中国食品学报, 2021, 21(1):225-235. BAO Y F, SHEN X C, HAN X R, et al.Studies on the hypoglycemic substances from moring oleifera leaves by spectrum-effect relations[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(1):225-235.
[54] AZAD S B, ANSARI P, AZAM S, et al.Anti-hyperglycaemic activity of Moringa oleifera is partly mediated by carbohydrase inhibition and glucose-fibre binding[J].Bioscience Reports, 2017, 37(3):BSR20170059.
[55] 赵欢, 曹玉霖, 朱彦锋.辣木的血糖调节功能研究进展[J].天然产物研究与开发, 2017, 29(10):1791-1796. ZHAO H, CAO Y L, ZHU Y F.Review on blood glucose regulating function of Moringa oleifera Lam[J].Natural Product Research and Development, 2017, 29(10):1791-1796.
[56] 陈玉芳, 文雅, 王水云.糖尿病合并高血压体检人群体重指数与血脂、脂肪肝的关联性分析及健康生活方式指导[J].糖尿病新世界, 2021, 24(16):159-161;165. CHEN Y F, WEN Y, WANG S Y.Correlation analysis of body mass index, blood lipids and fatty liver in people with diabetes and hypertension on physical examination and guidance on healthy lifestyle[J].Diabetes New World, 2021, 24(16):159-161;165.
[57] 张文龙, 马新英, 交艳.中西医结合治疗2型糖尿病合并高血脂症、脂肪肝的临床观察[J].中医药导报, 2009, 15(1):21-22. ZHANG W L, MA X Y, JIAO Y.Clinical observation on the treatment of type 2 diabetes mellitus complicated with hyperlipidemia and fatty liver with combination of traditional Chinese and western medicine[J].Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2009, 15(1):21-22.
[58] 沙子珺, 黎彩凤, 唐仕欢, 等.新资源药材辣木叶抗高脂血症的药效与作用机制探析[J].中国中药杂志, 2021, 46(14):3465-3477. SHA Z J, LI C F, TANG S H, et al.Efficacy and mechanism of new resource medicinal materia Moringa oleifera leaves against hyperlipidemia[J].China Journal of Chinese Materia Medica, 2021, 46(14):3465-3477.
[59] ATTAKPA E S, BERTIN G A, CHABI N W, et al.Moringa oleifera-rich diet and T cell calcium signaling in spontaneously hypertensive rats[J].Physiological Research, 2017, 66(5):753-767.