鼠尾草酸(carnosic acid, CA),一种易溶于油脂,不溶于水,耐高温的油溶性酚类二萜化合物,在自然界中广泛存在于牛至、鼠尾草、迷迭香、百里香等唇形科植物中[1]。CA表现出不同的生物学功能和化学性质,比如抗氧化[2]、抗炎[3]、抗肿瘤[4]以及抗微生物等特性被建议作为预防剂和治疗神经退行性疾病,还可将其用于增香的食品添加剂[5-6]等,这使其在医药卫生、食品工业等行业中具有广泛的应用价值[7-10],其需求量也是逐年提高。对于萜类生产,相较于目前已经广泛用于萜类合成的酿酒酵母而言,热带假丝酵母(Candida tropicalis)具有耐高温、鲁棒性强[11]、产油脂[12]、具有丰富的膜结构[13-15]等特点。伴随着代谢工程、合成生物学等生物技术的飞速发展,针对于萜类化合物的生物合成,常见的代谢工程改造策略有“推拉”策略、模块化工程、亚细胞区室化、蛋白质工程等。2015年,IGNEA等[16]报道了一个模块化的萜烯生产平台,同时挖掘和鉴定鼠尾草和迷迭香中抗氧化剂CA和相关二萜的生物合成途径中的酶系。在代谢工程改造方面,WEI等[17]通过融合蛋白共表达和不同过氧化氢酶的过表达以及内质网工程等代谢工程和合成生物策略在酿酒酵母中构建CA的生物合成途径异源生产CA,其摇瓶发酵和5 L补料分批发酵产量分别为24.65 mg/L和75.18 mg/L。
本研究以实验室前期构建生产次丹参酮二烯并带CRISPR Cas9编辑系统的尿嘧啶缺陷型热带假丝酵母1C2PM04作为出发菌株。进行如下代谢改造:利用模块化工程与酵母不同亚细胞区室的空间组合,将来源于鼠尾草的铁锈醇合酶基因(CYP76AH24)、鼠尾草酸合酶基因(CYP76AK6)和来源于拟南芥的细胞色素还原酶基因(ATR1)以模块化的方式导入胞质和过氧化物酶体中进行过表达构建下游鼠尾草酸合成途径(图1)并探究C.tropicalis在细胞质、过氧化物酶体中分别进行CA合成的潜力;通过融合基因表达策略,进一步消耗前体增加CA池;过表达ATR1,增加电子供体数目提高CA产量;敲除ERG9并通过CRISPR dCas9系统下调另一个拷贝的ERG9,这使得代谢通量导向合成CA前体GGPP的萜类合成途径。
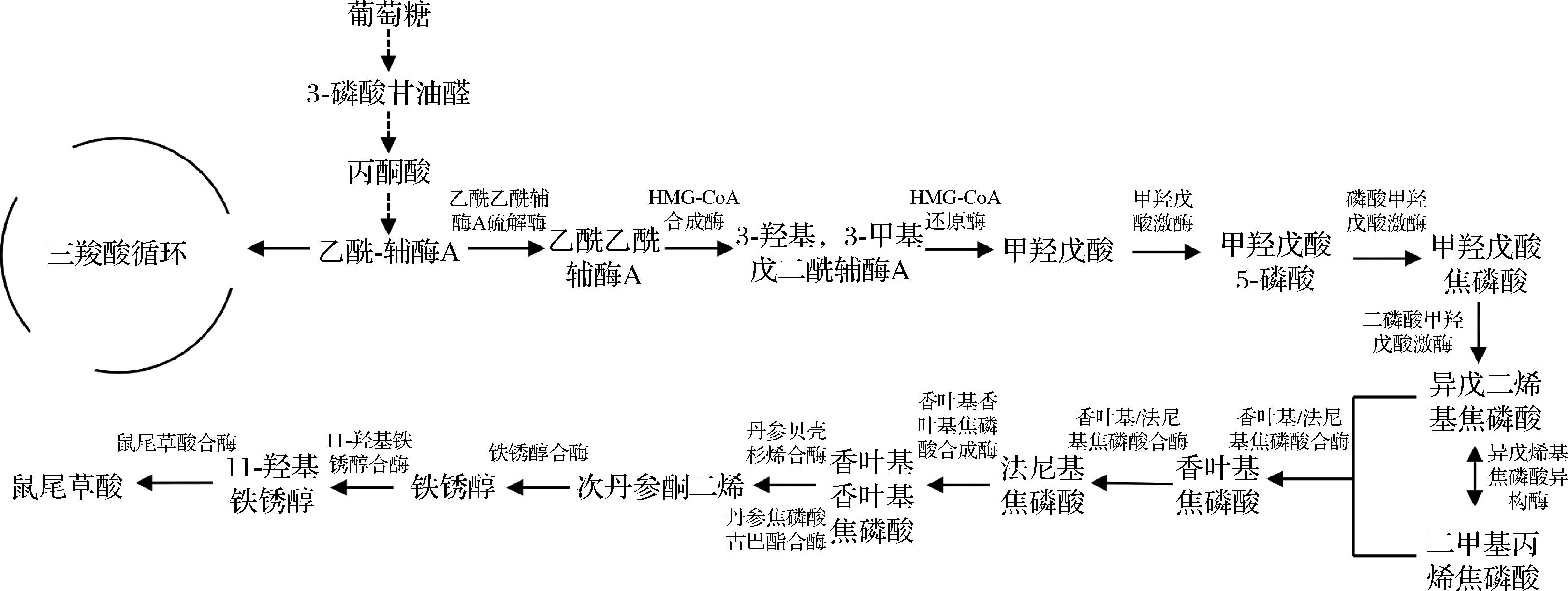
图1 热带假丝酵母中鼠尾草酸的参考代谢途径
Fig.1 Reference metabolic pathway of carnosic acid in C.tropicalis
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和引物
本实验中所用的基因克隆载体pMD19-T Simple,大连TaKaRa公司;用于载体构建的大肠杆菌(Escherichia coli)JM109,江南大学工业微生物资源与管理中心保藏;质粒PBRP01、Ts-GRE-gda-URA3、Ts-gEi-PGAP1-dCas9-TENO1,本实验室保藏;菌株1C2PM04为生产CA前体次丹参酮二烯的尿嘧啶(URA3)缺陷型菌株;本研究中构建菌株见电子版增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.035384,下同);本研究所用PCR引物见电子版增强出版附表2,引物合成、密码子优化后的基因合成以及基因测序,苏州金唯智生物科技有限公司。
1.1.2 培养基、试剂和仪器
LB培养基(g/L):NaCl 10,酵母粉5,蛋白胨10。
YPD培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20。
2×YPD培养基(g/L):葡萄糖40,酵母粉20,蛋白胨50。
MM培养基(g/L):葡萄糖20,酵母基础氮源培养基(yeast nitrogen base, YNB)6.7,(NH4)2SO4 Cl10。
SM培养基:在MM培养基基础上添加0.06 g/L尿嘧啶。
5-氟乳清酸(5-fluoroorotic acid,5-FOA)培养基:在SM培养基基础上添加2 g/L的5-FOA;对应的固体培养基在原培养基上加入20 g/L琼脂粉。
发酵培养基(g/L):葡萄糖60,酵母粉10,蛋白胨20。
CA标准品、正十二烷(色谱纯)、正己烷(色谱纯)等,阿拉丁试剂公司;5-FOA、YNB、酵母RNA提取试剂盒等,生工生物工程(上海)股份有限公司;一步克隆试剂盒、荧光定量PCR试剂盒,南京诺唯赞生物科技股份有限公司;高速台式离心机,上海联迈生物工程有限公司;WD-9403B 琼脂糖凝胶电泳仪,北京市六一仪器厂;UV2000110紫外可见分光光度计,上海尤尼科有限公司;PCR扩增仪,杭州米欧仪器有限公司;质粒提取试剂盒、PCR产物清洁试剂盒、琼脂糖电泳凝胶回收试剂盒,康宁生命科学(吴江)有限公司。
1.2 实验方法
1.2.1 整合框的构建
以PUC57-CYP76AH24为模板,AH24-F和AH24-R为引物,PCR扩增全长的铁锈醇合酶基因CYP76AH24并对其进行试剂盒纯化后备用;对质粒PBRP01进行Nhe I和Sal I双酶切后琼脂糖凝胶电泳回收8.2 kb片段并进行试剂盒纯化;将上述两纯化后的DNA片段通过一步克隆试剂盒进行连接得到质粒Ts-CYP76AH24-CarB。以PUC57-CYP76AK6为模板,AK6-F和AK6-R为引物,PCR扩增全长的鼠尾草酸合酶基因CYP76AK6并对其进行试剂盒纯化后备用;使用Spe I和Xba I对质粒Ts-CYP76AH24-CarB双酶切后琼脂糖凝胶电泳回收8.0 kb片段并进行试剂盒纯化;将上述两纯化后的DNA片段通过一步克隆试剂盒进行连接得到质粒Ts- PGAP1-CYP76AH24-TENO1-TPGK1-CYP76AK6-PFBA1。以FCPRA为模板,以CPR-F和CPR-R为引物,PCR扩增4.0 kb片段PFBA1-ATR1-TADH2并对其进行试剂盒纯化后备用;对质粒Ts-PGAP1-CYP76AH24-TENO1-TPGK1-CYP76AK6-PFBA1进行Not I单酶切,琼脂糖凝胶电泳回收后备用;将上述两纯化后的DNA片段通过一步克隆试剂盒进行连接得到质粒Ts-ATR-C(电子版增强出版附图1-a,https://doi.org/10.13995/j.cnki.11-1802/ts.035384,下同)。对质粒Ts-GRE3-gda324-URA3-GRE3(电子版增强出版附图2)进行EcoR I单酶切,并对酶切产物进行PCR清洁试剂盒纯化,同时用Mlu I酶切质粒Ts-ATR-C后进行琼脂糖凝胶电泳回收,将上述两纯化后的DNA片段通过一步克隆试剂盒进行连接,获得重组质粒Ts-GRE3-gda324-URA3-C(电子版增强出版附图1-b);使用Mlu I酶切质粒Ts-GRE3-gda324-URA3-C得到片段GRE3-gda324-URA3-PGAP1-CYP76AH24-TENO1-TPGK1-CYP76AK6-PFBA1-PFBA1-ATR1-TADH2,对所得片段进行纯化。
1.2.2 C.tropicalis的氯化锂转化
热带假丝酵母氯化锂转化参考文献[18],以尿嘧啶缺陷型菌株1C2PM04为出发菌株,以URA3基因为筛选标记,将纯化后的DNA片段转入宿主内涂布于MM固体培养基后,在30 ℃恒温培养箱培养3 d。
1.2.3 C.tropicalis转化子的筛选与URA3的重复使用
挑取1.2.2节MM固体培养基上的转化子提取基因组进行PCR验证,将鉴别正确的转化子涂布于5-FOA固体培养基上,对筛选标记基因URA3进行弹出,经PCR验证标记弹出后将纯化后的PCR产物送公司测序,挑取鉴定正确的菌株进行甘油管保藏。在上述基础上重复使用筛选基因URA3[19],并对GRE3和XKS基因进行敲除以及表达盒的整合。
1.2.4 基因转录水平的测定
通过软件Beacon Designer 7.9,设计荧光定量PCR所需引物QAH-F和QAH-R等。参考文献[20]测定CYP76AH24、ATR1、ERG9等基因的转录水平。
1.2.5 摇瓶发酵实验
将重组菌株于YPD固体平板上划线培养2 d后,在平板上挑取单菌落转接于20 mL YPD液体培养基中,置于200 r/min,30 ℃摇床过夜培养1 d至OD600值达到8.0~10.0,后转接于30 mL发酵培养基中,令其初始OD600值为0.1,将其置于30 ℃,200 r/min摇床培养,间隔12 h检测OD600值,发酵96 h后取发酵液检测。
1.2.6 发酵产物中CA的提取及检测
CA的提取:取1 mL发酵液于1.5 mL离心管中转速12 000 r/min离心3 min,离心结束后吸去上清液后用无菌水洗涤2次。向沉淀中加入1 mL 3 mol/L的HCl溶液,置于沸水浴3 min后冰浴1 min快速冷却,12 000 r/min离心3 min后弃去上清液,用1 mL无菌水再次洗涤沉淀。向沉淀加入1 mL甲醇,涡旋振荡10 min后12 000 r/min离心5 min,取上清液500 μL置于干净离心管中待检测。
CA的检测:采用LC-MS检测分析。LC检测条件为BEH C18液相色谱柱(1.7 μm,2.1 mm×150 mm),流动相为100%甲酸-40 min;30%乙腈70%甲酸-45 min;80%乙腈20%甲酸-50 min;100%乙腈-55 min;100%甲酸,检测波长285 nm,柱温45 ℃,流速0.3 mL/min,进样量为5 μL。
2 结果与分析
2.1 CA的生物合成
为构建下游CA模块,根据文献报道选择了可以承担两步酶促反应的双功能酶CYP76AH24以及CYP76AK6,前者可以将次丹参酮二烯经两步酶催化转化为11-羟基铁锈醇,而后者将催化合成的11-羟基铁锈醇转化为CA。根据热带假丝酵母密码子偏好性以及特殊性对CYP76AH24、CYP76AK6以及ATR1进行全序列密码子优化以及基因合成,以1C2CM02为出发菌株,通过CRISPR Cas9系统在C.tropicalis基因组中的GRE3位点上分别整合了上述3条外源基因。其中整合框质粒Ts-GRE3-gda324-URA3-C用MluⅠ单酶切(图2-a),凝胶电泳回收并纯化13.5 kb片段用于转化,使用GRE3同源臂外侧引物UGRE3-F和GRE3同源臂内侧引物UGRE3-R验证重组菌株基因组,正确转化子条带大小为1.0 kb(图2-b),得到单拷贝菌株M02-CS。提取产物后经LC-MS检测鉴定,CA标准品出峰时间为5.55 min,而处理后的发酵液在该时间处测得对应特征峰并对比标品质谱峰形完全一致(图2)。结果显示,在C.tropicalis中成功表达关于CA生物合成的外源基因。
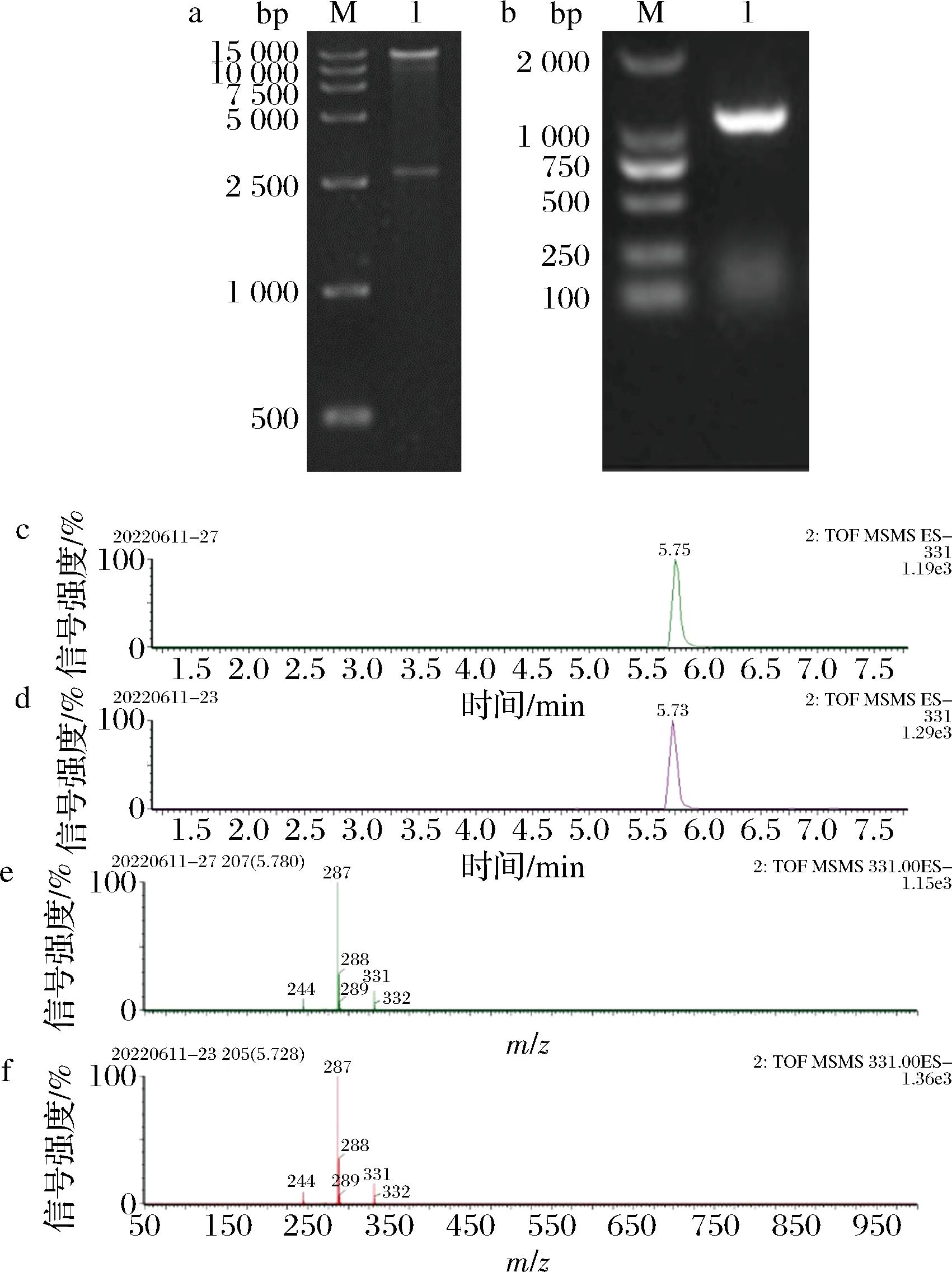
a-Ts-GRE3-gda324-URA3-C酶切验证(M-15 000 bp核酸marker,1-质粒酶切);b-GRE3-gda324-URA3-C整合框转化(M-2 000 bp核酸marker,1-重组菌株M02-CS转化子);c, d-CA标准品样品 液相色谱图;e, f-CA标准品和赝品LC-MS质谱图
图2 鼠尾草酸合成模块的构建
Fig.2 Construction of carnosic acid synthesis module
2.2 下游途径模块化、区室化对CA生物合成的影响
外源基因区室化是将某些特定的代谢途径定位在不同的亚细胞结构或区室内,比如胞质、过氧化物酶体、内质网、线粒体等。在本研究中,在C.tropicalis胞内不同细胞区室独有的理化环境来构建生产二萜类化合物的平台,选取实验室前期筛选所得的过氧化物酶体信号肽(ICL、PTS1、ePTS1、POS4-A、BnICL)中较为优秀的ePTS1作为本实验中用于将CA模块定位在过氧化物酶体的信号肽[21]。因此,在CYP76AH24、CYP76AK6以及ATR1蛋白质C端添加过氧化物酶体定位信号肽并将其过表达构建重组质粒以获得更优秀的产CA菌株。通过此策略,成功构建了单拷贝菌株M04-CS和M04-PS以及双拷贝菌株M04-CD和M04-PD。随后将上述重组菌株进行摇瓶发酵,通过LC-MS检测发酵产物,CA产量见图3-a,菌株M04-PS、M04-PD、M04-CS和M04-CD的CA产量分别为1.21、2.85、4.64、10.25 mg/L。当在外源基因C端后添加过氧化物酶体定位信号肽时,能够在M04-PD和M04-PS的发酵液中检测到CA。这表明CA前体物质次丹参酮二烯可以穿过C.tropicalis的亚细胞器过氧化物酶体,以及上述外源基因可以在C.tropicalis过氧化物酶体中正常表达。根据图3-b生长曲线显示,相对于单拷贝菌株,双拷贝菌株的生长情况明显受到抑制,推测过表达下游CA模块会加重细胞代谢负担以及过量的CA可能对细胞膜具有损伤作用,影响生长[22]。
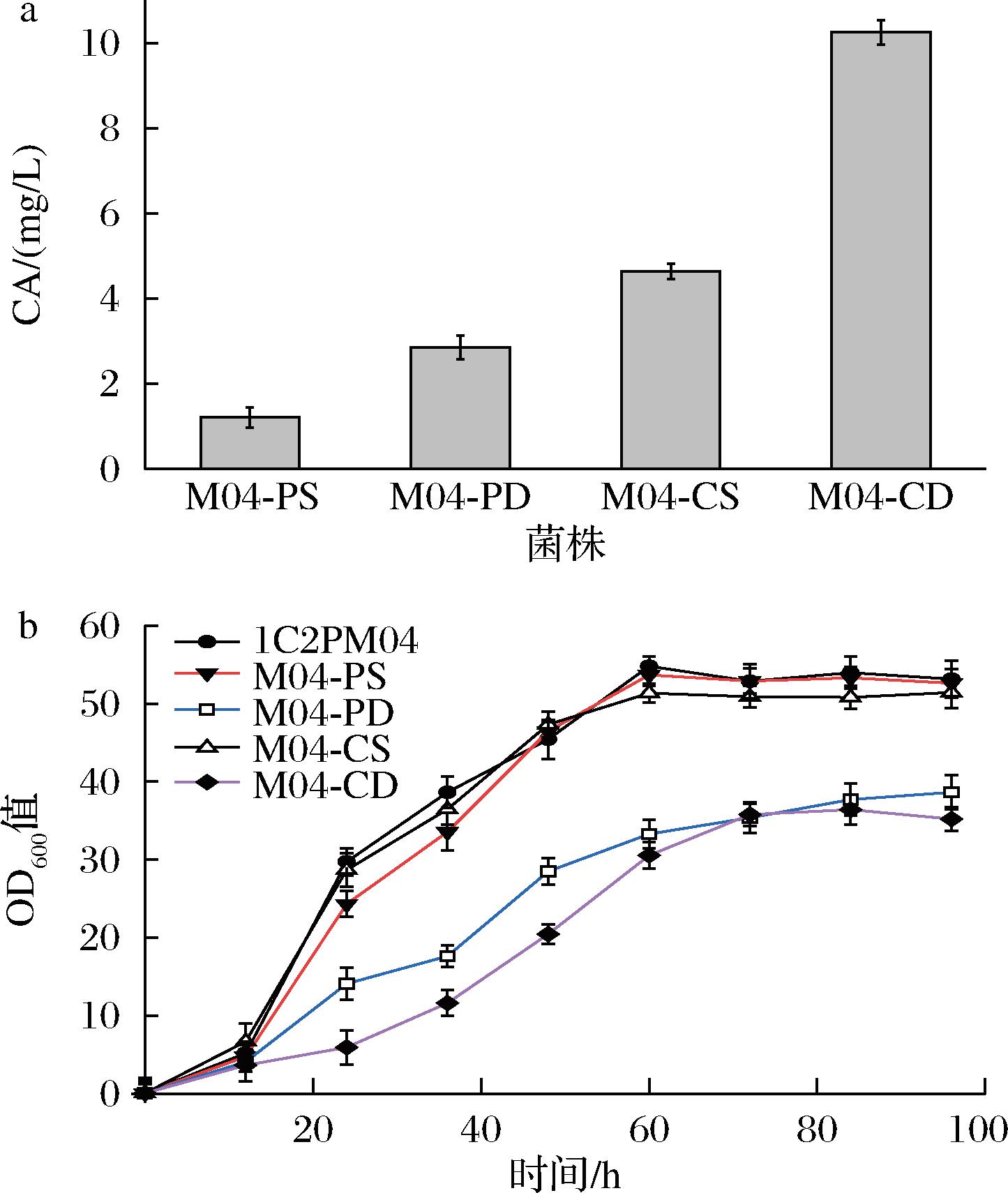
a-重组菌株的CA产量测定;b-重组菌株的生长情况
图3 重组热带假丝酵母鼠尾草酸产量以及生长曲线
Fig.3 Production of carnosic acid and growth curve in recombinant C.tropicalis
以肌动蛋白基因(ACT)为内参基因,通过荧光定量PCR检测出发菌株ATCC 20336、M04-CS、M04-CD、M04-PS和M04-PD中的外源基因CYP76AH24、CYP76AK6及ATR1的转录水平。根据结果显示,由于ATCC 20336基因组中未整合外源基因,因此在对照组中无法检测到对应基因转录信号;而M04-CD和M04-PD均过表达相关基因,其mRNA相对丰度远高于单拷贝菌株M04-CS和M04-PS(图4)。结果表明,成功在M04-CD中过表达CA途径外源基因,其摇瓶发酵产量相对较高,将在此基础上进一步进行代谢工程改造。
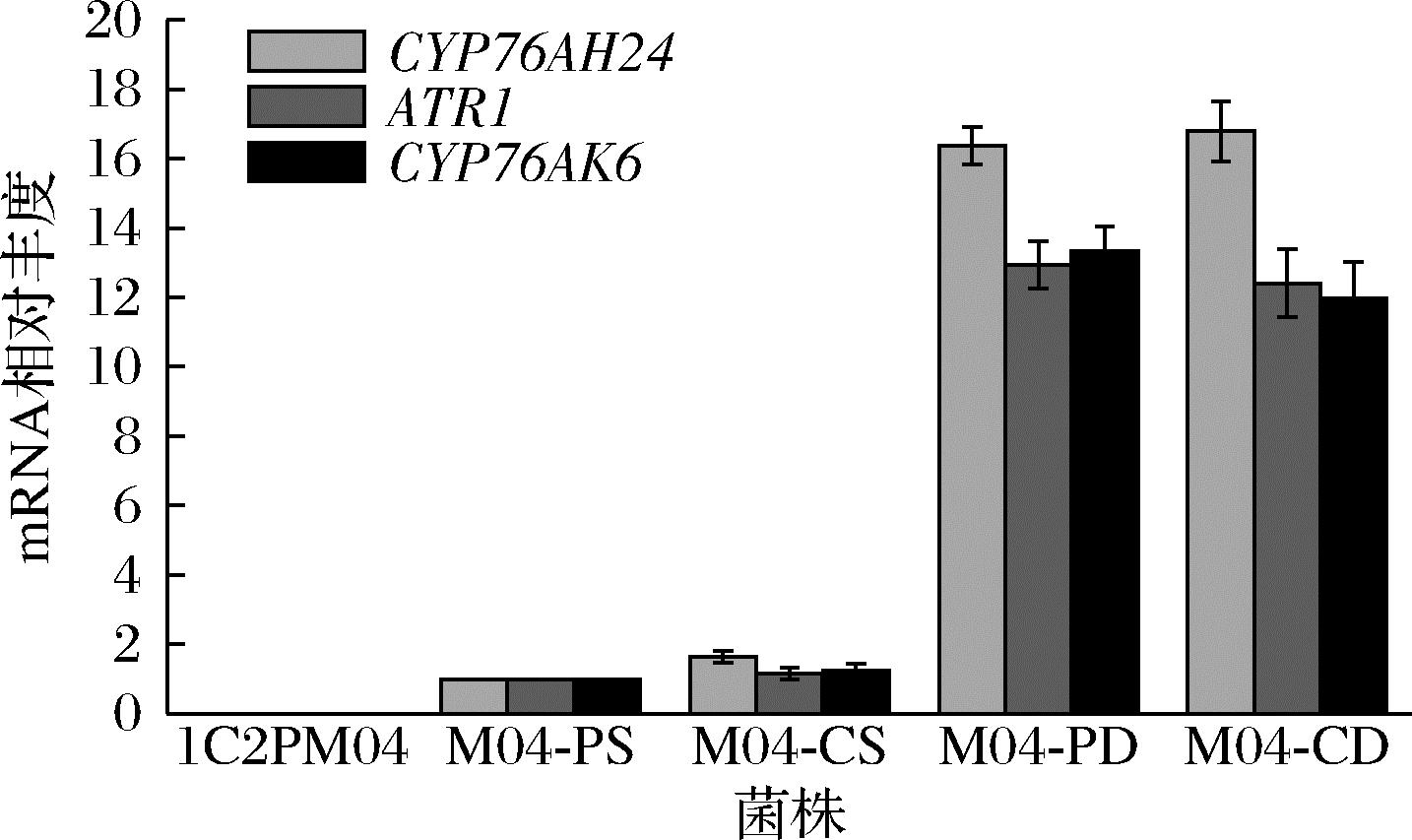
图4 外源基因在不同重组菌株中的表达水平
Fig.4 Gene expression levels of exogenous gene in different yeast strains
2.3 下调ERG9对CA合成的影响
在热带假丝酵母中,法尼基焦磷酸(farnesyl pyrophosphate, FPP)是生物合成CA途径的关键节点,其有2个分支代谢途径:麦角固醇合成途径和二萜类合成途径。C.tropicalis作为二倍体酵母其角鲨烯合酶为一对等位基因,为使得FPP池代谢通量尽可能地流向二萜类合成途径,因此选择先敲除掉其中一条等位基因以此构建GE0,再通过CRSPR-dCas9系统靶向ERG9不同区域下调另一条等位基因构建GEA、GEB等菌株,构建过程参考1.2.1节。将重组菌株M04-CD、GE0、GEB、GEC等分别接种于30 mL发酵培养基中,相对于对照菌株M04-CD,下调ERG9的重组菌株的生长均受到不同程度的抑制,与预期相符(图5-a)。利用LC-MS分别测量了对照菌株及重组菌株CA生产情况,如图5-b所示,在重组热带假丝酵母GEA、GEB等菌株中成功调控了内源基因ERG9,相对于对照组转录水平,C.tropicalis GEB中ERG9转录水平显著降低,并且该菌株中CA产量相对应提高到对照菌株产量的2.6倍(图5-c)。实验结果表明,CA的产量和ERG9的表达水平是负相关的,即对内源基因ERG9转录的抑制促使热带假丝酵母中CA的积累。
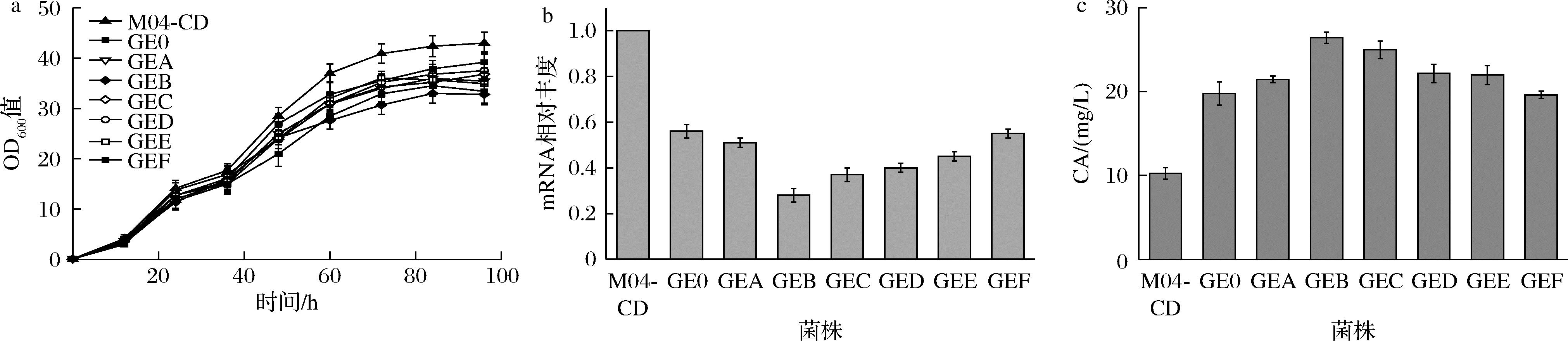
a-重组菌株GE0~GEF的生长情况;b-重组菌株GE0~GEF的ERG9转录水平测定;c-重组菌株GE0~GEF的CA产量测定
图5 GE0~GEF菌株CA产量、相对转录水平以及生长曲线
Fig.5 Production of carnosic acid, relative transcription level and growth curve in recombinant C.tropicalis GE0-GEF
2.4 CYP76AH24和ATR1融合表达对CA合成的影响
有研究表明,将细胞色素P450基因(CYP450)与细胞色素还原酶基因与已编码“Ser-Thr”的碱基密码linker连接,设计引物提高A/T相对含量,这会使细胞色素P450和CPR活性得到提高,进而影响下游萜类合成与修饰[23]。因此,将ATR1通过连接肽的形式连接在CYP76AH24的C端进行融合表达,进一步提高下游模块的催化效率以更好地合成CA。为测试柔性linker(G4S, G4S×2, G4S×3)和刚性linker(E3AK, E3AK×2, E3AK×3)哪种类型的linker更适合细胞色素和细胞色素还原酶的融合表达,以1C2PM04为出发菌株,以强启动子PGAP1,分别使用刚性和柔性类型linker构建并表达关键酶融合蛋白,得到重组菌株HD01~HD06,构建过程参考1.2.1节。实验结果见图6,CYP76AH24和ATR1融合表达不会对细胞生长造成影响(图6-a),刚性linker可以提高CA的产量,其中以E3AK×2融合表达CYP76AH24和ATR1的重组菌株HD05的CA产量达到15.75 mg/L,是对照菌株M04-CD的1.54倍(图6-b)。结果表明,通过刚性linker融合表达CYP76AH24和ATR1可以提高CA产量,推测可能是两种蛋白以复合体形式表达可以提高其中一种酶的活性进而提高催化效率。对重组热带假丝酵母菌株HD05进行ERG9敲除和下调构建HD07,其CA产量为40.75 mg/L,构建过程参考1.2.1节,后续会在此菌株上继续进行代谢改造。
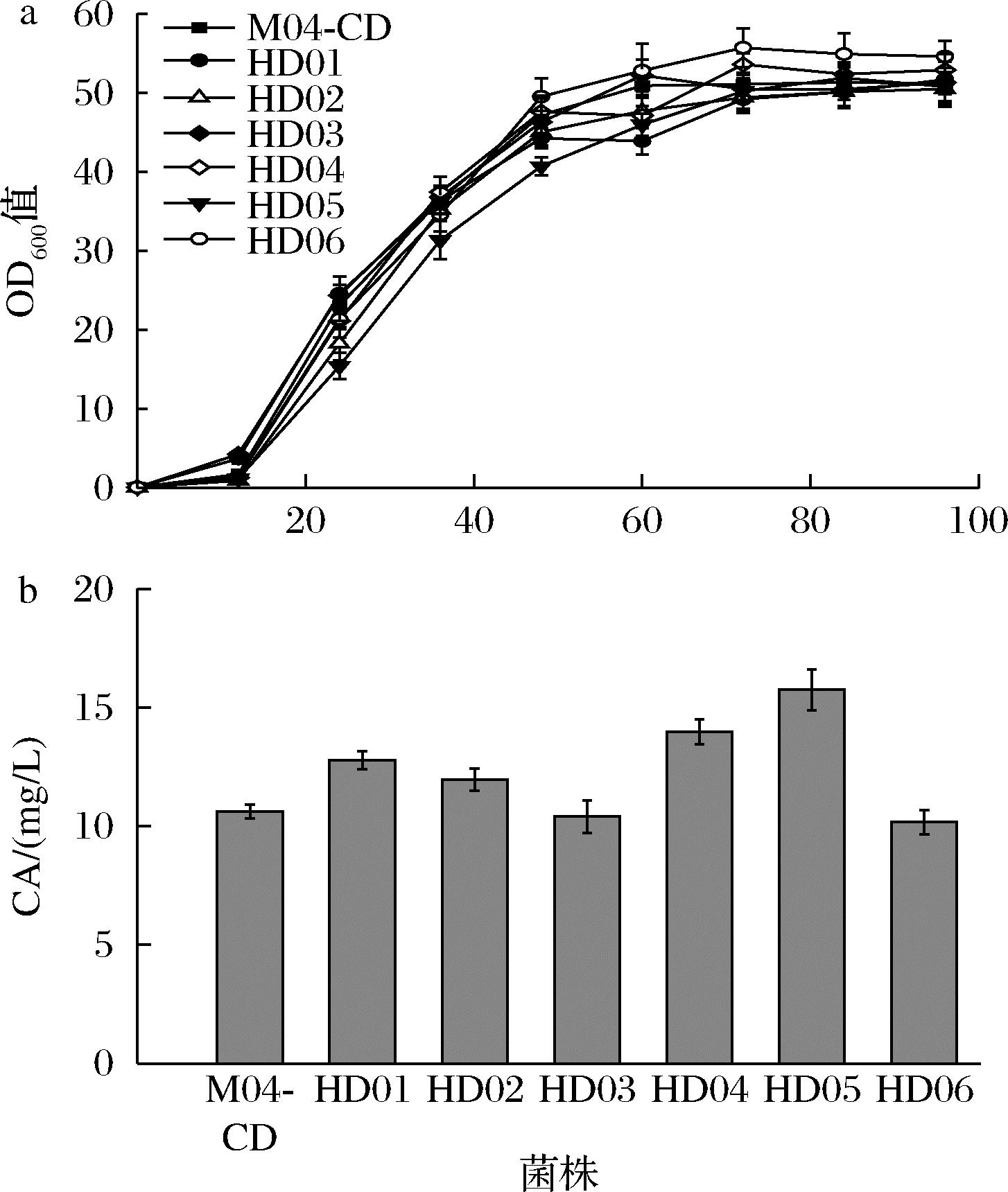
a-重组菌株HD01~HD06的CA产量测定; b-重组菌株HD01~HD06的生长情况
图6 HD01~HD06菌株的CA产量以及生长曲线
Fig.6 Production of carnosic acid and growth curve in recombinant C.tropicalis HD01-HD06
2.5 增加细胞色素还原酶拷贝数提高CA产量
细胞色素P450是一种血红蛋白类酶,广泛存在于动物、植物、微生物中。由于其具有脱烷基化、脱氨、氧化、羟基化等多种催化活性,CYP450在许多代谢途径中发挥重要作用,如萜类、固醇类的生物合成途径等。作为一种含铁氧化酶,底物与CYP450的结合位点和其蛋白中血红素-Fe3+复合物十分接近,催化反应方程式为NADPH+H++RH+O2→NADP++H2O+ROH。细胞色素氧化还原伴侣细胞色素还原酶的作用为从上述方程中NADPH中传递一个电子将Fe3+还原为Fe2+使CYP450发挥功能,因此CPR传递电子这一步骤极有可能为CYP450氧化还原酶反应的限速步骤。为研究细胞色素还原酶和细胞色素P450拷贝数比值对CA合成的影响,以HD07作为出发菌株,在热带假丝酵母基因组DPP3位点整合ATR1基因,进一步过表达细胞色素还原酶,得到重构组菌株HD08和HD09,构建过程参考1.2.1节。将对照菌株HD07以及重组菌株HD08和HD09进行摇瓶发酵。如图7所示,细胞色素还原酶基因ATR1的过表达使CA产量显著提高,单拷贝菌株HD08较HD07提高1.21倍,双拷贝菌株HD09较HD07提高1.92倍,产量达到78.24 mg/L。结果显示,细胞色素还原酶基因ATR1拷贝数的增加使得胞内氧化还原反应电子供体数量增加,可以有效提高CA的产量。
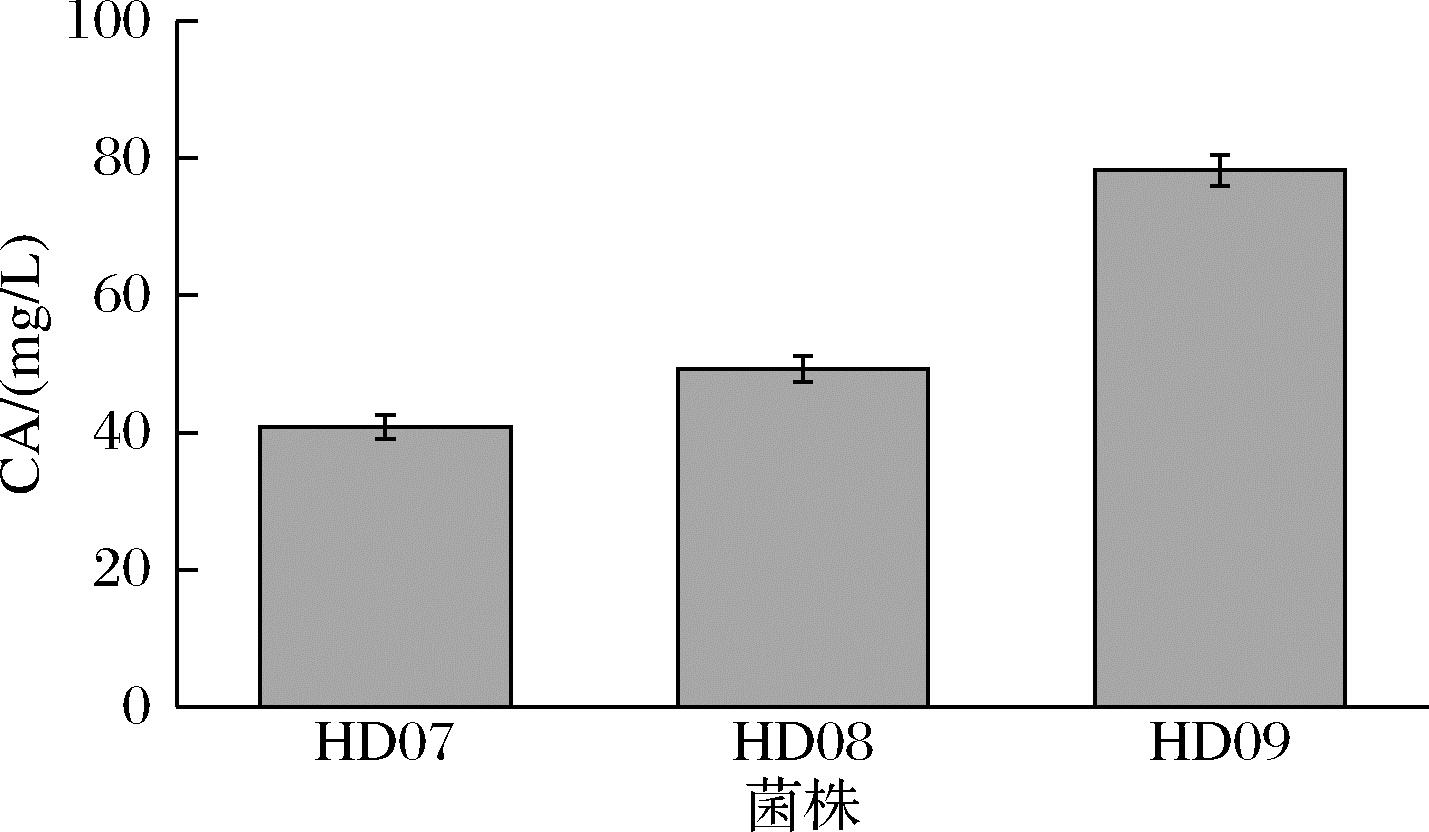
图7 重组热带假丝酵母HD08和HD09菌株CA产量
Fig.7 Production of carnosic acid in recombinant C.tropicalis HD08 and HD09
3 结论
本研究以热带假丝酵母1C2PM04出发,鉴定表达了来源于鼠尾草的外源基因SfCYP76AH24和SfCYP76AK6以及来源于拟南芥的AtATR1,在热带假丝酵母胞质中实现了CA的合成。通过将ATR1以连接linker的形式连接在SfCYP76AH24的C端,提高复合体CYP76AH24-ATR1催化CA前体次丹参酮二烯的催化效率,使得CA积累。敲除了内源角鲨烯合酶基因ERG9,减少二萜类前体FPP的消耗,使更多的碳通量流向CA合成途径。增加细胞色素还原酶拷贝数,提高电子供体数量,进而提高CA生物合成能力。经过上述代谢改造后,最终获得了一株以葡萄糖为底物生产CA的热带假丝酵母重组菌株HD09,经发酵后其CA产量较初始菌株M04-CD提高7.6倍。但目前还存在一些问题,比如将CA导向过氧化物酶体中后产量较胞内产量更低,具体的代谢机理还未曾得知;过表达下游CA模块和敲除或下调内源基因ERG9都会对菌体生长产生不同程度的抑制以及CA产量还有进一步提升空间等。本研究构建了以热带假丝酵母利用底物葡萄糖生产二萜类化合物CA的生物合成平台,得到了一株CA摇瓶发酵产量78.24 mg/L的重组菌株,为针对假丝酵母利用葡萄糖生产二萜类化合物的代谢改造和进一步研究提供了参考。
[1] 冀思华, 曹圣楷, 曾光尧, 等.迷迭香二萜酚类成分鼠尾草酸的研究进展[J].中南药学, 2014, 12(8):788-792. JI S H, CAO S K, ZENG G Y, et al.Advances in studies on carnosic acid from Rosmarinus officinalis L.[J].Central South Pharmacy, 2014, 12(8):788-792.
[2] BIRTI S, DUSSORT P, PIERRE F X, et al.Carnosic acid[J].Phytochemistry, 2015, 115:9-19.
S, DUSSORT P, PIERRE F X, et al.Carnosic acid[J].Phytochemistry, 2015, 115:9-19.
[3] HABTEMARIAM S.Anti-inflammatory therapeutic mechanisms of natural products:Insight from rosemary diterpenes, carnosic acid and carnosol[J].Biomedicines,2023, 11(2):545.
[4] MOORE J, YOUSEF M, TSIANI E.Anticancer effects of rosemary (Rosmarinus officinalis L.) extract and rosemary extract polyphenols[J].Nutrients, 2016, 8(11):731.
[5] CHOI S H, JANG G W, CHOI S I, et al.Development and validation of an analytical method for carnosol, carnosic acid and rosmarinic acid in food matrices and evaluation of the antioxidant activity of rosemary extract as a food additive[J].Antioxidants, 2019, 8(3):76.
[6] COLE R, 毕良武, 赵振东.欧洲迷迭香的研究状况[J].生物质化学工程, 2006, 40(2):41-44. COLE R, BI L W, ZHAO Z D.Research progress of rosemary in Europe[J].Biomass Chemical Engineering, 2006, 40(2):41-44.
[7] DUGGAL J, HARRISON J S, P STUDZINSKI G, et al.Involvement of microRNA181a in differentiation and cell cycle arrest induced by a plant-derived antioxidant carnosic acid and vitamin D analog doxercalciferol in human leukemia cells[J].microRNA E, 2012, 1(1):26-33.
[8] BAHRI S, JAMELEDDINE S, SHLYONSKY V.Relevance of carnosic acid to the treatment of several health disorders:Molecular targets and mechanisms[J].Biomedicine &Pharmacotherapy, 2016, 84:569-582.
[9] 吴蒙, 徐晓军.迷迭香化学成分及药理作用最新研究进展[J].生物质化学工程, 2016, 50(3):51-57. WU M, XU X J.New progress on chemical composition and pharmacological effects of Rosmarinus officinalis L.[J].Biomass Chemical Engineering, 2016, 50(3):51-57. [10] 王世杰, 张海冰, 沈微, 等.代谢工程改造热带假丝酵母高效合成中链ω-羟基脂肪酸[J].微生物学报, 2022, 62(1):77-89. WANG S J, ZHANG H B, SHEN W, et al.Efficient synthesis of medium-chain ω-hydroxy fatty acids by metabolic engineering in Candida tropicalis[J].Acta Microbiologica Sinica, 2022, 62(1):77-89.
[11] WANG S Z, CHENG G, JOSHUA C, et al.Furfural tolerance and detoxification mechanism in Candida tropicalis[J].Biotechnology for Biofuels, 2016, 9(1):1-11.
[12] 石莹. 长链脂肪酸转运蛋白对热带假丝酵母产二元酸的影响研究[D].济南:齐鲁工业大学, 2017. SHI Y.The effect of long chain fatty acid transport protein on the production of dicarboxylic acid in Candida tropicalis[D].Jinan:Qilu University of Technology, 2017.
[13] LI R F, SHI W N, ZHANG R L, et al.Effects of CGA-N12 on the membrane structure of Candida tropicalis cells[J].Biochemical Journal, 2020, 477(10):1813-1825.
[14] 孔婧, 朱坤, 刘士琦, 等.代谢工程改造解脂耶氏酵母合成植物萜类化合物的研究进展[J].微生物学通报, 2021, 48(4):1302-1313. KONG J, ZHU K, LIU S Q, et al.Advances in metabolic engineering of Yarrowia lipolytica to synthesize plant-derived terpenoids[J].Microbiology China, 2021, 48(4):1302-1313.
[15] 张利华. 热带假丝酵母生产萜类天然产物的系统代谢工程[D].无锡:江南大学, 2022. ZHANG L H.Systems metabolic engineering of Candida tropicalis for terpenoid production[D].Wuxi:Jiangnan University, 2022.
[16] IGNEA C, ATHANASAKOGLOU A, IOANNOU E, et al.Carnosic acid biosynthesis elucidated by a synthetic biology platform[J].Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(13):3681-3686.
[17] WEI P P, ZHANG C B, BIAN X K, et al.Metabolic engineering of Saccharomyces cerevisiae for heterologous carnosic acid production[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:916605.
[18] HAAS L O, CREGG J M, GLEESON M A.Development of an integrative DNA transformation system for the yeast Candida tropicalis[J].Journal of Bacteriology, 1990, 172(8):4571-4577.
[19] 黄玉堃, 张利华, 张海冰, 等.代谢改造热带假丝酵母提高D-乳酸的产量[J].食品与发酵工业, 2021, 47(24):109-115. HUANG Y K, ZHANG L H, ZHANG H B, et al.Metabolic engineering of Candida tropicalis to improve D-lactic acid production[J].Food and Fermentation Industries, 2021, 47(24):109-115.
[20] HAWKINS S F C, GUEST P C.Multiplex Analyses Using Real-Time Quantitative PCR[M]// Multiplex Biomarker Techniques.New York:Humana, 2017:125-133.
[21] ZHANG L H, YANG H Q, XIA Y Y, et al.Engineering the oleaginous yeast Candida tropicalis for α-humulene overproduction[J].Biotechnology for Biofuels and Bioproducts, 2022, 15(1):1-12.
[22] EL-HUNEIDI W, ANJUM S, SALEH M A, et al.Carnosic acid protects INS-1 β-cells against streptozotocin-induced damage by inhibiting apoptosis and improving insulin secretion and glucose uptake[J].Molecules, 2022, 27(7):2102.
[23] GUENGERICH F P, PARIKH A, JOHNSON E F, et al.Heterologous expression of human drug-metabolizing enzymes[J].Drug Metabolism and Disposition, 1997, 25(11):1234-1241.