半纤维素是一种复杂的多糖类化合物,主要是由甘露聚糖和木聚糖组成的[1]。被木质纤维素包裹致密的半纤维素难以被降解,限制了木材的强度[2] 和硬度,降低了资源的利用率。因此如何提高半纤维素降解效率、改善木质纤维素[3]的结构成为增强木材性能的主要问题。
降解半纤维素的方法有很多[4],使用β-甘露聚糖酶酶解是一种高效、清洁的方法。β-甘露聚糖酶广泛存在于动物、植物和微生物中,但大部分都来自于微生物[5],青霉属 (Penicillium)和木霉属 (Trichoderma)[6]微生物是生产 β-甘露聚糖酶的重要来源,且多数分泌到细胞外。
甘露聚糖酶的耐热特性使其在饲料工业[7-8]、造纸工业、食品工业[9]中有着广泛的应用。并且甘露聚糖酶在降解玉米和小麦秸秆废弃物方面也做出了重要贡献。目前,焚烧仍是处理秸秆的一种重要的方式[10],但焚烧会产生大量CH4、CO、CO2[11-13],最终会导致温室效应。2020年秸秆焚烧量已经达到了114.8万t[13]。而使用酶处理是一种温和的方式,基本不产生有毒副产物,为实现“碳中和,碳达峰”的国家战略目标提供了新研究思路。
毕赤酵母(Komagataella phaffii)作为异源蛋白的表达宿主具有显著的优点。该系统易于操作,生产成本低廉且与先进的真核表达系统 (如CHO细胞系)高度相似。与大肠细菌相比,K.phaffii表达系统可以对异源蛋白进行正确的折叠并形成二硫键,这些特性使该表达系统比细菌更有利于重组表达真核蛋白。同时,K.phaffii将异源蛋白直接分泌到培养基中,且内源蛋白的分泌水平较低,很大程度降低了下游蛋白纯化所需成本。此外,线性化的外源DNA通过交叉重组整合到K.phaffii基因组中,产生比较稳定的工程菌株。与Saccharomyces cerevisiae不同,K.phaffii将几乎所有的葡萄糖都转化为生物质而不转化为乙醇和有机酸,这使得K.phaffii在有氧条件下可以达到较高的细胞密度[14]。
1 材料与方法
1.1 材料与仪器
棘孢木霉(T.asperellum)ND-1源自内蒙古土壤样品,大肠杆菌(Escherichia coli)DH5α和BL21(DE3)购自北京博迈德基因技术有限公司,毕赤酵母X-33由本实验室保存。刺槐豆胶(locust bean gum, LBG), 美国Sigma-Aldrich公司。Xmark酶标仪,美国伯乐bio-rad有限公司;DYY-C电泳仪,北京六一生物科技有限公司。
1.2 培养基的配制
BMMY种子培养基:酵母粉10 g,胰蛋白胨20 g,100 mL 1 mol/L的磷酸钠缓冲液 (pH 6.0),去离子水定容至1 L。使用前加入无菌的100 mL 13.4%酵母基础氮源培养基和2 mL 0.02%生物素 (配方选自生工生物工程股份有限公司)。BMGY发酵培养基:在BMMY培养基的基础上,添加甘油10 g。LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10。YPD培养基(g/L):胰蛋白胨20,酵母粉10,葡萄糖20。
1.3 TaMan5A基因的克隆与表达
以新鲜菌丝为材料,利用试剂盒QIAGEN提取T.asperellum ND-1基因组,具体操作参考说明书。不同种类的微生物具有不同的密码子偏爱性,密码子的优化能够进一步提高重组蛋白在K.phaffii中的表达水平[15]。将TaMan5A送至北京擎科生物科技股份有限公司进行密码子优化,有效提高甘露聚糖酶TaMan5A在毕赤酵母中表达水平。
1.4 TaMan5A酶活力测定
用50 mmol/L,pH 4.0乙酸钠缓冲液配制5 g/L LBG溶液,将50 μL酶液与450 μL LBG混匀,65 ℃反应10 min,加入750 μL DNS,沸水浴5 min,测定OD540值。以缓冲液反应体系为空白对照,参考甘露糖标准曲线计算酶活力。上述条件下,将1 min内水解LBG产生1 μmol甘露糖所需的酶量作为一个酶活力单位。
1.5 TaMan5A酶学性质
1.5.1 最适pH及其稳定性
最适pH:配制50 mmol/L pH 2.0~8.0的缓冲液各100 mL[16],并用不同pH缓冲液配制底物,稀释酶液,测定不同pH条件下的酶活性,将最大酶活力作为100%。
pH稳定性:将用不同pH缓冲液稀释了100倍的酶液放入4 ℃冰箱中,孵育1 h,重复测定最适pH的实验步骤。以未孵育酶液测得的酶活力为100%。
1.5.2 最适温度及其稳定性
最适温度:设定了7个温度梯度(20~80 ℃),用50 mmol/L pH 4.0的醋酸钠缓冲液溶解底物并稀释酶液。设定最大酶活力为100%,分别测定不同温度下的酶活性。
温度稳定性:将稀释100倍的酶液在不同温度下孵育30 min。以未孵育的酶液测得的酶活力作为100%,分别测定不同温度下的酶活性。
1.5.3 乙醇和NaCl浓度变化对TaMan5A酶活性的影响
在2 mL离心管内分别加入2.5%、5%、10%、20%(体积分数)的乙醇和稀释了10倍的酶液,在另外的2 mL离心管内分别加入50、100、150 g/L的NaCl溶液和稀释了10倍的酶液,同放入4 ℃冰箱内孵育1 h,将未加乙醇和NaCl溶液的纯酶液组所测得的酶活力作为100%,测定不同乙醇和NaCl浓度处理组别的相对酶活力。
1.5.4 金属离子对TaMan5A酶活性的影响
用50 mmol/L pH 4.0的醋酸钠缓冲液稀释金属离子溶液和酶液,使得金属离子终浓度分别为1、5 mmol/L。将酶与金属混合液放入4 ℃冰箱内孵育1 h,将未加金属离子的酶液组所对应的酶活力作为100%,测定不同浓度金属离子处理酶液的相对酶活力。
1.6 曲面优化
1.6.1 单因素试验
以温度50 ℃、pH 4.0、玉米秸秆用量0.25 g、TaMan5A用量0.2 g、纤维素酶用量0.3 g、水解2 d为基础组合条件。首先采用单因素的方法优化秸秆降解效率,依次对pH值(2.0~8.0),玉米秸秆用量 (0.1~0.75 g),TaMan5A用量 (0.1~0.5 g),时间(1~3 d)进行优化,每次均以最佳条件作为定量值,以需优化单因素作为变量,获得单因素最佳优化条件。设计方案如表1。
表1 实验因素水平分析
Table 1 Analysis of experimental factor levels
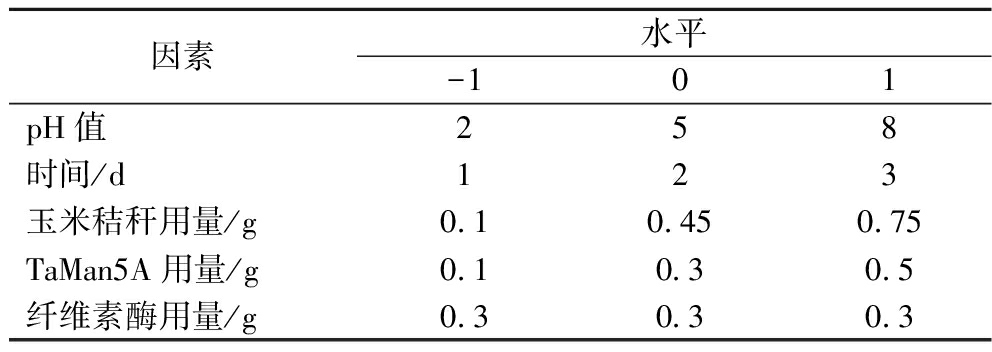
因素水平-101pH值258时间/d123玉米秸秆用量/g0.10.450.75TaMan5A用量/g0.10.30.5纤维素酶用量/g0.30.30.3
1.6.2 曲面优化
在优化单因素结果的基础上,以pH、玉米秸秆用量、TaMan5A用量、时间为自变量,以OD值为响应量对秸秆的降解效率进行优化。实验优化结果见表2。
表2 响应曲面设计方案及实验结果
Table 2 Response surface design scheme and experimental results
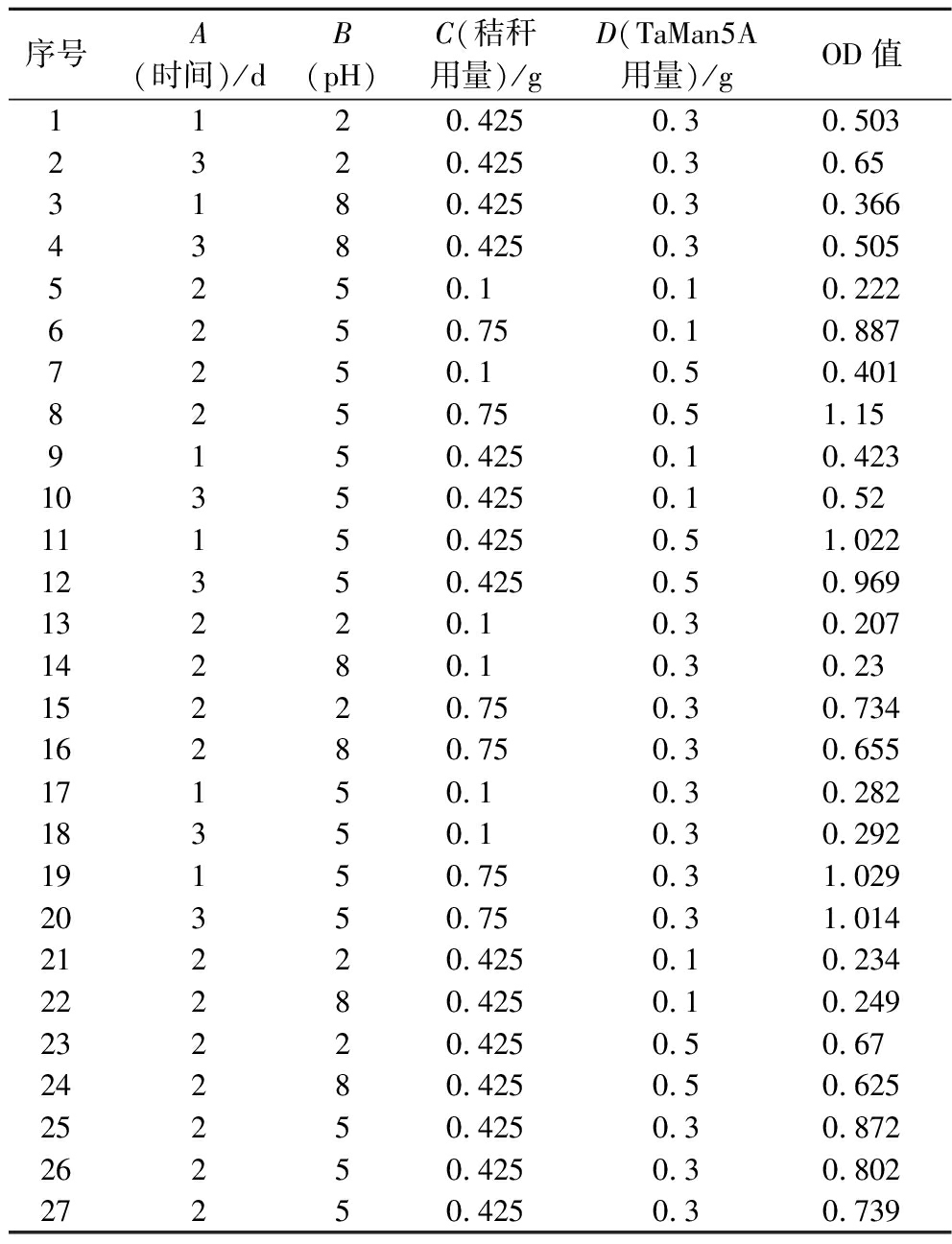
序号A(时间)/dB(pH)C(秸秆用量)/gD(TaMan5A用量)/gOD值1120.4250.30.5032320.4250.30.653180.4250.30.3664380.4250.30.5055250.10.10.2226250.750.10.8877250.10.50.4018250.750.51.159150.4250.10.42310350.4250.10.5211150.4250.51.02212350.4250.50.96913220.10.30.20714280.10.30.2315220.750.30.73416280.750.30.65517150.10.30.28218350.10.30.29219150.750.31.02920350.750.31.01421220.4250.10.23422280.4250.10.24923220.4250.50.6724280.4250.50.62525250.4250.30.87226250.4250.30.80227250.4250.30.739
1.7 实验数据的处理
酶学性质测定均作了2次重复,并设定了空白对照,采用Origin 2017对数据进行分析处理。
2 结果与分析
2.1 甘露聚糖酶基因TaMan5A的克隆
基于前期基因组测序信息,课题组从T.asperellum ND-1基因组中筛选了一个GH5家族的甘露聚糖酶基因TaMan5A,根据酵母密码子偏爱性,将甘露聚糖酶基因TaMan5A进行优化合成,并将其连在 pPICZαA表达质粒上,命名为pPICZα-TaMan5A。利用限制性内切酶Sac I对质粒pPICZα-TaMan5A进行线性化, 浓缩之后电转入K.phaffii中, 并在含有100 μg/mL Zeocin抗性的YPDS平板上进行培养和纯化。重组菌株命名为TaMan5A-X33。利用引物 (AOX-F:GACTGGTTCCAATTGACAAGC,AOX-R:GCAAATGGCATTCTGACATCC)对其进行PCR验证。由图1对比DNA marker可得,该基因的长度为941 bp;且3和4泳道上均得到了很亮的PCR扩增条带,说明2个工程菌均为真阳性。故本实验得到的K.phaffii重组子为阳性克隆。
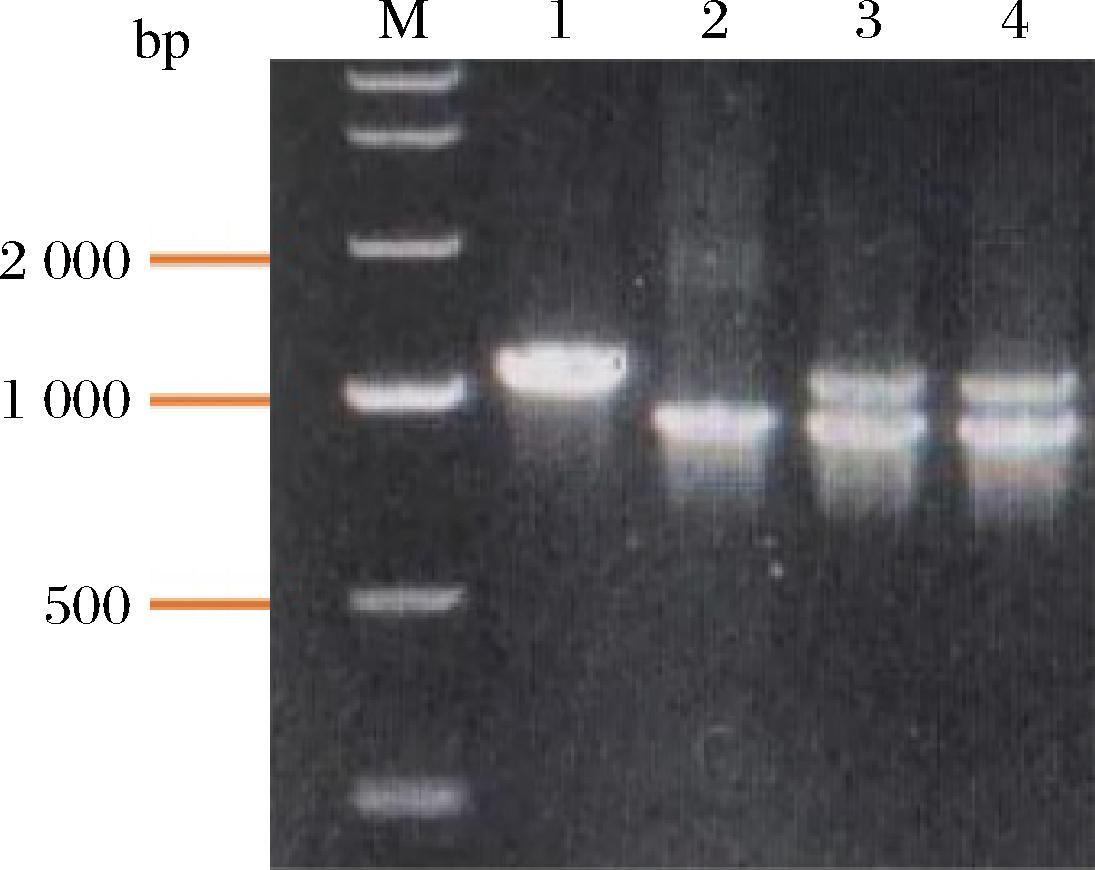
M-DNA marker;1-负对照;2-正对照;3,4-构建的工程菌株
图1 PCR验证K.phaffii重组
Fig.1 PCR verification of K.phaffii recombination
2.2 诱导表达
将成功设计的K.phaffii重组菌株 TaMan5A-X33在含Zeocin抗性的YPD平板上进行划线。28 ℃, 200 r/min培养, 利用1%的甲醇诱导132 h后, 收集上清液。利用SDS-PAGE对蛋白表达水平进行分析,得到一条分子质量约为67 kDa的蛋白条带(图2), 与分子质量的理论值相一致。随着诱导时间的延长, TaMan5A的表达量逐渐增多,说明TaMan5A在X-33中表达成功, 且蛋白纯度较高, 可直接进行后续的酶学性质研究。
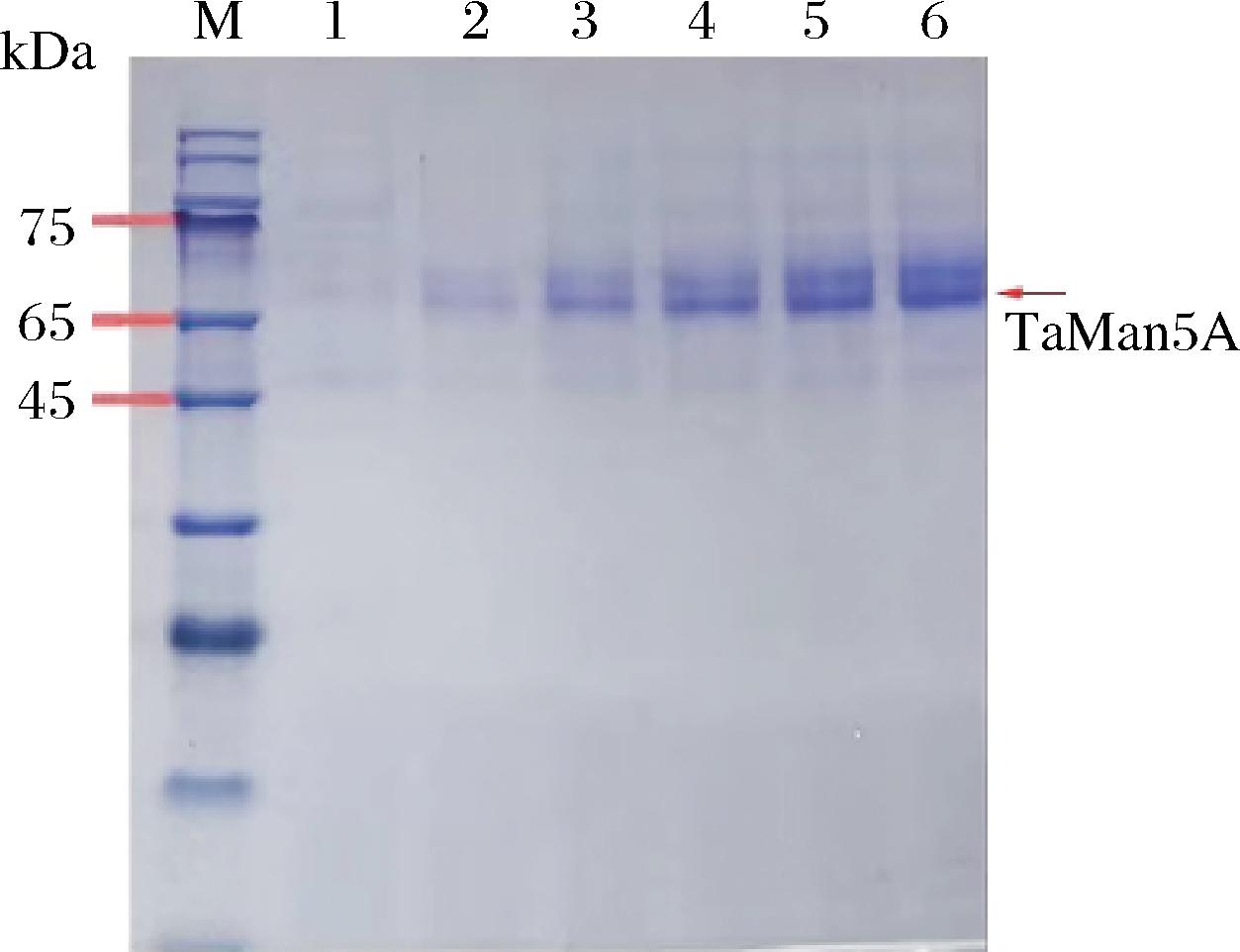
M-标准蛋白分子质量marker;1-0 h;2-24 h; 3-48 h;4-72 h;5-96 h;6-120 h
图2 TaMan5A 0~120 h摇瓶诱导表达
Fig.2 Induced expression of TaMan5A in shake flasks from 0 to 120 hours
2.3 TaMan5A酶学性质的分析
2.3.1 最适pH及其稳定性
离心获得的上清液即为实验测定酶液TaMan5A,如图3-a所示,在pH 2.0~8.0,酶活力呈现先上升后下降的趋势,相对酶活力都高于35%,pH 4.0条件下测得最高酶活力,pH 5.0~8.0的条件下,酶活力不断下降,是一类中性嗜酸酶。来源不同的甘露聚糖酶pH偏好不同,从枯草杆菌YZ-21中克隆出的甘露聚糖酶,其最适pH值为7.0,是一种pH中性酶[17]。如图3-b所示,pH 2.0~6.0的范围内残留酶活力都在80%以上,TaMan5A在该pH条件范围内稳定性高。pH>6.0时,残留酶活力下降明显,稳定性降低,但最低剩余酶活力也在43%以上。表明TaMan5A有较强的pH稳定性。
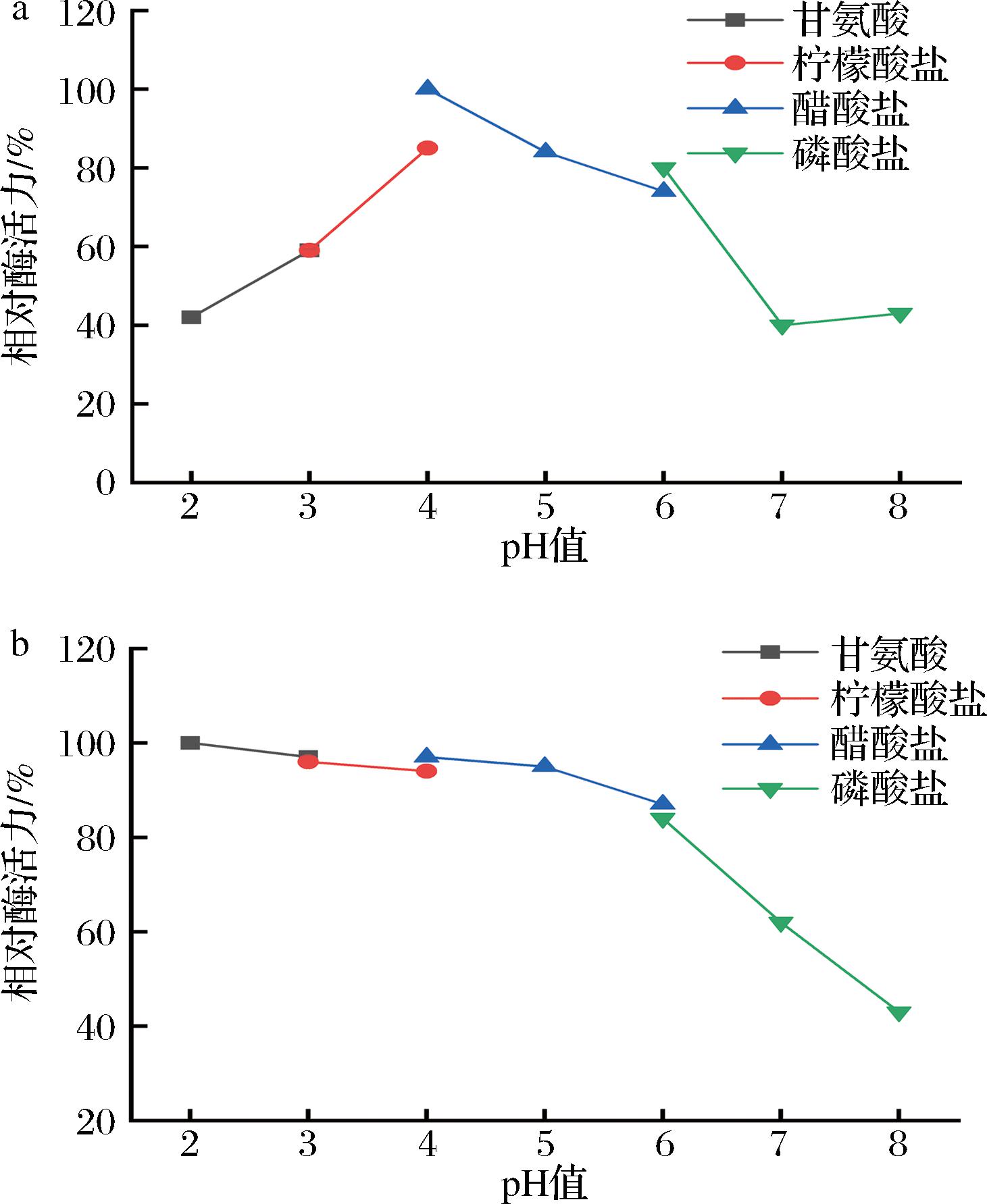
a-最适pH;b-pH稳定性
图3 TaMan5A的最适pH 及pH稳定性
Fig.3 Optimal pH and pH stability of TaMan5A
2.3.2 最适温度及其稳定性
如图4-a所示,在20~65 ℃时,随着温度升高,酶活力不断提升,20 ℃下,酶活力达到56%,在65 ℃下,酶活力最高,70 ℃~80 ℃时,酶活力下降明显,但80 ℃下仍有57%的剩余酶活力。从地衣芽孢杆菌KD-1中克隆出来的甘露聚糖酶的最适温度为60 ℃,2种酶都具有嗜高温属性[18]。如图4-b所示,该酶在20~60 ℃内相对稳定。高于60 ℃,相对酶活力略有下降,在80 ℃仍有75%的剩余酶活力。可知,TaMan5A具有耐高温,温度稳定性强的特质。
2.3.3 乙醇和NaCl浓度变化对TaMan5A的影响
如图5-a所示,各乙醇浓度下的相对酶活力都略有下降,但最低也能够达到90%。如图5-b所示,50 g/L NaCl条件下,酶活力提升了8%,对酶活力起促进作用。100、150 g/L NaCl条件下,相对酶活力都有所下降,对酶活力起抑制作用。但最低酶活力也能达到94%,表明TaMan5A对乙醇和NaCl有较好的耐受力。
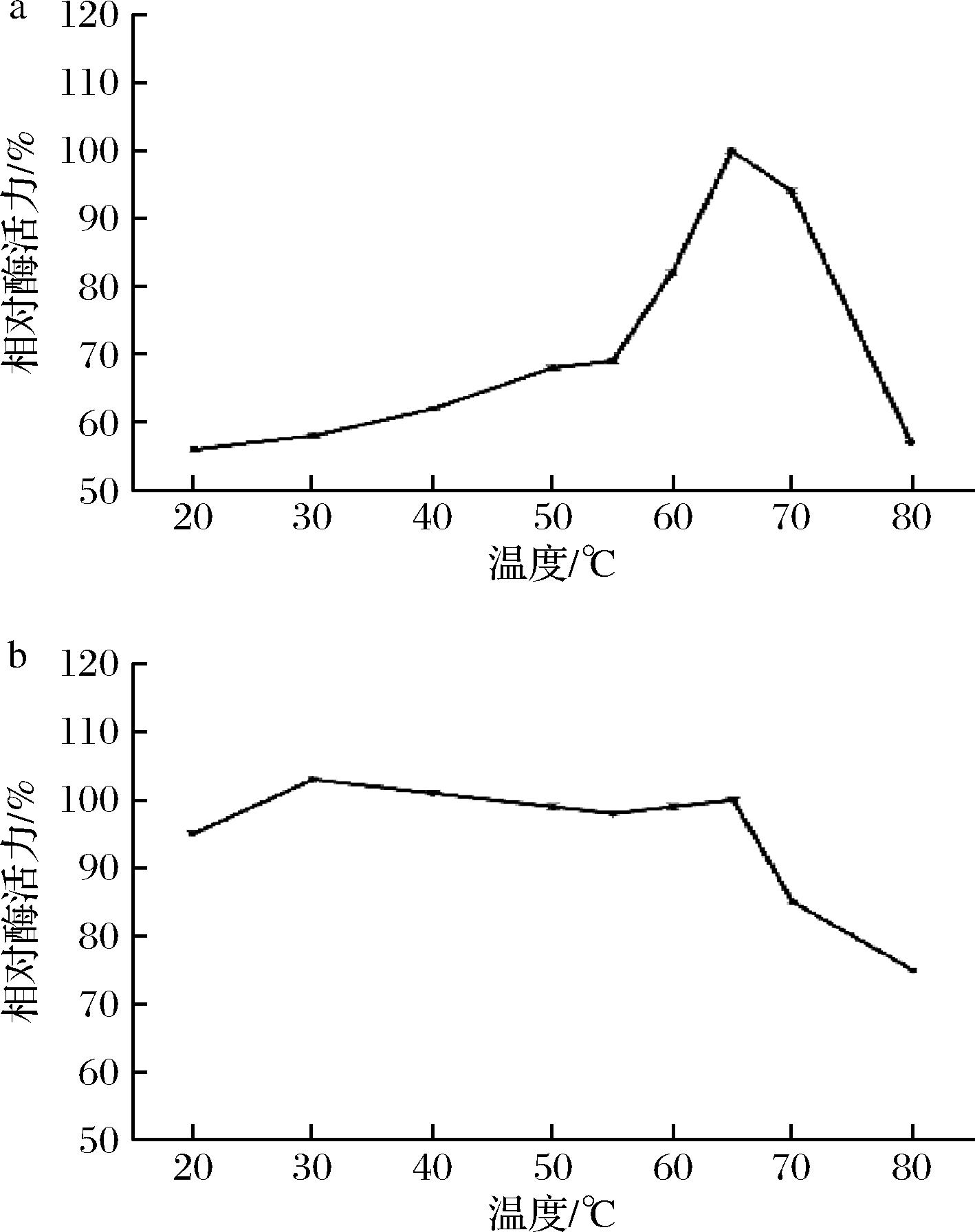
a-最适温度;b-温度稳定性
图4 TaMan5A的最适温度及温度稳定性
Fig.4 Optimal temperature and temperature stability of TaMan5A
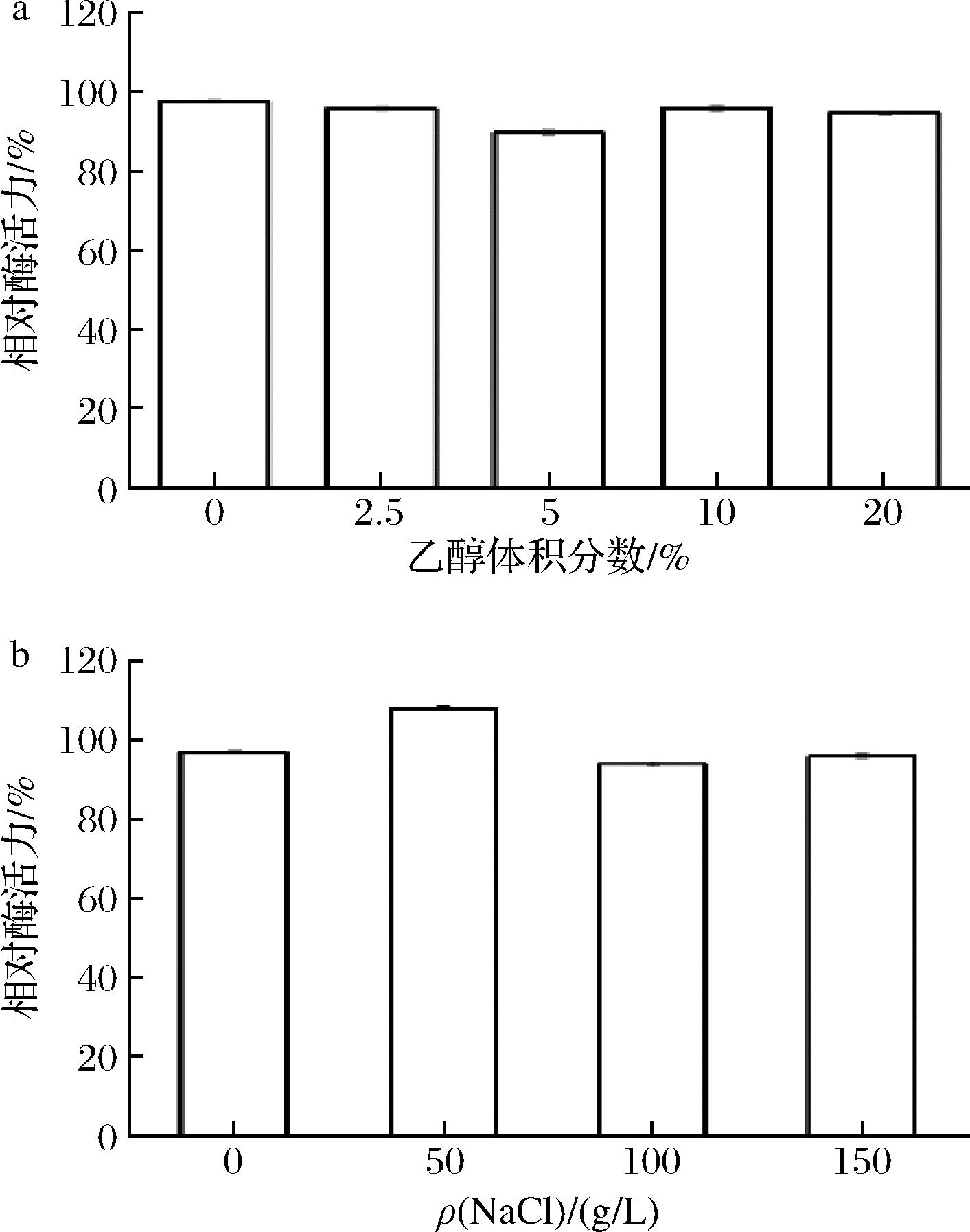
a-乙醇体积分数;b-NaCl质量浓度
图5 乙醇及NaCl浓度对TaManA的影响
Fig.5 Effect of changes in ethanol and NaCl concentration on TaMan5A
2.3.4 金属离子对TaMan5A的影响
如图6-a所示,与对照相比,1 mmol/L的Co2+、脲使酶活力有所提升,Co2+使酶活力提高了18%,促进效果最明显。Cu2+使酶活力降低了30%,抑制效果最强。如图6-b所示,5 mmol的SDS、Zn2+、Fe2+、Mn2+、Co2+、Ni+均使酶活力有所提升,其中在Fe2+、Co2+使酶活力分别提升了17%和15%,促进效果最明显。Mg2+、脲、Pb2+ 条件下,相对酶活力只有49%、55%和68%,对酶活力抑制能力强。
2.4 优化协同降解效率
2.4.1 单因素试验
OD540值反映了秸秆协同降解效果,OD540值越高,秸秆降解效率越高。由图7-a所示,水解2 d,OD540值最高,是其最佳反应时间。在最优时间下,测定最适pH值(图7-b),pH 4.0时OD540值最高,在pH=2.0或8.0时,秸秆几乎不被降解。在已知的最优条件下,测定玉米秸秆量对降解效果的影响 (图7-c),0.5 g秸秆时OD540值最高,是最佳秸秆用量。最后,测定最适TaMan5A用量 (图7-d),添加0.5 g TaMan5A时OD540值最高。在邵丽杰等[19]的单因素优化实验中,pH 4.8,温度51 ℃,水解56 h时有最高降解效率,与本实验最优基础条件相似。其最适半纤维素添加量为0.004 g/mL,本实验最佳添加量为0.05 g/mL,TaMan5A降解秸秆能力仍需优化。
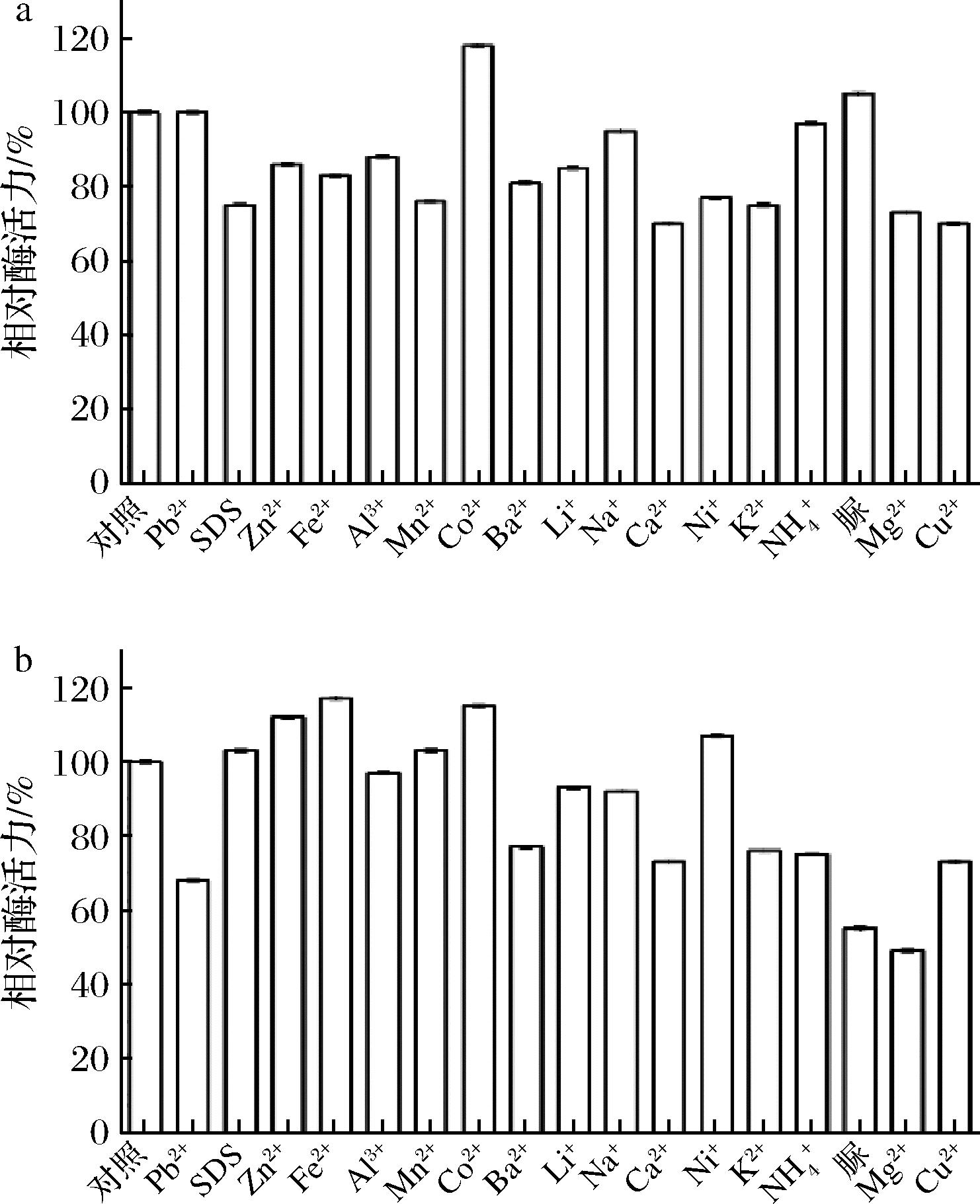
a-1 mmol/L金属离子;b-5 mmol/L金属离子
图6 1 mmol/L 及5 mmol/L金属离子对TaMan5A的影响
Fig.6 Effect of metal ions 1 mmol/L and 5 mmol/L on TaMan5A
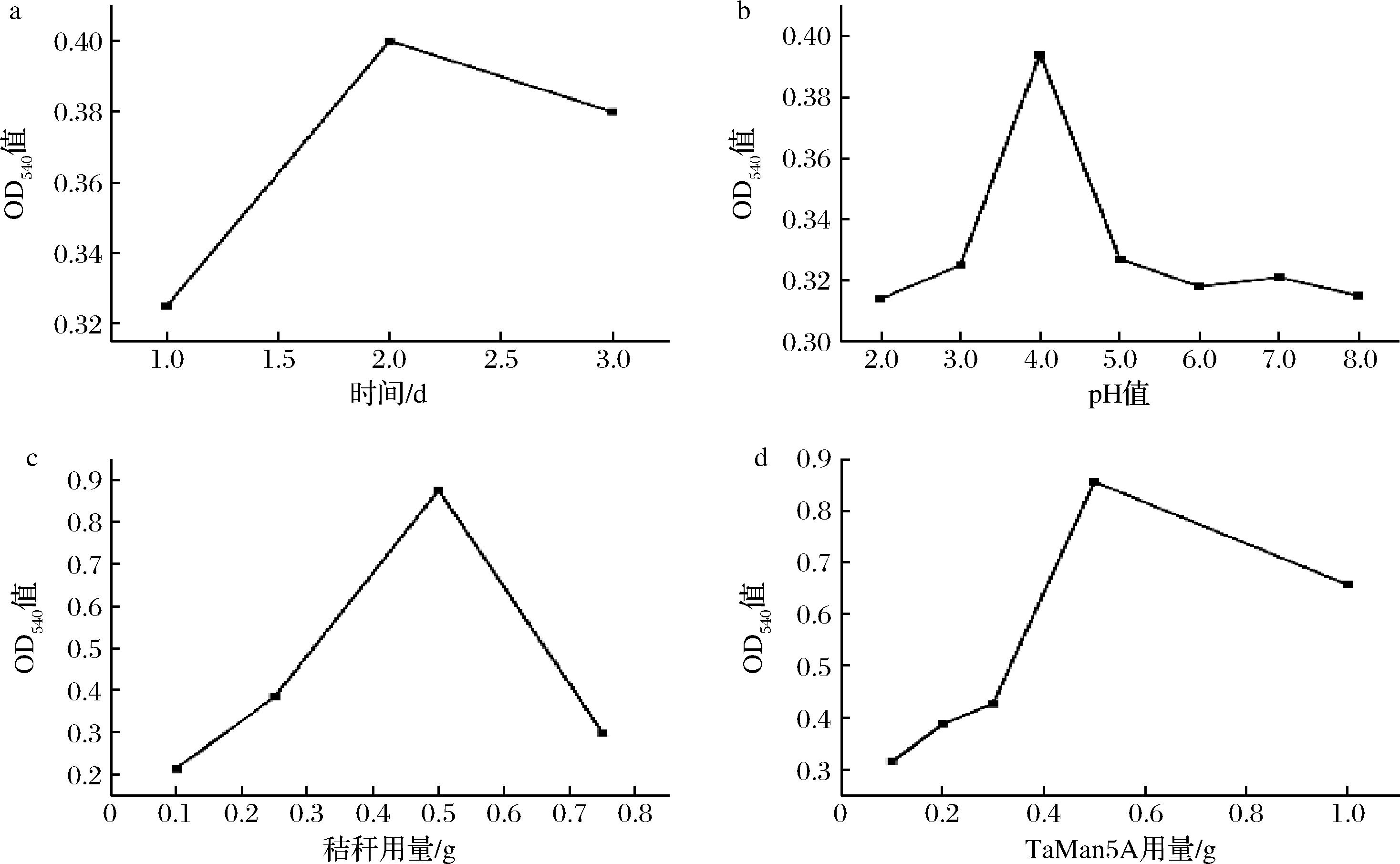
a-时间;b-pH值;c-秸秆用量;d-TaMan5A用量
图7 时间、pH、秸秆用量及TaMan5A用量单因素试验
Fig.7 Results of single-factor determinations with respect to degradation time, pH, corn stover amount, and TaMan5A amount
2.4.2 曲面优化
通过最小二乘法回归方程式分析得到时间、pH、秸秆用量、TaMan5A用量的二次多项回归模型:OD=0.804 3+0.027 1A-0.030 7B+0.319 6C+0.191 8D-0.002 0AB-0.006 2AC-0.037 5AD-0.025 5BC-0.015 0BD+0.021 0CD-0.031 9A2-0.275 3B2-0.090 9C2-0.057 3D2,对该模型进行方差分析,由表3可知,模型的P<0.01,说明实验模型极显著;缺乏拟合项(P=0.303 6>0.05),决定系数R2=94.38%,该回归方程的拟合度良好,模型成立。方程一次项中C、D(P<0.000 1)极其显著,底物量、TaMan5A用量对秸秆降解效率有很大影响,根据F值大小可以判断本实验所采用的4个因素对秸秆降解效率影响的主次顺序为 (秸秆用量>TaMan5A用量>pH>时间),二次项B2极显著 (P<0.01),pH的二次效应在实验中具有一定重要性。
由表3和图8分析可得出时间、秸秆用量、TaMan5A用量,pH值的P值都大于0.01,交互都不显著,表明因素间是独立的。其中底物用量和TaMan5A用量的F值分别为115.96和41.78,P值都小于0.01, 在提高秸秆讲解效率的过程中发挥着重要着作用。
表3 方差分析表
Table 3 Analysis of variance
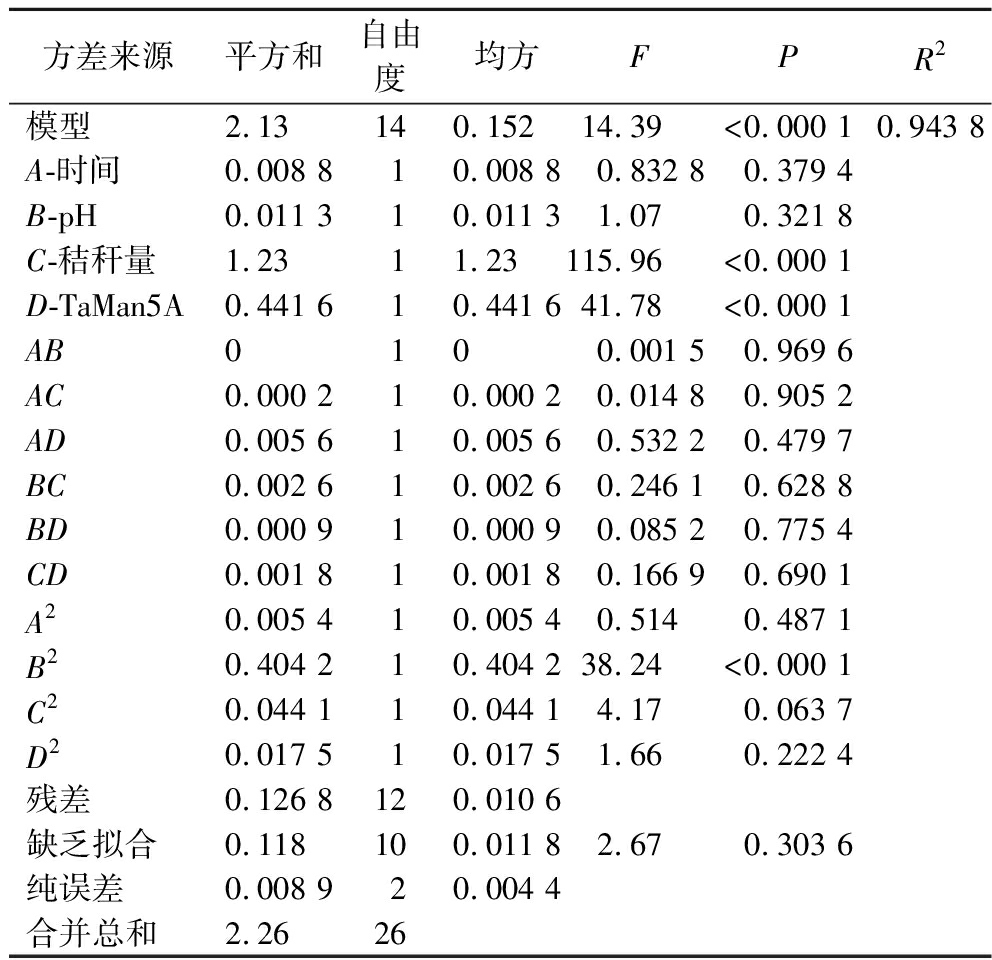
方差来源平方和自由度均方FPR2模型2.13 140.152 14.39 <0.000 10.943 8A-时间0.008 810.008 80.832 80.379 4B-pH0.011 310.011 31.070.321 8C-秸秆量1.2311.23115.96<0.000 1D-TaMan5A0.441 610.441 641.78<0.000 1AB0100.001 50.969 6AC0.000 210.000 20.014 80.905 2AD0.005 610.005 60.532 20.479 7BC0.002 610.002 60.246 10.628 8BD0.000 910.000 90.085 20.775 4CD0.001 810.001 80.166 90.690 1A20.005 410.005 40.5140.487 1B20.404 210.404 238.24<0.000 1C20.044 110.044 14.170.063 7D20.017 510.017 51.660.222 4残差0.126 8120.010 6缺乏拟合0.118100.011 82.670.303 6纯误差0.008 920.004 4合并总和2.2626
3 结论与讨论
TaMan5A基因是从T.asperellum ND-1中首次克隆出来,并在K.phaffii中成功表达的。其最适pH值和温度分别是4.0、65 ℃,是一种耐酸、耐高温的酶。且该酶对碱性条件也要一定的耐受力,在pH=7.0时,仍有48%酶活力,有较宽pH生长范围。在1 mmol/L的情况下,Co2+、脲,能提高TaMan5A的酶活力。在5 mmol/L的情况下,SDS、Zn2+、Fe2+等多种金属离子都对TaMan5A有激活作用。在秸秆降解过程中,秸秆用量和TaMan5A用量对降解效率影响最大。课题组从T.asperellum中克隆出来的TaMan5a,与李珊珊等[20]从黑曲霉克隆出来的甘露聚糖酶有很大的相似性,最适pH值同为4.0,耐酸。2种甘露聚糖酶同耐高温,最适温度都在65 ℃以上。研究以新选育的T.asperellum ND-1为出发菌株,筛选出了TaMan5A,同时探讨了其功能作用及高效表达模式,可为相关研究提供参考。

a-pH值与时间交互;b-TaMan5A用量与pH值交互; c- TaMan5A用量与时间交互;d-秸秆用量与时间交互; e-秸秆用量与pH值交互;f-秸秆用量与TaMan5A用量交互
图8 两因素交叉作用对响应值的影响
Fig.8 Response surface diagram of the effect of the intersection of two factors on the response value
[1] SUN Y C, ZHOU X H, ZHANG W, et al.Enhanced β-mannanase production by Bacillus licheniformis by optimizing carbon source and feeding regimes[J].Preparative Biochemistry &Biotechnology, 2022, 52(7):845-853.
[2] 雒翠梅, 王旭洁, 母军, 等.外源酸催化对木材半纤维素热降解规律的影响[J].北京林业大学学报, 2022, 44(4):147-156. LUO C M, WANG X J, MU J, et al.Effects of exogenous acid catalysis on the thermal degradation law of wood hemicellulose[J].Journal of Beijing Forestry University, 2022, 44(4):147-156.
[3] 张瀚文, 陈正军, 张晨雨, 等.木质纤维素预处理技术研究现状与展望[J].化工矿物与加工, 2023:1-15. ZHANG H W, CHEN Z J, ZHANG Y C, et al.Research status and prospects of wood cellulose pretreatment techniques[J].Chemical Engineering &Mineral Processing, 2023, 1-15.
[4] WEIMER P J.Degradation of cellulose and hemicellulose by ruminal microorganisms[J].Microorganisms, 2022, 10(12):2345.
[5] BEHERA S, DEV M J, SINGHAL R S.Cross-linked β-mannanase aggregates:Preparation, characterization, and application for producing partially hydrolyzed guar gum[J].Applied Biochemistry and Biotechnology, 2022, 194(5):1981-2004.
[6] LIAO H P, LI S X, ZHENG H P, et al.A new acidophilic thermostable endo-1, 4-β-mannanase from Penicillium oxalicum GZ-2:Cloning, characterization and functional expression in Pichia pastoris[J].BMC Biotechnology, 2014, 14:90.
[7] 徐智鹏, 周迪, 陈敬帮, 等.甘露聚糖酶在发酵棕榈粕中的应用及仿生消化研究[J].中国饲料, 2023(5):168-171. XU Z P, ZHOU D, CHEN J B, et al.Application of mannanase in fermented palm meal and study on biomimetic digestion[J].China Feed, 2023(5):168-171.
[8] ANGURAL S, JASSAL S, WARMOOTA R, et al.An integrated approach for pulp biobleaching:Application of cocktail of enzymes[J].Environmental Science and Pollution Research, 2023, 30(19):57155-57163.
[9] 王烁, 季海蕊, 曹慧莹, 等.干酪乳杆菌产β-甘露聚糖酶发酵条件优化及在果汁澄清中的应用[J].中国酿造, 2022, 41(11):144-149. WANG S, JI H R, CAO H Y, et al.Optimization of fermentation conditions and application in fruit juice clarification of β-mannanase from Lactobacillus casei[J].China Brewing, 2022, 41(11):144-149. [10] PIAO M Y, LI A, DU H S, et al.A review of additives use in straw composting[J].Environmental Science and Pollution Research International, 2023, 30(20):57253-57270.
[11] 杜亚彬, 赵红梅, 张学磊, 等.基于WRF-CMAQ评估秸秆禁烧对区域空气质量的影响[J].中国环境科学, 2022, 42(12):5578-5588. DU Y B, ZHAO H M, ZHANG X L, et al.Evaluation of the impacts of straw burning ban on air quality based on WRF-CMAQ[J].China Environmental Science, 2022, 42(12):5578-5588.
[12] 蒋斌, 陈多宏, 张涛, 等.华南水稻秸秆焚烧期碳质气溶胶组分特征及源贡献评估[J].生态环境学报, 2022, 31(12):2358-2366. JIANG B, CHEN D H, ZHANG T, et al.Characteristics and sources of carbonaceous aerosols during the crop straw burning seasons in southern China[J].Ecology and Environmental Sciences, 2022, 31(12):2358-2366.
[13] 刘慧琳, 莫招育, 覃纹, 等.广西秸秆露天焚烧源排放清单及时空分布研究[J].环境污染与防治, 2022, 44(5):631-638. LIU H L, MO Z Y, QIN W, et al.Emission inventory and the spatio-temporal distribution of pollutant from open field straw burning in Guangxi[J].Environmental Pollution &Control, 2022, 44(5):631-638.
[14] ÖZÇELIK A T, Y LMAZ S, INAN M.Pichia pastoris promoters[J].Methods in Molecular Biology, 2019, 1923:97-112.
LMAZ S, INAN M.Pichia pastoris promoters[J].Methods in Molecular Biology, 2019, 1923:97-112.
[15] ZHAO W, ZHENG J, ZHOU H B.A thermotolerant and cold-active mannan endo-1, 4-β-mannosidase from Aspergillus niger CBS 513.88:Constitutive overexpression and high-density fermentation in Pichia pastoris[J].Bioresource Technology, 2011, 102(16):7538-7547.
[16] ZHENG F Z, SONG L N, BASIT A, et al.An endoxylanase rapidly hydrolyzes xylan into major product xylobiose via transglycosylation of xylose to xylotriose or xylotetraose[J].Carbohydrate Polymers, 2020, 237:116121.
[17] 和子涵, 穆广亚, 贾一然, 等.椰果内生枯草芽孢杆菌YZ-21甘露聚糖酶基因的克隆、表达及酶学性质研究[J].饲料工业, 2023, 44(15):71-78. HE Z H, MU G Y, JIA Y R, et al.Cloning, expression and enzymatic properties of mannanase gene from Bacillus subtilis YZ-21 in coconut[J].Feed Industry, 2023, 44(15):71-78.
[18] 田庚, 高伟强, 陈晓波, 等.地衣芽孢杆菌KD-1β-甘露聚糖酶定点突变提高酶活性及稳定性[J].生物技术通报, 2021, 37(10):100-109. TIAN G, GAO W Q, CHEN X B, et al.Directed mutagenesis of β-mannanase gene from Bacillus licheniformis KD-1 for improving enzyme activity and stability[J].Biotechnology Bulletin, 2021, 37(10):100-109.
[19] 邵丽杰, 寇巍, 曹焱鑫, 等.纤维素酶、半纤维素酶降解膨化玉米秸秆工艺优化[J].环境工程学报, 2014, 8(10):4373-4378. SHAO L J, KOU W, CAO Y X, et al.Optimization of degradation of expanded corn straw by cellulase and hemicellulase[J].Chinese Journal of Environmental Engineering, 2014, 8(10):4373-4378.
[20] 李珊珊, 刘德海, 刁文涛, 等.黑曲霉β-甘露聚糖酶ManA耐热突变体的筛选[J].中国酿造, 2022, 41(3):62-68. LI S S, LIU D H, DIAO W T, et al.Screening of thermostable mutants of β-mannanase ManA from Aspergillus niger[J].China Brewing, 2022, 41(3):62-68.