氨基甲酸乙酯(ethyl carbamate, EC)是一种在发酵食品的储藏和运输过程中生成的有毒物质,对人类具有潜在的致癌性[1]。据报道,发酵酒精饮料中的乙醇可增强EC的致癌性[2],因此,为保障食品的安全性,需要对黄酒、葡萄酒、清酒、白兰地等发酵酒精饮料中EC的含量进行严格控制。黄酒中EC的含量上限为100 μg/L,而目前国内黄酒酿造中EC的含量最高可达750 μg/L[3],这不但影响长期饮酒者的健康,也会造成因未达到食品安全标准而影响出口的问题。减少食品中EC的主要方法有工艺优化法[4]、发酵菌株的代谢工程改造法[5]和酶促降解法[6-7]。前两种策略主要针对EC的底物和生成途径进行消减和改造,但这两种策略会产生无法完全消减EC、EC降解效率低、食品风味受损等问题。酶促降解法主要涉酸性脲酶[8]和EC水解酶[9],这2种酶能够分别将尿素和EC转化为乙醇、CO2和NH3[10-11]。脲酶是许多国家允许在发酵酒精饮料中添加的酶,它能通过有效地降解尿素(EC的前体)来控制EC的含量,但不能降解已形成的EC。EC水解酶可以直接水解EC,但EC水解酶难以在工业中得到应用,主要由于其乙醇耐受性较差且可溶性表达量较低,易形成不溶于水的、难以应用的包涵体。
目前,酶的改性策略包括理性设计[12]、定向进化[13]和半理性设计[14]。LIU等[15]通过对双功能脲酶结构进行解析,筛选出预计对酶活性影响较大的目标氨基酸位点,然后通过饱和突变筛选出了活性和乙醇耐受性提高的双功能脲酶。康婷婷[16]通过多序列比对挖掘突变位点提高了来自Agrobacterium tumefaciens的酰胺酶AmdA的活性和乙醇耐受性。酶的理性设计中,PROSS计算是一种在服务器中能够实现自由计算的程序,该程序通过将构象自由能和序列保守性相结合,筛选出蛋白结构中易产生错误折叠和不稳定的区域进行修饰和改造,从而达到可溶性表达和稳定性等酶学性质的提高[17]。PELEG等[18]将PROSS作为独立的应用工具进行了基准测试,10个目标蛋白中有9个热稳定性得到提高。此外,有2个野生型(wild type,WT)蛋白质在大肠杆菌中不能作为可溶性蛋白质表达,但经PROSS设计改造后,实现了高水平表达,并提高了热稳定性,证明PROSS可提高蛋白质的热稳定性和可溶性表达水平。因此,利用PROSS对EC水解酶的整体结构和序列进行计算,可能获得可溶性及稳定性等酶学性质得到提升的高性能突变体。
此外,对蛋白可溶性表达的改造主要策略还有:针对蛋白表达条件的优化[19],以及针对蛋白本身添加标签进行融合表达[20]等。表达条件的优化主要是指改变蛋白表达过程中的某些条件,从而达到促进蛋白正确折叠的目的,例如改变蛋白的表达温度、诱导蛋白表达的诱导剂浓度或在表达环境中添加化学分子伴侣等。李京京[21]曾通过调整EC水解酶的表达培养基、IPTG浓度、培养温度、培养时间以及添加蔗糖和山梨醇改变疏水渗透压等方法来优化EC水解酶的可溶性表达。融合标签能够促进蛋白可溶性表达的原因主要有:融合标签对分子伴侣有一定吸引作用,从而使蛋白能够在其指导下进行折叠减少错误概率;融合标签能够隔离错误折叠区域,从而使正确折叠结构暴露,增加其可溶性[22];融合标签所带的静电荷也可防止蛋白聚集从而形成包涵体[23]。
本研究以提高EC水解酶的工业属性为目标,拟结合基于计算辅助的酶工程手段与促溶标签优化表达等策略,改造获得活力高、可溶性表达好、乙醇稳定性强的高性能EC水解酶,为促进EC水解酶的工业化应用提供参考。
1 材料与方法
1.1 实验材料
克隆宿主大肠杆菌Escherichia coli JM109、表达宿主大肠杆菌E. coli BL21(DE3)、空质粒pET-20b,实验室保藏;EC水解酶基因来源于Lysinibacillus fusiformis SCO2 (GenBank ID: KU353448);酵母提取物、蛋白胨、NaCl、甘油、Na2HPO4、K2HPO4、亚硝基铁氰化钠、苯酚、NaClO、NaOH、三氯乙酸,国药集团化学试剂有限公司; IPTG、氨苄西林,上海生工生物工程有限公司;EC,美国Sigma公司;质粒提取试剂盒、Bradford蛋白定量试剂盒、Fast Mutagenesis kit V2试剂盒,TaKaRa公司。引物由金唯智公司合成,本文所用引物和序列见表1。
表1 本研究所使用的引物
Table 1 Primers used in this study

名称上游引物下游引物S21ECCATTACTTGCATCAAAGGAACTATCTCCCGTGTTAATTCCACGGGAGATAGTTCCTTTGATGCAAN135STATGCATGGGGAATTACCTCTAACAACCCTCATGCCATAATGAGGGTTGTTAGAGGTAATTCCCCH197YTAGGTTTAAAACCTACATATGGTCGTGTAACGTATTTACTTACACGACCATATGTAGGTTTTG227LGTTAAGGATGCAGCGCTTTTGCTCGAAGTAGCAATGACTTCGAGCAAAAGCGCTGCATCH237PAAGTCATTGCTGGTTTTGATCCTCAAGACCCTCACGCAAGTAGGGTCTTGAGGATCAAAACCAD248PTTGCGTGAATGTTCCAGTACCTAACTATGAGAAAGCTGCTTCTCATAGTTAGGTACTGGAACATE251LATGTTCCAGTAGACAACTATCTTAAGCAGCTTATTGCCAGTAAGCTGCTTAAGATAGTTGTCTN257DAGAAGCAGCTTACTGGCGATATCAAAGATCCAATCACTAGATCTTTGATATCGCCAGTAAGCV262RCTGGCAATATCAAAGATCTACGTATTGGTATCAATTCTTCATTGATACCAATACGTAGATCTTTGAS285AAGAGAAGGCTGTTAGAGCAGCTATTCAAAGCTATCCACTAAGCTTTGAATAGCTGCTCTAACAS292LTATTCAAAGCTTAGTGGATCTTGGCGCTAAAGTTCTACTTTAGCGCCAAGATCCACTAAGV298EGCGCTAAAGTAGAAGAAGTGCGTATTCGGGAAGGAATACGCACTTCTTCTACTTTAS315IGCAGAGCTTGTGACGATTCTTTCAGAGGGCTGCCTCTGAAAGAATCGTCACAAGCS325EGCAGCAGCTATACACCATGAAGATTTACAAAGGTCTCTTTTGTAAATCTTCATGGTGTATAP348IGCTTGGTGAGTTGATTTCTGCAGTCGTAATCGACTGCAGAAATCAACTCACCAI370VCAGGAGTTTACAGAGGTTTTTAATAAGACATCTACCTTATTAAAAACCTCTGTAAAG412ATTATCCGCTTTACAGCTCCTAGTAACTTATTAAGTTACTAGGAGCTGTAAAGCGGAA442PAAATTATTGGCCCACCTTTTAAAGAAGCGTCCTTCTTTAAAAGGTGGGCCAATN-SVM1TATACATGAGGACGATGAGGAAAAGGAGGAAGAATGAC-AACTGATTTACTAAATCAGTTGTCATTCTTCCTCCTTTTCCTCATCGTCCTCATG-TATAC-SVM1ATTTTTGCTAATATCGAAGAGGACGAAGAGAAAGAAGAG-GACGGATCCGAATATTCGGATCCGTCCTCTTCTTTCTCTTCGTCCTCTTCGATATTA-GCAAAAN-SVM2TATACATGAGGAAGATGAAGAGGAAAAAGAGGAAATGAC-AACTGATTTACTAAATCAGTTGTCATTTCCTCTTTTTCCTCTTCATCTTCCTCATG-TATAC-SVM2ATTTTTGCTAATATCGAAGAGGAGGAGGATGAGGAGGAA-GAAGGATCCGAATATTCGGATCCTTCTTCCTCCTCATCCTCCTCCTCTTCGATATTA-GCAAAAN-SVM3TATACATGAAGAGGAGGAGGATGAGGAGGAAGAAATGAC-AACTGATTTACTAAATCAGTTGTCATTTCTTCCTCCTCATCCTCCTCCTCTTCATG-TATAC-SVM3ATTTTTGCTAATATCGAGGAAGAAGAAAAAGAGGAGGAA-GAAGGATCCGAATATTCGGATCCTTCTTCCTCCTCTTTTTCTTCTTCCTCGATATTAGC-AAAA5D-EC4TATACATGACGACGACGACGACATGACAACTGATTTACTAAATCAGTTGTCATGTCGTCGTCGTCGTCATGTATA7D-EC4TATACATGACGACGACGACGACGACGACATGACAACTGA-TTTACTAAATCAGTTGTCATGTCGTCGTCGTCGTCGTCGTCATGTATA
注:引物序列中的下划线为突变位点。
1.2 实验方法
1.2.1 计算设计方法
将AlphaFold2所建模的EC水解酶结构上传至PROSS程序中,排除催化活性位点后进行计算[24]。PROSS程序识别序列后生成同源序列,通过比对后可以得出高分突变结果,对突变结果计算自由能变化,并根据能量的高低进行突变体的组合(https://pross.weizmann.ac.il)。此外,研究利用了2种通过支持向量机(support vector machine, SVM)模型设计的标签,一种为已报道的通过机器学习设计的通用促溶标签,另一种为利用MATLAB R2021b软件对EC水解酶蛋白序列分析后得出的特定提高EC水解酶可溶性表达的促溶标签[25]。
1.2.2 突变体构建及表达
以EC水解酶WT质粒为模板,采用Fast Mutagenesis kit V2试剂盒进行突变体表达质粒的构造。采用LB培养基培养菌株和TB培养基表达EC水解酶。重组菌株接种于含100 μg/mL氨苄青霉素的20 mL LB培养基中,37 ℃过夜培养。将接种量3%的种子液转入含100 μg/mL氨苄青霉素的200 mL TB培养基中,37 ℃培养。当菌液OD600值达到0.4时加入终浓度为0.1 mmol/L IPTG,然后在25 ℃下培养18 h。
1.2.3 酶纯化方法
菌株表达后离心收集,重悬于磷酸盐缓冲液中。4 ℃超声波处理30 min后,离心收集上清液。通过亲和层析的方法纯化与Ni+相连的带His标签的目标蛋白酶。纯化时,先用含100 mmol/L咪唑的磷酸盐缓冲液洗脱未结合的杂质蛋白,再用300 mmol/L的咪唑磷酸盐缓冲液洗脱目标蛋白,收集的洗脱蛋白经超滤管浓缩脱盐,适当稀释后用于酶学性质测定。
1.2.4 酶活性测定方法
通过反应中NH3的生成来测定EC水解酶的活性[26]。在最佳反应条件下单位时间降解EC产生1 μmol氨所需的酶量为一个酶活力单位。酶活力测定方法:反应底物1 mL 30 g/L的EC溶液,加入1 mL酶溶液37 ℃条件下反应15 min,反应结束后添加1 mL 10%三氯乙酸使酶失活。随后加入1 mL显色剂I (15 g苯酚和0.625 g硝普钠溶解至250 mL)和1 mL显色剂Ⅱ (13.125 g NaOH和7.5 mL NaClO溶解至250 mL) 混匀,37 ℃保温20 min后将反应体系稀释至10 mL并在625 nm处测定样品的吸光度,测定NH3含量。酶活性按公式(1)计算:
酶活性![]()
式中:ΔOD625,样品与空白对照的吸光度值之差;n,酶溶液的稀释倍数;k,标准曲线斜率的倒数,15,反应时间,min。
标准曲线的测定方法为:显色剂Ⅰ和Ⅱ按照如上反应方法和0.1、0.2、0.3、0.4、0.5 mmol/L的NH4+标准溶液反应后测得吸光值并绘制吸光度-浓度标准曲线。
1.2.5 酶学性质测定方法
为了测定蛋白的最佳反应温度,在不同温度条件下(30~60 ℃)测定酶活性,计算各条件下的相对酶活力。为验证酶的稳定性,将酶在不同温度(30~60 ℃)下保温30 min后再进行测定。测定不同乙醇体积分数(5%~20%)下的酶活性,计算各条件下的相对酶活力为蛋白的乙醇耐受性。在不同体积分数的乙醇(5%~20%)下保温1 h后测定蛋白酶活力,以表征其在乙醇中的稳定性。通过改良的Bradford蛋白检测试剂盒测定蛋白浓度以计算蛋白的比酶活力。在0~300 mmol/L的EC浓度范围内测定了WT EC水解酶及突变体的动力学参数,通过Origin软件绘制了酶活性与底物浓度的关系,拟合Michaelis-Menten方程,得到Vmax和Km。按公式(2)计算kcat:
式中:E为摩尔浓度。
1.2.6 模拟酒样实验方法
模拟酒样中乙醇体积分数为15%,pH值为4.5,底物EC质量浓度为500 μg/L。在模拟酒样中加入终质量浓度约为1.5 mg/mL的WT和突变型EC水解酶,在30 ℃下反应12 h。反应溶液分别在1、3、7、12 h后取样,用GC-MS精确检测残留的EC以判断其对EC的水解能力。在模拟酒样中测定EC水解酶的最适pH,将模拟酒样设置成不同pH值(4、5、6、7、8、9)后测定其在37 ℃中的酶活力。以模拟酒样为底物测定金属离子对EC水解酶活力的影响,将1 mmol/L的不同金属离子(Fe2+、Mg2+、Cu2+、Zn2+、Ba2+)及终浓度为0.1 mmol/L的化学试剂与酶液混合,然后于37 ℃条件下测定其在模拟酒样中的酶活力。最后将模拟酒样中的EC分别替换为同浓度的氨基甲酸甲酯(methyl carbamate, MC)、氨基甲酸丁酯(butyl carbamate, BC)、丙烯酰胺(acrylamide, AM)、甲基丙烯酰胺(methacrylamide, MAM),探究其对氨基甲酸酯类底物和酰胺类底物的水解能力。
2 结果与分析
2.1 基于PROSS计算的EC水解酶突变体构建及性质表征
利用AlphaFold2对EC水解酶序列进行结构建模,建模后上传至PROSS程序进行计算。PROSS的计算结果中共有9个突变体,其中突变位点最少的突变体包含了18个位点的突变,其余组合突变均突变了30个位点以上。通常情况下突变位点个数过多会导致结构变化过大从而使酶活力降低[27],所以本研究选择了最少的18点突变体进行了单突变位点的拆分和构建。如图1-a所示,大部分突变体的酶活性高于WT。其中酶活力提高最多的突变体为S21E,其比酶活力为2.47 U/mg,是WT比酶活力(1.89 U/mg)的1.31倍。如图1-b所示,耐受性增加最多的3个位点为S21E、H197Y及S292L。S21E在5%乙醇的相对酶活力为88.32%,高于WT的64.26%,虽在20%乙醇的相对酶活力下降至11.26%但仍高于WT的8.12%。另2个位点,在低乙醇浓度条件下所表现出的酶活力也较好,随着乙醇浓度升高酶活力下降较缓慢,在20%乙醇下H197Y的相对酶活力为20.75%,P348I的相对酶活力为12.87%。
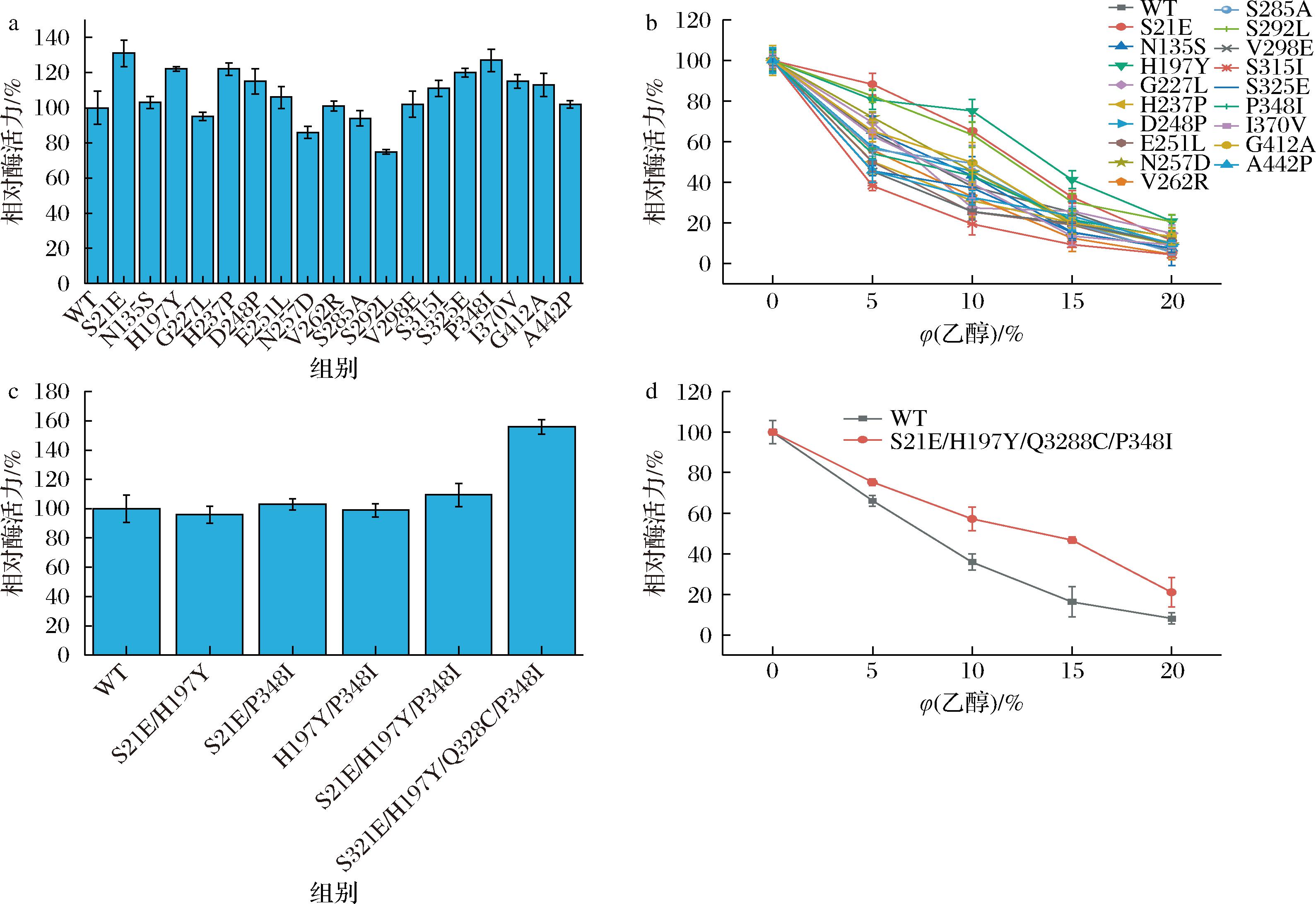
a-基于PROSS计算的单突变体相对酶活力;b-单突变体的乙醇耐受性;c-组合突变体的相对酶活力;d-组合突变体的乙醇耐受性
图1 基于计算设计的突变体的相对酶活力和乙醇耐受性
Fig.1 Relative enzyme activity and ethanol tolerance of various mutants constructed by computer-aided design
为进一步提高突变体的活性和乙醇耐受性,本研究选择了酶活力及乙醇耐受性都提高较多的3个突变体:S21E、H197Y及P348I进行组合突变。表达了S21E/H197Y、S21E/P348I、H197Y/P348I、S21E/H197Y/P348I并测定了其相对酶活力结果如图1-c所示,其中酶活力提高最多的突变体S21E/P348I/P348I的酶活力为2.06 U/mg,仅为WT的1.09倍,提高效果较差。因此,本研究结合前期筛选得到的能够提高EC水解酶活力的突变位点Q328C[28],构建的新突变体S21E/H197Y/Q328C/P348I命名为EC4,EC4比酶活力为2.93 U/mg,相较于WT提高了约1.55倍。如图1-d所示,20%乙醇中的相对酶活力为21.03%,相较于WT(8.2%)提高了约2.56倍。此外还测定了EC4的动力学常数如表2所示,其Km值为29.31 mmol/L,小于WT的37.67 mmol/L,表明其对底物的亲和力有所提高。
表2 野生型和突变体EC水解酶的动力学参数
Table 2 Enzymatic kinetic parameters of EC hydrolase WT and variants

组别Km/(mmol/L)Vmax/[μmol/(min·mg)]kcat/(s-1)kcat/Km/[L/(s·mol)]WT37.67±3.552.22±0.0718 509.92±4 341.41491.42S21E/H197Y/Q328C/P348I29.31±5.623.56±1.9325 347.21±5 842.21864.79
2.2 融合标签优化EC水解酶的表达
进一步地,为提高EC水解酶的可溶性表达,本研究选择了两大类融合标签优化EC水解酶的表达,其中一类为通过机器学习设计获得的短促溶标签,分别为已报道的通用标签SVM1、SVM2及本研究针对EC水解酶计算所得的促溶标签SVM3。另一类为几个天冬氨酸所组成的短肽,有研究认为在蛋白的氮端添加带负电的氨基酸可以帮助蛋白更好的折叠和表达,而天冬氨酸的辅助效果会优于谷氨酸,机器学习所选择的短促溶标签主要由谷氨酸组成,因此研究选择5个和7个天冬氨酸所组成的短肽作为促溶标签与EC水解酶相连,探究其对EC水解酶可溶性表达的提高效果[29]。上述5种短促溶标签序列见表3。
表3 促溶标签序列
Table 3 Sequence of solubility-enhancing tag
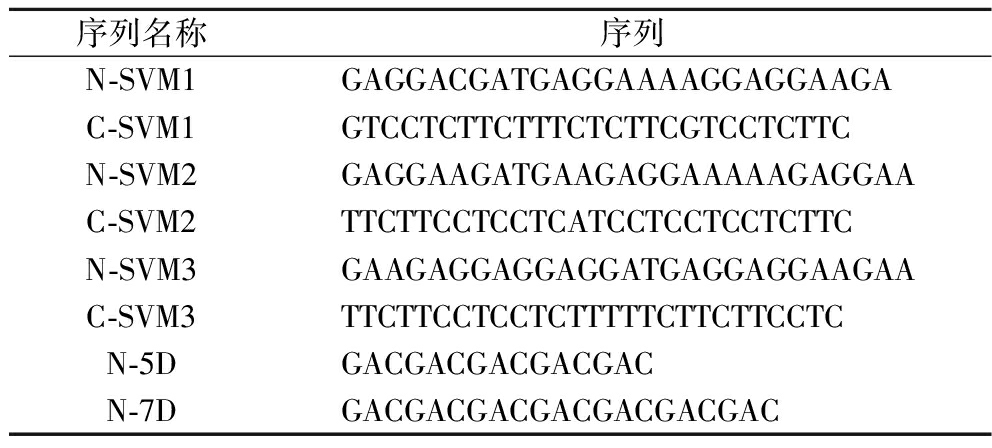
序列名称序列N-SVM1GAGGACGATGAGGAAAAGGAGGAAGAC-SVM1GTCCTCTTCTTTCTCTTCGTCCTCTTCN-SVM2GAGGAAGATGAAGAGGAAAAAGAGGAAC-SVM2TTCTTCCTCCTCATCCTCCTCCTCTTCN-SVM3GAAGAGGAGGAGGATGAGGAGGAAGAAC-SVM3TTCTTCCTCCTCTTTTTCTTCTTCCTCN-5DGACGACGACGACGACN-7DGACGACGACGACGACGACGAC
如图2-a所示,标签SVM1和5D对EC水解酶活力的提高最多,其中SVM1-EC4的酶活力为26.06 U/mL,约为WT的1.82倍。而5D-EC4的酶活力为23.06 U/mL,约为WT的1.61倍,添加其余5种标签后酶活力高于WT却低于EC4。

a-相对酶活力;b-表达验证(S为上清液,P为沉淀)
图2 含不同融合标签的EC4的活力与表达性能表征
Fig.2 Characterization of the activity and expression performance of EC4 with different fusion tags
如图2-b所示,添加促溶标签的EC水解酶表达条带均粗于WT和EC4的表达条带,且沉淀中的包涵体含量也有所减少。其中,SVM1-EC上清液中EC水解酶对应的条带最粗,表明其可溶性表达提高最明显。
2.3 含不同融合标签EC4的最适反应温度及温度稳定性
如图3-a所示,其中SVM1-EC4和SVM2-EC4的最适温度为45 ℃,在所有酶中最高,随着温度的升高,酶活力呈现出缓慢的下降趋势,在50 ℃下SVM1-EC4仍保留35.66%的相对酶活力,高于WT的16.08%。如图3-b所示,温度稳定性波动趋势与最适温度相似,均在40 ℃附近出现下降趋势,其中下降趋势较为缓慢的酶是SVM1-EC4,可能是由于标签蛋白的添加增强了EC水解酶整体的稳定性。
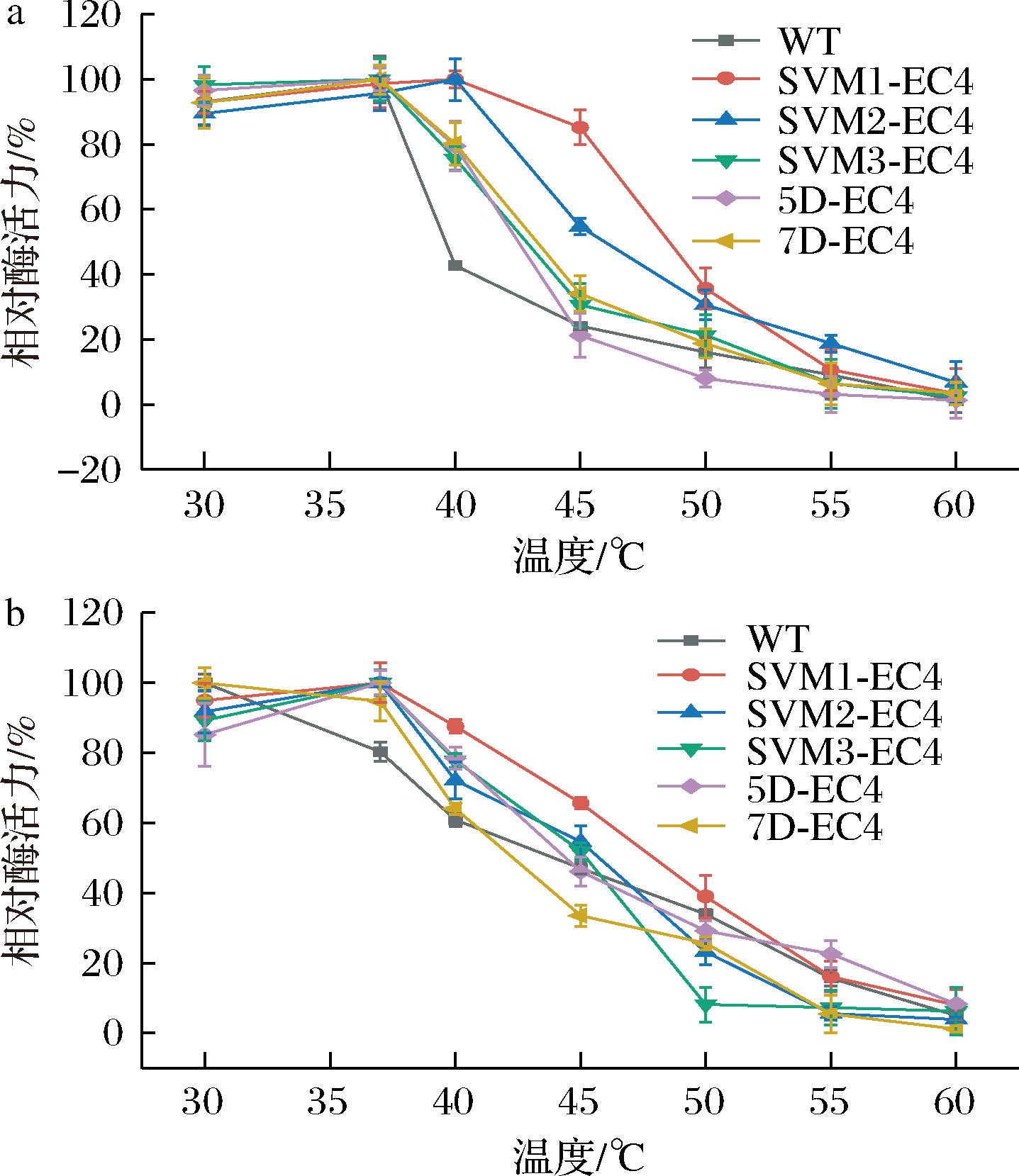
a-最适温度;b-温度稳定性
图3 含不同融合标签的EC4的最适温度和温度稳定性
Fig.3 Optimal temperature and temperature stability of EC4 with different fusion tags
2.4 含不同融合标签EC4的乙醇耐受性及乙醇耐受稳定性
在乙醇耐受性和乙醇稳定性的测定中,SVM1-EC4表现较好,如图4-a所示,其在15%乙醇中的相对酶活力为65.32%,是WT的3.99倍,高于连接其他融合标签的EC4;20%乙醇的相对酶活力为31.15%,是WT的3.80倍。如图4-b所示,随着乙醇浓度的升高这几种酶的酶活力下降速度变快,SVM1-EC4在5%乙醇的相对酶活力最高是58.15%,但在20%乙醇的相对酶活力仅有10.87%。5D-EC4则更加稳定,其在15%乙醇保温的相对酶活力仍有27.41%,为WT的2.98倍。
2.5 SVM1-EC4在模拟酒样中的应用
综合考量改造后EC水解酶活力、温度稳定性及乙醇稳定性的提高效果后,本研究选择SVM1-EC4进行进一步的酶学性质测定。通过模拟真实酒样条件下反应12 h后SVM1-EC4和WT消减EC的量来判断其对EC的水解能力,结果如图5-a所示,SVM1-EC4消减EC的能力为WT的2.07倍。此外,研究通过调整模拟酒样的pH来测定SVM1-EC4最适pH,结果如图5-b所示,pH=7.0时的酶活力最高,在pH值为6或8时,SVM1-EC4仍能保持50%以上的相对酶活,但其酶活力在pH 4~5及pH=9条件下很低,仅有5%。如图5-c所示,其中Mg2+对其酶活力有微弱促进作用,Ba2+对该酶有轻微抑制作用,Cu2+对其抑制作用最强。如图5-d所示,SVM1-EC4对MC和一些酰胺类物质较好的水解作用,但几乎不能水解BC。
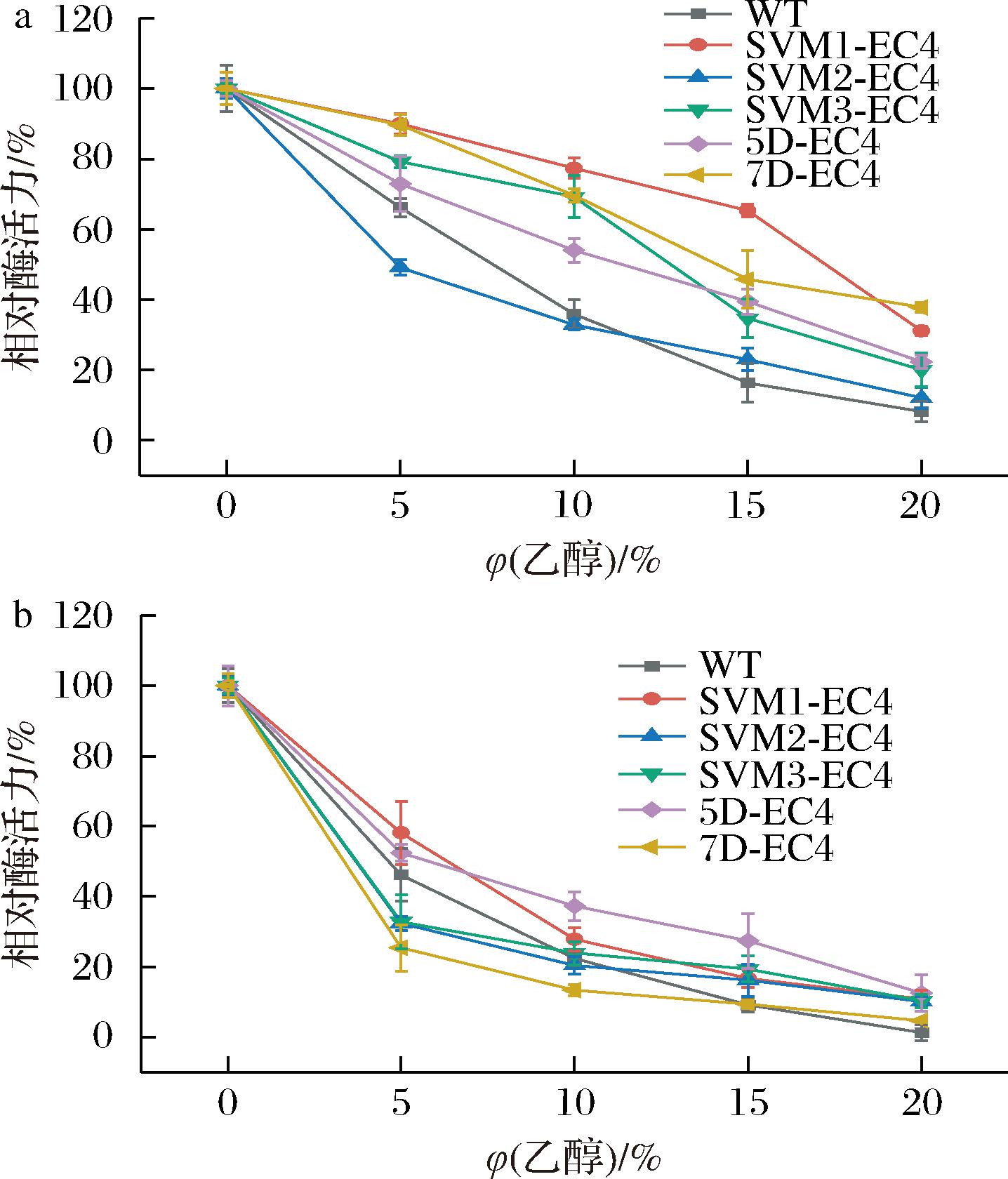
a-乙醇耐受性;b-乙醇耐受稳定性
图4 含不同融合标签的EC4的乙醇耐受性和 乙醇耐受稳定性
Fig.4 Ethanol tolerance and ethanol tolerance stability of EC4 with different fusion tags
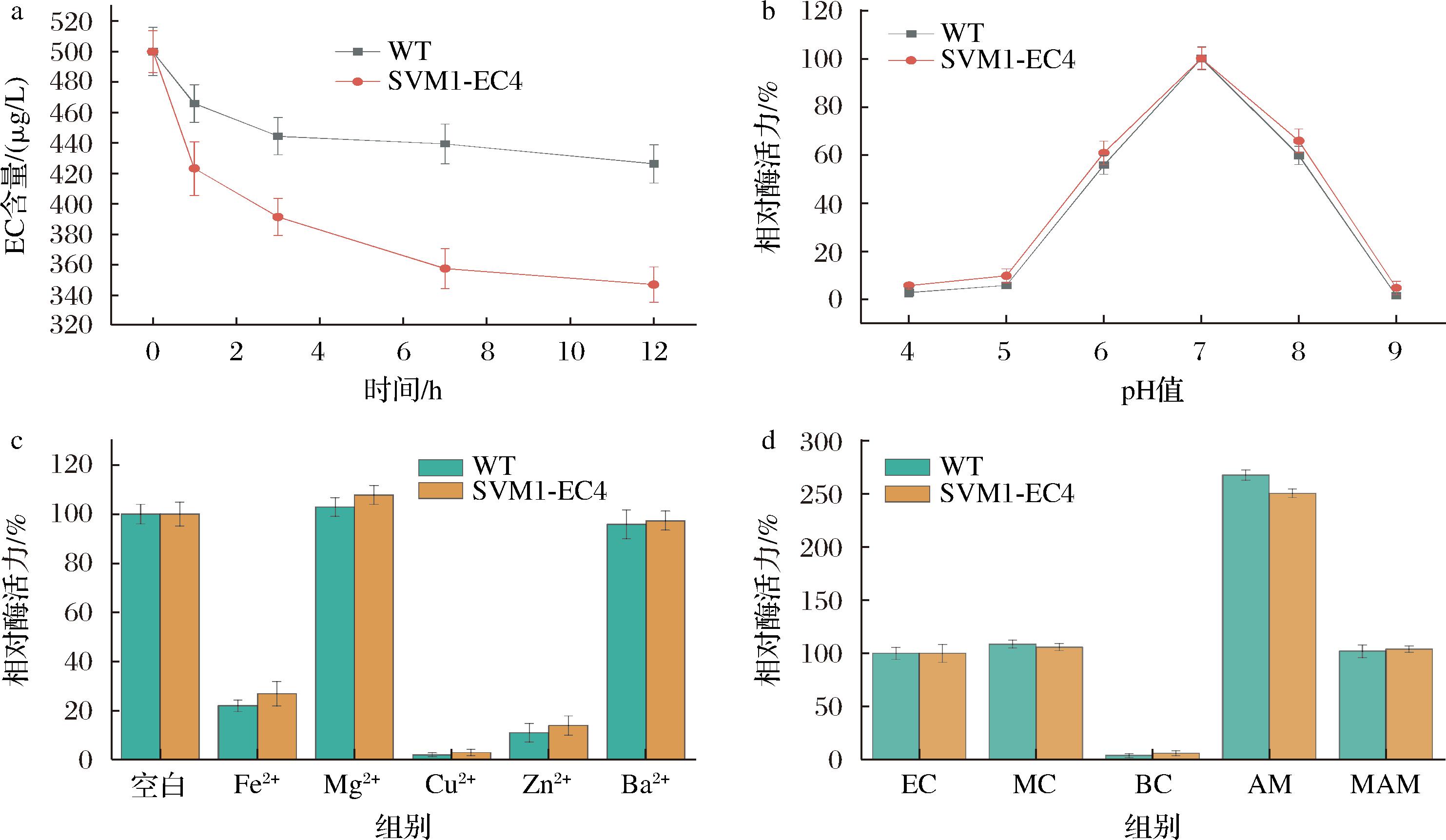
a-SVM1-EC4在模拟酒样中的应用;b-SVM1-EC4在模拟酒样中的最适pH;c-金属离子对SVM1-EC4的影响; d-SVM1-EC4对不同酰胺类物质的水解能力
图5 SVM1-EC4在模拟酒样中的酶学性质
Fig.5 Enzymatic properties of SVM1-EC4 in simulated wine samples
3 结论
本研究结合计算和融合标签来优化EC水解酶的稳定性及可溶性。基于PROSS计算获得四突变体S21E/H197Y/Q328C/P348I,其酶活力相较于WT提高了1.55倍,在20%乙醇中的相对酶活力为21.03%,相较于WT(8.2%)提高了约2.56倍。其次,选择了基于SVM模型设计的SVM1、SVM2、SVM3标签以及由不同数量天冬氨酸组成的短肽标签探究其对EC水解酶可溶性表达的影响。SVM1-EC4的可溶性表达提高最显著,且在15%乙醇中的相对酶活性是WT的3.99倍。最后,进一步探究了SVM1-EC4水解酶酶学性质及在模拟酒样中的应用,在模拟酒样中反应12 h后SVM1-EC4消减EC的量为WT的2.07倍。SVM1-EC4在pH=7.0条件下的酶活力最高,Mg2+对其有微弱促进作用,对除BC以外的MC、AM和MAM有较好的水解作用。总之,本研究利用基于计算辅助改造与融合标签相结合的优化改造策略有望促进传统发酵食品中酶法降解EC的工业化应用。
[1] FORKERT P G.Mechanisms of lung tumorigenesis by ethyl carbamate and vinyl carbamate[J].Drug Metabolism Reviews, 2010, 42(2):355-378.
[2] SAKANO K, OIKAWA S, HIRAKU Y, et al.Metabolism of carcinogenic urethane to nitric oxide is involved in oxidative DNA damage[J].Free Radical Biology and Medicine.2002, 33(5):703-714.
[3] CHEN D W, REN Y P, ZHONG Q D, et al.Ethyl carbamate in alcoholic beverages from China:Levels, dietary intake, and risk assessment[J].Food Control, 2017, 72:283-288.
[4] WEBER J V, SHARYPOV V I.Ethyl carbamate in foods and beverages:A review[J].Environmental Chemistry Letters, 2009, 7(3):233-247.
[5] WU D H, LI X M, LU J, et al.Constitutive expression of the DUR1,2 gene in an industrial yeast strain to minimize ethyl carbamate production during Chinese rice wine fermentation[J].FEMS Microbiology Letters, 2016, 363(1):fnv214.
[6] CERRETI M, FIDALEO M, BENUCCI I, et al.Assessing the potential content of ethyl carbamate in white, red, and rosé wines as a key factor for pursuing urea degradation by purified acid urease[J].Journal of Food Science, 2016, 81(7):C1603-C1612.
[7] ZHAO X R, DU G C, ZOU H J, et al.Progress in preventing the accumulation of ethyl carbamate in alcoholic beverages[J].Trends in Food Science &Technology, 2013, 32(2):97-107.
[8] KIM Y G, LYU J, KIM M K, et al.Effect of citrulline, urea, ethanol, and urease on the formation of ethyl carbamate in soybean paste model system[J].Food Chemistry, 2015, 189:74-79.
[9] DONG N H, XUE S Y, GUO H, et al.Genetic engineering production of ethyl carbamate hydrolase and its application in degrading ethyl carbamate in Chinese liquor[J].Foods, 2022, 11(7):937. [10] GOWD V, SU H M, KARLOVSKY P, et al.Ethyl carbamate:An emerging food and environmental toxicant[J].Food Chemistry, 2018, 248:312-321.
[11] MOHAPATRA B R.An Insight Into the Prevalence and Enzymatic Abatement of Urethane in Fermented Beverages[M]//Singapore:Microbial Biotechnology, 2018:153-170.
[12] KORENDOVYCH I V.Rational and semirational protein design[J].Methods in Molecular Biology, 2018, 1685:15-23.
[13] CHENG F, ZHU L L, SCHWANEBERG U.Directed evolution 2.0:Improving and deciphering enzyme properties[J].Chemical Communications, 2015, 51(48):9760-9772.
[14] FAN B, DONG W X, CHEN T Y, et al.Switching glycosyltransferase UGTBL1 regioselectivity toward polydatin synthesis using a semi-rational design[J].Organic &Biomolecular Chemistry, 2018, 16(14):2464-2469.
[15] LIU Q T, YAO X H, LIANG Q X, et al.Molecular engineering of Bacillus paralicheniformis acid urease to degrade urea and ethyl carbamate in model Chinese rice wine[J].Journal of Agricultural and Food Chemistry, 2018, 66(49):13011-13019.
[16] 康婷婷. 氨基甲酸乙酯水解酶的筛选、表达及活力改造[D].杭州:浙江大学, 2021. KANG T T.Screening, expression and activity modification of urethanases[D].Hangzhou:Zhejiang University, 2021.
[17] GOLDENZWEIG A, FLEISHMAN S J.Principles of protein stability and their application in computational design[J].Annual Review of Biochemistry, 2018, 87:105-129.
[18] PELEG Y, VINCENTELLI R, COLLINS B M, et al.Community-wide experimental evaluation of the PROSS stability-design method[J].Journal of Molecular Biology, 2021, 433(13):166964.
[19] ESPOSITO D, CHATTERJEE D K.Enhancement of soluble protein expression through the use of fusion tags[J].Current Opinion in Biotechnology, 2006, 17(4):353-358.
[20] KI M R, PACK S P.Fusion tags to enhance heterologous protein expression[J].Applied Microbiology and Biotechnology, 2020, 104(6):2411-2425.
[21] 李京京. 赖氨酸芽孢杆菌氨基甲酸乙酯水解酶的性质研究及异源表达[D].无锡:江南大学, 2014. LI J J.Characterization and heterologous expression of urethanase from Lysinibacillus fusiformis[D].Wuxi:Jiangnan University, 2014.
[22] 张磊, 唐永凯, 李红霞, 等.促进原核表达蛋白可溶性的研究进展[J].中国生物工程杂志, 2021, 41(S1):138-149. ZHANG L, TANG Y K, LI H X, et al.Advances in promoting solubility of prokaryotic expressed proteins[J].China Biotechnology, 2021, 41(S1):138-149.
[23] COSTA S, ALMEIDA A, CASTRO A, et al.Fusion tags for protein solubility, purification and immunogenicity in Escherichia coli:The novel Fh8 system[J].Frontiers in Microbiology, 2014, 5:63.
[24] LAURENTS D V.AlphaFold 2 and NMR spectroscopy:Partners to understand protein structure, dynamics and function[J].Frontiers in Molecular Biosciences, 2022, 9:906437.
[25] HAN X, NING W B, MA X Q, et al.Improving protein solubility and activity by introducing small peptide tags designed with machine learning models[J].Metabolic Engineering Communications, 2020, 11:e00138.
[26] LIU Q T, CHEN Y Q, YUAN M L, et al.A Bacillus paralicheniformis iron-containing urease reduces urea concentrations in rice wine[J].Applied and Environmental Microbiology, 2017, 83(17):e01258-e01217.
[27] 叶子莹. 计算机辅助设计提高琼胶酶Aga50D稳定性研究[D].无锡:江南大学, 2022. YE Z Y.Computer-aided design to improve the stability of agarase Aga50D[D].Wuxi:Jiangnan University, 2022.
[28] 刘晓慧, 方芳, 夏小乐, 等.定点突变改造提高纺锤形赖氨酸芽孢杆菌氨基甲酸乙酯水解酶稳定性[J].生物工程学报, 2016, 32(9):1233-1242. LIU X H, FANG F, XIA X L, et al.Stability enhancement of urethanase from Lysinibacillus fusiformis by site-directed mutagenesis[J].Chinese Journal of Biotechnology, 2016, 32(9):1233-1242.
[29] KIM S K, PARK Y C, LEE H H, et al.Simple amino acid tags improve both expression and secretion of Candida antarctica lipase B in recombinant Escherichia coli[J].Biotechnology and Bioengineering, 2015, 112(2):346-355.