大豆肽和豌豆肽是大豆分离蛋白或豌豆蛋白经现代生物酶解等生物技术制得的小分子低聚肽,通过酶解技术释放出蛋白质氨基酸序列中存在的多种活性肽段,因而具有多种生物活性功能。除增强免疫力[1]、缓解体力疲劳[2]等以外,大豆肽还被证实具有多种生理功能。YIMIT等[3]证明了大豆肽能够调节志愿者的细胞免疫系统,提高血浆多巴胺水平来调节神经递质,从而促进大脑功能。RAYAPROLU等[4]发现了大豆肽能够抑制包括血液CCRF-CEM和Kasami-3细胞、乳腺癌细胞MCF-7、前列腺癌细胞PC-3细胞等多种癌细胞生长,有望作为替代癌症治疗的食品配料或营养补充剂。AMAKYE等[5]通过D-半乳糖诱导的衰老小鼠灌胃不同来源生物活性肽,发现大豆肽也具有良好的抗衰老、抗氧化活性。ISHIHARA等[6]给予高脂饮食诱导的II型糖尿病小鼠大豆肽,结果显示大豆肽能够抑制II型糖尿病小鼠吸收膳食中的脂类,增加碳水化合物氧化,增加餐后能量消耗。
ZHU等[7]和WEI等[8]在豌豆肽中发现了4种具有调节糖代谢通路的肽段,并通过高脂饮食和链脲佐菌素诱导的II型糖尿病小鼠实验证明了豌豆肽能够预防胰岛素抵抗,可能具有开发糖尿病人使用的功能食品的基础。崔欣悦等[9]在HepG2细胞的胰岛素抵抗模型中发现,豌豆肽干预后细胞的葡萄糖消耗量提高了1.31~1.68倍,胰岛素受体的表达提高率1.19~1.34倍,凋亡蛋白Caspase-3阳性表达率增加。张敏佳等[10]也通过环磷酰胺致免疫抑制小鼠证实了豌豆肽能够改善小鼠免疫脏器质量及形态,提高白细胞、脾脏T淋巴细胞、免疫球蛋白含量等的含量。秦修远等[11]以DPPH自由基、羟自由基及Fe3+为判断指标,研究了豌豆肽的抗氧化作用。
尽管已有研究证明大豆肽和豌豆肽均具有开发II型糖尿病人营养膳食功能的基础,但对于二者的作用分子通路及二者复合的增效作用却鲜有研究。本研究建立胰岛素抵抗模型,探究不同比例的大豆肽与豌豆肽的复合物对HepG2细胞葡萄糖消耗、葡萄糖吸收的影响作用,并通过葡萄糖转运蛋白2(glucose transporter 2,GLUT2)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)及胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)/蛋白激酶B(Akt)。
1 材料与方法
1.1 材料与试剂
人肝癌细胞HepG2,中国医学科学院基础医学研究所细胞资源中心;DMEM(Dulbecco’s modified eagle medium)高糖培养基,美国Hyclone公司;胎牛血清(fetal bovine serum, FBS, 美国Gibco公司;双抗、CCK-8检测试剂盒,碧云天生物技术有限公司;人胰岛素,索莱宝科技有限公司;2-(N-(7-硝基苯并-2-氧杂-1,3-二唑-4-氨基)-2-脱氧葡萄糖(2-NBDG),美国Sigma公司;葡萄糖检测试剂盒、糖原检测试剂盒,南京建成生物工程研究所;IRS-1、磷酸化胰岛素受体底物-1(p-IRS-1)、Akt、磷酸化蛋白激酶(p-Akt)、GLUT2、GLUT4抗体,美国Proteintech公司;大豆肽、豌豆肽,北京中食海氏生物技术有限公司。
1.2 仪器与设备
生物安全柜,新加坡ESCO公司;细胞培养箱,美国Thermo Fisher Scientific;荧光酶标仪,美谷分子仪器(上海)有限公司;C6流式细胞仪,美国BD公司;SDS-PAGE系统,美国Bio-Rad公司 ;荧光及化学发光成像系统,上海勤翔科学仪器有限公司。
1.3 实验方法
1.3.1 肽的基础理化成分分析
参照GB 5009.3—2010《食品安全国家标准 食品中水分的测定》、GB 5009.4—2010《食品安全国家标准 食品中灰分的测定》、GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》,分别对大豆肽和豌豆肽中水分含量、灰分含量和总氮(粗蛋白)的含量进行试验测定。参照GB/T 5009.124—2016《食品中氨基酸的测定》,测定大豆肽和豌豆肽的氨基酸组成。采用文献[12]所述高效凝胶过滤色谱法测定大豆肽和豌豆肽分子质量及分布情况。
1.3.2 细胞培养
HepG2细胞培养在含5% CO2的37 ℃恒温培养箱中,培养基采用含10% FBS和1%双抗(均为体积分数)的DMEM高糖培养基。细胞融合达80%左右时用0.25%(体积分数)胰酶进行消化传代,平均2~3 d传代1次。
1.3.3 实验分组
对数期生长的HepG2细胞的实验分组情况如下:对照组,仅用2% FBS的DMEM高糖培养基处理;模型组,含10-6 mol/L胰岛素[13-14]的2% FBS的DMEM高糖培养基;实验组用含肽的2% FBS的DMEM高糖培养基处理,分为大豆肽组、豌豆肽组、大豆肽∶豌豆肽=1∶1组、大豆肽∶豌豆肽=1∶2组、大豆肽∶豌豆肽=1∶3组、大豆肽∶豌豆肽=3∶1组、大豆肽∶豌豆肽=2∶1组,共9组,以上均为质量比。
1.3.4 细胞活力检测
将1.3.2节所述各实验组设置质量浓度梯度为0、100、200、400、600、800 μg/mL,CCK-8法检测细胞存活率,根据细胞存活率选择最佳处理浓度。
1.3.5 葡萄糖消耗检测
收集细胞,接种于96孔板(1×105细胞/mL,200 μL/孔),培养24 h,然后,用含10-6 mol/L胰岛素和2% FBS的DMEM高糖培养基培养24 h。按照分组各自加入不同样品,继续培养48 h,每24 h更换新鲜培养基。收集最后24 h的细胞培养上清液,用葡萄糖检测试剂盒检测培养基中剩余葡萄糖含量。
1.3.6 葡萄糖吸收检测
细胞按照1×105/mL的密度接种在6孔板中(2 mL/孔)培养24 h。然后,用含10-6 mol/L胰岛素和2%FBS的DMEM高糖培养基培养24 h。按照分组各自加入不同样品,继续培养48 h,每24 h更换新鲜培养基。将细胞用PBS洗涤后,以50 μmol/L的终浓度加入2-NBDG,在37 ℃下孵育30 min后,将细胞用PBS洗涤2次,以去除残留的2-NBDG。消化细胞,将细胞全部收集在黑色96孔板中,并立即在485 nm/530 nm的激发/发射波长下使用荧光酶标仪检测细胞的荧光强度。荧光强度代表细胞对2-NBDG的摄取,以反映细胞对葡萄糖的吸收能力。
1.3.7 细胞糖原含量测定
按1.3.6节方法培养后。收集细胞,按照糖原检测试剂盒检测细胞糖原含量。
1.3.8 Western Blot实验
按1.3.6节方法培养后。收集细胞蛋白用于Western Blot。分别检测细胞中以下蛋白的相对表达量:IRS-1、p-IRS-1、Akt、p-Akt、GLUT2、GLUT4。
1.3.9 数据处理
采用Origin 2022对数据进行处理,实验结果以均值±标准误差表示。采用Tukey法进行数据分析,各项试验设置3~6次重复,*#P<0.05表示具有显著性差异。#与对照组相比具有显著性差异,*与模型组相比具有显著性差异。
2 结果与分析
2.1 大豆肽和豌豆肽的基础理化检测结果分析
大豆肽中水分含量为4.73%,灰分含量为5.08%,蛋白质含量(以干基计)为86.98%,豌豆肽中水分含量为4.46%,灰分含量为5.04%,蛋白质含量(以干基计)为88.30%。2种肽的氨基酸组成及分子质量分布如表1和表2所示。
2.2 细胞存活率检测
用CCK-8法检测大豆肽和豌豆肽对HepG2细胞的存活率影响,以确定安全剂量范围。由图1可以看出,在肽质量浓度为100 μg/mL和200 μg/mL时,各处理组对细胞存活率均无显著影响,当肽质量浓度达到400、600、800 μg/mL时,肽对细胞毒性的作用逐渐增强,细胞存活率显著性降低(#P<0.05),因此,大豆肽和豌豆肽100、200 μg/mL对HepG2细胞无显著细胞毒性,本实验后续采取肽的安全剂量为200 μg/mL。
表1 氨基酸组成
Table 1 Amino acid composition of oligopeptides

氨基酸名称豌豆肽含量/%大豆肽含量/%氨基酸名称豌豆肽含量/%大豆肽含量/%天门冬氨酸(Asp)9.149.40异亮氨酸(Ile)2.653.43苏氨酸(Thr)2.153.19亮氨酸(Leu)5.446.08丝氨酸(Ser)3.944.40酪氨酸(Tyr)1.113.26谷氨酸(Glu)16.1915.87苯丙氨酸(Phe)2.814.35甘氨酸(Gly)2.653.38组氨酸(His)1.581.04丙氨酸(Ala)3.293.39赖氨酸(Lys)5.264.32缬氨酸(Val)3.563.55色氨酸(Trp)0.150.08半胱氨酸(Cys)0.911.48精氨酸(Arg)4.185.02蛋氨酸(Met)0.421.04脯氨酸(Pro)1.563.48
表2 分子质量分布
Table 2 Molecular weight distribution of selenium-chelating oligopeptides

峰面积百分比/%>5 000 u2 000~5 000 u1 000~2 000 u500~1 000 u140~500 u<140 u<1 000 u豌豆肽00.836.09 25.43 61.91 5.61 92.95 大豆肽1.515.967.7422.0255.107.6684.78
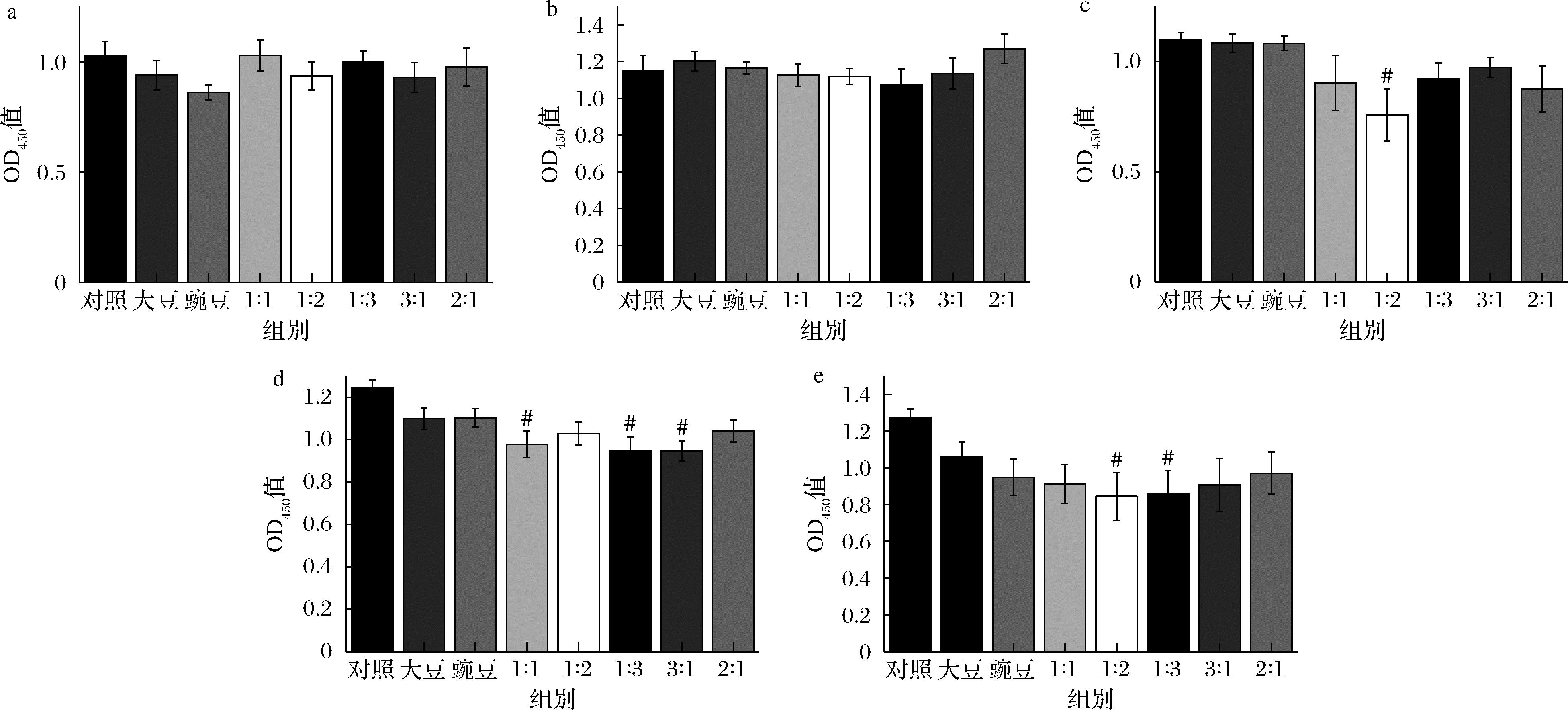
a-肽质量浓度100 μg/mL;b-肽质量浓度200 μg/mL;c-肽质量浓度400 μg/mL;d-肽质量浓度600 μg/mL;e-肽质量浓度800 μg/mL
图1 CCK-8法检测细胞存活率
Fig.1 Cell survival rate measured by CCK-8 assay
2.3 葡萄糖消耗检测
HepG2细胞在含有10-6 mol/L的胰岛素和2%FBS的DMEM高糖培养基中处理24 h建立胰岛素抵抗模型。从图2可知,模型组的葡萄糖消耗相比于对照组显著降低,说明HepG2细胞胰岛素抵抗模型建立成功,经大豆肽和豌豆肽及其各比例配比处理后,细胞对葡萄糖的消耗量都显著升高,其中,大豆肽∶豌豆肽=2∶1组在各处理组中相比于模型组差距最为显著。
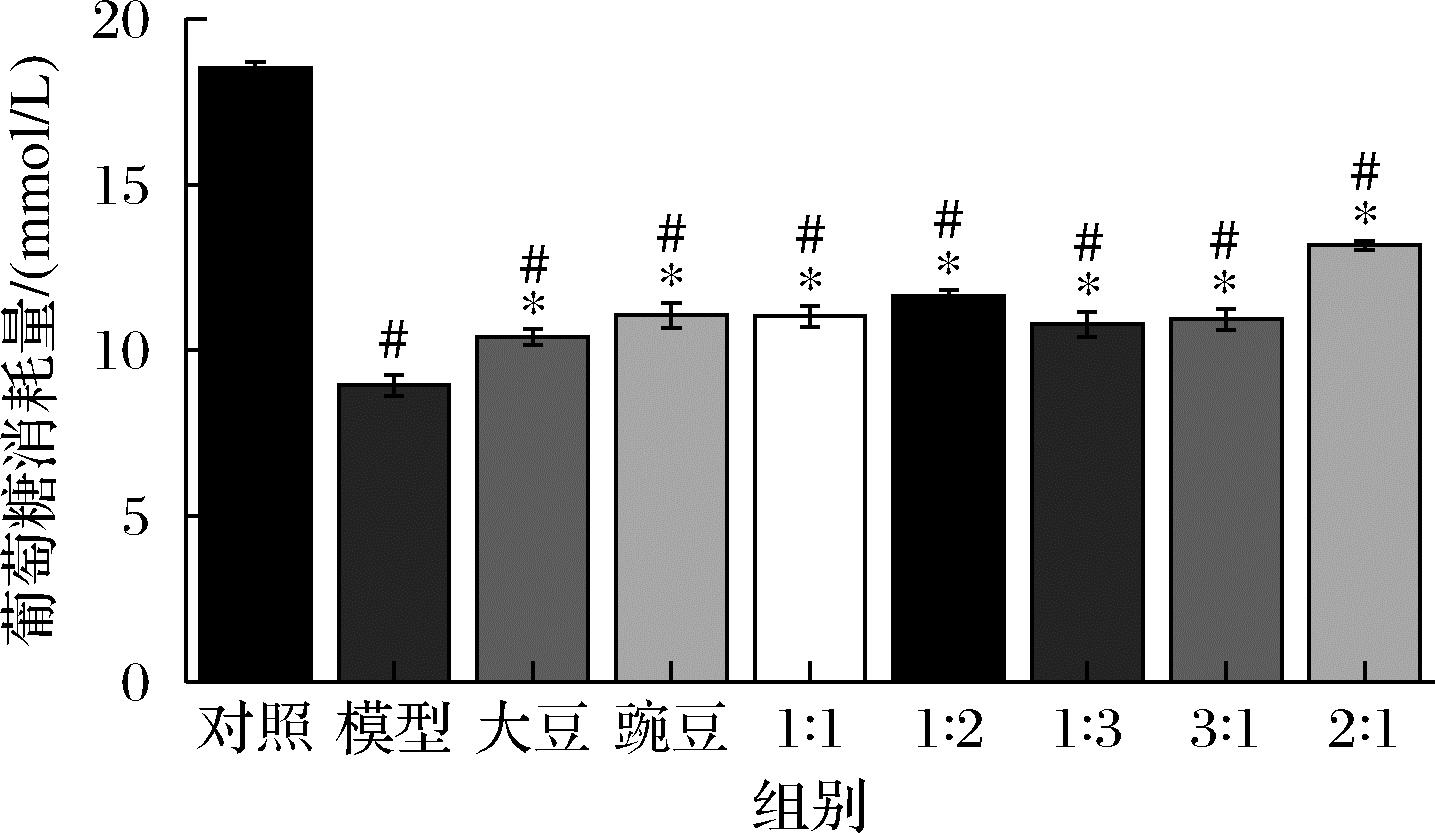
图2 HepG2细胞24 h的葡萄糖消耗量
Fig.2 Glucose consumption of HepG2 in 24 h
2.4 葡萄糖吸收检测
2-NBDG的荧光强度可以反映细胞对葡萄糖的吸收能力。由图3可知,经造模处理后,模型组的荧光强度相比于对照组显著降低,经大豆肽和豌豆肽及其各比例配比处理后,细胞中的荧光强度相比于模型组有了不同程度的升高,其中,豌豆肽组、大豆肽∶豌豆肽=1∶3和2∶1相比于模型组具有显著性差异,尤其是大豆肽∶豌豆肽=2∶1处理组中细胞的荧光强度相比于模型组差距最为显著,表明该组细胞的葡萄糖吸收能力升高最为显著。
2.5 细胞糖原含量检测
由图4可知,经过造模处理后,模型组细胞中糖原含量相比于对照组显著降低,经大豆肽和豌豆肽及其各比例配比处理后,各处理组中细胞糖原含量相比于模型组出现了不同程度的升高,其中,大豆肽∶豌豆肽=2∶1处理组中细胞糖原含量相比于模型组升高具有显著性差异。
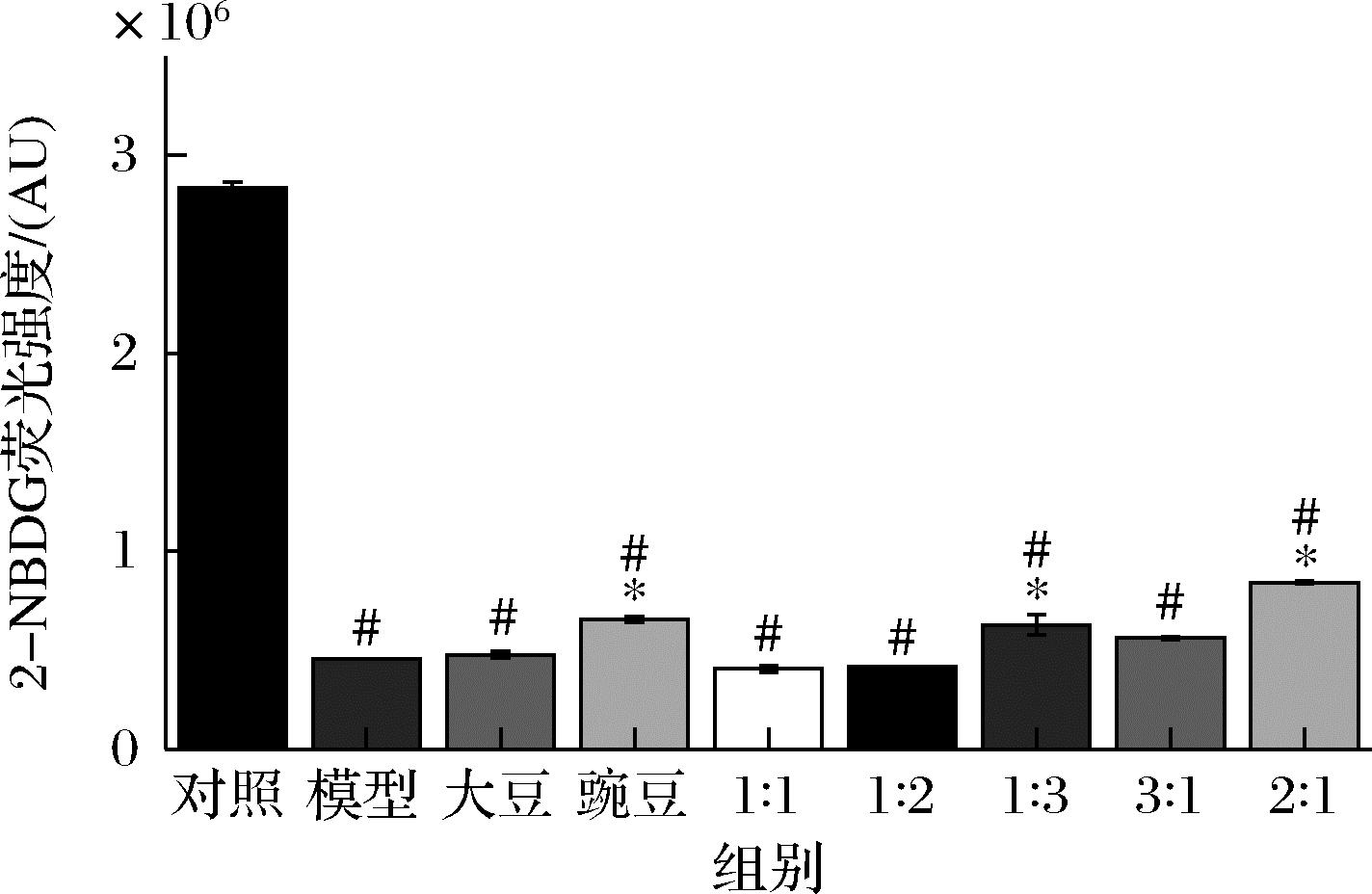
图3 HepG2细胞中2-NBDG的荧光强度
Fig.3 Fluorescence intensity of 2-NBDG in HepG2
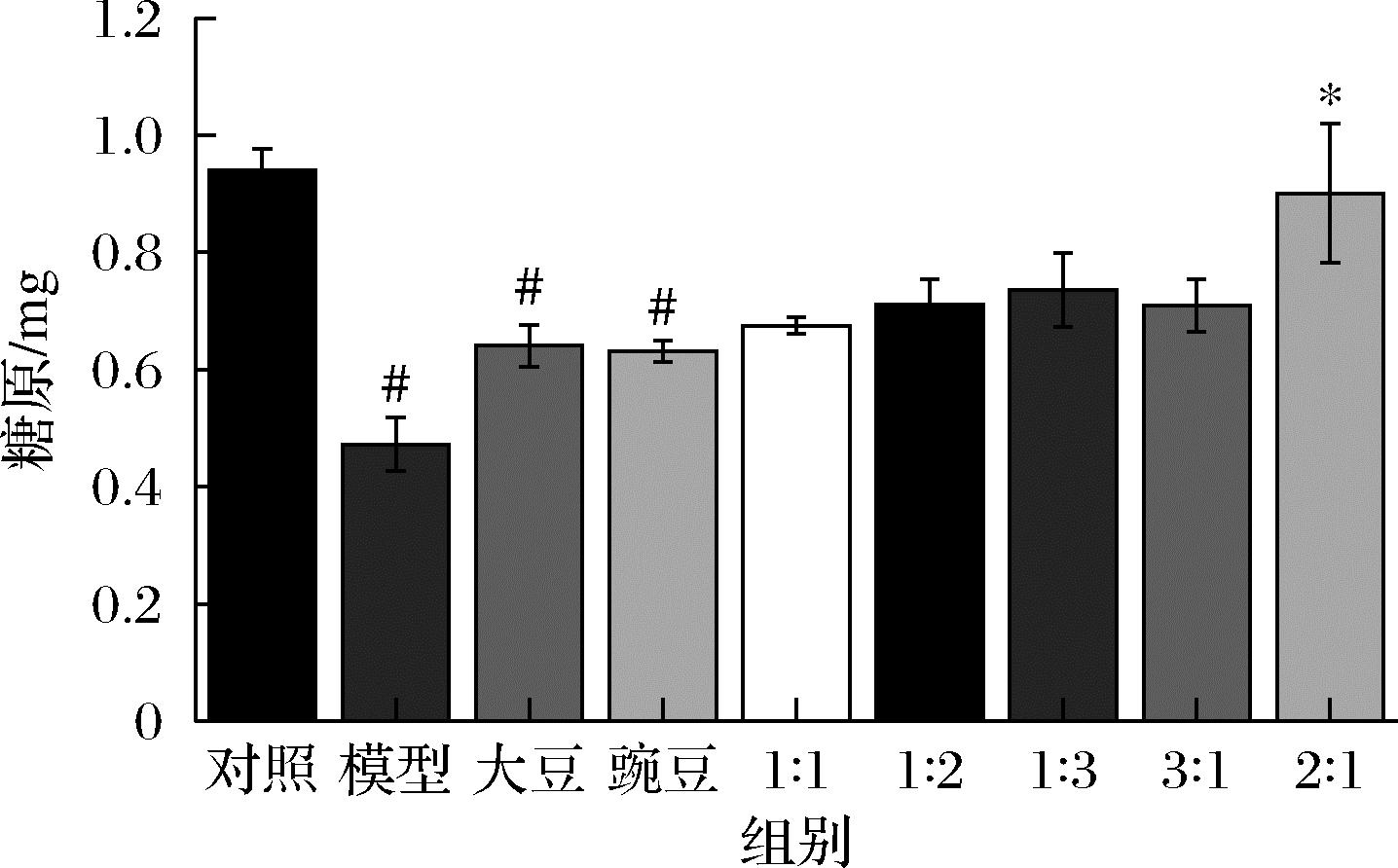
图4 HepG2细胞糖原含量
Fig.4 Glycogen content in HepG2
2.6 葡萄糖转运蛋白表达分析
GLUT2和GLUT4,同属促葡萄糖转运蛋白,分别以非胰岛素方式和胰岛素依赖性方式调节葡萄糖跨细胞膜转运[15-16]。图5模型组中,细胞的GLUT2和GLUT4蛋白的表达量相比于对照组都出现了一定程度的降低,在大豆肽和豌豆肽以及其不同配比下,细胞中GLUT2和GLUT4蛋白的表达量相比于模型组出现了不同程度的升高,其中,大豆肽∶豌豆肽=2∶1处理组的细胞中上述2个蛋白的表达量相比于模型组升高最为显著。
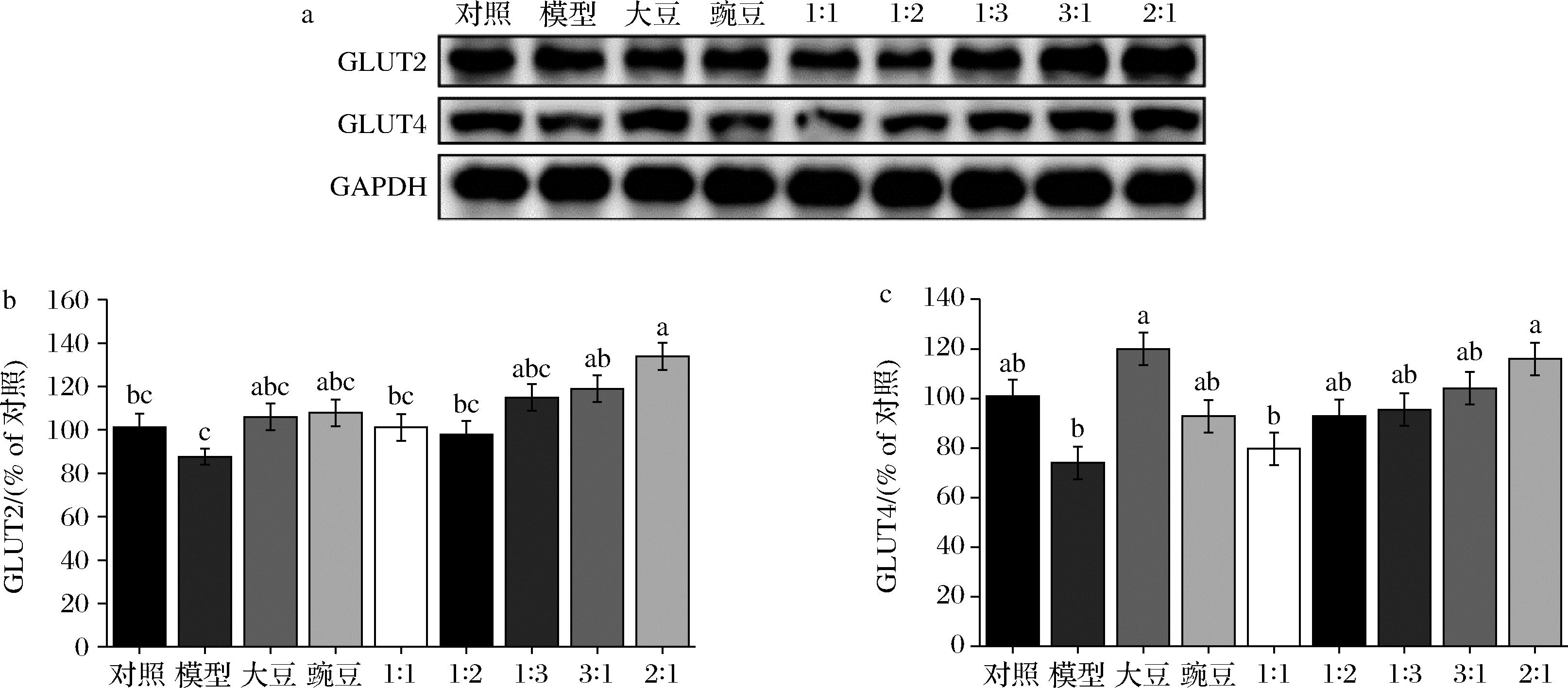
a-葡萄糖转运蛋白GLUT2和GLUT4灰度图;b-葡萄糖转运蛋白GLUT2相对灰度值;c-葡萄糖转运蛋白GLUT2相对灰度值
图5 GLUT2和GLUT4蛋白的相对表达水平
Fig.5 Relative expression levels of GLUT2 and GLUT4 preoteins
2.7 IRS-1/Akt通路磷酸化水平分析
磷酸化的IRS-1可以导致Akt产生磷酸化效应,引起Akt通路活化。Akt是胰岛素受体信号传导途径中的关键蛋白激酶,在细胞生长与凋亡、糖类代谢过程中起重要作用。活化的Akt抑制可以GSK-3β的磷酸化作用,引起GSK-3β下游底物糖原合成酶活性升高,从而促进糖原合成,抑制糖原分解,提高葡萄糖代谢,降低血糖,改善胰岛素抵抗状况。由图6可以看出,模型组中细胞IRS-1和Akt磷酸化水平相比于对照组显著降低,在处理组中,大豆肽∶豌豆肽=2∶1组的细胞中上述2种蛋白的磷酸化水平相比于模型组提高较为显著。
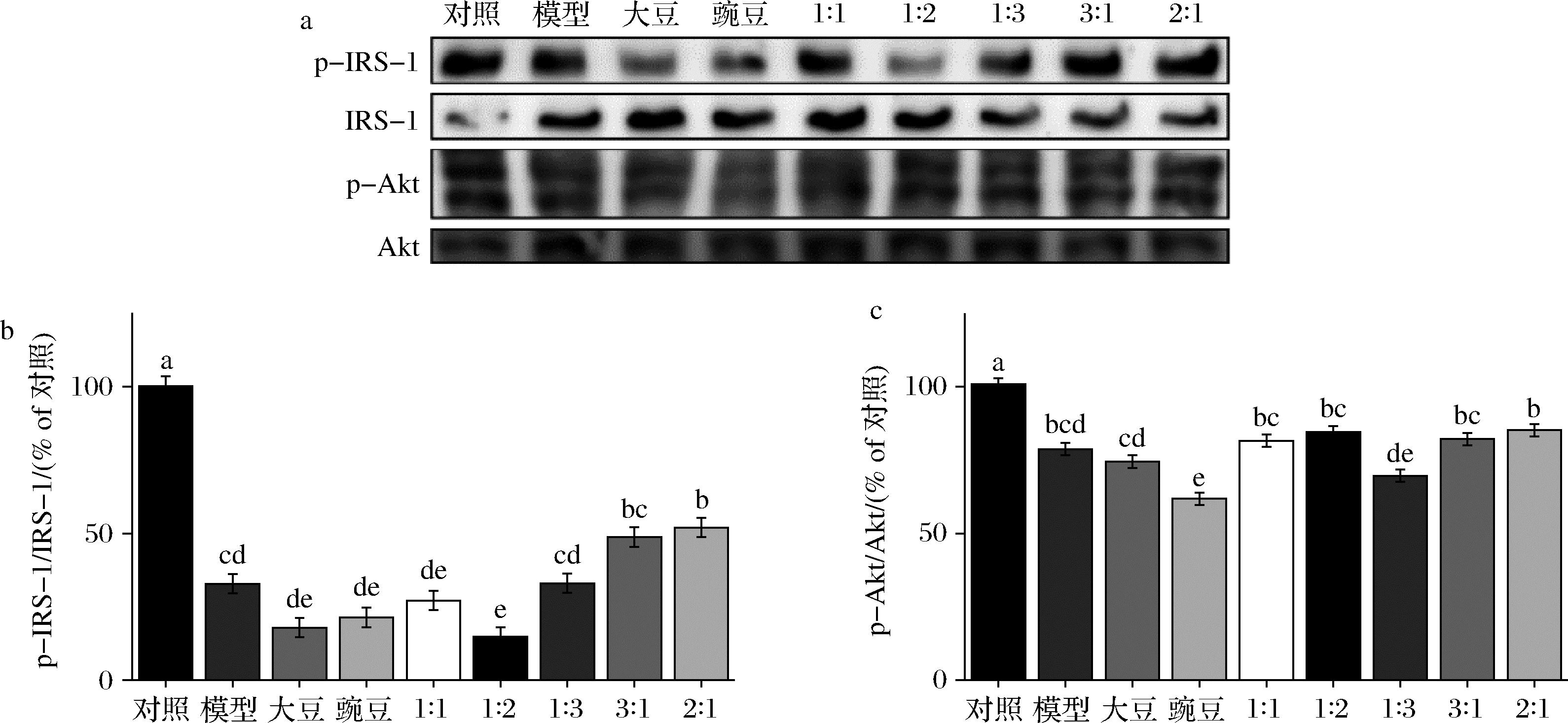
a-IRS-1、Akt及其磷酸化产物灰度图;b-IRS-1磷酸化水平;c-Akt磷酸化水平
图6 IRS-1和Akt蛋白的磷酸化水平
Fig.6 Phosphorylation levels of IRS-1 and Akt
3 结论
胰岛素抵抗是组织对胰岛素作用的敏感性下降,通常的临床上指的是机体对胰岛素促进葡萄糖提取的作用发生抵抗[17]。肝脏是胰岛素作用的中药靶组织之一,而HepG2细胞是一种体外研究肝细胞的常用细胞株,也是建立胰岛素抵抗模型研究的常用模型[18]。
GLUT2和GLUT4是调节葡萄糖跨细胞膜转运的蛋白成员,分别以非胰岛素和胰岛素依赖性方式调节葡萄糖跨细胞膜转运。IRS-1/P13K/AKT信号通路已被证实是GLUT4调控通路的上游。IRS-1促进P13K的磷酸化,磷酸化的P13K进一步将丝氨酸/苏氨酸Akt磷酸化为p-Akt,进一步促进GLU4从内囊泡转位到细胞膜,最后激发葡萄糖摄取。GLUT2易位能够介导葡萄糖在肝细胞膜中的扩散,并维持细胞内外葡萄糖的平衡[19]。因此,胰岛素刺激的葡萄糖摄取减少与胰岛素抵抗状态下p-IRS-1减少有关。
本研究中建立的胰岛素抵抗模型,表明HepG2细胞在模型刺激下的葡萄糖消耗、葡萄糖吸收、糖原含量的减少,GLUT2和GLUT4蛋白表达水平均降低,磷酸化的IRS-1及Akt均下降,而大豆肽及豌豆肽通过进入细胞膜作用,显著改善了葡萄糖代谢水平,这表明大豆肽和豌豆肽可能通过增加IRS和Akt的磷酸化水平来促进葡萄糖摄取和提高细胞中葡萄糖转运蛋白GLUT2和GLUT4的表达量,从而激活胰岛素信号通路,进一步改善葡萄糖跨膜代谢障碍,提高细胞对葡萄糖的吸收和消耗能力以及糖原合成能力。当大豆肽与豌豆肽以2∶1的比例时效果最佳。
[1] 朱振平, 韩晓英, 程东.大豆肽免疫调节作用实验研究[J].预防医学论坛, 2017, 23(9):710-711. ZHU Z P, HAN X Y, CHENG D.Study on immune regulation of soybean peptides[J].Preventive Medicine Tribune, 2017, 23(9):710-711.
[2] 谭秋实, 邵晶, 周丽丽, 等.大豆肽补充量和运动时间对大鼠血清游离氨基酸水平的影响[J].中国运动医学杂志, 2022, 41(4):288-299. TAN Q S, SHAO J, ZHOU L L, et al.Effects of soybean peptide supplement and exercise time on serum-free amino acid levels in rats[J].Chinese Journal of Sports Medicine, 2022, 41(4):288-299.
[3] YIMIT D, HOXUR P, AMAT N, et al.Effects of soybean peptide on immune function, brain function, and neurochemistry in healthy volunteers[J].Nutrition, 2012, 28(2):154-159.
[4] RAYAPROLU S J, HETTIARACHCHY N S, HORAX R, et al.Soybean peptide fractions inhibit human blood, breast and prostate cancer cell proliferation[J].Journal of Food Science and Technology, 2017, 54(1):38-44.
[5] AMAKYE W K, HOU C L, XIE L P, et al.Bioactive anti-aging agents and the identification of new anti-oxidant soybean peptides[J].Food Bioscience, 2021, 42:101194.
[6] ISHIHARA K, OYAIZU S, FUKUCHI Y, et al.A soybean peptide isolate diet promotes postprandial carbohydrate oxidation and energy expenditure in type II diabetic mice[J].The Journal of Nutrition, 2003, 133(3):752-757.
[7] WEI Y, ZHANG R X, FANG L, et al.Hypoglycemic effects and biochemical mechanisms of pea oligopeptide on high-fat diet and streptozotocin-induced diabetic mice[J].Journal of Food Biochemistry, 2019, 43(12):e13055.
[8] ZHU Y, ZHANG H X, WEI Y, et al.Pea-derived peptides, VLP, LLP, VA, and LL, improve insulin resistance in HepG2 cells via activating IRS-1/PI3K/AKT and blocking ROS-mediated p38MAPK signaling[J].Journal of Food Biochemistry, 2020, 44(11):e13454.
[9] 崔欣悦, 张瑞雪, 周明, 等.豌豆肽缓解胰岛素抵抗形成效果探究[J].食品工业科技, 2019, 40(12):145-148. CUI X Y, ZHANG R X, ZHOU M, et al.Effect of pea oligopeptides on relieving insulin resistance[J].Science and Technology of Food Industry, 2019, 40(12):145-148. [10] 张敏佳, 刘文颖, 贾福怀, 等.豌豆肽对环磷酰胺致免疫抑制小鼠免疫功能的影响[J].食品与发酵工业, 2018, 44(8):135-140. ZHANG M J, LIU W Y, JIA F H, et al.Effects of pea peptide on immune function in immunosuppressed mice induced by cyclophosphamide[J].Food and Fermentation Industries, 2018, 44(8):135-140.
[11] 秦修远, 陆路, 曹珂璐, 等.豌豆低聚肽的体外抗氧化作用[J].食品工业, 2018, 39(12):181-185. QIN X Y, LU L, CAO K L, et al.Antioxidant effects in vitro of pea oligopeptides[J].The Food Industry, 2018, 39(12):181-185.
[12] 刘文颖, 林峰, 金振涛, 等.玉米低聚肽的体外抗氧化作用[J].食品科学, 2011, 32(5):22-26. LIU W Y, LIN F, JIN Z T, et al.Antioxidant effect of corn oligopeptides in vitro[J].Food Science, 2011, 32(5):22-26.
[13] 尹忞强, 刘溪, 吴婷婷, 等.羁糖脂对HepG2胰岛素抵抗细胞葡萄糖代谢及相关蛋白表达的影响[J].药物评价研究, 2017, 40(6):783-787. YIN M Q, LIU X, WU T T, et al.Effects of Ji Tang Zhi on glucose metabolism and related protein expression in insulin resistance HepG2 cell line[J].Drug Evaluation Research, 2017, 40(6):783-787.
[14] YANG Z C, HUANG W, ZHANG J S, et al.Baicalein improves glucose metabolism in insulin resistant HepG2 cells[J].European Journal of Pharmacology, 2019, 854:187-193.
[15] CHEN B T, ABAYDULA Y, LI D L, et al.Taurine ameliorates oxidative stress by regulating PI3K/Akt/GLUT4 pathway in HepG2 cells and diabetic rats[J].Journal of Functional Foods, 2021, 85:104629.
[16] LI Y, LUO X X, YAN F D, et al.Puerariae lobatae radix elevated expression levels of OB-R, IRS2, GLUT1 and GLUT2 to regulate glucose metabolism in insulin-resistance HepG2 cells[J].China Journal of Chinese Materia Medica, 2017, 42(10):1939-1944.
[17] KHEIROLLAHZADEH F, EFTEKHARI E, GHOLLASI M, et al.Anti-hyperglycemic effects of Eryngium billardierei F.Delaroche extract on insulin-resistance HepG2 cells in vitro[J].Molecular Biology Reports, 2022, 49(5):3401-3411.
[18] 张敬升, 黄伟, 谢鸣.小檗碱对体外HepG2细胞IR模型抗IR的效应及机制[J].中国实验方剂学杂志, 2018, 24(21):138-143. ZHANG J S, HUANG W, XIE M.Effect of berberine on HepG2 IR model and its mechanism[J].Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(21):138-143.
[19] KLOVER P J, MOONEY R A.Hepatocytes:Critical for glucose homeostasis[J].The International Journal of Biochemistry &Cell Biology, 2004, 36(5):753-758.
[20] CHEN L, ZHENG S J, HUANG M, et al.β-ecdysterone from Cyanotis arachnoidea exerts hypoglycemic effects through activating IRS-1/Akt/GLUT4 and IRS-1/Akt/GLUT2 signal pathways in KK-Ay mice[J].Journal of Functional Foods, 2017, 39:123-132.