在全球范围内,宫颈癌是所有肿瘤疾病中导致女性死亡的第一或第二大诱因[1]。众所周知,肿瘤的转移是一个涉及细胞迁移和侵袭的复杂过程[2]。基质金属蛋白酶(matrix metalloproteinase, MMPs)被认为是与肿瘤侵袭和迁移相关的重要蛋白酶,其中,基质金属蛋白酶-2(matrix metalloproteinase 2, MMP-2)和基质金属蛋白酶-9(matrix metalloproteinase 9, MMP-9)在肿瘤转移中起着非常关键的作用,它们参与破坏I型和IV型胶原蛋白细胞外基质(extracellular matrix, ECM),从而促进癌症的转移[3-4]。因此,下调MMP-2和MMP-9蛋白的表达可能是抑制细胞迁移和侵袭的有效策略。
作为公认的微量元素,硒被发现在纳米尺度下,其理化性质会发生巨大变化,具有高效、低毒、吸收利用率高等独特的生物学效应[5-6]。但是,纳米硒(selenium nanoparticles, SeNPs)因具有较高的表面能,在水溶液中容易聚集成灰色和黑色元素硒,导致其生物活性和生物利用度降低,从而限制了它的应用[7]。因此,为了获得稳定的SeNPs,在制备过程中通常会加入稳定剂,不仅可以防止纳米硒聚沉,还能提高其生物活性。目前,常用的稳定剂有多糖[8]、蛋白质[9]、多肽[10]和多酚等[11]。其中,多糖因其复杂的支链结构和丰富的羟基被认为是天然、安全、方便和环保的分散剂[12]。此外,多糖也具有良好的水溶性和抗肿瘤等生物活性[13]。硫酸软骨素(chondroitin sulfate, CS)是一种硫酸化的线性黏多糖。研究发现,CS无毒性且生物相容性良好,骨架中含有大量活泼基团,易于实现疏水性化学修饰和聚合物接枝,具有抗氧化、抗肿瘤、抗血栓等多种生理活性[14-17]。
基于上述的优点,本文选择CS作为稳定剂对纳米硒进行修饰制备硫酸软骨素纳米硒(selenium-chondroitin sulfate nanoparticles, SeCS),希望实现CS和SeNPs协同抗肿瘤的效果。同时,还未见SeCS抑制人宫颈癌HeLa细胞迁移和侵袭的相关报道。故本文以Hela细胞为研究对象,进一步考察SeCS对Hela细胞迁移和侵袭的影响,为SeCS作为一种新型的肿瘤转移抑制剂提供理论依据和数据参考。
1 材料与方法
1.1 材料与试剂
硫酸软骨素纳米硒,实验室自制;硫酸软骨素(95%纯度,货号C107703),阿拉丁试剂(上海)有限公司;胎牛血清、PBS、DMEM高糖培养基、0.25%胰蛋白酶溶液和双抗溶液,美国Gibco公司;Hela人宫颈癌细胞,美国ATCC公司;Matrigel基质胶含酚红和草酸铵结晶紫染色液(0.1%),北京索莱宝公司;4%多聚甲醛,广州硕谱生物科技有限公司;PVDF膜浸润活化液、BCA蛋白浓度测定试剂盒、RIPA裂解液(强)、SDS-PAGE电泳液(Tris-Gly,Powder)、TBSTw(TBS+Tween-20)、Western转膜液、Western一抗稀释液、Western二抗稀释液、QuickBlockTM Western封闭液、BeyoGelTM Plus PAGE预制胶(Tris-Gly,8%,15孔)、ECL化学发光试剂盒和辣根过氧化物酶标记山羊抗兔IgG(H+L),上海碧云天生物技术公司;GAPDH抗体、MMP-2抗体和MMP-9抗体,维百奥(北京)生物科技有限公司。
1.2 仪器与设备
AUW120电子天平,日本岛津公司;HL-6数显恒温水浴锅,常州奥华仪器有限公司;FD8508真空冷冻干燥机,韩国ilshin公司;JEM-1400plus透射电子显微镜,日本JEOL公司;K-Alpha X射线光电子能谱仪,美国Thermo Scientific公司;傅立叶红外光谱仪,德国BRUKER公司;CKX41倒置显微镜,日本OLYMPUS公司;Tanon 5200全自动化学发光图像分析系统,广州誉维生物科技仪器有限公司。
1.3 实验方法
1.3.1 SeCS的制备
参考CHEN等[18]的方法,略作修改。将摩尔质量比为1∶8的Na2SeO3和抗坏血酸(维生素C)溶于30 mL 0.1 mg/mL的CS溶液中,在25 ℃下搅拌3 h。经透析袋(分子质量为3 500 kDa)透析48 h后,冷冻干燥得到所需的样品SeCS。SeNPs的制备过程同SeCS,只是不添加CS。
1.3.2 SeCS的结构表征
1.3.2.1 透射电镜(transmission electron microscopy, TEM)观察
运用TEM观察样品的微观形态。具体操作过程如下:将铜膜网格浸入样品中,然后用醋酸双氧铀染色90 s,待干燥后,观察样品的微观形态。
1.3.2.2 扫描电镜(scanning electron microscopy, SEM)观察
将少量样品均匀地分散在导电双面胶上进行固定,随后放入离子溅射镀膜仪中,在真空环境下对样品进行表面喷金处理,镀金条件为工作电压15 keV和工作电流15 mA,在不同放大倍数下观察样品形貌。
1.3.2.3 X射线光电子能谱仪(X-ray photoelectron spectroscopy, XPS)分析
运用XPS对样品的硒价态进行分析。具体参数如下:分析室工作时真空度优于5×10-7mBar;使用单色Al Kα源(能量1 486.6 eV)为X光源,在工作电压12 kV,灯丝电流6 mA条件下进行样品的XPS测试。
1.3.2.4 傅立叶红外光谱仪(Fourier transform infrared spectroscopy, FTIR)分析
取2.0 mg样品与KBr粉末以质量比1∶100的比例混合,研磨均匀后压片至透明薄片,在扫描波长为4 000~400 cm-1的条件进行检测。
1.3.3 划痕试验检测Hela细胞的愈合能力[19]
Hela细胞按2×105个/孔接种于24孔板,待细胞融合度达到90%以上时,用10 μL枪头于孔板中央做垂直划痕,再用PBS清洗3遍除去划下的悬浮细胞,然后,实验组每孔分别加入1 mL 20 μg/mL CS、SeNPS和SeCS的无血清培养基;空白对照组加入1 mL的无血清培养基。将处理后的细胞放入培养箱(37 ℃、5% CO2)中继续培养,在划痕后0、24、48 h对划痕区域随机选择5个点进行拍照,用Image J软件计算划痕愈合率。愈合率的计算如公式(1)所示:
愈合率![]()
1.3.4 Transwell小室检测Hela细胞的迁移能力
采用20 μg/mL CS、SeNPs和SeCS分别处理Hela细胞48 h,然后,细胞经消化、离心和无血清培养基重悬细胞后,以5×105个/孔的细胞密度接种于Transwell上室,每孔200 μL,下室中加入600 μL含20%(体积分数)血清的培养基。然后,Transwell小室放入培养箱(37 ℃、5% CO2)中培养48 h,取出上室经PBS反复润洗后,加入4%多聚甲醛固定30 min,结晶紫染色5 min,用棉签蘸取PBS擦去上室内未迁移的细胞,随机选取5个视野(200×)观察并计数穿越小室的细胞数目。迁移率的计算如公式(2)所示:
迁移率![]()
1.3.5 Transwell小室检测Hela细胞的侵袭能力[20]
将Matrigel基质胶涂在Transwell小室上,置于培养箱(37 ℃、5% CO2)固化1 h。采用20 μg/mL CS、SeNPs和SeCS分别处理Hela细胞48 h,然后,细胞经消化、离心和无血清培养基重悬细胞后,以5×105个/孔的细胞密度接种于Transwell上室,每孔200 μL,下室中加入600 μL含20%血清的培养基。然后,Transwell小室放入培养箱(37 ℃、5% CO2)中培养48 h,取出上室经PBS反复润洗后,加入4%多聚甲醛固定30 min,结晶紫染色5 min,用棉签蘸取PBS擦去上室内未迁移的细胞,随机选取5个视野(200×)观察并计数穿越小室的细胞数目。侵袭率的计算如公式(3)所示:
侵袭率![]()
1.3.6 Western blot检测MMP-2和MMP-9蛋白表达水平
20 μg/mL CS、SeNPs和SeCS分别处理Hela细胞48 h,经胰酶消化后,加入RIPA裂解液提取蛋白,用BCA试剂盒测定样品的蛋白浓度。样品经SDS-PAGE垂直板电泳后,电转至PVDF膜上。PVDF膜经封闭液封闭1 h后,加入一抗置于4 ℃下过夜孵育。然后,将PVDF膜放入对应的二抗中孵育2 h,经TBST洗膜3次后,采用ECL对膜进行显色,用化学发光成像仪进行拍照,计算机扫描并分析实验结果。
1.3.7 数据统计与分析
每次实验重复3次,实验数据均以平均值±标准差表示。实验结果采用SPSS 22.0软件进行统计学分析,采用单因素方差分析方法分析实验数据。
2 结果与分析
2.1 TEM观察SeCS的形态和大小
采用TEM对SeCS和SeNPs的形态和尺寸进行表征。实验结果如图1所示。由图1-a和图1-c可知,SeNPs严重聚集形成大颗粒,表明SeNPs极不稳定。由图1-b和图1-d可知,SeCS为尺寸相对较小的单分散且均匀的球形颗粒,表明SeNPs经CS修饰后能够阻止SeNPs颗粒的聚集从而起到分散和稳定SeNPs的作用。此外,由图1可知,SeCS的粒径明显小于SeNPs。

a,c-SeNPs;b,d-SeCS
图1 SeNPs和SeCS的透射电镜图
Fig.1 TEM of SeNPs and SeCS
2.2 SEM观察SeCS的表面形貌
采用SEM对SeCS的表面形貌进行检测,实验结果如图2所示。由图2-a和图2-c可知,SeNPs易聚集,形成拐枣形状的聚集体。而SeNPs经CS修饰形成SeCS后,形成大小均一的球形颗粒,说明CS可有效防止SeNPs的团聚沉淀(图2-b、图2-d)。

a,c-SeNPs; b,d-SeCS
图2 SeNPs和SeCS的扫描电镜图
Fig.2 SEM of SeNPs and SeCS
2.3 XPS测定SeCS的硒价态
采用XPS分析SeCS中硒元素的价态,实验结果如图3所示。由图3-a可知,SeNPs中Se的电子结合能为54.78 eV,根据HAN等[21]报道零价硒的电子结合能位于54.6~57.5 eV可知,该峰为零价硒电子结合能峰位。由图3-b可知,SeCS中Se的电子结合能峰位为54.58 eV,与SeNPs中Se的电子结合能峰位相近,表明SeCS中的Se也是以零价硒的形式存在。
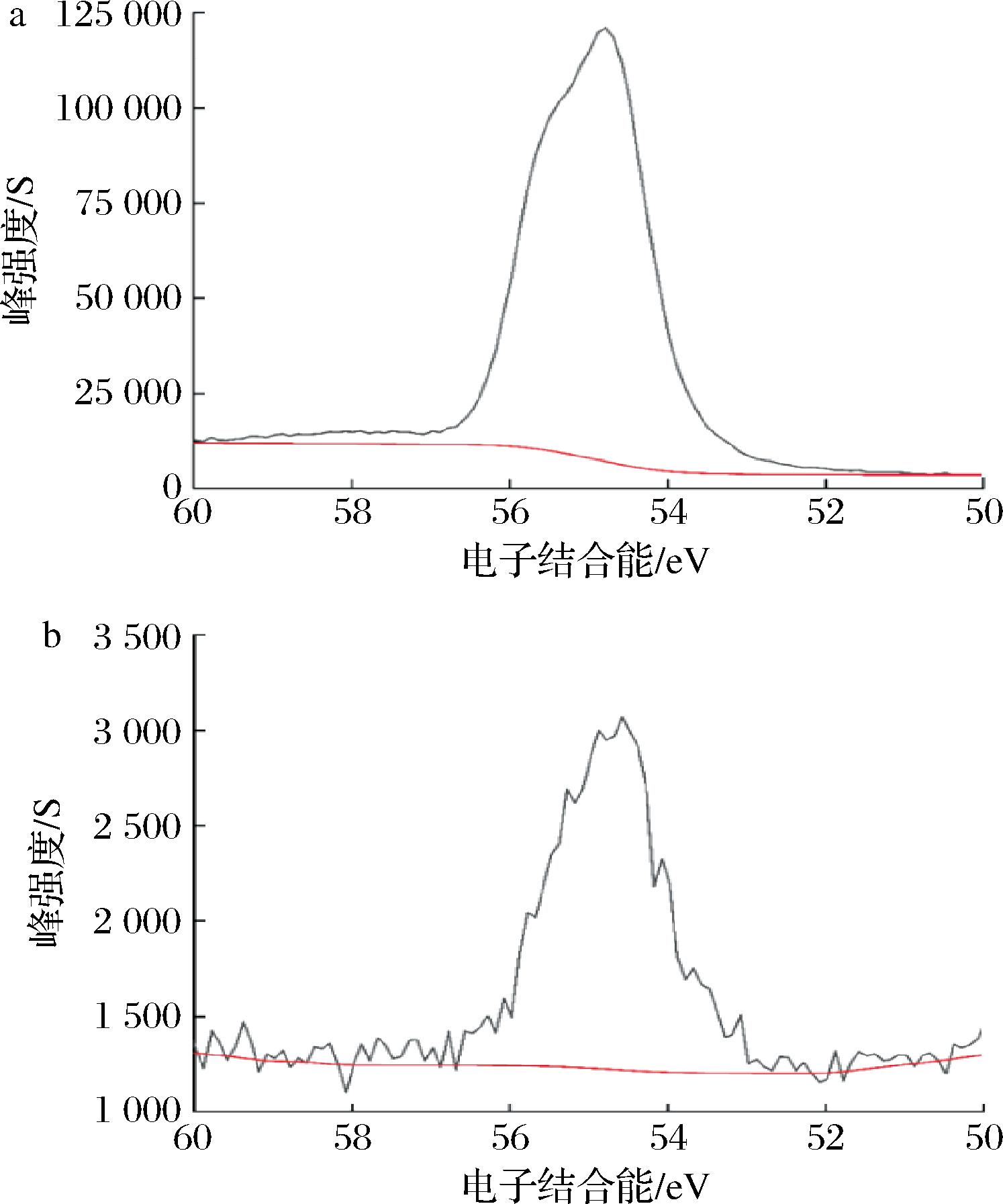
a-SeNPs; b-SeCS
图3 SeNPs和SeCS的XPS图
Fig.3 XPS diagrams of SeNPs and SeCS
2.4 FTIR测定SeCS的特征基团
采用FTIR技术表征SeCS中CS与SeNPs的结合方式,实验结果如图4所示。SeNPs的红外光谱图没有出现明显的特征吸收峰,这跟前人的报道基本一致[22]。然而,相比SeNPs,SeCS在3 400 cm-1附近有一宽峰,这可能是由于CS中羟基的伸缩振动引起的。此外,在1 620和1 415 cm-1附近出现了CS中乙酰氨基的N-H伸缩振动和羧基的振动,且在1 200~800 cm-1有硫酸基的特征吸收峰[23]。综上可知,SeCS中存在CS的特征吸收峰,提示CS可能通过吸附作用修饰在SeNPs的表面。
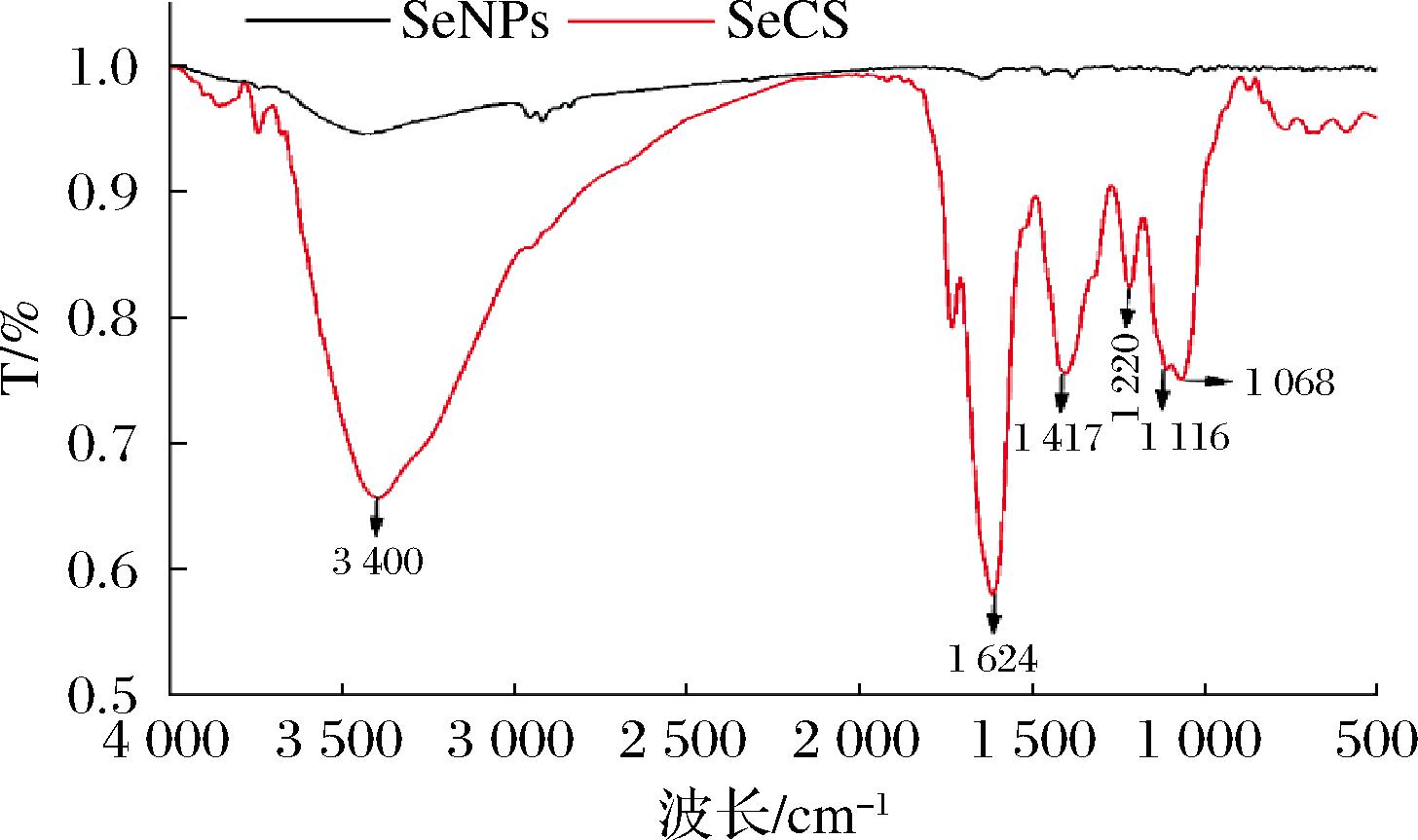
图4 SeNPs和SeCS的红外光谱图
Fig.4 FTIR diagrams of SeNPs and SeCS
2.5 划痕试验检测Hela细胞的愈合能力
采用划痕实验检测SeCS对Hela细胞愈合能力的影响。实验结果如图5所示。由图5-a可知,细胞经SeNPs和SeCS分别处理24和48 h后,SeCS处理组中划痕留下的空隙大于SeNPs,说明SeCS处理后的细胞划痕愈合的程度弱于SeNPs。而且,当处理时间为48 h时,SeCS处理组中的细胞愈合率仅为(6.85±1.30)%,显著低于SeNPs处理组中的愈合率(19.06±1.61)%(图5-b),表明SeCS抑制细胞愈合的能力强于SeNPs。而CS在24 h时没有表现出明显的抑制细胞愈合的能力,随着时间的延长,虽然相比空白对照组,愈合率有所下降,但没有显著差异。综上可知,CS与SeNPs结合形成SeCS后,抑制细胞愈合的能力显著上升。
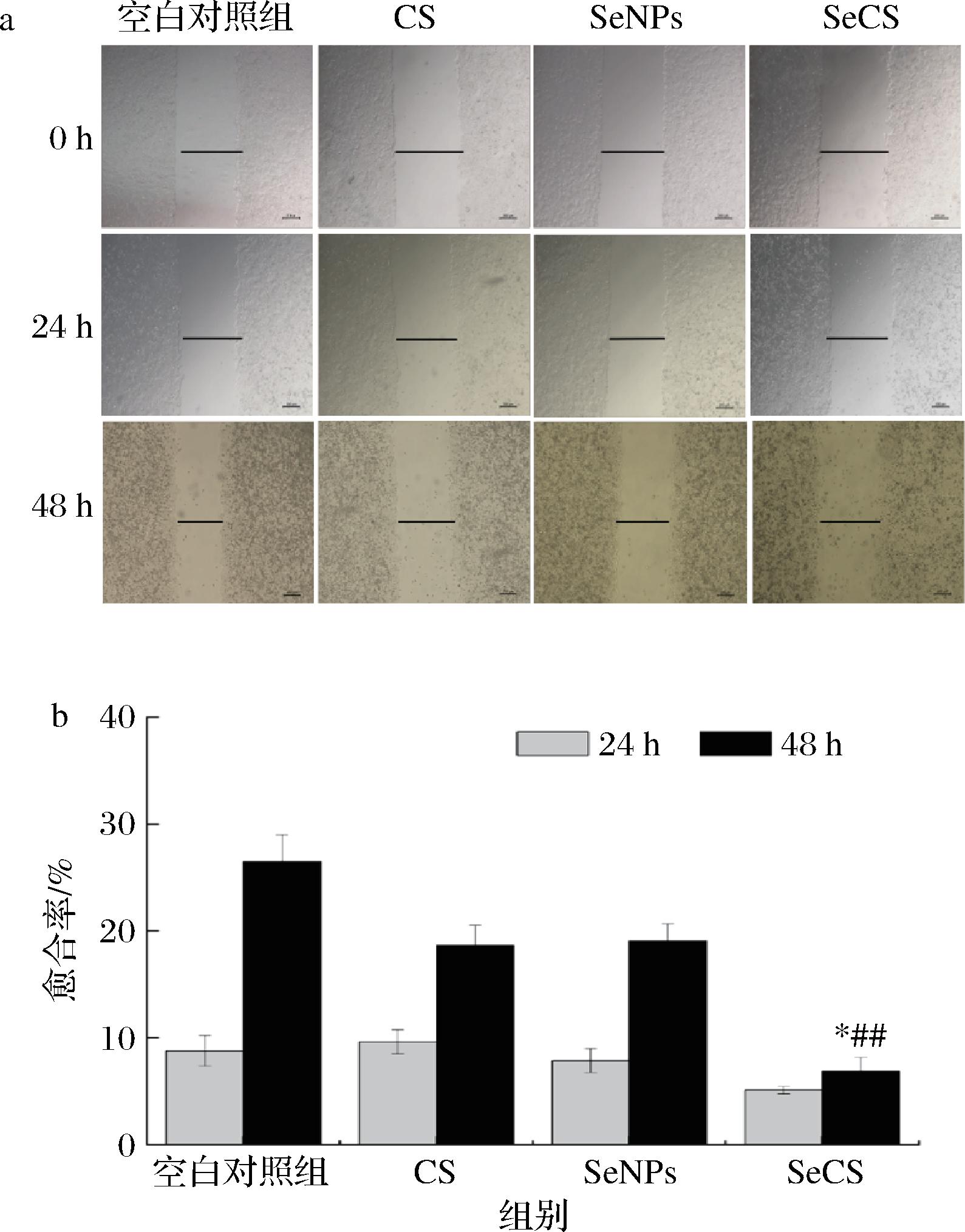
a-20 μg/mL CS、SeNPs和SeCS处理0、24、48 h后划伤Hela 细胞的显微镜照片(50×);b-Hela细胞划痕愈合率柱状图
图5 不同处理对Hela细胞愈合能力的影响
Fig.5 Effects of different treatments on healing ability of Hela cells 注:与空白对照组相比:*P<0.05,与SeNPs组相比: ##P<0.01(下同)。
2.6 Transwell小室检测Hela细胞迁移能力
采用Transwell法测定SeCS对Hela细胞迁移能力的影响。实验结果如图6所示。由图6-a可知,细胞经CS和SeNPs处理后,与空白对照组相比,迁移至下室的细胞虽有所减少,但效果不明显。而SeCS处理细胞后,与CS和SeNPs相比,迁移至下室的细胞明显减少,细胞聚集的密度显著降低,表明SeCS使细胞的迁移穿透能力减弱。而且,SeCS处理细胞后,细胞的迁移率为(59.19±7.74)%,显著低于CS组的迁移率(85.23±4.47)%和SeNPs处理组的迁移率(92.84±9.06)%(图6-b),表明SeCS抑制细胞迁移的能力强于CS和SeNPs。
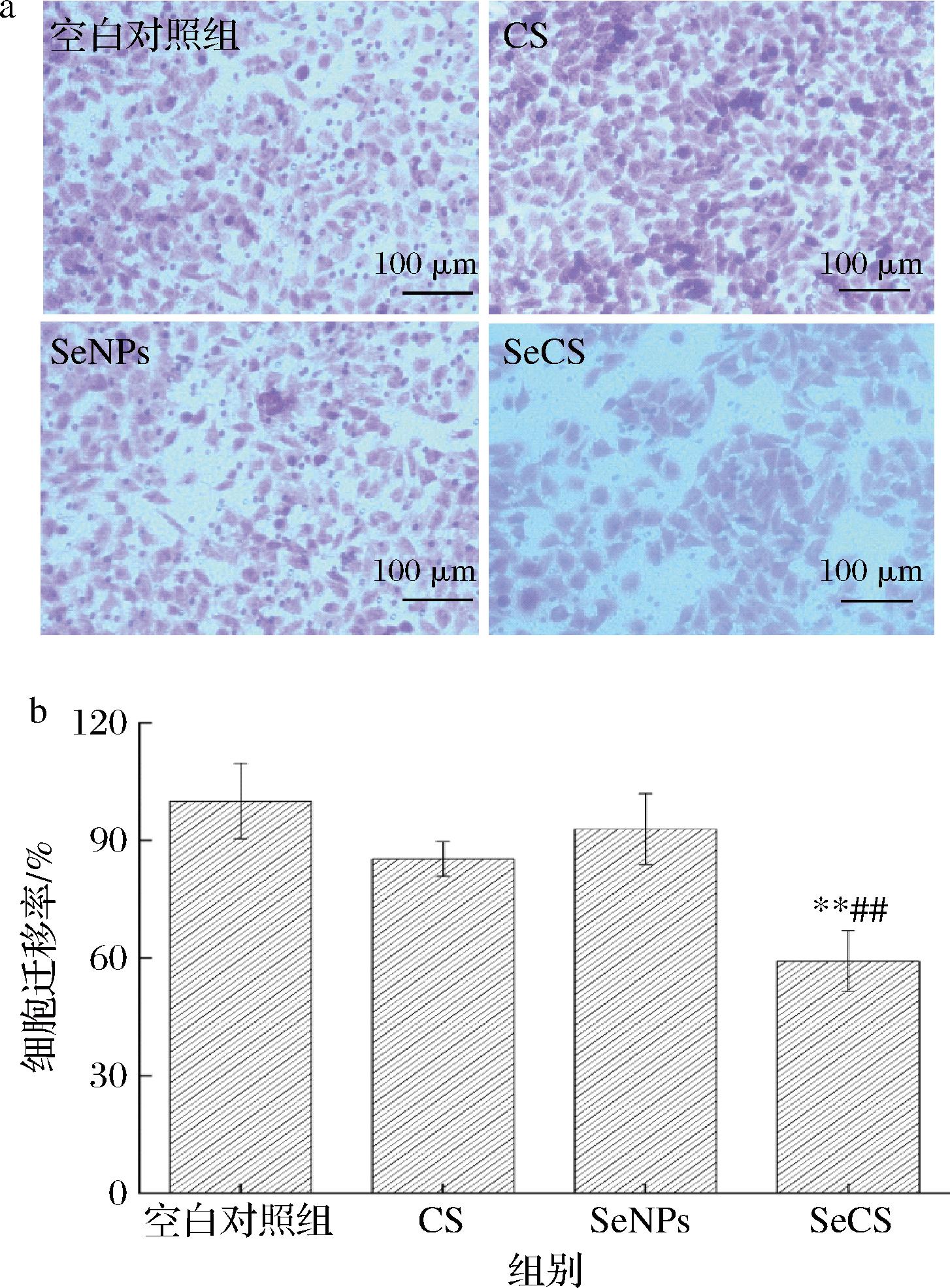
a-20 μg/mL CS、SeNPs和SeCS处理48 h后Hela细胞 迁移的显微照片(200×);b-Hela细胞迁移率柱状图
图6 不同处理对Hela细胞迁移能力的影响
Fig.6 Effects of different treatments on migration ability of Hela cells
2.7 Transwell小室检测Hela细胞侵袭能力
采用Transwell法测定SeCS对Hela细胞侵袭能力的影响。实验结果如图7所示。由图7-a可知,细胞经CS和SeNPs处理后,与空白对照组相比,侵袭至下室的细胞虽有所减少,但效果不明显。而SeCS处理细胞后,与CS和SeNPs相比,侵袭至下室的细胞明显减少,下室中的侵袭细胞数目越少,说明SeCS使细胞侵袭穿透基质胶的能力减弱。而且,SeCS处理细胞后,细胞的侵袭率为(82.43±4.21)%,显著低于CS组的侵袭率(103.28±6.14)%和SeNPs处理组的侵袭率(98.75±6.28)%(图7-b),表明SeCS抑制细胞侵袭的能力强于CS和SeNPs。
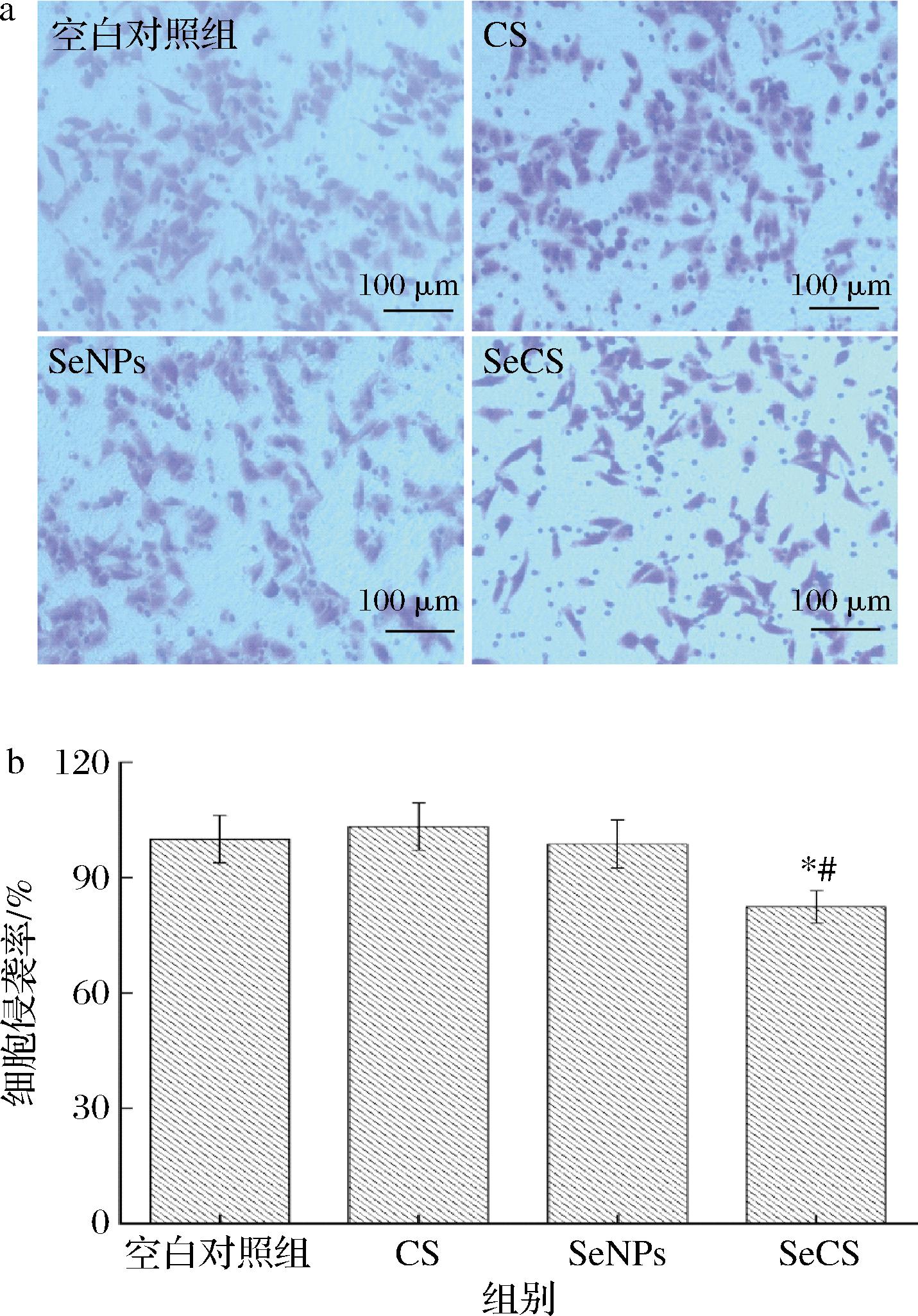
a-20 μg/mL CS、SeNPs和SeCS 处理48 h后Hela 细胞侵袭的显微照片(200×);b-Hela细胞侵袭率柱状图
图7 不同处理对Hela细胞侵袭能力的影响
Fig.7 Effects of different treatments on invasion ability of Hela cells
2.8 Western blot检测MMP-2和MMP-9蛋白的表达水平
MMP有助于肿瘤细胞的侵袭、血管生成和恶性进展,MMP-2和MMP-9蛋白在人宫颈癌中高表达,可能影响其侵袭性[24-25]。为了进一步探究SeCS抑制Hela细胞迁移和侵袭的可能机制,采用Western blot方法检测SeCS处理细胞后对细胞内MMP-2和MMP-9蛋白表达量的影响。由图8-a可知,相比CS和SeNPs处理组,SeCS处理细胞后,MMP-2和MMP-9的蛋白条带变淡,表明SeCS能够抑制MMP-2和MMP-9的表达。进一步对其条带的灰度值进行分析发现,MMP-2和MMP-9的蛋白表达量从SeNPs处理组的(112.69±11.53)%和(89.76±6.35)%下降到SeCS处理组的(75.75±7.32)%和(81.98±7.02)%,说明SeCS显著下调了MMP-2和MMP-9的表达水平(图8-b)。

a-蛋白表达条带图;b-蛋白表达柱状图
图8 Western Blot 检测MMP-2和MMP-9蛋白表达水平
Fig.8 Expression levels of MMP-2 and MMP- 9 proteins by Western blot 注:与空白对照组相比:*P<0.05或**P<0.01; 与SeNPs对照组相比:##P<0.01。
3 结论
本文采用氧化还原法制备SeCS,通过TEM、SEM、XPS和FTIR对其结构进行鉴定,发现成功制备得到的SeCS为零价态的球形纳米粒,这一研究结果与其他多糖如石榴多糖[26]、壳聚糖[27]和阿拉伯树胶[28]修饰纳米硒的报道相似。
癌细胞的转移和侵袭是肿瘤细胞的典型特征。肿瘤转移是一个涉及细胞迁移、侵袭和黏附的复杂过程[29]。其中,迁移是癌细胞侵袭和转移的关键环节[30]。为了进一步考察SeCS对Hela细胞迁移能力的影响,本文采用划痕实验考察了20 μg/mL CS、SeNPs和SeCS处理细胞0、24、48 h后细胞的愈合效果,发现与CS和SeNPs相比,SeCS划痕愈合速率显著低于CS和SeNPs,说明SeCS能抑制细胞的横向迁移。此外,本研究还运用Transwell实验进一步考察了SeCS抑制Hela细胞纵向迁移的效果,发现相比CS和SeNPs,细胞经SeCS处理后,迁移细胞数目减少,说明SeCS能够抑制Hela细胞的纵向迁移。而且,通过考察SeCS抑制Hela细胞侵袭的研究也发现,相比CS和SeNPs,SeCS处理后的细胞通过基质胶的能力变弱,说明SeCS能够抑制Hela细胞的侵袭。这可能是SeCS处理Hela细胞后因不能降解ECM导致其侵袭能力减弱[31-32]。
研究发现,MMPs参与细胞外基质和基底膜的降解,其中,MMP家族成员MMP-2和MMP-9通过降解细胞外基质的主要成分胶原蛋白来参与多种癌细胞的侵袭[33]。为了阐明SeCS抑制Hela细胞迁移和侵袭的可能机制,采用Western blot对SeCS处理细胞后的MMP-2和MMP-9蛋白表达情况进行检测,结果发现相比SeNPs,SeCS处理组中MMP-2和MMP-9蛋白的表达量更低,这可能是由于SeCS的尺寸小于SeNPs,使得SeCS更容易穿过细胞膜进入细胞,从而提高了细胞内SeCS的含量,增强了SeCS的抗肿瘤活性。同时,值得注意的是,相比空白对照组,CS组中的MMP-2和MMP-9蛋白没有表现出下调趋势,这一结果跟Transwell的实验结果是一致的,说明CS没有表现出抑制Hela细胞迁移和侵袭的作用。但是,这与前人报道的CS能够抑制黑色素瘤细胞[17]、肺癌细胞[34]、乳腺癌[35]等细胞增殖和迁移的研究结果不一致,推测可能是CS对不同的肿瘤细胞具有不同的细胞选择性,此外与CS处理细胞的浓度也密切相关。
综上所述,本研究制备的SeCS能够通过下调MMP-2和MMP-9的表达抑制Hela细胞的迁移和侵袭,为其后续的临床应用奠定理论基础和数据参考。
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA:a Cancer Journal for Clinicians, 2018, 68(6):394-424.
[2] WU J S, JIANG J, CHEN B J, et al.Plasticity of cancer cell invasion:Patterns and mechanisms[J].Translational Oncology, 2021, 14(1):100899.
[3] SUN Y S, THAKUR K, HU F, et al.Icariside II suppresses cervical cancer cell migration through JNK modulated matrix metalloproteinase-2/9 inhibition in vitro and in vivo[J].Biomedicine &Pharmacotherapy=Biomedecine &Pharmacotherapie, 2020, 125:110013.
[4] SHI Y, MA X C, FANG G, et al.Matrix metalloproteinase inhibitors (MMPIs) as attractive therapeutic targets:Recent progress and current challenges[J].NanoImpact, 2021, 21:100293.
[5] RAYMAN M P.The importance of selenium to human health[J].The Lancet, 2000, 356(9225):233-241.
[6] RAMAMURTHY C, SAMPATH K S, ARUNKUMAR P, et al.Green synthesis and characterization of selenium nanoparticles and its augmented cytotoxicity with doxorubicin on cancer cells[J].Bioprocess and Biosystems Engineering, 2013, 36(8):1131-1139.
[7] YAN J K, QIU W Y, WANG Y Y, et al.Fabrication and stabilization of biocompatible selenium nanoparticles by carboxylic curdlans with various molecular properties[J].Carbohydrate Polymers, 2018, 179:19-27.
[8] 史梦华, 任瑞芳, 郑涵予, 等.多糖纳米硒的制备、表征和生物活性的研究进展[J].食品科技, 2022, 47(3):8-14. SHI M H, REN R F, ZHENG H Y, et al.Research progress of synthesis, characterization and biological activity of selenium nanoparticles polysaccharides[J].Food Science and Technology, 2022, 47(3):8-14.
[9] SHAHABADI N, ZENDEHCHESHM S, KHADEMI F.Selenium nanoparticles:Synthesis, in-vitro cytotoxicity, antioxidant activity and interaction studies with ct-DNA and HSA, HHb and Cyt c serum proteins[J].Biotechnology Reports, 2021, 30:e00615. [10] TANG H Y, HUANG Q, WANG Y L, et al.Development, structure characterization and stability of food grade selenium nanoparticles stabilized by tilapia polypeptides[J].Journal of Food Engineering, 2020, 275:109878.
[11] 于少轩. 姜黄素纳米复合物的制备及其癌症化学预防活性研究[D].杨凌:西北农林科技大学, 2017. YU S X.Synthesis and cancer chemopreventive activities of curcumin nanocomposites[D].Yangling:Northwest A &F University, 2017.
[12] 刘晓庆, 魏凌峰, 贾继来, 等.纳米硒多糖载体的构建及其抗肿瘤应用的研究进展[J].食品工业科技, 2022, 43(21):454-460. LIU X Q, WEI L F, JIA J L, et al.Research progress of constructing selenium nanoparticles by polysaccharide carriers and their application in anti-tumor[J].Science and Technology of Food Industry, 2022, 43(21):454-460.
[13] CHAKRABORTY I, SEN I K, MONDAL S, et al.Bioactive polysaccharides from natural sources:A review on the antitumor and immunomodulating activities[J].Biocatalysis and Agricultural Biotechnology, 2019, 22:101425.
[14] 刘梦锐. 基于硫酸软骨素的环境敏感型自组装纳米粒递药系统的研究[D].济南:山东大学, 2019. LIU M R.Studies on the stimuli-responsive self-assembled nanoparticles based on chondroitin sulfate[D].Jinan:Shandong University, 2019.
[15] ZHOU C, MI S, LI J, et al.Purification, characterisation and antioxidant activities of chondroitin sulphate extracted from Raja porosa cartilage[J].Carbohydrate Polymers, 2020, 241:116306.
[16] KHAN A R, YANG X Y, DU X Y, et al.Chondroitin sulfate derived theranostic and therapeutic nanocarriers for tumor-targeted drug delivery[J].Carbohydrate Polymers, 2020, 233:115837.
[17] PALHARES L C G F, BARBOSA J S, SCORTECCI K C, et al.In vitro antitumor and anti-angiogenic activities of a shrimp chondroitin sulfate[J].International Journal of Biological Macromolecules, 2020, 162:1153-1165.
[18] CHEN J P, CHEN X H, LI J R, et al.Preparation and characterization of nano-selenium decorated by chondroitin sulfate derived from shark cartilage and investigation on its antioxidant activity[J].Marine Drugs, 2022, 20(3):172.
[19] SHI M L, CHEN Y F, WU W Q, et al.Luteolin inhibits the proliferation, adhesion, migration and invasion of choroidal melanoma cells in vitro[J].Experimental Eye Research, 2021, 210:108643.
[20] ZHANG S D, YU L, WANG P, et al.Inotodiol inhibits cells migration and invasion and induces apoptosis via p53-dependent pathway in HeLa cells[J].Phytomedicine, 2019, 60:152957.
[21] HAN D S, BATCHELOR B, ABDEL-WAHAB A.XPS analysis of sorption of selenium(IV) and selenium(VI) to mackinawite (FeS)[J].Environmental Progress &Sustainable Energy, 2013, 32(1):84-93.
[22] YE X G, CHEN Z Z, ZHANG Y Y, et al.Construction, characterization, and bioactive evaluation of nano-selenium stabilized by green tea nano-aggregates[J].LWT, 2020, 129:109475.
[23] WANG T, ZHANG S L, REN S Y, et al.Structural characterization and proliferation activity of chondroitin sulfate from the sturgeon, Acipenser schrenckii[J].International Journal of Biological Macromolecules, 2020, 164:3005-3011.
[24] YING T H, LIN C L, CHEN P N, et al.Angelol-a exerts anti-metastatic and anti-angiogenic effects on human cervical carcinoma cells by modulating the phosphorylated-ERK/miR-29a-3p that targets the MMP2/VEGFA axis[J].Life Sciences, 2022, 296:120317.
[25] SHI C, ZHANG G B, YIN S W.Effect of bortezomib on migration and invasion in cervical carcinoma HeLa cell[J].Asian Pacific Journal of Tropical Medicine, 2015, 8(6):485-488.
[26] TANG L, LUO X M, WANG M Y, et al.Synthesis, characterization, in vitro antioxidant and hypoglycemic activities of selenium nanoparticles decorated with polysaccharides of Gracilaria lemaneiformis[J].International Journal of Biological Macromolecules, 2021, 193(Pt A):923-932.
[27] ZHANG C Y, ZHAI X N, ZHAO G H, et al.Synthesis, characterization, and controlled release of selenium nanoparticles stabilized by chitosan of different molecular weights[J].Carbohydrate Polymers, 2015, 134:158-166.
[28] SONG X X, CHEN Y Y, SUN H B, et al.Physicochemical stability and functional properties of selenium nanoparticles stabilized by chitosan, carrageenan, and gum Arabic[J].Carbohydrate Polymers, 2021, 255:117379.
[29] JIANG W G, HISCOX S, SINGHRAO S K, et al.Induction of tyrosine phosphorylation and translocation of ezrin by hepatocyte growth factor/scatter factor (HGF/SF)[J].Biochemical and Biophysical Research Communications, 1995, 217(3):1062-1069.
[30] KIM E K, YUN S J, HA J M, et al.Selective activation of Akt1 by mammalian target of rapamycin complex 2 regulates cancer cell migration, invasion, and metastasis[J].Oncogene, 2011, 30(26):2954-2963.
[31] CURRAN S, MURRAY G I.Matrix metalloproteinases:Molecular aspects of their roles in tumour invasion and metastasis[J].European Journal of Cancer, 2000, 36(13):1621-1630.
[32] DERYUGINA E I, QUIGLEY J P.Matrix metalloproteinases and tumor metastasis[J].Cancer and Metastasis Reviews, 2006, 25(1):9-34.
[33] EDDY R J, WEIDMANN M D, SHARMA V P, et al.Tumor cell invadopodia:Invasive protrusions that orchestrate metastasis[J].Trends in Cell Biology, 2017, 27(8):595-607.
[34] LI F C, TEN DAM G B, MURUGAN S, et al.Involvement of highly sulfated chondroitin sulfate in the metastasis of the lewis lung carcinoma cells[J].Journal of Biological Chemistry, 2008, 283(49):34294-34304.
[35] NADANAKA S, KINOUCHI H, KITAGAWA H.Chondroitin sulfate-mediated N-cadherin/β-catenin signaling is associated with basal-like breast cancer cell invasion[J].The Journal of Biological Chemistry, 2018, 293(2):444-465.