贫血是常见的血液疾病,其特征是当血液缺乏足够健康的红细胞、血红蛋白浓度降低以及红细胞比积低于正常水平,导致携氧能力降低[1]从而引发的症状。贫血会损害一些身体功能(如精神和身体疲劳等[2])。贫血的3个主要原因来自于红细胞损伤增加、红细胞生成减少以及失血[3],在实验模型中经常使用乙酰苯肼(acetylphenylhydrazine,APH)和环磷酰胺(cyclophosphamide,CTX)联合诱导来建立贫血模型[4]。乙酰苯肼是一种强氧化剂,可以针对性地破坏红细胞,通过氧化血红蛋白从而对红细胞产生损害[5],使得血液中红细胞数明显减少,出现溶血性贫血现象。环磷酰胺作为一种常规化疗药物经常应用在肿瘤患者的治疗中,具有较强的免疫抑制作用,通过骨髓功能障碍造成造血干细胞的减少,导致再生性贫血症状[6];二者联合使用从双重环节上建立小鼠贫血模型。
乌鸡是我国的一种特有鸡种,主产于江西泰和地区,不仅在外形上十分抢眼,而且具有极高营养价值和药用价值。乌鸡的氨基酸种类齐全,含量远高于白鸡,具有丰富的必需氨基酸,此外还含有多种微量元素和常量元素,其中铁元素含量也比普通鸡高,是营养价值极高的滋补品[7-8]。乌鸡作为传统中药,具有补气血、益脾肾的作用,其治疗贫血的功能早已得到证实。为了更好地利用乌鸡的补血功能开发新的补血产品,本试验利用酶解法制备出乌鸡肽,并配以营养素(EDTAFeNa和维生素),探究乌鸡肽营养素配方对造血功能的恢复影响和造血作用机制,为开发贫血治疗产品提供重要的理论和实践依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试剂
乌鸡肽营养素配方样品(泰和乌鸡通过酶解工艺,生产为乌鸡肽,并调配以微量的EDTAFeNa和维生素得到),中国食品发酵工业研究院;CTX,上海华联制药有限公司; APH,北京索莱宝科技有限公司;复方阿胶浆,山东东阿阿胶股份有限公司;40 g/L多聚甲醛组织固定液,武汉塞维尔生物科技有限公司;小鼠EPO酶联免疫试剂盒、小鼠GM-CSF酶联免疫试剂盒,美国proteintech公司;小鼠IL-3酶联免疫试剂盒,南京森贝伽生物技术有限公司;ATP酶试剂盒、总胆红素试剂盒、直接胆红素试剂盒,南京建成生物工程研究所; STAT3、Bcl-2、Bcl-XL抗体,美国proteintech公司; p-JAK2、p-STAT3抗体,美国Cell signaling公司;JAK2抗体,上海Santa Cruz Biotechnology有限公司;蛋白分子质量标准,中国碧云天生物技术有限公司。
1.1.2 仪器与设备
TJ12-H绞肉机,广东恒联食品机械有限公司;RE5220旋转蒸发器,上海亚荣生化仪器厂;YC-L00U喷雾制粒包衣机,上海雅程仪器设备有限公司;R500小鼠麻醉机,深圳瑞沃德生命科技有限公司;Multiskan FC酶标仪,美国Thermo Scientific公司;恒温干燥箱,北京陆希科技有限公司;3K15离心机,德国sigma公司; BC-2800Vet自动血液分析仪,深圳迈瑞生物医疗电子股份有限公司; JXFSTPRP-YLS匀浆机,上海净信实业发展有限公司。
1.2 动物实验
选取6周龄SD雌性小鼠60只,体重约30 g,北京斯贝福生物技术有限公司[SCXK(京)2019-0010]。适应性喂养5 d,饲养条件:动物房温度(20±2) ℃,湿度(45±5)%,12 h日光灯明暗交替循环,自由进食和饮水。正式实验开始前将小鼠随机分配为5组,空白组、模型组、阳性对照组组(FEJ)、乌鸡肽配方低剂量组(L-WJ)和乌鸡肽配方高剂量组(H-WJ),每组12只。根据人体动物剂量换算公式换算[9],阳性对照组每天灌喂8 mL/kg的复方阿胶浆,低剂量实验组每天灌喂822 mg/kg乌鸡肽配方产品,高剂量实验组每天灌喂1 644 mg/kg乌鸡肽配方产品,空白组和模型组每天灌喂等量去离子水,持续灌喂21 d。实验分为干预期、造模期和恢复期,共计21 d。空白组小鼠腹腔注射0.1 mL的生理盐水,其余组小鼠于第8天、第11天腹腔注射20、40 mg/kg APH(配制于0.1 mL生理盐水中);从第11天到第14天,每日腹腔注射CTX 40 mg/kg(配制于0.1 mL生理盐水中),连续4 d。共造模7 d来制备小鼠贫血模型。实验第21天灌喂结束后将小鼠禁食过夜,在第22天称重,使用麻醉剂麻醉小鼠,眼球采血收集全血后处死,解剖收集脾脏置于液氮速冻,收集股骨置于40 g/L多聚甲醛组织固定液中。所有动物实验严格遵守实验伦理原则和要求。
1.2.1 体重及脏器指数测定
对小鼠体重进行记录,实验共称取4次体重,分别在第1天开始实验时,第7天干预试验结束后、第14天造模结束后和第21天实验结束后,记录体重的变化情况。
各组小鼠解剖后,立即取出脾脏和肾脏组织,用生理盐水冲去脏器表面残留的血液并修剪多余脂肪,滤纸吸干,称重并按公式(1)计算各脏器指数。
脏器指数=脏器质量(mg)/小鼠体重(g)
(1)
1.2.2 外周血象检测
小鼠取全血后放入肝素抗凝管中,立刻通过全自动血细胞分析仪对血液进行外周血分析,测定红细胞(red blood cell,RBC)、血红蛋白(hemoglobin,HGB)、红细胞比容(hematocrit value,HCT)、白细胞(white blood cell,WBC)和血小板(platelet,PLT)的含量。
1.2.3 骨髓病理学观察
用40 g/L多聚甲醛溶液将小鼠股骨固定,之后用甲酸-柠檬酸钠对股骨进行脱钙处理,脱钙完成后,包埋在石蜡中,切成切片,根据苏木精染色试剂盒说明染色,并使用倒置荧光显微镜进行显微镜检查。
1.2.4 ATP酶活力测定
各组小鼠取肝素抗凝全血,加4倍生理盐水,使用冷冻离心机1 500 r/min、4 ℃离心10 min,弃去上清液,在沉淀的红细胞中加入1.5 mL双蒸水,涡旋30 s,放置15 min,再涡旋30 s,再放置15 min,使其充分溶血直至溶质透亮。严格按ATP酶试剂盒(定磷法)操作说明测定红细胞膜Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性。
1.2.5 间接胆红素测定
将小鼠血样以3 000 r/min、4 ℃离心10 min获得血清。通过试剂盒测定血清中总胆红素和直接胆红素含量,根据公式(2)计算间接胆红素。
间接胆红素含量=总胆红素含量-直接胆红素含量
(2)
1.2.6 造血调控因子测定
将小鼠血样以3 000 r/min、4 ℃离心10 min获得血清。用酶联免疫测定试剂盒测定血清中造血功能因子红细胞生成素(erythropoietin,EPO)、重组巨噬细胞粒细胞集落刺激因子(human granulocyte-macrophage colony stimulating factor, GM-CSF)和白细胞介素-3(interleukin-3, IL-3)的含量。按照制造商的说明进行操作。
1.2.7 蛋白免疫印迹检测
通过蛋白免疫印迹方法测定脾脏中p-JAK、JAK2、STAT3、p-STAT3、Bcl-2、Bcl-XL蛋白含量。首先提取脾脏细胞蛋白质,通过BCA法检测蛋白质浓度,然后蛋白质上样、电泳和转膜。转膜完毕加入50 g/L脱脂牛奶封闭2 h,加入一抗,4 ℃摇床孵育过夜,用TBST溶液在室温下摇床洗膜3次,加入二抗,室温孵育2 h,TBST溶液清洗3次,避光加入ECL显影、定影试剂进行显影和定影。磷酸化蛋白与其非磷酸化通过灰度比值表示蛋白的相对表达量;其他目的蛋白与β-actin灰度比值表示蛋白的相对表达量。
1.3 数据处理
所有数据均以平均值±标准差表示。使用SPSS 25.0进行统计分析。*表示模型组与空白组相比存在差异(P<0.05);#表示治疗组与模型组相比存在差异(P<0.05)。Origin Lab Pro软件作图,Image J软件对蛋白条带定量分析。
2 结果与分析
2.1 体重变化及脏器指数
根据图1结果显示,模型组与治疗组体重在造模后的7~21 d体重急剧下降,由体重始末差值(表1)结果发现模型组体重减少的最多,H-WJ组体重减少最少。
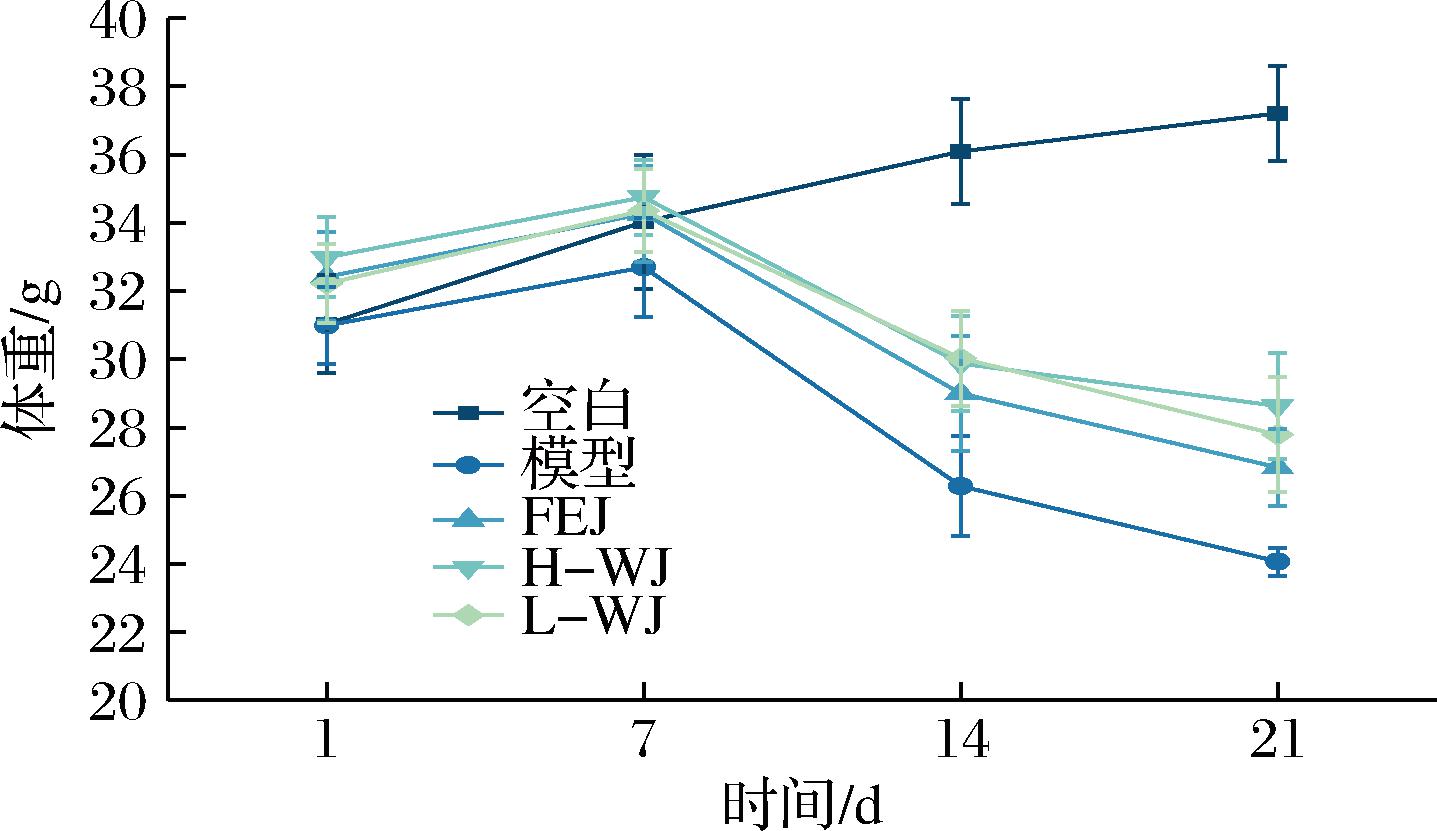
图1 小鼠体重变化
Fig.1 Body weight changes in mice
脏器指数结果见表1,与空白组相比,模型组的肾脏指数有显著性差异地增大(P<0.05),治疗组与模型组相比无显著性差异(P>0.05);模型组与治疗组脾脏指数差异显著(P<0.05),表明脾脏异常肿大,这是因为CTX和APH联合使用导致贫血而产生的原因。脾脏是贫血中最常见和最早期受影响的器官之一[10],造血功能缺乏和溶血破坏红细胞会导致红细胞在脾脏中的积聚[11-12],因此,红细胞的减少和贫血都可能与脾脏肿大相关。FEJ组和H-WJ组的脾脏指数显著低于模型组(P<0.05),说明乌鸡营养素配方通过剂量依赖的方式保护脾脏,减轻贫血损伤的副作用。
表1 脏器指数及体重始末差值
Table 1 Visceral index and weight start-end difference
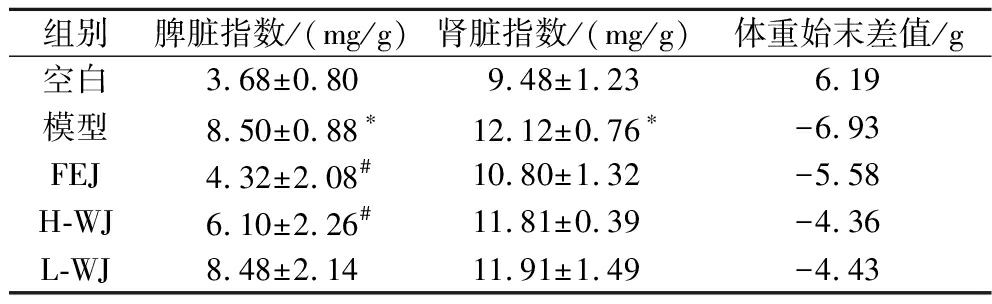
组别脾脏指数/(mg/g)肾脏指数/(mg/g)体重始末差值/g空白3.68±0.809.48±1.236.19模型8.50±0.88∗12.12±0.76∗-6.93FEJ4.32±2.08#10.80±1.32-5.58H-WJ6.10±2.26#11.81±0.39-4.36L-WJ8.48±2.1411.91±1.49-4.43
2.2 外周血象
测定小鼠外周血中RBC、HGB、HCT、PLT、WBC的量(表2)。与空白组相比,模型组RBC、HGB、HCT、PLT、WBC水平显著降低(P<0.05),说明贫血模型建立成功。与模型组比较显示,FEJ组和H-WJ配方组治疗小鼠的HGB、HCT、PLT和WBC水平显著升高(P<0.05)。同时,H-WJ和L-WJ均显著提高了RBC和WBC水平(P<0.05),但用L-WJ治疗小鼠的HGB和HCT水平没有显著增加。
表2 小鼠外周血象比较
Table 2 Comparison of peripheral blood picture in mice
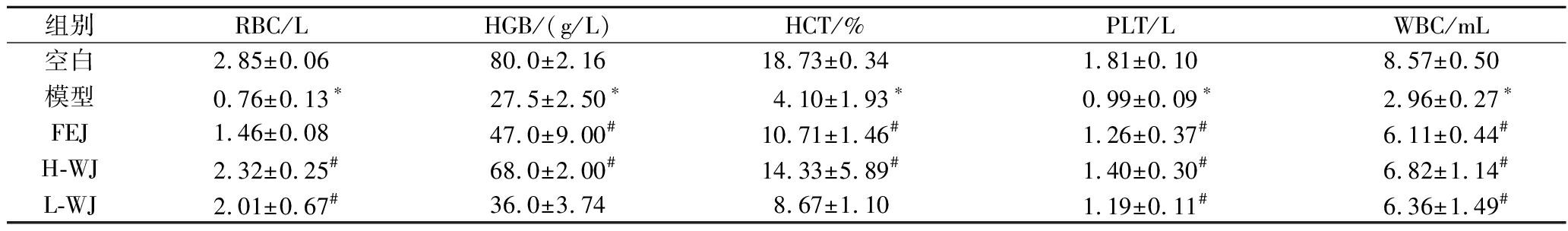
组别RBC/LHGB/(g/L)HCT/%PLT/LWBC/mL空白2.85±0.0680.0±2.1618.73±0.341.81±0.108.57±0.50模型0.76±0.13∗27.5±2.50∗4.10±1.93∗0.99±0.09∗2.96±0.27∗FEJ1.46±0.0847.0±9.00#10.71±1.46#1.26±0.37#6.11±0.44#H-WJ2.32±0.25#68.0±2.00#14.33±5.89#1.40±0.30#6.82±1.14#L-WJ2.01±0.67#36.0±3.748.67±1.101.19±0.11#6.36±1.49#
2.3 骨髓病理学观察
骨髓是最重要的造血器官,由不同时期的造血细胞组成,包括红细胞、白细胞和血小板。骨髓造血组织在细胞分裂中非常活跃,它对化学药剂非常敏感[13],很容易造成损伤,CTX就会引起骨髓抑制作用。由图2可知,空白组小鼠骨髓组织颜色均匀,骨髓细胞含量丰富,结构清晰;而与正常组相比,模型组骨髓出现退化,含有大量空泡,造血细胞数量减少。在FEJ组和WJ治疗组中发现,骨髓中的细胞密度增加,造血细胞丰富,而空泡明显减少。同时,在不同剂量的WJ治疗组中观察到,随着剂量的增加对骨髓恢复效果就越好。图中的结果显示乌鸡肽营养素配方对骨髓抑制有改善作用。
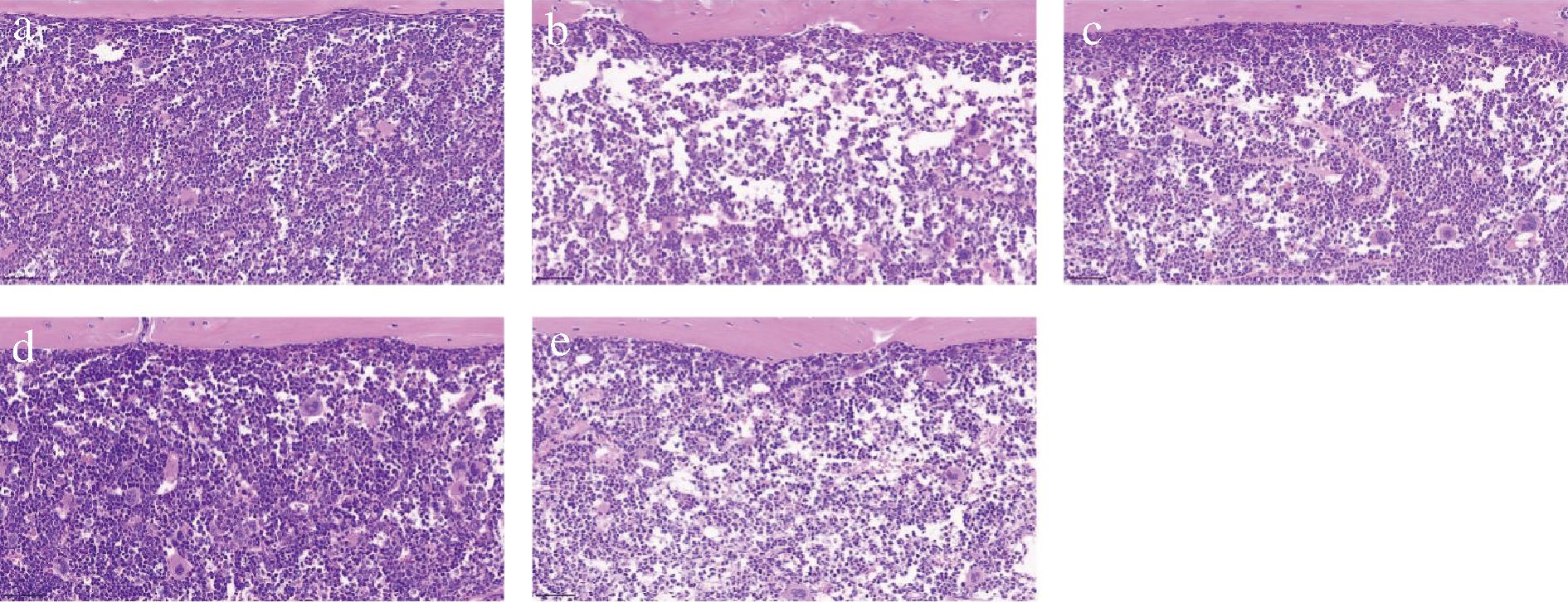
a-空白组;b-模型组;c-FEJ组;d-H-WJ组;e-L-WJ组
图2 骨髓病理学观察
Fig.2 Histopathology of the bone marrow
2.4 ATP酶活力水平
细胞膜上的Na+-K+-ATP保持膜内高钾和膜外高钠的平衡,可将ATP分解为ADP并产生能量,对维持红细胞的形态和功能具有重要作用,在贫血状态下其活力明显降低;Ca2+-Mg2+-ATP维持细胞外高钙和细胞内高镁的水平,亦可分解ADP以获得能量。ATP酶活力水平是红细胞能量代谢及功能有无受损的重要指标。
由图3可知,模型组的ATP酶活力显著低于空白组(P<0.05),说明能量代谢酶活力可以作为评价的有效指标。FEJ组和WJ组与模型组对比发现,贫血小鼠降低的红细胞膜Na+-K+-ATP酶和Ca2+-Mg2+ATP酶活力均有显著升高作用(P<0.05),说明WJ配方可能通过增加小鼠红细胞膜Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活力来发挥补血作用。其中H-WJ组对ATP的保护作用相比FEJ组和L-WJ组药效趋势更强。
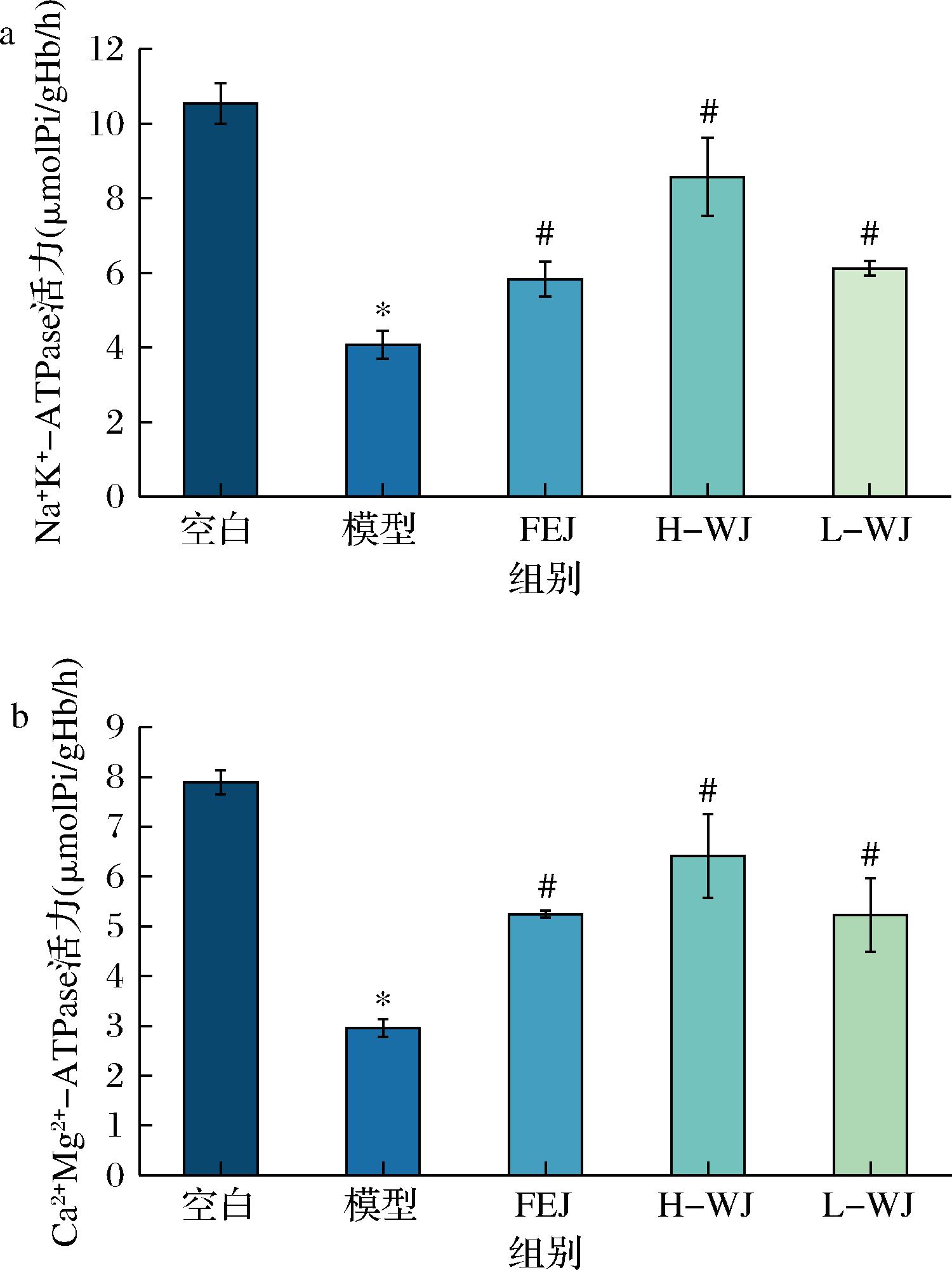
a-Na+-K+-ATP酶活力;b-Ca2+-Mg2+ATP酶活力
图3 小鼠红细胞ATP酶活力比较
Fig.3 ATPase activity in mouse erythrocytes
2.5 间接胆红素水平
间接胆红素和直接胆红素组成总胆红素。血清中间接胆红素升高主要与溶血情况有关。大量的红细胞破坏后,大量血红蛋白被转变成间接胆红素,超过了肝脏的处理能力,不能将其全部转变成直接胆红素,使血液中的间接胆红素升高。其浓度可反映红细胞被破坏产生溶血的情况。由图4可知,模型组的间接胆红素含量最高,说明模型组溶血效果最严重,与空白组有显著性差距(P<0.05)。FEJ组和H-WJ组与模型组相比间接胆红素含量显著下降(P<0.05),但L-WJ组与模型组相比无显著差异(P>0.05),这说明WJ配方会以剂量依赖的趋势保护红细胞不被破坏,减少间接胆红素的含量。
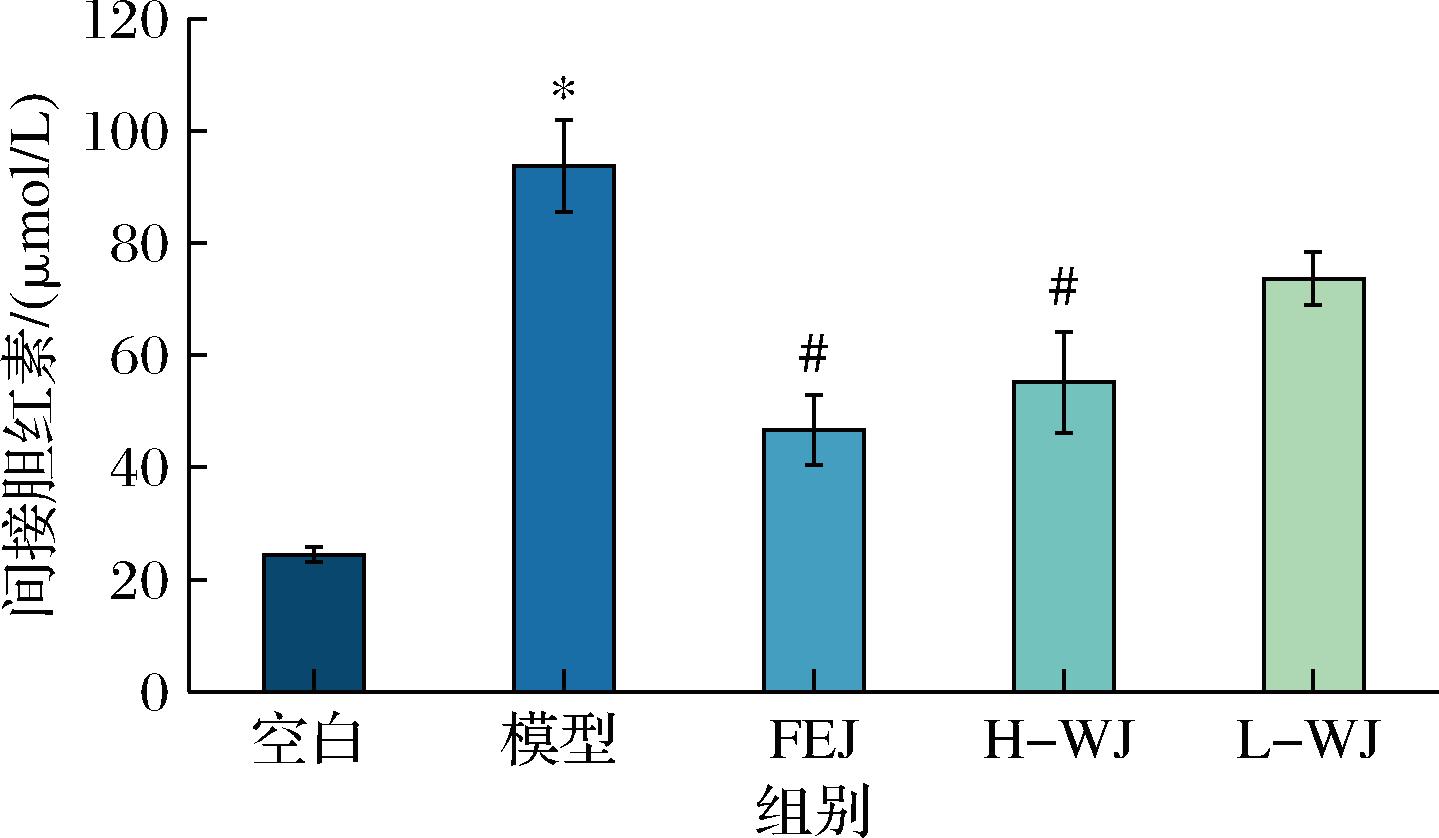
图4 小鼠血清中间接胆红素含量比较
Fig.4 Indirect bilirubin levels in mouse serum
2.6 造血因子水平
造血是血细胞形成的过程,造血干细胞受到造血微环境中的各种细胞因子(主要包括 EPO、GM-CSF、IL-6等细胞因子)的刺激,随后增殖和分化产生成熟的血细胞的过程[14]。EPO是一种糖蛋白激素,是产生 WBC 的主要激动剂[15],EPO的生长因子由肾脏释放并抑制祖细胞凋亡,还可以促进红细胞快速生成。另一个重要的造血因子是GM-CSF,主要作用于骨髓基质细胞或成纤维细胞,在调节造血和白细胞形成中起重要作用[16]。IL-3作为造血因子,可以在造血干细胞发育成血细胞时,促进造血干细胞增殖和分化。
由图5-a结果表明,模型组小鼠血清中的EPO含量远高于空白组(P<0.05),这符合贫血模型现象,环磷酰胺会抑制脾脏中红细胞前体的生成,从而导致EPO含量增加。FEJ组和H、L-WJ实验组与模型组相比都有显著性地(P<0.05)促进EPO的产生,从而提高造血能力。由图5-b和图5-c可知,FEJ组和H-WJ组与模型组相比会显著提高了GM-CSF含量;但对于IL-3的含量只有H-WJ配方与模型组相比存在显著性差异。同时,L-WJ与模型组在这2个造血因子上没有显著差异,以上结果可能说明WJ配方通过剂量依赖的方式增加GM-CSF和IL-3水平。
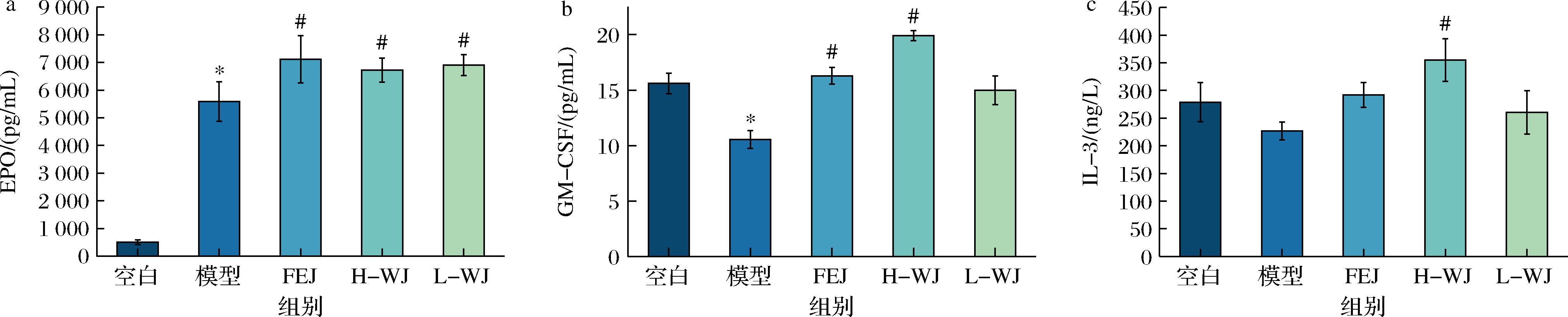
a-EPO;b-GM-CSF;c-IL-3
图5 小鼠血清中各造血因子水平比较
Fig.5 Comparison of serum levels of various haematopoietic factors in mice
2.7 信号通路
JAK2/STAT3信号通路被证明是参与造血、免疫调节和炎症的细胞因子信号转导的关键通路之一,表达并参与细胞增殖、分化和凋亡[17],并在其中起重要作用[18-20]。EPO与其受体EPOR的结合可迅速激活JAK-STAT信号通路,通过上调转录因子和凋亡蛋白促进造血干细胞的存活、增殖和分化,在该通路中,JAK2、STAT3是治疗贫血症状的主要靶点。细胞凋亡是 JAK2/STAT3 通路的下游生物学过程。Bcl-2和Bcl-XL为其下游的细胞因子,Bcl-2和Bcl-XL是一种抗凋亡调节蛋白。
如图6和表3所示,与空白组相比,模型组p-JAK2/JAK2水平有显著性降低(P<0.05),说明CTX和APH会降低信号通路中JAK2蛋白的磷酸化水平,从而影响JAK2/STAT3信号通路;与模型组相比,H-WJ和L-WJ组显著性提高了p-JAK2/JAK2 和p-STAT3/STAT3水平(P<0.05),并呈现剂量依赖的效果。
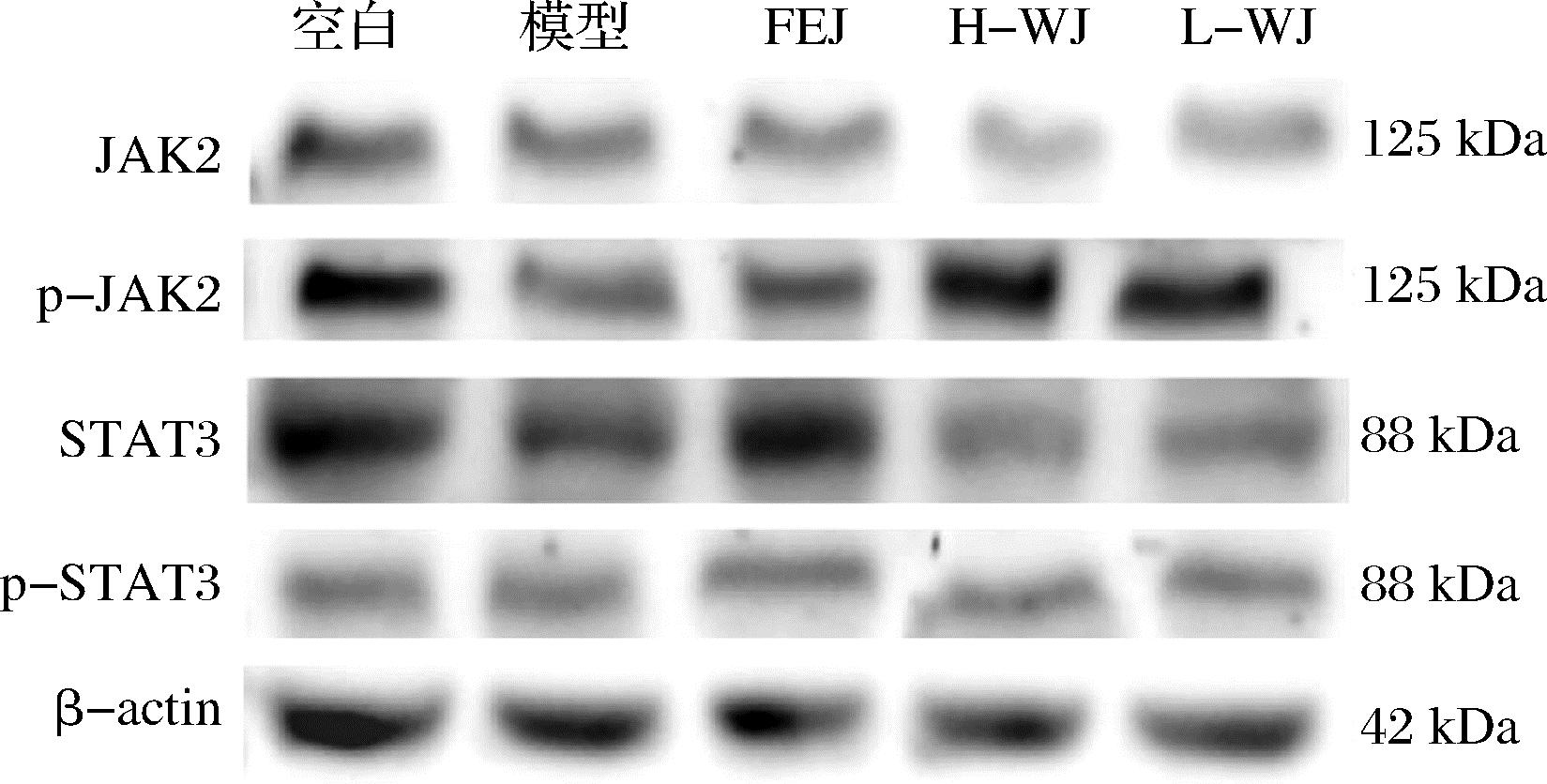
图6 小鼠脾细胞JAK2/STAT3信号通路蛋白表达
Fig.6 Expression of JAK2/STAT3 signaling pathway protein in mouse splenocytes
如图7和表3所示,与空白组相比,模型组 Bcl-2和Bcl-XL的水平显著降低(P<0.05),表明 CTX和APH 可以致使脾脏中的细胞凋亡。与模型组相比,FEJ组和H-WJ组Bcl-2水平显著升高(P<0.05),FEJ组、H-WJ和L-WJ组Bcl-XL水平显著升高(P<0.05),说明乌鸡肽营养素配方可以抑制脾脏细胞凋亡。上述研究结果表明,乌鸡肽营养素配方可以通过激活JAK2/STAT3通路的磷酸化水平及其下游的细胞凋亡蛋白来保护贫血小鼠的脾脏,促进造血细胞的增殖分化,从而恢复造血功能。
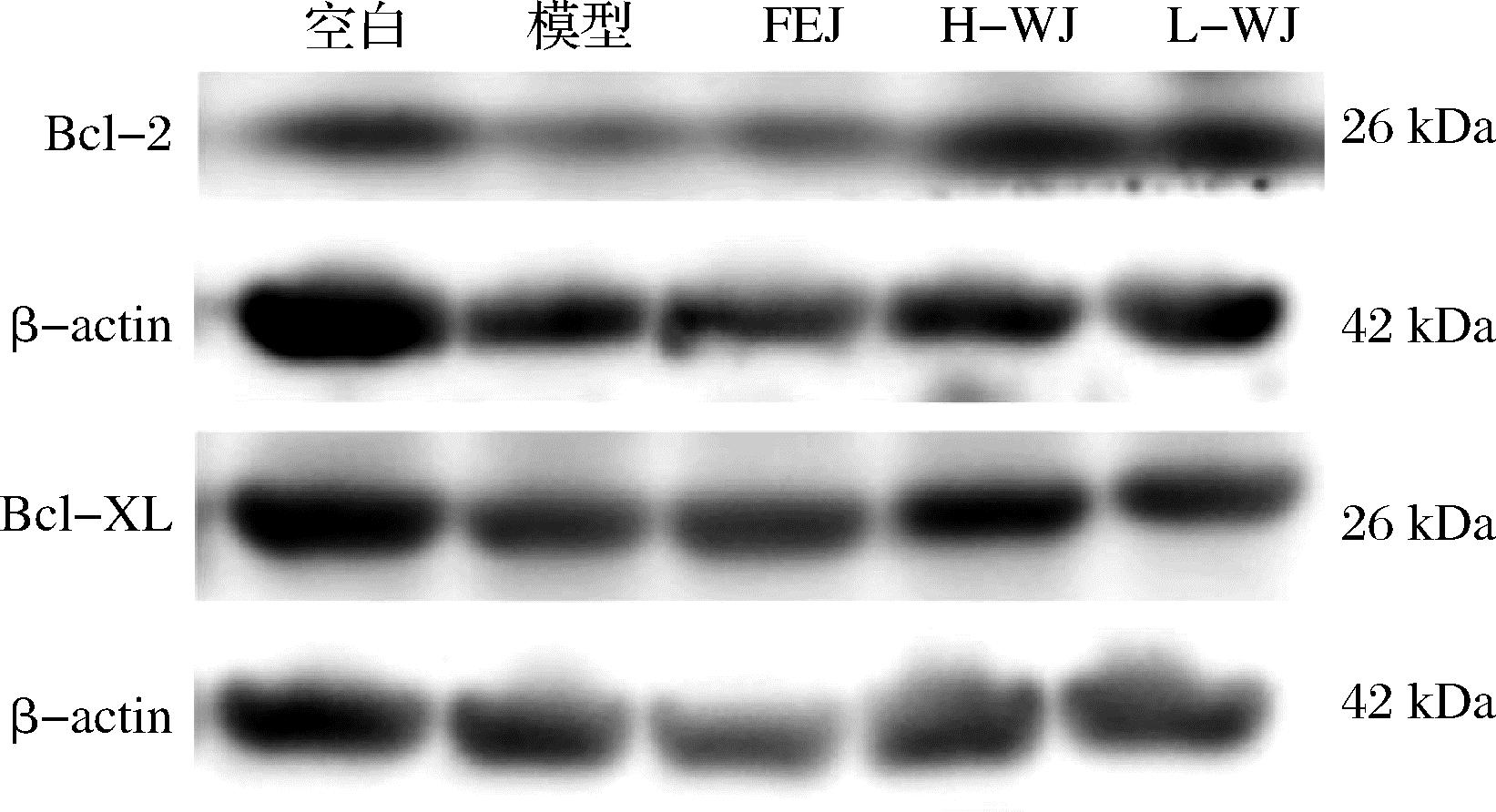
图7 小鼠脾细胞Bcl-2、Bcl-XL蛋白表达
Fig.7 Bcl-2 and Bcl-XL protein expression in mouse splenocytes
表3 通过蛋白质印迹预测的各蛋白灰度值比
Table 3 Gray value ratio of predicted target proteins by Western blot

组别p-JAK2/JAK2p-STAT3/STAT3Bcl-2Bcl-XL空白1.42±0.101.52±0.080.81±0.011.86±0.06模型0.98±0.01∗1.54±0.060.63±0.07∗1.05±0.09∗FEJ 1.13±0.151.40±0.150.91±0.06#1.58±0.19#H-WJ2.35±0.42#2.08±0.05#0.80±0.03#1.62±0.33#L-WJ1.95±0.14#2.05±0.14#0.69±0.021.34±0.39#
3 结论与讨论
本论文研究了乌鸡肽营养素配方在小鼠贫血模型中补血能力的恢复功效,在外周血象、骨髓病理学观察、ATP酶活力、间接胆红素含量和造血因子方面进行了探究,并深入探究了JAK2/STAT3信号通路在造血方面受到的影响。实验结果表明乌鸡肽逆转了外周血细胞的减少,对恢复造血能力和保护红细胞免受损害有显著功效。APH作为一种强氧化剂会使红细胞受到氧化性攻击而发生破裂,当红细胞被破坏过速、过多时会出现溶血现象,间接胆红素水平会增多,通过间接胆红素结果验证发现乌鸡肽减轻了红细胞的氧化损伤情况。贫血症小鼠的红细胞能量水平下降,红细胞膜蛋白的磷酸化受阻,细胞膜网架结构改变,会影响红细胞的形态和变形能力,乌鸡肽可以有效地提高红细胞膜上ATP酶活性,恢复红细胞的正常形态和功能。乌鸡肽通过促进造血因子EPO、GM-CSF和IL-3的产生,加快造血干细胞的分化和成熟,恢复骨髓中造血细胞的总量。乌鸡肽配方通过增强JAK2/STAT3信号通路中JAK2和STAT3磷酸化水平的表达来激活信号通路,并且提高下游细胞抗凋亡因子Bcl-2和Bcl-XL,从而影响造血细胞周期,使受损细胞在贫血环境中获得更好的生存条件。本研究的结果为乌鸡肽的开发和利用提供了指导。
[1] HOFFBRAND A V, MOSS P, PETTIT J E.Erythropoiesis and General Aspects of Anaemia[M].Essential Haematology.UK:Blackwell Publishing,2006.
[2] LOPEZ A, CACOUB P, MACDOUGALL I C, et al.Iron deficiency anaemia[J].The Lancet, 2016, 387(10021):907-916.
[3] MCLEAN E, COGSWELL M, EGLI I, et al.Worldwide prevalence of anaemia, WHO vitamin and mineral nutrition information system, 1993—2005[J].Public Health Nutrition, 2009, 12(4):444-454.
[4] ZHANG H, WANG H F, LIU Y, et al.The haematopoietic effect of Panax japonicus on blood deficiency model mice[J].Journal of Ethnopharmacology, 2014, 154(3):818-824.
[5] BERGER J.Phenylhydrazine haematotoxicity[J].Journal of Applied Biomedicine, 2007, 5(3):125-130.
[6] XU M, HE R R, ZHAI Y J, et al.Effects of carnosine on cyclophosphamide-induced hematopoietic suppression in mice[J].The American Journal of Chinese Medicine, 2014, 42(1):131-142.
[7] 孙龙生, 李慧芳, 陈国宏, 等.泰和乌骨鸡肌肉水分、蛋白质含量变化规律及相关性研究[J].江苏农业研究, 2000, 21(4):4-6;40. SUN L S, LI H F, CHEN G H, et al.Study on the change law and correlation of muscle moisture and protein content in Taihe silky fowl[J].Jiangsu Agricutural Research, 2000, 21(4):4-6;40.
[8] 陈晓东, 陈芳有.泰和乌骨鸡中微量元素分析[J].家禽科学, 2013(11):35-36. CHEN X D, CHEN F Y.Analysis of trace elements in Taihe silky chicken[J].Poultry Science, 2013(11):35-36.
[9] REAGAN-SHAW S, NIHAL M, AHMAD N.Dose translation from animal to human studies revisited[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2008, 22(3):659-661. [10] AL-SALEM A H.Splenic complications of sickle cell anemia and the role of splenectomy[J].ISRN Hematology, 2011, 2011:864257.
[11] QUEIROZ M L S, VALADARES M C, BINCOLETTO C, et al.Ehrlich ascites tumor as a tool in the development of compounds with immunomodulatory properties[J].Immunopharmacology and Immunotoxicology, 2004, 26(4):511-525.
[12] GASPAR B L, SHARMA P, DAS R.Anemia in malignancies:Pathogenetic and diagnostic considerations[J].Hematology, 2015, 20(1):18-25.
[13] LIU M X, TAN H N, ZHANG X K, et al.Hematopoietic effects and mechanisms of Fufang E’jiao Jiang on radiotherapy and chemotherapy-induced myelosuppressed mice[J].Journal of Ethnopharmacology, 2014, 152(3):575-584.
[14] GENOVA C, RIJAVEC E, GROSSI F.Hematopoietic growth factors in lung cancer[J].Current Opinion in Oncology, 2016, 28(2):135-144.
[15] FRANKE K, GASSMANN M, WIELOCKX B.Erythrocytosis:The HIF pathway in control[J].Blood, 2013, 122(7):1122-1128.
[16] WALLER E K.The role of sargramostim (rhGM-CSF) as immunotherapy[J].The Oncologist, 2007, 12(Suppl 2):22-26.
[17] XIN P, XU X Y, DENG C J, et al.The role of JAK/STAT signaling pathway and its inhibitors in diseases[J].International Immunopharmacology, 2020, 80:106210.
[18] KLAMPFER L.Signal transducers and activators of transcription (STATs):Novel targets of chemopreventive and chemotherapeutic drugs[J].Current Cancer Drug Targets, 2006, 6(2):107-121.
[19] XIONG H, ZHANG Z G, TIAN X Q, et al.Inhibition of JAK1, 2/STAT3 signaling induces apoptosis, cell cycle arrest, and reduces tumor cell invasion in colorectal cancer cells[J].Neoplasia, 2008, 10(3):287-297.
[20] SATRIOTOMO I, BOWEN K K, VEMUGANTI R.JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia[J].Journal of Neurochemistry, 2006, 98(5):1353-1368.