乳蛋白是牛乳中占比最高的营养组分,是国民健康饮食的重要组成。乳蛋白中丰富的酪蛋白、乳清蛋白等蛋白,是天然功能蛋白的优质来源。研究表明,乳蛋白在抗氧化、免疫调节、缓解疲劳、维持肠道健康[1-2]等方面均具有良好的生理作用。其中,抗氧化能力是各类生物活性的基础,长期的氧化应激会导致各种威胁生命的病理状况,例如衰老、心脏病、糖尿病、自身免疫性疾病、癌症、神经系统疾病等,因此其活性分析可为功能物质的挖掘与功能评价提供参考和遴选依据[3]。
采用生物加工的方法处理乳蛋白有利于功能蛋白/肽的挖掘。研究发现,将蛋白酶酶解乳清分离蛋白添加到酸奶后,可促进酸奶的发酵,提高酸奶的抗氧化活性[4]。除生物酶酶解方法外,采用乳酸菌发酵可促进更高活性的生物活性肽的产生。CHANU等[5]用乳酸菌发酵水牛乳制备得到对革兰氏阳性菌和阴性菌均有广谱抗菌活性的抗菌肽;PADGHAN等[6]用发酵剂结合Lactobacillus acidophilus NCDC-15发酵牛乳制备得到抗氧化性显著高于单独发酵剂组的抗氧化肽。乳酸菌发酵过程中分泌的多种蛋白酶可以弥补酶法水解中酶类单一的局限,但由于乳酸菌发酵产酸的特性,往往造成蛋白的聚集而影响蛋白酶活性的发挥,蛋白水解并不充分。因此,综合利用酶解与乳酸菌发酵联合的方法有利于充分发挥乳酸菌水解蛋白的能力,并促进功能物质的产生以及活性的提升[7]。
本文采用蛋白酶水解联合乳酸菌发酵的方法,依据体外抗氧化活性筛选可良好发酵乳蛋白水解物(milk protein hydrolysates,MPH)的乳酸菌,并在氧化损伤细胞模型上探讨发酵MPH对氧化损伤的保护作用。
1 材料与方法
1.1 材料与试剂
浓缩牛乳蛋白由宁夏塞尚乳业有限公司提供。实验所用菌株与RAW264.7巨噬细胞均保藏于本实验室。
碱性蛋白酶,诺维信(中国)生物技术有限公司;四甲基偶氮唑盐、H2O2、三氟乙酸、乙醇、水杨酸、葡萄糖、蛋白胨、酵母粉、牛肉膏、NaCl、MnSO4、MgSO4、吐温-80等,国药集团化学试剂有限公司;DPPH、ABTS,上海麦克林生化科技股份有限公司;胎牛血清、DMEM培养基,美国Gibco公司;One step qRT-PCR SYBR 试剂盒,诺唯赞生物科技有限公司。
1.2 实验仪器
酶标仪,美国Thermo公司;冷冻干燥机,美国LABCONCO公司;Synergy超纯水系统,美国Millipore公司;RCT型磁力加热搅拌器,德国IKA公司;YS100倒置显微镜,日本Nikon公司;CFX Connect实时荧光定量PCR仪,美国Bio-Rad公司;超滤浓缩仪,德国默克公司;超净工作台,苏州安泰空气技术有限公司;高压蒸汽灭菌锅,美国AUTOCLAVE Engineers公司。
1.3 实验方法
1.3.1 MPH的制备
配制40 g/L的牛乳蛋白水溶液,按3 000 U/g酶底比加入碱性蛋白酶,55 ℃水解3 h,过程中用1 mol/L NaOH水溶液调节pH值,使其维持在8.0。水解完毕后100 ℃加热10 min。采用分子质量3 000 Da的超滤膜在4 ℃ 下超滤,滤液冻干得到MPH备用。MPH中多肽含量采用双缩脲法进行测定,以水解后所得多肽质量与初始牛乳蛋白质量的比值计算MPH得率,为78.34%。
1.3.2 乳酸菌发酵MPH
将分离自泡菜的16株乳酸菌在MRS培养基中活化培养3代,每代活化12 h,以2%接种量接种至含MPH的发酵培养基,37 ℃ 发酵48 h。发酵液6 000 r/min 离心20 min,上清液冻干得到不同乳酸菌发酵MPH用于筛选评价。其中,以筛选所得的乳酸菌发酵MPH所得产物命名为FPS。
发酵培养基(g/L):MPH 25、柠檬酸氢二胺2、葡萄糖10、K2HPO4 2、乙酸钠3、MgSO4 0.58、MnSO4 0.25,100 ℃灭菌10 min。
1.3.3 MPH发酵前后抗氧化活性测定
将发酵前后的MPH样品分别配制成2、4、6、8、10 mg/mL 溶液。分别测量各样品对DPPH自由基、·OH、ABTS阳离子自由基的清除能力和铁离子还原力,采用模糊综合评价法评价抗氧化能力并依此筛选乳酸菌用于后续评价。以等量去离子水作为对照,每个测试样品设置3组平行。
1.3.3.1 DPPH自由基清除率的测定
参考KILIC等[8]的方法。配制0.08 mg/mL的DPPH溶液,将该溶液与样品溶液1∶1(体积比)涡旋混匀,避光孵育30 min后,在517 nm处测量吸光度。DPPH自由基清除率按照公式(1)计算:
式中:E,清除率;A0,对照组吸光值;Ai,待测样品吸光值。
1.3.3.2 ·OH清除率的测定
参考ZHOU等[9]的方法。将0.2 mL不同浓度的样品溶液依次与9 mmol/L FeSO4溶液、1 mL 8.8 mmol/L H2O2混合,室温反应10 min后加入1 mL 9 mmol/L水杨酸乙醇溶液,37 ℃水浴反应30 min后在510 nm处测定吸光值。参照公式(1)计算·OH清除率。
1.3.3.3 ABTS阳离子自由基清除率的测定
参考LI等[10]的方法。将7 mmol/L的ABTS溶液与2.45 mmol/L K2S2O8以1∶1体积比混合摇匀后室温避光静置12 h制得ABTS储备液;用10 mmol/L pH 7.4的PBS稀释ABTS储备液,使其在734 nm下吸光度为0.70±0.05时制得ABTS工作液。取20 μL不同浓度样品和200 μL ABTS工作液混合摇匀,室温避光静置10 min,于734 nm处测定吸光值。参照公式(1)计算ABTS阳离子自由基清除率。
1.3.3.4 铁离子还原力的测定
参考CHEN等[11]的方法。取 1 mL 不同浓度样品溶液与2 mL PBS(0.2 mol/L,pH 6.6)、2.5 mL 10 g/L铁氰化钾溶液混合,50 ℃反应20 min,冷却至室温后加入2.5 mL三氯乙酸溶液(10%,质量分数)混匀,3 000 r/min离心10 min后取2.5 mL上清液,加入2.5 mL去离子水和0.5 mL FeCl3溶液(0.1%,质量分数)于37 ℃水浴30 min,于700 nm处测定吸光值。
1.3.3.5 抗氧化活性的综合评价
采用模糊综合评价法[12]计算和评价样品抗氧化活性。根据极值标准化公式Zij=(Xij-Xij min)/(Xij max-Xij min),将各抗氧化指标值无量纲化置于闭区间[0,1]中。其中,Xij为第i个菌株发酵MPH的第j个抗氧化指标值,Xij max、Xij min分别为第i个菌株的第j个抗氧化指标的最大值和最小值。抗氧化综合评价值Zi按照公式(2)计算并作为乳酸菌筛选依据。
Zi=Σ(Zij)(i=1,2,…,16;j=1, 2, 3, 4)
(2)
1.3.4 分子质量分布的测定
采用凝胶渗透色谱(gel permeation chromatography,GPC)测定样品分子质量分布。配制溶液V(水)∶V(乙腈)∶V(三氟乙酸)=60∶40∶0.1,加入待测样本配制成20 mg/mL溶液,10 000 r/min离心10 min后过0.22 μm 滤膜用于测定。
色谱条件:色谱柱TSKgel G2000SWXL,柱温30 ℃,紫外检测波长220 nm,流动相为V(水)∶V(乙腈)∶V(三氟乙酸)=60∶40∶0.1,流速0.5 mL/min、进样量10 μL。
1.3.5 游离氨基酸的测定
取样品2.0 g,用50 g/L的三氯乙酸于50 mL容量瓶中定容,超声1 h后抽滤,滤液在10 000 r/min离心30 min,上清液用0.22 μm滤膜过滤,采用HPLC分析游离氨基酸含量。
色谱条件:色谱柱Agilent Hypersil ODS,柱温40 ℃,紫外检测波长338 nm,流动相为V(甲醇)∶V(乙腈)∶V(醋酸钠)=1∶2∶2,流速1.0 mL/min,进样量10 μL。
1.3.6 FPS对H2O2诱导RAW264.7巨噬细胞氧化损伤的保护作用评价
1.3.6.1 细胞存活率测定
RAW264.7细胞在含10%血清和1% 双抗的DMEM培养基中,于37 ℃、5% CO2的湿润环境培养。细胞(1×104个/孔)培养于96孔板中至完全贴壁后,添加不同浓度FPS的新鲜培养基继续孵育24 h。再次吸去培养基并用pH 7.5的PBS淋洗3遍后,加入含有10% CCK-8溶液的等体积无血清培养基,避光孵育2 h后于450 nm波长下测量吸光值。以不加FPS培养孔作为对照,以无细胞的培养孔为空白组。每组5个平行,根据公式(3)计算细胞存活率。
细胞存活率![]()
式中:A1,对照组吸光值;Ai,实验组吸光值;A0,空白组吸光值。
1.3.6.2 FPS对巨噬细胞RAW264.7氧化损伤的保护作用
取对数生长期的细胞(1×104个/孔)在96孔板中培养24 h后,添加含不同浓度FPS的新鲜培养基。孵育24 h后用PBS洗涤3次,更换含有400 μmol/L H2O2的无血清培养基培养12 h后,加入含有10% CCK-8溶液的等体积无血清培养基,避光孵育2 h后于450 nm测量吸光值。参照公式(3)计算细胞存活率。以不加FPS的培养孔为对照组,无细胞的培养孔为空白组,每组5个平行。
1.3.6.3 FPS对巨噬细胞RAW264.7抗氧化酶基因mRNA水平的影响
将对数生长期的细胞按5×104个/孔接种于6孔板中至完全贴壁,加入不同浓度的FPS培养24 h,PBS洗涤3次。之后除空白组以外,更换为含有400 μmol/L H2O2的无血清培养基培养,培养12 h后用PBS洗涤3次,弃去PBS后转移至无RNA酶的离心管中,裂解细胞,提取RNA进行PCR反转录,所用引物如表1所示。反应体系:200 ng RNA,5 nmol/L上下游引物,1 μL One Step SYBR Green Enzyme Mix,10 μL 2× One Step SYBR Green Mix,并在95 ℃,10 s;60 ℃,30 s条件下运行40个循环。通过RT-PCR系统测定靶基因上调核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)、超氧化物歧化酶1(superoxide dismutase 1,SOD1)、血红素加氧酶-1(heme oxygenase-1,HO-1)和谷胱甘肽过氧化酶1(glutathione peroxidase 1,GPX1)基因的相对转录水平,并用2-(△△CT)方法进行分析。测定的目标基因为每组平行3个复孔,实验重复3次。
表1 引物序列
Table 1 Primer sequence
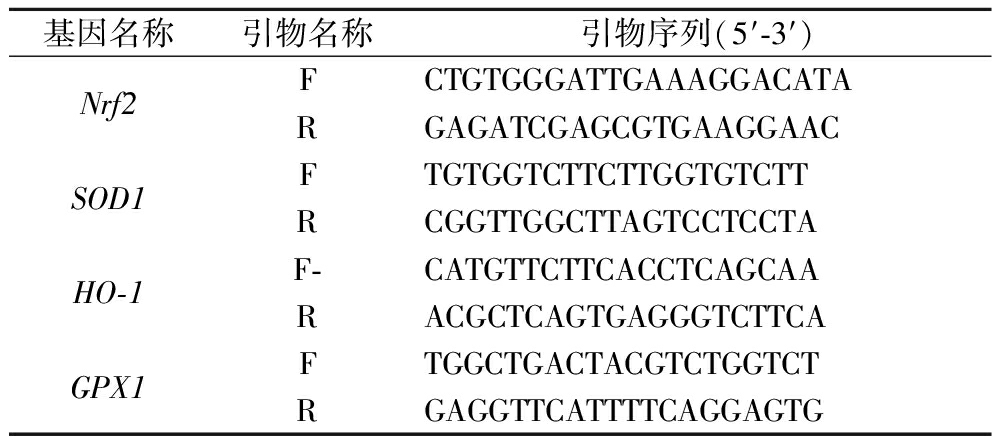
基因名称引物名称引物序列(5′-3′)Nrf2FCTGTGGGATTGAAAGGACATARGAGATCGAGCGTGAAGGAACSOD1FTGTGGTCTTCTTGGTGTCTTRCGGTTGGCTTAGTCCTCCTAHO-1F-CATGTTCTTCACCTCAGCAARACGCTCAGTGAGGGTCTTCAGPX1FTGGCTGACTACGTCTGGTCTRGAGGTTCATTTTCAGGAGTG
1.4 数据统计及分析
数据用平均值±标准差表示和单向方差分析法分析,采用Graphpad Prism 9作图。与对照组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
2 结果与分析
2.1 乳酸菌菌种的筛选
从泡菜样本中分离筛选获得16株乳酸菌,包括5株副干酪乳酪杆菌(Lacticaseibacillus paracasei)、3株植物乳植杆菌(Lactiplantibacillus plantarum)、2株发酵黏液乳杆菌(Limosilactobacillus fermentum)、2株鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosous)、2株谷糠乳杆菌(Lactobacillus farraginis)、1株瑞士乳杆菌(Lactobacillus helveticus)和1株嗜热链球菌(Streptococcus thermophilus)。进而对这些菌株发酵MPH的抗氧化能力进行评价。通过测定发酵前后不同样本对DPPH自由基、·OH、ABTS阳离子自由基清除率及铁离子还原力,并依据模糊综合评价法分析计算,结果如表2所示。综合来看,16株乳酸菌发酵产物对不同自由基清除能力和抗氧化能力有明显差异,其中,鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosous)ST(LST)发酵产物的抗氧化活性最强,综合评价值达到3.12,显著高于其他菌株。因此选定菌株LST发酵产物FPS作为后续评价对象。
表2 乳酸菌发酵MPH的抗氧化能力
Table 2 Antioxidant activities of MPH fermented with lactic acid bacteria

乳酸菌名称·OH清除率/%ABTS阳离子自由基清除率/%DPPH自由基清除率/%铁离子还原力(A700)抗氧化综合评价值Lacticaseibacillus rhamnosous ST38.73±1.6265.69±3.0029.20±3.080.37±0.013.12Lacticaseibacillus paracasei E1031.92±3.7158.55±2.7725.42±3.890.35±0.022.65Streptococcus thermophilus AR237.86±1.2654.14±1.7626.40±3.240.47±0.012.64Lactobacillus helveticus HE37.69±1.7850.28±2.1524.09±1.630.42±0.022.18Limosilactobacillus fermentum JN9 45.49±3.0460.54±3.5112.80±1.620.46±0.042.13Lacticaseibacillus rhamnosus JN438.07±1.9859.09±3.0412.00±2.180.36±0.011.66Lactobacillus farraginis JN527.94±3.9662.09±2.4712.53±1.290.39±0.041.63Lactiplantibacillus plantarum JN737.22±2.1751.53±2.8312.53±1.310.39±0.011.59Limosilactobacillus fermentum JN338.87±2.0745.60±1.5013.91±0.760.39±0.011.54Lacticaseibacillus paracasei JN832.38±1.3355.62±2.7212.49±1.910.35±0.041.53Lactiplantibacillus plantarum F29.16±3.7340.04±3.0714.04±2.740.37±0.031.39Lacticaseibacillus paracasei JN131.69±2.5934.76±2.0214.04±1.580.36±0.021.35Lacticaseibacillus paracasei JN228.20±1.2233.29±3.1114.40±2.540.41±0.011.35Lacticaseibacillus paracasei D 35.50±2.7628.64±2.0612.36±1.400.29±0.011.20Lactobacillus farraginis JN616.05±2.1924.37±1.8613.02±1.470.37±0.030.89Lactiplantibacillus plantarun AR1 25.89±3.8720.49±2.3913.38±0.730.35±0.020.78
2.2 LST发酵产物FPS的抗氧化活性
进一步评估FPS的体外抗氧化能力。如图1所示,随着浓度增加,FPS对3种自由基清除率和铁离子还原力逐渐增加,有良好的剂量依赖关系。与发酵前相比,当FPS质量浓度为10 mg/mL时,DPPH自由基、·OH和ABTS阳离子自由基的清除率分别提高了19.28%、19.21%、20.87%,铁离子还原力提高了34.38%,均有显著差异,说明MPH经LST发酵后显著提高了抗氧化活性。

a-DPPH自由基清除率;b-·OH清除率;c-ABTS阳离子自由基清除率;d-铁离子还原能力
图1 不同浓度MPH与FPS抗氧化能力的比较
Fig.1 Comparison of antioxidant activities of MPH and FPS at different concentrations 注:不同小写字母表示同一浓度下,MPH与FPS的差异达到显著水平(P<0.05)。
2.3 MPH与FPS游离氨基酸含量分析
比较MPH与FPS游离氨基酸含量,结果如表3所示。发酵后,游离氨基酸总量由32.6 mg/g 上升至52.7 mg/g;含量最高的Leu由11.1 mg/g增加到16.3 mg/g;Met、Asp和Ala浓度显著升高,约是发酵前的4~6倍。Trp、Tyr、Met、Asp等是具有较强抗氧化活性的氨基酸种类[13],且大多数抗氧化肽的末端或两端均含有疏水氨基酸,其含量的增加有利于抗氧化活性的提高[14]。研究发现,给高脂大鼠饲喂Leu可显著提高大鼠抗氧化能力[15],在酶解南瓜子中发现Trp增加并提高了水解物的抗氧化活性[16];Met对活性氧敏感,通过与活性氧结合使其失活并促进谷胱甘肽的合成发挥抗氧化作用[17]。由此推测,FPS抗氧化性的增加与LST水解乳蛋白释放游离氨基酸的组成、疏水性以及位置有关,有待进一步分析。
表3 MPH与FPS的游离氨基酸含量 单位:mg/g
Table 3 Content of free amino acids in MPH and FPS
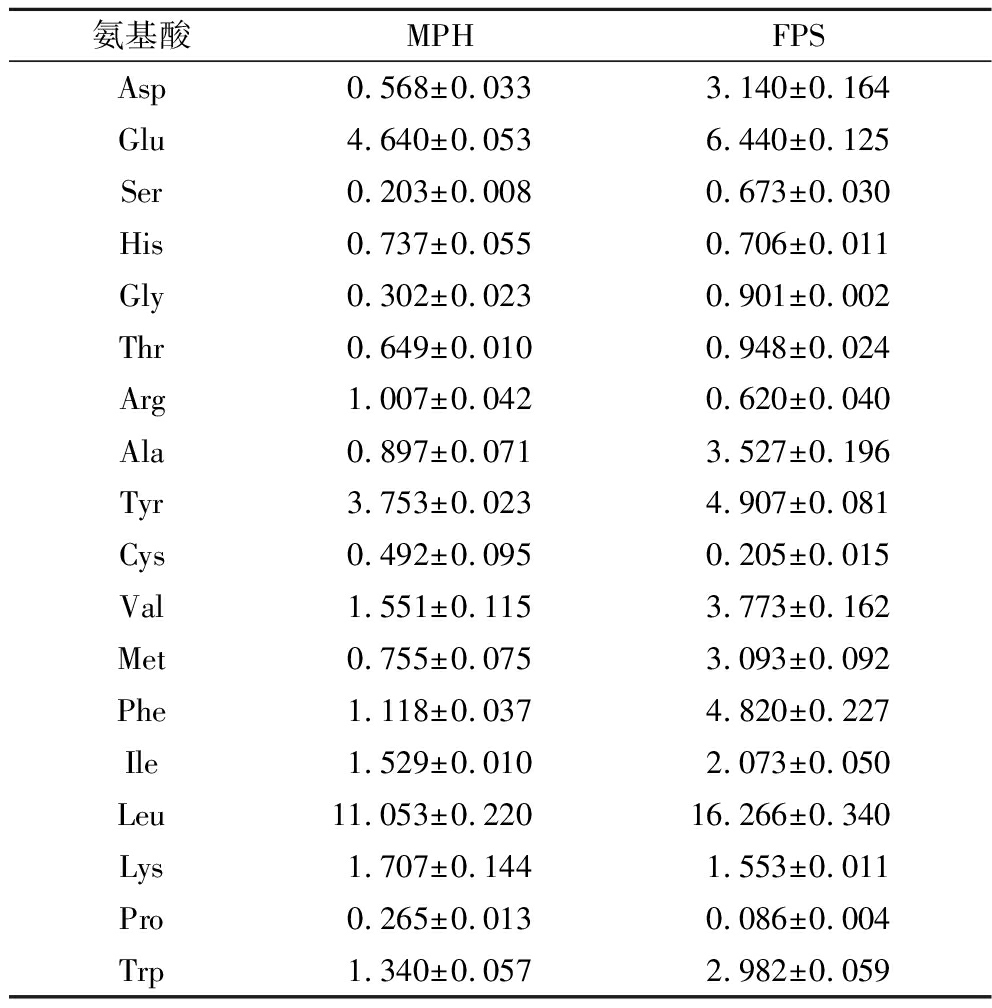
氨基酸MPHFPSAsp0.568±0.0333.140±0.164Glu4.640±0.0536.440±0.125Ser0.203±0.0080.673±0.030His0.737±0.0550.706±0.011Gly0.302±0.0230.901±0.002Thr0.649±0.0100.948±0.024Arg1.007±0.0420.620±0.040Ala0.897±0.0713.527±0.196Tyr3.753±0.0234.907±0.081Cys0.492±0.0950.205±0.015Val1.551±0.1153.773±0.162Met0.755±0.0753.093±0.092Phe1.118±0.0374.820±0.227Ile1.529±0.0102.073±0.050Leu11.053±0.22016.266±0.340Lys1.707±0.1441.553±0.011Pro0.265±0.0130.086±0.004Trp1.340±0.0572.982±0.059
2.4 MPH与FPS分子质量变化
如图2所示,MPH经发酵后,FSP重均分子质量由发酵前425 Da下降至396 Da。具体分析不同分子质量大小的组分分布发现(表4),1 000~180 Da组分比例显著下降,其中,分子质量500~180 Da的组分减少最为显著,为7.43%,分子质量<180 Da的组分增加了8.66%。说明LST发酵过程中可将分子质量较小的多肽进一步水解,这也与游离氨基酸含量的增加相吻合。
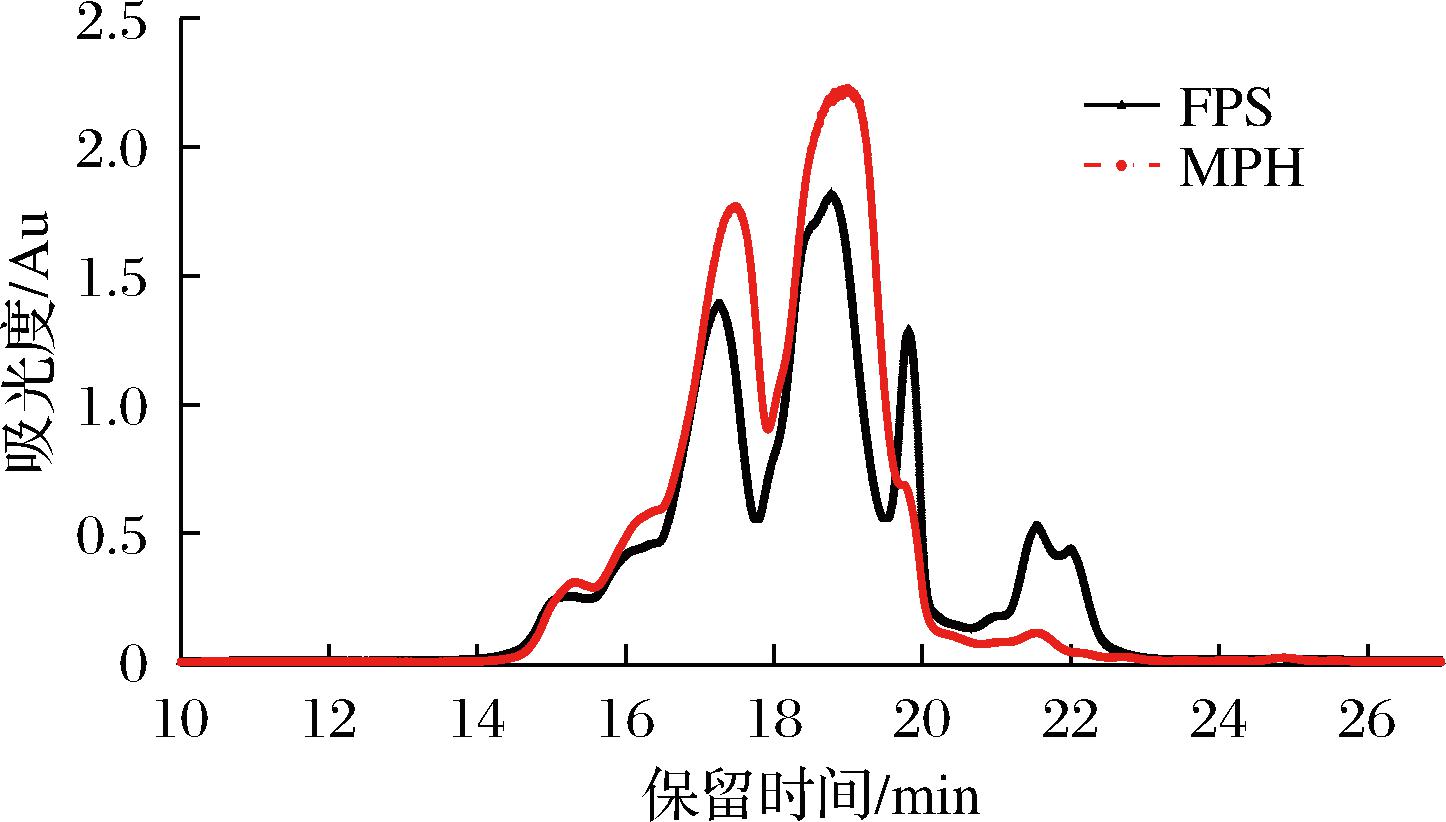
图2 MPH与FPS的GPC图谱
Fig.2 GPC profiles of MPH and FPS
表4 MPH与FPS的分子质量分布情况
Table 4 Molecular weight distribution of MPH and FPS
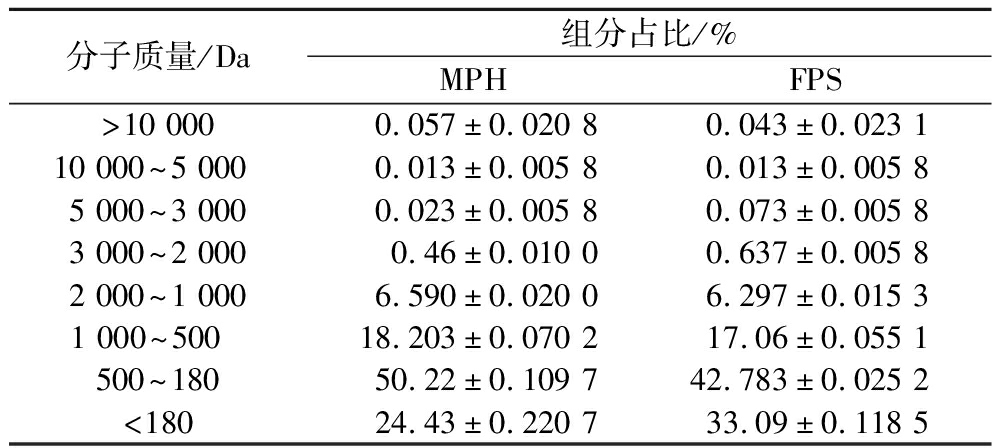
分子质量/Da组分占比/%MPHFPS>10 0000.057±0.020 80.043±0.023 110 000~5 000 0.013±0.005 80.013±0.005 85 000~3 0000.023±0.005 80.073±0.005 83 000~2 0000.46±0.010 00.637±0.005 82 000~1 0006.590±0.020 06.297±0.015 31 000~500 18.203±0.070 217.06±0.055 1500~18050.22±0.109 742.783±0.025 2<18024.43±0.220 733.09±0.118 5
2.5 FPS对H2O2诱导RAW 264.7 巨噬细胞氧化损伤的保护作用
2.5.1 FPS对RAW264.7细胞活力的影响
巨噬细胞在宿主免疫过程中发挥重要作用,是多种氧化剂和亲电试剂的靶细胞[18],并对活性氧反应敏感[19]。研究采用巨噬细胞RAW264.7建立氧化损伤模型,首先考查FPS对RAW264.7细胞活力的影响。如图3所示,在质量浓度为50~400 μg/mL时,FPS对细胞活力无显著影响。因此,后续实验即在此浓度范围内考查FPS对细胞氧化应激状态的影响。
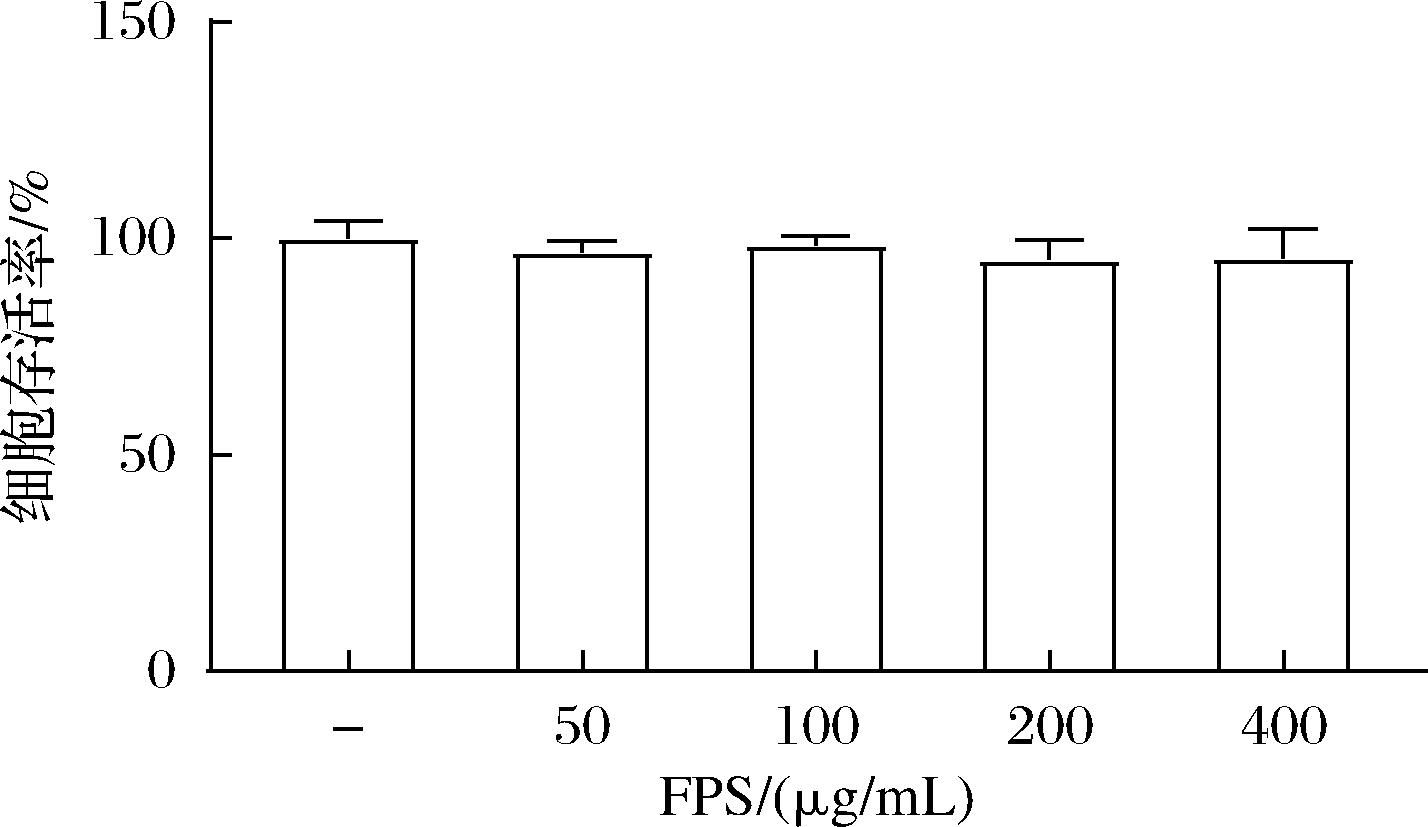
图3 不同浓度FPS对RAW 264.7细胞活力的影响
Fig.3 Effect of FPS concentration on the viability of RAW264.7 cell
2.5.2 FPS对氧化损伤RAW 264.7细胞存活率的影响
进一步在氧化损伤模型中考查FPS对细胞存活率的影响。采用H2O2诱导巨噬细胞RAW264.7建立氧化损伤模型。如图4所示,经H2O2 处理后,模型组细胞存活率为65.79%;给药FPS后,与模型组相比,细胞存活率随FPS浓度的增加而增加,并具有良好的剂量依赖性;当FPS质量浓度为400 μg/mL时,细胞存活率上升了31.48%,且与对照组无显著差异。由此说明,FPS对H2O2 诱导的细胞损伤具有良好的保护作用。
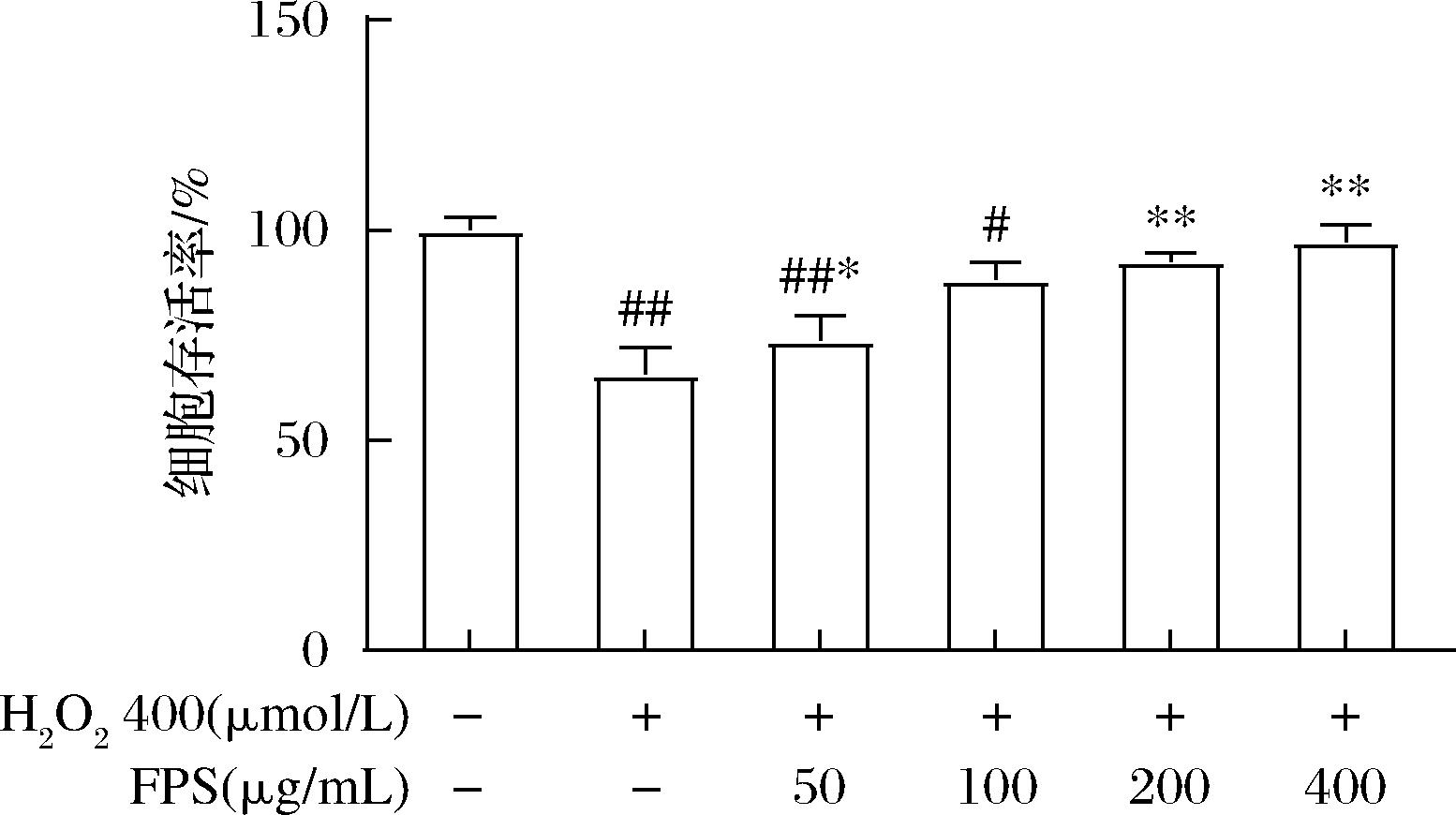
图4 不同浓度 FPS 对氧化损伤RAW 264.7 细胞活力的影响
Fig.4 Effect of the concentration of FPS solution on the viability of oxidative-damaged RAW 264.7 cells 注:与对照组相比,#P<0.05,##P<0.01; 与模型组相比,*P<0.05,**P<0.01(下同)。
2.5.3 FPS对Nrf2、SOD1、HO-1、GPX1基因转录水平的影响
在氧化应激下,抗氧化防御系统被激活以清除活性氧。Nrf2是抗氧化防御的重要内源性调节因子,当Nrf2转位到细胞核中,它会结合到抗氧化反应元件并上调一系列抗氧化酶的表达,包括SOD1、HO-1、GPX1等[20-21]。如图5所示,在H2O2诱导的RAW264.7 巨噬细胞氧化损伤模型中,Nrf2、SOD1、HO-1、GPX1基因转录水平均显著下降;给药FPS后,随剂量的增加,FPS均明显提高如上抗氧化基因的转录水平,当质量浓度为100~400 μg/mL时有显著差异,且呈剂量依赖关系。结果说明,FPS可显著促进氧化损伤细胞中抗氧化基因的转录,改善氧化应激并发挥保护作用。
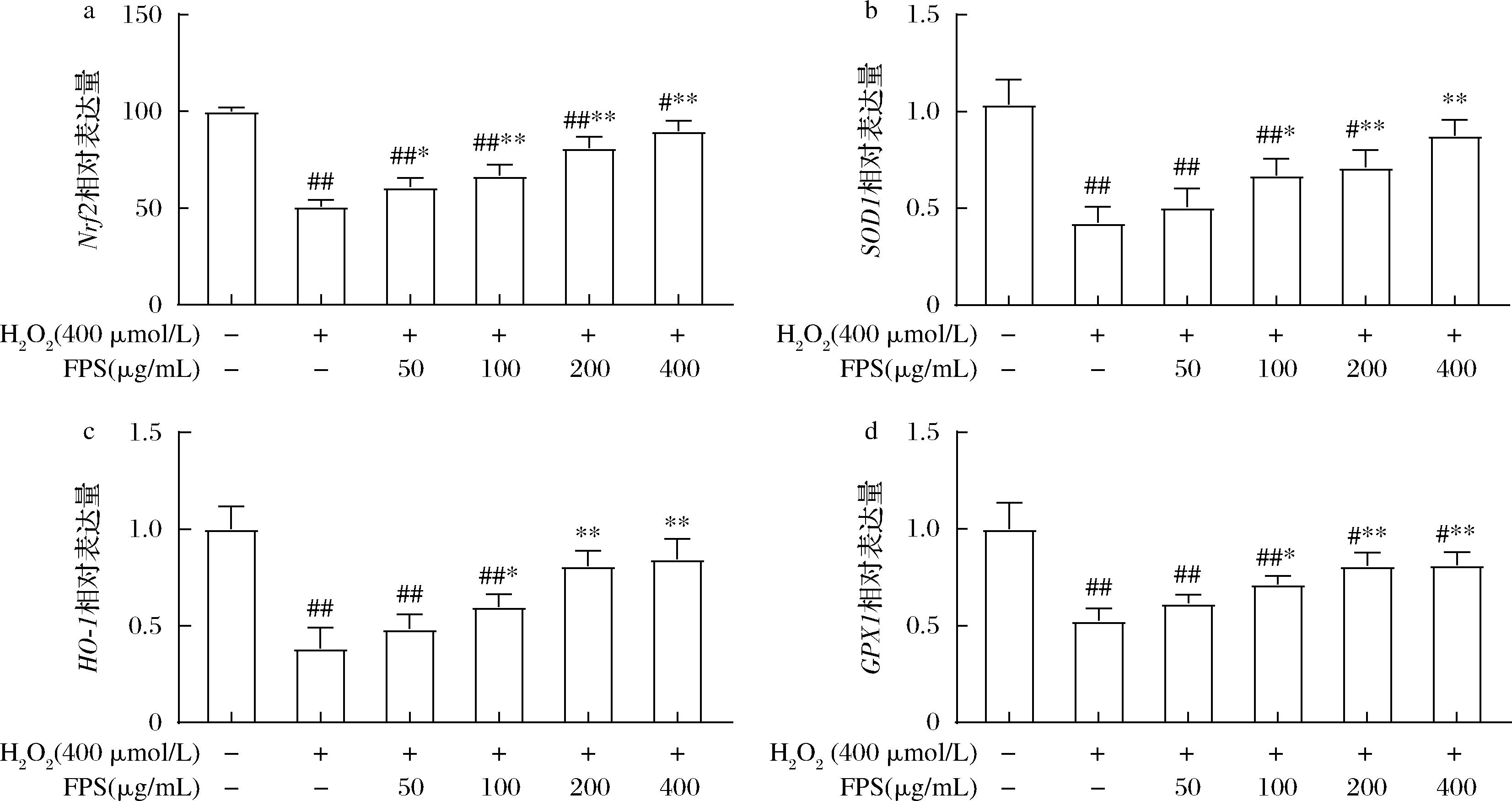
a-Nrf2;b-SOD1;c-HO-1;d-GPX1
图5 FPS对氧化损伤RAW 264.7细胞中氧化应激相关基因转录水平的影响
Fig.5 Effects of FPS on the transcriptional level of the genes for oxidative stress in oxidative-damaged RAW 264.7 cells
3 结论
采用生物酶水解联合乳酸菌发酵的生物加工方法有助于乳蛋白的进一步水解,促进抗氧化等活性的提升。本研究在利用蛋白酶水解获得MPH的基础上,从发酵食品中分离筛选获得16株乳酸菌,通过综合评价分析不同乳酸菌发酵MPH产物的体外多种自由基清除能力及铁离子还原能力,从中筛选获得一株抗氧化活性较强的鼠李糖乳酪杆菌LST。与发酵前相比,LST发酵MPH所得产物上清液FPS在质量浓度为10 mg/mL时,对DPPH自由基、·OH和ABTS阳离子自由基的清除率分别提高了19.28%、19.21%、20.87%,铁离子还原力提高了34.38%,具有良好的抗氧化活性。进一步分析FPS的游离氨基酸含量与分子质量分布,发酵后分子质量进一步下降,500~180 Da组分减少7.43%,分子质量<180 Da的组分增加了8.66%,说明LST具有良好的发酵MPH能力,产生的游离氨基酸中,Leu、Met、Asp、Ala、Trp、Tyr等抗氧化与疏水性氨基酸的量显著增加。FSP不影响RAW264.7细胞增殖,在H2O2诱导的RAW264.7细胞氧化损伤模型中,同时促进Nrf2、SOD1、GPX1、HO-1等抗氧化基因的转录,剂量依赖关系良好,从而对细胞氧化损伤进行保护。综上所述, LST具有良好发酵MPH的能力,且可产生更高的抗氧化活性。后续研究将进一步探讨发酵产生的抗氧化乳肽等功能物质,分析其缓解氧化损伤的机理。
[1] ZANUTTO-ELGUI M R, VIEIRA J C S, DO PRADO D Z, et al.Production of milk peptides with antimicrobial and antioxidant properties through fungal proteases[J].Food Chemistry, 2019, 278:823-831.
[2] PRAKASH P K, ELIGAR S M, PRAKRUTHI M, et al.Comparative assessment of antioxidant and immunomodulatory properties of skimmed milk protein hydrolysates and their incorporation in beverage mix[J].Journal of Agriculture and Food Sciences, 2022, 102(14):6414-6422.
[3] AHMAD HAJAM Y, RANI R, GANIE S Y, et al.Oxidative stress in human pathology and aging:Molecular mechanisms and perspectives[J].Cells, 2022, 11(3):552.
[4] 张国柱, 闫碧轩, 贾亚婷, 等.乳清分离蛋白酶解物对酸奶品质与抗氧化能力的影响[J].食品工业, 2019, 40(3):35-38. ZHANG G Z, YAN B X, JIA Y T, et al.Effect of whey protein hydrolysate on the quality and antioxidant ability of yogurt[J].The Food Industry, 2019, 40(3):35-38.
[5] CHANU K V, THAKURIA D, KUMAR S.Antimicrobial peptides of buffalo and their role in host defenses[J].Veterinary World, 2018, 11(2):192-200.
[6] PADGHAN P V, MANN B, HATI S.Purification and characterization of antioxidative peptides derived from fermented milk (Lassi) by lactic cultures[J].International Journal of Peptide Research and Therapeutics, 2018, 24(2):235-249.
[7] 刘一璇, 鲁丁强, 刘丹阳, 等.牛乳蛋白生物脱敏技术研究进展[J].中国乳品工业, 2023, 51(2):40-48. LIU Y X, LU D Q, LIU D Y, et al.Research progress of desensitization technology and detection methods of milk protein based on biological method[J].China Dairy Industry, 2023, 51(2):40-48.
[8] KILIC I, YE ILO
ILO LU Y, BAYRAK Y.Spectroscopic studies on the antioxidant activity of ellagic acid[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2014, 130:447-452.
LU Y, BAYRAK Y.Spectroscopic studies on the antioxidant activity of ellagic acid[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2014, 130:447-452.
[9] ZHOU S Y, HUANG G L.Extraction, derivatization, and antioxidant activity of Morinda citrifolia polysaccharide[J].Chemical Biology &Drug Design, 2022, 99(4):603-608. [10] LI H A, ZHANG C Y, DENG Z Y, et al.Antioxidant activity of delphinidin and pelargonidin:Theory and practice[J].Journal of Food Biochemistry, 2022, 46(8):e14192.
[11] CHEN F, HUANG G L, YANG Z Y, et al.Antioxidant activity of Momordica charantia polysaccharide and its derivatives[J].International Journal of Biological Macromolecules, 2019, 138:673-680.
[12] 何秋彤, 余以刚, 李聪聪, 等.20种市售凉茶类植物饮料抗氧化性的比较研究[J].食品科学, 2011, 32(7):47-51. HE Q T, YU Y G, LI C C, et al.Comparison of antioxidant activities of twenty kinds of commercial herbal tea[J].Food Science, 2011, 32(7):47-51.
[13] GARRETT A R, WEAGEL E G, MARTINEZ A D, et al.A novel method for predicting antioxidant activity based on amino acid structure[J].Food Chemistry, 2014, 158:490-496.
[14] SAMARANAYAKA A G P, LI-CHAN E C Y.Food-derived peptidic antioxidants:A review of their production, assessment, and potential applications[J].Journal of Functional Foods, 2011, 3(4):229-254.
[15] 袁雪薇. 亮氨酸改善非酒精性脂肪性肝病的机制研究[D].苏州:苏州大学, 2015. YUAN X W.Effect of leucine on improving nonalcoholic fatty liver disease and the underlying mechanisms[D].Suzhou:Soochow University, 2015.
[16] VARGAS M A, BERNAL C, MART NEZ R.Protease-assisted process for tryptophan release from pumpkin (Cucurbita maxima) seed protein extracts[J].Journal of Food Processing and Preservation, 2022, 46(2):e16290.
NEZ R.Protease-assisted process for tryptophan release from pumpkin (Cucurbita maxima) seed protein extracts[J].Journal of Food Processing and Preservation, 2022, 46(2):e16290.
[17] BIN P, HUANG R L, ZHOU X H.Oxidation resistance of the sulfur amino acids:Methionine and cysteine[J].BioMed Research International, 2017, 2017:9584932.
[18] ZHU H, JIA Z Q, ZHANG L, et al.Antioxidants and phase 2 enzymes in macrophages:Regulation by Nrf2 signaling and protection against oxidative and electrophilic stress[J].Experimental Biology and Medicine, 2008, 233(4):463-474.
[19] BHASKARAN N, SHUKLA S, KANWAL R, et al.Induction of heme oxygenase-1 by chamomile protects murine macrophages against oxidative stress[J].Life Sciences, 2012, 90(25-26):1027-1033.
[20] MOEZZI D, DONG Y F, JAIN R W, et al.Expression of antioxidant enzymes in lesions of multiple sclerosis and its models[J].Scientific Reports, 2022, 12(1):12761.
[21] ZUO C C, CAO H, SONG Y, et al.Nrf2:An all-rounder in depression[J].Redox Biology, 2022, 58:102522.