5-羟甲基糠醛(5-hydroxymethylfurfural, 5-HMF)是一种主要通过还原糖发生美拉德或焦糖化反应生成的呋喃类化合物,常见于含碳水化合物较高的食品和植物中[1]。LEE等[2]对包括苹果、芒果、荔枝等在内的56种果汁进行检测,发现所有样品均含有5-HMF(质量浓度范围0.08~91.5 mg/L);罗弈皓等[3]对金银花中5-HMF的含量进行检测,发现其含量范围为0.003 3%~0.013 6%;邢倩倩[4]通过高效液相色谱法测得在巴氏杀菌乳和常温酸奶中羟甲基糠醛含量分别为6.69、747.58 μg/100 g。日常生活中,人体每天通过饮食摄入的5-HMF大约是3.14~68.86 mg[5],其中咖啡和面包占总量的85%,其他重要来源包括酒精饮料、饼干、蜂蜜和巴氏杀菌产品等[6]。由此可见,5-HMF涉及到的食品种类多,含量差异较大。
关于5-HMF的研究和认识主要集中于两方面。一方面,5-HMF被认为是食物和药品中的潜在毒性物质,对眼黏膜、上呼吸道黏膜、横纹肌、内脏和神经系统等有毒副作用[7],并且高剂量5-HMF具有潜在的致癌风险[8]。5-HMF及其2种低聚物(Ⅱ和Ⅲ)被发现能够以剂量和时间依赖的方式阻断PC12和HT22细胞在S或G2-M期的增殖,并通过小鼠模型证明了当给药剂量达到0.15 mg/kg时,低聚物Ⅲ可以诱导青春期小鼠焦虑和抑郁样行为[9]。另一方面,低剂量5-HMF所具有的抗氧化、改善学习记忆、保护神经细胞等生物活性也受到广泛关注[10]。顾海等[11]使用10 μmol/L和1 μmol/L的5-HMF作用于H2O2引起的氧化损伤海马神经细胞,结果显示5-HMF对神经细胞具有一定的保护作用。ZHAO等[12]发现5-HMF通过清除ABTS阳离子自由基和DPPH自由基表现出抗氧化活性,并以剂量依赖性方式诱导红细胞溶血现象。因此,研究不同浓度的5-HMF对人体健康的“两面性”影响及其作用机制具有重要意义。
秀丽隐杆线虫,是与人类基因高度同源且代谢途径与人类相似的一种模式生物,是迄今为止发现的唯一一种完成全基因组测序的多细胞生物[13],其研究包括诸多领域,如发育生物学、寿命及衰老研究、神经退行性疾病等。VAN BOXEL等[14]将秀丽隐杆线虫暴露于微塑料中,在蠕虫的消化道中发现了微塑料的存在,并且在生殖期间发现了较小微塑料的存在,这表明,微塑料对秀丽隐杆线虫具有生殖毒性;MART NEZ-FERN
NEZ-FERN NDEZ等[15]将秀丽隐杆线虫作为实验模型,研究发现多巴胺(dopamine, DA)对顺铂诱导的神经毒性对动物运动的影响具有保护作用;也有研究学者将秀丽隐杆线虫作为实验模型,研究电离辐射对神经系统的影响[16]。但目前为止关于5-HMF对线虫毒性机制的研究相对较少,因此,本实验运用常见模式生物秀丽隐杆线虫作为研究对象,通过分析不同浓度5-HMF对线虫寿命、产卵、基础运动指标以及与胰岛素/胰岛素样生长因子信号通路(includinginsulin/insulin-like growth factor, IIS)相关基因的表达情况进行分析,探究5-HMF对于机体的影响及其初步机制,为5-HMF在毒理学领域的进一步深入研究提供参考。
NDEZ等[15]将秀丽隐杆线虫作为实验模型,研究发现多巴胺(dopamine, DA)对顺铂诱导的神经毒性对动物运动的影响具有保护作用;也有研究学者将秀丽隐杆线虫作为实验模型,研究电离辐射对神经系统的影响[16]。但目前为止关于5-HMF对线虫毒性机制的研究相对较少,因此,本实验运用常见模式生物秀丽隐杆线虫作为研究对象,通过分析不同浓度5-HMF对线虫寿命、产卵、基础运动指标以及与胰岛素/胰岛素样生长因子信号通路(includinginsulin/insulin-like growth factor, IIS)相关基因的表达情况进行分析,探究5-HMF对于机体的影响及其初步机制,为5-HMF在毒理学领域的进一步深入研究提供参考。
1 材料与方法
1.1 材料与试剂
5-HMF(H106323-250 mg),阿拉丁科技(中国)有限公司;秀丽隐杆线虫(野生型),OP50菌株,上源生物科技有限公司。
5-氟-2′-脱氧尿嘧啶核苷,Sigma公司;酵母提取物粉、胰蛋白胨,Oxoid公司;细菌蛋白胨,海博生物技术有限公司;NaCl、琼脂粉、CaCl2、MgSO4、K3PO4、胆固醇、Na2HPO4、KH2PO4、甘油、NaOH、NaClO,国药集团化学试剂股份有限公司。
1.2 仪器与设备
16021线虫培养皿、XSCWP08挑虫针,上源生物科技有限公司;MS5C磁力搅拌器,JOANLAB公司;XSC-SM1线虫专用体视显微镜,北京学思创生物科技有限公司。
1.3 实验方法
1.3.1 不同浓度5-HMF线虫培养皿的配制
母液的配制(40 mg/mL):400 mg的5-HMF溶于10 mL的无菌水中,高压灭菌锅121 ℃灭菌15 min,冷却至室温,4 ℃冰箱备用。
100 mL NGM、含0.010、0.100、1.000 mg/mL 5-HMF的线虫生长培养基(nematode growth medium,NGM)(100 mL)的制备:准确称取NaCl 0.3 g、琼脂粉2 g和细菌蛋白胨0.25 g,溶于去离子水中(NGM:97 mL,0.010 mg/mL 5-HMF:96.975 mL,0.100 mg/mL 5-HMF:96.75 mL,1.000 mg/mL 5-HMF:94.5 mL),高压灭菌15 min后,待其冷却至60 ℃,加入1 mL提前配制好的CaCl2(1 mol/L)和MgSO4(1 mol/L)、2.5 mL K3PO4(1 mol/L pH 6.0)以及0.32 mL胆固醇溶液(5 mg/mL无水乙醇),配制含0.010、0.100、1.000 mg/mL 5-HMF的NGM培养基还需分别加入0.025、0.25、2.5 mL质量浓度为40 mg/mL的5-HMF。将上述试剂混匀,倒入平板,待凝固后,置于室温2 d,看是否有杂菌污染。置于4 ℃冰箱备用,可保存1个月。
含有5-氟-2′-脱氧尿嘧啶核苷的不同浓度5-HMF线虫生长培养基(mNGM)的配制:配制方法与上述NGM相似。去离子水添加量有所不同:mNGM:90 mL,0.010 mg/mL 5-HMF:89.975 mL,0.100 mg/mL 5-HMF:89.75 mL,1.000 mg/mL 5-HMF:87.5 mL。最后,分别向不同的培养基中各加入7 mL 5-氟-2′-脱氧尿嘧啶核苷,即可配制成不同浓度的mNGM培养基。
1.3.2 秀丽隐杆线虫的培养及同期化
秀丽隐杆线虫复苏后,转移至已经滴加大肠杆菌的NGM培养皿中,待线虫长至产卵期时,参考代亚贤[17]的实验方法进行同期化实验。
1.3.3 寿命实验
采用含有5-氟-2′-脱氧尿嘧啶核苷的培养基进行实验。参考SAKTHIVEL等[18]的实验方法,每块平板挑取20条线虫,每组5块平板,20 ℃培养,每天观察线虫的生存情况,每天更换平板(目的:减少因后代而产生的的误差,使线虫食物充足)。判定线虫死亡的标准参照ZHANG等[19]的实验方法。待全部线虫死亡,则实验结束。
1.3.4 产卵情况
参照SITIA等[20]的实验方法,将线虫同期化培养48 h后,显微镜下观察,选择生殖口为透明半月形的L4期雌雄同体的线虫,使用挑针挑取到含有不同浓度5-HMF的NGM平板上,每块平板挑取3条线虫,每组5块平板,20 ℃培养。进行产卵实验。
每天观察线虫产卵情况,将挑至新板的线虫继续培养,在显微镜下记录旧板中产卵数量,并计算平均值,此项实验持续5 d。
1.3.5 基础运动指标的测定
实验方法参考李煜等[21]的方法,在寿命实验的第4、8、12、16、20天分别进行基础运动指标的测定。每个实验组选取9条线虫,放置在显微镜下,记录1 min内线虫咽泵频率、头部摆动、身体弯曲的次数。
1.3.6 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)
1.3.6.1 秀丽隐杆线虫总RNA的提取
将各组别线虫用含5-氟-2′-脱氧尿嘧啶核苷的培养基培养至第10天后,按照试剂盒说明进行操作。
1.3.6.2 cDNA合成
按照试剂盒说明进行操作。
1.3.6.3 PCR扩增
按照试剂盒说明进行操作。所用引物序列见表1。其中Actin为内参基因。
表1 引物序列
Table 1 Primer sequence
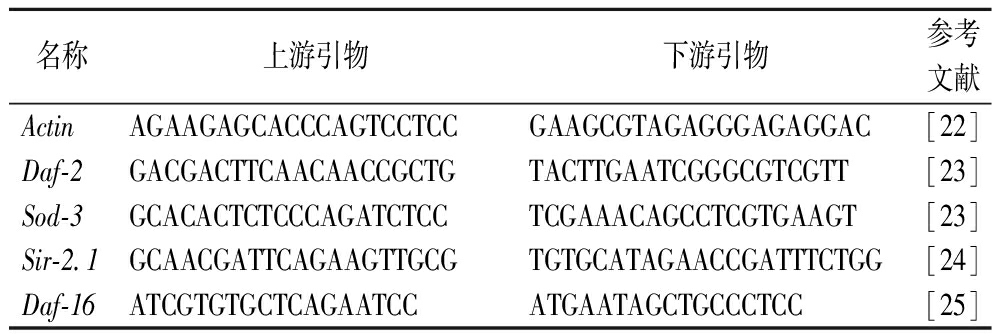
名称上游引物下游引物参考文献ActinAGAAGAGCACCCAGTCCTCCGAAGCGTAGAGGGAGAGGAC[22]Daf-2GACGACTTCAACAACCGCTGTACTTGAATCGGGCGTCGTT[23]Sod-3GCACACTCTCCCAGATCTCCTCGAAACAGCCTCGTGAAGT[23]Sir-2.1GCAACGATTCAGAAGTTGCGTGTGCATAGAACCGATTTCTGG[24]Daf-16ATCGTGTGCTCAGAATCCATGAATAGCTGCCCTCC[25]
1.4 数据处理分析
实验数据使用SPSS单因素方差分析进行多组间的比较,所有结果数据以平均值±标准差表示,P<0.05被认为差异具有统计学意义。GraphPad Prism 8软件进行作图,其中不同小写字母代表有显著性差异,相同小写字母代表无显著性差异(本实验结果中,与时间相关实验结果保留小数点后一位,与浓度相关实验结果,保留小数点后3位)。
2 结果与分析
2.1 不同浓度5-HMF对秀丽隐杆线虫寿命的影响
如图1及表2所示,低浓度5-HMF作用于线虫时,会使线虫的最长寿命(其中最后一条线虫死亡的时间)从24 d增加至27 d(延长12.5%);平均最长寿命(5个平板中线虫最长寿命的平均值)从23.3 d增加至25 d(延长7.8%);中位生存时间(线虫存活剩50%所经历的时间)由(12.0±2.4) d增加至(14.0±2.6) d(延长16.7%);平均寿命(每个浓度组共100条线虫的平均存活时间)从12.5 d增加至14.0 d(延长12%)。相反,当5-HMF浓度升高至中高浓度时,会导致实验组中线虫的最长寿命分别缩短20.8%和41.7%。结合图1-c和图1-d中线虫的平均最长寿命以及最长寿命拟合曲线可知,当线虫分别存活23.3、24 d时(5-HMF浓度为0时的存活时间),5-HMF的质量浓度分别为0.035、0.056 mg/mL。由此表明,0.035 mg/mL可作为5-HMF影响线虫平均最长寿命的临界浓度值,0.056 mg/mL可作为5-HMF影响线虫最长寿命的临界浓度值。
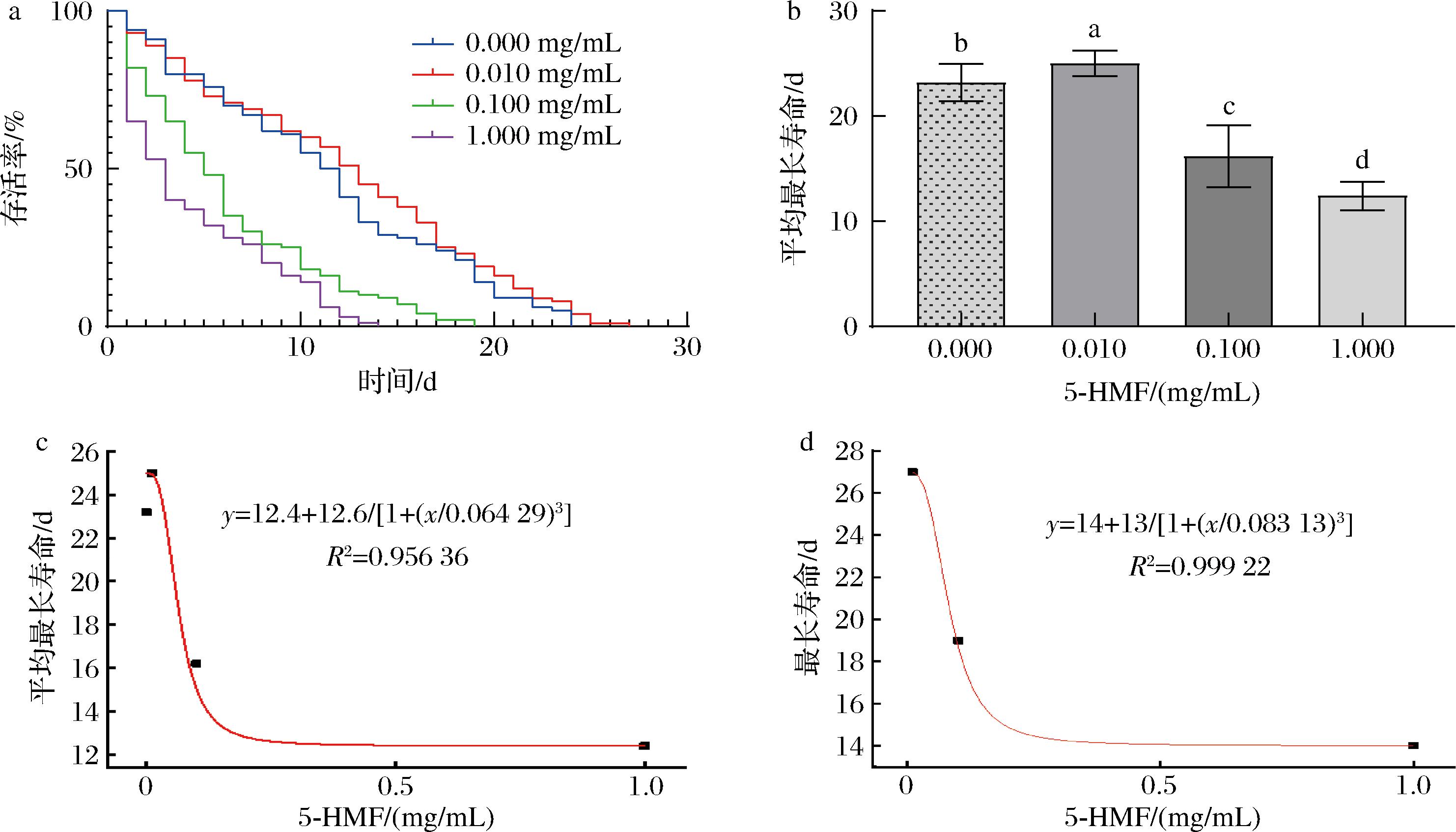
a-寿命生存曲线;b-平均最长寿命;c-平均最长寿命拟合曲线;d-最长寿命拟合曲线
图1 不同浓度5-HMF对秀丽隐杆线虫寿命的影响
Fig.1 Effect of different concentrations of 5-HMF on the life span of Caenorhabditis elegans 注:不同小写字母代表差异显著(P<0.05)(下同)。
表2 不同浓度5-HMF对秀丽隐杆线虫中位生存时间,平均寿命以及平均最长寿命的影响
Table 2 Effects of different concentrations of 5-HMF on the median survival time, average life span, and average maximum life span of C. elegans
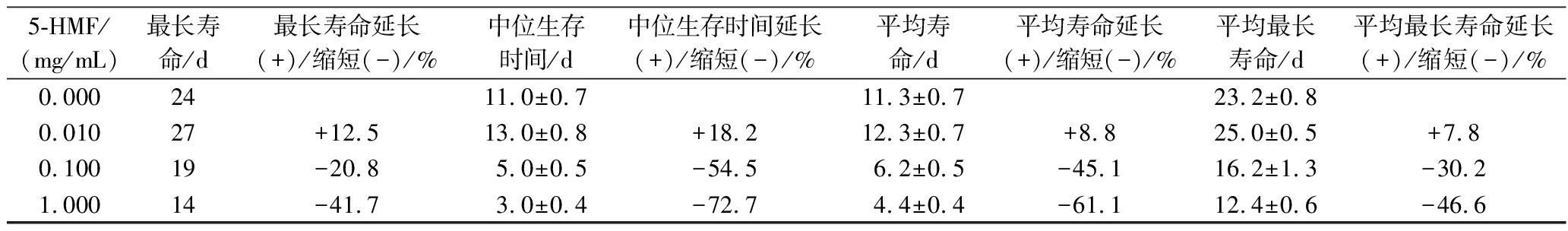
5-HMF/(mg/mL)最长寿命/d最长寿命延长(+)/缩短(-)/%中位生存时间/d中位生存时间延长(+)/缩短(-)/%平均寿命/d平均寿命延长(+)/缩短(-)/%平均最长寿命/d平均最长寿命延长(+)/缩短(-)/%0.0002411.0±0.711.3±0.723.2±0.80.01027+12.513.0±0.8+18.212.3±0.7+8.825.0±0.5+7.80.10019-20.85.0±0.5-54.56.2±0.5-45.116.2±1.3-30.21.00014-41.73.0±0.4-72.74.4±0.4-61.112.4±0.6-46.6
2.2 不同浓度5-HMF对秀丽隐杆线虫产卵情况的影响
如图2所示,与对照组相比,低浓度组5-HMF在线虫的整个产卵周期中,没有产生显著影响;而当5-HMF浓度达到中、高浓度组时,线虫的产卵数量从第1天开始出现显著下降(P<0.05)。其中,在第1、4、5天时,中高浓度组并无显著性差异;第2天和第3天时,两组组间也呈现出显著性差异(P<0.05)。这表明,中、高浓度的5-HMF会以时间和浓度依赖性的方式显著减少线虫的产卵数量。
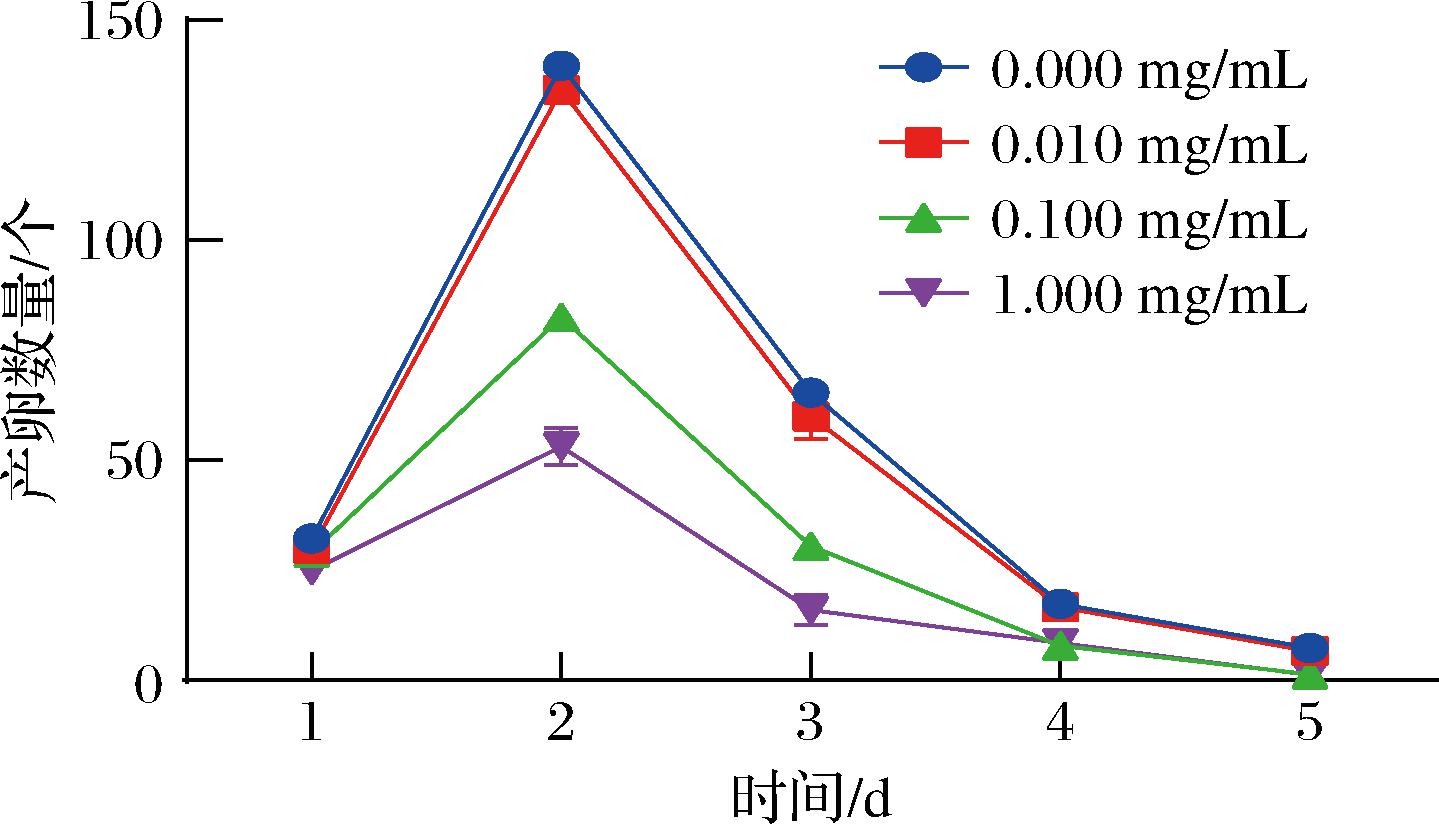
图2 不同浓度5-HMF对秀丽隐杆线虫产卵情况的影响
Fig.2 Effect of different concentrations of 5-HMF on egg laying of C. elegans
2.3 不同浓度5-HMF对秀丽隐杆线虫基础运动指标的影响
如图3所示,与对照组相比,低浓度组5-HMF在线虫的整个生命周期中,对线虫的咽泵频率、头部摆动以及身体弯曲次数并无显著性影响;中浓度组的5-HMF在本次实验进行到第12天时,才会显著性减少线虫的咽泵频率、头部摆动以及身体弯曲的次数;高浓度组的5-HMF在实验进行到第4天时就已经出现显著性减少3种基础运动指标次数的情况。由此可表明,中、高浓度的5-HMF均会以时间和浓度依赖性的方式显著减少线虫的咽泵频率、头部摆动以及身体弯曲的次数。
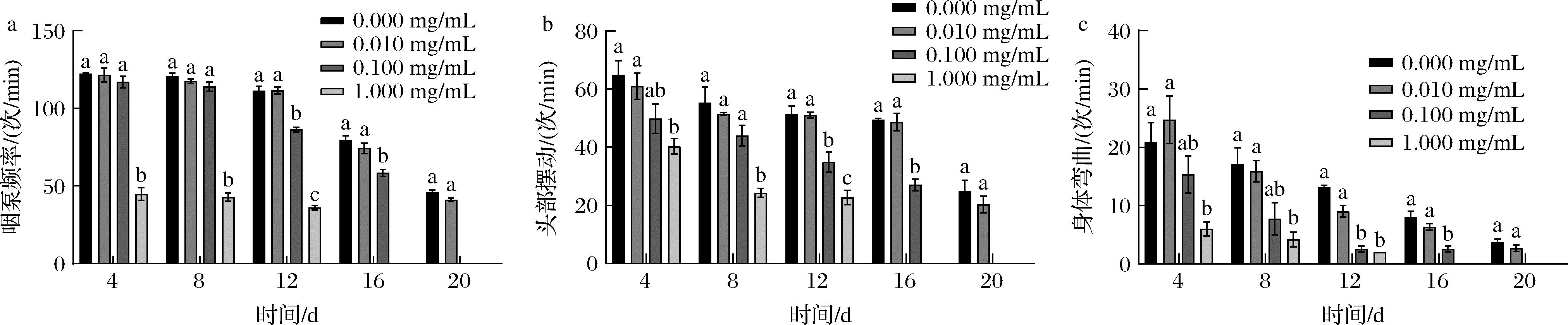
a-咽泵频率;b-头部摆动;c-身体弯曲
图3 不同浓度5-HMF对秀丽隐杆线虫咽泵频率、头部摆动、身体弯曲的影响
Fig.3 Effects of different concentrations of 5-HMF on pharyngeal pump frequency, head swing, and body bending of C. elegans 注:由于中浓度组线虫在本次实验第19天就已全部死亡,故在基础运动指标测定时,第20天并无数据,高浓度组线虫在 本次实验第14天就已全部死亡,故在基础运动指标测定时,第16天以及20天并无数据。
2.4 不同浓度5-HMF对秀丽隐杆线虫IIS通路相关基因表达的影响
如图4所示,5-HMF低浓度组中Daf-2基因表达水平显著降低(P<0.05),中高浓度组中Daf-2基因表达水平显著上升(P<0.05)。相反,Daf-16、Sod-3、Sir-2.1基因表达量均随着5-HMF浓度的升高而降低。5-HMF在低浓度时,3组基因表达量均呈显著性上升(P<0.05),在中高浓度时基因表达量均显著下降(P<0.05)。由此推测,5-HMF在低浓度时可以抑制IIS信号通路中Daf-2基因的表达,并促进Daf-16、Sod-3、Sir-2.1基因的表达;在高浓度时则完全相反。该结果与秀丽隐杆线虫寿命实验结论相呼应。
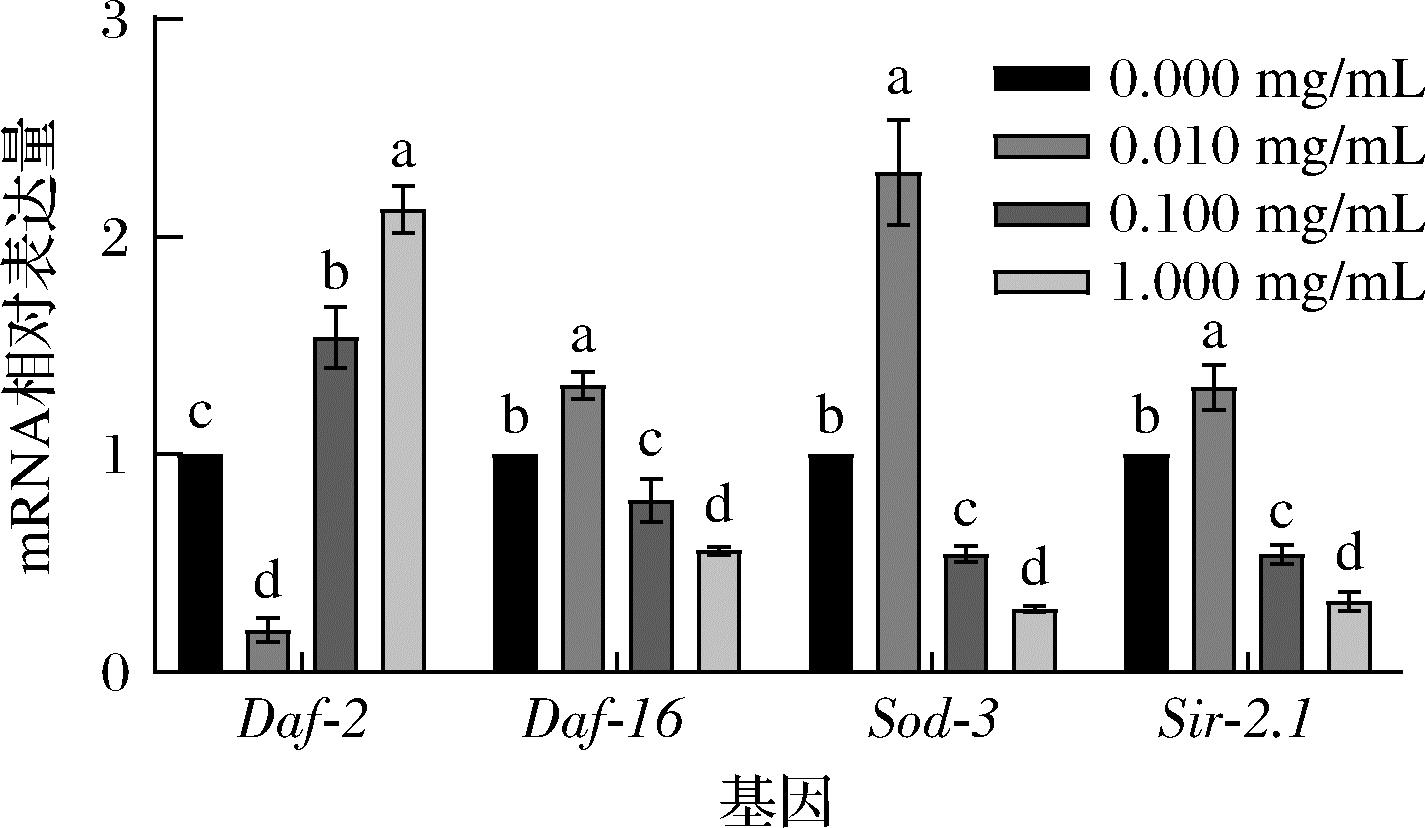
图4 不同浓度5-HMF对秀丽隐杆线虫IIS相关 基因表达水平的影响
Fig.4 Effects of different concentrations of 5-HMF on the expression level of IIS related genes in C. elegans
如图5所示,由基因拟合关系式可知,当基因表达水平为1时(5-HMF浓度为0),5-HMF作用于基因Daf-2,Daf-16,Sod-3以及Sir-2.1的临界质量浓度分别为0.067、0.067、0.075、0.052 mg/mL。该结果结合2.1节平均最长寿命临界质量浓度值0.035 mg/mL以及最长寿命临界质量0.056 mg/mL可知,对于寿命相关基因和寿命表型相关实验结果的量效关系中,5-HMF的临界质量浓度均处于0.010~0.100 mg/mL,即5-HMF对寿命有关基因和表型的影响具有较高的吻合度。由此可以初步推断,当5-HMF质量浓度≤0.010 mg/mL时,可起到延长线虫寿命的作用,而当5-HMF质量浓度≥0.100 mg/mL时,则会对线虫寿命有不利影响。

a-Daf-2;b-Daf-16;c-Sod-3;d-Sir-2.1
图5 不同浓度5-HMF对秀丽隐杆线虫IIS 相关基因表达水平影响的非线性拟合曲线
Fig.5 Non-linear fitting curve of effects of different concentrations of 5-HMF on the expression levels of IIS related genes of C. elegans
3 结论
5-HMF作为一种两面性化合物,对人体既可能产生有益作用,也可能有负面作用。本研究利用与人类基因组高度同源的秀丽隐杆线虫建立体内实验模型,通过设置质量浓度梯度(低浓度组:0.010 mg/mL;中浓度组:0.100 mg/mL;高浓度组:1.000 mg/mL)研究5-HMF对秀丽隐杆线虫寿命、产卵数量、基础生理指标中3个指标(咽泵频率、头部摆动、身体弯曲)以及与寿命相关通路IIS中部分基因(Daf-2、Daf-16、Sod-3和Sir-2.1)表达的影响。
寿命实验结果发现,低浓度的5-HMF对秀丽隐杆线虫寿命相关指标没有显著损害,反而能够使其显著上升。而中高浓度的5-HMF对秀丽隐杆线虫有显著的毒性作用,即缩短线虫寿命。对于线虫的最长寿命以及平均最长寿命的临界质量浓度值分别为0.056 mg/mL和0.035 mg/mL。测定线虫的产卵数量是常用评价外源化合物对秀丽隐杆线虫生殖毒性的指标之一[26]。本实验通过统计秀丽隐杆线虫的产卵数量进而预测5-HMF对线虫的生殖毒性情况。实验结果表明,低浓度的5-HMF并不会对线虫的产卵情况产生影响。相反,中高浓度组5-HMF会显著性减少线虫的产卵数量。这一结果提示线虫的产卵数量会受5-HMF浓度的影响。
测定秀丽隐杆线虫的运动能力是评定其健康状况[27]以及反应神经网络是否完整[28]的常用方法之一,其中身体弯曲被证实与活性氧的产生具有相关性[29]。本实验通过对3组运动能力指标的测定,可以对线虫的运动能力水平进行初步分析。结果显示,与对照组相比,低浓度的5-HMF对线虫的咽泵频率、头部摆动以及身体弯曲次数并无明显影响;而中、高浓度的5-HMF则会在不同程度上显著性减少3组运动行为的次数。这些结果提示5-HMF对秀丽隐杆线虫运动能力的影响与处理时间和浓度相关。
与秀丽隐杆线虫寿命实验结果相对应,qRT-PCR实验结果也显示出5-HMF以浓度依赖性的方式影响秀丽隐杆线虫寿命相关通路IIS的部分基因。Daf-2是线虫胰岛素/胰岛素样生长因子1受体的同源蛋白,缺失该基因可使成年线虫的寿命延长一倍;Daf-16基因同寿命、免疫力密切相关,是一种寿命调控因子,其作为该通路的下游靶器官,可用于调节线虫的寿命和抗压性;Sod-3是线虫体内超氧化物歧化酶家族成员之一,与线虫过氧化损伤引起的衰老有关;Sir-2.1作为Daf-16的辅助因子,当其过度表达时,可导致线虫寿命延长[30],而Daf-16可通过调节该通路下游与氧化应激相关的超氧化物歧化酶基因(Sod-3)的表达,保护线虫免受或减弱氧化应激的损伤,进而提高线虫抗氧化能力,达到延长寿命的目的。本文结果表明,不同浓度5-HMF可能通过调节寿命途径中IIS相关基因的表达来延长/缩短线虫寿命,并且对于不同基因的作用浓度有所区别,其中低浓度5-HMF可以延长线虫寿命,而中、高浓度5-HMF会加快线虫死亡时间。根据相关基因和寿命的非线性拟合曲线的结果可初步推断当5-HMF质量浓度≤0.010 mg/mL时,会对线虫寿命产生正面影响,当5-HMF质量浓度≥0.100 mg/mL时,则会对线虫寿命产生负面影响。
综上所述,5-HMF对秀丽隐杆线虫的正负向影响与浓度密切相关,不同浓度的5-HMF可能通过调节秀丽隐杆线虫IIS通路部分基因影响线虫的寿命,以及通过对产卵数量、基础运动指标产生影响,改变线虫的健康状况。本研究结果可为后续进行有关5-HMF毒理学领域的深入研究提供初步参考,并为5-HMF进一步毒性分析和安全应用提供理论依据。
[1] LI E C, LIN N, HAO R R, et al.5-HMF induces anaphylactoid reactions in vivo and in vitro[J].Toxicology Reports, 2020, 7:1402-1411.
[2] LEE T P, SAKAI R, MANAF N A, et al.High performance liquid chromatography method for the determination of patulin and 5-hydroxymethylfurfural in fruit juices marketed in Malaysia[J].Food Control, 2014, 38:142-149.
[3] 罗弈皓, 刘楠, 袁枫林, 等.金银花变色与5-羟甲基糠醛等有效成分含量的相关性研究[J].湖南生态科学学报, 2021, 8(4):38-42. LUO Y H, LIU N, YUAN F L, et al.Correlation between color change in Lonicera japonica thunb and the content of active ingredients as 5-hydroxymethylphenidate[J].Journal of Hunan Ecological Science, 2021, 8(4):38-42.
[4] 邢倩倩. 高效液相色谱法测定干酪和炼乳中糠醛类化合物含量[J].乳业科学与技术, 2021, 44(1):28-32. XING Q Q.Determination of furfural compounds in cheese and condensed milk by high performance liquid chromatography[J].Journal of Dairy Science and Technology, 2021, 44(1):28-32.
[5] PASTORIZA DE LA CUEVA S,  LVAREZ J, VÉGV
LVAREZ J, VÉGV RI
RI  , et al.Relationship between HMF intake and SMF formation in vivo:An animal and human study[J].Molecular Nutrition &Food Research, 2017, 61(3):1600773.
, et al.Relationship between HMF intake and SMF formation in vivo:An animal and human study[J].Molecular Nutrition &Food Research, 2017, 61(3):1600773.
[6] RUFI N-HENARES J A, DE LA CUEVA S P.Assessment of hydroxymethylfurfural intake in the Spanish diet[J].Food Additives &Contaminants:Part A, 2008, 25(11):1306-1312.
N-HENARES J A, DE LA CUEVA S P.Assessment of hydroxymethylfurfural intake in the Spanish diet[J].Food Additives &Contaminants:Part A, 2008, 25(11):1306-1312.
[7] 阚旭辉, 郭红英, 谭兴和, 等.食品中5-羟甲基糠醛的研究进展[J].食品工业, 2017, 38(3):251-255. KAN X H, GUO H Y, TAN X H, et al.Research progress on 5-hydroxymethylfurfural in food[J].The Food Industry, 2017, 38(3):251-255.
[8] FARAG M R, ALAGAWANY M, BIN-JUMAH M, et al.The toxicological aspects of the heat-borne toxicant 5-hydroxymethylfurfural in animals:A review[J].Molecules, 2020, 25(8):1941.
[9] WANG C, LIU Z R, HU T, et al.Potential neurotoxicity of 5-hydroxymethylfurfural and its oligomers:Widespread substances in carbohydrate-containing foods[J].Food &Function, 2020, 11(5):4216-4223. [10] 王梅, 王越欣, 武英茹, 等.5-羟甲基糠醛在中药加工过程中的变化及药理作用研究概况[J].药物评价研究, 2020, 43(11):2319-2327. WANG M, WANG Y X, WU Y R, et al.Research progress on content changes of 5-hydroxymethyl furfural during processing of Chinese medicine and it’s pharmacological effects[J].Drug Evaluation Research, 2020, 43(11):2319-2327.
[11] 顾海, 姜泽群, 姜海英, 等.5-羟甲基糠醛对过氧化氢致大鼠海马神经细胞损伤的保护作用研究[J].南京中医药大学学报, 2011, 27(5):437-440. GU H, JIANG Z Q, JIANG H Y, et al.5-hydroxyl methyl-furfural’s effect and mechanism on rat with H2O2 induced hippocampal neurons injuries[J].Journal of Nanjing University of Traditional Chinese Medicine, 2011, 27(5):437-440.
[12] ZHAO L, CHEN J P, SU J Y, et al.In vitro antioxidant and antiproliferative activities of 5-hydroxymethylfurfural[J].Journal of Agricultural and Food Chemistry, 2013, 61(44):10604-10611.
[13] 孟艺伟, 赵燕秋, 孟庆洲, 等.秀丽隐杆线虫模型在抗衰老研究中的应用[J].生物资源, 2023, 45(1):9-15. MENG Y W, ZHAO Y Q, MENG Q Z, et al.Application of Caenorhabditis elegans model in anti-aging research[J].Biotic Resources, 2023, 45(1):9-15.
[14] VAN BOXEL J, DARRAZ O, VAN DUURSEN M B M, et al.P06-06 Toxicological effects of polystyrene nanoparticles on the nematode Caenorhabditis elegans:A predictive model for human toxicity of microplastics[J].Toxicology Letters, 2022, 368:S115.
[15] MART NEZ-FERN
NEZ-FERN NDEZ C, BERGAMINO M, BRENA D, et al.Insights into cisplatin-induced neurotoxicity and mitochondrial dysfunction in Caenorhabditis elegans[J].Disease Models &Mechanisms.DOI:10.1101/2021.06.03.445826.
NDEZ C, BERGAMINO M, BRENA D, et al.Insights into cisplatin-induced neurotoxicity and mitochondrial dysfunction in Caenorhabditis elegans[J].Disease Models &Mechanisms.DOI:10.1101/2021.06.03.445826.
[16] LONG H Q, GAO J, HE S Q, et al. The role of crm-1 in ionizing radiation-induced nervous system dysfunction in Caenorhabditis elegans[J]. Neural Regeneration Research, 2023, 18(6): 1386-1392.
[17] 代亚贤. 东紫苏精油微波无溶剂法提取及杀线虫活性研究[D].昆明:昆明医科大学, 2019. DAI Y X.Solvent-free microwave extraction of essential oil from elsholtiza bodinieri vaniot and research on its nematodes activity[D].Kunming:Kunming Medical University, 2019.
[18] SAKTHIVEL A, DANANJEYAN B.Pathogenesis of plant-associated Pseudomonas aeruginosa in Caenorhabditis elegans model[J].BMC Microbiology, 2022, 22(1):269.
[19] ZHANG S Y, QIN Z C, SUN Y Y, et al.Genistein promotes anti-heat stress and antioxidant effects via the coordinated regulation of IIS, HSP, MAPK, DR, and mitochondrial pathways in Caenorhabditis elegans[J].Antioxidants, 2023, 12(1):125.
[20] SITIA G, FIORDALISO F, VIOLATTO M B, et al.Food-grade titanium dioxide induces toxicity in the nematode Caenorhabditis elegans and acute hepatic and pulmonary responses in mice[J].Nanomaterials, 2022, 12(10):1669.
[21] 李煜, 王雪岩, 罗环, 等.秀丽隐杆线虫在乙酸钙不动杆菌致病性评价中的应用[J].环境与健康杂志, 2020, 37(3):228-232. LI Y, WANG X Y, LUO H, et al.Application of Caenorhabditis elegans in pathogenicity evaluation of Acinetobacter calcoaceticus[J].Journal of Environment and Health, 2020, 37(3):228-232.
[22] 张晓娟. 基于秀丽隐杆线虫模型的伏马毒素B1神经毒性机制及其干预研究[D].无锡:江南大学, 2022. ZHANG X J.Study on mechanism and intervention of fumonisin B1-induced neurotoxicity based on Caenorhabditis elegans model[D].Wuxi:Jiangnan University, 2022.
[23] 李孝丽. 香椿子不同部位提取物对秀丽隐杆线虫热应激的防护作用研究[D].阜阳:阜阳师范大学, 2020. LI X L.The protective effect of extracts from different parts of Toona sinensis fruits on heat stress of C.elegans[D].Fuyang:Fuyang Normal University, 2020.
[24] 张照康. 枸杞多糖在秀丽线虫中延缓衰老的实验研究[D].武汉:华中师范大学, 2020. ZHANG Z K.Effects of Lycium barbarum polysaccharides on health and aging of C.elegans[D].Wuhan:Central China Normal University, 2020.
[25] 张照康, JOHN B K, 努尔古丽·苏里坦, 等.microRNA-260在秀丽隐杆线虫衰老进程中的作用研究[J].华中师范大学学报(自然科学版), 2016, 50(6):897-903. ZHANG Z K, JOHN B K, NUERGULI S, et al.The role of miR-260 in the ageing process of C.elegans and its molecular mechanism[J].Journal of Central China Normal University (Natural Sciences), 2016, 50(6):897-903.
[26] 阮嘉莉. 地塞米松对秀丽隐杆线虫的多种毒性效应及作用机制[D].南宁:广西医科大学, 2020. RUAN J L.Various toxic effects and mechanism of dexamethasone on Caenorhabditis elegans[D].Nanning:Guangxi Medical University, 2020.
[27] YU Z Y, CHEN X X, ZHANG J, et al.Transgenerational effects of heavy metals on L3 larva of Caenorhabditis elegans with greater behavior and growth inhibitions in the progeny[J].Ecotoxicology and Environmental Safety, 2013, 88:178-184.
[28] LEUNG M C K, WILLIAMS P L, BENEDETTO A, et al.Caenorhabditis elegans:An emerging model in biomedical and environmental toxicology[J].Toxicological Sciences, 2008, 106(1):5-28.
[29] WU Q L, WANG W, LI Y X, et al.Small sizes of TiO2-NPs exhibit adverse effects at predicted environmental relevant concentrations on nematodes in a modified chronic toxicity assay system[J].Journal of Hazardous Materials, 2012, 243:161-168.
[30] 姜顺. 冬凌草素对淀粉样蛋白损伤保护的生物学活性研究[D].长春:吉林大学, 2022. JIANG S.Study on biological activity of rubescensin in protecting amyloid protein from injury[D].Changchun:Jilin University, 2022.