玉米黄质,也被称作玉米黄素,其分子式为C40H56O2,是一种常见的橙黄色含氧烯萜类化合物,属于类胡萝卜素,作为四萜的含氧衍生物,同时包含11个共轭的碳碳双键(图1)。玉米黄质拥有较好的脂溶性,广泛的存在于橙色、红色以及黄色植物花朵或果实中,由β-胡萝卜素经β-胡萝卜素羟化酶CrtZ催化而来。玉米黄质与其同分异构体叶黄素都具有较强的抗氧化性,对一些如老年黄斑变性、白内障以及肿瘤之类的疾病有预防作用[1-3]。玉米黄质含有的多个共轭碳碳双键,既可以吸收部分波长的可见光使玉米黄质晶体显色,又会受到热量的影响变得不稳定,还会受到缺电子的基团以及金属离子的攻击,在受到这些因素影响的同时,这些双键还可以淬灭掉游离的单态氧[4]。这些效果导致了玉米黄质在较高温度下及光照等条件下具有不稳定性,容易被氧化。玉米黄质和叶黄素都存在于视网膜中[5],并被证明与视网膜健康有关[6]。玉米黄质不能由人体合成,所以需要通过食物补充[7]。
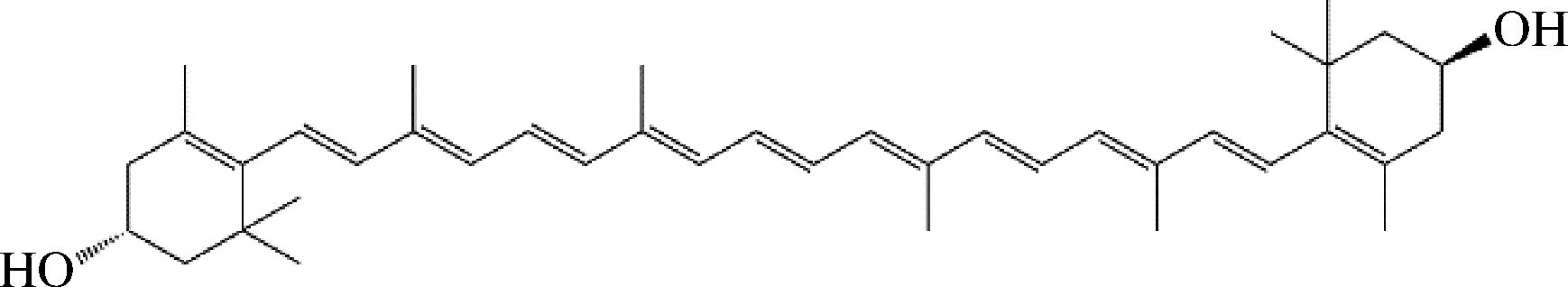
图1 玉米黄质化学结构
Fig.1 Chemical structure of zeaxanthin
玉米黄质的主要合成方法包括植物提取法、化学合成法以及生物合成法3种。其中,植物提取法主要通过从黄色的蔬菜和水果(如玉米、辣椒、橙子、甜瓜和芒果)中提取玉米黄质,通过一些提取技术获得的玉米黄质依旧可以保持多种功能活性,但这种方法带来的问题(如较低的产率和产量、提取过程中带来的废料物质和环境污染)限制了植物提取法的发展空间[8-9]。而化学合成法获得玉米黄质较为困难,合成过程成本较高且步骤繁杂,合成得到的玉米黄质具有较差的生物活性,只能用作染料用途[10],因此化学合成不是获得玉米黄质的优先选择。最后,玉米黄质的微生物生产可以用野生或工程微生物进行[11-12]。应用微生物合成玉米黄质具有原材料成本低、环境污染小的优点,这两方面都提高了玉米黄质可持续生产的可能性。此外,微生物的代谢工程也提供了另一种从本身无法合成玉米黄质的菌株中得到玉米黄素的方法[13]。由于玉米黄质的安全性以及生物活性,利用新的生物技术合成玉米黄质受到了更多的关注,很多的基因操作可用于增强玉米黄质在细菌、酵母和微藻中的积累。
萜类化合物可以通过两个基本的结构单元异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)以及二甲基丙烯焦磷酸(dimethylallyl pyrophosphate,DMAPP)合成,这两种物质在一定的条件下可以互变。在酿酒酵母中含有可以为合成萜类物质提供前体的甲羟戊酸途径(mevalonate pathway,MVA)。将MVA中产生的IPP和DMAPP 作为前体,通过香叶基香叶基二磷酸合成酶(CrtE)生成香叶基香叶基二磷酸酯(geranylgeranyl pyrophosphate,GGPP),在八氢番茄红素合成酶(CrtB)的作用下合成八氢番茄红素,最后再由八氢番茄红素去饱和酶(CrtI)得到一系列中间产物和最终的产物番茄红素[14],番茄红素再通过番茄红素折叠酶(CrtYB)和β-胡萝卜素羟化酶(CrtZ)反应生成玉米黄质,玉米黄质在酿酒酵母中合成的整个过程如图2所示。

图2 玉米黄质的从头合成
Fig.2 De novo synthesis of zeaxanthin
注:羟甲基戊二酸还原酶(tHMGr); 异戊烯二磷酸异构酶 (isopentenyl diphosphate isomerase,IDI)。
BHOSALE等[15]使用多食黄杆菌(Flavobacterium multivorum)合成玉米黄质积累量达到(10.65±0.63) μg/mL。ASKER等[16]使用了玉米黄原中黄杆菌(Mesoflavibacter zeaxanthinifaciens)合成玉米黄质,积累量[以细胞干重(dry cell weight,DCW)计]可以达到910 μg/g DCW。SUN等[17]通过将木糖利用途径以及玉米黄质合成途径整合到酿酒酵母中得到了一株可以吸收木糖合成玉米黄质的菌株,玉米黄质的产量为0.74 mg/L。LIANG等[18]利用诱导型启动子最终使产量提高了50倍,使酿酒酵母中玉米黄质的产量达到了37 mg/L。SINGH等[19]成功使用小球藻(Chlorella saccharophila)作为工程菌合成了玉米黄质。玉米黄质在合成后会积累在细胞内部,有可能产生细胞毒性,李方迪等[20]构建合成番茄红素酿酒酵母时,发现增加胞内脂滴的表达量可以提升番茄红素的产量,推测与番茄红素有着类似性质的玉米黄质也可以通过相同的方式降低细胞毒性进而增加产量。
本文以本实验室的酿酒酵母YPH499-YthmgI为出发菌株,整合本实验室构建的番茄红素合成途径后将外源的CrtYB和CrtZ整合得到产玉米黄质菌株。在得到产玉米黄质酿酒酵母后过表达脂质体表达相关基因再通过补料优化提升了产玉米黄质酿酒酵母在发酵罐中的产量。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物
本文使用的所有菌株、质粒、引物见表1~表3。
表1 本研究使用菌株
Table 1 Strains used in this study

菌株基因型来源YPH499MATa, his3-Δ200, leu2-Δ1, trp1-Δ63, ura3-52, lys2-801, ade2-101本实验室YPH499-tHMG1asYPH499;ΔGAL80::loxp,GAL1pr-tHMG1-tCYC1::ADH5本实验室tHMG1-19asYPH499-tHMG1;ACS1::YPL062 W,PAP1::GAL7,LDP1::GAL10,DGA1-PAH1::EXG1本研究19-09-zeaas tHMG1-19;GAL1prGAL10pr—CrtYB-tADH-TEF1pr-CrtZ-tRG1::yhr210c本研究19-09-IB/IEas 19-09-zea;tCYC1-crtI-GAL1prGAL10pr-crtB-tADH1::YJL064 WtCYC1-crtI-GAL1prGAL10pr-crtE-tADH1::ROX1本研究
表2 本实验使用质粒
Table 2 Plasmids used in this study

质粒来源质粒来源PY26本实验室CrtYB-CrtZ本研究crtE-crtI本实验室Vector 19T(simple)Thermo ScientificcrtB-crtI本实验室
表3 本实验使用引物
Table 3 Primers used in this study

引物序列 (5′→3′)BamHⅠ-YPL062 W-1CGCGGATCCGACACACCTAATGATCTGA-TGCBamHⅠ-YPL062 W-2CGCGGATCCTCGCTGTTTGAGCTGACTAAEcoRⅠ-YPL062 W-3CCGGAATTCGCCCTTACGTGAGGGGCAGSalⅠ-YPL062 W-4ACGCGTCGACCACCGACCATGTGGGCAA-ATTCSalⅠ-XKX-FACGCGTCGACAAAATTCTGCGTTCGGTACCSalⅠ-XKX-RACGCGTCGACCGATCCTCTGGAGATGAG-CTCEcoRⅠ-GAL10pr-FCCGGAATTCTTATATTGAATTTTCAAAAATTGAL1pr-RGTAGTAAGCCAAAGCAGTCATTATAGTTT-TTTCTCCTTGACGTTAXaCrtYB-FTAACGTCAAGGAGAAAAAACTATAATGA-CTGCTTTGGCTTACTACXaCrtYB-RCAAACCTCTGGCGAAGAATTTTATTGACC-TTCCCAACCAtADH1-FGTCTGGTTGGGAAGGTCAATAAAATTCTT-CGCCAGAGGTSalⅠ-tADH1-RTTCGACGCGTGCTATTACGCCAGCTGAAT-TGCrtYB-YAN-F tHMG1-FCATACTACGTACAAACACGCCCrtZ-FAATCACTGCCGTTAATTAAAGATCTC-CGCGGGGCrtZ-RGCATTCCAAATCCACAACATGCGCrtZ-TEF1p-FCAACATGCGGCCGCGCTAGTTCTAGAACrtZ-TEF1p-RAGGAGTAGAAACATTTTGAAGCTATGTA-ATACGACTCACYHR210C-L-FCATAAGCAACTCTCATACCAGTTTTAGA-GCTAGAAATAGCAAGTTAAAAYHR210C-L-RCTAAAACTGGTATGAGAGTTGCTTATGAT-CATTTATCTTTCACTGCGGAGAAGTYHR210C-R-FATCGAATGGACCGCTCAAGGTGGTTTTAG-AGCTAGAAATAGCAAGTTAAAATYHR210C-R-RTCTAAAACCACCTTGAGCGGTCCATTCGA-TCATTTATCTTTCACTGCGGAGAA
1.1.2 培养基
本实验培养大肠杆菌所用培养基为LB(g/L):酵母粉5,蛋白胨10,NaCl 10;培养酿酒酵母所用培养基为YPD(g/L):酵母粉 10,蛋白胨20,葡萄糖20。
1.1.3 母液配制
抗生素母液:氨苄青霉素、硫酸诺尔斯菌素、潮霉素、遗传霉素母液质量浓度分别按照500、100、100、500 mg/mL配制,以0.1%(体积分数)添加于培养基中。
1.1.4 酶与试剂盒
2×Taq PCR Master Mix、Phanta® Max Super-Fidelity DNA polymerase、FastPure Plasmid Mini Kit,诺唯赞生物科技(南京)有限公司;Fast DigestedTM、Solution 1,赛默飞世尔科技公司;T4 DNA Ligase,宝日医生物技术(北京)有限公司。
1.2 实验方法
1.2.1 重组菌表达盒的构建
本实验中选用来源于红法夫酵母(Xanthophyllomyces dendrorhous)的番茄红素折叠酶基因CrtYB(AAO73816.1)以及来源于玉米细菌性枯萎病菌(Pantoea stewartii) β-胡萝卜素羟化酶基因CrtZ(PANA_RS21155),按照酿酒酵母密码子偏好性进行优化并规避常用酶切位点,由生工生物工程(上海)股份有限公司合成。
表达盒的构建:1)分别以质粒PUC57-CrtYB、PUC57-CrtZ和pY26为模板扩增CrtYB、CrtZ和ADH1终止子片段。以本实验室保藏的酿酒酵母YPH499基因组为模板,扩增GAL1pr、TEFpr启动子及YHR210C基因的开放阅读框(open reading frame,ORF)和上下游同源臂。2)通过融合PCR将GAL1pr、TEFpr、CrtYB、CrtZ和tADH1终止子链接在一起,使用TA链接法将表达盒子连接在19T(simple)载体上,转化到大肠杆菌JM109中进行PCR验证。3)利用TA连接将靶点YHR210C连带其左右同源臂连接到载体Vector 19T(simple)上,反向PCR扩增连带左右同源臂的载体片段;4)挑取步骤2)验证的菌落接入液体LB培养基,于37 ℃,200 r/min过夜培养后提取质粒并酶切纯化得到目的片段,将该片段与步骤3)扩增出的携带同源臂的载体转化至JM109,进行菌落PCR验证。
1.2.2 转化及筛选方法
本研究利用同源重组的方法进行基因整合,利用醋酸锂转化法将线性化重组片段转入细胞,利用同源重组的机制完成整合,利用表达盒子携带的遗传霉素抗性标签进行重组菌株筛选,将完成转化的菌液涂布至遗传霉素抗性YPD平板上,倒置于30 ℃培养箱至长出转化子,经菌落PCR初步筛选,再通过基因组测序验证后获得整合表达菌株。
1.2.3 重组菌发酵实验
摇瓶培养:挑取转化完成的菌落接种到YPD培养基中,30 ℃,220 r/min培养至对数生长中期,即OD值为0.6~0.8,以10%的接种量接至含50 mL培养基的250 mL摇瓶中,30 ℃,220 r/min进行培养,定时取样对重组菌生长趋势及胞内合成玉米黄质水平进行测定。
发酵罐培养:挑取转化完成的菌落接种至含50 mL YPD培养基的250 mL摇瓶中,48 h后挑选生长状况较好的作为种子液。培养条件:温度30 ℃,pH值为6.5,搅拌转速500 r/min。
1.2.4 生长趋势测定及玉米黄质提取
取2 mL发酵液备用,其中1 mL菌液离心并弃上清液,再使用ddH2O洗涤两次后烘至恒重,称量并计算菌体量。剩余1 mL菌液同样离心洗涤,先加入不小于菌体体积的直径为0.5 mm的玻璃珠,再加入1 mL 氯仿并标记液面高度,振荡10 min使菌体充分破碎,使用锡纸包裹后静置过夜,萃取其中的产物。待菌体颜色褪去后提取溶液过膜。在处理样品的过程中尽量避光防止产物氧化造成损失,存放时也需要放置在阴凉避光的位置。
1.2.5 检测方法
实验中使用岛津20A HPLC,Hypersil ODS-2液相色谱柱,流动相选择V(乙腈)∶V(水)=95∶5,流速1 mL/min,柱温35 ℃,检测波长450 nm,进样量20 μL。
2 结果与分析
2.1 玉米黄质合成途径的构建与发酵
本文中构建的表达盒子如图3所示,利用已经敲除Gal80的酿酒酵母YPH499-tHMG1为出发菌株。敲除Gal80后GAL启动子不再受半乳糖的诱导,但仍受到葡萄糖的部分抑制。表现为前期葡萄糖浓度较高,产物合成基因受到抑制,主要积累菌体,后期葡萄糖浓度下降大量积累产物。将β-胡萝卜素羟化酶(CrtZ)和双功能八氢番茄红素合酶/番茄红素环化酶(CrtYB)组成的玉米黄质合成表达盒子转化至YPH499-tHMG1,替换YHR210C的ORF,之后提取基因组进行PCR验证和测序验证,结果表明重组菌成功构建。
图3 玉米黄质的合成途径的表达盒子结构
Fig.3 Metabolic engineering pathway expression box of zeaxanthin
在YPD培养基中摇瓶培养72 h,发现玉米黄质在60 h积累量最高,为3.4 mg/L,单位细胞产量为0.58 mg/g CDW(图4)。发酵60 h以后,产物玉米黄质的产量急剧下降,可能的原因是产物积累对细胞产生一定的毒性,影响细胞生长,并进一步影响产物在胞内的积累。因此,提高酿酒酵母对玉米黄质的耐受性应该可以增加玉米黄质的积累量。
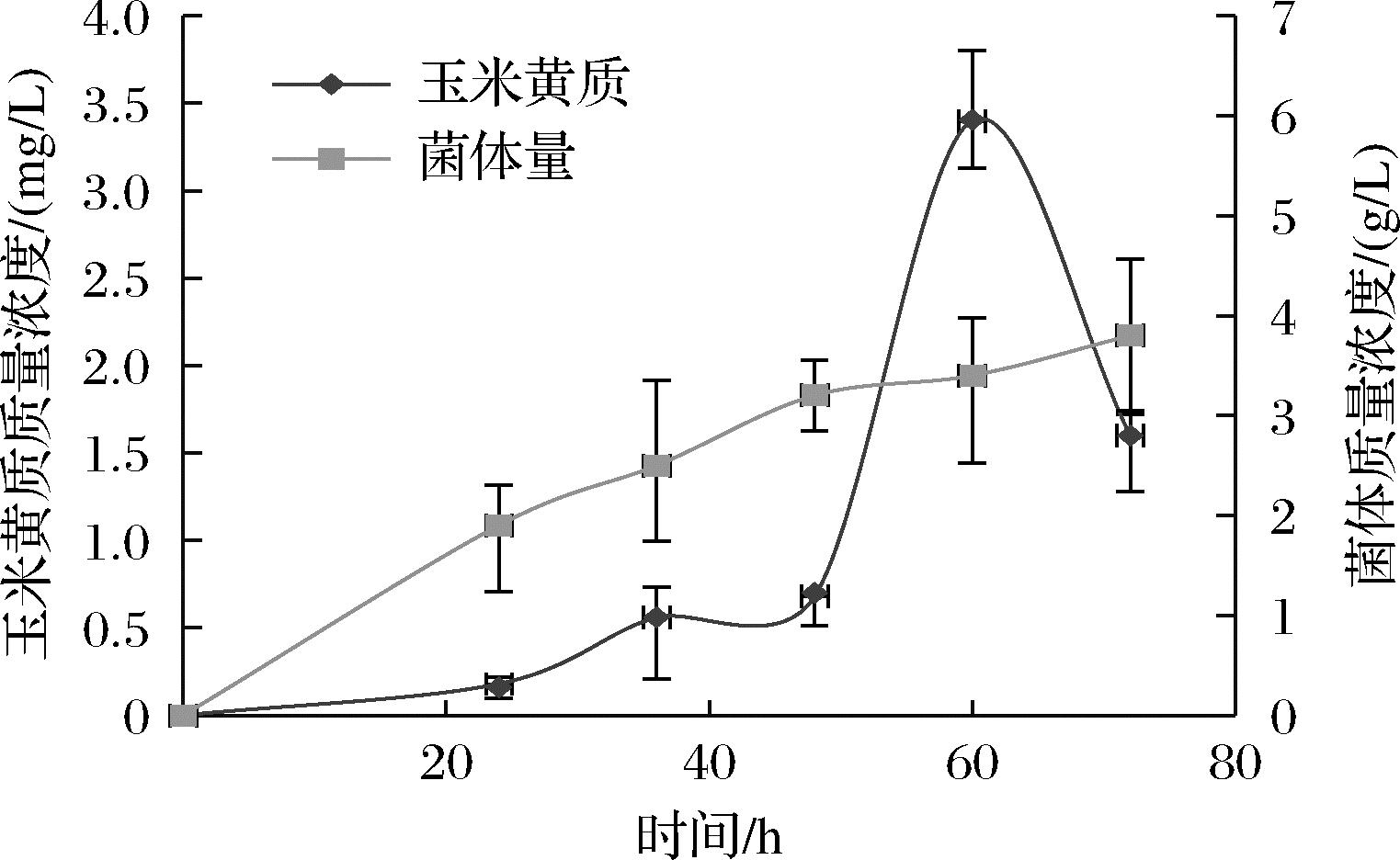
图4 玉米黄质产量及菌体量变化
Fig.4 Changes of zeaxanthin yield and bacterial biomass
2.2 利用脂质体含量提高的重组酵母提高玉米黄质的积累
类胡萝卜素都具有较好的脂溶性,增加酿酒酵母的脂质体表达可以让玉米黄质溶解在脂质载体中。李方迪等[20]通过过量积累酿酒酵母中的脂质载体,将番茄红素的产量提高1.7倍,通过荧光显微镜观察发现番茄红素积累在脂质体上。玉米黄质与番茄红素同属萜类化合物,推测脂质体的过表达对玉米黄质在酿酒酵母中的积累也有类似的作用。因此,利用本实验室已构建的过表达脂质载体的酿酒酵母tHMG1-19,整合上述合成玉米黄质合成酶得到菌株19-09-zea-IB/IE。摇瓶发酵结果表明60 h时的玉米黄质积累到5 mg/L,此时菌体量为3.3 g/L(图5-a)。摇瓶发酵24 h后每24 h补加0.8 mL 500 g/L的葡萄糖,玉米黄质的积累如图5-b所示,玉米黄质产量提高到16 mg/L,此时的菌体量为5.3 g/L。
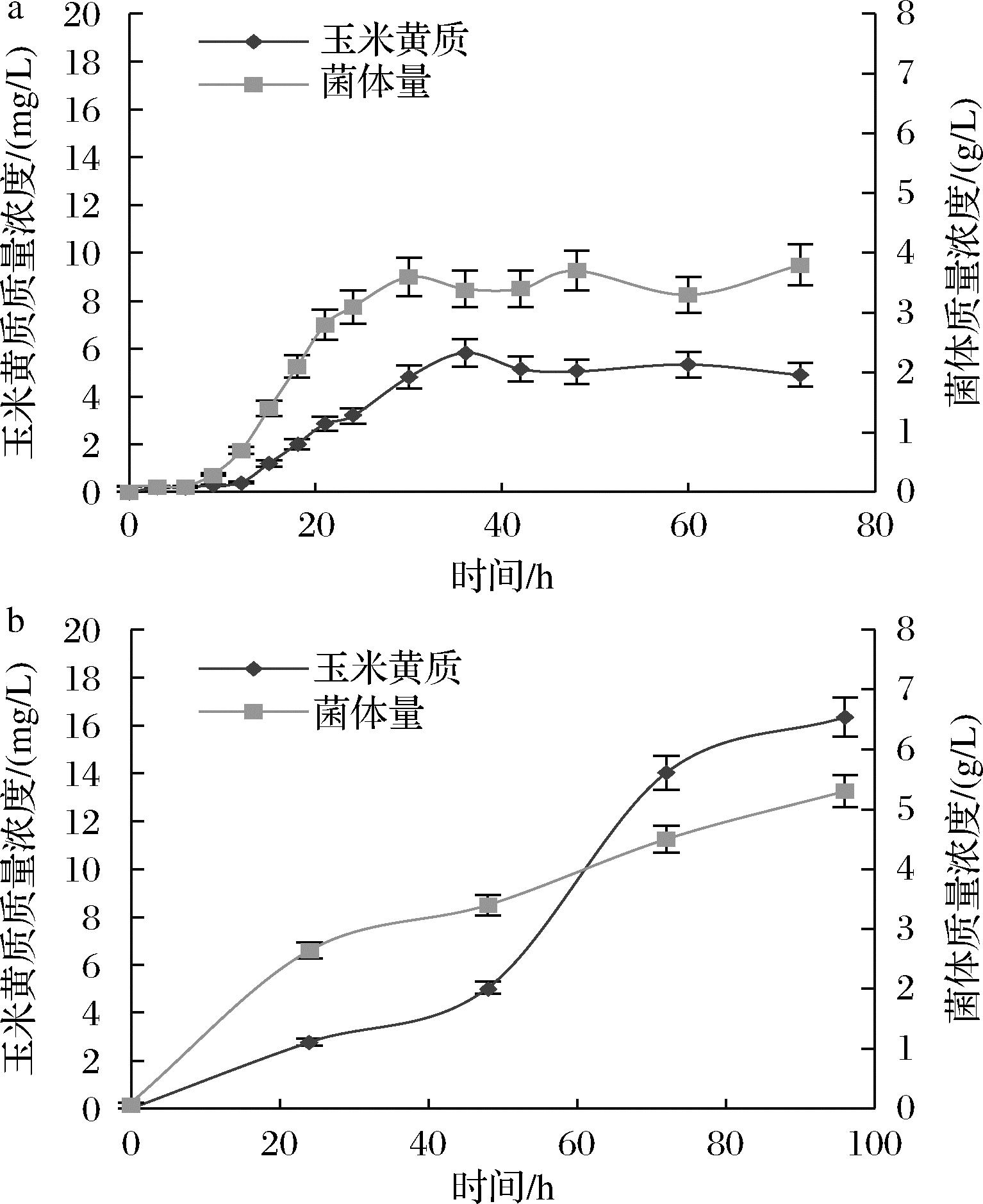
a-未补加葡萄糖时;b-补加葡萄糖时
图5 过表达脂质载体的酿酒酵母中玉米黄质的产量以及菌体量变化
Fig. 5 Changes of zeaxanthin yield and bacterial biomass in Saccharomyces cerevisiae overexpressing lipid carriers
2.3 补加半乳糖发酵产玉米黄质酿酒酵母
GAL作为玉米黄质合成酶在表达时利用的启动子,受到半乳糖调控,半乳糖浓度提高,GAL启动子表达强度也会相应提高,因此尝试使用半乳糖代替葡萄糖作为补料碳源进行摇瓶培养,结果如图6所示。菌体生长状态相比补加葡萄糖有较大的区别,玉米黄质产量在72 h最高,为8 mg/L,此时的细胞菌体量为4.9 g/L。但在补加葡萄糖的发酵培养实验中,玉米黄质产量在此后仍有较大幅度的提高。此外,本实验室已有研究中发现,流加乙醇作为碳源能有效提高番茄红素的积累[20],因此本研究中也尝试使用分批补加乙醇的方式进行发酵,在发酵培养24 h后每24 h补加1 mL 37.5%(体积分数)的乙醇。结果如图6-b所示,玉米黄质产量在96 h最高,仅为2.6 mg/L,此时的菌体量仅有3 g/L。因此本研究采用流加葡萄糖的方法进行下一步上罐实验。
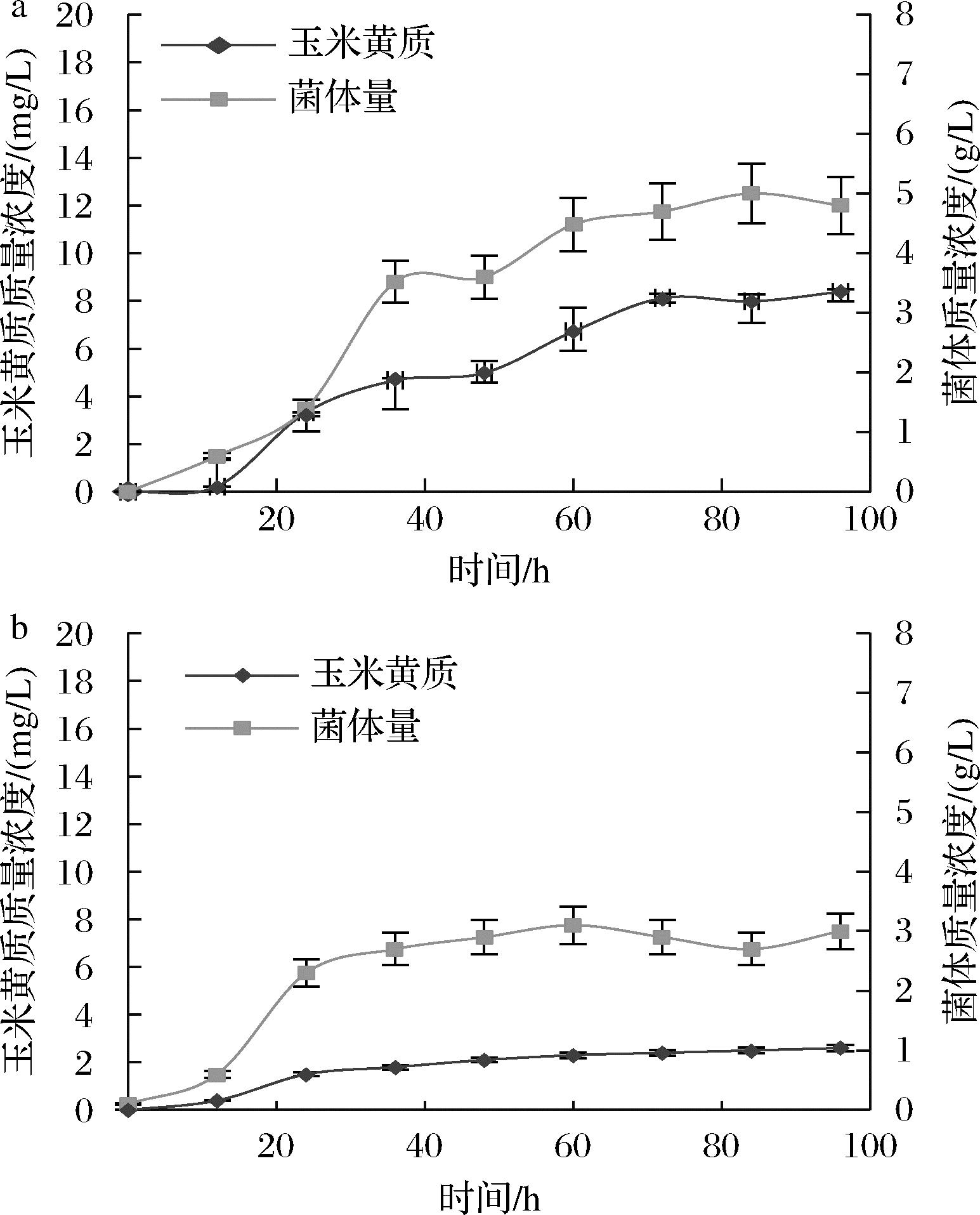
a-补加半乳糖;b-补加乙醇
图6 补加不同碳源时的玉米黄质的产量以及菌体量
Fig.6 Changes in the yield of zeaxanthin and bacterial biomass under different carbon sources
2.4 5 L罐发酵培养重组酿酒酵母生产玉米黄质
菌株19-09-zea-IB/IE在5 L发酵罐中进行发酵。分别24、36、48、60 h开始以2.5 g/h的速度恒速流加葡萄糖,发酵的总时长为168 h。对玉米黄质产量、菌体生长情况进行测定,如图7所示,不同时间开始补加葡萄糖时,都检测到了乙醇和葡萄糖在后期的积累。从24、36、48 h 开始流加葡萄糖,玉米黄质分别在168、144、144 h产量最高,分别为32.5、38.3、42.3 mg/L。60 h开始流加玉米黄质产量急剧下降,细胞菌体量也有明显降低,因此选取48 h为起始流加时间。
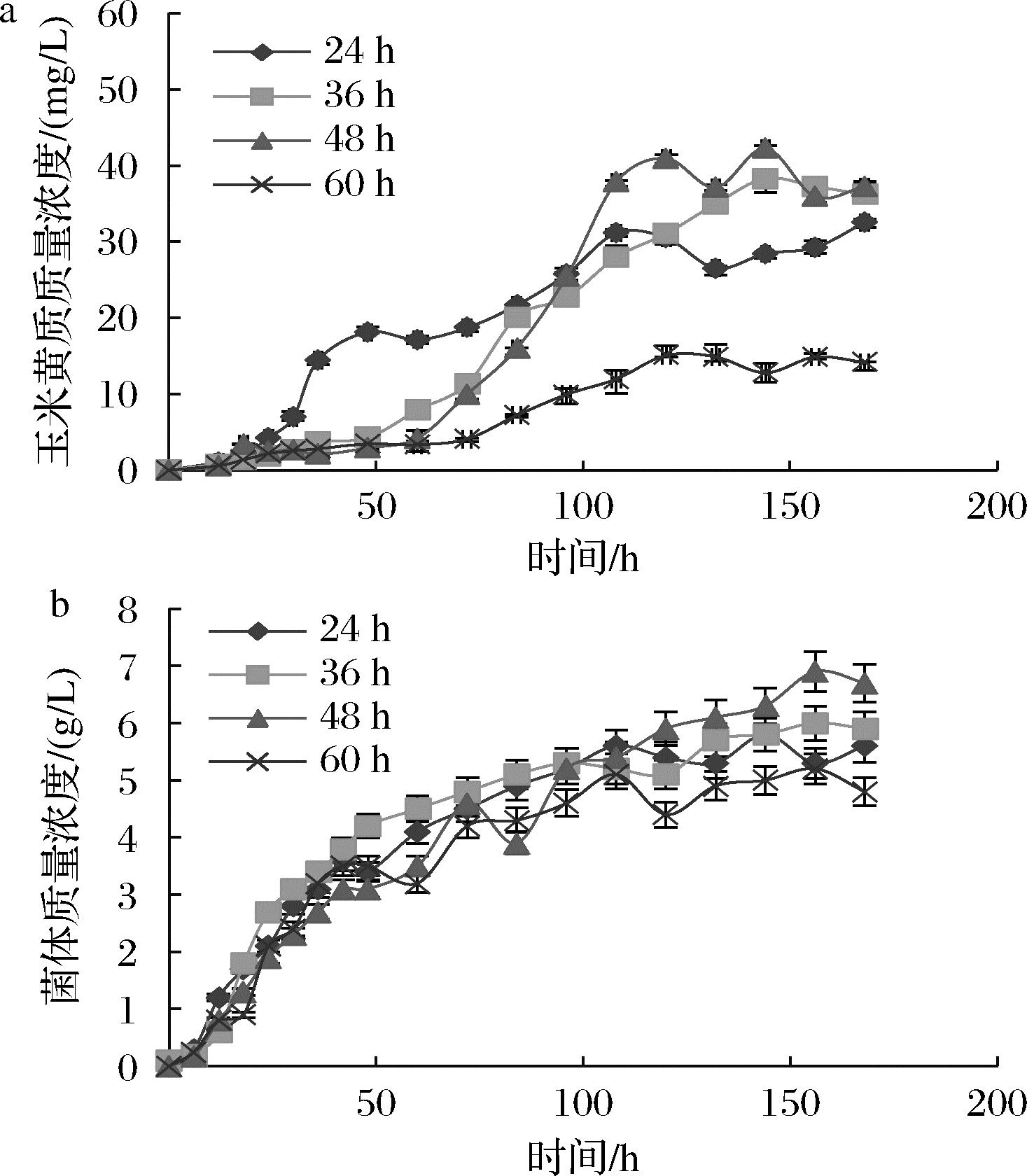
a-玉米黄质产量;b-菌体量
图7 不同时间开始补加葡萄糖时的玉米黄质产量和菌体量
Fig.7 Yield of zeaxanthin and microbial biomass at different times of glucose supplementation
进一步尝试采用指数流加的方式维持酵母细胞的持续生长,进而获得更高的产物积累和菌体量。根据之前的发酵罐实验中获得的数据计算得出在本次研究中应用在发酵罐上的指数流加参数分别为μ=0.028 8 h-1,k0=0.006 L/h,流加起始时间为48 h,葡萄糖质量浓度250 g/L。玉米黄质的产量以及菌体量如图8所示。玉米黄质产量在144 h最高达到47.7 mg/L,菌体量为6.5 g/L,相比48 h开始恒速流加葡萄糖时的玉米黄质产量有所提高,因此利用指数流加的方法对酿酒酵母合成玉米黄质更为有效。
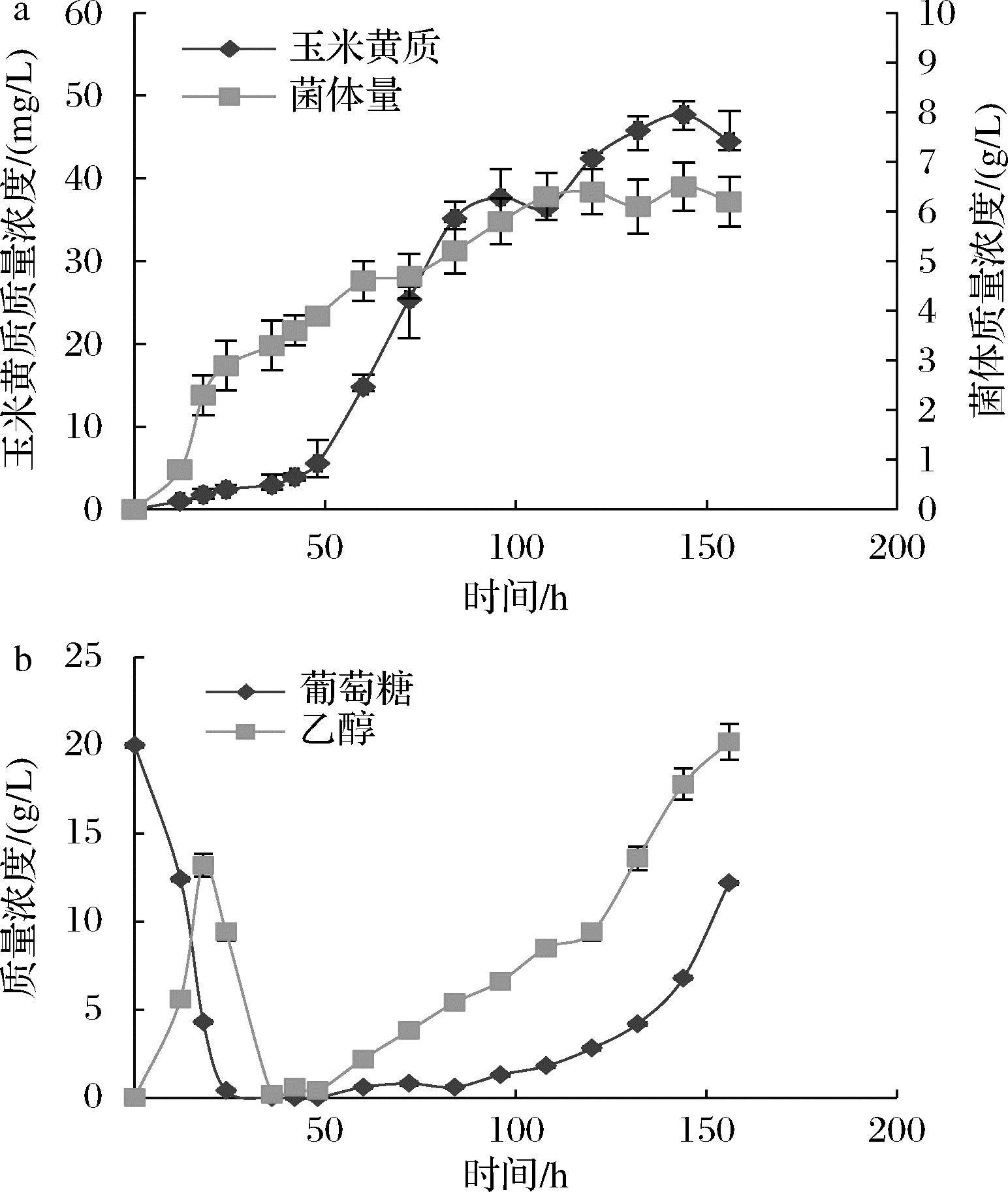
a-玉米黄质产量以及菌体量;b-罐内物质积累量
图8 指数流加葡萄糖时的玉米黄质产量、 菌体量以及罐内物质积累量
Fig.8 Yield of zeaxanthin, bacterial biomass, and accumulation of substances in the tank under exponential-feeding
3 结论与讨论
酿酒酵母适于生产玉米黄质。已有研究表明,一些微生物能够积累大量的脂质载体,产物附着其上能够降低对细胞的毒性[14]。本研究利用前期构建的脂质体积累工程菌,使产物玉米黄质的产量提高1.5倍。以葡萄糖为碳源进行补料,发现48 h开始补料产量最高。结合前期实验,优化了补料方法,以指数流加方式维持酵母细胞的进一步持续生长和产物的积累,最终玉米黄质产量在144 h最高,达到47.7 mg/L,此时菌体质量浓度为6.5 g/L。
目前,国内外对玉米黄质生产的研究较少,普遍产量较低。本研究发现即使以指数流加的方式进行葡萄糖补料,达到的最高菌体量依旧较低。因此,玉米黄质产量不高的主要瓶颈在于菌体浓度过低。由于YPH499是多重氨基酸营养缺陷型菌株,虽然实验采用YPD完全培养基,但其氨基酸含量可能仍然低于细胞生长和产物合成所需,因此后续可以通过敲入缺失的氨基酸合成必需基因,使其成为非营养缺陷型菌株,并进一步优化发酵培养基、补料策略等,提高重组菌玉米黄质的产量。
[1] KRINSKY N I.Possible biologic mechanisms for a protective role of xanthophylls[J].The Journal of Nutrition, 2002, 132(3):540S-542S.
[2] KRINSKY N I, LANDRUM J T, BONE R A.Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye[J].Annual Review of Nutrition, 2003, 23:171-201.
[3] MARES-PERLMAN J A, MILLEN A E, FICEK T L, et al.The body of evidence to support a protective role for lutein and zeaxanthin in delaying chronic disease[J].The Journal of Nutrition, 2002, 132(3):518S-524S.
[4] TABUNOKI H, SUGIYAMA H, TANAKA Y, et al.Isolation, characterization, and cDNA sequence of a carotenoid binding protein from the silk gland of Bombyx mori larvae[J].Journal of Biological Chemistry, 2002, 277(35):32133-32140.
[5] LI Z X, CHEN Q Q, TANG J L, et al.Integrating balanced mevalonate pathway into chromosome for improving lycopene production in Escherichia coli[J].Chinese Journal of Biotechnology, 2019, 35(3):404-414.
[6] 任龙. Blakeslea trispora产番茄红素菌株的选育及优化[D].武汉:华中农业大学, 2007. REN L.Screening and optimizing of Blakeslea trispora strains for producing lycopene[D].Wuhan:Huazhong Agricultural University, 2007.
[7] TOYODA Y, THOMSON L R, LANGNER A, et al.Effect of dietary zeaxanthin on tissue distribution of zeaxanthin and lutein in quail[J].Investigative Ophthalmology &Visual Science, 2002, 43(4):1210-1221.
[8] HSU Y W, TSAI C F, CHEN W K, et al.Determination of lutein and zeaxanthin and antioxidant capacity of supercritical carbon dioxide extract from daylily (Hemerocallis disticha)[J].Food Chemistry, 2011, 129(4):1813-1818.
[9] LIAU B C, HONG S E, CHANG L P, et al.Separation of sight-protecting zeaxanthin from Nannochloropsis oculata by using supercritical fluids extraction coupled with elution chromatography[J].Separation and Purification Technology, 2011, 78(1):1-8. [10] CATALDO V F, L PEZ J, C
PEZ J, C RCAMO M, et al.Chemical vs.biotechnological synthesis of C13-apocarotenoids:Current methods, applications and perspectives[J].Applied Microbiology and Biotechnology, 2016, 100(13):5703-5718.
RCAMO M, et al.Chemical vs.biotechnological synthesis of C13-apocarotenoids:Current methods, applications and perspectives[J].Applied Microbiology and Biotechnology, 2016, 100(13):5703-5718.
[11] MANTZOURIDOU F, TSIMIDOU M Z.Lycopene formation in Blakeslea trispora.Chemical aspects of a bioprocess[J].Trends in Food Science &Technology, 2008, 19(7):363-371.
[12] CHOUDHARI S M, ANANTHANARAYAN L, SINGHAL R S.Use of metabolic stimulators and inhibitors for enhanced production of β-carotene and lycopene by Blakeslea trispora NRRL 2895 and 2896[J].Bioresource Technology, 2008, 99(8):3166-3173.
[13] DIRETTO G, AHRAZEM O, RUBIO-MORAGA  , et al.UGT709G1:A novel uridine diphosphate glycosyltransferase involved in the biosynthesis of picrocrocin, the precursor of safranal in saffron (Crocus sativus)[J].The New Phytologist, 2019, 224(2):725-740.
, et al.UGT709G1:A novel uridine diphosphate glycosyltransferase involved in the biosynthesis of picrocrocin, the precursor of safranal in saffron (Crocus sativus)[J].The New Phytologist, 2019, 224(2):725-740.
[14] MA T, SHI B, YE Z L, et al.Lipid engineering combined with systematic metabolic engineering of Saccharomyces cerevisiae for high-yield production of lycopene[J].Metabolic Engineering, 2019, 52:134-142.
[15] BHOSALE P, LARSON A J, BERNSTEIN P S.Factorial analysis of tricarboxylic acid cycle intermediates for optimization of zeaxanthin production from Flavobacterium multivorum[J].Journal of Applied Microbiology, 2004, 96(3):623-629.
[16] ASKER D, BEPPU T, UEDA K.Mesoflavibacter zeaxanthinifaciens gen.nov., sp.nov., a novel zeaxanthin-producing marine bacterium of the family Flavobacteriaceae[J].Systematic and Applied Microbiology, 2007, 30(4):291-296.
[17] SUN J, SHAO Z Y, ZHAO H M, et al. Cloning and characterization of a panel of constitutive promoters for applications in pathway engineering in Saccharomyces cerevisiae[J]. Biotechnology and Bioengineering, 2012, 109(8):2082-2092.
[18] LIANG J, NING J C, ZHAO H M Coordinated induction of multigene pathways in Saccharomyces cerevisiae[J]. Nucleic Acids Research, 2013, 41(4) :1-10.
[19] SINGH D, BARROW C J, MATHUR A S, et al. Optimization of zeaxanthin and β-carotene extraction from Chlorella saccharophila isolated from New Zealand marine waters[J]. Biocatalysis and Agricultural Biotechnology, 2015, 4(2):166-173.
[20] 李方迪, 李由然, 张梁, 等.代谢改造酿酒酵母生产番茄红素[J].食品与发酵工业, 2022, 48(23):25-33. LI F D, LI Y R, ZHANG L, et al.Metabolic engineering of Saccharomyces cerevisiae for lycopene production[J].Food and Fermentation Industries, 2022, 48(23):25-33.