红酸汤属于蔬菜类发酵食品[1],主要以辣椒和番茄为原料发酵制成,因色泽诱人、酸辣适口以及富含多种营养功能成分,成为贵州省内苗族、侗族的一种特色传统美食。但传统红酸汤发酵周期1个月到12个月不等,容易引起微生物菌群波动,导致发酵红酸汤风味及品质不稳定,这已成为制约红酸汤发展的关键技术瓶颈。民间常见传统发酵工艺是由红辣椒和番茄分别辅以糯米饭、食盐、大蒜等发酵制成“番茄酸汤”和“辣椒酸汤”半成品,再按1∶1比例混合进行二次发酵制成红酸汤[2],即分料发酵工艺。另一种是直接将番茄、辣椒、糯米、食盐等混合发酵,即混料发酵工艺。值得注意的是,分料发酵工艺是通过番茄酸汤和辣椒酸汤分料发酵后再将二者混合发酵,更多的、复杂的微生物群落物种在适宜环境下相互作用后发酵产生有机酸、氨基酸等风味成分,从而最大限度保持或增加红酸汤的风味品质。
发酵红酸汤因其不同的发酵环境和生态系统,导致微生物菌群结构不同,但乳杆菌科(Lactobacillaceae)和酵母科(Saccharomycetaceae)作为共性优势菌,在红酸汤发酵中发挥着重要作用。何扬波等[3]表明纳木雷氏乳杆菌(Lactobacillus namurensis)和戊糖乳杆菌(Lactobacillus pentosus)分别为辣椒酸汤和番茄酸汤的优势乳酸菌,汉逊德巴利酵母(Debaryomyces hansenii)和膜璞毕赤酵母(Pichia membranifaciens)分别为两种酸汤发酵后期的优势真菌。LIN等[4]发现德凯拉菌属(Dekkera)和毕赤酵母属(Pichia)是番茄酸汤中的主要优势菌,酵母菌属和毕赤酵母属是辣椒酸汤中的主要真菌,毕赤酵母属是另一种番茄酸汤中的主要真菌。王琪琪等[5]发现辣椒红酸汤和番茄红酸汤的优势细菌为乳杆菌属(Lactobacillus)、片球菌属(Pediococcus),辣椒红酸汤的优势真菌为Kazachstania、酵母属、双足囊菌属(Dipodascus)、毕赤酵母属,番茄红酸汤的优势真菌为Kazachstania、毕赤酵母属。宫路路等[6]发现凯里红酸汤3个样品细菌群落多样性各有差异,ST9和ST10样品优势菌属为乳酸杆菌属,ST22样品优势细菌主要为假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、Aeribacillus等。
除高通量测序外,研究者还用传统培养的方法,对微生物优势功能微生物进行筛选、分离、鉴定。田永峰[7]在苗酸汤中筛选出了pH下降快、产酸率高的嗜酸乳杆菌,但并未对菌株产酸量进行研究。张玉龙等[8]从红酸汤筛选出产胞外多糖和抗氧化能力的葡萄球菌H1(Staphylococcus H1),但未对其产酸能力进行研究。郑莎莎等[9]采用红酸汤中优势菌干酪乳杆菌H1(Lactobacillus casei H1)和鼠李糖乳杆菌H3(Lactobacillus rhamnosus H3)强化发酵红酸汤,但未见菌种特性的报道。XIONG等[10]从凯里红酸汤中筛选出优势菌种布氏乳杆菌H9(Lactobacillus buchneri H9),产酸能力为(3.268±0.016) g/L。贺晓洁等[11]从传统发酵辣椒酸汤中筛选出1株耐盐植物乳杆菌L-14(Lactobacillus plantarum L-14),并测得产酸量为(7.770±0.033) g/L。上述研究中仅对红酸汤及其半成品的微生物进行了优势菌种的筛选,局限于红酸汤微生物区系的探讨和菌株的产酸性能研究,对酸汤中菌株的益生特性研究较少。近年来,具备胃肠道耐受性和抗氧化能力的菌株备受关注,相关研究大多集中在泡菜和乳品中乳酸杆菌的耐酸、耐胆盐和抗氧化性能[12-14]方面,而鲜有关于红酸汤中功能益酵菌株的相关报道。
本研究分别以分料发酵的优质番茄酸汤、辣椒酸汤和混合酸汤为菌源,分离筛选并鉴定出益酵乳酸菌和酵母菌,并研究其应用特性,初步构建一种可应用于红酸汤强化发酵模式的级联发酵体系,为人工接种乳酸菌和酵母菌强化发酵红酸汤提供理论应用价值。
1 材料与方法
1.1 材料与试剂
样品:贵州南山婆食品加工有限公司2020年下半年所产分料发酵红酸汤的3个组成部分,分别是TA1、TA2和TA3(番茄酸汤),CA1和CA2(辣椒酸汤),MA1和MA2(混合酸汤),均于2021年11月采集,4 ℃条件下运往实验室。
材料与试剂:牛胆盐、美蓝染液、革兰氏染色试剂套盒、抗氧化能力检测试剂盒[羟自由基(·OH)、DPPH自由基和ABTS阳离子自由基清除能力],北京索莱宝科技有限公司;MRS、PDA、YPD琼脂培养基和MRS、PDB、YEPD液体培养基,上海博微生物科技有限公司;NaCl、H2O2、NaOH、丙三醇、浓盐酸等均为国产分析纯,天津市致远化学试剂有限公司。
1.2 仪器与设备
DMEX20电子显微镜,宁波舜宇仪器有限公司;SW-CJ-2D0双人净化工作台,浙江苏净净化设备有限公司;HH-B11600BY电热恒温生化培养箱,上海跃进医疗器械有限公司;Spectra Max 190光吸收酶标仪,美谷分子有限公司;ZWY-C2112B恒温摇床,上海智城分析仪器制造有限公司;L5S紫外-可见分光光度计,上海仪电分析仪器有限公司;LDZF-75KB-Ⅱ立式压力蒸汽灭菌锅,上海申安医疗器械厂。
1.3 实验方法
1.3.1 采样
取样品封存至无菌采样瓶中,分别是TA1、TA2和TA3(番茄酸汤),CA1和CA2(辣椒酸汤),MA1和MA2(混合酸汤),均以4 ℃保存运往实验室。
1.3.2 乳酸菌和酵母菌的分离纯化
将样品用无菌生理盐水稀释至合适的浓度梯度,分别涂布在MRS琼脂培养基上37 ℃厌氧培养48 h,在PDA琼脂培养基上30 ℃培养3~5 d,分别挑出疑似乳酸菌和酵母菌的菌落,用平板划线法进一步纯化,重复纯化4~5次,直到获得单个菌落。分别将纯化的单个菌落保存在4 ℃的MRS斜面培养基和YPD斜面培养基中直至使用,每4周进行一次传代培养。
1.3.3 菌株形态和微观结构
将在MRS琼脂培养基上厌氧培养得到的疑似乳酸菌的菌落固定到干净的载玻片上,进行革兰氏染色,置于显微镜下观察细菌形态并拍照记录,紫色和红色分别代表革兰氏阳性和革兰氏阴性。同时进行过氧化氢酶测试,在超净工作台用接种环挑取菌落于干净的载玻片上,加入质量分数为3% H2O2溶液,30 s内出现气泡为过氧化氢酶阳性,反之为阴性。将过氧化氢酶阴性和革兰氏阳性的菌株暂视为乳酸菌。将在PDA琼脂培养基上得到的疑似酵母菌的菌落固定到干净的载玻片上,用美蓝染液染色后于显微镜下观察真菌形态并拍照记录,具有典型酵母特征的菌株暂视为酵母菌。通过菌株形态和生理生化特征筛选暂视为乳酸菌和酵母菌的菌株保存在4 ℃斜面培养基和-80 ℃冻存管中。
1.3.4 益酵菌株的筛选和功能特性
1.3.4.1 乳酸菌耐酸耐胆盐能力的测定
参考LIU等[15]的方法按照3%接种量将活化的乳酸菌种子液分别接种到pH 2.0和pH 3.0的MRS液体培养基中,含0.3 g/L和0.6 g/L牛胆盐的MRS液体培养基中,于37 ℃培养16 h后测定菌株的OD600nm。
1.3.4.2 乳酸菌和酵母菌产酸能力的测定
根据ZHENG等[16]的方法稍作修改,吸取10.0 mL菌液于100 mL容量瓶中,加水至刻度,混匀。吸取20.0 mL,置于200 mL烧杯中,加60 mL水,开动磁力搅拌器,用NaOH标准滴定溶液滴定至酸度计指示pH 8.2,同时做空白实验。
1.3.4.3 产香酵母的筛选
将活化的酵母菌种子液在恒温摇床(30 ℃,120 r/min)中培养1 d,参考文献[17-20]用感官嗅闻法筛选产香酵母并稍作修改,请10位食品专业品评人员将样品置于鼻孔下方,嗅闻挥发的香气,进行香气评价,主要内容如表1所示,主要包括勾选香气类型和香气浓淡、选填香气描述,统计结果以票数过半(n≥5)的香气评价为准,以此筛选有较浓酯香或特殊果香的酵母菌株。
表1 香气评价表
Table 1 Aroma evaluation form

项目选项香气类型□醇香 □酯香 □水果香 □无特殊香香气浓淡□浓郁 □较浓 □较淡 □清淡香气描述选填(包括但不限于清新、酸、甜等描述)
1.3.4.4 乳酸菌和酵母菌抗氧化性能的测定
将所筛选出的菌株种子液用·OH清除能力检测试剂盒、DPPH自由基清除能力检测试剂盒和ABTS阳离子自由基清除能力检测试剂盒测定菌株相应抗氧化能力,按照试剂盒的说明操作和计算。
1.3.5 菌种鉴定和构建系统发育树
分别按Ezup柱式细菌基因组DNA抽提试剂盒和Ezup柱式酵母基因组DNA抽提试剂盒提取基因组,用细菌通用引物27 F和1492 R扩增细菌的16S rDNA序列,用酵母通用引物NL1和NL4扩增酵母的26S rDNA D1/D2区序列,PCR产物测序后在核糖体数据库上进行BLAST对比。设置Bootstrap method重复抽样次数为1 000,Gaps/Missing Data Treatment 采用Pairwise deletion模型。在NCBI GenBank数据库中进行BLAST分析,用ClustalX软件进行多序列比对(multiple alignments),并用Mega软件构建系统,采用NJ法构建系统发育树。
1.3.6 级联发酵模式菌株生长初探
参考张东亚[2]和韦明明[21]的红酸汤制作方法稍作修改。无损伤的本地新鲜番茄洗净破碎备用,添加6%食盐,2%糯米饭,3%菌株lt1-6的二代种子液,30 ℃发酵制得番茄酸汤,发酵96 h期间每12 h涂布1次计算乳酸菌活菌数并测番茄酸汤的pH值;无损伤的新鲜红美人辣椒、姜、大蒜洗净破碎备用,添加7%食盐,3%姜,2%大蒜、4%糯米饭和3%菌株lc2-1的二代种子液,30 ℃发酵制得辣椒酸汤,发酵96 h期间每12 h涂布1次计算乳酸菌活菌数并测辣椒酸汤的pH值;将发酵了96 h的番茄酸汤和辣椒酸汤按照1∶1的比例混合均匀,添加5%菌株ym1-3的二代种子液,30 ℃发酵制得混合酸汤继续发酵,发酵96 h期间每12 h涂布1次计算酵母菌活菌数并测混合酸汤的pH值。参照何扬波等[3]用酸度计测量样品pH值;乳酸菌和酵母菌计数分别参照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》和GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》。
2 结果与分析
2.1 菌株形态及微观结构
从图1乳酸菌的菌落形态和显微镜下的菌株微观结构可以看到不同乳酸菌呈现出球形、短棒状、中棒状、长棒状和椭圆形等形态,初步筛选出43株乳酸菌。从图2酵母菌的菌落形态和显微镜下的菌株微观结构可以看到不同酵母菌呈现出了变色、淡黄色等菌落形态;显微镜下呈现出球形、米粒状等形态,初步筛选出28株酵母菌。

图1 乳酸菌菌落形态及微观结构
Fig.1 Colony morphology and microstructure of lactic acid bacteria
注:分别以6种、9种为例(图2同)。
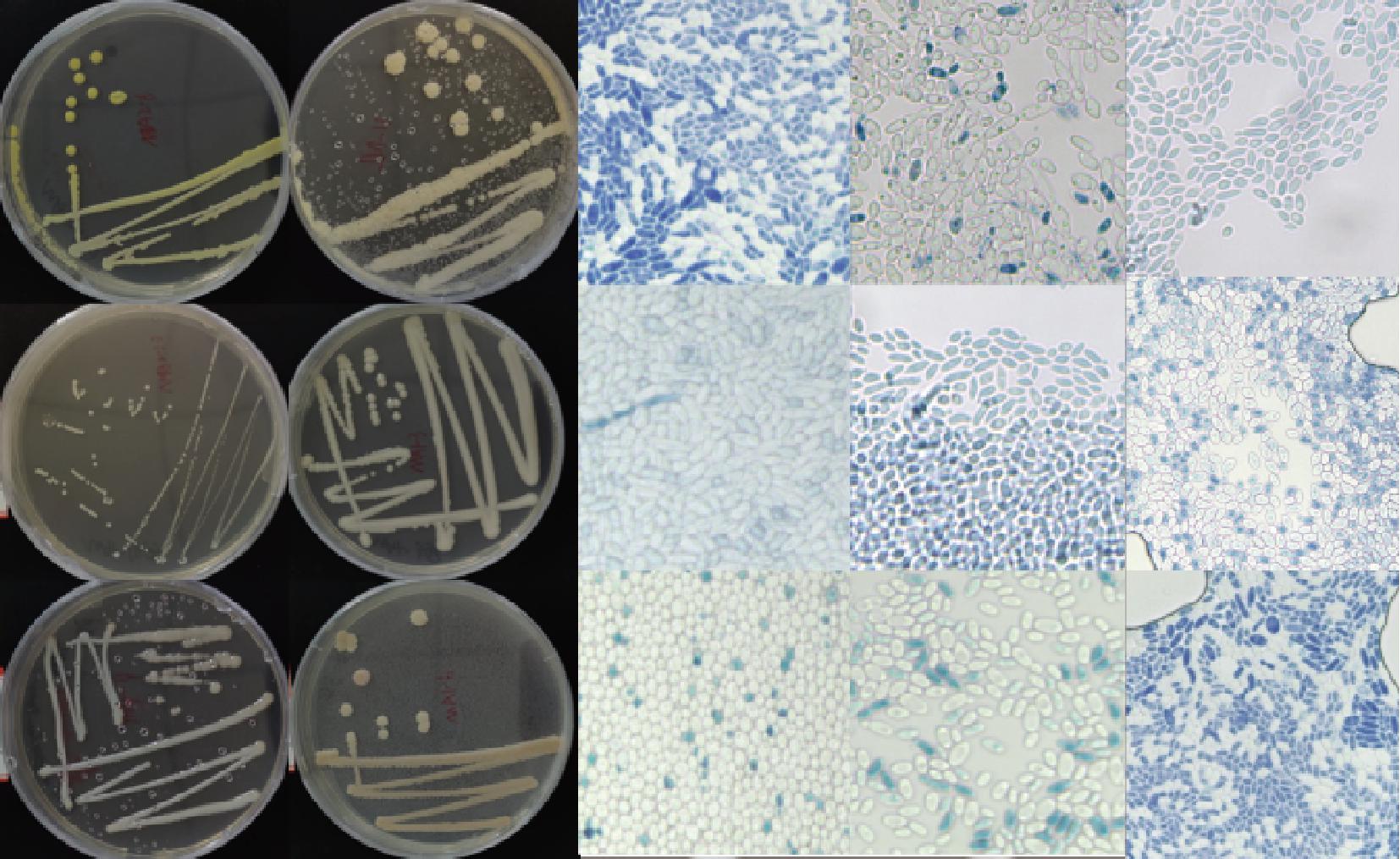
图2 酵母菌菌落形态及微观结构
Fig.2 Colony morphology and microstructure of yeast
2.2 乳酸菌耐酸耐胆盐能力分析
通过微生物传统分离培养法分离纯化样品中的可培养微生物,结合本课题组前期研究的高通量测序结果,主要筛选红酸汤中的乳酸菌和酵母菌。通过菌落形态、显微镜微观结构、生理生化特征等,筛选出了26株乳酸菌进行pH 3.0和2.0下的耐酸能力和胆盐质量浓度0.3、0.6 g/L下的耐胆盐能力测定。食物经胃液消化,pH值通常为3.0左右,随后与肠道内的胆盐接触,胆盐能破坏细胞膜完整度造成细胞死亡,因此耐酸耐胆盐能力是衡量菌株益生特性的重要指标[22]。从表2可以看出菌株在pH 3.0下的耐酸能力要高于pH 2.0下的耐酸能力,在0.3 g/L胆盐浓度下菌种的生长能力要高于0.6 g/L胆盐浓度的菌种生长能力。考虑到从红酸汤不同组成成分中(番茄酸汤、辣椒酸汤和混合酸汤)分别选出益酵菌株,并且耐酸耐胆盐能力均需较好的条件下,选择了的10株优良的乳酸菌(lt1-2、lt1-3、lt1-4、lt1-6、lt1-7、lt3-5、lc2-1、lm1-4、lm2-1和ly-3)进行产酸能力测定。
表2 乳酸菌的耐酸耐胆盐能力(OD600nm)
Table 2 Acid and bile salt tolerance of lactic acid bacteria

菌株吸光度OD600nmpH 3.0pH 2.00.3 g/L胆盐0.6 g/L胆盐lt1-10.435±0.002a0.147±0.001i0.824±0.002f0.980±0.008dlt1-20.121±0.001qr0.112±0.003l0.720±0.002j0.595±0.001mlt1-30.146±0.001o0.135±0.003j0.805±0.003g0.526±0.004olt1-40.090±0.002s0.101±0.002m0.117±0.003s0.114±0.003xlt1-50.125±0.002q0.093±0.003n0.296±0.003o0.121±0.002wlt1-60.165±0.004kl0.136±0.004j1.129±0.004d0.922±0.001flt1-70.120±0.002r0.129±0.001k0.718±0.002j0.574±0.002nlt1-80.087±0.002s0.084±0.005o0.100±0.009t0.105±0.000ylt1-90.138±0.000p0.096±0.003n1.150±0.003c0.314±0.002qlt1-100.163±0.001l0.172±0.003f0.175±0.002r0.197±0.001slt2-20.154±0.001m0.162±0.002gh0.171±0.003r0.175±0.003ult2-30.165±0.001kl0.107±0.003l0.173±0.004r0.190±0.002tlt2-40.201±0.001g0.044±0.001p1.547±0.003a1.549±0.000alt3-10.151±0.001n0.160±0.002h0.172±0.004r0.166±0.001vlt3-20.170±0.005j0.125±0.002k0.700±0.003k1.042±0.002clt3-40.168±0.002jk0.175±0.001f0.274±0.002p0.185±0.002tlt3-50.175±0.002i0.158±0.002h1.271±0.002b0.932±0.003elc2-10.302±0.001c0.329±0.004b1.122±0.003d1.281±0.001blc1-10.162±0.001l0.161±0.003h0.262±0.003q0.288±0.001rlm1-10.259±0.004d0.092±0.003n0.719±0.003j0.689±0.001llm1-20.353±0.000b0.341±0.004a0.391±0.007n0.422±0.002plm1-40.262±0.001d0.167±0.002g0.782±0.009h0.854±0.005glm2-10.190±0.001h0.194±0.003e0.683±0.006l0.756±0.004jlm2-20.179±0.001i0.189±0.001e0.608±0.003m0.720±0.002kly-20.230±0.002e0.233±0.003c0.915±0.006e0.805±0.002ily-30.212±0.001f0.212±0.001d0.760±0.008i0.816±0.003h
注:结果以平均值±标准差表示,重复3次;a~g同一列中的不同字母表示有显著差异(P<0.05)(下同)。
2.3 乳酸菌和酵母菌产酸能力分析
将10株乳酸菌与通过微生物传统分离培养法分离纯化,菌落形态、显微镜微观结构、生理生化特征等筛选出的10株酵母菌进行产酸能力测定,从表3可以发现番茄酸汤中lt1-3、lt1-6、lt3-5产酸能力较好,且目前未见对番茄酸汤的菌株产酸能力的研究报道。辣椒酸汤中lc2-1产酸能力较好,产酸能力[(7.92±0.01) g/kg]优于贺晓洁等[11]从传统发酵辣椒酸汤中筛选出1株耐盐植物乳杆菌L-14产酸能力[(7.770±0.033) g/L]。发酵红酸汤中lm2-1产酸能力较好,为(8.69±0.03) g/kg,优于XIONG等[10]从凯里红酸汤中筛选出优势菌种布氏乳杆菌H9的产酸能力[(3.268±0.016) g/L]。另外,酵母菌的产酸能力都弱于乳酸菌。将此结果与耐酸耐胆盐能力相结合,筛选出了6株乳酸菌进行抗氧化能力测定,10株酵母菌继续进行产香特性分析。
表3 乳酸菌、酵母菌的产酸能力
Table 3 Acid production capacity of lactic acid bacteria and yeast
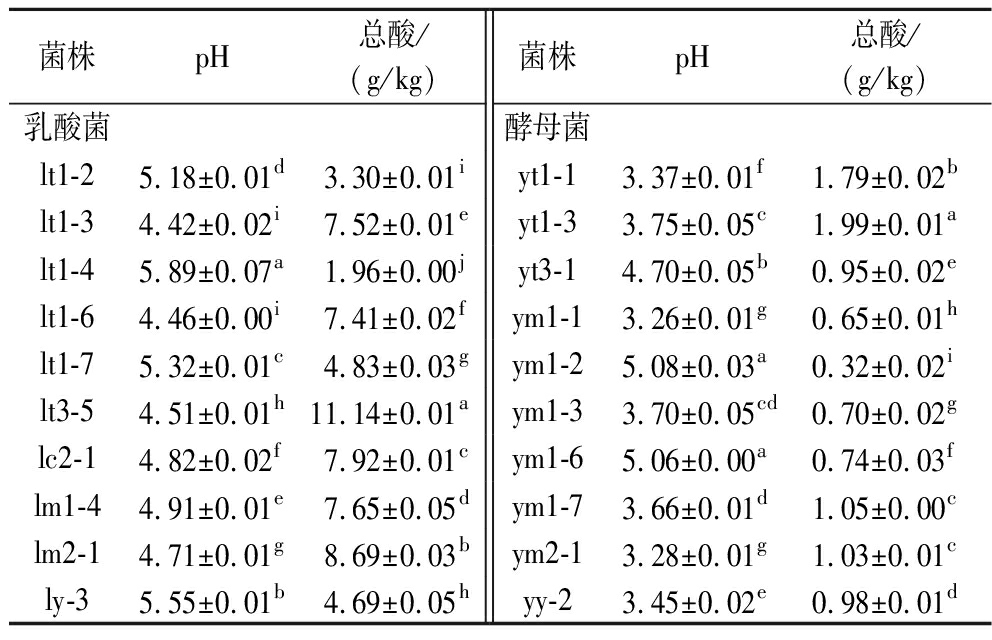
菌株pH总酸/(g/kg)菌株pH总酸/(g/kg)乳酸菌酵母菌lt1-25.18±0.01d3.30±0.01iyt1-13.37±0.01f1.79±0.02blt1-34.42±0.02i7.52±0.01eyt1-33.75±0.05c1.99±0.01alt1-45.89±0.07a1.96±0.00jyt3-14.70±0.05b0.95±0.02elt1-64.46±0.00i7.41±0.02fym1-13.26±0.01g0.65±0.01hlt1-75.32±0.01c4.83±0.03gym1-25.08±0.03a0.32±0.02ilt3-54.51±0.01h11.14±0.01aym1-33.70±0.05cd0.70±0.02glc2-14.82±0.02f7.92±0.01cym1-65.06±0.00a0.74±0.03flm1-44.91±0.01e7.65±0.05dym1-73.66±0.01d1.05±0.00clm2-14.71±0.01g8.69±0.03bym2-13.28±0.01g1.03±0.01cly-35.55±0.01b4.69±0.05hyy-23.45±0.02e0.98±0.01d
2.4 酵母菌的产香能力
根据消费者感官偏好的重要性,香气浓郁、醇香味和鲜味是重要的香气评价指标[23]。通过感官嗅闻法评价酵母菌种子液的香气特征,大多数能产酯香、醇香。表4为10株酵母菌的香气评价表,据此选出7株较优秀的酵母菌(yt1-1、ym1-1、ym1-3、ym1-6、ym1-7、ym2-1和yy-2)进行抗氧化能力的测定,尤其是ym1-3,能产水果香,香气浓郁且细腻清新,产香能力较好,目前未有关于红酸汤及其半成品产香能力菌株的报道。
表4 酵母菌的香气评价
Table 4 Aroma evaluation of yeast
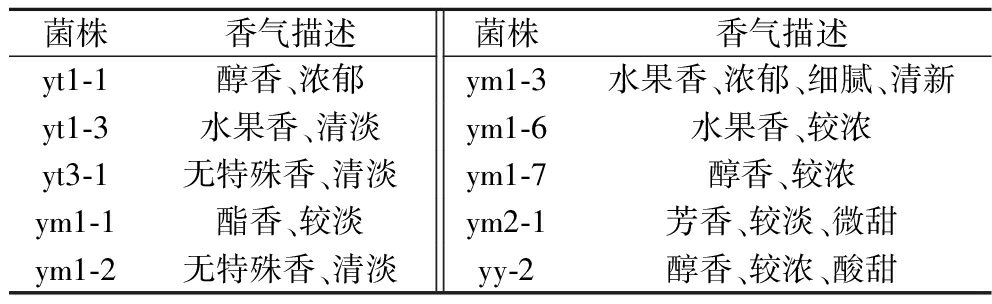
菌株香气描述菌株香气描述yt1-1醇香、浓郁ym1-3水果香、浓郁、细腻、清新yt1-3水果香、清淡ym1-6水果香、较浓yt3-1无特殊香、清淡ym1-7醇香、较浓ym1-1酯香、较淡ym2-1芳香、较淡、微甜ym1-2无特殊香、清淡yy-2醇香、较浓、酸甜
2.5 乳酸菌和酵母菌抗氧化性能分析
由表5和表6可知,菌株的DPPH自由基清除能力较·OH清除能力和ABTS阳离子自由基清除能力较好。综合考虑耐酸耐胆盐、产酸、产香和抗氧化能力后,从番茄酸汤中选择了lt1-6,辣椒酸汤中选择了lc2-1,混合酸汤中选择了ym1-3作为强化发酵菌株。目前对于红酸汤功能菌种的报道研究较少,仅有张玉龙等[8]从红酸汤筛选出的产胞外多糖和抗氧化能力的葡萄球菌H1,但未研究其产酸能力。
表5 乳酸菌的抗氧化能力 单位:%
Table 5 Antioxidant capacity of lactic acid bacteria
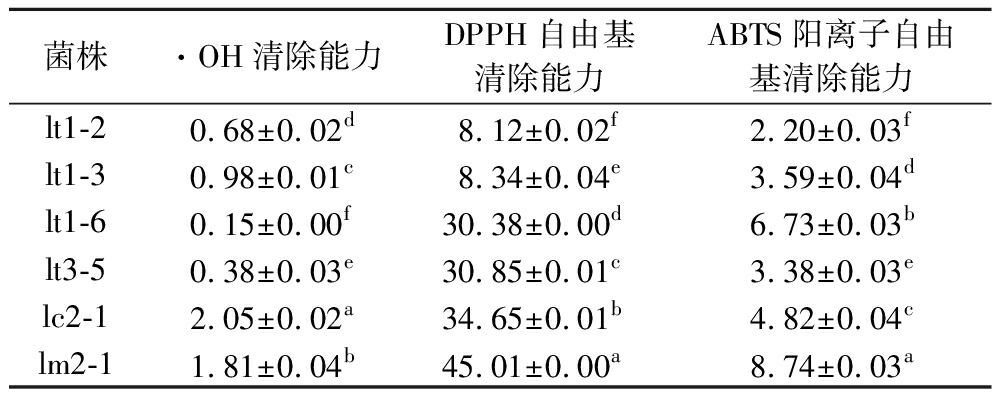
菌株·OH清除能力DPPH自由基清除能力ABTS阳离子自由基清除能力lt1-20.68±0.02d8.12±0.02f2.20±0.03flt1-30.98±0.01c8.34±0.04e3.59±0.04dlt1-60.15±0.00f30.38±0.00d6.73±0.03blt3-50.38±0.03e30.85±0.01c3.38±0.03elc2-12.05±0.02a34.65±0.01b4.82±0.04clm2-11.81±0.04b45.01±0.00a8.74±0.03a
表6 酵母菌的抗氧化能力 单位:%
Table 6 Antioxidant capacity of yeast
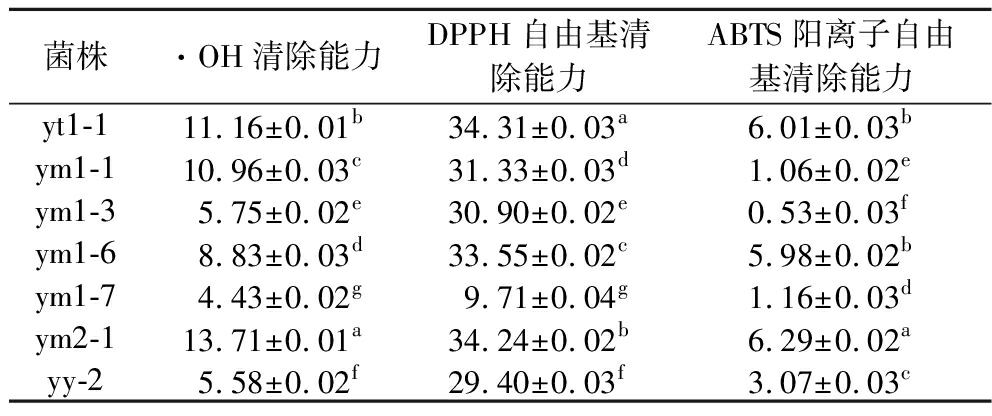
菌株·OH清除能力DPPH自由基清除能力ABTS阳离子自由基清除能力yt1-111.16±0.01b34.31±0.03a6.01±0.03bym1-110.96±0.03c31.33±0.03d1.06±0.02eym1-35.75±0.02e30.90±0.02e0.53±0.03fym1-68.83±0.03d33.55±0.02c5.98±0.02bym1-74.43±0.02g9.71±0.04g1.16±0.03dym2-113.71±0.01a34.24±0.02b6.29±0.02ayy-25.58±0.02f29.40±0.03f3.07±0.03c
2.6 菌种鉴定结果
通过16S rRNA 和26S rRNA序列分析构建系统发育树确定这3株性能优良的菌种lt1-6、lc2-1和ym1-3分别为Lentilactobacillus buchneri、Pediococcus ethanolidurans和Kazachstania bulderi(图3、图4)。对红酸汤中L.buchneri的研究,仅有XIONG等[10]从凯里红酸汤中筛选出优势菌种布氏乳杆菌H9,产酸能力为(3.268±0.016) g/L。刘玉凌等[24]从传统榨菜中分离出的一株发酵性能优良的酵母菌ZH2为Kazachstania bulderi,不产膜,产气、产醇能力强,且能耐受较低pH值和较高盐浓度(10%)。但目前未见P.ethanolidurans和K.bulderi的相关红酸汤筛菌报道。
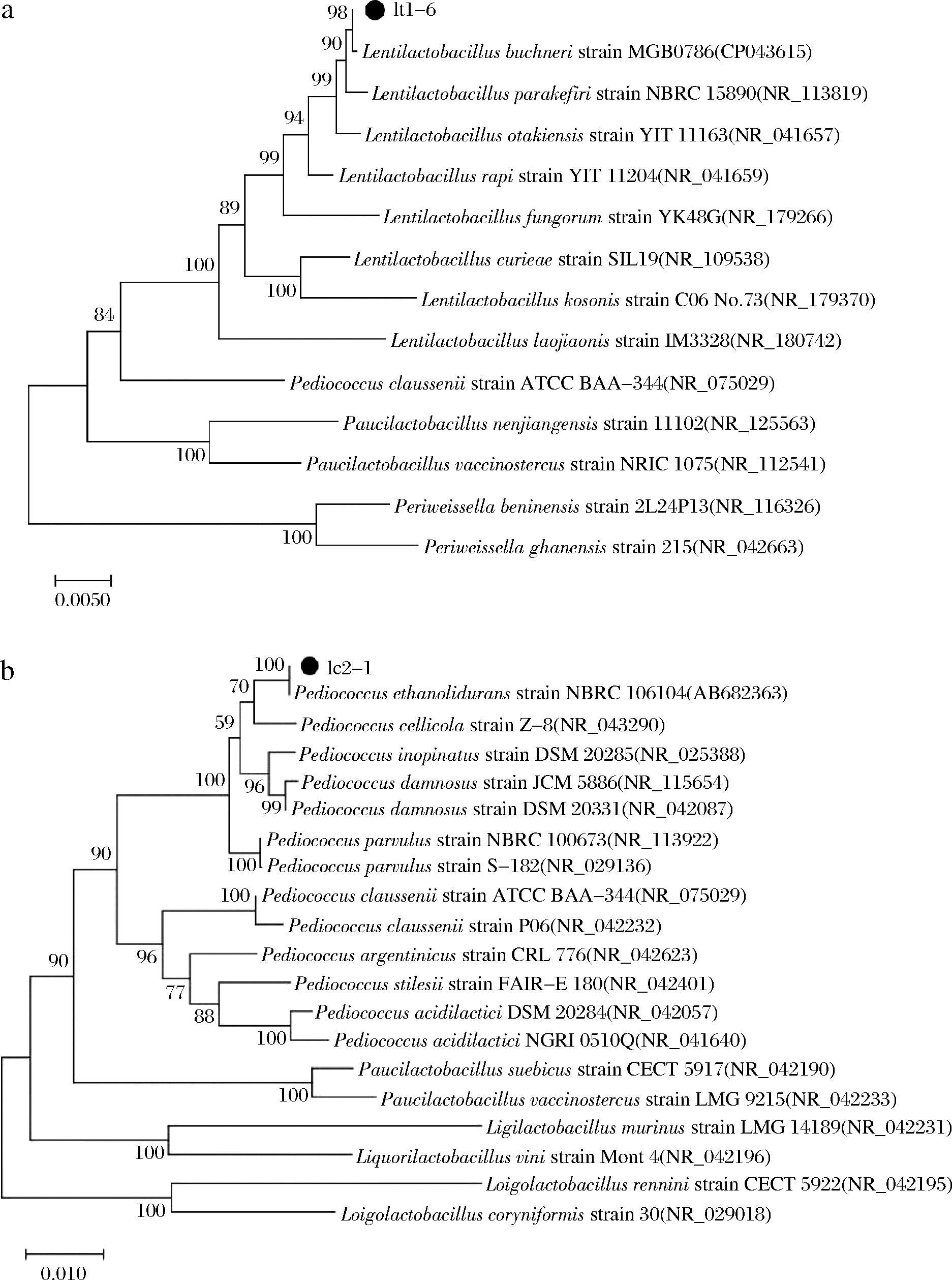
a-lt1-6系统发育树;b-lc2-1系统发育树
图3 基于16S rDNA序列的同源性绘制的lt1-6 和lc2-1的系统发育树
Fig.3 Phylogenetic trees of lt1-6 and lc2-1 based on homology of 16S rDNA sequences
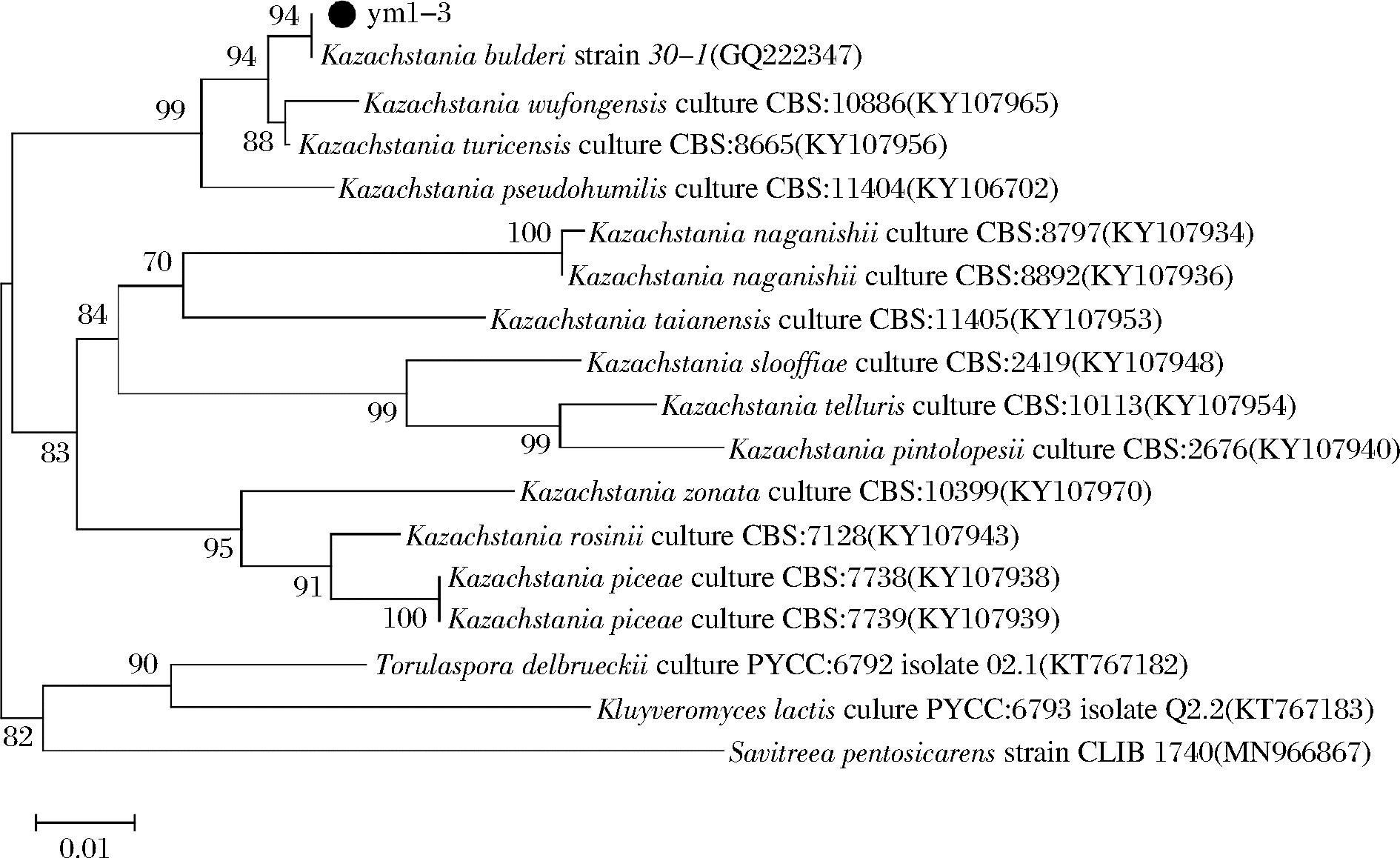
图4 基于26S rRNA序列的同源性绘制的ym1-3的系统发育树
Fig.4 Phylogenetic tree of ym1-3 based on homology of 26S rRNA sequences
2.7 菌株生长曲线
研究菌种生长是否适合于食品发酵体系具有十分重要的意义[25]。对3株菌种的生长特性进行了研究,结果如图5,lt1-6在6 h进入生长对数期,OD600nm值为0.140,pH值为5.78;菌株lc2-1则需要16 h进入生长对数期,pH值为5.78左右;菌株ym1-3在6 h进入对数期,OD600nm值为0.160,pH值为5.48。本部分研究可为后续在特定时间进行强化发酵接种红酸汤提供数据参考。
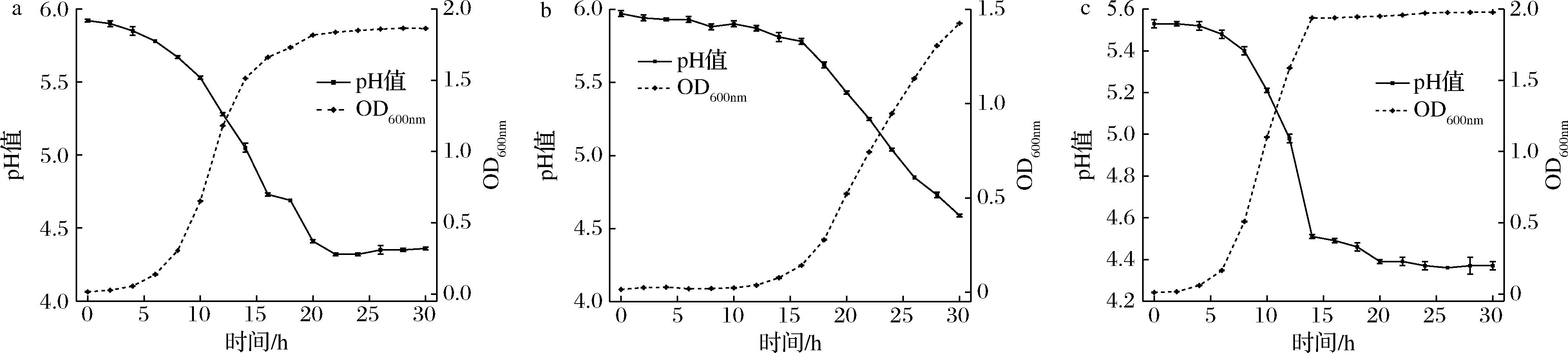
a-lt1-6生长曲线;b-lc2-1生长曲线;c-ym1-3生长曲线
图5 乳酸菌和酵母菌关于OD600nm和pH值的生长曲线
Fig.5 Growth curves of lactic acid bacteria and yeast with respect to OD600nm and pH
2.8 级联发酵模式菌株生长情况
从图6可知,lt1-6接种至番茄酸汤后,0~36 h生长缓慢,pH值降低幅度较慢;36~96 h时生长快速,pH值从4.0下降到3.5;在96 h时菌浓度为(4.925±0.020)×107 CFU/mL,pH值为3.51±0.02,此时微生物已适应环境,且能最大程度地发挥其生物学功能,与韦明明[21]的结论相同,即乳酸菌在番茄酸汤中能够良好生长。lc2-1接种至辣椒酸汤后,12~72 h pH值下降较快;72~96 h pH值下降较为缓慢,活菌数呈现先上升后下降的变化,84 h达到生长最高点,菌浓度为(10.000±0.000)×107 CFU/mL,pH值为3.41±0.01;在96 h时菌浓度为(5.900±0.020)×107 CFU/mL,pH值为3.32±0.02,菌落总数稍有回落,可能是发酵后期基质营养有限而限制微生物生长[26]。番茄酸汤与辣椒酸汤发酵96 h后二者1∶1混合,接种ym1-3,菌株生长情况良好,pH值在接种12 h下降后基本稳定在3.29。结果表明这3株菌种分别在发酵底物中生长情况良好,且加速酸汤成熟,可考虑作为红酸汤级联发酵体系的强化发酵菌株进行研究并应用于生产。
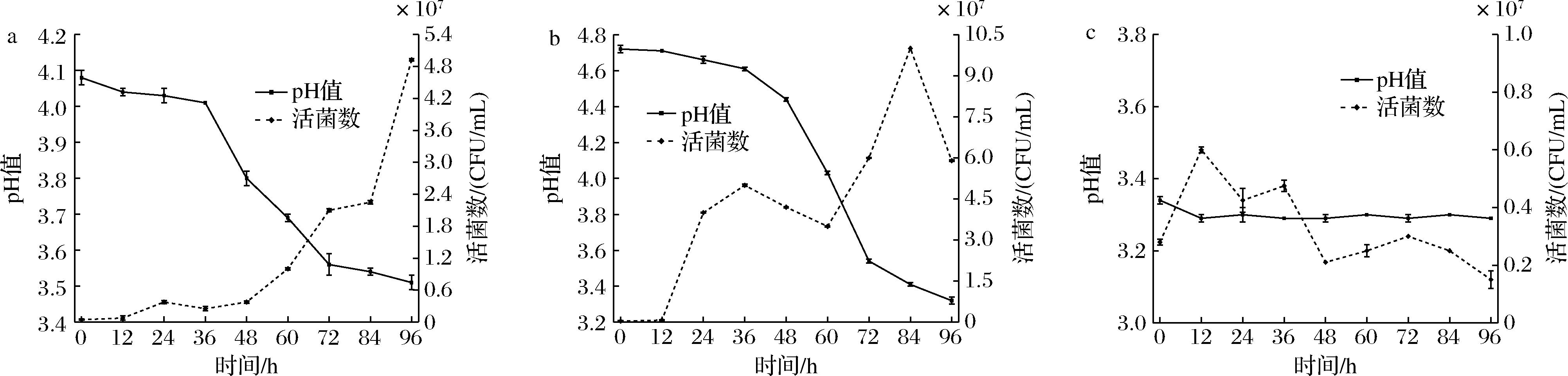
a-番茄酸汤接种lt1-6生长情况;b-辣椒酸汤接种lc2-1生长情况;c-混合酸汤接种ym1-3生长情况
图6 番茄酸汤、辣椒酸汤和混合酸汤分别接种lt1-6、lc2-1和ym1-3的生长情况
Fig.6 The growth of tomato, chili and mixed sour soup inoculated with lt1-6, lc2-1 and ym1-3
3 结论
本研究从红酸汤半成品番茄酸汤中筛选出一株产酸功能菌种为lt1-6[产酸能力(7.41±0.02) g/kg,·OH清除能力(0.15±0.00)%,DPPH自由基清除能力(30.38±0.00)%,ABTS阳离子自由基清除能力(6.73±0.03)%],辣椒酸汤中筛选出一株产酸功能菌种为lc2-1[产酸能力(7.92±0.01) g/kg,·OH清除能力(2.05±0.02)%,DPPH自由基清除能力(34.65±0.01)%,ABTS阳离子自由基清除能力(4.82±0.04)%],二次发酵混合酸汤中筛选出一株产香功能菌种为ym1-3[可产浓郁水果香,·OH清除能力(5.75±0.02)%,DPPH自由基清除能力(30.90±0.02)%,ABTS阳离子自由基清除能力(0.53±0.03)%],通过分子生物学鉴定和构建系统发育树确定这3株性能优良的菌种分别为L.buchneri、P.ethanolidurans和K.bulderi,通过级联发酵体系(用L.buchneri和P.ethanolidurans分别发酵96 h后的番茄酸汤和辣椒酸汤按1∶1复配再接种K.bulderi发酵96 h)验证,菌株生长情况良好,番茄酸汤中L.buchneri浓度为(4.925±0.020)×107 CFU/mL,辣椒酸汤中P.ethanolidurans浓度为(5.900±0.021)×107 CFU/mL,混合酸汤中K.bulderi浓度为(0.150±0.031)×107 CFU/mL,发酵酸度高(pH值均小于3.51±0.02),初步构建一种可应用于红酸汤强化发酵模式的级联发酵体系,将为人工接种乳酸菌和酵母菌强化发酵红酸汤提供技术参考。
[1] 鲁杨, 王楠兰, 李贤, 等.凯里红酸汤主要营养和功能成分的分析研究[J].食品研究与开发, 2019,40(7):163-166. LU Y, WANG N L, LI X, et al.Analysis and research on main nutrition and functional components of Kaili red acid soup[J].Food Research and Development, 2019,40(7):163-166.
[2] 张东亚. 红酸汤发酵工艺优化及品质控制研究[D].贵阳:贵州大学, 2018. ZHANG D Y.Research on the optimization of fermentation process and quality control of the red sour soup [D].Guiyang:Guizhou University, 2018.
[3] 何扬波, 李国林, 李咏富, 等.红酸汤发酵过程中微生物区系及挥发性物质组成变化分析[J].食品工业科技, 2022,43(19):177-190. HE Y B, LI G L, LI Y F, et al.Analysis of microflora and volatile substances change in red sour soup during fermentation[J].Science and Technology of Food Industry, 2022,43(19):177-190.
[4] LIN L J, DU F M, ZENG J, et al.Deep insights into fungal diversity in traditional Chinese sour soup by Illumina MiSeq sequencing[J].Food Research International, 2020,137:109439.
[5] 王琪琪, 田界先, 潘宗东, 等.基于 Illumina MiSeq 分析贵州凯里酸汤独特风味的优势菌群[J].食品与发酵工业, 2020,46(14):40-47. WANG Q Q, TIAN J X, PAN Z D, et al.Analysis of dominant microflora associated with the unique flavor of Guizhou Kaili sour soup using Illumina MiSeq sequencing[J].Food and Fermentation Industries, 2020,46(14):40-47.
[6] 宫路路, 李晓然, 陈芳勇, 等.凯里红酸汤细菌群落多样性分析及其优势乳酸菌筛选[J].中国调味品, 2022,47(10):67-72. GONG L L, LI X R, CHEN F Y, et al.Analysis of bacterial community diversity and screening of dominant lactic acid bacteria of Kaili red sour soup[J].China Condiment, 2022,47(10):67-72.
[7] 田永峰. 贵州苗族发酵型酸汤中功能性乳酸菌的筛选[D].贵阳:贵州大学, 2008. TIAN Y F.Screening of functional lactic acid bacteria in Guizhou Miao fermented soup[D].Guiyang:Guizhou University, 2008.
[8] 张玉龙, 胡萍, 王金龙, 等.产胞外多糖乳酸菌的筛选及抗氧化特性研究[J].中国酿造, 2015,34(10):37-42. ZHANG Y L, HU P, WANG J L, et al.Isolation of exopolysaccharides-producing lactic acid bacteria and its antioxidant properties[J].China Brewing, 2015,34(10):37-42.
[9] 郑莎莎, 胡萍.利用乳酸菌发酵红酸汤的品质变化研究[J].中国调味品, 2019,44(8):65-70. ZHENG S S, HU P.Study on quality change of red sour soup fermented by lactic acid bacteria[J].China Condiment, 2019,44(8):65-70. [10] XIONG K X, HAN F, WANG Z H, et al.Screening of dominant strains in red sour soup from Miao nationality and the optimization of inoculating fermentation conditions[J].Food Science &Nutrition, 2020,9(1):261-271.
[11] 贺晓洁, 赵良忠, 李明, 等.耐盐乳酸菌的筛选及其诱变育种与耐受性研究[J].食品与发酵工业, 2022,48(1):84-90. HE X J, ZHAO L Z, LI M, et al.Screening and breeding of salt-tolerant lactic acid bacteria[J].Food and Fermentation Industries, 2022,48(1):84-90.
[12] 龚加路, 赵兴秀, 邹伟, 等.高产酸乳酸菌的分离鉴定及其益生特性的研究[J].中国调味品, 2016,41(3):17-20;31. GONG J L, ZHAO X X, ZOU W, et al.Isolation and identification of a high-yield lactic acid bacterium and its probiotic property[J].China Condiment, 2016,41(3):17-20;31.
[13] KHAN I, KANG S C.Probiotic potential of nutritionally improved Lactobacillus plantarum DGK-17 isolated from Kimchi:A traditional Korean fermented food[J].Food Control, 2016,60:88-94.
[14] POURRAMEZAN Z, KERMANSHAHI R K, OLOOMI M, et al.In vitro study of antioxidant and antibacterial activities of Lactobacillus probiotic spp.[J].Folia Microbiologica, 2018,63(1):31-42.
[15] LIU N, MIAO S, QIN L K.Screening and application of lactic acid bacteria and yeast with L-lactic acid-producing and antioxidant capacity in traditional fermented rice acid[J].Food Science &Nutrition, 2020,8(11):6095-6111.
[16] ZHENG S S, WU W Y, ZHANG Y L, et al.Improvement of tomato sour soup fermentation by Lacticaseibacillus casei H1 addition[J].Journal of Food Processing and Preservation, 2022,46(8):e16806.
[17] 彭璐, 明红梅, 陶敏, 等.樱桃酒酿造用产香酵母的筛选及其特征香气成分分析[J].中国酿造, 2020,39(11):36-42. PENG L, MING H M, TAO M, et al.Screening of aroma-producing yeast for cherry wine brewing and analysis of its characteristic aroma components[J].China Brewing, 2020,39(11):36-42.
[18] 刘宜睿, 魏雯丽, 苏瑶, 等.桑葚酒用产香酵母的选育及特性分析[J].食品科技, 2022,47(12):1-7. LIU Y R, WEI W L, SU Y, et al.Breeding and characteristic analysis of aroma-producing yeast for mulberry wine[J].Food Science and Technology, 2022,47(12):1-7.
[19] 杜亚军, 郭尚, 李群, 等.木枣产香酵母的分离筛选和应用[J].中国酿造, 2021,40(10):123-128. DU Y J, GUO S, LI Q, et al.Screening and application of aroma-producing yeast strains from jujube[J].China Brewing, 2021,40(10):123-128.
[20] 刘文丽, 孙舒扬, 贡汉生, 等.不同酿酒酵母发酵的干红樱桃酒酒体成分及感官质量分析[J].食品与发酵工业, 2016,42(1):157-161;166. LIU W L, SUN S Y, GONG H S, et al.The compositional profile and sensory analysis of cherry wines fermented by different Saccharomyces cerevisiae strains[J].Food and Fermentation Industries, 2016,42(1):157-161;166.
[21] 韦明明. 番茄酸汤发酵过程分析及混菌发酵工艺研究[D].南京:南京农业大学, 2016. WEI M M.Analysis of tomato sour soup during fermentation process and study on the mixed culture fermentation technology for tomato sour soup[D].Nanjing:Nanjing Agricultural University, 2016.
[22] 王祎然, 韦明明, 张涵, 等.酸汤中乳酸菌的鉴定及其耐酸、耐胆盐和抗氧化活性[J].食品工业科技, 2020,41(16):121-126;139. WANG Y R, WEI M M, ZHANG H, et al.Identification, acid and bile salt tolerance, and antioxidant ability of lactic acid bacteria isolated from sour soup [J].Science and Technology of Food Industry, 2020,41(16):121-126;139.
[23] LI D F, DUAN F X, TIAN Q M, et al.Physiochemical, microbiological and flavor characteristics of traditional Chinese fermented food Kaili Red Sour Soup[J].LWT, 2021,142:110933.
[24] 刘玉凌, 任亭, 赵志平, 等.传统榨菜中酵母菌的分离鉴定及特性研究[J].食品科技, 2022, 47(10):57-61. LIU Y L, REN T, ZHAO Z P, et al.Isolation,identification and characterization of yeast from traditional mustard[J].Food Science and Technology, 2022, 47(10):57-61.
[25] LIU N, QIN L K, LU X F, et al.Physicochemical components and flavor properties of acid rice soup (rice-acid) fermented with Lactobacillus paracasei and/or Kluyveromyces marxianus[J].Food Bioscience, 2021,43:101278.
[26] AN F Y, SUN H J, WU J R, et al.Investigating the core microbiota and its influencing factors in traditional Chinese pickles[J].Food Research International, 2021,147:110543.