尿石素A是鞣花酸经肠道菌群代谢后产生的多酚类化合物[1]。研究发现,尿石素A具有延长线虫寿命、增加小鼠肌肉功能、增强肠道屏障功能、抑制高糖诱导的神经元淀粉样变性等生理活性[2-5]。鞣花酸普遍存在于石榴、坚果及浆果等食物中[6],但不同人群的肠道吸收功能和肠道菌群组成存在较大差异,导致个体间对尿石素A的吸收转化效率不同,且鞣花酸向尿石素A的转化随着年龄增加会逐渐下降[3],因此,通过膳食方式直接补充尿石素A往往无法达到预期功效浓度。而尿石素A不溶于水和脂溶性溶剂,微溶于乙醇,直接补充尿石素A的生物利用率低[7]。为解决尿石素A生物利用度的问题,ZOU等[8]制备了尿石素A纳米粒子剂型,发现制剂改变后可以显著提高尿石素A的口服生物利用度。YI等[9]通过制备尿石素A聚乙二醇化脂质体来提高尿石素A的生物利用度和抗肿瘤疗效,其他关于提高尿石素A水溶性和生物利用度的报道则较少。因此,急需寻找更多有效的方法来提高尿石素A的口服生物利用度。
作为食品高新技术,食品递送体系近年来被广泛应用于保护和递送膳食多酚,具有显著提高多酚类化合物的稳定性、生物利用度和肠道吸收等作用[10]。目前用于膳食多酚的递送体系主要有脂质体、纳米颗粒、水凝胶、乳液等,其中脂质体因良好的生物相容性、生物降解性而被广泛应用。由于磷脂分子具有两亲性,当分散在水介质中时,其在剪切力作用下可以自发地组装形成脂质体。亲水性物质可以结合在水核中,亲脂性物质可以结合在脂质双层中,并在水相中自组装成球型小泡[11]。因此,脂质体可以同时包裹亲水性和亲脂性生物活性物质,抵御不利的环境条件。另外,脂质体优良的生物相容性可使被包裹的活性物质不与外界环境接触进而避免被氧化分解,同时通过控制活性物质在体内的释放速率从而提高其稳定性和生物利用度[12]。
pH驱动法是一种绿色、无溶剂、低能耗的封装方法。最初,PAN等[13]根据生物聚合物的“解离-复性”和多酚类物质从碱性到酸性环境经历“去质子化-质子化”的过程发明了该方法,是一种基于亲脂性多酚溶解度随pH值改变的原理发展起来的新型载药方法。以姜黄素为例,在酸性环境下,姜黄素分子不带电且水溶解度极低,当pH值逐渐升高,大于姜黄素酚羟基的电解离常数时,酚羟基逐步电离,姜黄素分子带电,水溶解度急剧升高,当姜黄素完全溶解于水后,将pH值调回酸性,姜黄素分子质子化,水溶解度极度下降,可与生物聚合物形成姜黄素纳米粒子[14]。整个过程没有额外的能量投入,使其具有成本效益;无有机试剂,避免了安全问题;简单的酸碱滴定,提高了工作效率。因此,该方法易于推广,具有较好的工业化前景等优点[15]。尿石素A分子(图1-a)是一种具有二羟基-6H-二苯并吡楠-酮结构的亲脂性多酚,其从碱性到酸性环境也会经历“去质子化-质子化”的过程,但目前尚未有采用pH驱动法制备UA-LPs的相关研究报道。因此,本论文的目的是采用pH驱动法将尿石素A包埋于脂质体中,优化制备工艺,并对其微观结构、稳定性进行分析,以期提高尿石素A的生物利用度,为尿石素A在食品和保健品领域的广泛应用提供科学依据。
1 材料与方法
1.1 材料与试剂
尿石素A(纯度>97%),上海毕得医药科技股份有限公司;大豆卵磷脂,北京索莱宝科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、NaOH,美国Sigma公司;无水乙醇、乙腈、乙酸、乙醇,天津市大茂化学试剂厂;所有使用的试剂均为分析纯。
1.2 仪器与设备
ESJ200-4电子分析天平,上海精科天美科学仪器有限公司;TG16A-WS高速台式离心机,上海聚亮光学仪器有限公司;U-2910紫外可见分光光度计,上海美谱达仪器有限公司;Zetasizer Nano-ZSP 纳米粒度仪,英国马尔文仪器有限公司;HH-4数显电子恒温水浴锅,常州国华电器有限公司;XMTD-204水浴锅,江苏科析仪器有限公司;Chromaster Organizer液相,北京日立公司。
1.3 实验方法
1.3.1 尿石素A碱性稳定性和回复性分析
称取尿石素A溶解于pH值为12的NaOH溶液中并搅拌5 min制备成尿石素A母液备用,每隔10 min取出4 mL尿石素A母液,以pH值为12的NaOH溶液为空白对照测其在250~350 nm的紫外吸收光谱。同时,每隔10 min取出5 mL尿石素A母液调节pH至7,采用高效液相色谱检测其含量,色谱柱为Agilent C18(250 mm×4.6 mm,5 μm),以1%的甲酸水和乙腈(30∶70,V∶V)为流动相,流速为0.8 mL/min,柱温箱温度为25 ℃,紫外检测波长为256 nm。
1.3.2 尿石素A脂质体的制备
采用pH驱动法制备尿石素A脂质体(urolithin A liposomes,UA-LPs)[16]。称取一定量的尿石素A溶解于pH值为12的NaOH溶液中并搅拌5 min制成不同质量浓度的尿石素A母液(0.2、0.6、1、1.4、1.8、2 mg/mL),称取大豆卵磷脂(soybean phosphatidyl choline, SPC)分散于pH 7.2 10 mmol/L的PBS中,磁力搅拌1 h制备成不同质量浓度的粗脂质体(10、15、20、40 mg/mL),将粗脂质体用均质机在85 MPa条件下均质3次,得到不同浓度的空白纳米脂质体(LPs)。最后将不同浓度的LPs与尿石素A母液以1∶1体积比混合,并立即调节pH至7,制备成尿石素A终质量浓度为0.5 mg/mL,SPC质量浓度为5、10、15、20 mg/mL的UA-LPs。按同样方式制备SPC质量浓度20 mg/mL,尿石素A终质量浓度为0.1、0.3、0.5、0.7、0.9、1 mg/mL的UA-LPs。
1.3.3 UA-LPs包埋率及负载率的测定
将UA-LPs于12 000 r/min下离心10 min分离游离尿石素A(固体结晶)。取上清液用体积分数10%二甲基亚砜的无水乙醇稀释20倍后,测其在256 nm处的吸光度,用回归曲线(y=0.086 8x+0.076,R2=0.999 9)计算尿石素A的包埋率及负载率,计算如公式(1)和公式(2)所示:
包埋率![]()
(1)
负载率![]()
(2)
1.3.4 UA-LPs粒径与Zeta电位测定
采用Zetasizer Nano ZSP测定脂质体的平均粒径、多分散系数(polydispersity index,PDI)以及Zeta电位变化。样品用超纯水稀释10倍,每个样品测定3次,磷脂的折光率为1.490,分散相(水)的折光率为1.33。
1.3.5 UA-LPs微观形貌测定
将UA-LPs稀释成尿石素A质量浓度为0.5 mg/mL,然后取5 μL样品溶液于新剥离云母片表面,自然干燥后利用原子力显微镜测量[17]。
1.3.6 UA-LPs稳定性分析
pH稳定性:将UA-LPs的pH分别调节至3、5、7、9和11,用激光粒度仪记录不同pH环境下UA-LPs的平均粒径及电位变化,并采用公式(1)计算其包埋率。
热稳定性:将UA-LPs分别于40 ℃和80 ℃处理30、60、90、180 min,放置冷水中冷却至室温后,用激光纳米粒度仪测其平均粒径及电位变化,采用公式(1)计算包埋率的变化。
1.3.7 UA-LPs的体外模拟消化
通过模拟胃、小肠的消化来研究UA-LPs的消化特性,具体步骤如下[16]:
胃阶段:称取2 g NaCl用500 mL超纯水溶解,然后缓慢加入7 mL浓HCl溶液,用超纯水定容至1 L,即得模拟胃消化溶液,并用模拟胃消化液溶解胃蛋白酶(3.2 mg/mL,现配现用)。往样品中加入6 mL预热至37 ℃的胃消化液(包含胃蛋白酶),调pH至2.5后在摇床中100 r/min孵育2 h。
小肠阶段:胃消化结束后,加入12 mL提前预热至37 ℃的PBS(10 mmol/L,pH 6.5),继续在37 ℃水浴10 min,后用NaOH溶液将pH值调至7.0。加入含胰酶(24 mg/mL,2 mL)、胆盐(50 mg/mL,2.8 mL)和盐溶液(0.5 mol/L CaCl2和7.5 mol/L NaCl的混合溶液,1.2 mL)的模拟小肠消化液到胃消化液中,继续在水浴锅中模拟消化2 h,在此过程中,使用NaOH溶液将消化液的pH值保持在7.0。
UA-LPs释放率:取模拟体外消化后的样品于256 nm测定吸光度,计算消化液中尿石素A的浓度。同时取一定量消化后的样品12 000 r/min离心10 min,评价上清液中尿石素A的含量,在消化液中可溶解的部分被认为是在胶束中能被吸收的部分。尿石素A的转化率和生物可接受率通过公式(3)和公式(4)计算:
转化率![]()
(3)
生物可接受率![]()
(4)
1.4 数据统计及分析
所有实验均重复3次,结果表示为平均值±标准差。使用SPSS 13.0软件对实验数据进行分析,采用单因素方差分析(One-way ANOVA),通过Duncan法评价不同组间的显著性差异,P<0.05认定具有显著性差异。采用Origin Pro 2019制图。
2 结果与分析
2.1 尿石素A碱稳定性和回复性分析
多酚类化合物的水溶解度随pH值变化而改变的特性是pH驱动法包埋疏水性多酚的基础条件,但多酚在碱性环境下易发生降解,故考察尿石素A在碱性条件下的稳定性是采用pH驱动法进行包埋的重要前提。尿石素A在pH值为12的强碱性环境下的稳定性结果如图1-b所示,尿石素A在pH值为12的NaOH溶液中孵育60 min后,其紫外吸收峰略有下降,且孵育时间越长,在296 nm和318 nm处的紫外吸光强度降低得越多,在296 nm处的吸收值从0 min的2.905降低到了孵育60 min的2.476,在碱性条件下,尿石素A分子的酚羟基会逐步电离去质子化导致其带电,最大吸收峰的下降可能是因为尿石素A的酚羟基在碱性条件与溶剂中溶解的少量氧分子发生反应,氧化成醌或者半醌中间体(图1-e),从而导致尿石素A的结构改变[18]。
为验证碱性条件下尿石素A结构的回复性,将尿石素A溶于pH值为12的NaOH溶液,每隔10 min取出相同体积的样品调pH至中性,并采用高效液相色谱检测其降解程度,结果如图1-c所示,发现出峰时间未有明显变化,但随着时间的变化峰面积呈逐渐下降的趋势,在孵育60 min后,其峰面积下降了约43%(图1-d),这可能是因为在强碱性环境下尿石素A分子中的酚羟基数量上升,电离态的羟基基团易受到攻击[16]的原因。但在10 min内尿石素A仅降解2.55%,说明尿石素A在一定时间内从强碱性条件恢复至中性条件并不会对其结构及含量有较大影响,验证了pH驱动法包埋尿石素A的可行性,因此在后续实验中,尿石素A碱溶液采取现配现用的方式,并将LPs与尿石素A母液混匀、调回pH至中性的时间控制在10 min内。
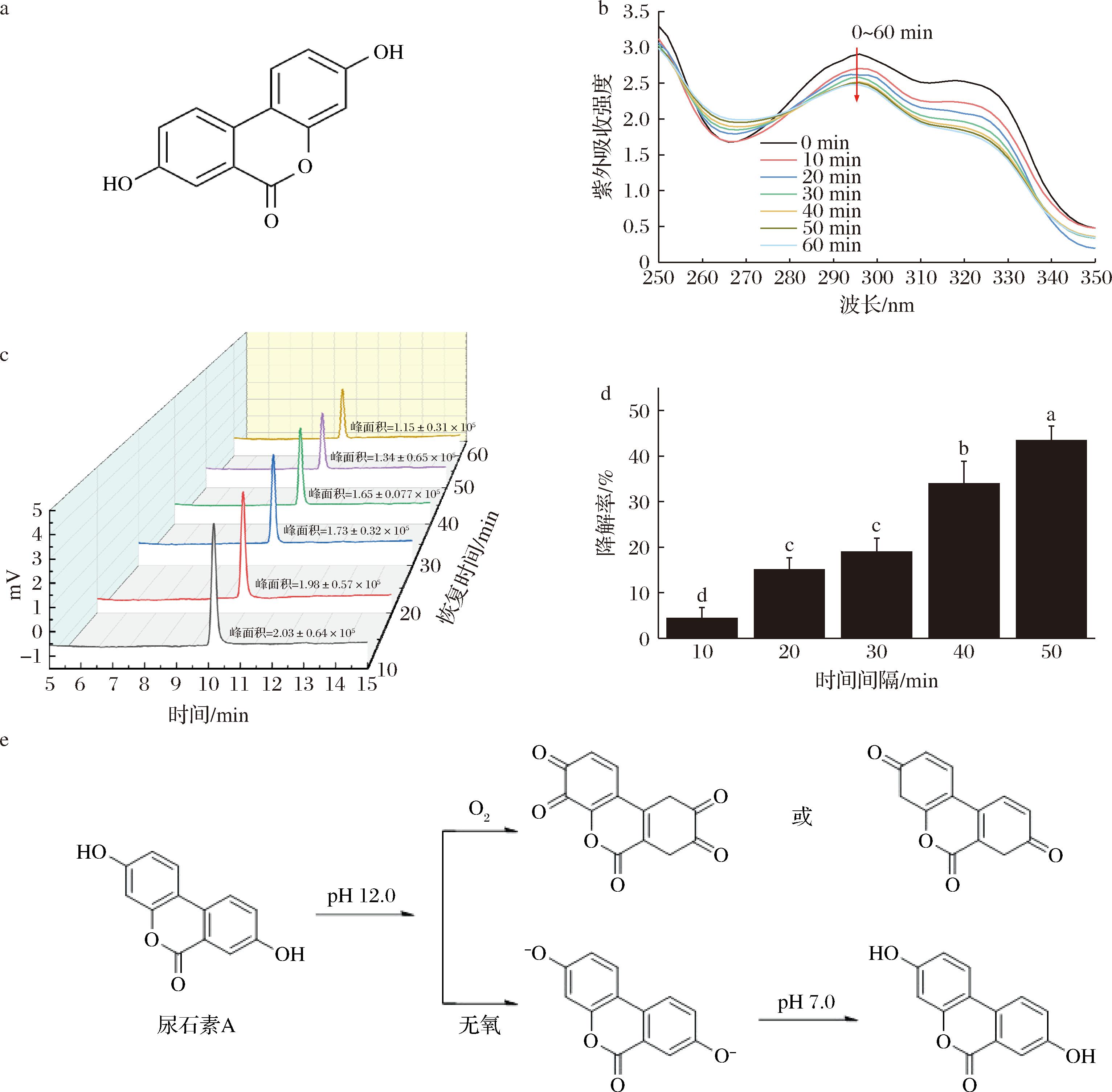
a-尿石素A结构式;b-尿石素A在60 min内紫外吸收强度变化;c-尿石素A在不同时间内的碱性恢复性; d-尿石素A在碱性环境下的降解率;e-尿石素A在碱性条件下的结构变化
图1 尿石素A碱性稳定性
Fig.1 Alkaline stability of urolithin A
2.2 不同SPC浓度UA-LPs包埋率及负载率的测定
固定尿石素A质量浓度为0.5 mg/mL,不同质量浓度SPC(5~20 mg/mL)对尿石素A包埋率的影响如图2-a所示。随着SPC添加量的上升,其包埋率分别为(60.01±0.12)%、(68.19±1.01)%、(86.88±2.03)%和(98.11±0.26)%。
当SPC添加量低于10 mg/mL时,不足以包封分散在体系中的尿石素A,这是由于一定量的磷脂所形成的脂质体对尿石素A的包埋能力是有限的,当尿石素A的含量超过脂质膜的饱和度时,导致其包埋率下降[19]。随着添加量的上升,分散在体系中的卵磷脂足以包封体系中的尿石素A,并逐渐饱和[20]。对尿石素A负载率影响结果如图2-b所示,随着SPC添加量的上升,其负载率分别为(5.46±0.01)%、(3.25±0.05)%、(2.80±0.07)%和(2.39±0.01)%,说明SPC的浓度越大,其负载率越低。
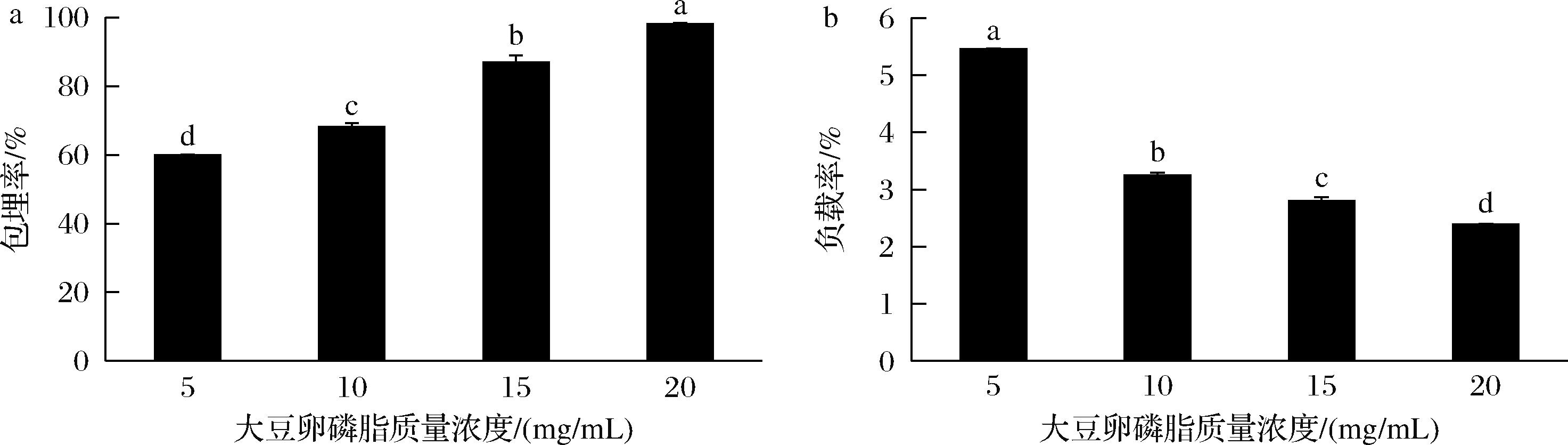
a-包埋率;b-负载率
图2 壁材浓度对包埋率及负载率的影响
Fig.2 Influence of wall material concentration on embedding rate and load rate
注:不同小写字母代表显著性差异,P<0.05(下同)。
2.3 不同SPC浓度UA-LPs的粒径及Zeta电位测定
脂质体的稳定性通常受其粒径与Zeta电位影响,脂质体分散性PDI值也是考察脂质体物理稳定性的重要指标,研究表明,脂质体粒径越小、电位绝对值越高,脂质体越稳定,PDI通常小于0.20为优良[21]。由图3-a所示,固定尿石素A的质量浓度为0.5 mg/mL,随着SPC浓度的增加,UA-LPs与LPs粒径均呈不断上升的趋势,当SPC质量浓度为20 mg/mL时,LPs粒径为131.5 nm,UA-LPs粒径大小为97.5 nm。UA-LPs均比空白脂质体的粒径小,这可能是尿石素A与大豆卵磷脂相互结合导致粒径减小。
如图3-b所示,UA-LPs的PDI指数相较LPs略有上升,但SPC浓度越大PDI指数越小,当SPC的质量浓度从5 mg/mL增加到20 mg/mL时,UA-LPs的PDI从0.40下降到0.27,说明20 mg/mL SPC制备的UA-LPs脂质体分散性最好,这有可能是因为磷脂浓度过低不利于包埋尿石素A导致其环境不均一。
图3-c表明,不同SPC浓度UA-LPs 的Zeta电位相较LPs绝对值均有所增加,稳定性更好,当SPC质量浓度为20 mg/mL时,LPs电位为-24.8 mV,UA-LPs电位为-40.3 mV。这可能由于尿石素A分子的极性羟基与磷脂极性头基的胆碱相互作用,产生的偶极子取向增加了脂质体的表面负电荷[22]。综合考虑选择SPC最大添加量为20 mg/mL。
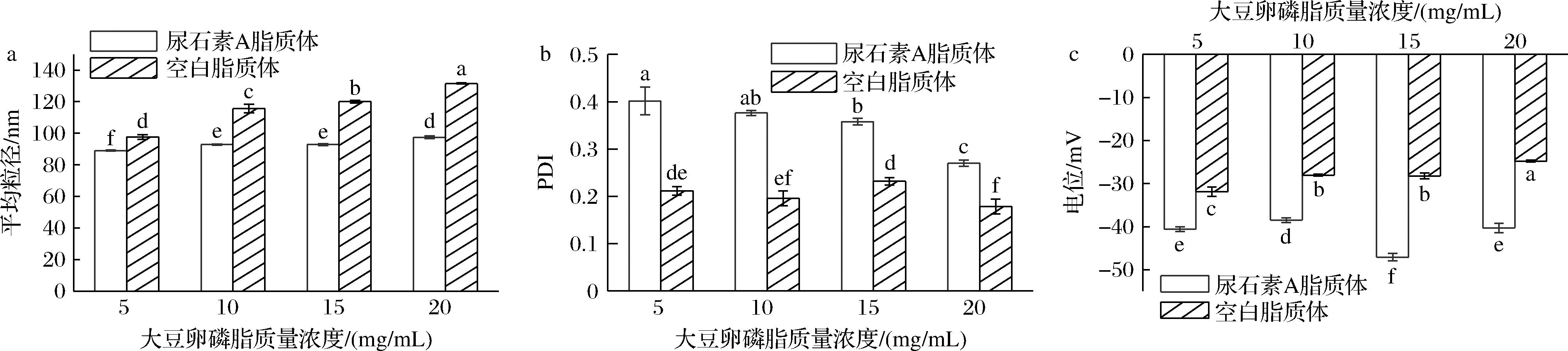
a-平均粒径;b-PDI;c-Zeta电位
图3 壁材浓度对粒径、PDI及Zeta电位的影响
Fig.3 Effect of wall material concentration on particle size, PDI, and Zeta potential
2.4 不同芯材浓度UA-LPs的包埋率、负载率、粒径及Zeta电位测定
固定SPC质量浓度为20 mg/mL,不同浓度尿石素A对UA-LPs包埋率、负载率的影响如图4-a、图4-b所示。在芯材质量浓度小于0.5 mg/mL时,其包埋率无显著差异,均在97%左右,随着尿石素A质量浓度(0.1~0.5 mg/mL)的增大,其负载率由0.4%上升至2.36%,当尿石素A添加量从0.5 mg/mL增加至0.7 mg/mL时,其包埋率从96.6%显著下降至69.8%,证明尿石素A的添加量为0.5 mg/mL时,达到该脂质膜的最佳饱和度。随着尿石素A质量浓度(0.5~1 mg/mL)的增加,负载率则由2.36%上升至3.04%,说明随着尿石素A含量的增加,其负载率逐渐上升。
如图4-b所示,固定SPC质量浓度为20 mg/mL,尿石素A质量浓度(0.1~1 mg/mL)的增加对UA-LPs平均粒径的影响较小,粒径均维持在90 nm左右,而UA-LPs粒径均比LPs小,初步推测可能原因是尿石素A与大豆卵磷脂相互结合导致粒径减小。
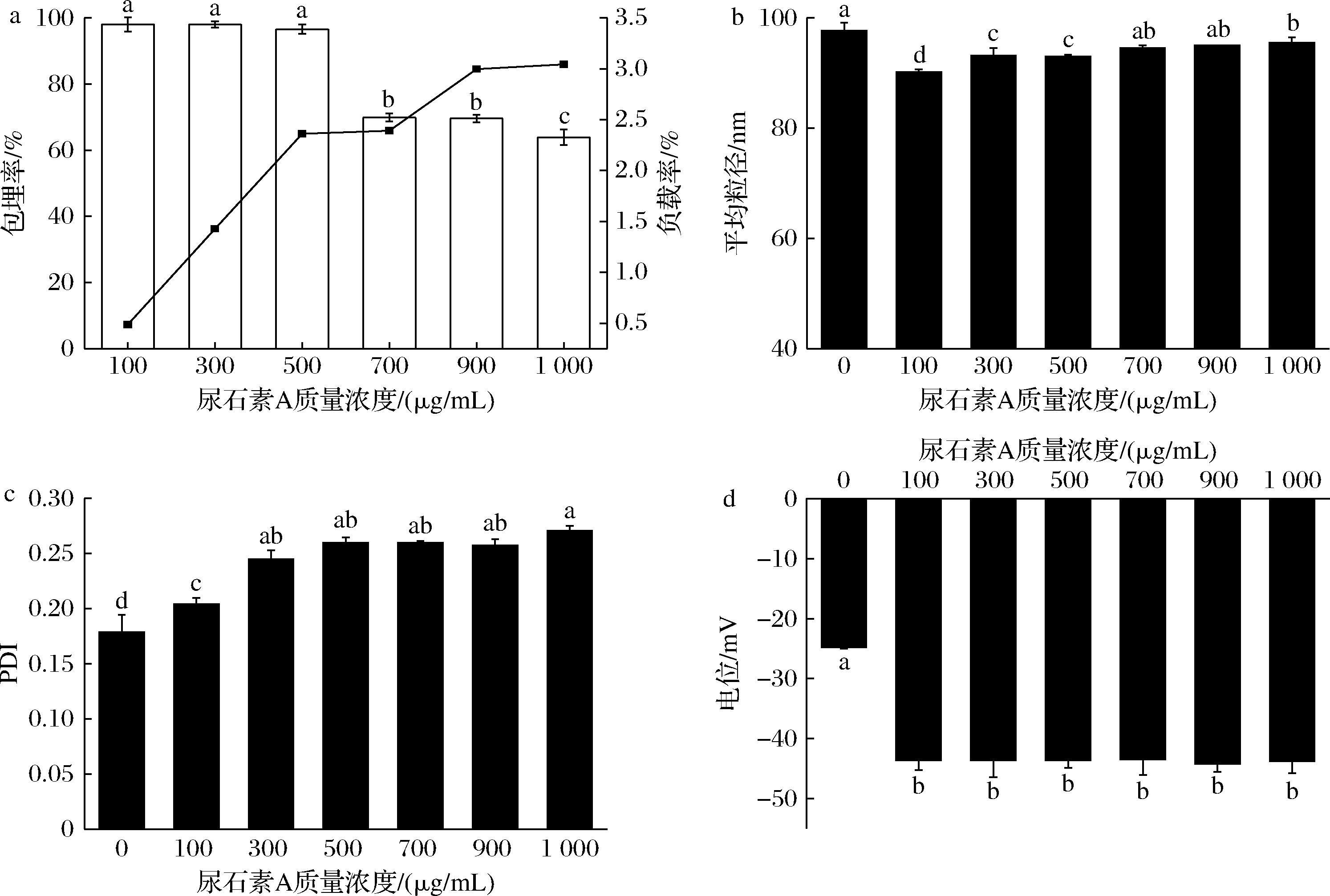
a-包埋率及负载率;b-平均粒径;c-PDI;d-Zeta电位
图4 芯材浓度对UA-LPs包埋率、负载率、粒径、PDI及Zeta电位的影响
Fig.4 Influence of core material concentration on UA-LPs embedding rate, load rate, particle size, PDI and Zeta potential
图4-c表明,随着尿石素A质量浓度(0.1~1 mg/mL)的增加, UA-LPs的PDI呈现逐渐上升趋势,其中尿石素A质量浓度为0.1 mg/mL时,PDI为0.20,尿石素A质量浓度为1 mg/mL时,PDI为0.27,均小于0.3,代表UA-LPs的分散性都较良好。
图4-d表明,随着尿石素A质量浓度(0.1~1 mg/mL)的增加,UA-LPs的电位变化无显著性差异(P>0.05),保持在-43 mV左右,而LPs电位为-24.8 mV。说明负载不同浓度尿石素A的UA-LPs的电位相较LPs的绝对值均有所增加,稳定性上升,这可能由于尿石素A在制备过程中从不带电状态转为带负电,使得脂质体的表面带更多负电荷[14]。根据以上数据分析,综合考虑选择尿石素A的最大添加量为0.5 mg/mL。
2.5 微观形貌
为进一步表征UA-LPs形貌,通过原子力显微镜观察UA-LPs的外观图,如图5所示。在扫描范围内,可以观察到单个囊泡呈球形或者椭球结构,且分布较均匀,UA-LPs的平均粒径在100 nm左右,与激光纳米粒度仪测定的结果相一致。
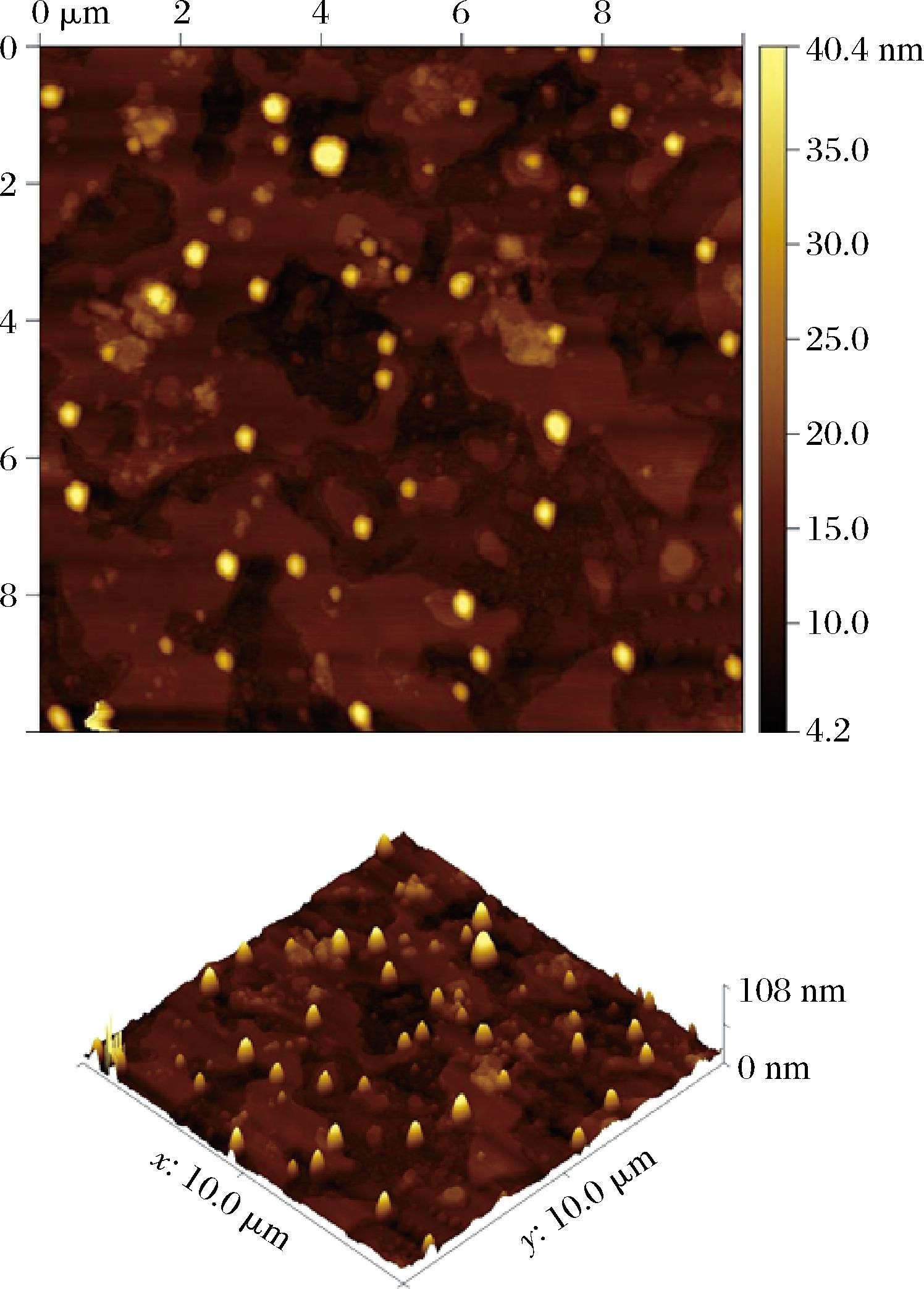
图5 UA-LPs原子力显微镜图
Fig.5 Atomic force microscopy of UA-LPs
2.6 UA-LPs稳定性分析
2.6.1 热稳定性
2.6.1.1 包埋率
UA-LPs在40 ℃和80 ℃温度下孵育30~180 min后的包埋率变化如图6所示。
在40 ℃下,随着时间的推移,同一种壁材浓度的UA-LPs的包埋率均呈现逐渐下降趋势,经180 min后,SPC为5 mg/mL的UA-LPs的包埋率从60.0%下降至23.5%,SPC为20 mg/mL的UA-LPs的包埋率从98.1%下降至53.9%(图6-a),证明高浓度的壁材在40 ℃下能更多的保留住包封的尿石素A。孵育30 min后,不同壁材浓度的UA-LPs的包埋率分别为34.2%、52.8%、71.2%和97.8%,说明加热时间相同时,UA-LPs的包埋率均随着SPC浓度的增加而增加。图6-b表明热处理温度为80 ℃时,随着处理时间的延长,同一种壁材浓度的UA-LPs的包埋率也具有显著下降趋势(P<0.05),孵育180 min后,SPC为5 mg/mL的UA-LPs的包埋率从60.0%下降至15.7%,而SPC为20 mg/mL的UA-LPs的包埋率从98.1%下降至39.1%,仍保留将近45%的尿石素A。与40 ℃相比,相同壁材浓度的UA-LPs在80 ℃下热稳定性更差,说明UA-LPs的热稳定性随着温度的升高而降低。这可能是由于温度升高,磷脂水解速率加快,导致脂质体破裂,包埋的尿石素A渗漏量增加[22]。为排除尿石素A自身在加热过程中的降解对实验带来的干扰,本文评价了尿石素A在40和80 ℃温度下孵育30~180 min后的紫外吸收强度,由图6-c、图6-d可知,在两种温度下,尿石素A 的紫外吸收强度均随着时间的延长无显著性变化(P<0.05),证明尿石素A本身热稳定性较好。
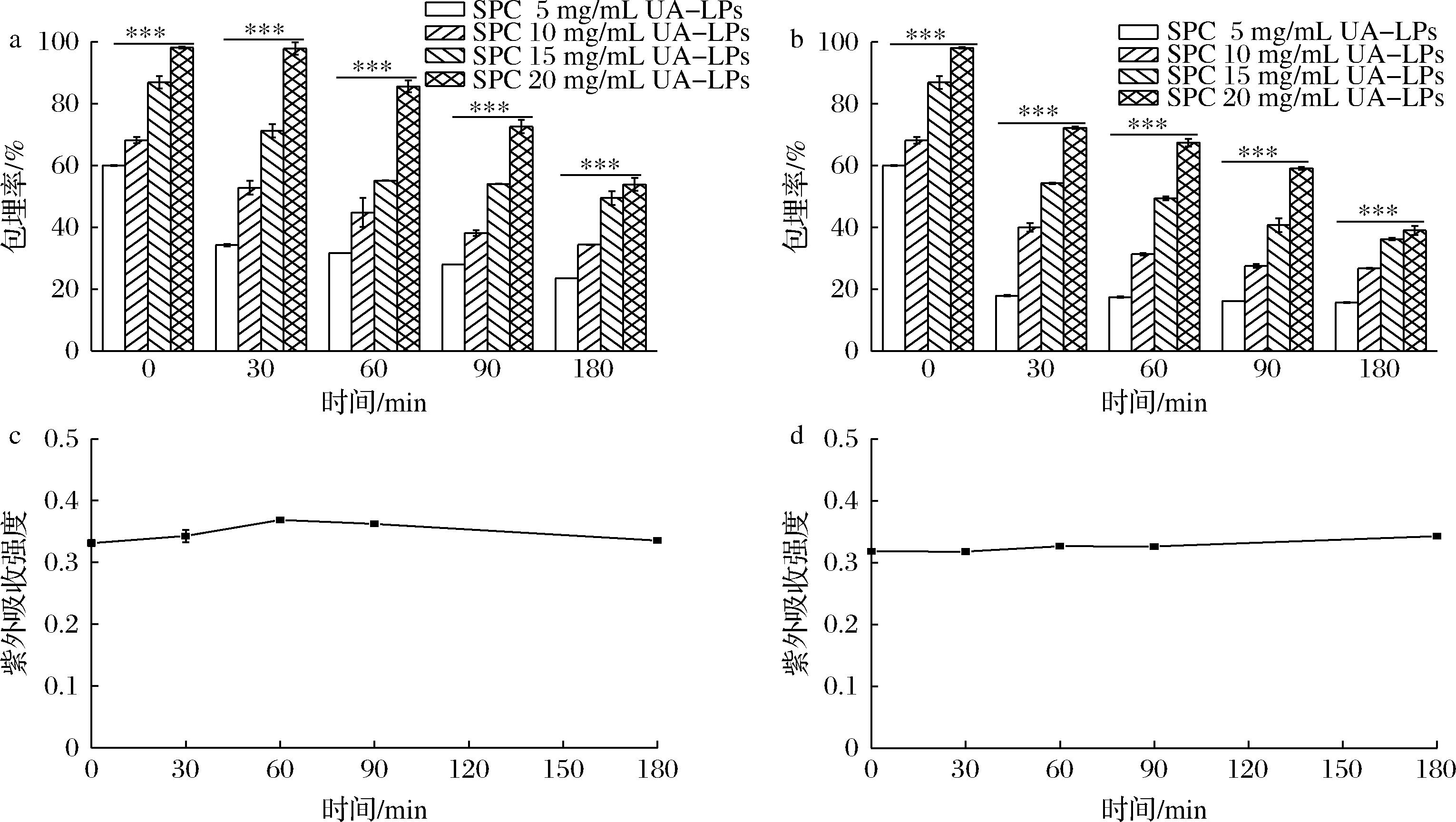
a-40 ℃对不同壁材浓度UA-LPs包埋率的影响;b-80 ℃对不同壁材浓度UA-LPs 包埋率的影响; c-40 ℃对尿石素A紫外吸收强度的影响;d-80 ℃对尿石素A紫外吸收强度的影响;
图6 不同温度对不同SPC浓度UA-LPs包埋率及尿石素A紫外吸收强度的影响
Fig.6 Effect of different temperatures on EE of UA-LPs with different SPC concentrations and UV-absorption intensity of UA
注:***代表差异极显著P<0.001(下同)。
2.6.1.2 粒径、PDI和电位
如图7-a所示,在40 ℃ 处理180 min后, SPC质量浓度为5 mg/mL的UA-LPs的粒径增大了68.3 nm,SPC质量浓度为20 mg/mL的UA-LPs的粒径仅增大24.5 nm;80 ℃ 处理180 min后,SPC质量浓度为5 mg/mL的UA-LPs粒径增大了85.9 nm,SPC质量浓度为20 mg/mL的UA-LPs粒径增大了41.8 nm(图7-d)。说明在不同温度下,随着加热时间的增加,不同SPC浓度的UA-LPs平均粒径均有逐渐增大的趋势,且温度越高其粒径增大的越多,这是因为较高的温度处理可能会破坏芯材层与壁材层之间相互作用,使其结构较为松散从而引起粒径增大[23]。
温度对不同壁材浓度UA-LPs的PDI影响如图7-b、图7-e所示。热处理180 min后,在40 ℃条件下,SPC质量浓度为5 mg/mL的UA-LPs的PDI粒径从0.4上升至0.48,SPC质量浓度为20 mg/mL的UA-LPs的PDI从0.26升至0.28。在80 ℃下,SPC质量浓度为5 mg/mL的UA-LPs的PDI从0.4上升至0.49,SPC质量浓度为20 mg/mL的UA-LPs 的PDI从0.26升至0.45。这说明在较低温度下,随着时间的推移,不同SPC浓度UA-LPs的PDI均无较大影响。而较高温度会对高壁材浓度UA-LPs的PDI有一定的影响。
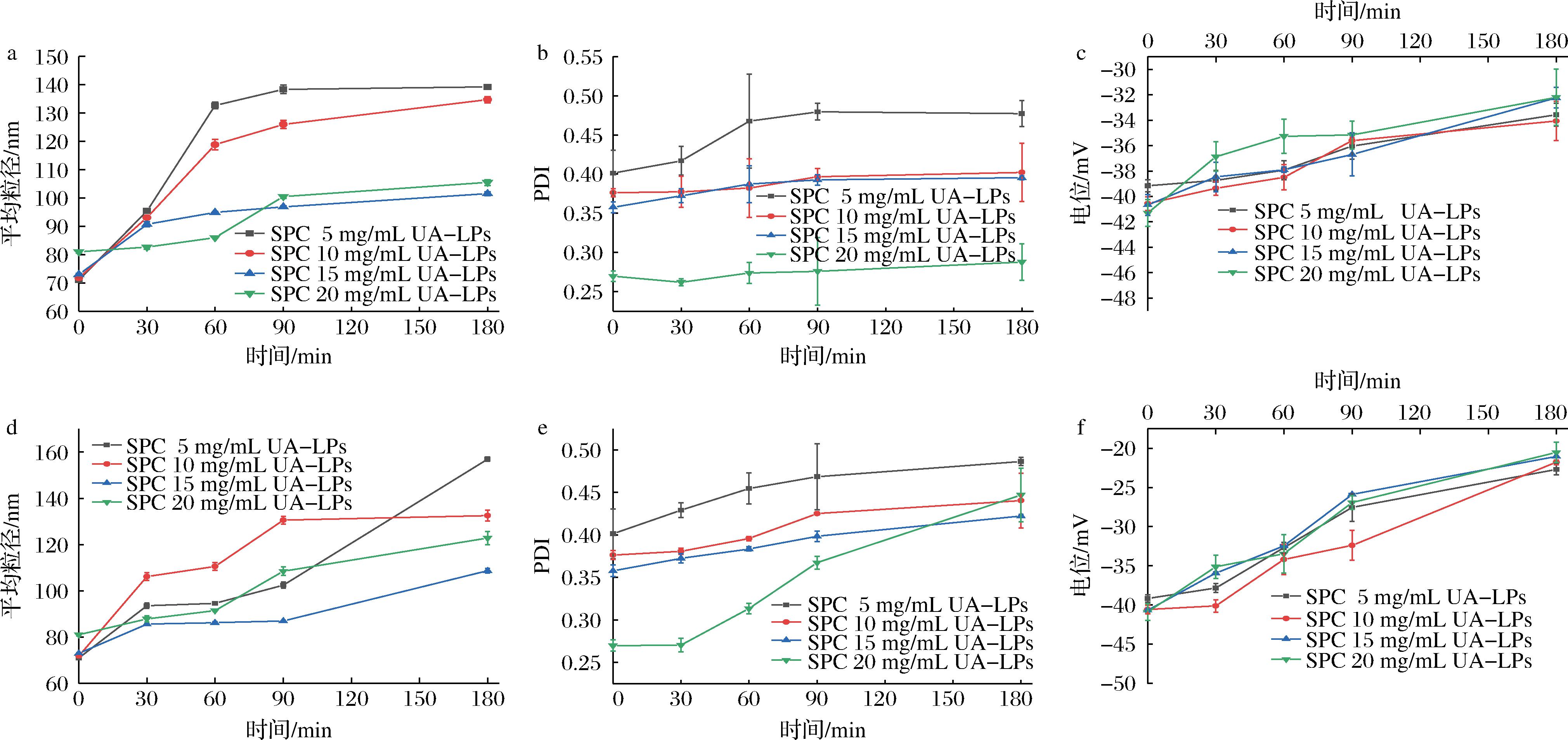
a-40 ℃对不同壁材浓度UA-LPs粒径的影响;b-40 ℃对不同壁材浓度UA-LPs PDI的影响;c-40 ℃对不同壁材浓度UA-LPs电位的影响; d-80 ℃对不同壁材浓度UA-LPs粒径的影响;e-80 ℃对不同壁材浓度UA-LPs PDI的影响;f-80 ℃对不同壁材浓度UA-LPs电位的影响
图7 不同温度对不同SPC浓度UA-LPs粒径、PDI、电位的影响
Fig.7 Effects of temperature on particle size, PDI and potential of UA-LPs at different SPC concentrations
图7-c、图7-f为不同温度对不同壁材浓度UA-LPs的电位影响。40 ℃水浴加热180 min后,随着SPC质量浓度(5~20 mg/mL)的增加,UA-LPs的电位绝对值分别下降了5.0、6.5、8.4、9.1 mV。80 ℃加热180 min后,随着SPC浓度的增加,UA-LPs的电位绝对值分别下降了16.4、18.8、19.6、20.4 mV。说明在同一温度下,加热时间的延长对高壁材浓度制备的UA-LPs电位的影响低于低壁材浓度制备的UA-LPs,且相同壁材浓度的UA-LPs在高温下的热稳定性更差。这是因为经过加热后磷脂的水解和氧化会改变脂质体的双层结构,从而影响脂质体稳定性[24]。
2.6.2 pH稳定性
为验证尿石素A的稳定性,本文测定了不同pH对尿石素A紫外吸收强度的影响,如图8-a所示,当pH值从3增加至9时,紫外吸收强度值分别为0.34、0.48、0.50、0.71,呈现上升趋势,这可能是因为尿石素A的溶解度在碱性条件下随着pH值的增大而增大,从而导致其吸光值增加。根据激光共聚焦显微镜结果显示,在pH 3~9条件下,UA-LPs的形态仍较好(如图8-b所示),故可以排除UA-LPs本身因破乳导致尿石素A泄露的影响,因此在评价UA-LPs的pH稳定性的时候,可以排除尿石素A本身溶解度的增加对包埋率结果的影响。
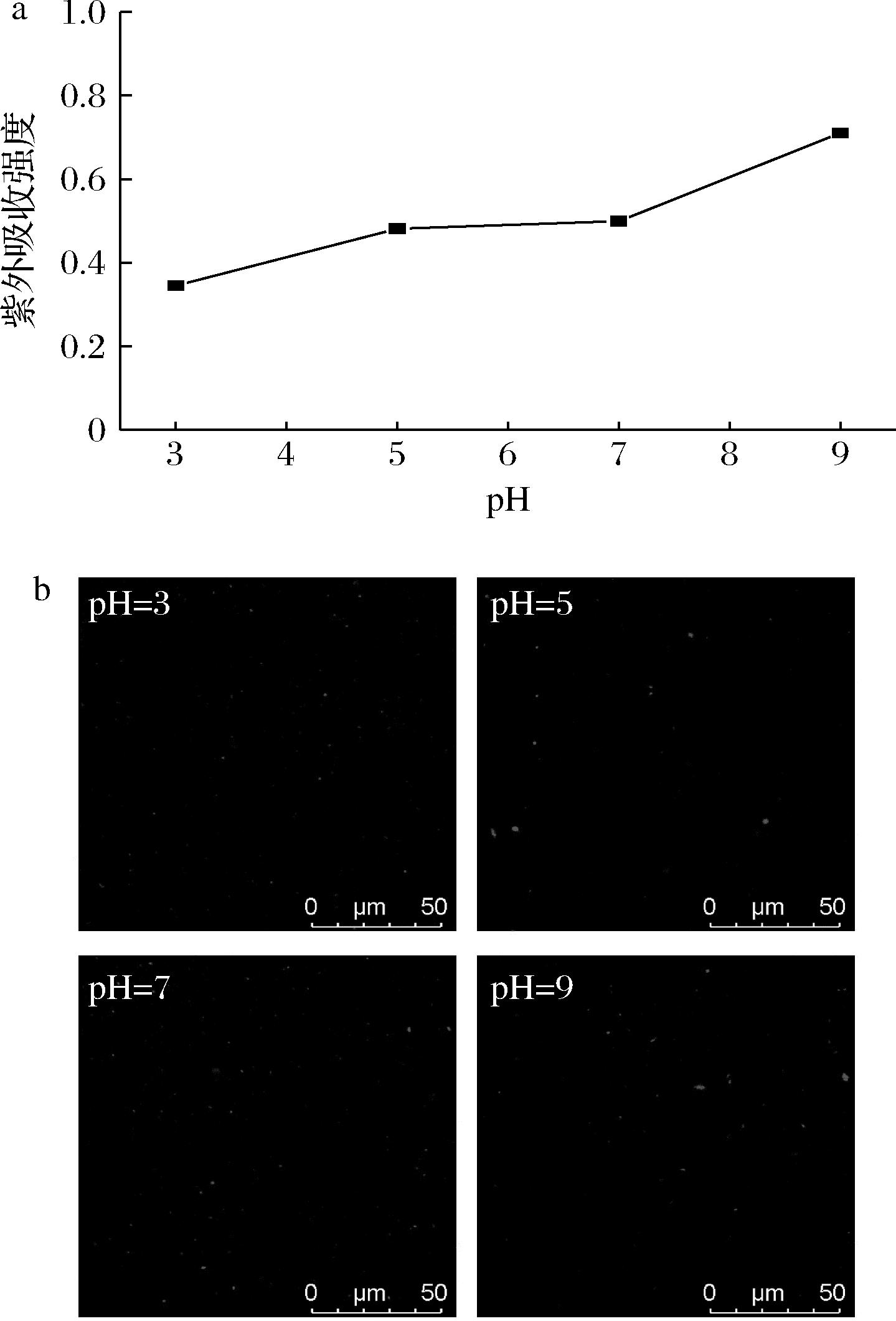
a-不同pH对尿石素A的影响;b-不同pH下UA-LPs 激光共聚焦显微镜图
图8 不同pH对尿石素A的影响
Fig.8 Effects of different pH on urolithin A
不同pH条件下不同壁材浓度UA-LPs的稳定性如图9所示。如图9-a所示,当SPC质量浓度为20 mg/mL时,随着pH值由3增加至7,其粒径由115.8 nm降低至109.3 nm,这种现象可能是由于脂质体在酸性介质中溶胀能力较强,导致囊泡增大[25]。当pH值由7增加至9时,粒径变化不显著(P>0.05),说明碱性环境对UA-LPs粒径的影响较小。当pH值为3时,随着SPC质量浓度的增加(5~20 mg/mL),其粒径分别为117.2、114.4、113.4和115.8 nm(P>0.05),说明在同一个pH值下,壁材浓度的变化对其粒径的影响较小。
如图9-b所示,当SPC质量浓度为20 mg/mL时,随着pH值由3增加至9,UA-LPs的PDI指数从0.48先降至0.34后增加到0.57,但数值总体变化差异不大。pH值分别为3和7时,不同壁材浓度的UA-LPs的PDI间无显著性差异(P>0.05),但在pH值为5和9时,呈不同的变化趋势,但最高和最低PDI的差异均在0.1之内,证明不同pH环境对不同SPC浓度的UA-LPs分散性影响较小。
如图9-c所示,5 mg/mL的UA-LPs的电位绝对值随着pH值的增加(3~9)从-39.5 mV降低至-49.0 mV,其Zeta电位绝对值变大,稳定性上升;在其他SPC浓度下,电位均随pH增加呈相同的变化趋势。上升主要归因于磷酸基团在碱性环境下电离。相比之下UA-LPs受碱性环境的影响较小,能够提高多酚在碱性条件下的稳定性。在同一个pH下,壁材浓度的变化对其表面电位绝对值的影响较小,整体来看,高浓度壁材的脂质体在不同的pH条件下,粒径改变幅度较小,Zeta电位更稳定。
在pH=3时,随着SPC质量浓度(5~20 mg/mL)的增加,其包埋率分别为47.8%、66.9%、72.5%和79.1%,呈现逐渐上升趋势(图9-d),证明壁材浓度越高,UA-LPs的pH稳定性越好。随着pH值的变化(3~9),20 mg/mL的UA-LPs的包埋率由79.1%增加至99.7%,说明UA-LPs在酸性条件下包埋率较低,这可能是由于磷脂的水解常数与环境的pH值密切相关,在强酸环境中,磷脂的水解常数增加,水解速率增大,从而影响脂质体的包埋率[26]。

a-粒径;b-PDI;c-电位;d-包埋率
图9 pH对UA-LPs粒径、PDI、电位及包埋率的影响
Fig.9 Effect of pH on particle size, PDI, potential and embedding rate of UA-LPs
2.7 体外模拟消化
采用体外模拟消化模型考察不同SPC浓度制备的UA-LPs在消化过程中的转化率及生物利用率。转化率为尿石素A在消化后仍保持潜在生物活性形式的百分比,而生物可接受度决定了尿石素A在消化液中溶解并因此可被吸收的部分,是评价营养素吸收率的重要指标[27]。其结果如图10所示,未包埋的尿石素A在经过胃肠模拟消化后的转化率为18.2%,包埋后,尿石素A的转化率随SPC浓度的增加分别为21.4%、25.3%、53.7%和77.5%,由此可见,经过包埋后可以将尿石素A与消化液隔离,改善其转化率。高浓度壁材的脂质体转化率更高,这是因为SPC浓度越高,所形成壁材越稳定,其更能阻止尿石素A与中性或碱性的环境相互作用,从而减少尿石素A的降解[28]。
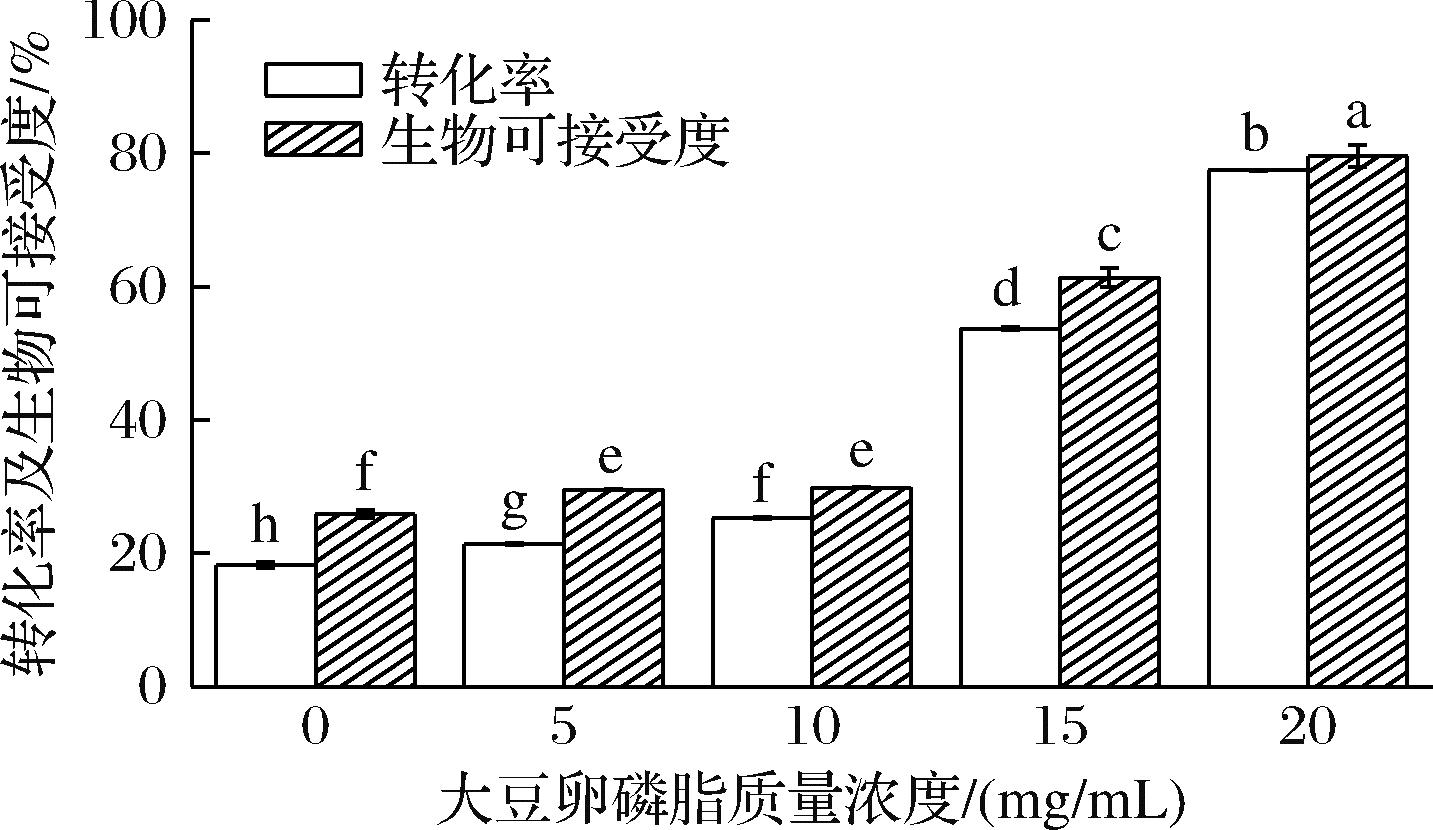
图10 UA-LPs模拟消化后的转化率及生物可接受度
Fig.10 Conversion and bio-acceptability of UA-LPs after simulated digestion
未包埋的尿石素A经胃肠模拟消化后的生物可接受度为25.9%,随SPC浓度的增加,UA-LPs的转化率分别为29.6%、29.8%、61.3%和79.6%,经过包埋后尿石素A的生物可接受度均比未包埋有所提高,其中SPC为20 mg/mL的脂质体将尿石素A的生物可接受度提高了2.07倍,说明SPC浓度越高,所制备的UA-LPs的生物可接受度越高。这是因为脂质体的磷脂消化产物可以增加用于结合疏水生物活性的非极性结构域数量来进一步增加混合胶束的增溶能力。从而使得尿石素A的生物可接受度增加[29]。
3 结论
通过研究芯材和壁材浓度对UA-LPs的包埋率、粒度、电位和稳定性等影响以及微观形貌分析。确定了UA-LPs制备工艺条件为尿石素A 0.5 mg/mL、大豆卵磷脂20 mg/mL,在此条件下,尿石素A的包埋率为(98.11±0.26)%,UA-LPs的平均粒径为(97.46±0.83) nm,多分散系数为0.27±0.01,Zeta电位为(-40.3±1.06) mV。原子力显微镜分析显示UA-LPs呈均匀分布的小球状,热稳定性研究结果表明,高壁材浓度的UA-LPs的热稳定性更好,在80 ℃孵育180 min后仍有40%的尿石素A负载率,在碱性环境下的稳定性也更高。体外模拟消化实验结果表明,UA-LPs能够显著提高尿石素A的转化率以及生物可接受度,下一步我们将通过动物实验来验证UA-LPs对生物体内利用率的影响。从而为拓宽尿石素A在食品和医药领域的应用提供依据。
[1] LANDETE J M, ARQUÉS J, MEDINA M, et al.Bioactivation of phytoestrogens:Intestinal bacteria and health[J].Critical Reviews in Food Science and Nutrition, 2016, 56(11):1826-1843.
[2] RYU D, MOUCHIROUD L, ANDREUX P A, et al.Urolithin A induces mitophagy and prolongs lifespan in C.elegans and increases muscle function in rodents[J].Nature Medicine, 2016, 22(8):879-888.
[3] D’AMICO D, ANDREUX P A, VALDÉS P, et al.Impact of the natural compound urolithin A on health, disease, and aging[J].Trends in Molecular Medicine, 2021, 27(7):687-699.
[4] LEE H J, JUNG Y H, CHOI G E, et al.Urolithin A suppresses high glucose-induced neuronal amyloidogenesis by modulating TGM2-dependent ER-mitochondria contacts and calcium homeostasis[J].Cell Death &Differentiation, 2021, 28(1):184-202.
[5] LUAN P L, D’AMICO D, ANDREUX P A, et al.Urolithin A improves muscle function by inducing mitophagy in muscular dystrophy[J].Science Translational Medicine, 2021, 13(588):eabb0319.
[6] KUJAWSKA M, JODYNIS-LIEBERT J.Potential of the ellagic acid-derived gut microbiota metabolite - Urolithin A in gastrointestinal protection[J].World Journal of Gastroenterology, 2020, 26(23):3170-3181.
[7] CERD B, ESP
B, ESP N J C, PARRA S, et al.The potent in vitro antioxidant ellagitannins from pomegranate juice are metabolised into bioavailable but poor antioxidant hydroxy-6H-dibenzopyran-6-one derivatives by the colonic microflora of healthy humans[J].European Journal of Nutrition, 2004, 43(4):205-220.
N J C, PARRA S, et al.The potent in vitro antioxidant ellagitannins from pomegranate juice are metabolised into bioavailable but poor antioxidant hydroxy-6H-dibenzopyran-6-one derivatives by the colonic microflora of healthy humans[J].European Journal of Nutrition, 2004, 43(4):205-220.
[8] ZOU D X, GANUGULA R, ARORA M, et al.Oral delivery of nanoparticle urolithin A normalizes cellular stress and improves survival in mouse model of cisplatin-induced AKI[J].American Journal of Physiology.Renal Physiology, 2019, 317(5):F1255-F1264.
[9] YI S F, ZHANG C, HU J J, et al.Preparation, characterization, and in vitro pharmacodynamics and pharmacokinetics evaluation of PEGylated urolithin A liposomes[J].AAPS PharmSciTech, 2021, 22(1):1-12. [10] LIU Y X, HUANG L, LI D H, et al.Re-assembled oleic acid-protein complexes as nano-vehicles for astaxanthin:Multispectral analysis and molecular docking[J].Food Hydrocolloids, 2020, 103:105689.
[11] 李妍, 方芳, 曹珂珂, 等.枸杞多糖脂质体制备工艺[J].食品与发酵工业, 2018, 44(5):176-181. LI Y, FANG F, CAO K K, et al.Liposome preparation technology of Lycium barbarum polysaccharide[J].Food and Fermentation Industries, 2018, 44(5):176-181.
[12] 董鸿春, 付聪, 杨贤庆, 等.类胡萝卜素脂质体的特性、制备与评价的研究进展[J].食品与发酵工业, 2022, 48(14):303-310. DONG H C, FU C, YANG X Q,et al.Research progress on characteristics, preparation and evaluation of carotenoid-loaded liposomes[J].Food and Fermentation Industries, 2022, 48(14):303-310.
[13] PAN K, LUO Y C, GAN Y D, et al.pH-driven encapsulation of curcumin in self-assembled casein nanoparticles for enhanced dispersibility and bioactivity[J].Soft Matter, 2014, 10(35):6820-6830.
[14] 彭盛峰. pH驱动法制备姜黄素食品运载体及其生物利用率[D].南昌:南昌大学, 2019. PENG S F.The preparation and bioavailability of curcumin loaded food delivery system by pH-driven method[D].Nanchang:Nanchang University, 2019.
[15] ZHANG J Y, HASSANE HAMADOU A, CHEN C, et al.Encapsulation of phenolic compounds within food-grade carriers and delivery systems by pH-driven method:A systematic review[J].Critical Reviews in Food Science and Nutrition, 2023, 63(19):4153-4174.
[16] PENG S F, ZOU L Q, ZHOU W, et al.Encapsulation of lipophilic polyphenols into nanoliposomes using pH-driven method:Advantages and disadvantages[J].Journal of Agricultural and Food Chemistry, 2019, 67(26):7506-7511.
[17] 王胜男, 赵贺开, 邵国强, 等.酶改性大豆种皮多糖对蛋白乳液稳定性的影响[J].食品与发酵工业, 2020, 46(15):46-51. WANG S N, ZHAO H K, SHAO G Q, et al.Effect of enzymatically modified soybean polysaccharides on stability of protein emulsion[J].Food and Fermentation Industries, 2020, 46(15):46-51.
[18] ZHANG Q Z, CHENG Z Z, WANG Y B, et al.Dietary protein-phenolic interactions:Characterization, biochemical-physiological consequences, and potential food applications[J].Critical Reviews in Food Science and Nutrition, 2021, 61(21):3589-3615.
[19] 葛彦. 茶树精油脂质体/壳聚糖缓释抗菌材料的制备及性能研究[D].无锡:江南大学, 2015. GE Y.Preparation and properties of tea tree oil liposomes/chitosan sustained-release antimicrobial materials[D].Wuxi:Jiangnan University, 2015.
[20] 郝静梅, 孙志高, 盛冉, 等.柠檬烯纳米脂质体的制备及其性质测定[J].食品与发酵工业, 2018, 44(4):173-179. HAO J M, SUN Z G, SHENG R, et al.Preparation and characterization of limonene nanoliposomes[J].Food and Fermentation Industries, 2018, 44(4):173-179.
[21] 邝鹏程, 王伟华, 郭瑞成.脂质体的制备、表征及其在食品中应用的研究进展[J].食品工业, 2021, 42(9):245-249. KUANG P C, WANG W H, GUO R C.Preparation, characterization and application of liposome in food[J].The Food Industry, 2021, 42(9):245-249.
[22] 刘瑞霞, 潘丽, 丁冬有.苦杏仁苷脂质体的制备及特性研究[J].河南工业大学学报(自然科学版), 2020, 41(5):57-63;78. LIU R X, PAN L, DING D Y.Preparation of amygdalin-loaded liposomes and the characteristics study [J].Journal of Henan University of Technology (Natural Science Edition), 2020, 41(5):57-63;78.
[23] 袁松, 孙会敏, 丁丽霞.脂质体物理化学稳定性研究进展[J].中国药事, 2011, 25(4):384-388. YUAN S, SUN H M, DING L X.Progress of physical and chemical stability of liposomes[J].Chinese Pharmaceutical Affairs, 2011, 25(4):384-388.
[24] 涂宗财, 张朋, 王辉,等.鱼油纳米脂质体的制备及其性质测定[J].食品与发酵工业, 2013, 39(2):50-55. TU Z C, ZHANG P, WANG H, et al.Preparation and characterization of fish oil nanoliposomes [J].Food and Fermentation Industries, 2013, 39(2):50-55.
[25] KALANTARI K, AFIFI A M, JAHANGIRIAN H, et al.Biomedical applications of chitosan electrospun nanofibers as a green polymer-Review[J].Carbohydrate Polymers, 2019, 207:588-600.
[26] FRENZEL M, STEFFEN-HEINS A.Impact of quercetin and fish oil encapsulation on bilayer membrane and oxidation stability of liposomes[J].Food Chemistry, 2015, 185:48-57.
[27] ZOU L Q, ZHENG B J, ZHANG R J, et al.Food-grade nanoparticles for encapsulation, protection and delivery of curcumin:Comparison of lipid, protein, and phospholipid nanoparticles under simulated gastrointestinal conditions[J].RSC Advances, 2016, 6(4):3126-3136.
[28] LI Z L, PENG S F, CHEN X, et al.Pluronics modified liposomes for curcumin encapsulation:Sustained release, stability and bioaccessibility[J].Food Research International, 2018, 108:246-253.
[29] BIRRU W A, WARREN D B, IBRAHIM A, et al.Digestion of phospholipids after secretion of bile into the duodenum changes the phase behavior of bile components[J].Molecular Pharmaceutics, 2014, 11(8):2825-2834.