B族维生素是根据其水溶性和相互关联的细胞辅酶功能进行分类而得到的一组维生素。其中维生素B9作为主要的甲基携带者,参与人体的叶酸循环并与蛋氨酸循环共同构成一碳代谢,在DNA、RNA的合成、修复,神经管的闭合,髓鞘的发育等方面发挥了不可或缺的作用[1]。尤其是生命的“前1 000天”,充足的叶酸可以预防神经管缺陷、促进儿童的认知发育等[2-3]。因此,维生素B9的有效补充对于孕妇和儿童至关重要。研究表明,我国预计有30%的孕妇存在叶酸缺乏现象,尤其北方地区的孕妇[4]。其原因一方面在于富叶酸食物的摄入量不足;另一方面食物中的维生素B9多以多聚谷氨酸形式存在,而小肠细胞仅能转运单谷氨酸形式的维生素B9[5],造成了食物中维生素B9的低生物可及性,进而影响其生物利用度,所以进行额外的补充剂摄入是有必要的。叶酸常被用于指代一种合成的氧化形式的维生素B9,即蝶酰谷氨酸,相对于天然维生素B9来说,由于它具有更好的稳定性和生物利用度,且生产工艺成熟、价格低廉,因此常被用于膳食补充剂或食品添加剂。但叶酸的酸不稳定性导致其进入胃部后易产生损耗,因此,对叶酸进行一定的包埋有利于提高其生物可及性。
国外已有包括凝聚、电喷雾、静电纺丝、脂质体等[6]技术应用于叶酸包埋以提高其储存、消化过程中的稳定性,但存在工艺复杂、设备昂贵、引入较多非食品原料、生物可及性不高等问题,而国内研究大部分致力于使叶酸功能化携带药物达到靶向治疗癌症作用,较少关注叶酸的包埋,且已有的研究通常采用相分离法,同样存在类似问题[7],而市面上已有的叶酸补充剂大多直接与辅料混合压片,无法在胃部达到保护作用,少数采用薄膜包衣技术,但成分复杂。因此,制备一款工艺简单、无需过多非食品原料且生物可及性良好的叶酸补充剂非常有必要。
壳聚糖在递送方面,是应用最广泛的聚合物之一。因其分子质量适中、毒性低、生物可降解性以及酸性条件下富含的质子化氨基,能实现pH响应型体系的可控释放[8]。其中常用方法包括共价交联法、离子交联法、复凝聚法、喷雾干燥法[9]。其中共价交联法是利用分子链上的氨基或羟基等与一些化学交联剂发生化学交联反应,产物稳定性好,但交联剂往往具备一定毒性。离子交联法通常是利用三聚磷酸钠与壳聚糖进行离子间静电吸附诱导胶凝化,该法反应条件温和。复凝聚法是通过混合带相反电荷的聚电解质溶液调节pH而自发形成微囊。喷雾干燥法是使流体样品与干燥气流间形成最大表面积,促使有效快速雾化。前2种方法相对共价交联法均具有更高的安全性,但相对喷雾干燥法存在步骤较为复杂,工业生产条件要求较高等缺点。
综上所述,本研究采用喷雾干燥法,以壳聚糖为壁材,制备叶酸微胶囊,之后分析评价其粉体颗粒的大小和粒度分布是否均匀,观察其颗粒微观形态;然后通过模拟体外消化,采用HPLC方法对其生物可及性进行评价,并选取市售4种叶酸补充剂进行生物可及性对比。最后,为进一步探究壳聚糖微胶囊的动力学溶出特性,测定了该微胶囊在水中的溶出过程,并选取5种动力学模型进行非线性拟合,将壳聚糖的溶出过程数字化,为缓释产品的设计和其他微胶囊系统的设计提供参考。
1 材料与方法
1.1 材料与试剂
叶酸、壳聚糖、唾液淀粉酶、胃蛋白酶、胰酶,美国Sigma化学公司;胆盐,上海麦克林生化科技股份有限公司;其他试剂均为国产分析纯;除尘罐,上海展途化工有限公司;叶酸补充剂,市售。
1.2 仪器与设备
PL203型分析天平,梅特勒-托利多仪器有限公司;T25基本型ULTRA-TURRAX分散机,德国IKA公司;S3500激光粒度分析仪美国麦奇克有限公司;B-290小型喷雾干燥机,瑞士步琦实验室仪器公司;Phenom ProX型台式能谱扫描电镜,荷兰Delmic公司;Spectra Max i3酶标仪,美国MD公司;2695液相色谱仪,美国Waters公司;ChromCore AR C18液相色谱柱(5.0 μm,250 mm×4.6 mm),纳谱分析技术(苏州)有限公司;ZRS-8G药物溶出仪,天津鑫洲科技有限公司。
1.3 实验方法
1.3.1 壳聚糖-叶酸微胶囊制备工艺
在ESTEVINHO等[10]的基础上,通过预实验得到以下工艺流程:
壳聚糖→溶解→加入叶酸→剪切→喷雾干燥→叶酸微胶囊
将壳聚糖溶于2%(体积分数)的醋酸溶液得到2%(质量分数)壳聚糖溶液,加入叶酸,在6 500 r/min下剪切15 min得到含0.5%(质量分数)叶酸的壁芯材悬浊液,之后在入口温度150 ℃,4 mL/min流速下进行喷雾干燥,得到壳聚糖-叶酸微胶囊。
1.3.2 壳聚糖-叶酸微胶囊的粉体特性
1.3.2.1 壳聚糖-叶酸微胶囊的粒度分析
将一定量的样品加入至无水乙醇中,经超声波分散30 s后,滴入至粒度分析仪中,检测得到样品的平均径、中位径(D50)、跨度[(D90-D10)/D50]和粒度分布。
1.3.2.2 壳聚糖-叶酸微胶囊的电镜观察
取少量微胶囊粉末置于导电胶上,使用除尘罐吹去浮粉,将样品放于置物台上,于电镜中分别在4 000×、7 000×、12 000×倍数下进行观察。同时,对未包埋叶酸进行观察对比。
1.3.3 壳聚糖-叶酸微胶囊的生物可及性
1.3.3.1 叶酸含量测定
采用HPLC法,参照高桂花等[11]的方法稍作修改。梯度洗脱程序如表1所示,进样量10 μL,流速0.8 mL/min,检测波长254 nm,检测时间30 min。
表1 HPLC方法测定叶酸的梯度洗脱流程
Table 1 HPLC gradient elution process of folic acid

时间/minA[V(水)∶V(冰醋酸)=60∶0.1]/%B(甲醇)/%08020152080235050308020
称取3 mg叶酸标品溶解于0.5%(体积分数)氨水中,并定容至25 mL,稀释得到一定浓度梯度的叶酸标准溶液,过0.22 μm滤膜后进入HPLC测定峰面积,并绘制标准曲线。通过在一天中的3个不同时间和连续3 d测量同一样品,检测日内精密度和日间精密度,每次重复注射3次,并计算峰面积之间的相对标准偏差。通过将不同样品与已知标准溶液混合测定并计算回收率,以检查HPLC方法的可靠性。
1.3.3.2 壳聚糖-叶酸微胶囊的负载量测定
在确定生物可及性之前确定微胶囊及市售产品的负载量。将5 mg微胶囊及一片市售产品溶于0.5%(体积分数)的氨水溶液中,在25 mL容量瓶中定容,过0.22 μm的滤膜后,按照1.3.3.1节的方法测定叶酸含量。并根据公式(1)计算出负载量:
负载量![]()
(1)
1.3.3.3 壳聚糖-叶酸微胶囊的生物可及性探究
体外模拟消化模型是参考文献[12-13]的方法并略有调整。所需各溶液配制如表2所示。每次试验前通过预试验确定调节胃液和肠液pH所需1 mol/L HCl或1 mol/L NaOH溶液的量。
表2 体外消化液的配制
Table 2 Configuration of in vitro digestion solution
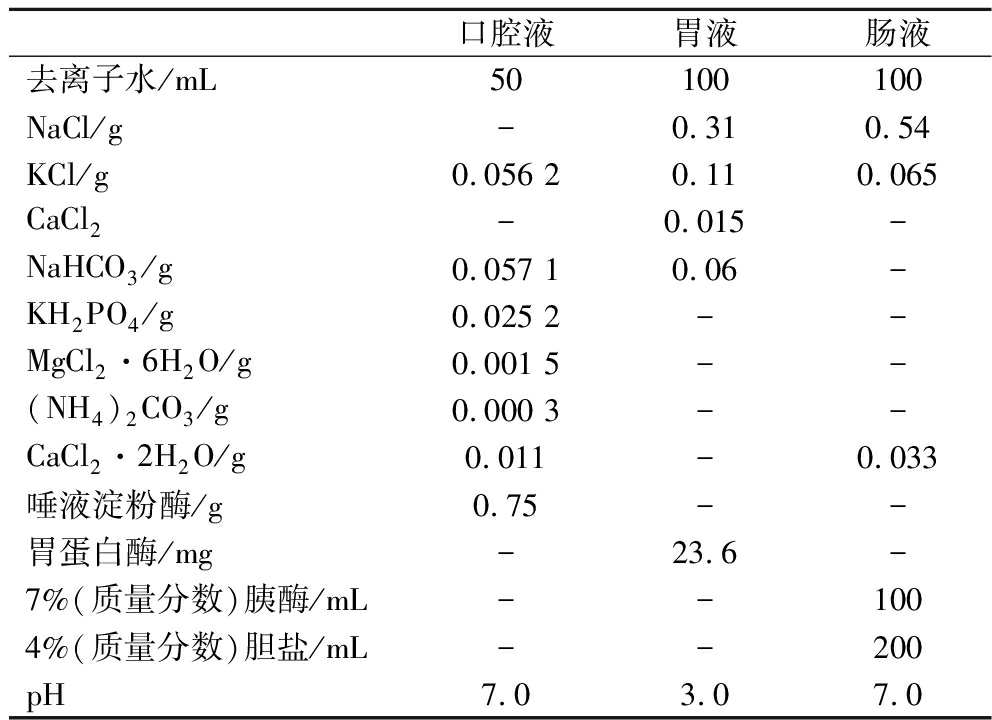
口腔液胃液肠液去离子水/mL50100100NaCl/g-0.310.54KCl/g0.056 20.110.065CaCl2-0.015-NaHCO3/g0.057 10.06-KH2PO4/g0.025 2--MgCl2·6H2O/g0.001 5--(NH4)2CO3/g0.000 3--CaCl2·2H2O/g0.011-0.033唾液淀粉酶/g0.75--胃蛋白酶/mg-23.6-7%(质量分数)胰酶/mL--1004%(质量分数)胆盐/mL--200pH7.03.07.0
注:-表示未添加。
除本研究制备的壳聚糖-叶酸微胶囊外,还任意选取了市面上已有的4种叶酸补充剂探究生物可及性。测量时,称取50 mg微胶囊,以及含相同叶酸量的市售产品,用水稀释至5 mL,与口腔电解质按1∶1(体积比)混合,并加入唾液淀粉酶。在2 min内加入1 mol/L HCl溶液调节pH值为2.0并涡旋混匀以停止口腔模拟消化,再用胃液以1∶1(体积比)的比例稀释口腔消化物,然后在pH 3.0、200 r/min下搅拌2 h。然后于消化体系中立即加入1 mol/L NaOH溶液调节pH值到7.0以停止胃模拟消化,再用肠液1∶1(体积比)稀释胃消化液,然后在pH 7.0、200 r/min条件下搅拌2 h。分别在胃消化阶段和肠消化阶段的30、60、90和120 min取500 μL样品,加入到4倍体积的无水乙醇中,然后加入5 mL的0.5%(体积分数)氨水溶解稳定叶酸。通过0.22 μm滤膜过滤,进入HPLC检测叶酸含量。叶酸释放率的计算如公式(2)所示:
叶酸释放率![]()
(2)
1.3.4 壳聚糖-叶酸微胶囊的溶出特性评价
1.3.4.1 酶标仪法测定壳聚糖-叶酸
考虑到溶出特性研究侧重于芯材释放的整体变化过程,且研究过程中取样点密集,因此选取检出限更高,但无需前处理且检测速率快的酶标仪法对叶酸进行快速、高效的测定。
首先称取3 mg叶酸标品分散于水中并定容至25 mL,再稀释成一定浓度梯度的标准溶液,在360 nm处测定吸光值,并绘制标准曲线。
1.3.4.2 壳聚糖-叶酸微胶囊溶出释放率的测定
取5 mg样品加入500 r/min搅拌的100 mL水中,在10、30、60 s处取1 mL溶液,之后再间隔60 s取样,并用等量水补齐,之后利用酶标仪测定叶酸含量。根据公式(3)计算叶酸溶出率:
叶酸溶出率![]()
(3)
1.3.4.3 溶出模型拟合[14-17]
结合该微胶囊的粉体特性,通过文献调研,选出与之相符的动力学模型,共5种动力学模型,利用SPSS软件进行非线性拟合,得到不同参数的最大似然估计值。
(a)Weibull模型
该模型适用于比较基质类药物的释放曲线,如通过喷雾干燥获得的微胶囊。具体如公式(4)所示:
![]() =1-e-α(t-Ti)β
=1-e-α(t-Ti)β
(4)
式中:Mt,t时叶酸的释放量;M∞,时间趋于无穷时叶酸的释放量;α,比例参数,定义了过程的时间尺度,即时间依赖性;Ti,位置参数,指开始释放的滞后时间,通常为0。形状参数β描述了溶解曲线的形状。当β=1时,曲线为指数曲线,其中常数K=1/α;当β>1时,曲线为S形。当β<1时,其形状显示为抛物线曲线,显示了使用复合曲线得出的数据的陡峭程度,这基本上显示了特定部位的双相释放动力学。
(b)Korsmeyer-Peppas模型
该模型用于分析药物在膨胀和非膨胀聚合物输送系统中的Fick扩散和non-Fick扩散的经验公式。如公式(5)所示:
![]() =KKtn
=KKtn
(5)
式中:KK,Korsmeyer速率常数,它与物质的结构和几何特征相关,包括微胶囊、薄膜、片剂等。n,释放指数,不同的n值范围可用于描述不同的释放机制。
(c)Baker-Lonsdale模型
该模型用于描述类球形胶囊的释放,线性化微囊制剂的释放数据。如公式(6)、公式(7)所示:
(6)
(7)
式中:释放率常数k与斜率相对应,而Cs为叶酸在壁材溶液中的溶解度;D,扩散系数;r0,微胶囊的半径、C0,单位体积所含有的初始叶酸量。且满足C0≫Cs。
(d)Gompertz模型
Gompertz模型由公式(8)表示,更适合于比较具有较好溶解度和中等释放率的药物的释放曲线。
Xt=Xmaxexp(-αeβ lgt)
(8)
式中:Xt,时间t的溶解百分比除以100;Xmax,最大溶解度;α,时间t=1时未溶解的比例,描述为位置或比例参数;β,单位时间的溶解率,描述为形状参数。
(e)Hixson-Crowell模型
该模型描述的是颗粒或片剂溶解释放时表面积和直径随时间发生的变化,如公式(9)所示。
(9)
式中:W0,微胶囊中叶酸的初始量,Wt,时间t时微胶囊中剩余的叶酸量。K,常数,结合了表面与体积关系。
1.3.4.4 拟合优度分析
赤池信息准则(Akike information criteria,AIC)和贝叶斯信息准则(Bayesian information criterion,BIC)是评估所选模型拟合质量的指标,其计算按公式(10)、公式(11)所示:
(10)
(11)
式中:RSS,残差平方的总和;p,模型中参数的数量;n,试验数据点的数量。
1.3.5 数据统计
所有试验均进行3次,并通过Excel 2021计算平均值。通过SPSS Statistics 25进行溶出曲线的模型拟合。图表由Origin 2019 b绘制。
2 结果与分析
2.1 壳聚糖-叶酸微胶囊的粉体特性
2.1.1 粒度分析
壳聚糖-叶酸微胶囊平均径、中位径(D50)、跨度[(D90-D10)/D50]和粒度分布的峰值如表3所示,粒度分布曲线如图1所示。总体可以看出,制备的微胶囊粒度分布均匀,且加入叶酸后,微胶囊的平均粒径及中位径均减小。其中平均径包括体积平均径[D(4,3)]和比表面积平均径[D(3,2)],2种粒径相差越小,说明颗粒越接近球形,由表3中可以看出,空胶颗粒的D(4,3)、D(3,2)相差不大,说明颗粒接近球形,但加入叶酸后两值相差变大,说明包埋后存在不规则颗粒。由跨度变化可以看出加入叶酸后粒度分布均匀度降低,反映在粒度分布曲线上为峰宽变宽。且加入叶酸后,颗粒粒度整体前移,峰值由36.12 μm降至20.62 μm。
表3 壳聚糖-叶酸微胶囊的粒度分析结果
Table 3 Particle size of chitosan-folic acid microcapsules

平均径D(4,3)/μmD(3,2)/μmD50/μm(D90-D10)/D50峰/μm壳聚糖33.0834.0231.800.6736.12 壳聚糖+叶酸18.8920.0317.780.9020.62
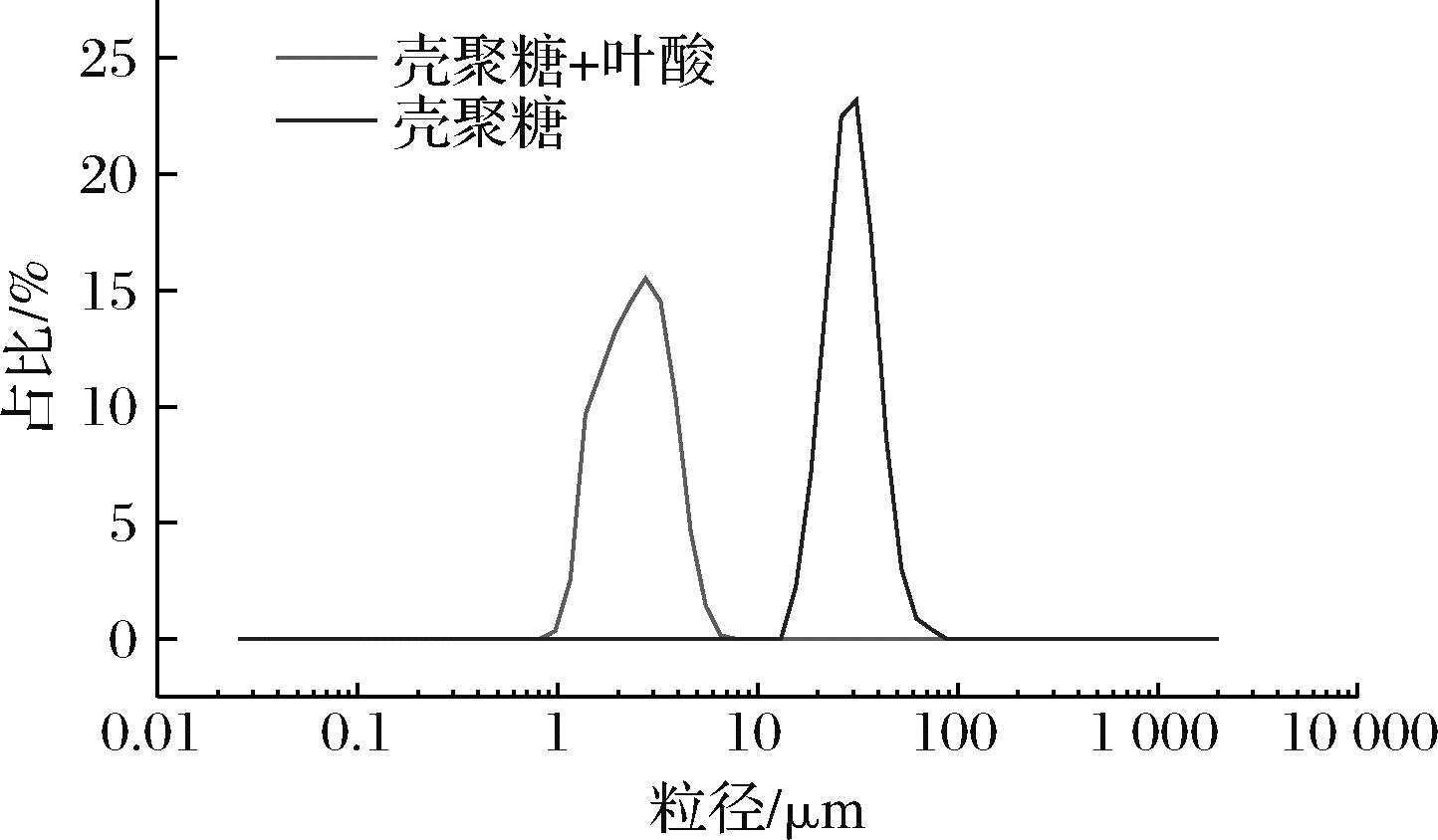
图1 壳聚糖和壳聚糖-叶酸微胶囊的粒度分布图
Fig.1 Particle size distribution of chitosan and chitosan-folic acid microcapsules
2.1.2 电镜观察
叶酸、壳聚糖空胶以及壳聚糖-叶酸微胶囊的电镜图见图2。

a-叶酸(7 000×);b-叶酸(12 000×);c-壳聚糖(7 000×); d-壳聚糖(12 000×);e-壳聚糖-叶酸微胶囊(7 000×); f-壳聚糖-叶酸微胶囊(12 000×)
图2 不同倍数下叶酸、壳聚糖和壳聚糖-叶酸 微胶囊的电镜图
Fig.2 Electron micrographs of folic acid, chitosan, and chitosan-folic acid microcapsules at different magnifications
叶酸呈长片状结构,而壳聚糖空胶接近球状结构,且表面非常粗糙,有类似于大脑表面结构的褶皱,呈多孔状结构,即使在加入叶酸后,形成的微胶囊表面也有类似的褶皱和小孔,此外,加入叶酸后,受叶酸长片状结构影响,微胶囊存在不规则颗粒,部分变成梭状结构。综上所述,电镜结果与粒度分析结果均说明壳聚糖-叶酸微胶囊存在不规则颗粒。
2.2 壳聚糖-叶酸微胶囊的生物可及性
2.2.1 HPLC测定结果
HPLC方法测定叶酸的出峰时间为9.25 min,对修改后的方法进行验证,不同浓度标准溶液色谱图如图3所示,得到的标准曲线回归方程为y=15 465.788x+2.973,R2=1,回归的标准误差Sy/x=2.277,斜率的偏差Sa=22.896,截距的偏差Sb=1.295。斜率的置信区间为(15 402.219,15 529.356),截距的置信区间为(-0.622,6.569)。计算出的检测限为0.053 μg/mL,定量限为0.162 μg/mL。加标回收率为(103.69±0.41)%,相对标准偏差为0.39%。日内精密度为0.44%,日间精密度为0.92%,说明方法重复性好。

图3 叶酸标准溶液色谱图
Fig.3 Chromatogram of folic acid standard solution
2.2.2 生物可及性
由表4中可以看出,单独叶酸在经过胃肠道消化时会发生损失,由于叶酸对酸性环境的敏感性,叶酸在胃部2 h共损失32.31%,且主要发生在前30 min内,而在肠道损失较少。经过喷雾干燥法包埋后,微胶囊在胃肠道消化过程中的损失减少,尤其在胃部极端酸性条件下的损失减小,2 h仅损失12.08%,且叶酸分解速率降低。其原因可能有2点,一是壳聚糖的包埋使叶酸在胃部被缓慢释放,在1 h左右叶酸才被完全释放,缩短了叶酸与酸性环境的接触时间;二是壳聚糖的包裹减少了叶酸与酸性环境的接触面积,所以在1 h后叶酸的损失增加。而从市售产品消化过程中叶酸释放率变化可以看出,叶酸发生损失同样主要在胃部,同时相对于未包埋叶酸,胃部损失率更大,说明这些产品的生产方式并未对叶酸起保护作用甚至不利于叶酸在胃部的稳定性。此外,叶酸释放率在肠部的增加现象可能是部分叶酸在胃部未完全溶解或部分叶酸在酸性条件下分解后,再转入中性条件下时,产物可能会重新形成叶酸,但目前还未有相关研究报道。
表4 叶酸、壳聚糖-叶酸微胶囊和市售产品体外消化的叶酸释放率
Table 4 Folic acid release rates from folic acid, chitosan-folic acid microcapsules, and commercial products digested in vitro
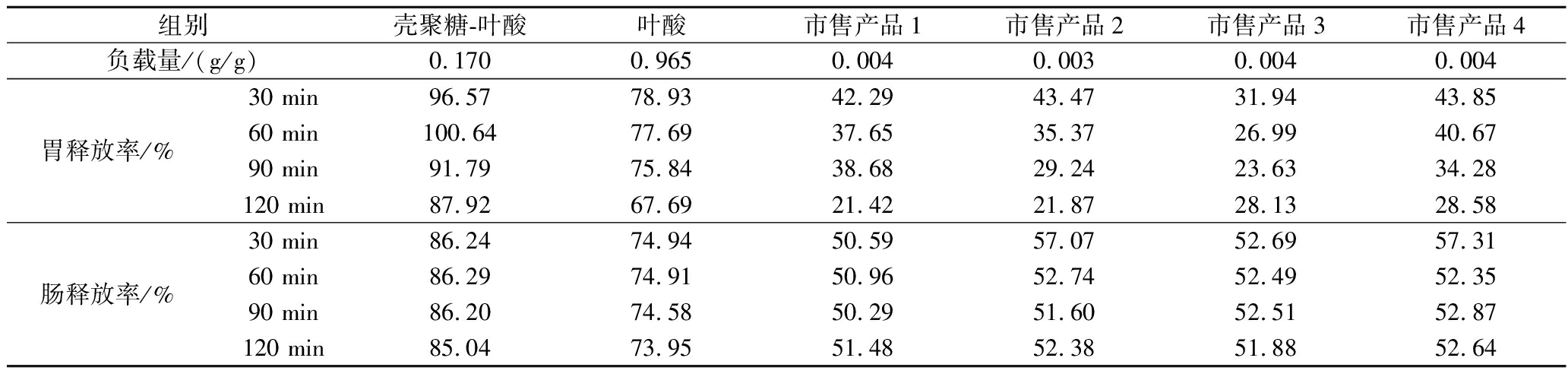
组别壳聚糖-叶酸叶酸市售产品1市售产品2市售产品3市售产品4负载量/(g/g)0.1700.9650.0040.0030.0040.004胃释放率/%30 min96.5778.9342.2943.4731.9443.8560 min100.6477.6937.6535.3726.9940.6790 min91.7975.8438.6829.2423.6334.28120 min87.9267.6921.4221.8728.1328.58肠释放率/%30 min86.2474.9450.5957.0752.6957.3160 min86.2974.9150.9652.7452.4952.3590 min86.2074.5850.2951.6052.5152.87120 min85.0473.9551.4852.3851.8852.64
由于叶酸在小肠的空肠近端及十二指肠处被吸收,因此其在小肠部位的释放率体现了微胶囊的生物可及性。微囊化的叶酸在经过4 h的胃肠道消化后其生物可及性由73.95%增加到85.04%,而4种产品生物可及性在51%~53%,说明该壳聚糖-叶酸微胶囊生物可及性良好。PENALVA等[18]制备了酪蛋白纳米颗粒,测定了其在pH=1.2的胃部消化2 h和pH=6.8的肠部消化20 h的叶酸释放量,发现该纳米胶囊在胃部没有释放,而在肠部时,一开始释放较快,但在消化4 h时释放率仅为70%,之后释放极为缓慢,直到10 h时释放率才达到约90%,但在人体体内环境中,大部分摄入叶酸无法在小肠前端停留10 h,因此,本文制备的叶酸微胶囊生物可及性更高。FATHIMA等[19]同样选取了壳聚糖作为壁材制备叶酸纳米胶囊,但采用的方法是离子交联法,通过壳聚糖伯氨基上的阳离子与三聚磷酸钠的阴离子在适宜的条件下交联,得到的叶酸纳米胶囊生物可及性高,经过10 min pH 6.8的口腔消化、2 h pH 2.0的胃部消化以及3 h pH 7.0的肠部消化后,生物可及性达到90%,但该法操作复杂,不适用于工业生产。因此,总体来说,壳聚糖适合作为叶酸微囊化的壁材,在胃部可保护叶酸减少损失,提高生物可及性,但制备过程中应注意叶酸与壳聚糖溶液的接触时间,避免时间过长造成叶酸在制备过程中的大量损耗。
2.3 壳聚糖-叶酸微胶囊的溶出特性
在本研究对壳聚糖-叶酸微胶囊体外释放进行了研究。由释放过程可看出(图4),壳聚糖-叶酸微胶囊的释放可以分为3个阶段,第一个阶段是快速释放阶段,由于制备过程中,包埋的亲水性化合物会吸附在界面上,从而可能会变成生物活性物质的饱和状态,再加上未被包埋的化合物,使其在水中发生快速释放;第二阶段是持续释放阶段,叶酸随壳聚糖的溶胀缓慢漏出;第三阶段是平稳阶段,壳聚糖的溶胀到达极限,无法释放更多叶酸,释放率趋于平缓。由释放的时间可以看出,壳聚糖在水中进行极为缓慢的溶胀现象,超过200 min仍未完全溶解,且叶酸释放量趋于不变,超过20%(质量分数)的叶酸未被释放,其原因是壳聚糖的酸性溶解性使其在水中无法完全溶解。
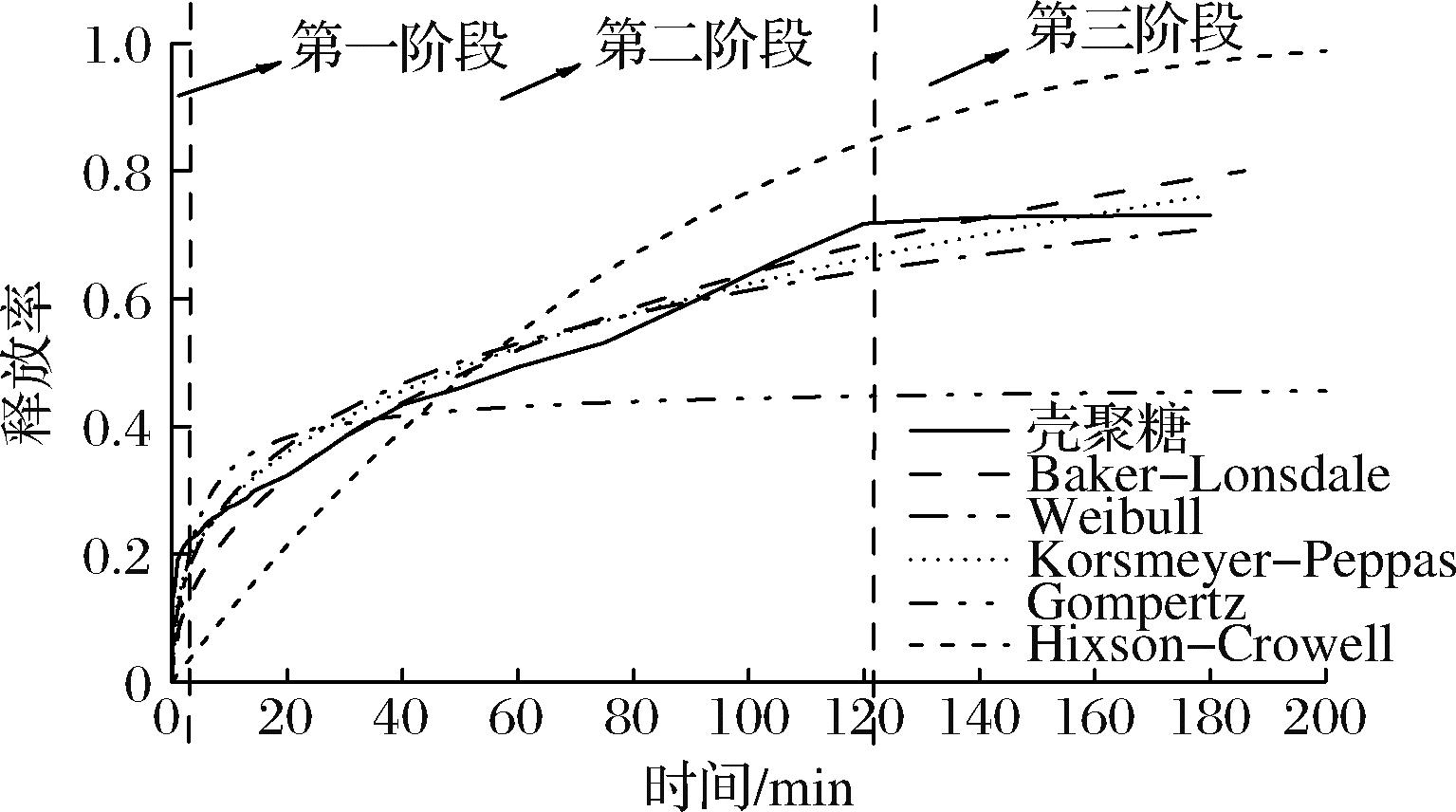
图4 壳聚糖-叶酸微胶囊溶出曲线及不同模型拟合曲线
Fig.4 Dissolution curves of chitosan-folic acid microcapsules and fitting curves of different models
通过对该微囊系统释放机制的研究,有助于设计理想的控释系统。溶解释放过程包括生物活性物质向相邻界面的初次迁移,以及随后从界面扩散到介质中[20],上述第一和第二阶段均包含了这2个过程。通过选取适当的动力学模型将该释放机制数字化,再利用参数变化,模拟设计参数制备产品,从而改变第一和第二阶段的变化过程。因此,本研究利用软件选取不同模型与微胶囊释放过程进行拟合,从而选取最适模型将该微胶囊的释放过程数字化,如表5所示。AIC与BIC均是常用于评估拟合优度的指标,其值越小说明模型拟合效果越佳,而AIC更倾向于选出预测效果最优的模型,BIC则偏向于与数据最为符合的模型。从表5可以看出,AIC与BIC结果较为一致,均显示Baker-Lonsdale模型拟合效果最好,说明微胶囊的负载量远大于叶酸的溶解度,而从制备过程壁芯材悬浊液状态可看出叶酸的溶解度低。Baker-Lonsdale模型得到的拟合曲线方程为![]() 其中,k=0.001,该参数与叶酸、壳聚糖以及微胶囊本身甚至制备方法均相关。因此,通过调整这些因素可以改变释放过程,从而根据目标控释系统制备出相应的产品。
其中,k=0.001,该参数与叶酸、壳聚糖以及微胶囊本身甚至制备方法均相关。因此,通过调整这些因素可以改变释放过程,从而根据目标控释系统制备出相应的产品。
表5 不同模型拟合参数及拟合优度分析结果
Table 5 Dissolution curves of chitosan-folic acid microcapsules and fitting curves of different models
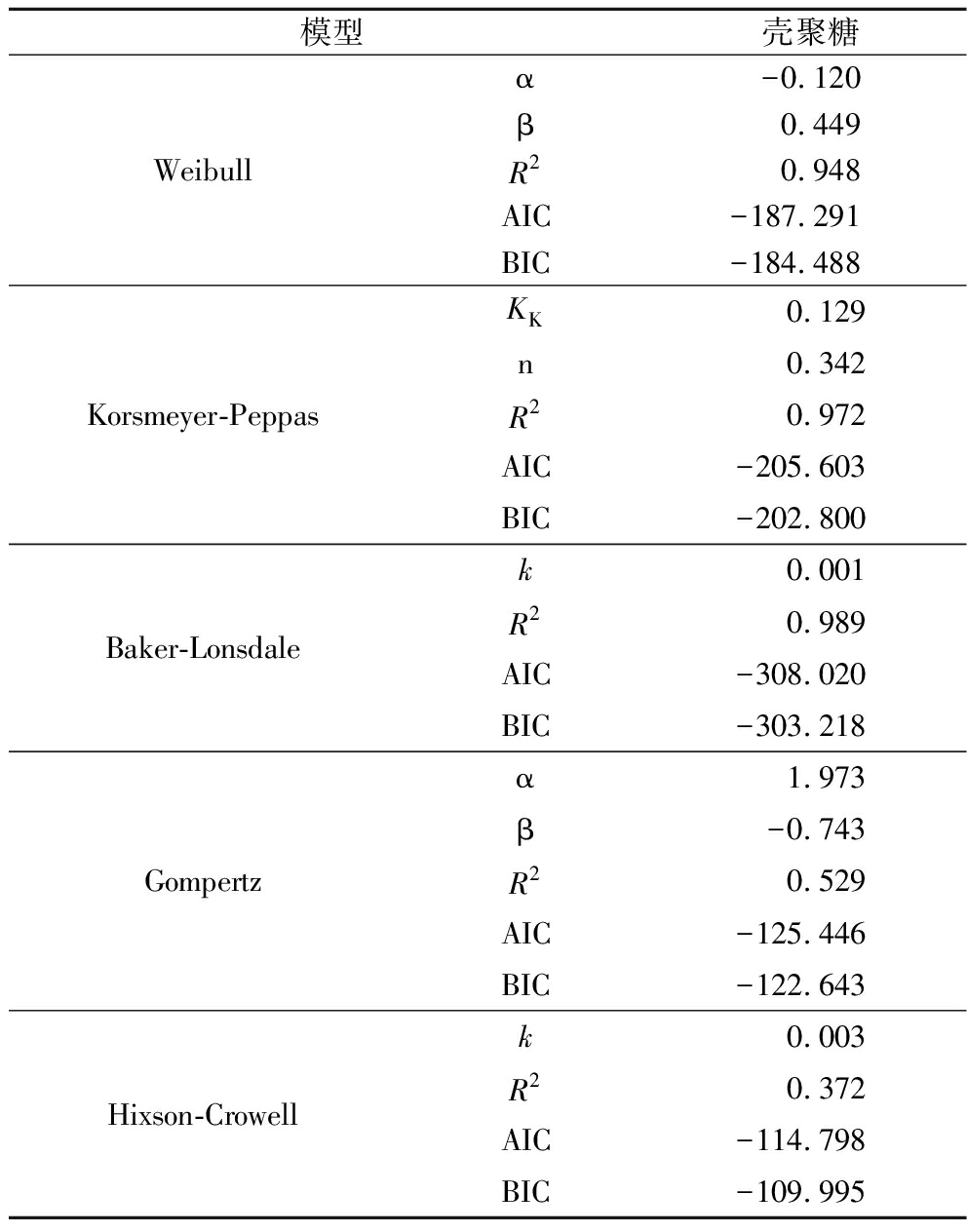
模型壳聚糖Weibullα-0.120β0.449R20.948 AIC-187.291BIC-184.488Korsmeyer-PeppasKK 0.129n0.342R20.972AIC-205.603BIC-202.800Baker-Lonsdalek 0.001R20.989AIC-308.020BIC-303.218Gompertzα 1.973β-0.743R20.529AIC-125.446BIC-122.643Hixson-Crowellk 0.003R20.372AIC-114.798BIC-109.995
3 结论
本研究采用喷雾干燥法制备了一款壳聚糖-叶酸微胶囊,该法操作简单,无废水废物产生,制得的壳聚糖-叶酸微胶囊粒度均匀,表面呈多孔结构,形状不规则。该微胶囊还提高了叶酸在胃部酸性环境的稳定性,延缓了其在胃部的释放,大大减少了其在胃部的损失,最终在肠道的生物可及性可达到85.04%,比市售的几种产品均更高。因此,制备的该微胶囊可考虑作为营养补充剂使用。另外对微胶囊在水中的溶出特性研究发现,其在水中缓慢释放叶酸,可作为某些产品的营养强化剂,如面粉等需要进一步加工的产品,可避免其在加工过程中提前释放叶酸,影响其稳定性。此外,通过与5种动力学模型拟合的结果,发现微胶囊溶解释放曲线与Baker-Lonsdale模型的拟合曲线最相符,在往后的研究中可通过改变其参数,设计出目标溶出过程,制备出目标产品。
[1] KENNEDY D O.B vitamins and the brain:Mechanisms, dose and efficacy:A review[J].Nutrients, 2016, 8(2):68.
[2] BELUSKA-TURKAN K, KORCZAK R, HARTELL B, et al.Nutritional gaps and supplementation in the first 1000 days[J].Nutrients, 2019, 11(12):2891.
[3] BUTTE N F, HOPKINSON J M, WONG W W, et al.Body composition during the first 2 years of life:An updated reference[J].Pediatric Research, 2000, 47(5):578-585.
[4] ZHOU Y B, SI K Y, LI H T, et al.Trends and influencing factors of plasma folate levels in Chinese women at mid-pregnancy, late pregnancy and lactation periods[J].The British Journal of Nutrition, 2021, 126(6):885-891.
[5] VISENTIN M, DIOP-BOVE N, ZHAO R B, et al.The intestinal absorption of folates[J].Annual Review of Physiology, 2014, 76:251-274.
[6] PREMJIT Y, PANDEY S, MITRA J.Recent trends in folic acid (vitamin B9) encapsulation, controlled release, and mathematical modelling[J].Food Reviews International, 2023, 39(8):5528-5562.
[7] 刘欢. 食用叶酸的微胶囊化及高叶酸调和油的研制[D].长春:吉林大学, 2015. LIU H.Microencapsulation edible folate and development of blending oil with high level of folate[D].Changchun:Jilin University, 2015.
[8] QIU Q H, QUAN Z Z, ZHANG H N, et al.pH-triggered sustained drug release of multilayer encapsulation system with hollow mesoporous silica nanoparticles/chitosan/polyacrylic acid[J].Materials Letters, 2020, 260:126907.
[9] 杨梦璐, 张娜, 王方远, 等.壳聚糖在纳米药物递送载体领域的应用现状[J].中国组织工程研究, 2021, 25(28):4546-4552. YANG M L, ZHANG N, WANG F Y, et al.Application of chitosan in nano drug delivery system[J].Chinese Journal of Tissue Engineering Research, 2021, 25(28):4546-4552. [10] ESTEVINHO B N, LAZAR R, BLAGA A, et al.Preliminary evaluation and studies on the preparation, characterization and in vitro release studies of different biopolymer microparticles for controlled release of folic acid[J].Powder Technology, 2020, 369:279-288.
[11] 高桂花, 盛筱, 李雪冰.高效液相色谱法测定叶酸片中叶酸含量[J].济宁医学院学报, 2010, 33(4):238-240. GAO G H, SHENG X, LI X B.Determination of folic acid in folic acid tablets by HPLC[J].Journal of Jining Medical University, 2010, 33(4):238-240.
[12] DING Q, NIE S P, HU J L, et al.In vitro and in vivo gastrointestinal digestion and fermentation of the polysaccharide from Ganoderma atrum[J].Food Hydrocolloids, 2017, 63:646-655.
[13] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[14] DASH S, MURTHY P N, NATH L, et al.Kinetic modeling on drug release from controlled drug delivery systems[J].Acta Poloniae Pharmaceutica, 2010, 67(3):217-223.
[15] PAARAKH M P, JOSE P A, SETTY C M, et al.Release kinetics-concepts and applications[J].International Journal of Pharmaceutics, 2018, 8(1):12-20.
[16] GE M L, LI X X, LI Y Y, et al.Preparation of magadiite-sodium alginate drug carrier composite by pickering-emulsion-templated-encapsulation method and its properties of sustained release mechanism by baker-lonsdale and korsmeyer-peppas model[J].Journal of Polymers and the Environment, 2022, 30(9):3890-3900.
[17] PERMANADEWI I, KUMORO A C, WARDHANI D H, et al.Modelling of controlled drug release in gastrointestinal tract simulation[J].Journal of Physics:Conference Series, 2019, 1295(1):012063.
[18] PENALVA R, ESPARZA I, AGÜEROS M, et al.Casein nanoparticles as carriers for the oral delivery of folic acid[J].Food Hydrocolloids, 2015, 44:399-406.
[19] FATHIMA E, NALLAMUTHU I, ANAND T, et al.Enhanced cellular uptake, transport and oral bioavailability of optimized folic acid-loaded chitosan nanoparticles[J].International Journal of Biological Macromolecules, 2022, 208:596-610.
[20] BOOSTANI S, JAFARI S M.A comprehensive review on the controlled release of encapsulated food ingredients;fundamental concepts to design and applications[J].Trends in Food Science &Technology, 2021, 109:303-321.