有氧生物的新陈代谢和呼吸过程中会产生活性氧[1](reactive oxygen species,ROS), 当ROS自由基产生过多且没有被完全清除时,它们可以攻击附近的分子,造成细胞的氧化损伤[2]。目前,因天然抗氧化肽结构简单,同时比酶类抗氧化剂更稳定,不会产生危险的免疫反应,可以作为外源性抗氧化剂维持体内的氧化还原平衡[3]。
肉类蛋白是一种极佳的抗氧化肽来源,与豆类蛋白相比,肉类蛋白富含更多的人体必需氨基酸,如Arg、Lys和Gly等[4],不同肉类制备的水解液可以作为必需氨基酸的良好来源[5],且其容易被人体吸收[6]。与其他蛋白资源相比,肉类蛋白具有不同的氨基酸的种类和水平,这为制备出不同结构的抗氧化肽带来更多的可能性。近年来,针对抗氧化肽制备、分离纯化和鉴定序列方面的研究较多[7],分离纯化抗氧化肽的方法有很多,凝胶过滤色谱和反相高效液相色谱法较为常见,但随着研究的深入,大孔树脂也被用于抗氧化肽的分离纯化。WANG等[8]通过凝胶色谱法从鲭鱼内脏中分离出了具有抗氧化活性的三肽MVH;YANG等[9]利用色谱法从鳄鱼肉水解物中分离出了4种具有抗氧化活性的肽:SSLTIQFVEGQFVDSYDPTIENTFTK、VPPHIY、VAPEEHPVLLTEAPLNPK和RNGLPGPIGPAG;CAI等[10]从干腌宣威火腿中分离出了7种具有活性肽;LI等[11]选用XAD-7HP大孔树脂分离出了紫花芸豆中的抗氧化肽。
本课题以干腌牛肉为原料,以盐酸提取法提取多肽,通过AB-8型大孔树脂及C18球形硅胶柱的分离纯化出抗氧化肽,借助质谱的技术进行了抗氧化肽的鉴定,利用分子对接4种抗氧化肽与SOD的结合方式,为后续开发干腌牛肉制品提供了理论依据。
1 材料与方法
1.1 试剂与仪器
干腌牛肉,滇南回乡食品有限公司;AB-8、D101、S-8、X-S、HPD-500、NKA-9,凯威化工;C18球形硅胶柱,常州三泰生物科技公司;盐酸、无水乙醇、乙腈、三氟乙酸、DPPH、ABTS、氯化硝基四氮唑蓝(p-nitro-blue tetrazolium chloride, NBT)、吩嗪硫酸甲酯(phenazine methosulfate, PMS)、牛源超氧化物歧化酶(superoxide dismutase,SOD)、NADH,阿拉丁(上海)生物试剂公司,均为分析纯;SOD活力检测盒,南京建成生物。
721 N可见光分光光度计,上海仪电分析仪器有限公司;多功能离心机,艾本德(上海)国际贸易有限公司;SHB-ⅢA环水式真空泵,上海聚昆仪器设备有限公司;ATY224精密电子天平,常州万泰天平仪器有限公司;UV-3600紫外可见近红外分光光度计,岛津企业管理(中国)有限公司;Q ExactiveTM Plus质谱仪,赛默飞世尔科技公司。
1.2 实验方法
1.2.1 多肽的处理
1.2.1.1 多肽的提取
根据LI等[12]的方法稍加修改。采用盐酸提取法,剥去肉眼可见的脂肪和结缔组织用匀浆机将50 g肌肉在250 mL 0.01 mol/L盐酸中匀浆。均质采用4次冲程,每次30 s,在冰水中冷却。匀浆在低温(12 000×g,4 ℃,20 min)下离心,快速定性滤纸过滤后,用乙醇按料液比1∶3(g∶mL)变性沉淀上清液中的蛋白质组分。将混合物在4 ℃下放置20 min后在4 ℃下以12 000×g离心20 min。将混合物在50 ℃、55 r/min的旋转蒸发器中除去乙醇,然后冷冻干燥并储存在-20 ℃备用。
1.2.1.2 标准曲线的绘制
测定采用双缩脲法[13],在540 nm波长下测定吸光度,以牛血清白蛋白质量浓度(0、2、4、6、8、10 mg/mL)为横坐标(x),A540nm吸光值为纵坐标(y),绘制标准曲线,算得样品溶液的多肽含量。通过双缩脲法测定标准曲线为y=0.255x+0.003 3,R2=0.999 9,曲线拟合良好。
1.2.2 抗氧化能力测定
1.2.2.1 DPPH自由基清除能力测定
根据L PEZ-PEDROUSO等[14]的方法稍加修改。用无菌水配制不同质量浓度的抗氧化肽(1、2、3、4、5 mg/mL)。将2 mL 0.2 mmol/L DPPH溶液[95%(体积分数)乙醇溶解]加入2 mL样品,混匀,室温避光反应30 min,在517 nm波长处测样品吸光度。空白为2 mL样品加2 mL 95%乙醇,对照为2 mL DPPH加2 mL 95%乙醇,同样条件下测A517nm。按公式(1)计算DPPH自由基清除能力:
PEZ-PEDROUSO等[14]的方法稍加修改。用无菌水配制不同质量浓度的抗氧化肽(1、2、3、4、5 mg/mL)。将2 mL 0.2 mmol/L DPPH溶液[95%(体积分数)乙醇溶解]加入2 mL样品,混匀,室温避光反应30 min,在517 nm波长处测样品吸光度。空白为2 mL样品加2 mL 95%乙醇,对照为2 mL DPPH加2 mL 95%乙醇,同样条件下测A517nm。按公式(1)计算DPPH自由基清除能力:
DPPH自由基清除能力![]()
(1)
式中:As、Ab分别代表样品和空白的吸光度。
1.2.2.2 ABTS阳离子自由基清除能力测定
根据ILYASOV等[15]的方法稍加修改。用无菌水配制不同质量浓度的抗氧化肽(1、2、3、4、5 mg/mL)。将5 mL 7 mmol/L ABTS溶液与88 μL 140 mmol/L过硫酸钾溶液混合,在20 ℃下放置20 h,加入约3倍体积时75%(体积分数)乙醇,在734 nm波长处的吸光度为0.70±0.02,得到ABTS阳离子自由基。样品由9.8 mL稀释的ABTS阳离子自由基溶液和0.2 mL 1 mg/mL粗肽组成。以0.2 mL蒸馏水和9.8 mL稀释的ABTS阳离子自由基溶液的混合物为空白,0.2 mL粗肽和9.8 mL蒸馏水为对照。所有混合物在室温下放置0.5 h,用分光光度计在734 nm处测定。ABTS阳离子自由基清除能力按公式(2)计算:
ABTS阳离子自由基清除能力![]()
(2)
式中:As、Ac、Ab分别表示样品、对照和空白的吸光度。
1.2.2.3 超氧阴离子(·O2-)清除能力测定
根据CAI等[10]的方法稍加修改。用无菌水配制不同质量浓度的抗氧化肽(1、2、3、4、5 mg/mL)。1.5 mL粗肽液,依次加入0.5 mL 300 μmol/L NBT(pH 8.0 Tris-HCl缓冲液配制),0.5 mL 468 μmol/L NADH(pH 8.0 Tris-HCl缓冲液配制), 0.5 mL 60 μmol/L PMS(pH 8.0 Tris-HCl缓冲液配制),振荡混匀,25 ℃水浴5 min,560 nm波长测定吸光值,以缓冲液代替样品作为空白对照。·O2-清除能力按公式(3)计算:
·O2-清除能力![]()
(3)
式中:As、Ab分别代表样品和空白吸光度。
1.2.3 大孔树脂的筛选
1.2.3.1 大孔树脂预处理
本实验选用6种不同性质的大孔树脂,分别为AB-8、D101、S-8、X-S、HPD-500、NKA-9。大孔树脂预先用95%乙醇浸泡24 h,用蒸馏水多次冲洗大孔树脂至无明显乙醇味,流出液无浑浊后,用4% NaOH浸泡24 h,去除树脂合成过程中的杂质,避免对样品吸附造成影响[16]。处理完成的树脂用蒸馏水清洗至中性后双层滤纸滤去水分备用。
1.2.3.2 大孔树脂的参数
不同性质的大孔树脂对于不同极性的物质具有不同的分离效果,综合比较6种不同大孔树脂对于多肽的吸附率、解吸率的差异来筛选树脂。不同树脂的参数见表1。
表1 六种不同大孔树脂的性质比较
Table 1 Comparison of properties of six different macroporous resins
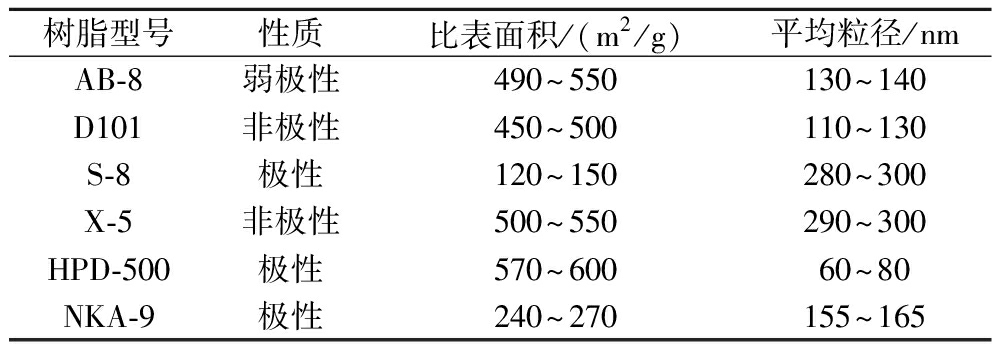
树脂型号性质比表面积/(m2/g)平均粒径/nmAB-8弱极性490~550130~140D101非极性450~500110~130S-8极性120~150280~300X-5非极性500~550290~300HPD-500极性570~60060~80NKA-9极性240~270155~165
1.2.3.3 吸附率的计算
选用AB-8、D101、S-8、X-S、HPD-500、NKA-9共6种大孔树脂,取不同种类的大孔树脂2.5 g于锥形瓶内,加入25 mL多肽液,放入恒温振荡箱中8 h(25 ℃,180 r/min)后取上清液测定溶液中剩余多肽含量。根据公式(4)计算吸附率:
吸附率![]()
(4)
式中:ρ1,吸附前溶液多肽含量,mg/mL;ρ2,吸附后溶液剩余多肽含量,mg/mL。
1.2.3.4 解吸率的计算
乙醇可以和大孔树脂进行分子态的物质竞争吸附,使物质溶解于乙醇,从而从大孔树脂上解析下来[17]。将充分吸附8 h后的大孔树脂放入锥形瓶内,加入25 mL 75%乙醇,放入恒温振荡箱中8 h(25 ℃,180 r/min)后取上清液测定溶液中剩余多肽含量。根据公式(5)计算解吸率:
解吸率![]()
(5)
式中:ρ1,吸附前溶液多肽含量,mg/mL;ρ2,吸附后溶液剩余多肽含量,mg/mL;ρ3,解吸后溶液多肽含量,mg/mL;V1,解吸液体积,mL;V2,吸附液体积,mL。
1.2.4 动态洗脱工艺的确定
1.2.4.1 确定最佳上样流速
选用30 mm×300 mm的层析柱,将层析柱垂直安装,采用湿法装柱,将大孔树脂装入层析柱后蒸馏水冲洗平衡,然后上样10 mL 5 mg/mL的多肽液。实验选用1、2、3、4、5 BV/h的流速进行收集,待大孔树脂吸附30 min后加入75%乙醇,每管收集1 mL,按照1.2.1.2节的方法测定多肽含量,绘制曲线,确定最佳上样流速。
1.2.4.2 确定最佳上样量
根据最佳上样流速进行收集,每管收集1 mL,按照1.2.1.2节的方法测定多肽含量,绘制泄漏曲线,确定最佳上样量。
1.2.4.3 确定最佳乙醇洗脱浓度
根据1.2.4.2节的最佳上样量上样,控制最佳上样流速直至吸附饱和,选用不同体积分数(55%、65%、75%、85%、95%)乙醇进行洗脱,控制流速1 mL/min,每管收集1 mL,按照1.2.1.2节的方法测定多肽含量,绘制曲线,确定最佳乙醇洗脱浓度。
1.2.4.4 确定最佳洗脱速度
分别设置流速为0.25、0.5、0.75、1.0、1.5、2.0 mL/min进行洗脱。每管收集1 mL,按照1.2.1.2节的方法测定多肽含量,绘制曲线,确定最佳洗脱速度。
1.2.4.5 大孔树脂分离
根据最佳上样量、最佳上样流速、最佳乙醇洗脱浓度、最佳洗脱速度进行吸附分离,分离后的不同组分根据1.2.2节的方法测试其抗氧化能力。
1.2.5 C18柱分离
C18球形硅胶柱选用常州三泰科技公司分离柱,粒径15 mm,孔径100 Å,柱尺寸20 g,最大工作压力400 psi(27.5 bar),pH值范围2~8。通过多点BET法测定的比表面积为312 m2/g, 孔径为0.88 mL/g, 粒度分析仪测得硅胶柱粒度分布D50为15.2 mm, 采用元素分析法测得碳含量为16.3%(质量分数)。流动相选用含有0.1%三氟乙酸的70%(体积分数)乙腈[18],选用经大孔树脂分离后抗氧化效果好的组分上样,上样量为5 mL,流速1 mL/min,每管收集1 mL备用。按照1.2.2节方法测试抗氧化能力。
1.2.6 抗氧化肽的鉴定
质谱仪在数据依赖采集模式下运行,自动在MS和MS/MS 采集间切换。质谱参数[19]:1) MS:扫描范围(m/z)为200~1 800;分辨率为70 000;AGC target为3e6;最大注入时间为50 ms;2) HCD-MS/MS:分辨率为17 500;AGCtarget:1e5;最大注入时间为45 ms;碰撞能量为28;动态排除时间为30 s。
1.2.7 分子对接
采用ChemBioDraw Ultra 14.0绘制多肽结构,将结构导入ChemBio3D Ultra 14.0进行能量最小化,将Minimum RMS Gradient设置为0.001,将小分子保存为mol2格式。将优化好的小分子导入AutodockTools-1.5.6进行加氢、计算电荷、分配电荷、设置可旋转键后保存为“pdbqt”格式。PDB数据库下载SOD(PDB ID:1E9O)蛋白结构;使用Pymol 2.3.0去除蛋白结晶水、原始配体等,将蛋白结构导入AutoDocktools(v1.5.6)进行加氢、计算电荷、分配电荷、指定原子类型并保存为“pdbqt”格式。使用POCASA 1.1预测蛋白结合位点,采用AutoDock Vina1.1.2进行对接,SOD相关参数[20]设置为:center_x=16.3,center_y =28.4,center_z =74.9;搜索空间:size_x:50,size_y:50,size_z:50(每个格点的间距为0.375 Å),exhaustiveness:10,其余参数为默认设置。
为测试多肽对于SOD的活力及酶活力单位影响,采用SOD活力检测盒进行检测,测试方法按照其说明书进行。
1.3 数据处理
试验重复3次,数据采用Origin 9.0进行分析处理,分子对接部分采用Pymol 2.3.0进行处理。
2 结果与分析
2.1 抗氧化能力的测定
测试不同浓度活性肽的抗氧化能力,发现随着肽含量的增加,抗氧化能力也在逐渐增加,如图1所示,当肽含量为5 mg/mL时,DPPH自由基、ABTS阳离子自由基和·O2-的清除率分别为86.24%、35.62%和54.34%。DPPH自由基、ABTS阳离子自由基和·O2-清除活性可以反映大多数天然提取物的抗氧化活性。抗氧化肽主要通过电子转移和氢原子转移反应来淬灭自由基,在淬灭自由基的2种机制中,与氢原子转移相比,电子转移反应非常快并且不受扩散控制[21-22]。因此,多肽在自由基清除活性方面的差异可能是由于肽含量的增加,赋予了抗氧化肽更强的氢原子转移能力,进而表现出良好的抗氧化活性。
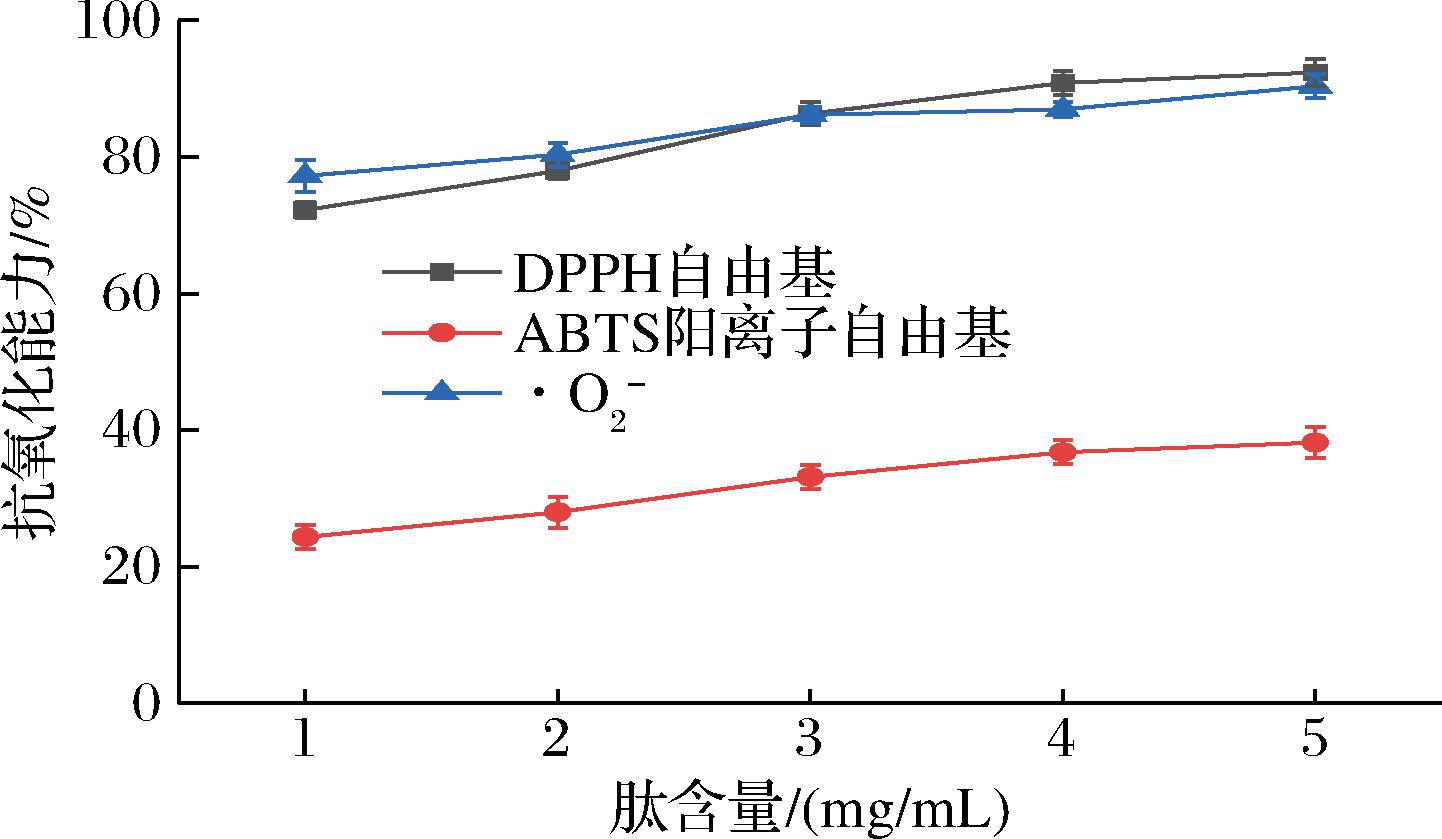
图1 不同浓度多肽的抗氧化能力
Fig.1 Antioxidant capacity of peptides at different concentrations
2.2 吸附率与解吸率
吸附率和解吸率是评价大孔树脂分离能力的一项重要指标。如图2所示,通过对6种大孔树脂进行吸附率与解吸率测试,结果表明AB-8型大孔树脂的吸附率和解吸率最好,分别为92.55%和82.88%。这可能是因为AB-8型大孔树脂具有弱极性、网状结构以及高比表面积的特点[23],能对不同分子大小的化合物进行筛选分离,适用于各类蛋白质、多肽类的分离纯化。因此选用AB-8型大孔树脂进行分离纯化多肽。
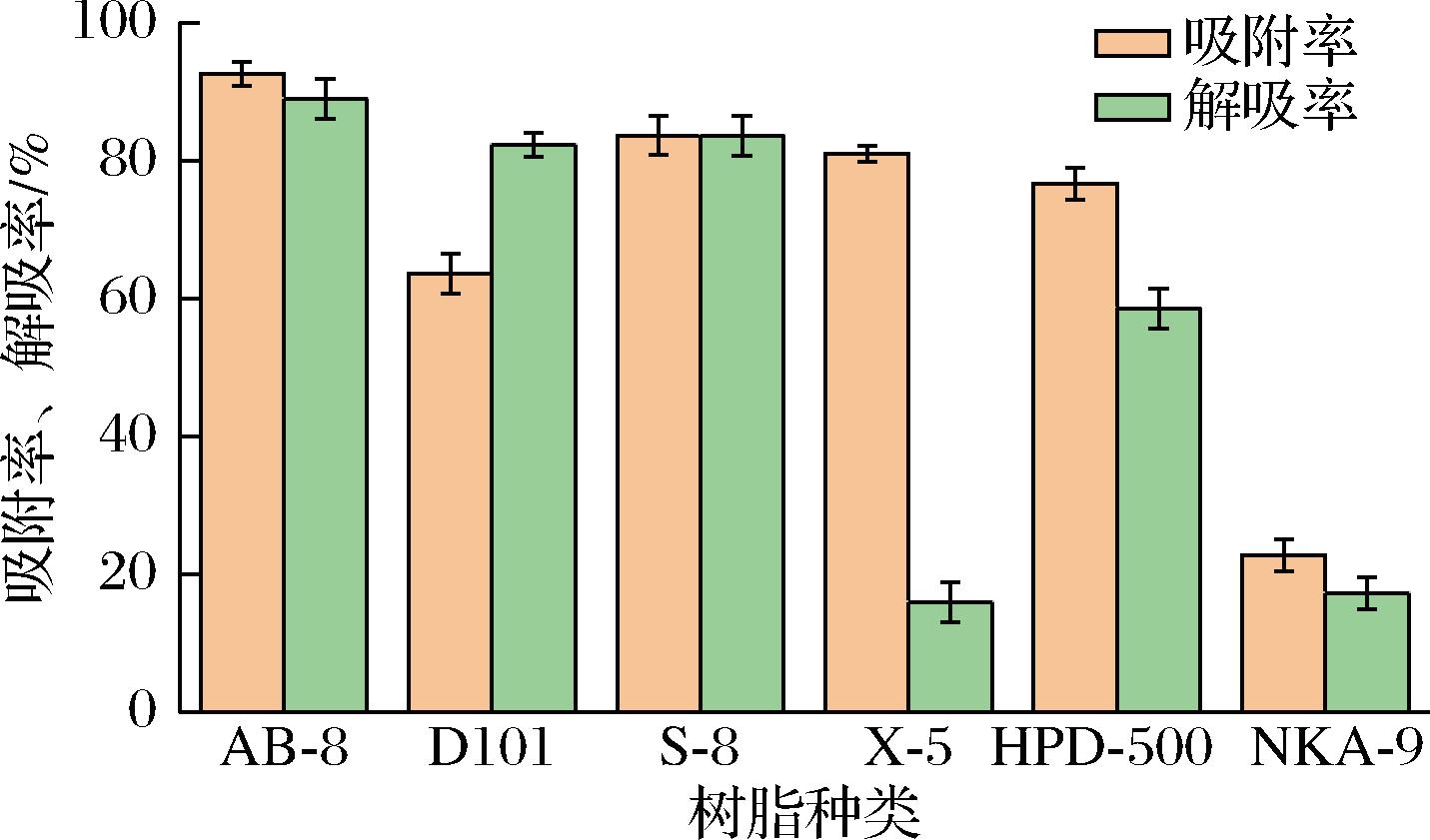
图2 六种大孔树脂的吸附率与解吸率
Fig.2 Adsorption and desorption rates of 6 macroporous resins
2.3 AB-8大孔树脂的选用
大孔树脂的分离能力受很多条件的影响,上样速度、上样量的差异、洗脱剂的浓度以及洗脱流速的差异都会影响最终分离效果。因为大孔树脂对于多肽类的吸附不受pH的影响[11],因此我们比较了不同上样速度、上样量、洗脱剂浓度以及洗脱流速对于AB-8型大孔树脂分离效果的影响。
2.3.1 确定最佳上样流速
由图3可知,不同上样流速的分离效果有所差异,当上样流速为2 BV/h时,曲线迅速达到峰值,流出液的多肽含量为2.63 mg/mL,说明2 BV/h时大孔树脂吸附迅速达到饱和,多肽未被充分吸附进树脂内部就被冲出柱外[24],当上样流速为4 BV/h时,第21管的多肽含量达到了1.40 mg/mL,4 BV/h时的流出液多肽含量低于1、2、5 BV/h流速的,略高于3 BV/h的1.27 mg/mL,但由于3 BV/h的峰形拖尾严重,4 BV/h流速时,随着收集管数的增加,第21管之后的多肽含量下降明显,因此选用4 BV/h上样流速较为合理。
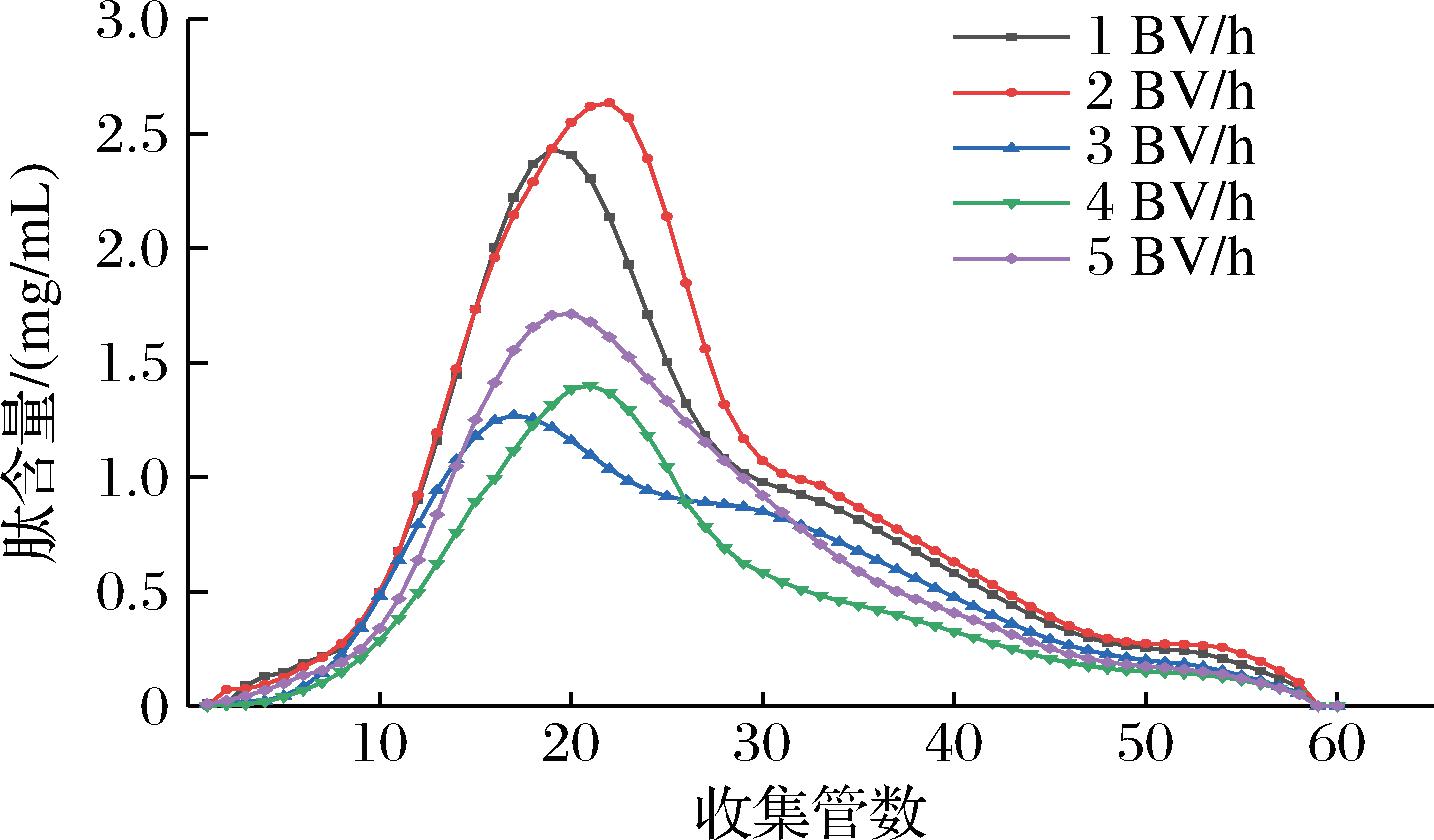
图3 不同上样流速洗脱曲线
Fig.3 Elution curves with different loading flow rates
2.3.2 确定最佳上样量
用4 BV/h上样流速收集溶液,测试多肽含量,由图4可知,当柱体积不变时,多肽含量随着流出液的增加而增加,当收集管数为39时,多肽含量达到最大值为2.52 mg/mL,最后开始缓慢下降,第60管时多肽含量为2.48 mg/mL,这说明在第39管时AB-8型大孔树脂的吸附已经趋于饱和状态[24],因此选择第39管(即39 mL)为最佳上样量。
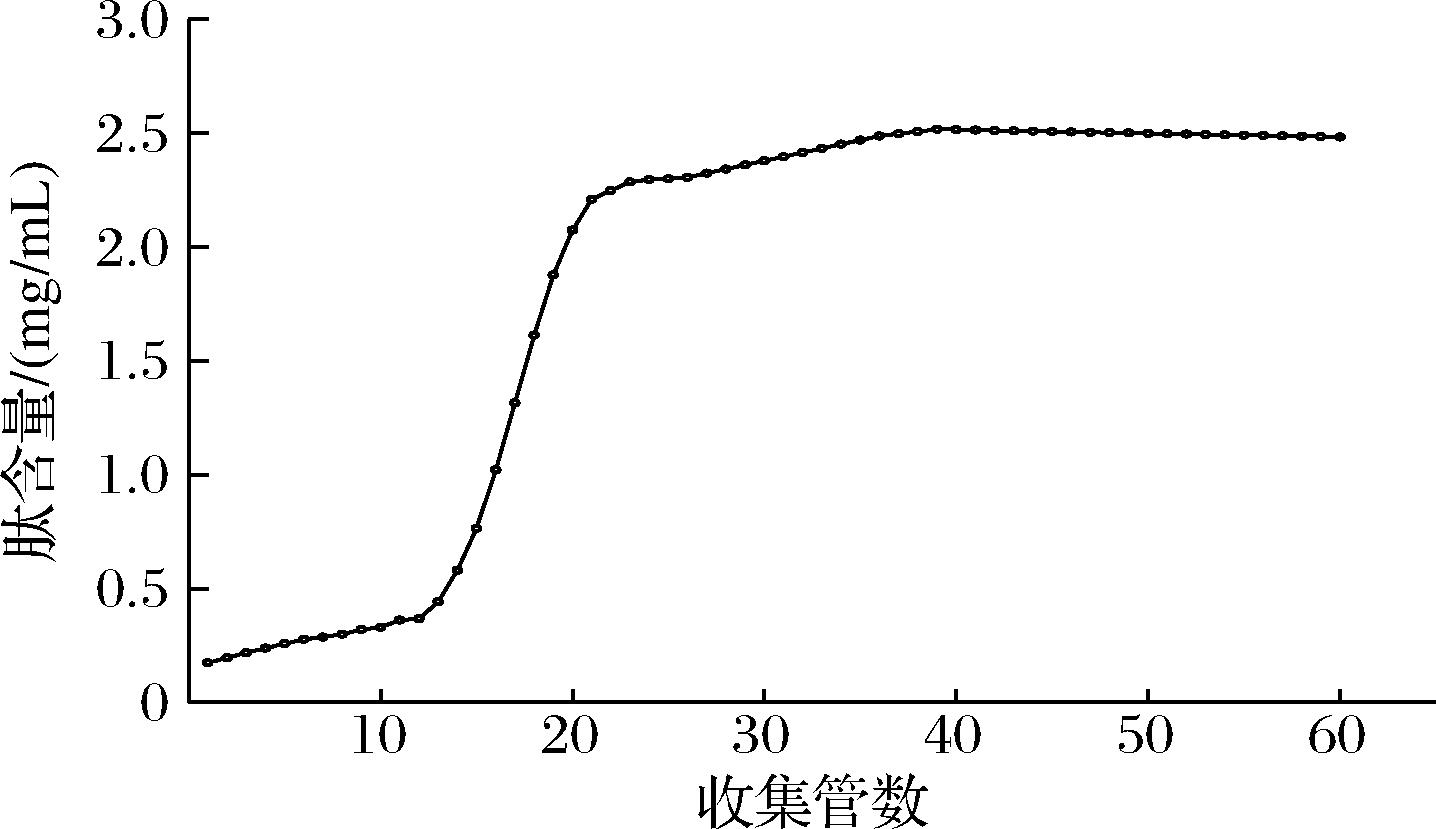
图4 AB-8大孔树脂泄漏曲线
Fig.4 AB-8 macroporous resin leakage curve
2.3.3 确定最佳乙醇洗脱浓度
乙醇溶液通过削弱多肽与大孔树脂之间的疏水相互作用[25],从而使吸附物洗脱下来,且乙醇溶液具有无毒性、易回收的特点,因此选用乙醇作为洗脱剂。由图5可知,不同浓度的乙醇溶液对于多肽有不同的洗脱效果,75%乙醇溶液洗脱的多肽含量最高为1.56 mg/mL,高于其他浓度的乙醇溶液,这可能是因为不同浓度的乙醇溶液对于多肽与大孔树脂间的作用力影响有所差异,因此选用75%乙醇溶液为洗脱剂。
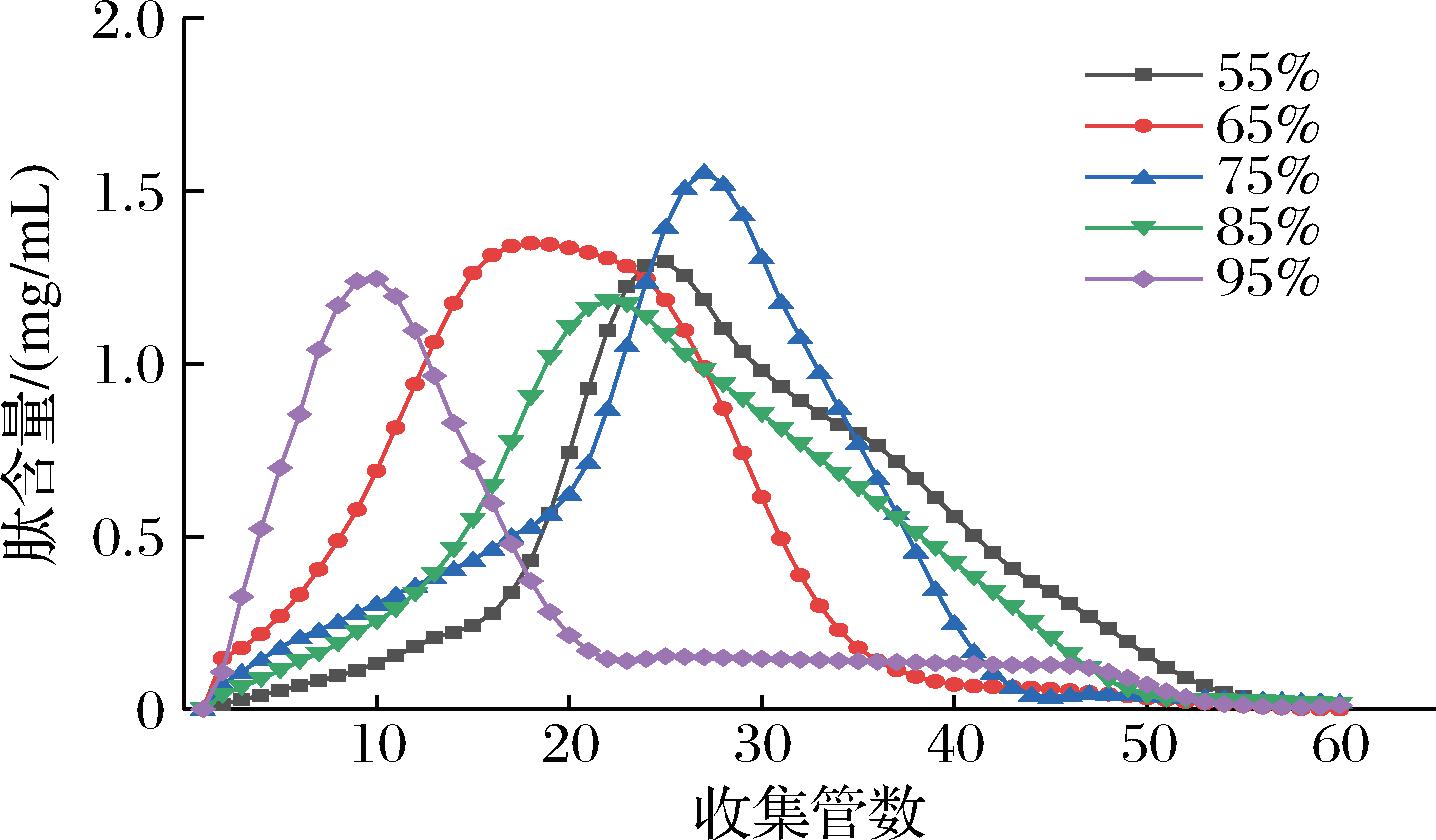
图5 不同浓度乙醇洗脱曲线
Fig.5 Elution curves of different concentrations of ethanol
2.3.4 确定最佳洗脱速度
洗脱流速也是影响洗脱效果的一个重要因素,太快的洗脱流速会导致多肽分子未能被洗脱剂洗脱出柱,太慢的洗脱速度则会导致多组分被一同洗脱出柱,分离效果受到影响[26]。根据2.3.3节的洗脱曲线,选用75%乙醇进行洗脱,比较了不同流速的洗脱曲线,如图6所示,当洗脱流速为1 mL/min时,多肽含量最高为1.63 mg/mL,当洗脱流速<1 mL/min时,洗脱曲线出现严重拖尾现象,这可能是因为多组分被一同洗脱导致,当洗脱流速>1 mL/min时,多肽含量相比于1 mL/min时减少,且最高峰位置出现后移现象,这可能是因为洗脱流速过快导致多肽与大孔树脂未能充分分离。因此选用1 mL/min洗脱流速较为合适。
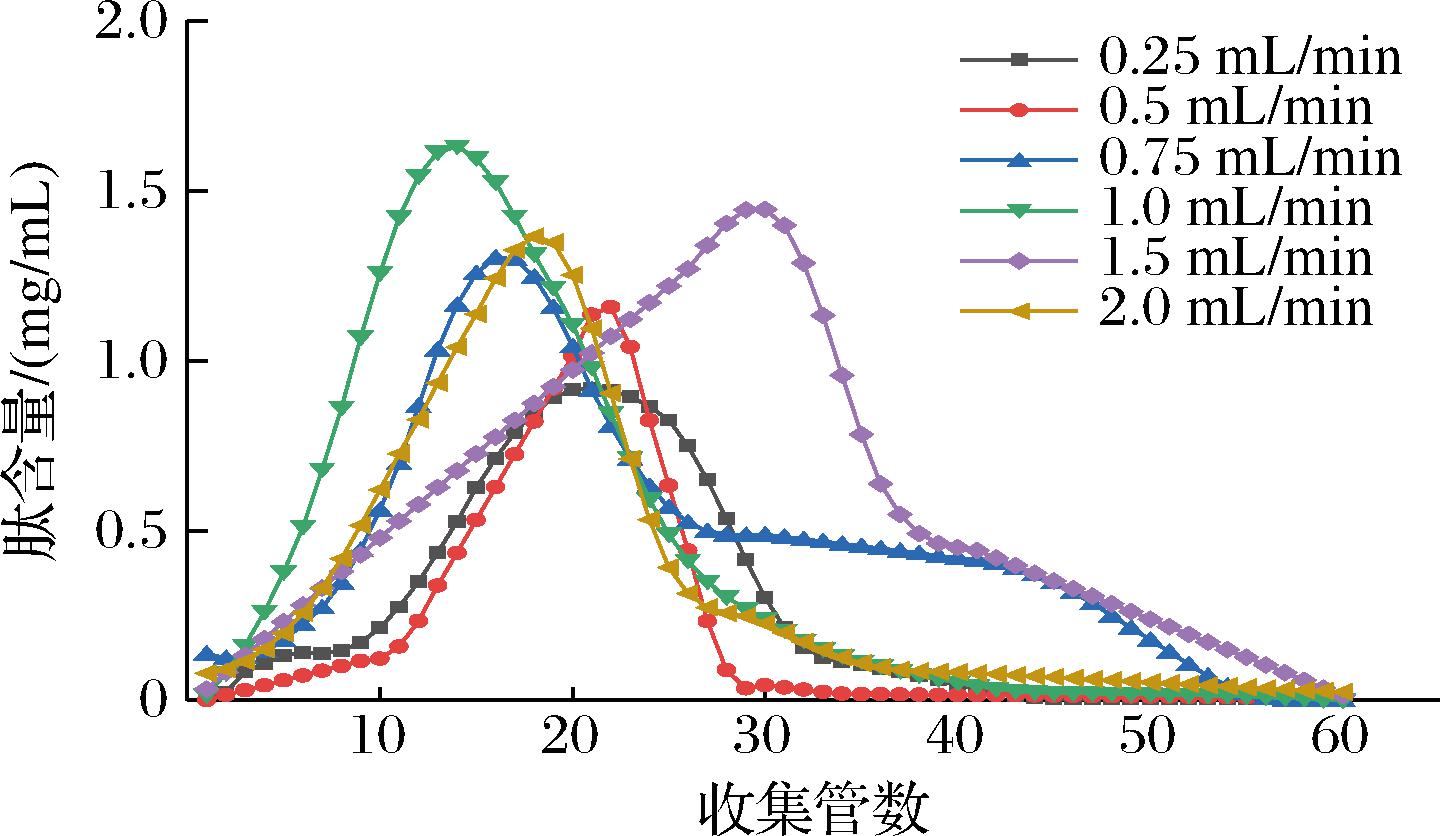
图6 不同洗脱速度洗脱曲线
Fig.6 Elution curves at different elution rates
2.3.5 AB-8大孔树脂分离抗氧化肽
采用最佳工艺对多肽进行分离,以收集管数为横坐标(x),OD240nm值为纵坐标(y)。通过检测OD240nm值可以分析AB-8型大孔树脂分离的组分,结果如图7所示,AB-8型大孔树脂对于多肽具有良好的分离效果,共分离出A、B和C三个组分,将A、B和C三个组分冷冻干燥后配制为1 mg/mL的多肽溶液,测试其在1 mg/mL时的抗氧化能力,B组分的DPPH自由基、ABTS阳离子自由基和·O2-清除率最高,分别为73.33%、21.01%和63.33%,高于A、C组分。因此选择B组分进行后续分离。
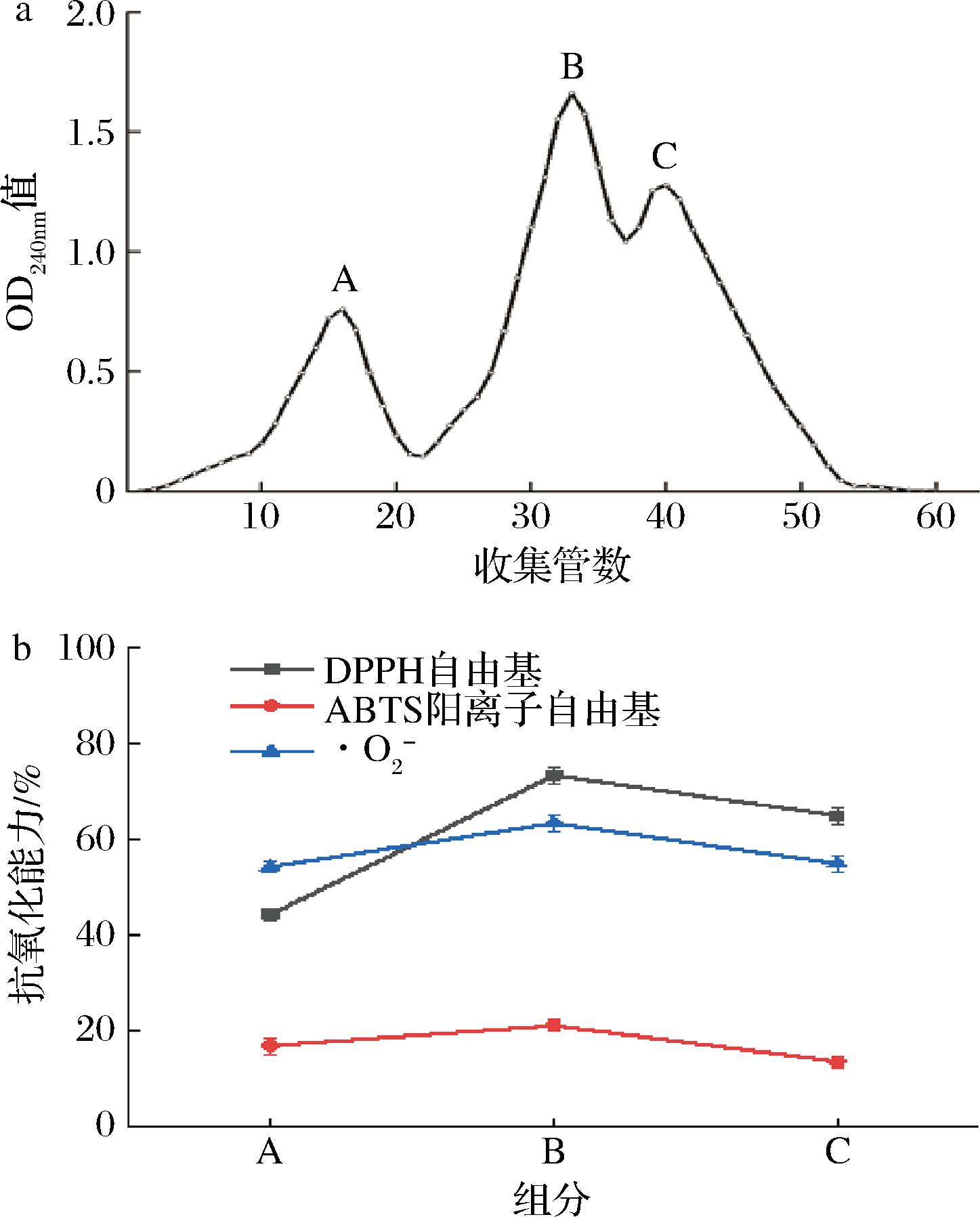
a-AB-8树脂分离组分;b-抗氧化能力
图7 AB-8分离组分及抗氧化能力
Fig.7 AB-8 fractions and antioxidant capacity
注:图7-b中各组分质量浓度为1 mg/mL(图8同)。
2.4 C18柱分离
AB-8型大孔树脂通常用于分离不同组分,因此我们借助制备色谱柱(C18球形硅胶柱)进行进一步分离,C18柱具有分离效率高的特点,可以将混合物分离纯化为单一组分[27],广泛应用于蛋白质与多肽的纯化。通过对B组分的进一步分离,分离出了4个组分,如表2所示,分别为B-1、B-2、B-3和B-4。将4个组分冷冻干燥后配制为1 mg/mL的多肽溶液,测试其在1 mg/mL时的抗氧化能力,如图8所示,B-1组分的DPPH自由基、ABTS阳离子自由基和·O2-清除能力最高,分别为76.55%、26.31%和73.65%,高于其他3个组分。对其进行结构结构分析,结果如表2所示,鉴定出4个组分,Score为多肽评分(http://distilldeep.ucd.ie/PeptideRanker/),得分为(0~1),越接近1,表明其预测该多肽的生物活性最强[28]。由表2可知FDGDF的多肽活性最强,得分为0.948 8。半衰期为多肽的一个重要指标,通过预测(https://web.expasy.org/protparam/)多肽在哺乳动物体内的半衰期,可以为后续开发相关多肽产品提供思路[29]。
表2 B组分成分分析
Table 2 Analysis of B components

组分序列分子式长度m/z等电点Score半衰期/hB-1FDGDFC28H33N5O105600.230 43.3150.948 81.1B-2TGPGPWC29H39N7O86614.294 45.7460.867 47.2B-3FLSDHC28H39N7O95618.289 55.0610.494 31.1B-4KPFDAKC33H52N8O96705.394 79.2870.464 31.3
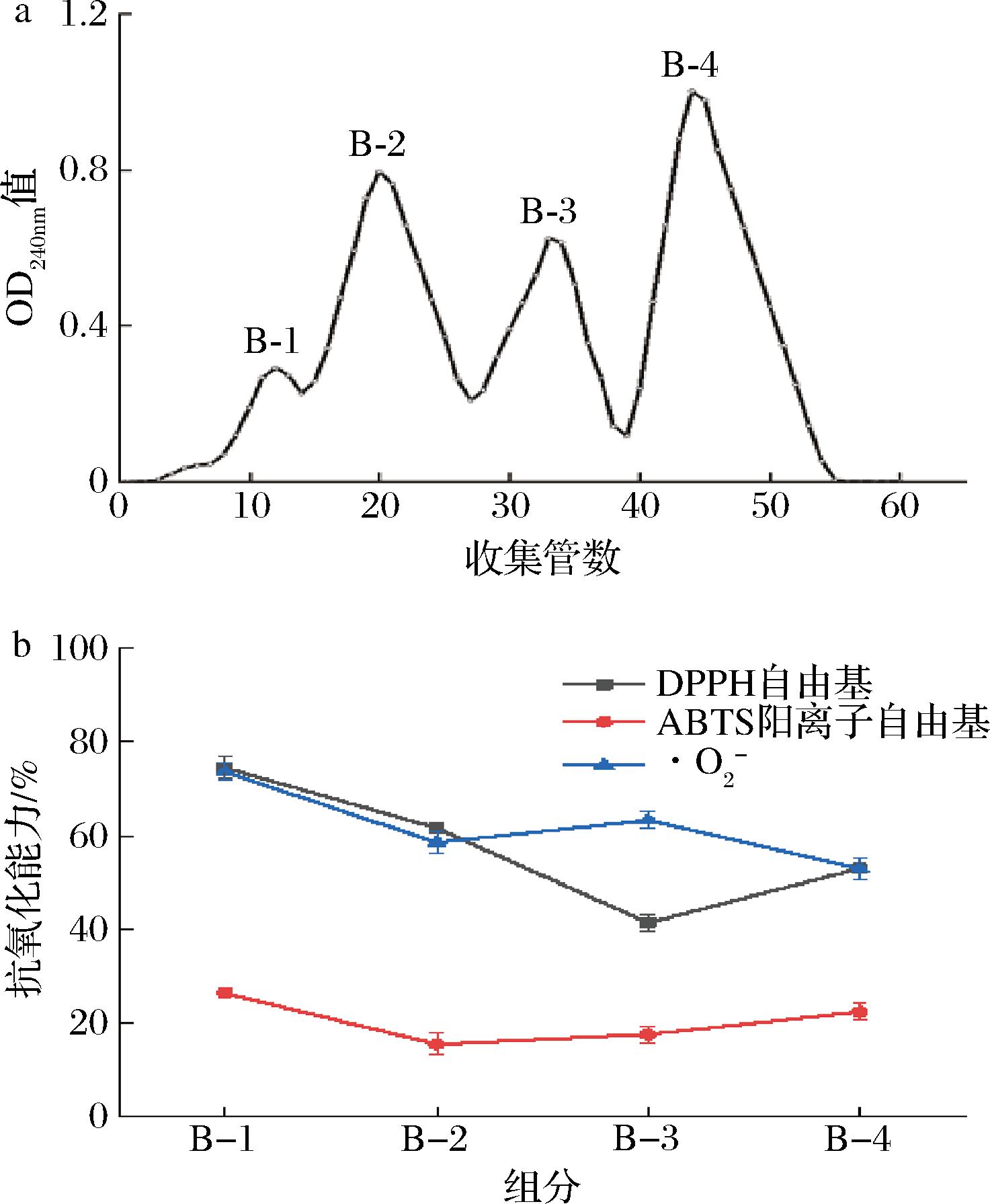
a-C18柱分离组分;b-抗氧化能力
图8 C18柱分离B组分及抗氧化能力
Fig.8 Separation and antioxidant capacity of Component B by C18 column
2.5 分子对接
分子模拟是分析蛋白质作用力的一项重要工具。SOD广泛存在于各种生物体内,是生物体内广泛存在的一种抗氧化金属酶,能够催化·O2-生成氧和H2O2,在机体氧化与抗氧化的平衡中发挥至关重要的作用[30-31]。牛的体内也存在SOD(PDB ID;1E9O),相比较于牛体内的其他抗氧化酶,SOD十分稳定,牛红细胞SOD在75 ℃下加热数分钟仍很少失活,对酸碱也较稳定,可在pH 5.3~10.5范围内反应。通过分离出的4种抗氧化肽;FDGDF、TGPGPW、FLSDH和KPFDAK与SOD进行分子对接,结合量子化学的方法,推断抗氧化肽与SOD的结合方式,为发现牛体内的抗氧化机制提供研究基础,为后续开发相关产品提供理论研究。
如图9所示,FDGDF与SOD的结合能为-6.7 kcal/mol,证明具有较好的结合作用。FDGDF与SOD发生相互作用,主要是通过形成氢键以及疏水作用力,与Arg-141、Thr-135、Ala-138、Gly-139形成氢键,氢键的长度分别为3.20、3.24、3.07、3.05、3.24、2.87、3.32、2.87 Å;与Pro-60、His-78、Lys-134、Thr-56氨基酸形成疏水相互作用。
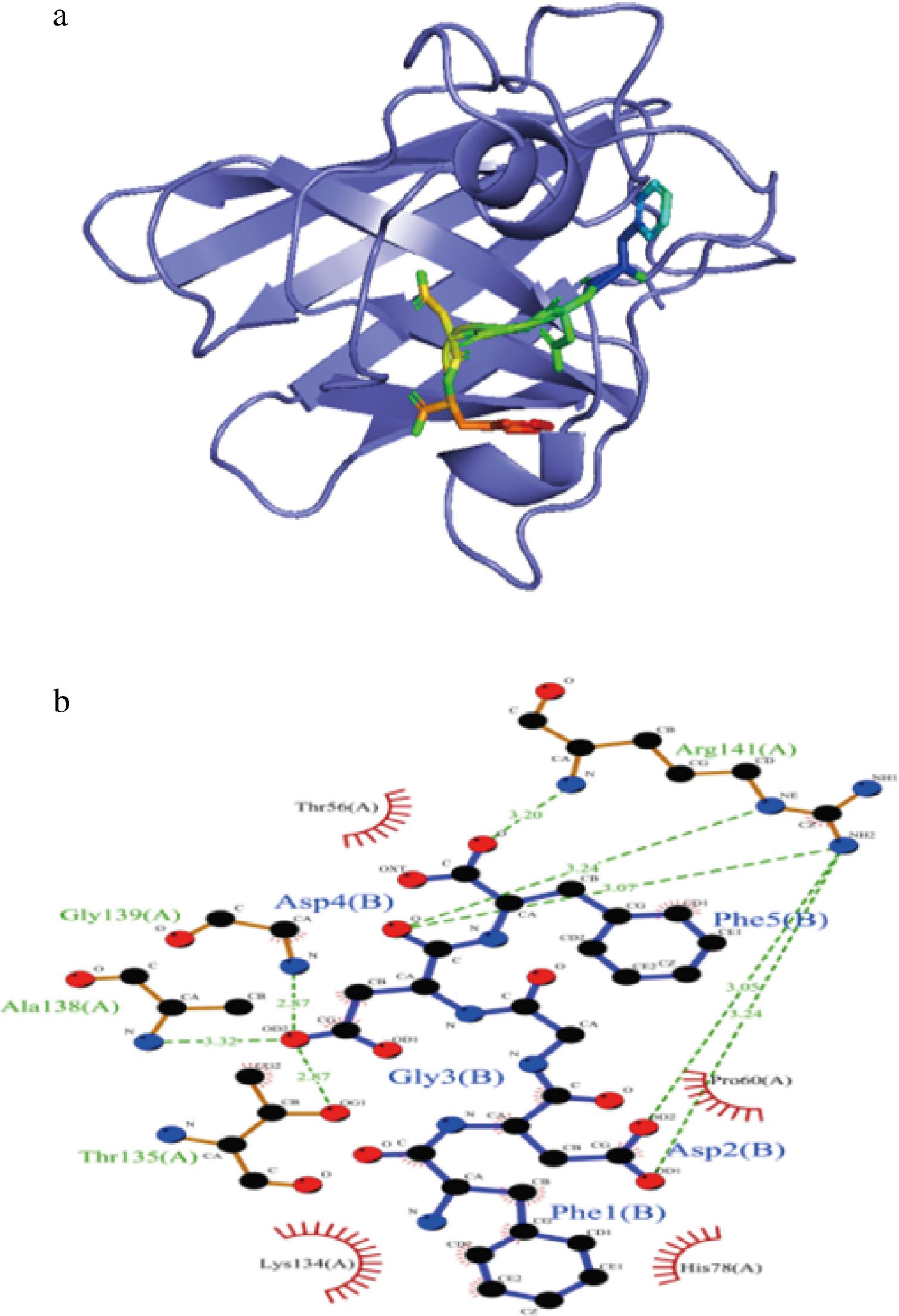
a-分子对接;b-分子作用力细节图
图9 FDGDF与SOD分子对接
Fig.9 Docking of FDGDF with SOD molecular docking
如图10所示,TGPGPW与SOD的结合能为-6.55 kcal/mol, 表明多肽与蛋白存在很强的结合作用,TGPGPW与SOD蛋白发生相互作用主要是通过形成氢键及疏水相互作用力,与Arg-141、Lys-134氨基酸形成很强的氢键相互作用,氢键的长度分别为3.09、3.29、3.24、2.94、2.92、2.90 Å,另外,还可以与Pro-60、Gly-59、Thr-56、Gly-139、Asp-11、Cys-55、Ser-140、Thr-135氨基酸形成疏水相互作用。
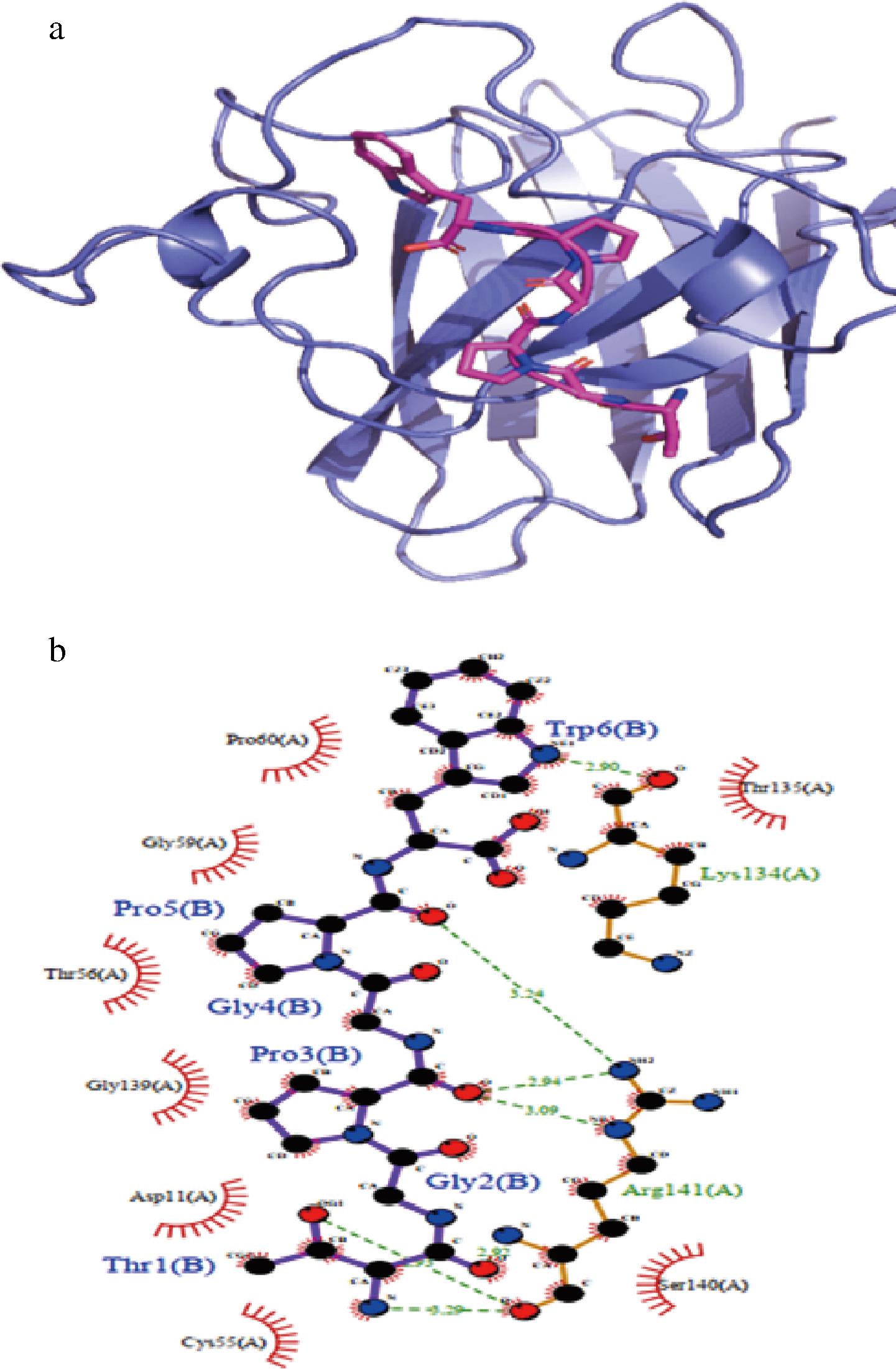
a-分子对接;b-分子作用力细节图
图10 TGPGPW与SOD分子对接
Fig.10 Docking of TGPGPW with SOD molecular docking
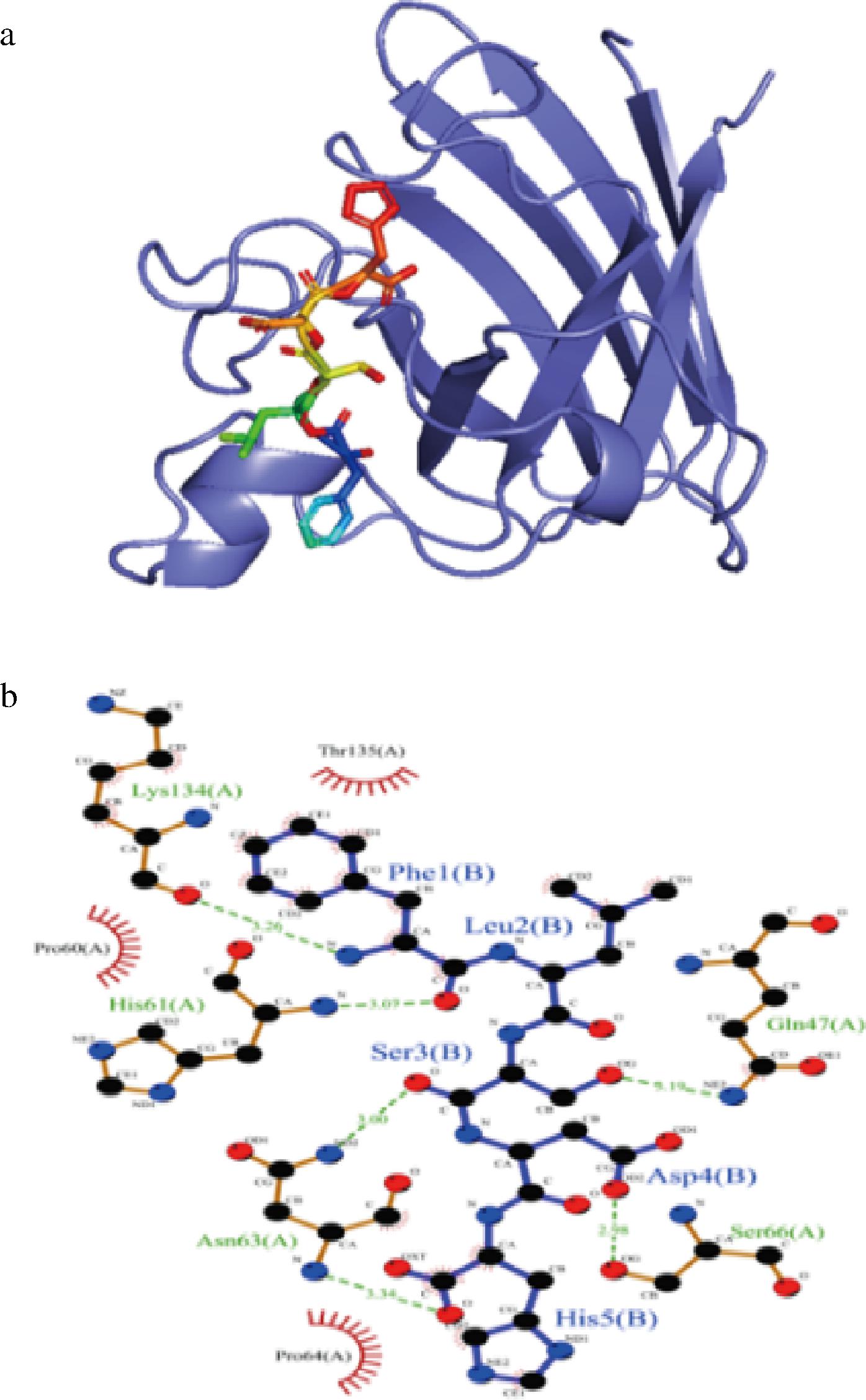
如图11所示,FLSDH与SOD的结合能为-6.6 kcal/mol,证明具有较好的结合作用。FLSDH与SOD发生相互作用,主要是通过形成氢键以及疏水作用力,与Gln-47、Ser-66、Asn-63、His-61、Lys-134形成氢键,氢键的长度分别为3.19、2.98、3.34、3.00、3.07、3.26 Å;与Thr-135、Pro-64、Pro-60氨基酸形成疏水相互作用。
a-分子对接;b-分子作用力细节图
图11 FLSDH与SOD分子对接
Fig.11 Docking of FLSDH with SOD molecular docking
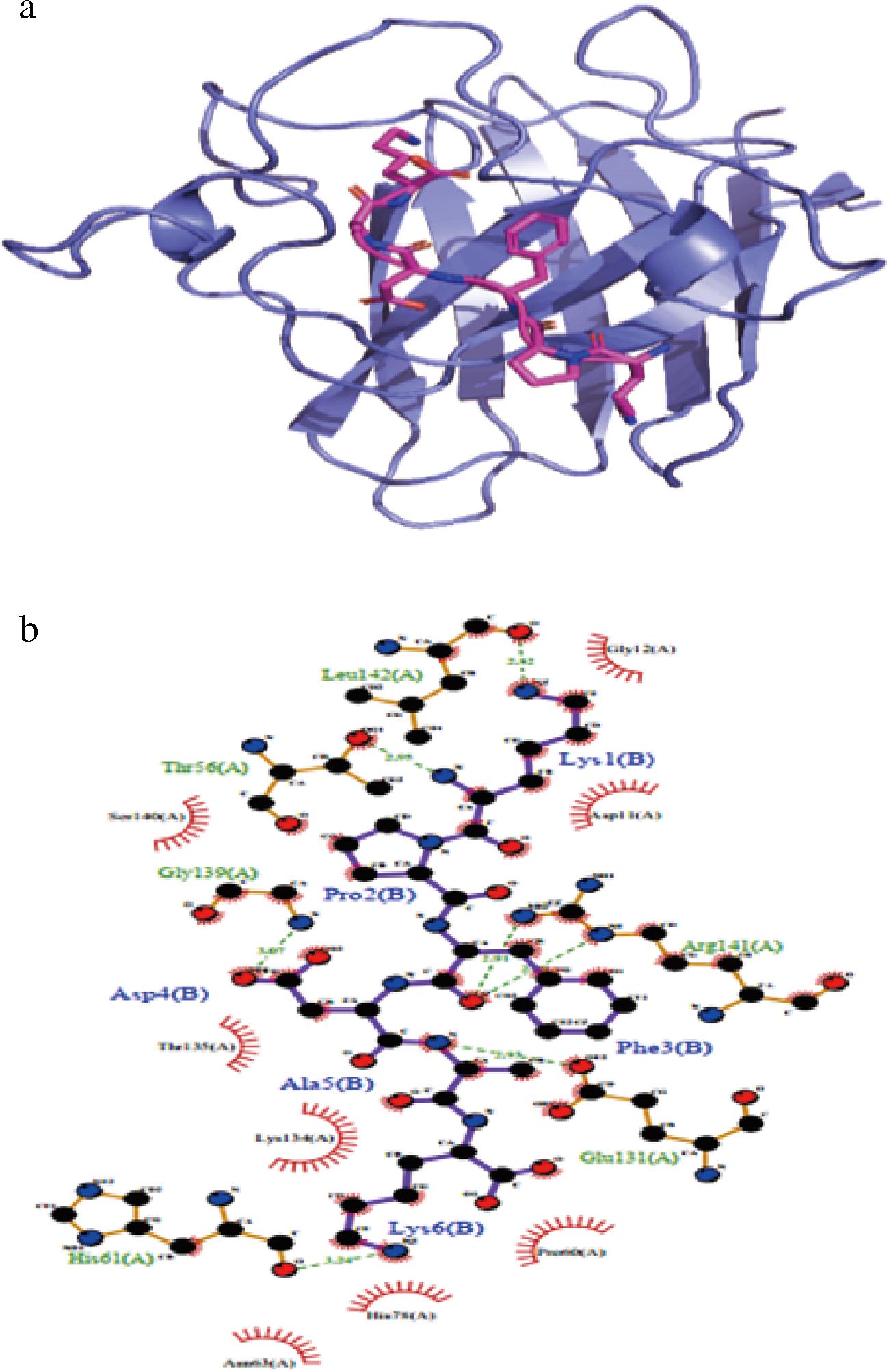
如图12所示,KPFDAK与SOD的结合能为-7.35 kcal/mol,表明KPFDAK与SOD存在很强的结合作用,KPFDAK与SOD蛋白发生相互作用主要是通过形成氢键及疏水相互作用力,KPFDAK与SOD的Leu-142、Thr-56、Gly-139、His-61、Glu-131、Arg-141氨基酸形成很强的氢键相互作用,氢键的长度分别为2.82、2.95、3.07、3.24、2.93、2.91、2.99 Å;另外,还可以与Ser-140、Thr-135、Lys-134、Asn-63、His-78、Pro-60、Asp-11、Gly-12氨基酸形成疏水相互作用。
a-分子对接;b-分子作用力细节图
图12 KPFDAK与SOD分子对接
Fig.12 Docking of KPFDAK with SOD molecular docking
如图13所示,1 mg/mL的FDGDF可以有效增加SOD活力与酶活力单位,1 mg/mL时酶活力增加11.64%,酶活力单位增加697 U/mL。因此我们推断FDGDF可以有效提高SOD活力与酶活力单位。
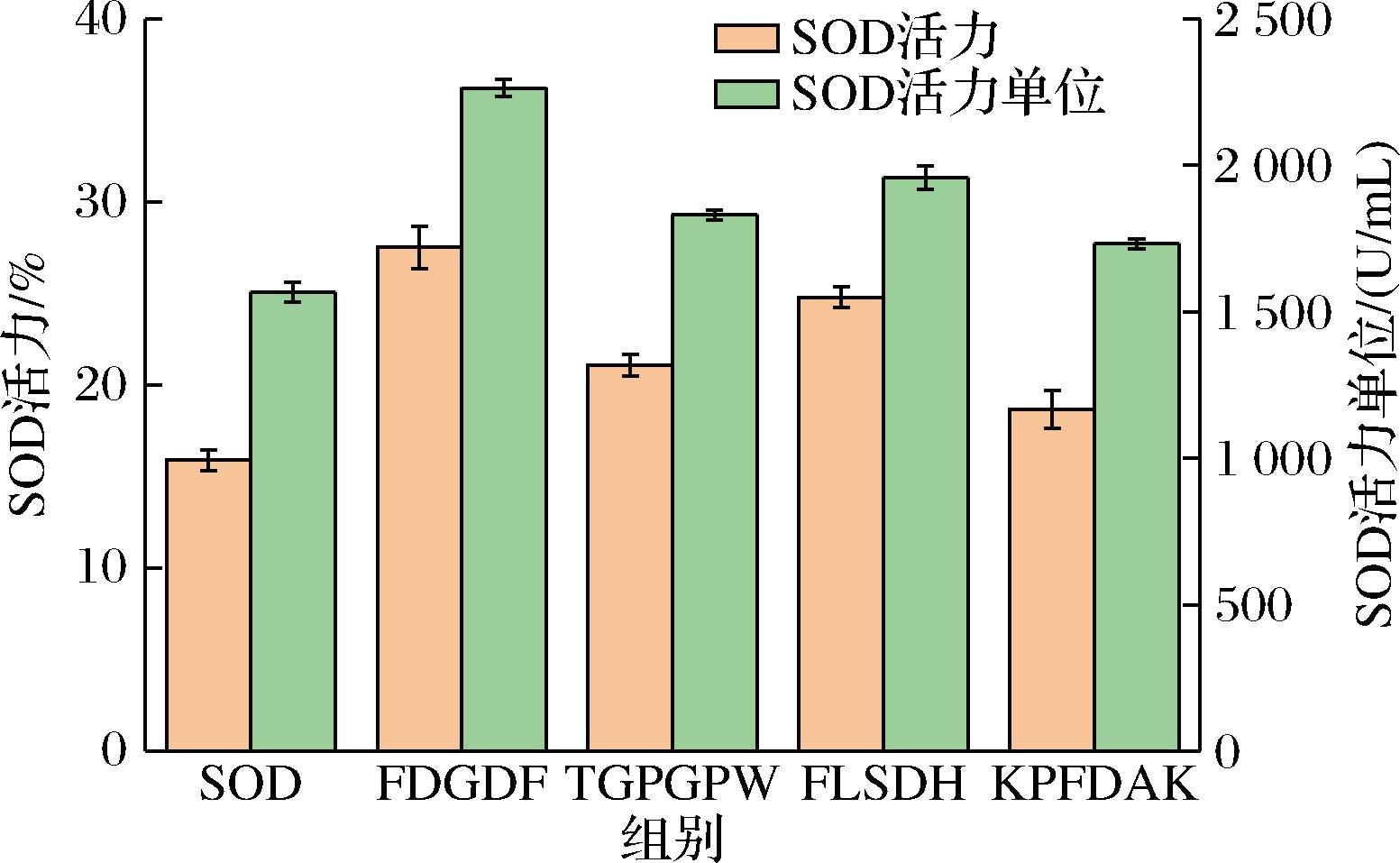
图13 SOD活力与酶活力单位
Fig.13 SOD activity and enzyme activity unit
3 结论
活性肽是指对生物机体的生命活动有益或具有生物活性的肽类化合物,属于蛋白质片段,起着调节机体功能平衡的作用。本实验利用盐酸提取法提取并发现干腌牛肉活性肽在5 mg/mL时对DPPH自由基、ABTS阳离子自由基和·O2-的清除率分别为86.24%、35.62%和54.34%。AB-8型大孔树脂的吸附率与解吸率性能最好,分别为92.55%和82.88%。优化得出AB-8的上样流速4 BV/h、上样量39 mL、乙醇洗脱体积分数75%,洗脱流速1 mL/min,分离得到3个组分(A、B和C),测试选出抗氧化能力最好的B组分进行C18柱分离,分离出4个抗氧化肽:FDGDF、TGPGPW、FLSDH和KPFDAK。与SOD(PDB ID;1E9O)进行分子对接,发现FDGDF、TGPGPW、FLSDH和KPFDAK均可以与SOD形成氢键。本实验通过大孔树脂-C18柱联用分离了干腌牛肉抗氧化肽,为干腌牛肉制品的开发提供理论基础。
[1] BORGSTAHL G E O,OBERLEY-DEEGAN R E.Superoxide dismutases (SODs) and SOD mimetics[J].Antioxidants, 2018, 7(11):156.
[2] YANG Z, MIN Z J, YU B.Reactive oxygen species and immune regulation[J].International Reviews of Immunology, 2020, 39(6):292-298.
[3] KANG L L, HAN T T, CONG H L, et al.Recent research progress of biologically active peptides[J].BioFactors, 2022, 48(3):575-596.
[4] DE OLIVEIRA PADILHA L G, MALEK L, UMBERGER W J.Consumers’ attitudes towards lab-grown meat, conventionally raised meat and plant-based protein alternatives[J].Food Quality and Preference, 2022, 99:104573.
[5] WEI R M, ROSS A B, SU M M, et al.Front cover:Metabotypes related to meat and vegetable intake reflect microbial, lipid and amino acid metabolism in healthy people[J].Molecular Nutrition &Food Research, 2018, 62(21):1800583.
[6] REITELSEDER S, TRANBERG B, AGERGAARD J, et al.Phenylalanine stable isotope tracer labeling of cow milk and meat and human experimental applications to study dietary protein-derived amino acid availability[J].Clinical Nutrition, 2020, 39(12):3652-3662.
[7] ALAVI F, CIFTCI O N.Purification and fractionation of bioactive peptides through membrane filtration:A critical and application review[J].Trends in Food Science &Technology, 2023, 131:118-128.
[8] WANG X Q, YU H H, XING R, et al.Optimization of antioxidative peptides from mackerel (Pneumatophorus japonicus) viscera[J].Peerj, 2018, 6:e4373.
[9] YANG L, XING Y, CHEN R, et al.Isolation and identification of antioxidative peptides from crocodile meat hydrolysates using silica gel chromatography[J].Scientific Reports, 2022, 12:13223. [10] CAI J M, XING L J, ZHANG W G, et al.Selection of potential probiotic yeasts from dry-cured Xuanwei ham and identification of yeast-derived antioxidant peptides[J].Antioxidants, 2022, 11(10):1970.
[11] LI D, XU X Y, YANG Y, et al.Separation and purification of antioxidant peptides from purple speckled kidney bean by macroporous adsorption resin and analysis of amino acid composition[J].Frontiers in Nutrition, 2022, 9:1001456.
[12] LI C L, MORA L, TOLDR F.Structure-function relationship of small peptides generated during the ripening of Spanish dry-cured ham:Peptidome, molecular stability and computational modelling[J].Food Chemistry, 2022, 375:131673.
F.Structure-function relationship of small peptides generated during the ripening of Spanish dry-cured ham:Peptidome, molecular stability and computational modelling[J].Food Chemistry, 2022, 375:131673.
[13] TORTEN J, WHITAKER J R.Evaluation of the biuret and dye-binding methods for protein determination in meats[J].Journal of Food Science, 1964, 29(2):168-174.
[14] L PEZ-PEDROUSO M, BORRAJO P, PATEIRO M, et al.Antioxidant activity and peptidomic analysis of porcine liver hydrolysates using alcalase, bromelain, flavourzyme and papain enzymes[J].Food Research International, 2020, 137:109389.
PEZ-PEDROUSO M, BORRAJO P, PATEIRO M, et al.Antioxidant activity and peptidomic analysis of porcine liver hydrolysates using alcalase, bromelain, flavourzyme and papain enzymes[J].Food Research International, 2020, 137:109389.
[15] ILYASOV I R, BELOBORODOV V L, SELIVANOVA I A, et al.ABTS/PP decolorization assay of antioxidant capacity reaction pathways[J].International Journal of Molecular Sciences, 2020, 21(3):1131.
[16] ZHAO J H, LIAO S Q, BI X P, et al.Isolation, identification and characterization of taste peptides from fermented broad bean paste[J].Food &Function, 2022, 13(16):8730-8740.
[17] CHEN H G, LIANG Q A, ZHOU X, et al.Preparative separation of the flavonoid fractions from Periploca forrestii Schltr.ethanol extracts using macroporous resin combined with HPLC analysis and evaluation of their biological activities[J].Journal of Separation Science, 2019, 42(3):650-661.
[18] YANG Y J, WANG B, TIAN Q, et al.Purification and characterization of novel collagen peptides against platelet aggregation and thrombosis from Salmo salar[J].ACS Omega, 2020, 5(32):19995-20003.
[19] XIA Z, MIAO J Y, CHEN B B, et al.Purification, identification, and antioxidative mechanism of three novel selenium-enriched oyster antioxidant peptides[J].Food Research International, 2022, 157:111359.
[20] YANG M H, CHE T, LI Z X, et al.Identification, taste properties and molecular docking of novel umami peptides from Butyriboletus roseoflavus[J].European Food Research and Technology, 2022, 248(11):2665-2677.
[21] HOKAZONO E, OTA E, GOTO T, et al.Development of a protein assay with copper chelator chromeazurol B, based on the biuret reaction[J].Analytical Biochemistry, 2021, 630:114320.
[22] TONOLO F, FIORESE F, MORETTO L, et al.Identification of new peptides from fermented milk showing antioxidant properties:Mechanism of action[J].Antioxidants, 2020, 9(2):117.
[23] YANG Y Q, ZHU R C, LI J, et al.Separation and enrichment of three coumarins from angelicae pubescentis Radix by macroporous resin with preparative HPLC and evaluation of their anti-inflammatory activity[J].Molecules, 2019, 24(14):2664.
[24] GUO L, QIU H T, ZHOU Y, et al.Composition analysis and antioxidant activity of purified Boletus auripes pigment using macroporous resin[J].Journal of Food Processing and Preservation, 2022, 46(7):e16702.
[25] REN Y, WU H, LI X F, et al.Purification and characterization of high antioxidant peptides from duck egg white protein hydrolysates[J].Biochemical and Biophysical Research Communications, 2014, 452(4):888-894.
[26] HAN C J, LIN B J, HUANG X Y, et al.Quinoa husk peptides reduce melanin content via Akt signaling and apoptosis pathways[J].iScience, 2023, 26(1):105721.
[27] CHAI T T, XIAO J B, MOHANA DASS S, et al.Identification of antioxidant peptides derived from tropical jackfruit seed and investigation of the stability profiles[J].Food Chemistry, 2021, 340:127876.
[28] ZHANG T, HUA Y, ZHOU C Y, et al.Umami peptides screened based on peptidomics and virtual screening from Ruditapes philippinarum and Mactra veneriformis clams[J].Food Chemistry, 2022, 394:133504.
[29] JUNG S J, NGUYEN N T T, LEE S A, et al.In-vivo half-life and hypoglycemic bioactivity of a fusion protein of exenatide and elastin-based polypeptide from recombinant Saccharomyces cerevisiae[J].Journal of Biotechnology, 2019, 303:16-24.
[30] BORGSTAHL G E O, OBERLEY-DEEGAN R E.Superoxide dismutases (SODs) and SOD mimetics[J].Antioxidants, 2018, 7(11):156.
[31] LI X, QIU S, SHI J Y, et al.A new function of copper zinc superoxide dismutase:As a regulatory DNA-binding protein in gene expression in response to intracellular hydrogen peroxide[J].Nucleic Acids Research, 2019, 47:5074-5085.