我国是世界栽培橄榄最多的国家,主要分布在福建、广东(多属乌榄),橄榄营养丰富,含有17种人体所需要的氨基酸,尤其含钙质和维生素C十分丰富,对孕妇及儿童大有补益[1]。
植物多肽是从植物中分离得到的具有促进免疫、抗氧化、抗菌等生理功能的生物活性肽[3],其来源广泛、获取成本低、营养价值高。当前已有许多植物源抗氧化肽的报道,如桑叶蛋白[3]、猴头菇[4]、紫花芸豆蛋白[5]等。经过蛋白酶水解可将高分子的蛋白质转化为短链的多肽甚至是氨基酸,这些低分子质量的多肽生物活性比原蛋白更高。蛋白质来源、蛋白酶类型,水解条件等因素影响蛋白水解产物的抗氧化活性,因此选择合适的条件水解蛋白具有重要的意义[6]。
本文以橄榄仁为原料,采用酶解法制备抗氧化肽。首先从6种商用蛋白酶中以水解度(degree of hydrolysis,DH)、DPPH自由基清除率为考察指标筛选蛋白酶,利用单因素试验和响应面分析法优化酶解条件,制备橄榄仁抗氧化肽。对最优工艺条件下制得的酶解液进行分离鉴定,得出抗氧化活性较强的肽段,并通过分子对接技术对橄榄仁抗氧化肽与超氧化物歧化酶(superoxide dismutase,SOD)进行对接模拟,对其生物学性质进行评价并确定其分子机制,为进一步对植物抗氧化活性肽的研究和开发应用打下基础。
1 材料与方法
1.1 材料与仪器
橄榄仁,福建;ABTS、DPPH、1,10-菲咯啉,Sigma-Aldrich(上海)贸易有限公司;CuSO4、无水乙醇、牛血清蛋白、NaOH、邻二氮菲、FeSO4,上海凌峰化学试剂有限公司;石油醚、酒石酸钾钠、国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼、三氯乙酸,谷胱甘肽(glutathione, GSH),上海阿拉丁试剂有限公司。所有其他化学品和试剂均为分析级。
UV1200B紫外可见分光光度计,上海仪电分析仪器有限公司;TG16G多功能离心机,Eppendorf/艾本德;XL-130粉碎机,上海精宏实验设备有限公司;ATY224精密电子天平,奥豪斯仪器(上海)有限公司;RE-2000B旋转蒸发仪,上海亚荣生化仪器公司;SCIENTZ-50真空冷冻干燥机,宁波新芝冻干设备股份有限公司。
1.2 实验方法
1.2.1 橄榄仁成分分析
水分测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;脂肪含量参照GB/T 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;灰分含量参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》;蛋白含量参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;氨基酸分析参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。
1.2.2 脱脂粉制备
将橄榄仁去皮粉碎后过40目筛,按料液比1∶4(g∶mL)加入石油醚。磁力搅拌5 h进行脱脂,进行抽滤至滤液澄清后置于通风橱中,将溶剂挥发。再次粉碎后过40目筛,得橄榄仁脱脂粉,置于-20 ℃冰箱保存备用。
1.2.3 多肽提取
提取方法参考文献[7]。橄榄仁脱脂粉按料液比1∶40(g∶mL)加入去离子水配制成溶液,搅拌均匀后离心(4 ℃、4 000 r/min、20 min)收集上清液,调节pH值为4.0,搅拌30 min后离心收集沉淀。水洗中和后冷冻干燥得到橄榄仁蛋白。将橄榄仁蛋白按液料比加入去离子水稳定后加入蛋白酶进行酶解反应。酶解结束后沸水浴20 min灭酶。冷却至室温后离心(4 ℃、4 000 r/min、20 min)收集上清液后得到橄榄仁多肽,冷冻干燥后置于4 ℃备用。
1.2.4 蛋白酶的筛选
如表1所示选用6种酶,在各自最适pH和温度下酶解橄榄仁蛋白,选取DPPH自由基清除率和DH为测试指标,筛选出最适宜的蛋白酶。
表1 蛋白酶的特异性和作用条件
Table 1 Specificity and operation conditions of different proteases
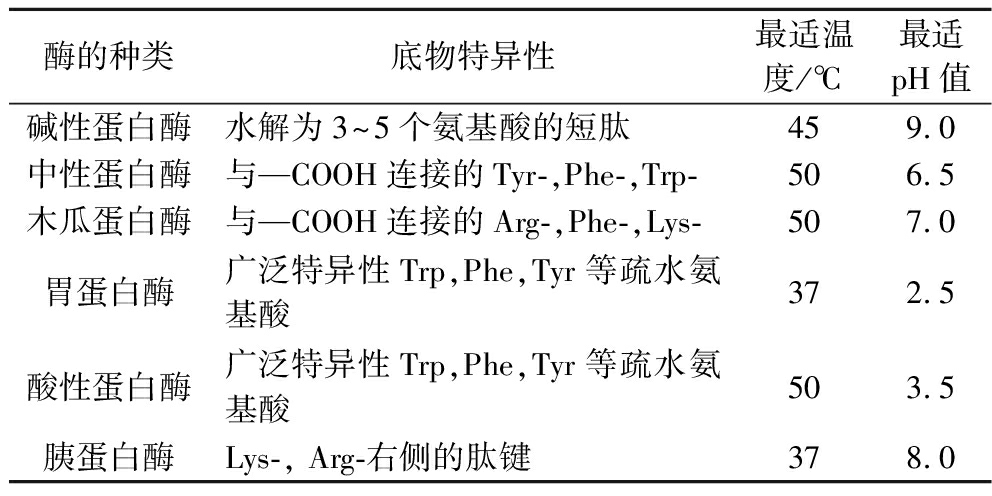
酶的种类底物特异性最适温度/℃最适pH值碱性蛋白酶水解为3~5个氨基酸的短肽459.0中性蛋白酶与—COOH连接的Tyr-,Phe-,Trp-506.5木瓜蛋白酶与—COOH连接的Arg-,Phe-,Lys-507.0胃蛋白酶广泛特异性Trp,Phe,Tyr等疏水氨基酸372.5酸性蛋白酶广泛特异性Trp,Phe,Tyr等疏水氨基酸503.5胰蛋白酶Lys-, Arg-右侧的肽键378.0
1.2.5 单因素试验
研究底物浓度、酶底比、酶解时间、酶解温度对橄榄仁粗肽液DPPH自由基清除率的影响。设计各单因素条件为:底物质量浓度20、30、40、50、60 g/L;酶底比1.5%、2.0%、2.5%、3.0%、3.5%、4.0%(质量分数,下同);酶解时间60、90、120、150、180、240 min;酶解温度45、50、55、60、65、70 ℃,进行橄榄仁粗肽的提取,测定粗肽液DH以及对DPPH自由基的清除率。
1.2.6 响应面法优化提取工艺
以单因素试验结果为基础,使用Design Expert 8.0.6软件根据Box-Behnken中心组合设计原理,以DPPH自由基清除率为指标,通过响应面分析对提取条件进行优化,得到酶解法制备抗氧化肽的最优条件,试验因素水平如表2所示。
表2 响应面分析实验因素水平表
Table 2 Factors and levels of response surface design
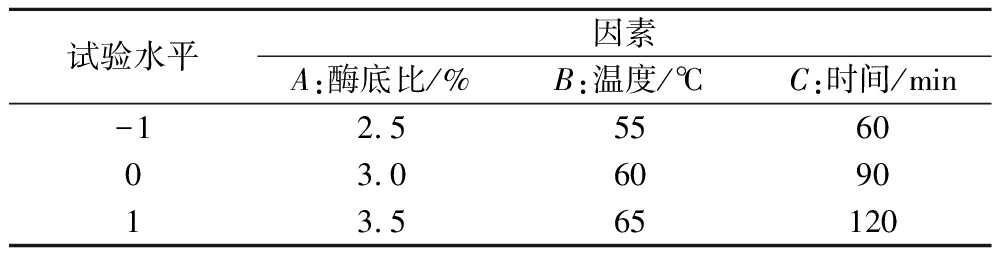
试验水平因素A:酶底比/%B:温度/℃C:时间/min-12.5556003.0609013.565120
1.2.7 DH测定
参考GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》测定橄榄仁多肽液中氨基酸态氮含量,总氮含量测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》。DH的计算如公式(1)所示:
(1)
1.2.8 DPPH自由基清除率测定
参照文献[18]稍作修改。在试管中加入2 mL多肽溶液和2 mL 0.4 mg/mL DPPH溶液,作为实验组(A1),混匀后室温下避光反应30 min,于517 nm下测定其吸光度值。以无水乙醇代替DPPH溶液作对照组(A2),以水代替多肽液作空白组(A3)。每组实验重复3次取平均值,DPPH自由基清除率的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
1.2.9 超氧阴离子自由基(·O2-)清除率测定
测定方法参照文献[9]。配制1 mg/mL的橄榄仁多肽液,取1.5 mL多肽液依次加入0.5 mL 300 μmol/L氯化硝基四氮唑蓝(pH 8.0 Tris-HCl缓冲液配制),0.5 mL 468 μmol/L还原型辅酶Ⅰ(pH 8.0 Tris-HCl缓冲液配制),0.5 mL 60 μmol/L吩嗪硫酸甲酯(pH 8.0 Tris-HCl缓冲液配制),振荡混匀,25 ℃水浴5 min,560 nm波长测定吸光值,记为A2。以缓冲液代替样品作为空白对照,测定吸光度值记为A1。·O2-清除率的计算如公式(3)所示:
·O2-清除率![]()
(3)
1.2.10 羟自由基(·OH)清除率测定
测定方法参照文献[10]。在试管中加入4 mL 5 mmol/L 1,10-邻菲咯啉溶液和4 mL 5 mmol/L FeSO4溶液,然后加入3 mL磷酸盐缓冲液(pH 7.4)、H2O2 0.3 mmol/L和4 mL多肽溶液,于36 ℃下反应1 h,在536 nm处测量吸光度记为A1。用蒸馏水代替多肽溶液,其他试剂与样品相同,测定吸光度记为A2。用蒸馏水代替H2O2,其他试剂与样品相同,测定吸光度记为A3。·OH清除率的计算如公式(4)所示:
·OH清除率![]()
(4)
1.2.11 橄榄仁抗氧化肽分离鉴定
根据优化后的酶解工艺条件提取橄榄仁多肽,进行分离纯化,选择SephadexG-25和SephadexG-15分别进行2次分离纯化[11]。SephadexG-25分离纯化条件:选择26 mm×1 m层析柱,蒸馏水经45 nm过滤后作为洗脱液进行洗脱,调节流速0.5 mL/min,每管收集5 mL洗脱液,分别进行抗氧化性能测试,选择抗氧化性能好的收集液进行SephadexG-15二次分离纯化并进行抗氧化性能测试,条件同SephadexG-25。
nano-HPLC-MS/MS分析:将样品经由配备在线纳喷离子源的LC-MS/MS分析。整套系统为串联EASY-nanoLC 1200的Q ExactiveTM Plus质谱仪(Thermo Fisher Scientific, MA, USA)。共上样5 μL样品(分析柱Acclaim PepMap C18, 75 μm×25 cm),以60 min的梯度分离样品,柱流量控制在300 nL/min,柱温40 ℃,电喷雾电压2 kV。质谱仪在数据依赖采集模式下运行,自动在MS和MS/MS采集间切换。质谱参数设置如下:(1)MS:扫描范围m/z为200~1 800;分辨率70 000;AGC target为3e6;最大注入时间为50 ms;(2)HCD-MS/MS:分辨率为17 500;AGCtarget为1e5;最大注入时间为45 ms;碰撞能量为28;动态排除时间为30 s。
1.2.12 分子对接
从PDB数据库下载SOD(PDB ID:2ADQ)蛋白结构;使用Pymol 2.3.0去除蛋白结晶水、原始配体等,将蛋白结构导入Auto Docktools(v1.5.6)进行加氢、计算电荷、分配电荷、指定原子类型并保存为“pdbqt”格式[12]。使用POCASA 1.1预测蛋白结合位点,采用AutoDock Vina1.1.2进行对接,CASP3相关参数设置为:center_x=-5.9,center_y=28.9,center_z=210.4;搜索空间:size_x:80,size_y:80,size_z:80(每个格点的间距为0.375Å),exhaustiveness:10,其余参数为默认设置。
1.4 数据分析
试验中每组试验重复3次,使用Origin 2022b对数据进行绘图,分子对接部分采用ChemBioDraw Ultra 14.0绘制多肽的结构,利用PyMOL2.3.0和LigPlot+ v 2.2.5进行对接结果的相互作用模式分析。
2 结果与分析
2.1 橄榄仁成分分析
橄榄仁的基本成分见表3,橄榄仁中有较高的营养成分,油脂和蛋白质含量之和高达77.51%,水分和灰分含量均不高。橄榄仁蛋白氨基酸组分如表4所示,橄榄仁中必需氨基酸总量占全部氨基酸含量的34.01%。其中精氨酸含量最高为81.501 mg/g,谷氨酸含量仅次于精氨酸,这2种氨基酸在食品工业中广泛应用。
表3 橄榄仁的基本成分
Table 3 Compositions of olive kernel
成分水分脂肪灰分蛋白质其他质量分数/%4.7248.655.2328.8612.45
表4 橄榄仁的氨基酸组成
Table 4 Amino acid composition of olive kernel
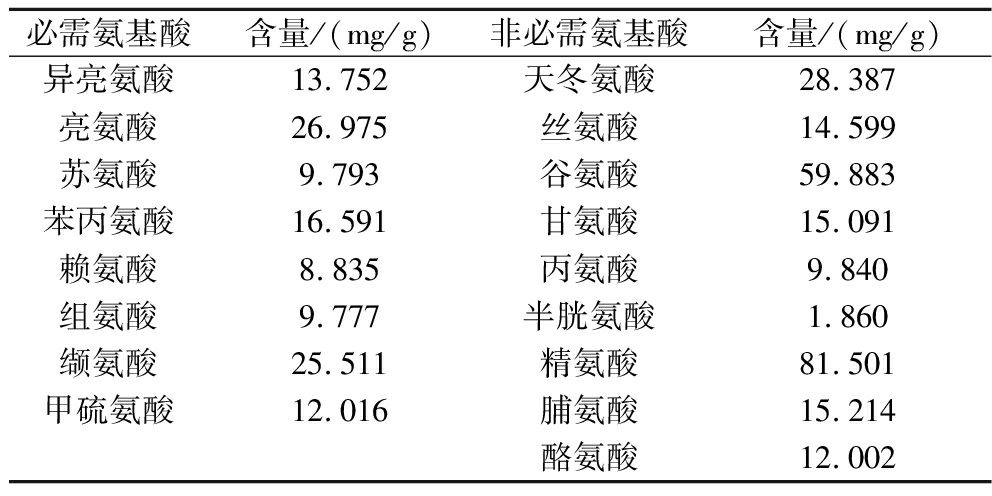
必需氨基酸含量/(mg/g)非必需氨基酸含量/(mg/g)异亮氨酸13.752天冬氨酸28.387亮氨酸26.975丝氨酸14.599苏氨酸9.793谷氨酸59.883苯丙氨酸16.591甘氨酸15.091赖氨酸8.835丙氨酸9.840组氨酸9.777半胱氨酸1.860缬氨酸25.511精氨酸81.501甲硫氨酸12.016脯氨酸15.214酪氨酸12.002
2.2 蛋白酶的选择
酶可以将蛋白质水解成小分子物质,DH是衡量酶解效果重要指标之一[13],蛋白酶具有专一性,具有特异性酶切位点,不同的酶对橄榄仁蛋白水解得到的酶解产物具有不同的生物活性[19]。由图1可知,6种蛋白酶对产物DH影响差异较大,木瓜蛋白酶处理组DH高达27.73%,明显高于其他组。同样,酶解产物的抗氧化活性差异明显,木瓜蛋白酶酶解所得多肽的DPPH自由基清除率最高,为71.46%,其次是碱性蛋白酶和胃蛋白酶,清除效果最差的为胰蛋白酶,为21.81%。橄榄仁氨基酸组成中,Phe和Lys这2种氨基酸含量较高,与木瓜蛋白酶的酶切位点正好相同[14]。酶解反应受多种条件的影响,不同酶的反应条件各不相同,将蛋白酶组合进行酶解虽可以少量提升多肽得率,但其对于反应条件的控制也更为苛刻,容易引起蛋白质失活[15],所以综合考虑选择木瓜蛋白酶作为橄榄仁蛋白的水解酶。
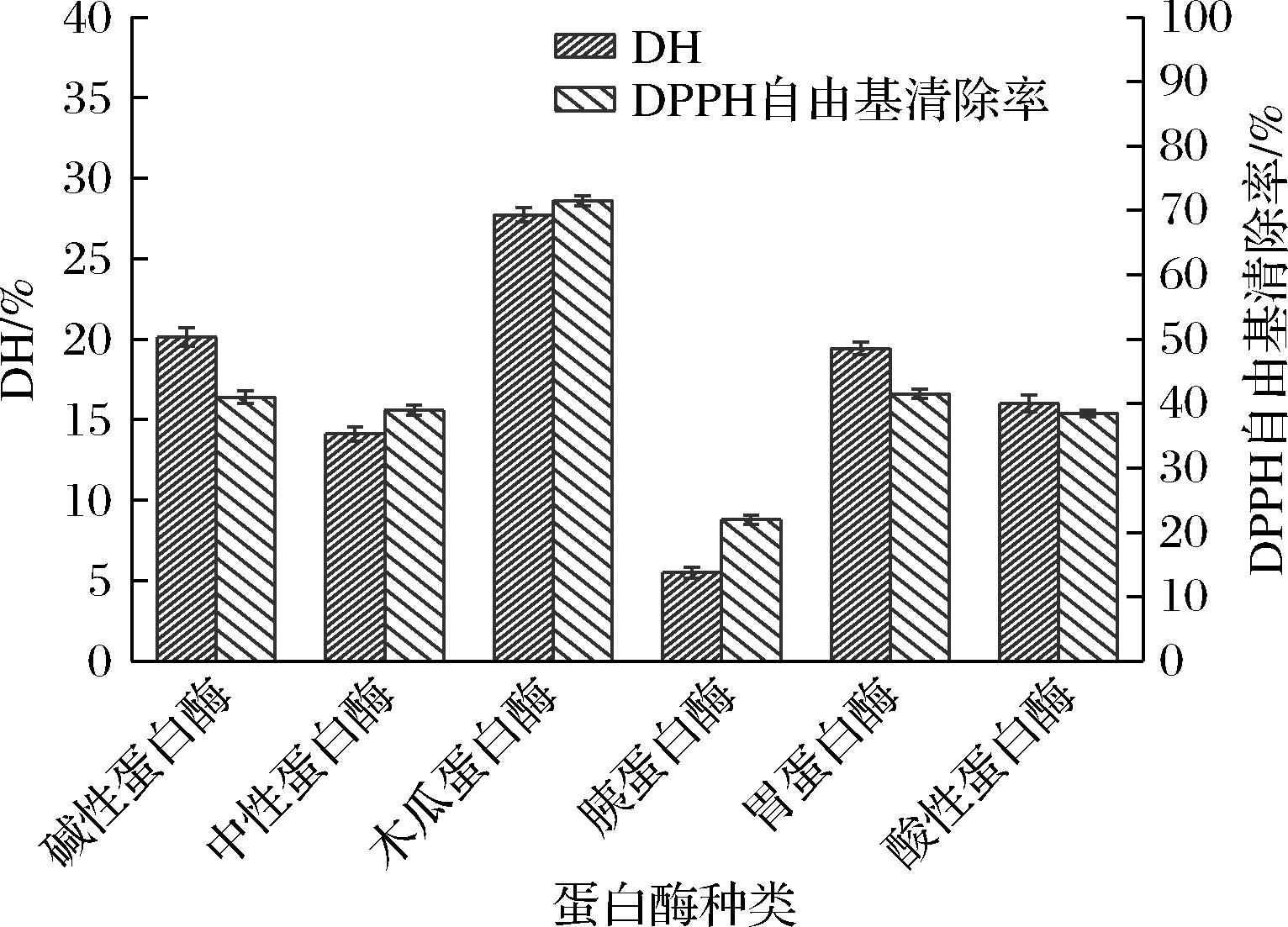
图1 不同蛋白酶处理组的DH及DPPH自由基清除率
Fig.1 DH and DPPH free radical clearance ability in different protease-treated groups
2.3 单因素试验结果
由图2-a可知,底物质量浓度由20 g/L增加到50 g/L时DH不断上升达到最大,底物浓度>50 g/L时,DH开始下降。这是因为底物浓度过高,蛋白质与水分子接触不充分,不利于酶和底物的反应,从而导致DH降低[16]。DPPH自由基的清除率随着底物浓度增大而增大,底物质量浓度为40~60 g/L时清除率差别不大。综合考虑,酶解选择最佳底物质量浓度为50 g/L。由图2-b所示,由于蛋白质的量有限,当酶底比为3.0%(质量分数,下同)后DH提高不明显,体系达到饱和状态,DPPH自由基清除率在酶底比为2.5%达到最大值[17]。酶底比增加清除率有降低的趋势,从节约成本考虑,选择酶底比为3%比较适宜。由图2-c可知,反应90 min后,反应速率降低,过长的时间会导致了部分长肽也被水解[18]。DPPH自由基的清除率在120 min时达到最大,随着水解时间的增加,橄榄仁蛋白水解物的活性没有明显增加。综合考虑,最佳酶解时间为90 min。由2-d所示,酶解温度在65 ℃时,DH达到最高随后DH降低,木瓜蛋白酶的适用温度区间较大,但温度过高会降低蛋白酶活力。DPPH自由基的清除率在45 ℃时较低,当温度在50~70 ℃时,清除率变化不明显。综合考虑,选择60 ℃为最佳酶解温度。
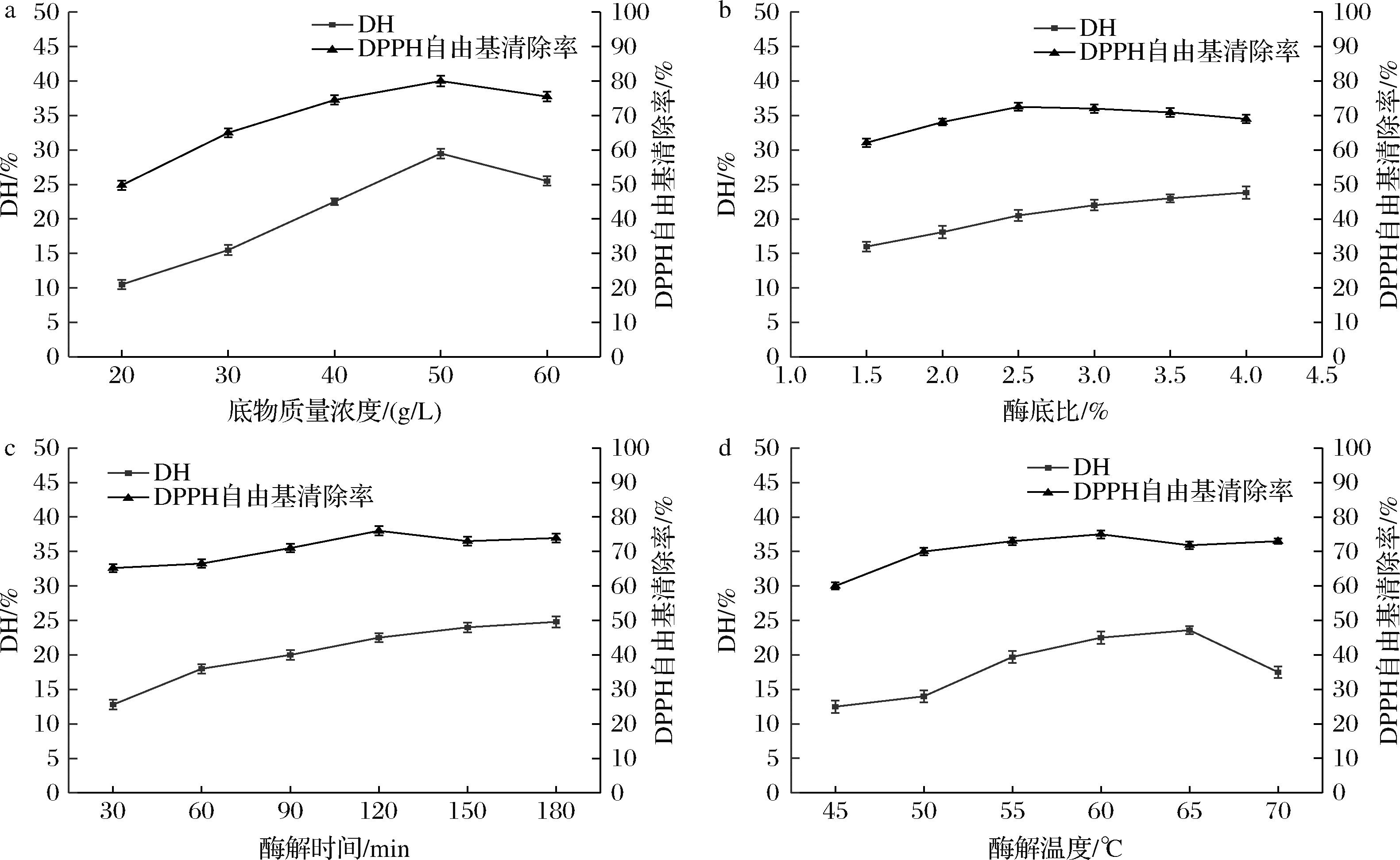
a-底物浓度;b-酶底比;c-酶解时间;d-酶解温度
图2 底物浓度、酶底比、酶解时间和酶解温度对酶解液DH及DPPH自由基清除率的影响
Fig.2 Effects of substrate concentration, substrate ratio, hydrolysis time and temperature on DH clearance of DPPH free radical
2.4 响应面试验结果
选取酶底比(A)、温度(B)、时间(C)3个因素,以DPPH自由基清除率为响应值,进行响应面优化试验,分析酶解橄榄仁制备抗氧化活性肽的最佳工艺条件。试验设计结果见表5。
表5 响应面设计方案与试验结果
Table 5 Response surface design scheme and test results
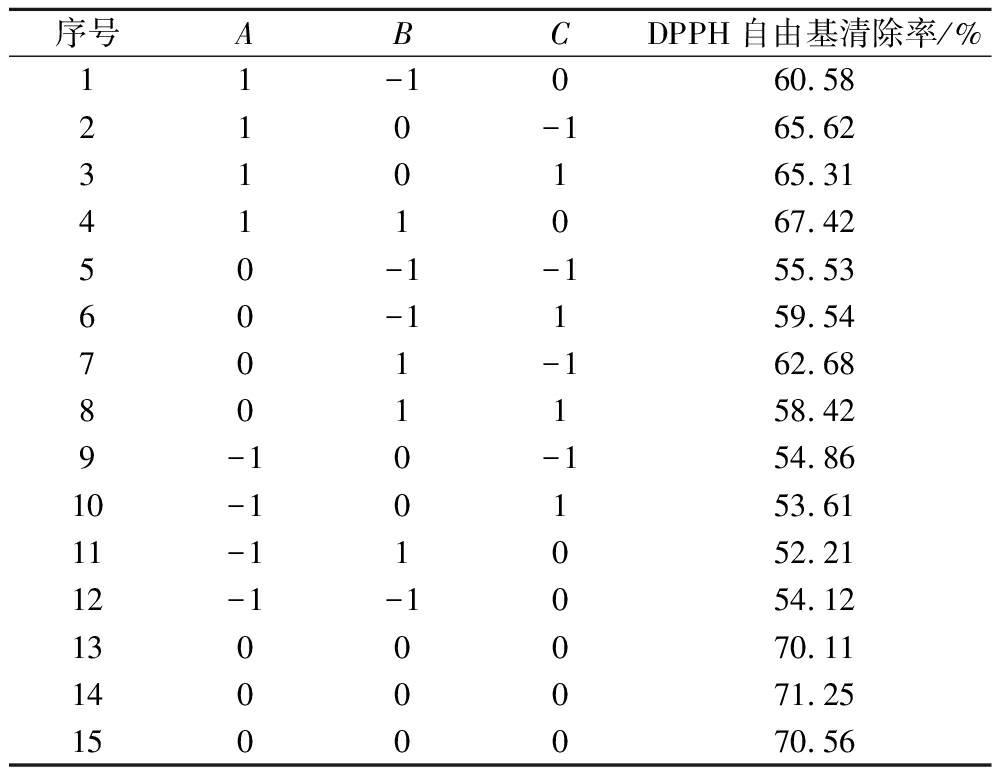
序号ABCDPPH自由基清除率/%11-1060.58210-165.62310165.31411067.4250-1-155.5360-1159.54701-162.68801158.429-10-154.8610-10153.6111-11052.2112-1-1054.121300070.111400071.251500070.56
运用Design-Expert.V8.0.6软件,通过拟合,进行二次回归分析,得到DPPH自由基清除率的回归方程,如公式(5)所示:
Y=70.64+5.52A+1.37B-0.23C+2.19AB+0.23AC-2.07BC-5.63A2-6.43B2-5.17C2
(5)
响应面方差分析结果如表6所示,P<0.000 1,该模型达到了极显著水平,且拟合方程的R2=0.986 1,表明二次回归模型具有良好的拟合度。酶底比的影响显著,其次是温度,最后是时间。
表6 试验结果响应面二次模型方差分析表
Table 6 Analysis of variance table of quadratic model of response surface of experimental results
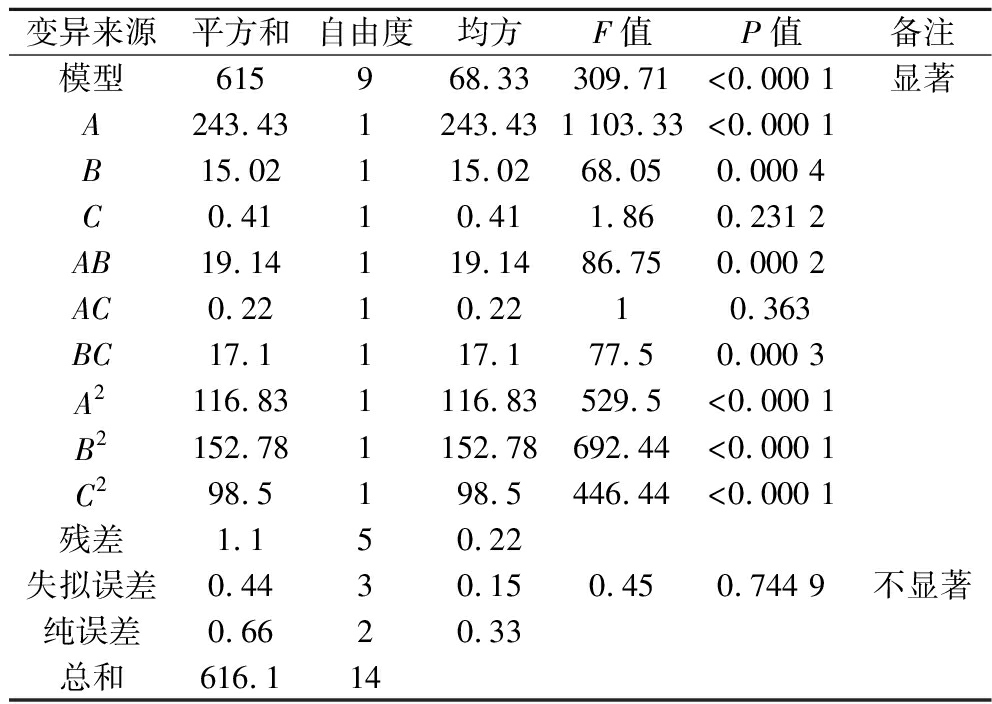
变异来源平方和自由度均方F值P值备注模型615968.33309.71<0.000 1显著A243.431243.431 103.33<0.000 1B15.02115.0268.050.000 4C0.4110.411.860.231 2AB19.14119.1486.750.000 2AC0.2210.2210.363BC17.1117.177.50.000 3A2116.831116.83529.5<0.000 1B2152.781152.78692.44<0.000 1C298.5198.5446.44<0.000 1残差1.150.22失拟误差0.4430.150.450.744 9不显著纯误差0.6620.33总和616.114
模型中的酶底比、温度、时间的一个因素固定在0水平,得到了其他2个因素与DPPH自由基清除能力相互作用的子模型,图3所示为三维曲面图和等高线示意图。
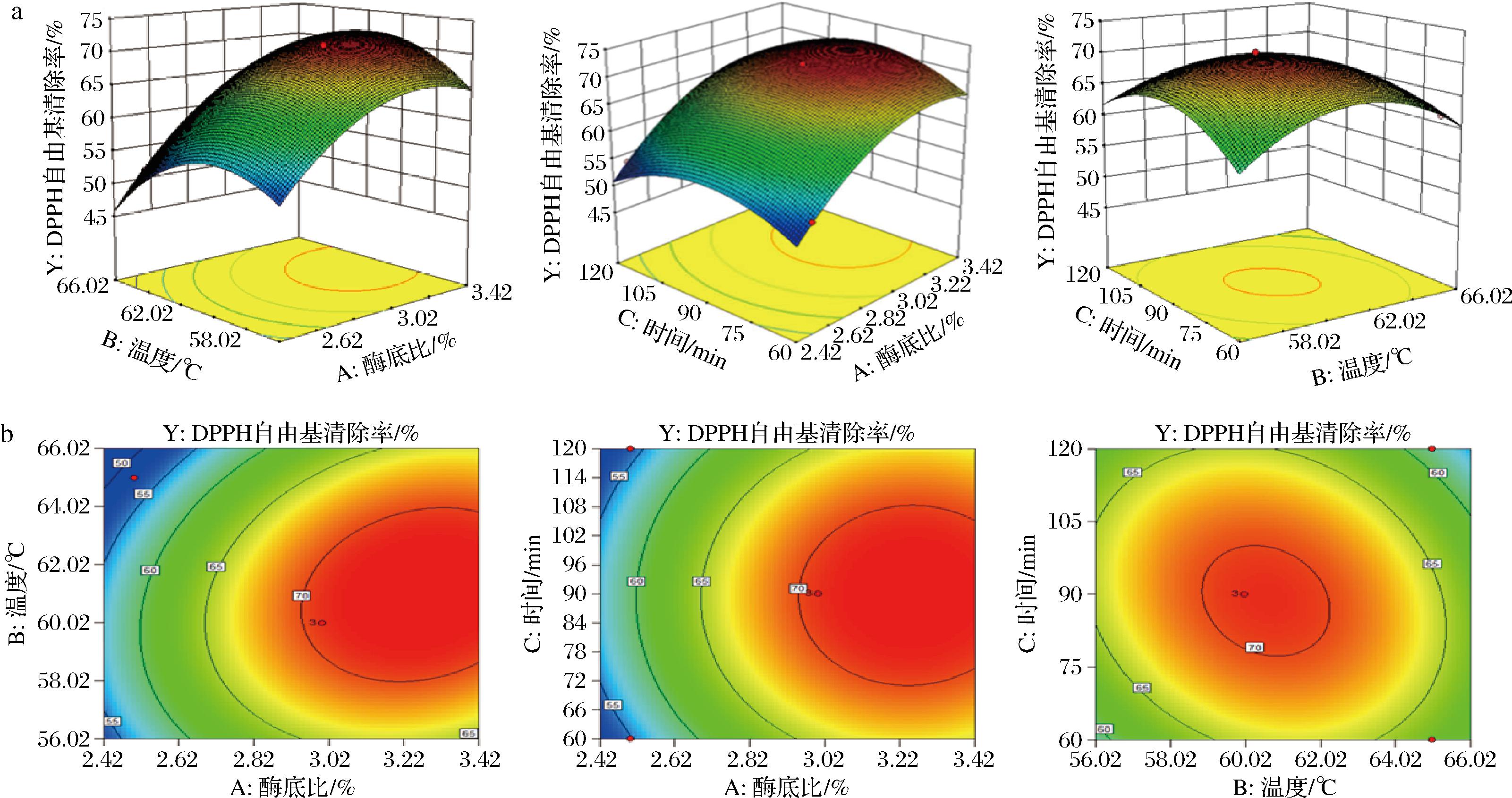
a-三维曲面图;b-等高曲线图
图3 各因素之间交互作用的曲面图
Fig.3 Surface plot of the interactions between factors
由图可以看出,当固定C=0时,Y的较高值落在A=2.93%~3.5%、B=58~64 ℃的范围内;当固定B=0时,Y的较高值落在A=3.0%~3.4%、C=70~110 min;当固定A=0时,Y的较高值落在B=58.50~62.05 ℃、C=80~100 min范围内。根据软件分析得出,最佳酶解条件为:酶底比3.26%、温度61 ℃、时间88.48 min,此时DPPH自由基清除率预测值为72.25%。检验模型结果,酶底比3.3%、温度61 ℃、时间88 min,此时测的清除率为(69.53±1.34)%,与预测值较为接近。
2.5 橄榄仁抗氧化肽分离鉴定
2.5.1 多肽分子质量的分布
利用高效液相色谱测定橄榄仁多肽的分子质量分布情况,表7为最佳酶解工艺条件下制得的橄榄仁多肽液分子质量分布情况。由面积占比可知,橄榄仁多肽相对分子质量<1 000 Da的多肽占76.04%,<3 000 Da的组分占91.56%,这一组分肽段对酶解液的营养价值和生物活性起重要作用[19]。
表7 橄榄仁多肽分子质量分布表
Table 7 Molecular weight distribution of olive kernel peptide
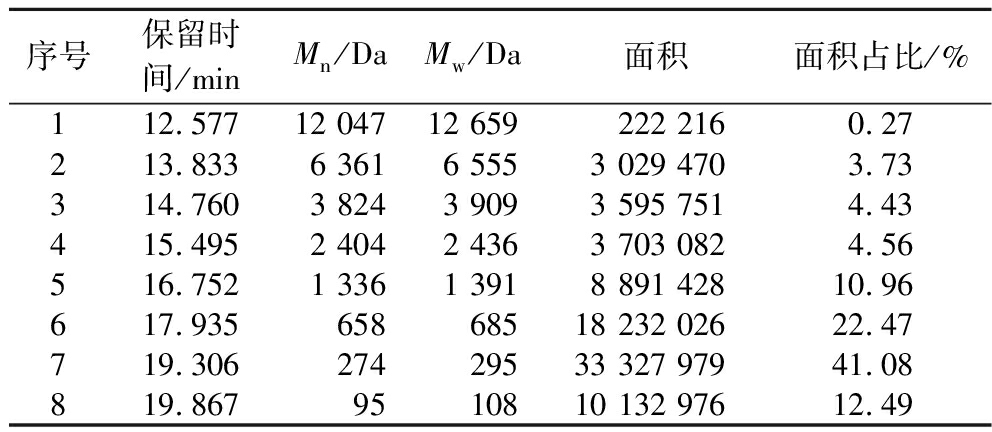
序号保留时间/minMn/DaMw/Da面积面积占比/%112.57712 04712 659 222 2160.27213.8336 3616 5553 029 4703.73314.7603 8243 9093 595 7514.43415.4952 4042 4363 703 0824.56516.7521 3361 3918 891 42810.96617.93565868518 232 02622.47719.30627429533 327 97941.08819.8679510810 132 97612.49
2.5.2 橄榄仁抗氧化肽分离鉴定
凝胶过滤色谱法是一种简便而有效的液相柱层色谱技术[20],该法分离条件温和、产品回收率高、工作范围广、分离分子质量的覆盖面大,可分离百至数万分子质量的分子[21]。按最佳酶解工艺制得橄榄仁多肽经由SephadexG-25分离得到5个组分。由表8可知,各组分性能差异较大,组分B抗氧化性能最好。
表8 SephadexG-25分离组分抗氧化活性
Table 8 Antioxidant activities of SephadexG-25 isolated fractions

组分DPPH自由基清除率/%·OH清除率/%·O2-清除率/%A59.1527.9473.34B73.4935.1690.16C68.2621.9282.58D62.9219.6475.53E51.7315.0768.25
使用SephadexG-15将组分B进行二次分离,得到6个组分,如图4所示,由质谱结合软件分析及蛋白质数据库分析氨基酸序列,得到氨基酸序列分别为:WLSF、TSVLR、LVYLVR、AGGKPFQ、YYPFKGFA、AFNVDERLAR。
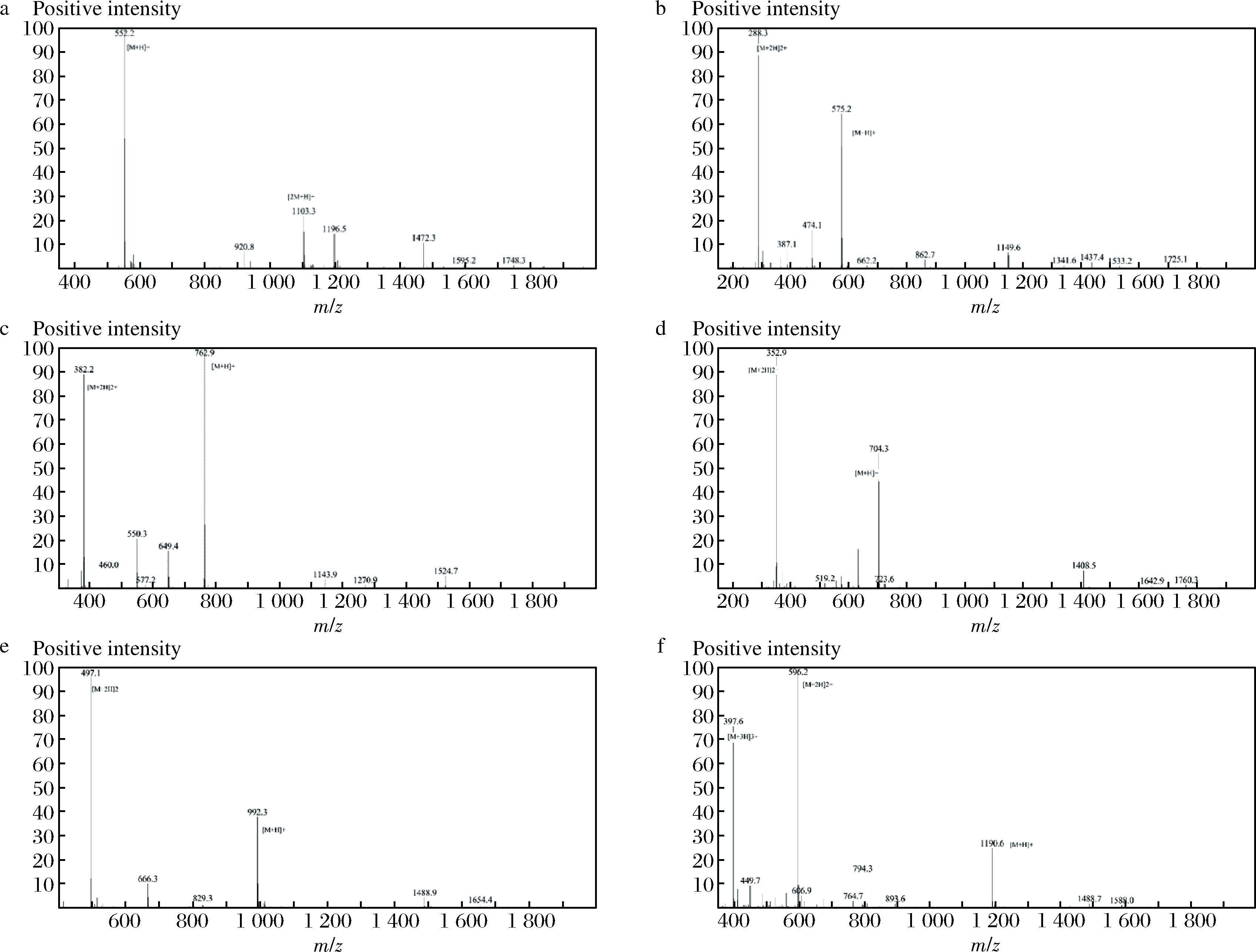
a-WLSF;b-TSVLR;c-LVYLVR;d-AGGKPFQ;e-YYPFKGFA;f-AFNVDERLAR
图4 质谱图
Fig.4 Mass spectrogram
如图5所示,多肽质量浓度1 mg/mL时6种肽对DPPH自由基和·O2-的清除能力无显著性差异,对DPPH自由基清除率最高的是TSVLR,清除率为81.07%,最低是AGGKPFQ,清除率为71.70%;对·O2-清除率均在90%以上;TSVLR肽对·OH清除率最高,达42.48%,综合来看TSVLR肽的抗氧化能力较好。研究表明含有下列氨基酸的肽段有抗氧剂能力:组氨酸、色氨酸、赖氨酸、精氨酸、亮氨酸和缬氨酸等[22]。活性较高的TSVLR肽中含有缬氨酸、亮氨酸和精氨酸,这可能对抗氧化活性有较大贡献[23]。
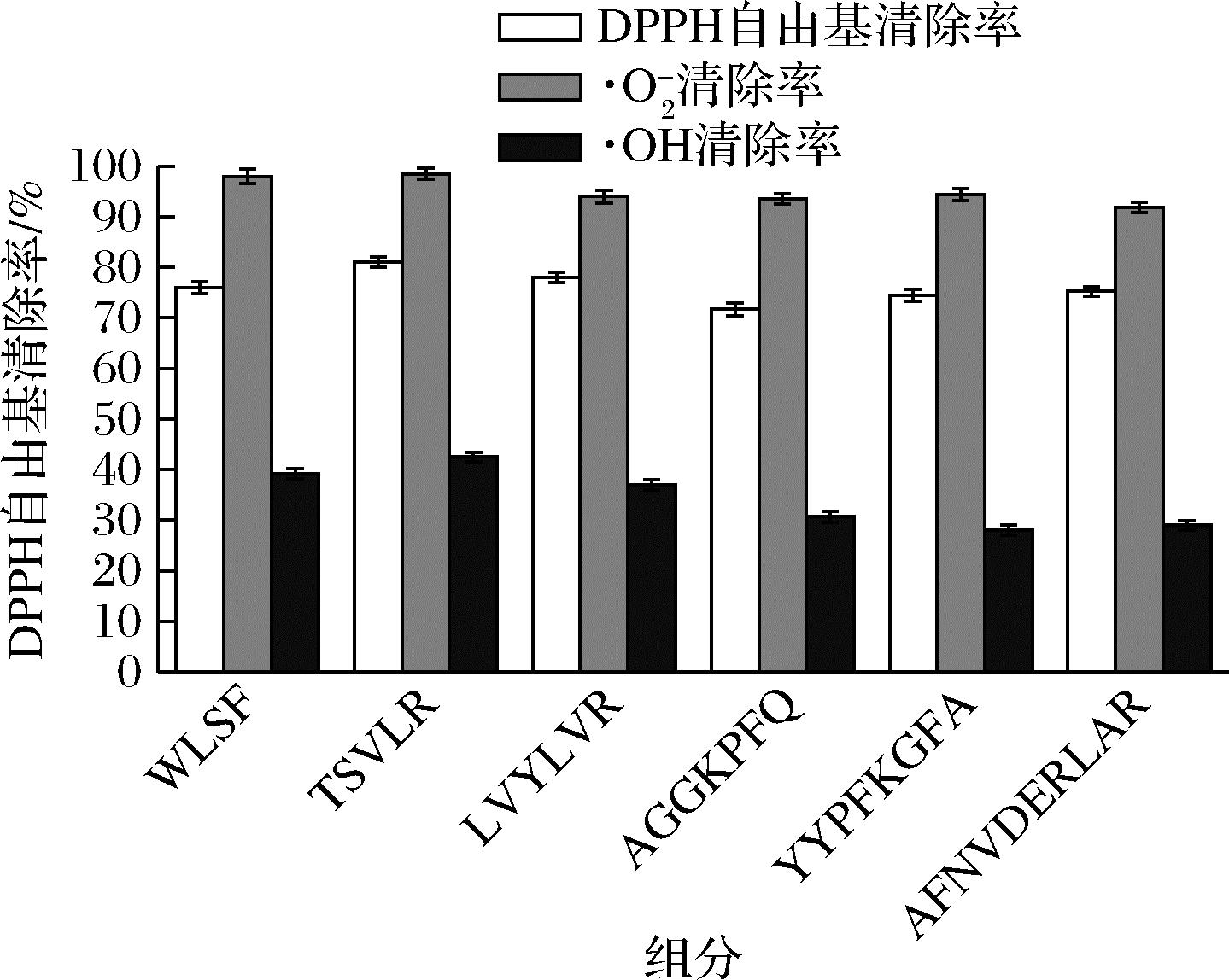
图5 SephadexG-15分离各组分抗氧化测试
Fig.5 Antioxidant test of SephadexG-15 secondary separation
2.6 分子对接
SOD是存在于动物、植物及微生物中与清除活性氧密切相关的金属蛋白酶,在机体氧化与抗氧化平衡中起到至关重要的作用。SOD能有效清除体内破坏健康、导致疾病的自由基,将其分解成对人体无害的氧分子和水分子,并顺利排除体外[24]。为清除细胞有氧代谢产生的各种活性氧,几乎所有需氧生物都进化出了一套氧化防御体系来保护细胞免受不良环境的影响,SOD被认为是抗氧化系统的第一道防线,在保护细胞免受氧自由基的毒害中发挥着重要作用[25]。因此,本文选择SOD(PDB ID:2ADQ)为受体蛋白与6种橄榄仁抗氧化肽进行对接模拟,其对接结合能、氢键及对接相互作用可视化图分别见表9和图6。结果表明,纯化后的多肽能很好地与目的蛋白的活性部位结合,其结合能分别为-5.6、-6.5、-6.1、-6.4、-6.7和-5.6 kcal/mol。
表9 抗氧化肽与2ADQ的对接结合能
Table 9 Docking binding energy of antioxidant peptide and 2ADQ

名称对接合能/(kcal/mol)WLSF-5.6TSVLR-6.5LVYLVR-6.1AGGKPFQ-6.4YYPFKGFA-6.7AFNVDERLAR-5.6
各肽段与SOD发生相互作用,主要是通过形成氢键以及疏水作用力。图6-a表示WLSF与SOD的His163、His30形成氢键,氢键的长度分别为2.95、3.11 Å;Leu167、Tyr166、Glu162、Trp161、Tyr34、Ala33、Phe66具有疏水作用;图6-b表示TSVLR与SOD的His30、Tyr34、His163形成氢键,氢键的长度分别为3.07、3.12、3.39、2.82、3.44、3.48 Å;与Glu162、Tyr166、Leu167、Leu25、Ser121、Trp161具有疏水作用;图6-c表示LVYLVR与SOD的Gln46、Glu42形成氢键,氢键的长度分别为3.44、3.32 Å;与Lys65、Gln61、Pro145、Gly148、Gly68、Ile72、Leu38、Leu64、Tyr45具有疏水作用;图6-d表示AGGKPFQ与SOD的Asn188、Arg192、Ser75、His2形成氢键,氢键的长度分别为2.83、3.06、3.38、2.87、3.00、3.27、3.06 Å;与Ile76、Lys65、Gly68、Ile72、Pro5、Thr79、Trp78、Pro8具有疏水作用;图6-e表示YYPFKGFA与SOD的Gly148、Gln147、Asp6、Asn185形成氢键,氢键的长度分别为3.30、3.16、3.33、3.30、3.10 Å;Pro8、Thr79、Pro5、Ser75、Ile76、Ser75、Ile76、His71、Ile72具有疏水作用;图6-f表示AFNVDERLAR与SOD的Pro62、Tyr34、Glu62、His163、His30形成氢键,氢键的长度分别为3.38、3.16、3.13、2.87、3.14、2.77、3.43、3.05 Å;与Tyr166、Leu167、Phe66、Ser121、Trp161具有疏水作用[25]。
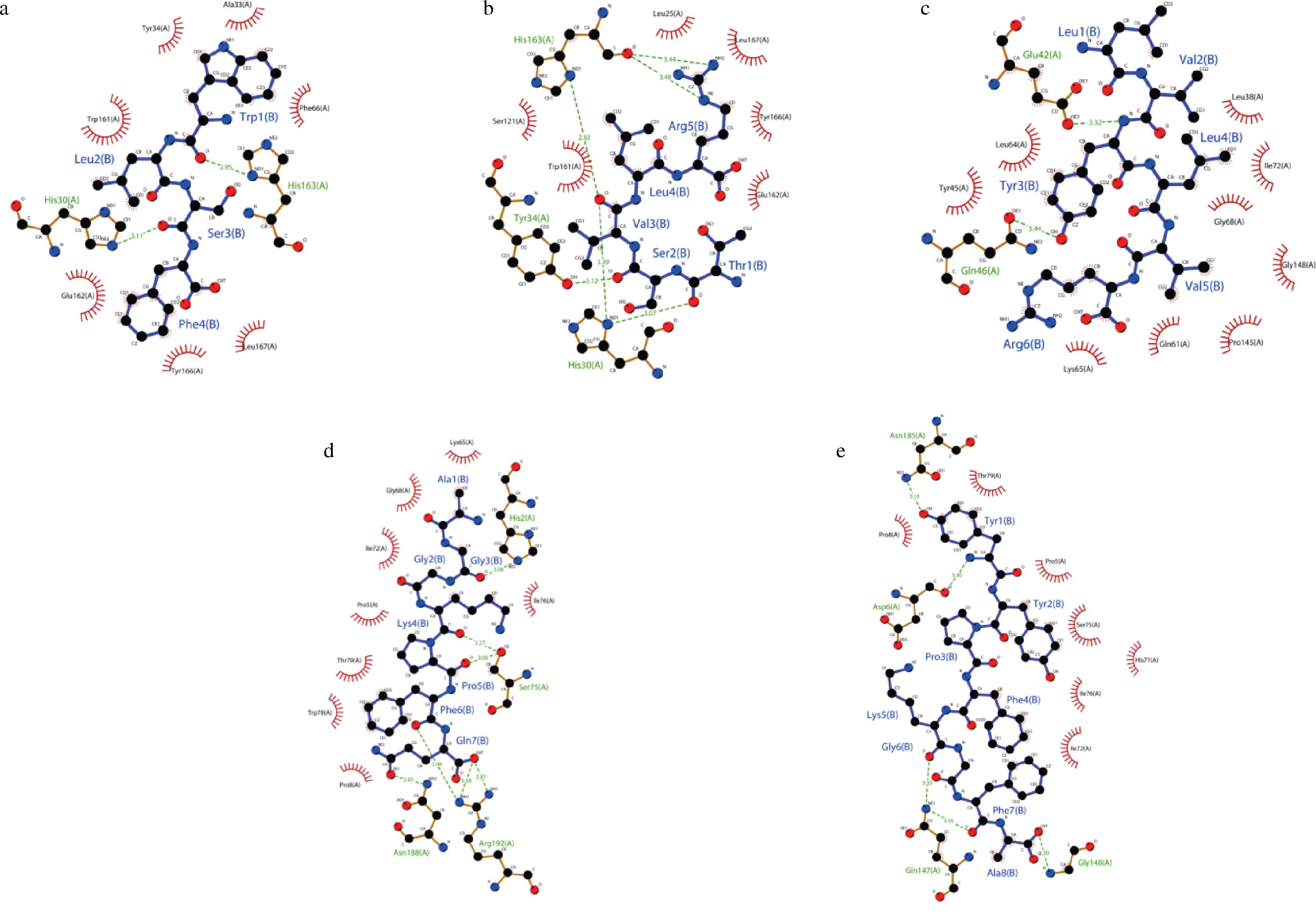
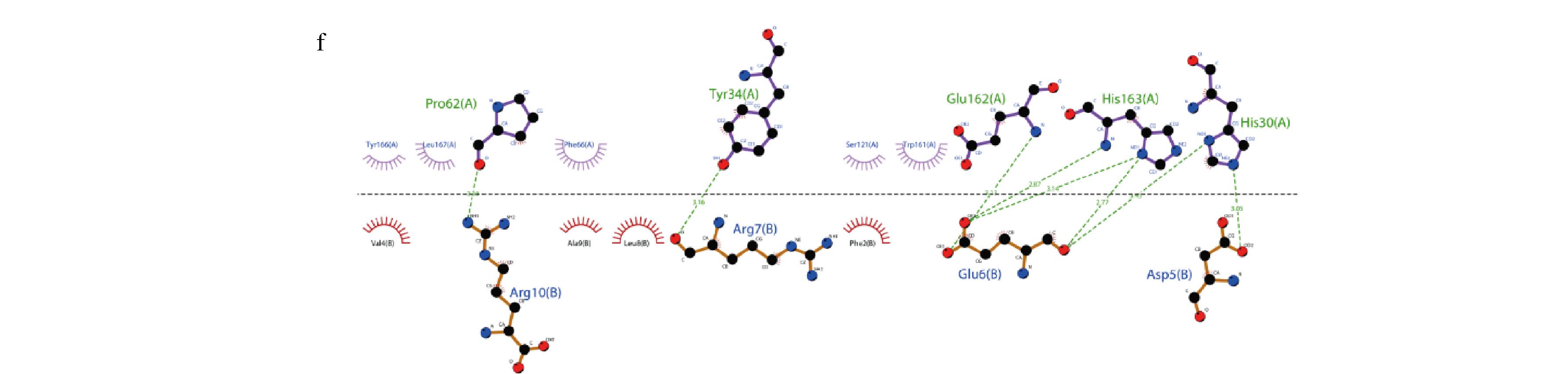
a-SOD-WLSF;b-SOD-TSVLR;c-SOD-LVYLVR;d-SOD-AGGKPFQ;e-SOD-YYPFKGFA;f- SOD-AFNVDERLAR
图6 对接可视化图
Fig.6 Docking visualization diagram
在本研究中,进行了6种橄榄仁抗氧化肽与SOD蛋白之间的分子对接研究,以研究其作用机制。结果表明,纯化肽和抗氧化相关靶蛋白之间的疏水效应和氢键可能是其潜在生物活性的原因。通过对6种抗氧化肽与SOD蛋白之间的分子对接研究,分析其对接结果,发现YYPFKGFA、TSVLR与SOD具有较高的结合能,同时YYPFKGFA、TSVLR也可以与SOD结合产生氢键,因此我们猜测YYPFKGFA与TSVLR可以提高SOD的酶活性,但因为蛋白质在生物体内的反应受很多条件影响,不同的温度、酸碱度等都会导致SOD失活[26],因此想要探究YYPFKGFA、TSVLR对于SOD的影响还需要进一步实验论证。
3 结论
本研究采用响应面优化酶解工艺、分级、超滤、色谱分析以及抗氧化活性测定等方法,从橄榄仁水解物中提取分离并鉴定了具有抗氧化活性的肽。6种蛋白酶水解物经过抗氧化活性测试得出木瓜蛋白酶较适合制备橄榄仁抗氧化活性肽,响应面优化出的最佳提取工艺为底物质量浓度50 g/L、酶底比为3.3%(质量分数)、温度61 ℃、时间88 min。将所得粗肽经过SephadexG-25和SephadexG-15两次分离纯化后发现6个肽具有良好的抗氧化活性。分别为WLSF、TSVLR、LVYLVR、AGGKPFQ、YYPFKGFA、AFNVDERLAR。多肽质量浓度为1 mg/mL时,综合对比出TSVLR肽的抗氧化能力较好,对DPPH自由基清除率为81.07%,对·O2-的清除率在90%以上。分子对接研究表明,纯化肽和SOD之间的疏水效应和氢键可能是橄榄仁活性肽具有良好的抗氧化活性的原因。本研究结果表明橄榄仁具有较好的抗氧化活性,可作为天然食物来源制取功能性食品的一个新的探究方向,并且由于其有益作用,在经济上可能具有更好的前景。
[1] 曹小舟, 刘永祥, 俞凌, 等.植物蛋白源抗氧化肽活性的评价方法及作用机制的研究进展[J].食品工业科技, 2016, 37(13):355-359; 364. CAO X Z, LIU Y X, YU L, et al.Progress in evaluation methods and action mechanism of antioxidant activity for plant protein- derived peptides[J].Science and Technology of Food Industry, 2016, 37(13):355-359; 364.
[2] MAZORRA-MANZANO M A, RAM REZ-SUAREZ J C, YADA R Y.Plant proteases for bioactive peptides release:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(13):2147-2163.
REZ-SUAREZ J C, YADA R Y.Plant proteases for bioactive peptides release:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(13):2147-2163.
[3] 孙崇臻, 汤新, 孙崇军, 等.桑叶蛋白抗氧化肽的酶法制备[J].现代食品科技, 2020, 36(4):192-201. SUN C Z, TANG X, SUN C J, et al.Enzymatic preparation of antioxidant peptides of mulberry (Morus atropurpurea Roxb.) leaf protein[J].Modern Food Science and Technology, 2020, 36(4):192-201.
[4] YU Y H, HU Q H, LIU J H, et al.Isolation, purification and identification of immunologically active peptides from Hericium erinaceus[J].Food and Chemical Toxicology, 2021, 151:112111.
[5] FAN S H, HU Y N, LI C, et al.Optimization of preparation of antioxidative peptides from pumpkin seeds using response surface method[J].PLoS One, 2014, 9(3):e92335.
[6] 王耀冉, 陈明杰, 李治平, 等.生物活性肽制备、鉴定及其生物活性研究进展[J].食品工业, 2021, 42(12):349-354. WANG Y R, CHEN M J, LI Z P, et al.Research progress on preparation, identification and biological activity of bioactive peptides[J].The Food Industry, 2021, 42(12):349-354.
[7] MAESTRI E, MARMIROLI M, MARMIROLI N.Bioactive peptides in plant-derived foodstuffs[J].Journal of Proteomics, 2016, 147:140-155.
[8] SUN Q A, CHENG Y M, YANG G, et al.Stability and sensory analysis of walnut polypeptide liquid:Response surface optimization[J].International Journal of Food Properties, 2019, 22(1):853-862.
[9] JANG H L, LICEAGA A M, YOON K Y.Purification, characterisation and stability of an antioxidant peptide derived from sandfish (Arctoscopus japonicus) protein hydrolysates[J].Journal of Functional Foods, 2016, 20:433-442.
[10] KONYALIOGLU S, CEBE G E, AKTAR S.Antioxidant activity of Crataegus monogyna L flowers[J].Free Radical Biology and Medicine, 2017, 108:S56.
[11] ZHUANG Y L, SUN L P.Preparation of reactive oxygen scavenging peptides from tilapia (Oreochromis niloticus) skin gelatin:Optimization using response surface methodology[J].Journal of Food Science, 2011, 76(3):C483-C489.
[12] SUSSMAN J L, LIN D W, JIANG J S, et al.Protein data bank (PDB):Database of three-dimensional structural information of biological macromolecules[J].Acta Crystallographica Section D Biological Crystallography, 1998, 54(6):1078-1084.
[13] AN G J, WEI M Y, WANG Z C, et al.Effects of enzymolysis method on the preparation of peptides from wheat flour[J].Food Bioscience, 2022, 49:101956.
[14] YANG J, HUANG J C, ZHU Z S, et al.Investigation of optimal conditions for production of antioxidant peptides from duck blood plasma:Response surface methodology[J].Poultry Science, 2020, 99(12):7159-7168.
[15] ZHANG X, ZHANG H, JIAO P F, et al.Preparation and evaluation of antioxidant activities of bioactive peptides obtained from Cornus officinalis[J].Molecules, 2022, 27(4):1232.
[16] 孙会刚, 陈志轩, 周中驰, 等.响应面法优化大豆分离蛋白提取及复合酶解制备活性肽[J].中国调味品, 2022, 47(3):82-87. SUN H G, CHEN Z X, ZHOU Z C, et al.Optimization of soybean protein isolate extraction by response surface method and complex enzymatic hydrolysis for preparing active peptides[J].China Condiment, 2022, 47(3):82-87.
[17] 栾俊家, 张尚悦, 李昂达, 等.响应面法优化秋刀鱼酶解制备抗氧化活性肽的工艺[J].食品工业科技, 2022, 43(5):172-181. LUAN J J, ZHANG S Y, LI A D, et al.The optimization of the preparation process of antioxidative active peptide from the enzymatic hydrolysate of Pacific saury(Cololabis saira) by response surface methodology[J].Science and Technology of Food Industry, 2022, 43(5):172-181.
[18] HUANG G L, MEI X Y, HU J C.The antioxidant activities of natural polysaccharides[J].Current Drug Targets, 2017, 18(11):1296-1300.
[19] CHANIOTI S, SIAMANDOURA P, TZIA C.Evaluation of extracts prepared from olive oil by-products using microwave-assisted enzymatic extraction:Effect of encapsulation on the stability of final products[J].Waste and Biomass Valorization, 2016, 7(4):831-842.
[20] MOTALLEBI RIEKANDEH S, MAZANDARANI M, EBRAHIMZADEH M A, et al.Antioxidant activities of Eryngium caucasicum inflorescence[J].European Review for Medical and Pharmacological Sciences, 2016, 20(5):946-949.
[21] 蔡树杏, 邹江林, 徐友阳, 等.响应面法优化三七茎叶茶酶解工艺[J].食品与发酵科技, 2021, 57(2):108-114. CAI S X, ZOU J L, XU Y Y, et al.Optimization of enzymatic hydrolysis process of Panax notoginseng stem-leaf tea by response surface methodology[J].Food and Fermentation Sciences &Technology, 2021, 57(2):108-114.
[22] WU B Y, QIAN B J, ZHU Q, et al.Purification and identification of an angiotensin I-converting enzyme-inhibitory peptide from Argopecten irradians mantle enzymatic hydrolysate[J].European Food Research and Technology, 2017, 243(4):711-717.
[23] ACHIRI R, FOUZIA M, BENOMARI F Z, et al.Chemical composition/pharmacophore modelling- based, virtual screening, molecular docking and dynamic simulation studies for the discovery of novel superoxide dismutase (SODs) of bioactive molecules from aerial parts of Inula montana as antioxydant’s agents[J].Journal of Biomolecular Structure and Dynamics, 2022, 40(23):12439-12460.
[24] GAIKWAD D, JADHAV N.Development of stable emulsified formulations of Terminalia arjuna for topical application:Evaluation of antioxidant activity of final product and molecular docking study[J].Drug Development and Industrial Pharmacy, 2019, 45(11):1740-1750.
[25] SHENG Y W, ABREU I A, CABELLI D E, et al.Superoxide dismutases and superoxide reductases[J].Chemical Reviews, 2014, 114(7):3854-3918.
[26] 孙娟, 黄业传, 李婷婷.猪肉超氧化物歧化酶超高压失活动力学研究[J].食品工业科技, 2016, 37(1):126-129; 152. SUN J, HUANG Y C, LI T T.Study on the ultrahigh pressure inactivation kinetics of pork superoxide dismutase[J].Science and Technology of Food Industry, 2016, 37(1):126-129; 152.