南美白对虾(Litopenaeus vannamei)属十足目、对虾科,其营养丰富、味道鲜美、肉质细腻,深受消费者的喜爱。南美白对虾在20世纪90年代初期成功进行人工繁殖,其养殖规模随消费者需求量的增加而扩大,2021年我国养殖南美白对虾产量高达197.74万t,占全国养殖虾类总产量的36.97%[1]。
目前,南美白对虾主要以冷冻品形式销售。冷链运输是指冷藏冷冻品从生产、加工、运输、销售、配送直到消费者手中、全过程始终处于维持其品质所需的可控环境温度下的特殊供应链,减少因腐败变质引起的损耗,使产品保持相对较高的新鲜度[2]。近几年,随着人们对高品质消费需求的快速增长,冷链物流行业发展规模显著扩大。然而,冷链流通过程中由于冷链设备缺乏、物流技术落后和物流不规范等原因常会出现“断链”现象[3],使得冷冻水产品在运输、贮藏和销售等过程中不可避免地会发生温度波动。温度波动会导致水产品肌肉组织中的冰晶重结晶、蛋白变性、汁液流失等,严重影响其食用品质。韩洋[4]对国内冷链近距离运输和远距离运输时低温运输车内的温度进行实时记录,总结发现3 d内运输车内小幅度温度波动范围为5 ℃左右,大幅度温度波动范围为12 ℃左右,某些极端条件下甚至会升温至0 ℃,全程波动频率在1~4次。SZYMCZAK等[5]将腌制7 d后的海鲱鱼片分别置于恒温-19 ℃和在-19~-23 ℃周期性变化的温度下贮藏5个月,结果发现温度波动组鱼片的硬度、色泽和感官评分显著高于恒温组,温度波动会导致肌肉组织结构和溶酶体膜的分解。XIE等[6]模拟带鱼在恒温冷链、运输和零售过程中的温度波动,研究表明鱼片温度波动次数越多,其品质劣变速度越快,显著高于贮藏在恒定温度的样品。ZHANG等[7]将冷冻凡纳滨对虾在-18~4 ℃进行温度波动,结果显示温度波动会导致冰晶生长和重结晶现象,从而使得解冻损失、肌纤维间隙增大,降低了其硬度、弹性、肌原纤维蛋白含量和Ca2+-ATPase活性。现阶段,国内外针对温度波动的研究主要集中在水产品的冻融循环过程,以及将物流运输分为多个阶段,每个阶段不同温度的切换波动中。而真正冷链流通中的温度波动研究较少,且鲜有对持水性及质构特性进行深入的分析。
本研究依据冷链流通过程中环境温度可能发生小幅度、大幅度以及极端波动,对冷冻南美白对虾分别进行-18~-12、-18~-6、-18~0 ℃ 3个温度波动处理,研究不同温度波动及次数对其持水性及质构的影响并探究其内在机理,旨在为冷冻南美白对虾在冷链流通过程中的品质调控提供参考和理论基础。
1 材料与方法
1.1 材料与试剂
冷冻南美白对虾整虾[(24.87±3.01) g/尾,n=2 000]于2022年8月采购于上海新鱼港国际贸易有限公司,置于泡沫箱中加干冰、冰袋,12 h内运输至上海海洋大学实验室,在-18 ℃冰箱内贮藏备用。该样品由工厂专业化条件进行冻结并在-18 ℃下贮藏12个月,出厂日期一致且均在保质期内。
浓盐酸、Tris,国药集团化学试剂有限公司;NaCl、Na2HPO4、NaH2PO4、体积分数2.5%戊二醛固定液、考马斯亮蓝,上海麦克林生化科技有限公司;Carnoy固定液、无水乙醇、伊红染液,北京索莱宝科技有限公司;5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithio bis-(2-nitrobenzoic acid),DTNB],上海阿拉丁生化科技股份有限公司;以上均为分析纯。
1.2 仪器与设备
RC-4温度记录仪,江苏省精创电子有限公司;DHG-9070A型鼓风干燥箱,上海鳌珍仪器制造有限公司;TA.XT Plus质构仪,英国 SMS公司;BT-224S电子分析天平,赛多利斯科学仪器有限公司;FJ200-SH型数显高速分散均质机,上海标本模型厂;H2050R高速冷冻离心机,长沙湘仪有限公司;UV-1800PC紫外可见分光光度计,中国上海美普达公司;HWS-24电热恒温水浴锅,上海恒科学仪器;AE-6500垂直电泳槽,日本ATTO公司;F-7100荧光分光光度计,日本日立高新技术公司;Eclipse E100正置光学显微镜,日本Nikon;SU5000热场发射扫描电镜,日本日立有限公司。
1.3 实验方法
1.3.1 实验设计
根据韩洋[4]监测到的国内近距离冷链流通中存在的小幅度(约5 ℃)、大幅度(约12 ℃)和极端波动(升温至0 ℃)情况,本文设计了3种温度波动梯度范围(-18~-12、-18~-6、-18~0 ℃),使研究更贴合实际运输情况。
将冷冻南美白对虾整虾随机分为3组(n=900),分别进行-18~-12、-18~-6、-18~0 ℃温度波动处理。温度波动过程主要是将冷冻南美白对虾整虾置于-18 ℃冰箱中并用温度计实时监测其环境温度,温度稳定后调节冰箱温度至目标温度(-12、-6、0 ℃),待其环境温度稳定在目标温度后保持1 h,随后将其温度调回-18 ℃并在此温度下贮藏24 h,即完成1次温度波动。重复上述操作,分别取温度波动0、1、3、5、7次的样品进行相关指标的测定。
1.3.2 持水性测定
1.3.2.1 水分含量
水分含量测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中直接干燥法。
1.3.2.2 解冻损失
称量解冻前和解冻后南美白对虾的质量,分别记为m1和m2,按公式(1)计算解冻损失:
解冻损失![]()
(1)
1.3.2.3 离心损失
参考王玥科等[8]实验方法并略有改动。称量去头、去壳后的南美白对虾的质量,记为m3;用两层滤纸包裹后置于离心管中,离心(5 000 r/min,15 min,4 ℃)后称量样品质量,记为m4。按公式(2)计算离心损失:
离心损失![]()
(2)
1.3.3 质地剖面分析(texture profile analysis,TPA)及剪切力测定
参考李学鹏[9]的方法并略作修改。采用质构仪对南美白对虾腹部第二节进行2次质地剖面分析。测定参数如下:采用P/5平底柱形探头,测前速率为3.00 mm/s,测试速率为1.00 mm/s,测后速率为1.00 mm/s,压缩变形率为50%,探头2次测试停留间隔时间为5 s,触发力为5 g,每组测定6个样品并取平均值。
参考邱泽慧等[10]的方法并稍作修改。采用WBS探头,沿垂直于南美白对虾第二腹节方向完全切断,测前速率为5.00 mm/s,测试速率为1.00 mm/s,测后速率为10.00 mm/s,压缩程度为50%,每组样品测6组平行并取平均值。
1.3.4 肌原纤维蛋白的提取
参考杨慧等[11]的方法并稍作修改。在2.0 g切碎的虾肉中加入10倍体积预冷缓冲液A(0.1 mol/L NaCl, 20 mmol/L Tris-HCl,pH 7.5),均质(10 000 r/min,30 s/次)2次后离心(10 000 r/min, 10 min, 4 ℃)取沉淀。加入5倍体积缓冲液继续离心(10 000 r/min,10 min,4 ℃),重复2次,最后所得沉淀加入相同体积缓冲液B(0.6 mol/L NaCl, 20 mmol/L Tris-HCl, pH 7.5)后在4 ℃下浸提2 h,用双层纱布过滤除去不溶性部分,滤液即为肌原纤维蛋白溶液。以牛血清白蛋白(bovine albumin,BSA)制作标准曲线,采用双缩脲法测定蛋白质浓度。
1.3.5 蛋白质巯基含量的测定
根据ZHANG等[12]的测定方法并稍作修改。将提取的肌原纤维蛋白溶液调整为4 mg/mL,取0.5 mL蛋白溶液中加入4.5 mL 0.2 mmol/L Tris-HCl缓冲液(pH 7.5),充分混合。取上述混合液4 mL,加入0.5 mL DTNB,混合均匀后置于40 ℃水浴25 min。以0.6 mol/L的NaCl溶液代替蛋白质溶液作为对照组,在波长412 nm处测定吸光度。按公式(3)计算巯基含量:
巯基含量![]()
(3)
式中:A412,412 nm处的吸光度;n,蛋白质的稀释倍数;4,蛋白质质量浓度,mg/mL;13 600,摩尔吸光系数,L/(mol·cm)。
1.3.6 内源荧光强度的测定
参照ZHANG等[13]测定方法并稍作改动。调整肌原纤维蛋白溶液质量浓度为0.3 mg/mL,采用F-4600荧光分光光度仪进行测定。设置参数如下:激发波长为295 nm,发射光谱范围为300~400 nm,扫描速度为1 200 nm/min。
1.3.7 SDS-PAGE
参考LAEMMLI[14]的测定方法并加以调整。调整肌原纤维蛋白溶液质量浓度为1.2 mg/mL,加5×非还原蛋白上样缓冲液并充分混合。在体积分数4%~20%的预制胶中进行电泳,上样量为10 μL,在120 V电压下电泳1 h。跑完后将凝胶置于体积分数0.1%考马斯亮蓝R-250染色10 min,用脱色液脱色。
1.3.8 冰晶形态的观察与测定
参考ZHANG等[7]描述的苏木精-伊红(hematoxylin-eosin,HE)染色方法,观察虾肌肉组织中冰晶形态的变化情况。将样品浸于固定液中过夜,用系列不同体积分数乙醇溶液(50%、70%、80%、90%、95%、100%)进行梯度洗脱,用石蜡包埋后于切片机下切成5 μm厚的切片,通过HE染色后在光学显微镜下进行观察。
参考史羽瑶等[15]的方法,使用ImageJ图像分析软件对横截面切片图像进行处理并计算冰晶平均横截面积和圆度,以评价冰晶的大小和形态。每组样品至少选取3张图片进行计算,图中的有效冰晶个数不少于100个,以确保数据分析的准确性。
1.3.9 肌纤维微观结构测定
根据ZHANG等[7]方法并略有改动。将解冻后的样品切成2~3 mm厚的小块,置于2.5%戊二醛固定液中固定24 h,随后用0.2 mol/L磷酸盐缓冲溶液(pH 7.5)洗脱3次,每次15 min;并用不同体积分数的乙醇溶液(30%、50%、70%、80%、90%、95%和100%)进行梯度洗脱,每次10 min;冷冻干燥,镀金后于扫描电镜下进行观察。
1.3.10 数据处理
每组实验至少重复3次以上,结果以平均值±标准差表示。通过SPSS软件进行单因素方差分析(Duncan’s法),显著性差异为 95%置信区间(P<0.05)。所有图的绘制使用Origin 2023软件;采用SIMCA 14.1软件进行偏最小二乘法分析。
2 结果与分析
2.1 温度波动对冷冻南美白对虾冰晶形态的影响
2.1.1 冰晶形态的变化
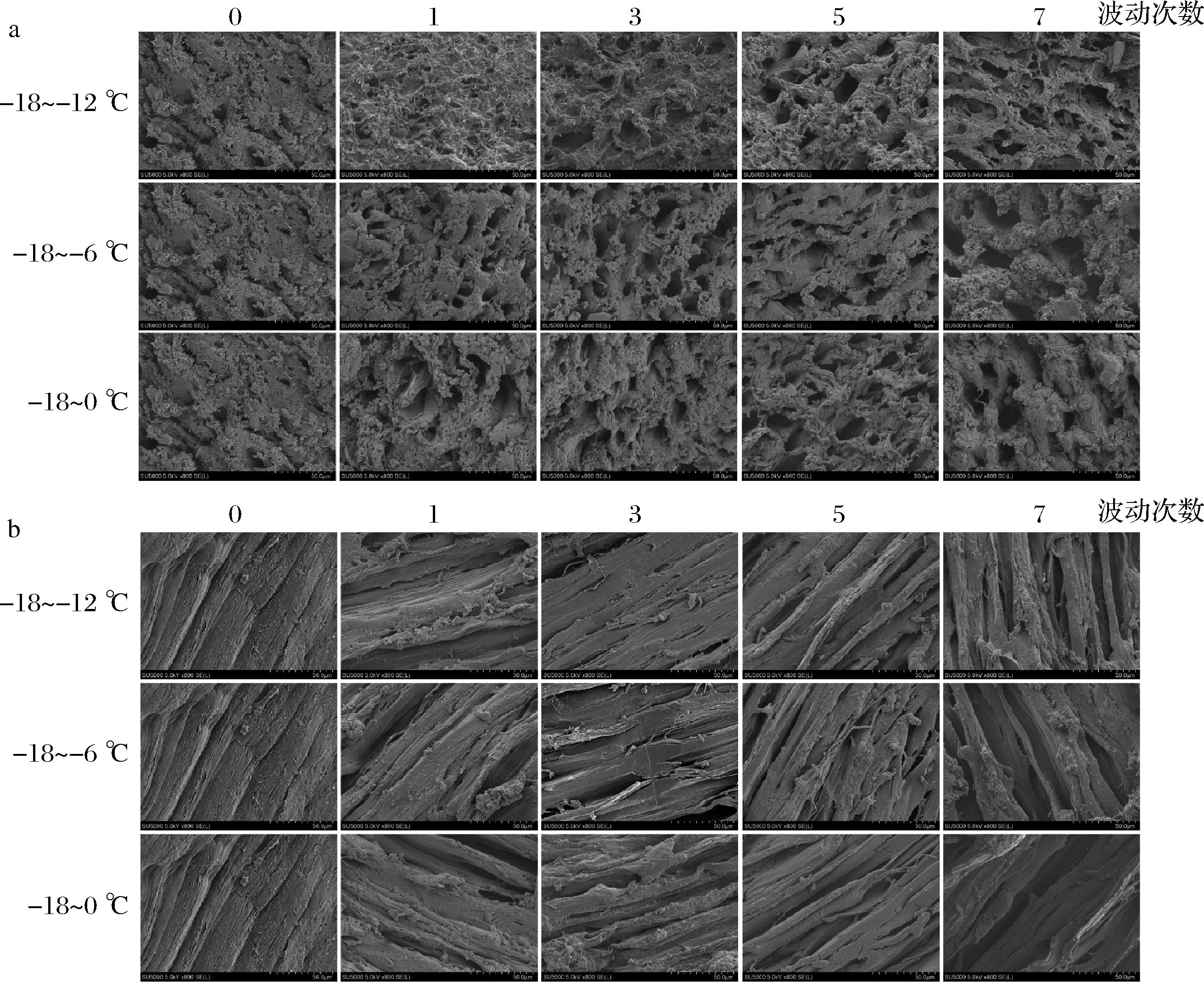
冷链物流中温度波动将导致冰晶的重结晶,当冰晶再次冻结时会以小冰晶的积聚、迁移和表面等渗形式生长,从而使得冰晶体积变大、形态变得不规则化,挤压肌肉组织甚至刺破细胞膜,造成不可逆的机械损伤,引起持水性、质构特性等食用品质的降低[16]。冷冻南美白对虾在不同温度波动下组织横截面和纵截面中冰晶形态的变化如图1所示,可看到未波动组的南美白对虾肌纤维连接紧密,部分出现组织间隙,但冰晶细小且分布均匀。随着温度波动次数和范围的增大,冰晶变得大且不规则,逐渐占据细胞外空间,肌纤维间隙增加,使得组织完整性降低。与-18~-12 ℃组相比,-18~-6 ℃和-18~0 ℃组样品中冰晶形态变化更为明显,波动1次后冰晶开始呈现出大而不规则的形态,肌纤维间存在较大间隙。尤其-18~0 ℃组波动7次后冰晶体积显著增加,部分肌纤维膜不连贯,甚至严重解体,形成大量小碎片。温度波动次数和范围越大,小冰晶积聚、迁移和表面等渗的程度越剧烈,形成的大且不规则冰晶极易导致肌肉软化和肌纤维的形变[17]。ZHANG等[18]研究发现凡纳滨对虾在-18~4 ℃波动6次后肌肉细胞外空间明显变大,甚至导致肌肉严重解体,冰晶生长也会降低结缔组织的机械强度,从而引起质构特性的下降。
2.1.2 平均横截面积及圆度分析
通过ImageJ图像分析软件计算出冷冻南美白对虾横截面中冰晶的平均横截面积和圆度,可准确地显示出冰晶的大小和形态,以更好地判断温度波动过程中冰晶的变化对南美白对虾品质的影响[19]。结果如图2所示。
3组样品中冰晶的横截面积整体上呈现增加的趋势,-18~0 ℃组波动7次横截面积由322.07 μm2增加至2 059.91 μm2,增加幅度显著高于其余两组。圆度值可用来描述冰晶的形态大小,圆度值越接近1其形态越圆且规则。3组样品的圆度值在波动前3次均未发生显著性变化(P>0.05),在波动5次后开始显著性降低,波动7次后3组样品的圆度值从0.58分别下降至0.52、0.52和0.45。这说明温度波动过程中前期冰晶的生长主要以体积增大为主,但随着波动次数和范围的增加,冰晶形态开始不规则化,从而导致波动后期对肌肉组织的损伤更为严重。
2.2 温度波动对冷冻南美白对虾持水性的影响
持水性一般指肌肉组织网络结构中保留水分的能力,是衡量水产品品质好坏的重要指标[20]。水分是南美白对虾中含量最丰富的成分,它直接影响虾类在温度波动过程中持水性、质构特性等品质变化[21]。由表1可知,-18~-12、-18~-6、-18~0 ℃组样品水分含量整体上均随波动次数的延长呈下降趋势,波动7次后-18~-12 ℃显著高于其余2组(P<0.05)。3组样品经温度波动7次后解冻损失由1.86%分别增加至3.29%、3.56%和3.86%,但-18~-12 ℃和-18~-6 ℃组没有显著性差异(P>0.05)。各组离心损失与解冻损失变化趋势一致,-18~0 ℃组离心损失一直保持最高,表明温度波动幅度越大,持水性越差。
表1 不同温度波动对冷冻南美白对虾持水性的影响
Table 1 Effect of different temperature fluctuations on water holding capacity of frozen L. vannamei
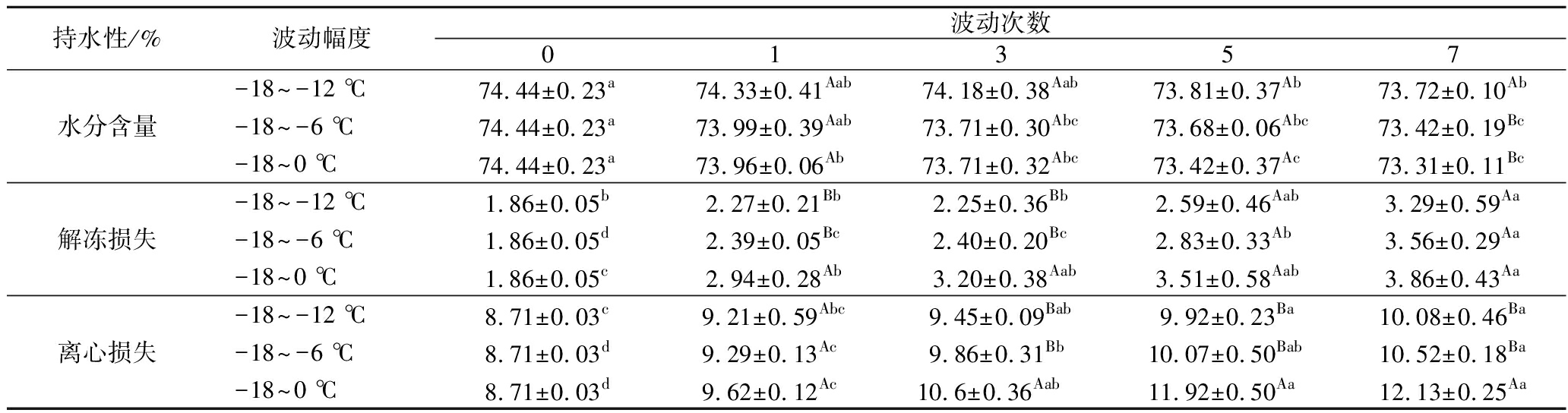
持水性/%波动幅度波动次数01357水分含量-18~-12 ℃74.44±0.23a74.33±0.41Aab74.18±0.38Aab73.81±0.37Ab73.72±0.10Ab-18~-6 ℃74.44±0.23a73.99±0.39Aab73.71±0.30Abc73.68±0.06Abc73.42±0.19Bc-18~0 ℃74.44±0.23a73.96±0.06Ab73.71±0.32Abc73.42±0.37Ac73.31±0.11Bc解冻损失-18~-12 ℃1.86±0.05b2.27±0.21Bb2.25±0.36Bb2.59±0.46Aab3.29±0.59Aa-18~-6 ℃1.86±0.05d2.39±0.05Bc2.40±0.20Bc2.83±0.33Ab3.56±0.29Aa-18~0 ℃1.86±0.05c2.94±0.28Ab3.20±0.38Aab3.51±0.58Aab3.86±0.43Aa离心损失-18~-12 ℃8.71±0.03c9.21±0.59Abc9.45±0.09Bab9.92±0.23Ba10.08±0.46Ba-18~-6 ℃8.71±0.03d9.29±0.13Ac9.86±0.31Bb10.07±0.50Bab10.52±0.18Ba-18~0 ℃8.71±0.03d9.62±0.12Ac10.6±0.36Aab11.92±0.50Aa12.13±0.25Aa
注:同行小写字母不同,表示组内差异显著(P<0.05);同列大写字母不同,表示组间差异显著(P<0.05)。
水产品肌肉组织中85%以上的水分存在于肌原纤维网络结构及其间隙中[22],由此推断汁液流失主要与肌纤维的收缩程度及完整性有关。环境中的温度波动会使得冷冻品出现冻融现象,导致冰晶发生重结晶,改变冰晶的大小和形态[16],从而挤压甚至刺破肌纤维细胞,引起解冻损失增加。3组样品的离心损失及解冻损失均发生增加与图2中冰晶面积增加、形态逐渐不规则化的趋势相一致。当温度波动次数过多时,肌肉细胞受损严重,其细胞间结合力下降,一旦在外力的作用下如离心处理时,肌肉中的水分会流出,造成较大的离心损失[23]。同时,重结晶过程中冰晶的生长会导致水分的迁移,不易流动水逐渐转变为自由水流出,使得水分含量降低。温度波动幅度越小,持水性越好,这可能是因为环境温度波动小,冰晶发生重结晶程度小,从而对肌肉组织形成的机械性损伤小,图1中可直观看出-18~0 ℃组发生冰晶重结晶现象较其余2组严重。
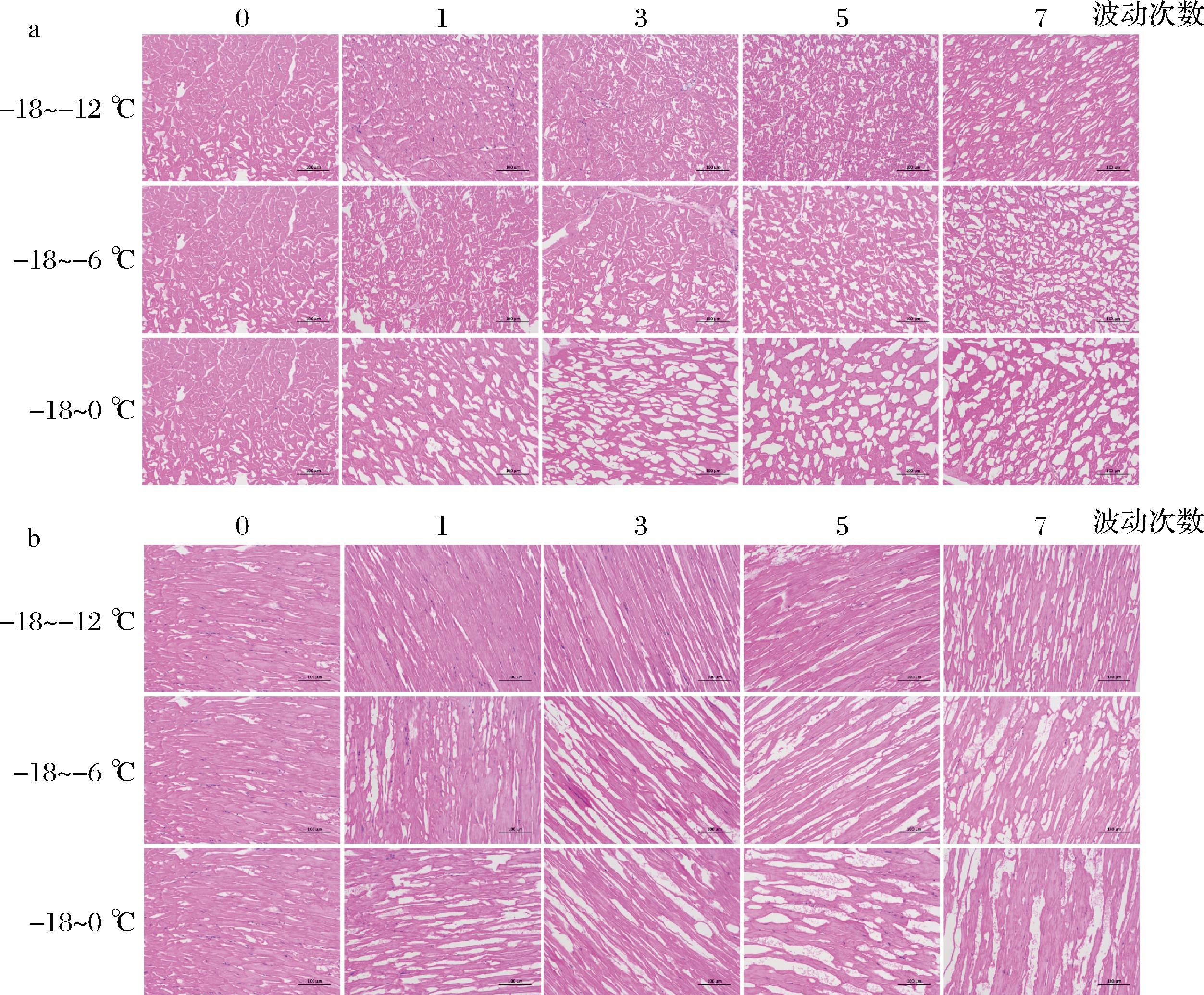
a-横截面;b-纵截面
图1 冷冻南美白对虾冰晶形态的显微图像(200×)
Fig.1 Micrographs on the ice crystals morphology of frozen L. vannamei
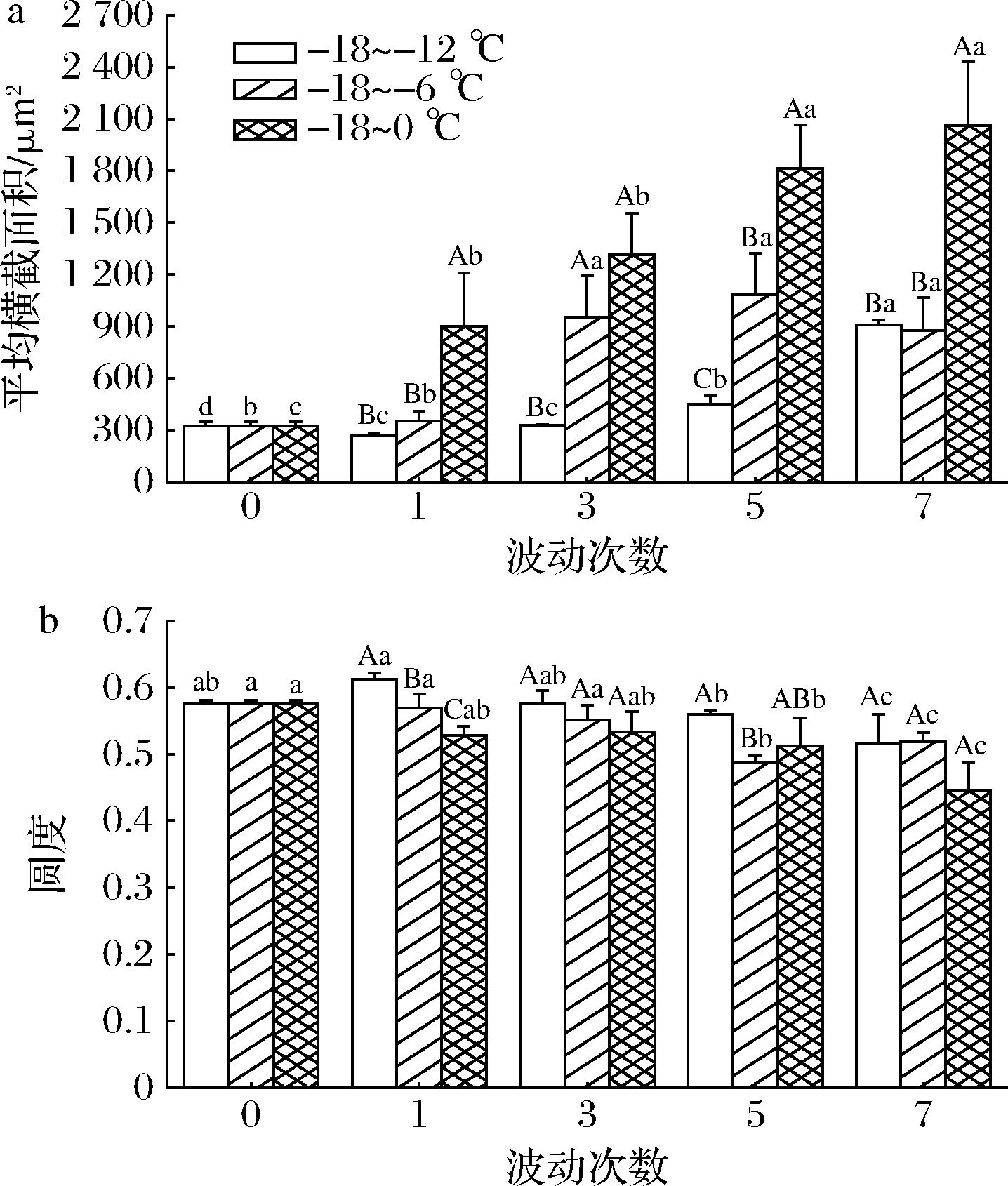
a-平均横截面积;b-圆度
图2 不同温度波动对冷冻南美白对虾冰晶 平均横截面积和圆度的影响
Fig.2 Effects of different temperature fluctuations on the average cross-sectional area and roundness of ice crystals in frozen L. vannamei
注:图中小写字母不同,表示组内差异显著(P<0.05); 大写字母不同,表示组间差异显著(P<0.05)(下同)。
2.3 温度波动对冷冻南美白对虾质构特性的影响
硬度、内聚性和咀嚼性等质构特性指标对评价水产品品质和消费者可接受度具有十分重要的意义。质构特性主要与肌肉组织结构及蛋白质网络结构有关,在温度波动过程中冰晶重结晶形成的较大冰晶会破坏肌纤维细胞的完整性;水分的迁移也可能会夺走与蛋白质表面结合的水,使得其二硫键暴露导致蛋白质变性,从而引起质构的劣变现象[24]。如图3所示,3组样品的硬度在温度波动过程中均呈现下降趋势。与-18~-12 ℃和-18~-6 ℃组样品相比,-18~0 ℃组南美白对虾的硬度显著降低(P<0.05)。波动7次后,3组样品的硬度分别减少15.54%、18.14%和19.54%。内聚性和咀嚼性均随波动次数的增加而减小,与硬度变化趋势相同,但3组之间无显著性差异(P<0.05)。ZHANG等[7]研究中空白组凡纳滨对虾的硬度随温度波动次数的增加而显著降低,且显著低于海藻糖组,其推断可能是由于温度波动期间冰晶的形成和生长导致的肌原纤维部分变性引起的聚集和水分损失。其中,-18~-12 ℃组样品的内聚性和咀嚼性在温度波动过程中均无显著性差异(P<0.05),表明小幅度的温度波动对南美白对虾内聚性和咀嚼性并无影响。
剪切力是评价水产品嫩度的一个重要指标,也可反映肌原纤维蛋白的化学结构状态[25]。由图3-b可知,在温度波动过程中3组样品剪切力不断下降,但-18~-12 ℃和-18~-6 ℃组整体无明显差异(P>0.05);而-18~0 ℃组在波动5次后开始差异显著,到第7次其剪切力达到3 501.53 g。这说明温度波动幅度越大,剪切力越小,进一步验证说明大幅度的温度波动引起的重结晶会使得冰晶大而不规则,破坏肌肉纤维组织,导致肌原纤维蛋白变性,剪切力降低。
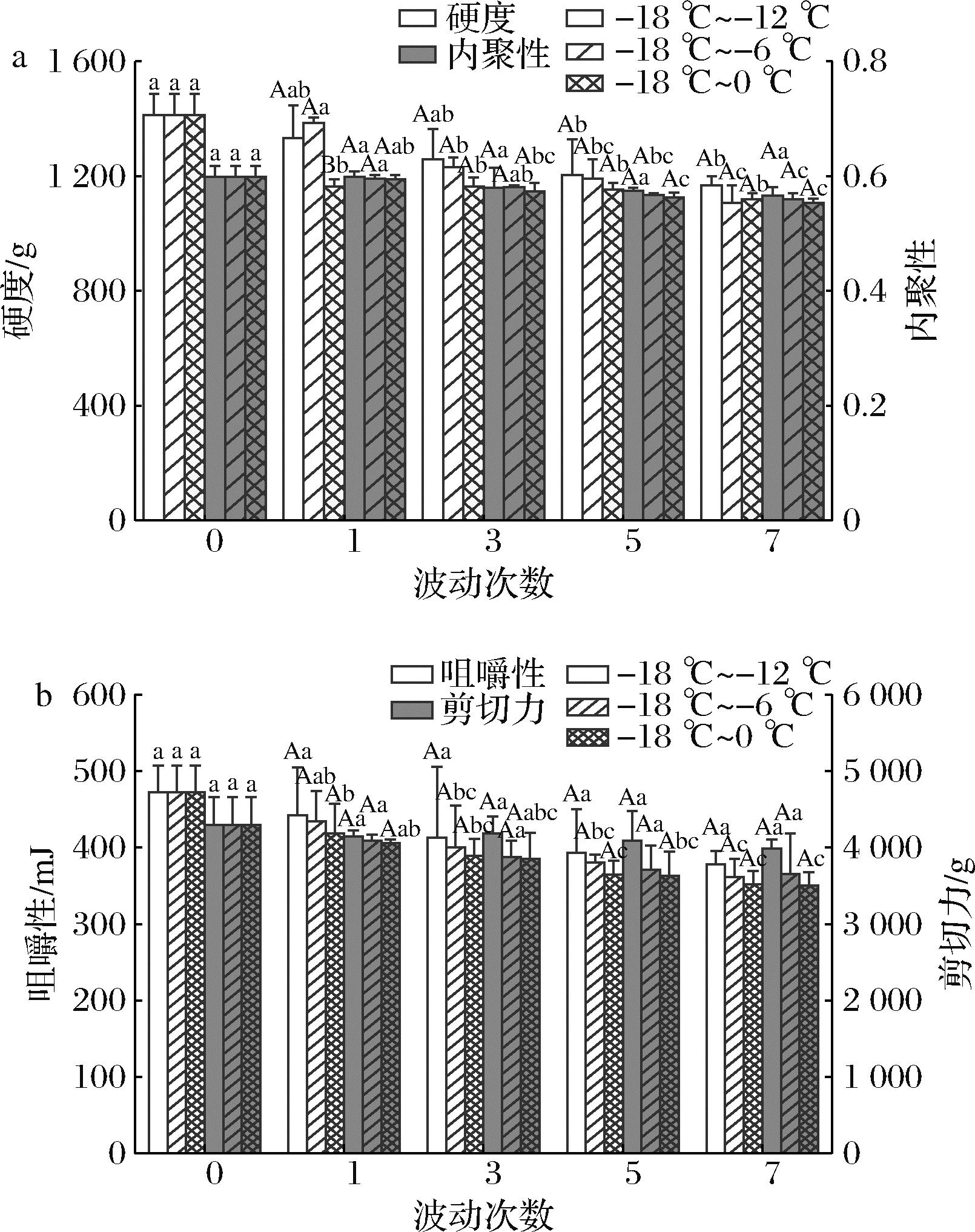
a-硬度、内聚性;b-咀嚼性、剪切力
图3 不同温度波动对冷冻南美白对虾质构特性的影响
Fig.3 Effects of different temperature fluctuations on texture characteristics of frozen L. vannamei
2.4 温度波动对冷冻南美白对虾蛋白质性质的影响
2.4.1 巯基含量
巯基是肌肉蛋白质中最敏感的官能团之一,70%以上的巯基存在于肌原纤维蛋白中,当它受到自由基攻击时极易氧化成二硫键,从而导致蛋白质变性[26]。如图4所示,各组样品的巯基含量均呈现下降趋势,这与上文提到的质构特性变化趋势相一致。波动7次时,-18~-12、-18~-6、-18~0 ℃组的巯基含量分别减少20.07%、30.44%和35.32%,-18~0 ℃组巯基含量下降程度是-18~-12 ℃和-18~-6 ℃的1.76和1.16倍,且显著低于其余2组(P<0.05)。SRIKET等[27]研究发现黑虎虾和南美白对虾巯基含量随冻融循环次数的增加而减少。这主要归因于温度波动会对肌肉细胞组织造成机械性损伤,破坏肌原纤维蛋白内部的空间结构,使得巯基暴露出来从而被氧化成二硫键,进一步氧化则会导致蛋白质的交联。温度波动幅度越大,重结晶所形成的冰晶越大,肌肉组织损伤越严重,巯基含量越低。
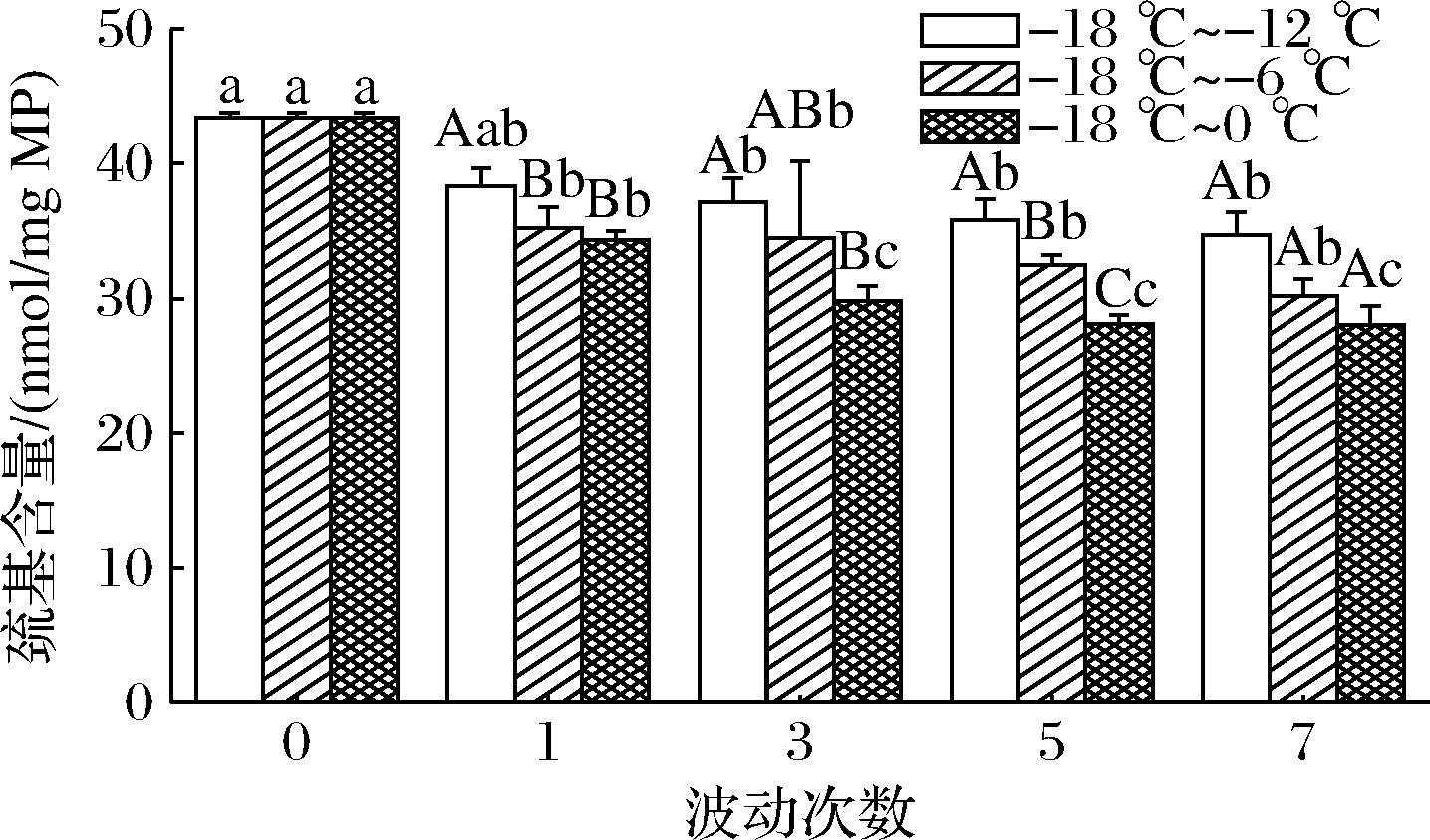
图4 不同温度波动对冷冻南美白对虾蛋白质 巯基含量的影响
Fig.4 Effects of different temperature fluctuations on sulfhydryl content of frozen L. vannamei
2.4.2 内源荧光强度
色氨酸残基主要位于蛋白质内核中,其极易受周边微环境极性的影响,一旦色氨酸暴露于极性环境时,蛋白质的内源荧光强度会降低,因此内源荧光强度常被广泛用于蛋白质三级结构的测定[28]。不同温度波动对冷冻南美白对虾的内源荧光强度均会产生影响(图5)。-18~-12、-18~-6、-18~0 ℃组的冷冻南美白对虾在温度波动过程中内源荧光强度均呈现显著下降趋势(P<0.05)。这表明蛋白质的三级结构经过温度波动后逐渐展开,内部的色氨酸残基暴露在极性环境中,因此极易与蛋白质氧化产生的过氧化氢自由基反应形成稳定的化合物,导致荧光猝灭。-18~0 ℃组的内源荧光强度下降程度最大,且显著低于其余2组。与巯基相同,较大的温度波动幅度会导致更大且不规则的冰晶,从而对肌原纤维蛋白质三级结构造成的破坏较大,一定程度上也会影响持水性及质构特性的变化。DU等[26]研究结果也证实反复冻融形成的大冰晶会加剧蛋白质的氧化程度,从而引起内源荧光强度的降低。

a--18~-12 ℃;b--18~-6 ℃;c--18~0 ℃
图5 不同温度波动对冷冻南美白对虾肌原纤维蛋白内源荧光强度的影响
Fig.5 Effect of different temperature fluctuations on fluorescence intensity of myofibril protein of frozen L. vannamei
2.4.3 SDS-PAGE图谱
图6为不同温度波动下冷冻南美白对虾肌原纤维蛋白的SDS-PAGE图谱,其中主要条带:肌球蛋白重链(约220 kDa),副肌球蛋白(约100 kDa),肌动蛋白(约48 kDa)和原肌球蛋白(约34 kDa)。随着温度波动次数的增加,4个条带均逐渐变窄变浅,但肌动蛋白条带变化不明显。-18~-12 ℃组变化最小,其肌球蛋白重链条带在波动7次后仍显示出较宽且清晰的条带;而-18~-6 ℃组和-18~0 ℃组的肌球蛋白重链条带分别在波动3次和5次后变窄变浅。这一结果与巯基含量和内源荧光强度变化情况相同,推断可能因为温度波动过程中较大冰晶的形成破坏了蛋白质内部的网络结构,蛋白质分子不稳定被氧化引起蛋白质交联、聚集,导致部分较大蛋白分子无法进入凝胶。姜晴晴等[23]发现冻融循环后肌原纤维蛋白分子间二硫键、二酪氨酸的形成引起的蛋白聚集是导致重链肌球蛋白条带变窄变浅的主要原因。这也进一步解释说明了温度波动会使得肌原纤维蛋白发生交联和聚集,温度波动次数越多、波动幅度越大,则蛋白质氧化变性程度越大。

图6 不同温度波动对冷冻南美白对虾肌原纤维蛋白SDS-PAGE的影响
Fig.6 Effects of different temperature fluctuations on SDS-PAGE pattern of myofibril protein of frozen L. vannamei
2.5 温度波动对冷冻南美白对虾组织结构的影响
南美白对虾的持水性及质构特性的变化与肌肉组织的微观结构密切相关,通过图7可对不同温度波动下其肌肉组织的形态变化进行观察,以判断出其品质的好坏。
从图7中可以看出,未波动组横截面肌肉组织平整,存在少许冰晶留下的小孔洞,肌纤维束纵向排列紧密且有序。随着波动次数和范围的增加,横截面逐渐变得凹凸不平,孔洞增大且出现部分蜂窝状小孔洞;肌纤维发生形变且间隙增加明显,尤其在波动7次后,-18~0 ℃组肌纤维间不相连,甚至出现断裂,推断这主要是冰晶生长对肌纤维造成的挤压,使得肌肉组织结构出现不可逆的变形。这与图2中冰晶的大小和形态演变一致,深入验证了温度波动过程中冰晶重结晶的程度决定其品质的好坏。QIAN等[29]研究发现肌肉组织间孔洞大小会影响肌肉组织的持水能力和汁液流失的程度,与上文解冻损失和离心损失变化趋势相一致。LI等[30]研究证明了肌肉组织完整性的减小会导致质构劣变,本文研究中硬度、内聚性、咀嚼性等结果与肌肉组织完整性变化相关。周聃等[31]认为肌纤维排列越致密,其硬度和咀嚼性越大,这与本文中硬度和咀嚼性研究结果相一致。
a-横截面;b-纵截面
图7 不同温度波动对南美白对虾肌肉组织微观结构的影响(400×)
Fig.7 Effects of different temperature fluctuations on the microstructure of muscle tissue of L. vannamei
2.6 温度波动对冷冻南美白对虾持水性及质构的影响机制
通过偏最小二乘法(partial least squares regression,PLS-R)来分析持水性、质构特性、冰晶形态及蛋白质氧化间的相关关系,结果如图8所示。
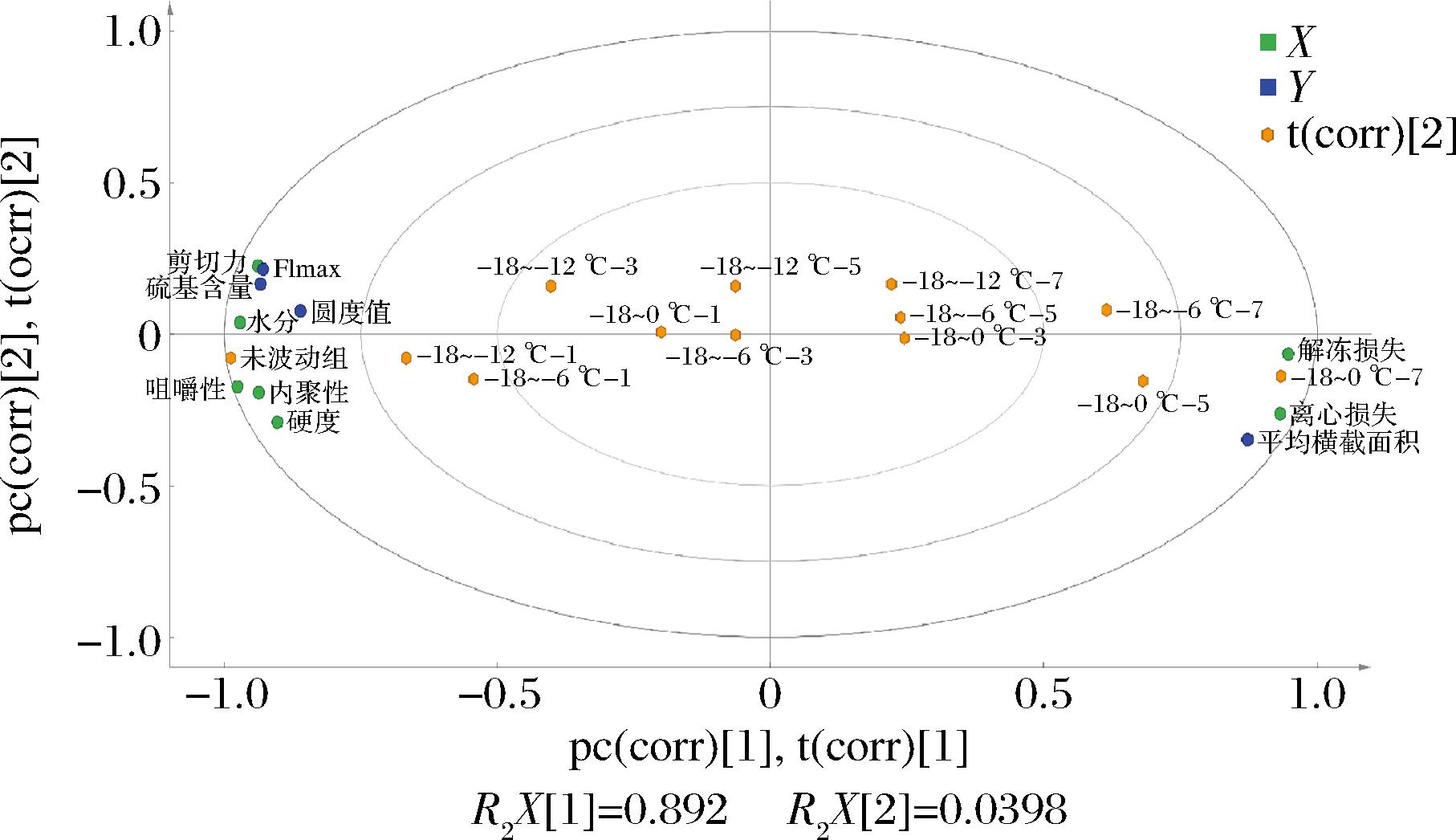
图8 偏最小二乘回归相关图
Fig.8 PLS-R correlation map
PC1和PC2方差贡献率分别为89.20%和3.98%,总贡献率达到了93.18%,说明此模型能较好地评价各组别及指标间的相关性,且各组别间距离越远则表示经过不同温度波动处理后南美白对虾间存在差异。-18~-12、-18~-6、-18~0 ℃组南美白对虾在经过温度波动后逐渐分布于右半部分,说明其分别在波动7、5和3次后各指标发生显著性变化(P<0.05),-18~0 ℃组各样品点分布较远,说明该组受温度波动影响变化程度较大,验证了上文中-18~0 ℃组持水性及质构特性较其余2组差的结论。剪切力、咀嚼性、内聚性、硬度和内源荧光强度、巯基含量、圆度值之间具有较强的相关性,这表明蛋白变性一定程度上会导致质构特性劣变,这与吴兴阁等[32]的研究结果相一致。巯基含量和内源荧光强度值的降低会引起水分含量的下降,这意味着蛋白变性后内部空间网络结构破坏,出现汁液流失现象。解冻损失、离心损失和平均横截面积间显著相关(P<0.05),且平均横截面积越大,解冻损失和离心损失越大,这说明冰晶的生长会引起持水性的下降。因此,综合前面的分析结果进一步说明在温度波动过程中冰晶形态和蛋白变性程度均会影响冷冻南美白对虾的持水性和质构特性。
3 结论
本研究结果显示,随着温度波动次数的增加,3组温度波动组南美白对虾的水分含量、硬度、内聚性、咀嚼性和剪切力逐渐减少,解冻损失、离心损失逐渐增加,表明在温度波动过程中持水性及质构特性发生劣变且随着波动范围的增加劣变程度加剧。巯基含量、最大内源荧光强度不断下降,且SDS-PAGE图显示肌原纤维蛋白部分发生氧化变性;通过微观结构更直观地发现温度波动过程中各组的冰晶和肌肉组织中的孔洞逐渐增大且不规则化。此外,通过PLS-R进一步阐明蛋白变性和冰晶的重结晶是引起持水性及质构特性下降的主要原因。因此,温度波动次数增加会加剧南美白对虾持水性和质构特性的下降,应尽量避免冷链流通过程中多次大幅度甚至极端温度波动情况的发生。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.中国渔业统计年鉴-2022[M].北京:中国农业出版社, 2022:22-24. Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Promotion Station, China Fisheries Society.2022 China Fishery Statistical Yearbook[M].Beijing:China Agricultural Publishing House, 2022:22-24.
[2] 兰洪杰. 食品冷链物流系统协同研究[D].北京:北京交通大学, 2009. LAN H J.Collaborative research on food cold chain logistics system[D].Beijing:Beijing Jiaotong University, 2009.
[3] 张金钰. 生鲜品冷链断链原因及对策分析[J].中国物流与采购, 2020(17):49-50. ZHANG J Y.Causes and countermeasures of cold chain breakage of fresh products[J].China Logistics &Purchasing, 2020(17):49-50.
[4] 韩洋. 冻藏过程中阿拉斯加鳕鱼品质变化研究[D].大连:大连工业大学, 2016. HAN Y.Study on quality change of Alaska cod during frozen storage[D].Dalian:Dalian Polytechnic University, 2016.
[5] SZYMCZAK M, KAMI SKI P, FELISIAK K, et al.Effect of constant and fluctuating temperatures during frozen storage on quality of marinated fillets from Atlantic and Baltic herrings (Clupea harengus)[J].LWT, 2020, 133:109961.
SKI P, FELISIAK K, et al.Effect of constant and fluctuating temperatures during frozen storage on quality of marinated fillets from Atlantic and Baltic herrings (Clupea harengus)[J].LWT, 2020, 133:109961.
[6] XIE J, WANG Z, WANG S, et al.Textural and quality changes of hairtail fillets (Trichiurus haumela) related with water distribution during simulated cold chain logistics[J].Food Science and Technology International, 2020, 26(4):291-299.
[7] ZHANG B, ZHAO J L, CHEN S J, et al.Influence of trehalose and alginate oligosaccharides on ice crystal growth and recrystallization in whiteleg shrimp (Litopenaeus vannamei) during frozen storage with temperature fluctuations[J].International Journal of Refrigeration, 2019, 99:176-185.
[8] 王玥科, 郑尧, 王红丽, 等.基于因子分析及多元线性回归的市售冻凡纳滨对虾品质评价[J].渔业科学进展, 2021, 42(5):176-187. WANG Y K, ZHENG Y, WANG H L, et al.Quality evaluation of commercial frozen shrimps(Litopenaeus vannamei) based on factor and regression analysis[J].Progress in Fishery Sciences, 2021, 42(5):176-187.
[9] 李学鹏. 中国对虾冷藏过程中品质评价及新鲜度指示蛋白研究[D].杭州:浙江工商大学, 2012. LI X P.Studies on quality assessment and protein indicators of freshness in Chinese shrimp(Fenneropenaeus chinensis) during refrigerated storage[D].Hangzhou:Zhejiang Gongshang University, 2012. [10] 邱泽慧, 郑尧, 王锡昌.解冻方式对养殖暗纹东方鲀持水性及质构特性的影响[J].食品科学, 2022, 43(17):56-63. QIU Z H, ZHENG Y, WANG X C.Effects of thawing methods on water-holding capacity and texture of frozen farmed Takifugu obscurus[J].Food Science, 2022, 43(17):56-63.
[11] 杨慧, 陈德经, 陈海涛, 等.大鲵肌肉分离蛋白特性[J].肉类研究, 2020, 34(7):28-32. YANG H, CHEN D J, CHEN H T, et al.Characteristics of proteins isolated from giant salamander muscle[J].Meat Research, 2020, 34(7):28-32.
[12] ZHANG L T, LI Q, JIA S L, et al.Effect of different stunning methods on antioxidant status, in vivo myofibrillar protein oxidation, and the susceptibility to oxidation of silver carp (Hypophthalmichthys molitrix) fillets during 72 h postmortem[J].Food Chemistry, 2018, 246:121-128.
[13] ZHANG M C, LI F F, DIAO X P, et al.Moisture migration, microstructure damage and protein structure changes in porcine longissimus muscle as influenced by multiple freeze-thaw cycles[J].Meat Science, 2017, 133:10-18.
[14] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227(5259):680-685.
[15] 史羽瑶, 郑尧, 王红丽, 等.抗冻蛋白对冷冻虾夷扇贝闭壳肌持水性及质构特性的影响[J].食品科学, 2022, 43(10):22-28. SHI Y Y, ZHENG Y, WANG H L, et al.Effect of antifreeze protein on water-holding capacity and texture of frozen scallop (Patinopecten yessoensis) adductor muscle[J].Food Science, 2022, 43(10):22-28.
[16] 韩昕苑, 樊震宇, 从娇娇, 等.冷冻水产品冷链流通过程中品质变化及调控技术研究进展[J].食品科学, 2021, 42(15):293-299. HAN X Y, FAN Z Y, CONG J J, et al.Progress in quality changes and control technologies of frozen aquatic products during cold chain circulation[J].Food Science, 2021, 42(15):293-299.
[17] 王红丽. 冷冻罗非鱼片品质综合评价及货架期预测模型的研究[D].上海:上海海洋大学, 2022. WANG H L.Study on comprehensive quality evaluation and shelf life prediction model of frozen tilapia fillets[D].Shanghai:Shanghai Ocean University, 2022.
[18] ZHANG B, CAO H J, WEI W Y, et al.Influence of temperature fluctuations on growth and recrystallization of ice crystals in frozen peeled shrimp (Litopenaeus vannamei) pre-soaked with carrageenan oligosaccharide and xylooligosaccharide[J].Food Chemistry, 2020, 306:125641.
[19] 李桢桢, 尹明雨, 王红丽, 等.水产品肌肉组织微观结构变化及其检测方法研究进展[J].食品科学,2023,44(9):278-286. LI Z Z, YIN M Y, WANG H L, et al.Research progress on the micro-structure changes and its detection methods for aquatic product muscle tissue[J].Food Science, 2023,44(9):278-286.
[20] DIAO Y D, CHENG X Y, WANG L S, et al.Effects of immersion freezing methods on water holding capacity, ice crystals and water migration in grass carp during frozen storage[J].International Journal of Refrigeration, 2021, 131:581-591.
[21] LI X X, LIU S C, SU W M, et al.Physical quality changes of precooked Chinese shrimp Fenneropenaeus chinensis and correlation to water distribution and mobility by low-field NMR during frozen storage[J].Journal of Food Processing and Preservation, 2017, 41(6):e13220.
[22] ESTÉVEZ M.Protein carbonyls in meat systems:A review[J].Meat Science, 2011, 89(3):259-279.
[23] 姜晴晴, 邵世奇, 陈士国, 等.冻融循环对带鱼蛋白性质及肌肉品质的影响[J].中国食品学报, 2016, 16(4):122-129. JIANG Q Q, SHAO S Q, CHEN S G, et al.Effect of freeze-thaw cycles on the characteristics of protein and the quality of muscle in hairtail(Trichiurus haumela)[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(4):122-129.
[24] 蓝蔚青, 孙雨晴, 肖蕾, 等.冻融循环对大目金枪鱼质构与蛋白质特性变化的影响[J].食品科学, 2021, 42(7):240-246. LAN W Q, SUN Y Q, XIAO L, et al.Effects of freeze-thaw cycles on texture properties and protein properties in big-eye tuna(Thunnus obesus)[J].Food Science, 2021, 42(7):240-246.
[25] 杨静. 暗纹东方鲀冷藏过程中质构劣化和蛋白降解变化研究[D].无锡:江南大学, 2017. YANG J.Study on the changes of texture deterioration and protein degradation of Fugu obscurus during cold storage[D].Wuxi:Jiangnan University, 2017.
[26] DU X, LI H J, DONG C H, et al.Effect of ice structuring protein on the microstructure and myofibrillar protein structure of mirror carp (Cyprinus carpio L.) induced by freeze-thaw processes[J].LWT, 2021, 139:110570.
[27] SRIKET P, BENJAKUL S, VISESSANGUAN W, et al.Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei) muscle[J].Food Chemistry, 2007, 104(1):113-121.
[28] BIAN C H, YU H J, YANG K, et al.Effects of single-, dual-, and multi-frequency ultrasound-assisted freezing on the muscle quality and myofibrillar protein structure in large yellow croaker (Larimichthys crocea)[J].Food Chemistry:X, 2022, 15:100362.
[29] QIAN S Y, LI X, WANG H, et al.Effects of low voltage electrostatic field thawing on the changes in physicochemical properties of myofibrillar proteins of bovine Longissimus dorsi muscle[J].Journal of Food Engineering, 2019, 261:140-149.
[30] LI H Y, WANG L, WANG J X, et al.Effects of ultrasound-assisted freezing on the quality of large yellow croaker (Pseudosciaena crocea) subjected to multiple freeze-thaw cycles[J].Food Chemistry, 2023, 404:134530.
[31] 周聃, 崔雁娜, 周冬仁, 等.不同养殖模式下加州鲈鱼肉质比较分析[J].江苏农业科学, 2021, 49(6):146-149. ZHOU D, CUI Y N, ZHOU D R, et al.Comparative analysis of meat quality of Micropterus salmoides under different breeding models[J].Jiangsu Agricultural Sciences, 2021, 49(6):146-149.
[32] 吴兴阁, 曾茂茂, 何志勇, 等.冻融对肌原纤维蛋白溶出猪肉糜体系蛋白质变性及品质的影响[J].食品与发酵工业, 2021, 47(19):101-110. WU X G, ZENG M M, HE Z Y, et al.Effect of freeze-thaw cycles on myofibril dissolution system protein denaturation and quality of minced pork[J].Food and Fermentation Industries, 2021, 47(19):101-110.