虾青素(3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素)是一种含氧类胡萝卜素,广泛存在于鲑鱼、南极磷虾等水产品中,也存在于藻类、细菌、真菌等特定微生物中。虾青素分子结构中存在的长链共轭不饱和双键、酮基等与其生理功能密切相关。虾青素不仅有抗氧化作用,而且还有很多生理活性,包括防治心血管疾病和增强免疫系统等[1]。虾青素在自然界中大部分是全反式-(all-E-)。虾青素在光照、热量、O2和酸碱的作用下,很容易被降解和破坏,这些都有利于全反式转化为顺式虾青素[2]。人体内可检测到9-顺式虾青素及13-顺式虾青素,另外在食品加工产品还发现15顺虾青素及(9顺-,13顺-)(9顺-,15顺-)(13顺-,15顺-)双顺式虾青素,其中主要的顺式异构体为9-顺式虾青素、13-顺式虾青素。YANG等[3]研究指出,9-顺和13-顺虾青素的抗氧化性和生物利用率远高于全反式虾青素。天然存在的虾青素大多是全反式构型,但是虾青素想要更好的在体内发挥其生物活性,需要将全反式构型转变为顺式结构。
目前常见的虾青素异构化方法有热异构、光异构、碘催化等,这些方法在异构化速率和其他方面都各不相同[4-5]。陈晓枫[6]通过添加碘单质进行光催化,碘日光照射生成的顺式虾青素占比高,且方法便捷、耗时短。杨成[7]使用热异构的方法比较了多种溶剂对全反式虾青素异构化的影响,结果表明二氯甲烷是促进全反式虾青素异构化的最佳溶剂,将含有虾青素的二氯甲烷溶液于35 ℃加热,50 h内反应即可达到平衡;同时杨成[7]发现采用二甲基亚砜作为溶剂时,高温(50 ℃)可以增加全反式虾青素异构化的转化率,转化率比25、35 ℃时更高。虾青素异构体的检测方法主要有HPLC,利用不同的检测器根据保留时间和光谱特征进行定性分析。LI等[8]利用HPLC法鉴定类胡萝卜素的几何异构体;杨成[7]采用半制备液相分离虾青素顺式异构体;巩风英[9]通过对合成过程中异构化进行分析,利用HPLC分析了几何异构体的占比。然而常见的全反式虾青素异构化方法中多数存在催化剂不易脱除和实验耗用时间长的缺陷[10-16]。目前关于高效大量制备顺式虾青素的研究较少,且虾青素异构化过程中有机溶剂、催化剂的选择等方面还需进一步研究。
本研究的原料为全反式虾青素,采用微波加热法对虾青素进行异构化,探究有机溶剂、催化剂、虾青素浓度、微波条件对虾青素异构化的影响,优化高顺式虾青素制备工艺。为其在功能性食品中的应用奠定理论基础。
1 材料与方法
1.1 材料与仪器
虾青素(纯度98%),陕西金康泰生物科技有限公司;虾青素标准品,阿拉丁试剂上海有限公司;丙酮、二氯甲烷、二甲基亚砜、乙酸乙酯(分析纯),天津市科密欧化学试剂有限公司;异硫氰酸甲酯、异硫氰酸己酯、二甲基三硫(分析纯)、乙腈、甲酸(色谱级),阿拉丁试剂上海有限公司。
1260型高效液相色谱仪,安捷伦科技中国有限公司;XH-MC-1微波干燥器,北京祥鹄科技发展有限公司;MC型精密电子天平(精度0.1 mg),北京赛多利斯仪器系统有限公司;Thermo Scientific Q-Exactive质谱仪,美国Thermo公司。
1.2 实验方法
1.2.1 高顺式虾青素异构体的测定
1.2.1.1 虾青素顺式异构化方法
采用微波加热法对全反式虾青素进行异构化。取5 mg全反式虾青素,溶于5 mL乙酸乙酯,配制成1.0 mg/mL的虾青素溶液,倒入三口烧瓶,置于微波干燥器中,接回流冷凝装置。微波功率600 W、微波温度65 ℃,加热5 min后取样,反应后的溶液用甲醇定容,0.22 μm有机滤膜过滤;HPLC检测分析并计算虾青素异构体的含量。
1.2.1.2 HPLC条件
HPLC条件参照杨成[7]的方法稍有修改:使用Infinity-II-126型高效液相色谱仪搭配二极管阵列检测器(diode array detector,DAD),色谱柱:UltimateXB-C18色谱柱(4.6 mm×150 mm,4 μm);柱温25 ℃,流速0.7 mL/min,进样量10 μL。梯度洗脱的条件为:流动相: A(0.1%甲酸-水溶液),B(95%甲醇与5%乙腈), 0~2.5 min,40%~20%A;2.5~7.5 min,20%~0%A;17.5~20 min,0%A;20~20.5 min,0%~40%A,20.5~26 min,40%A。
DAD波长扫描范围:220~700 nm。参照标准品的保留时间及UV/Vis光谱数据(Q值)以及文献[17-18]对不同虾青素异构体进行了初步鉴定。
1.2.1.3 顺式占比的计算
通过计算液相色谱图中顺式峰峰面积的所占比,从而得到不同顺式结构的顺式占比。
1.2.2 单因素试验
1.2.2.1 有机溶剂的确定
采用不同的有机溶剂研究虾青素在溶液中的异构化反应。选择了一些在室温下容易溶解虾青素的溶剂,如二甲基亚砜、乙酸乙酯和丙酮。取5 mg全反式虾青素溶于不同有机溶剂,配制成1.0 mg/mL的虾青素溶液,倒入三口烧瓶,置于微波干燥器中,接回流冷凝装置。微波功率600 W、微波温度65 ℃,加热5 min后取样,反应后的溶液用甲醇定容,0.22 μm有机滤膜过滤;HPLC检测分析并计算虾青素异构体的含量。考察了4种不同有机溶剂在虾青素异构化过程中的作用,并筛选出顺式比例最大的作为后续试验对象。
1.2.2.2 催化剂及添加量的确定
称取5 mg虾青素,将其溶于乙酸乙酯,配制成1.0 mg/mL的虾青素溶液,水浴超声让虾青素完全溶解。分别加入催化剂异硫氰酸甲酯、异硫氰酸己酯和二丙基三硫,每种催化剂的质量浓度分别为20、40、60、80、100 mg/mL。倒入三口烧瓶,置于微波干燥器中,接回流冷凝装置。微波功率600 W、微波温度65 ℃,加热5 min后取样,反应后的溶液用甲醇定容,0.22 μm有机滤膜过滤,HPLC检测分析并计算虾青素异构体含量。考察了3种不同类型的催化剂及其添加量对虾青素异构化的影响,筛选出其中顺式比例较高的催化剂和添加量。
1.2.2.3 虾青素溶液质量浓度的确定
称取虾青素(5、7.5、10、12.5、15 mg),将其溶于乙酸乙酯,配制成不同质量浓度(1.0、1.5、2.0、2.5、3.0 mg/mL)的虾青素溶液,水浴超声让虾青素完全溶解,添加催化剂(异硫氰酸甲酯添加量60 mg/mL)。倒入三口烧瓶,置于微波干燥器中,接回流冷凝装置。微波功率600 W、微波温度65 ℃,加热5 min后取样,反应后的溶液用甲醇定容,0.22 μm有机滤膜过滤,HPLC检测分析并计算虾青素异构体含量。研究虾青素溶液质量浓度对异构化的作用效果,选择顺式占比最高的虾青素溶液质量浓度进行后续实验。
1.2.2.4 微波加热条件的确定
称取7.5 mg虾青素,将其溶于乙酸乙酯,配制成1.5 mg/mL的虾青素溶液,水浴超声让虾青素完全溶解,添加催化剂(异硫氰酸甲酯,60 mg/mL)。微波时间5~25 min、微波功率300~700 W、微波温度55~75 ℃。反应后的溶液用甲醇定容,0.22 μm有机滤膜过滤,HPLC检测分析并计算虾青素异构体含量。确定最优的微波加热条件。
1.2.3 响应面试验
以单因素试验结果为依据,自变量为A、B、C、D,分别为温度、功率、时间及虾青素溶液质量浓度,因变量为Y:虾青素顺式占比。设计实验方案,表1为因素及水平编码。
表1 响应面试验因素和水平
Table 1 Experimental factors and level for response surfaces
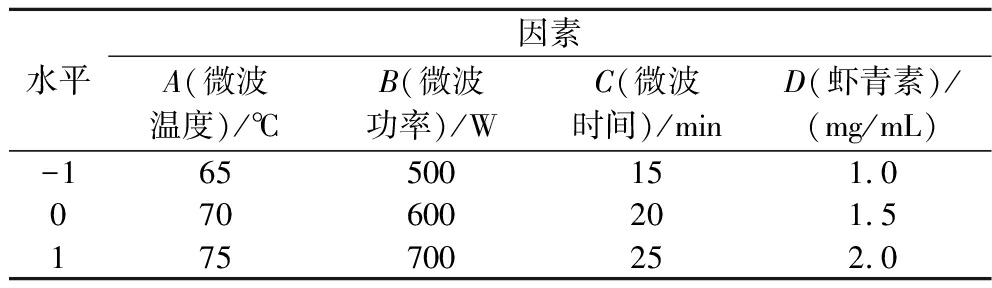
水平因素A(微波温度)/℃B(微波功率)/WC(微波时间)/minD(虾青素)/(mg/mL)-165500151.0070600201.5175700252.0
1.3 数据统计与分析
所有实验至少进行3次平行实验。曲线图使用Origin对数据进行绘制,采用Design-Expert进行响应面分析。
1.4 顺式虾青素的构型鉴定
异构化后的产物采用超高效液相-质谱(ultra-HPLC-mass spectrometry, UPLC-MS)联用技术进一步鉴定并确定了顺式虾青素的结构组成[19]。质谱条件:离子源HESI,毛细管263 ℃,气化温度425 ℃,源电压3.5 kV,扫描范围:100~1 000 m/z。通过LC-MS得到不同时间峰对应的质谱图,再与虾青素的分子质量进行比对分析,判断新生成的物质是否为虾青素异构体。
2 结果与分析
2.1 高效液相色谱法鉴定虾青素结构
高效液相色谱法能较好地将样品中天然色素分离出来,它具有分离效果好,检测灵敏度和分离效率高的优点,目前已成为类胡萝卜素分析应用非常活跃的方法之一,是虾青素定性定量检测最重要的技术[20-21]。从图1-a可以看出,全反式虾青素检测出现了一个色谱峰,且在此液相条件下的保留时间为17.67 min。
微波加热将全反式虾青素异构化形成高顺式虾青素。经微波加热后的液相色谱图表明,检测获得了3个色谱峰,从3个色谱峰和各色谱峰的UV-Vis光谱中得知,1号色谱峰保留时间为17.35 min与全反式虾青素的保留时间基本一致,由此可以推断峰1为全反式虾青素。图1-b色谱峰上峰1的保留时间(17.35 min)、峰2的保留时间(19.45 min)、峰3的保留时间(19.62 min)对应色谱峰的UV-Vis光谱与全反式虾青素的UV-Vis光谱相似,可确定图1中峰2和峰3是2个顺式异构色谱峰。
由图2可知,不同峰位在某一波长区间吸光度的变化情况,其中全反式虾青素特征吸收峰出现在470 nm处,这一波长为虾青素的最大吸收波长。另一些异构体除了主要的吸收峰以外,还同时会在300~400 nm出现特征顺式峰。YUAN等[22]认为全反式虾青素异构化生成顺式异构体后,紫外吸收波长最大值发生位移,光谱近紫外区有一个新的吸收最大值出现,体现在色谱图中即为“蓝移”。如图2所示,其中峰2的紫外最大吸收波长为470 nm,发生了2~10 nm的蓝移,被认定为9-顺式异构体,与YUAN等[22]的实验结果吻合。同时,峰3不同的地方在于370 nm以及468 nm时出现2个最大吸收峰,被认定为13-顺式虾青素异构体,与ZHAO等[23]的实验结果一致,表明该试验可以成功鉴定虾青素的异构体。将顺式峰的吸光度和主峰的吸光度之比定义为Q值,并将Q值进行对比来判断虾青素的几何构型[24]。如表2所示,图1中2、3号峰所对应的Q值分别为0.39和0.95。Q值越高,C链中间出现异构的可能性也就越大[25]。可以确定热异构化后虾青素多个不同的异构体:其中峰1是全反式虾青素,峰2是9-顺式虾青素,峰3是13-顺式虾青素。由于使用了不同的流动相及色谱条件,该研究中Q值及UV-Vis光谱与文献中所报道的资料略有不同。
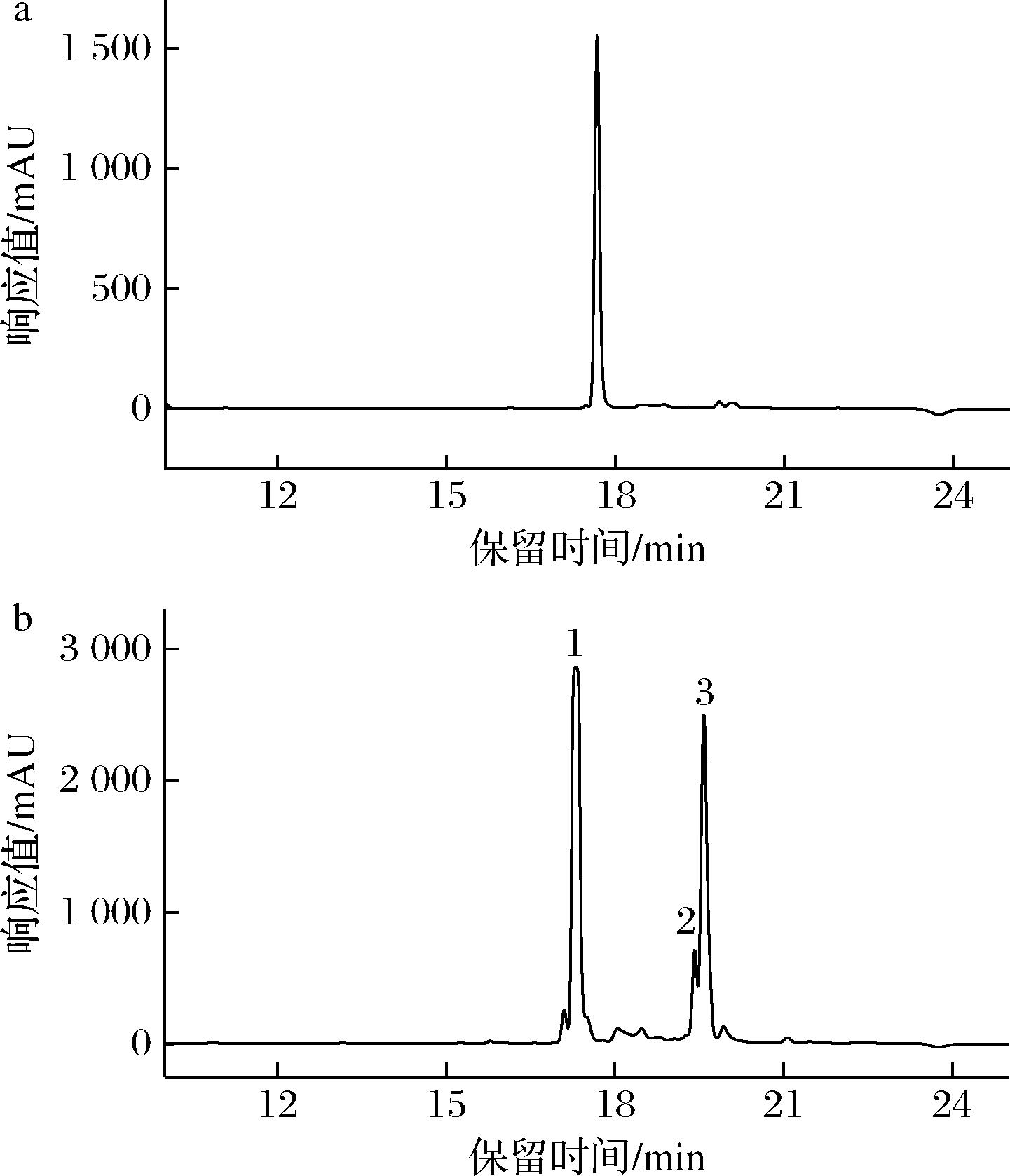
a-全反式虾青素标准品;b-虾青素异构化后
图1 全反式虾青素标准品与虾青素异构化后的 HPLC图
Fig.1 HPLC pattern before and after the isomerization of all-trans-astaxanthin
表2 虾青素异构体的初步鉴定
Table 2 Initial identification of the astaxanthin isomers
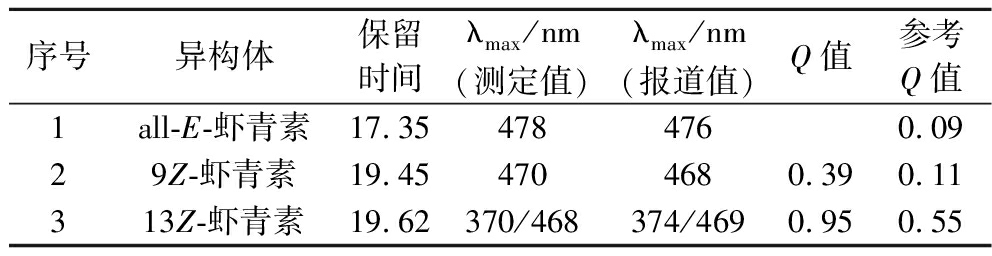
序号异构体保留时间λmax/nm(测定值)λmax/nm(报道值)Q值参考Q值1all-E-虾青素17.354784760.0929Z-虾青素19.454704680.390.11313Z-虾青素19.62370/468374/4690.950.55

a-全反式虾青素;b-9-顺式虾青素;c-13-顺式虾青素
图2 虾青素异构体的UV-Vis光谱图
Fig.2 UV-Vis spectra of astaxanthin isomers
2.2 单因素试验
2.2.1 不同有机溶剂对虾青素顺式占比的影响
不同的反应条件会影响虾青素异构化产物的种类和产率,已有研究报道不同溶剂加热时全反式虾青素异构体的异构化效果,并发现高温有利于全反式虾青异构体的形成,溶剂效应也会影响不同顺式异构体的形成和积累[26]。本研究将全反式虾青素分别溶于丙酮,乙酸乙酯和二甲基亚砜中加热,如图3所示,在65 ℃高温加热条件下,不同溶剂中虾青素转化效率顺序为乙酸乙酯(22.6%)>二甲基亚砜(20.8%)>丙酮(14%)。全反式虾青素溶于乙酸乙酯,2种顺式虾青素异构体比例存在显著性差异,所得的9-顺式虾青素的占比为4.62%,13-顺式虾青素占比为17.98%。
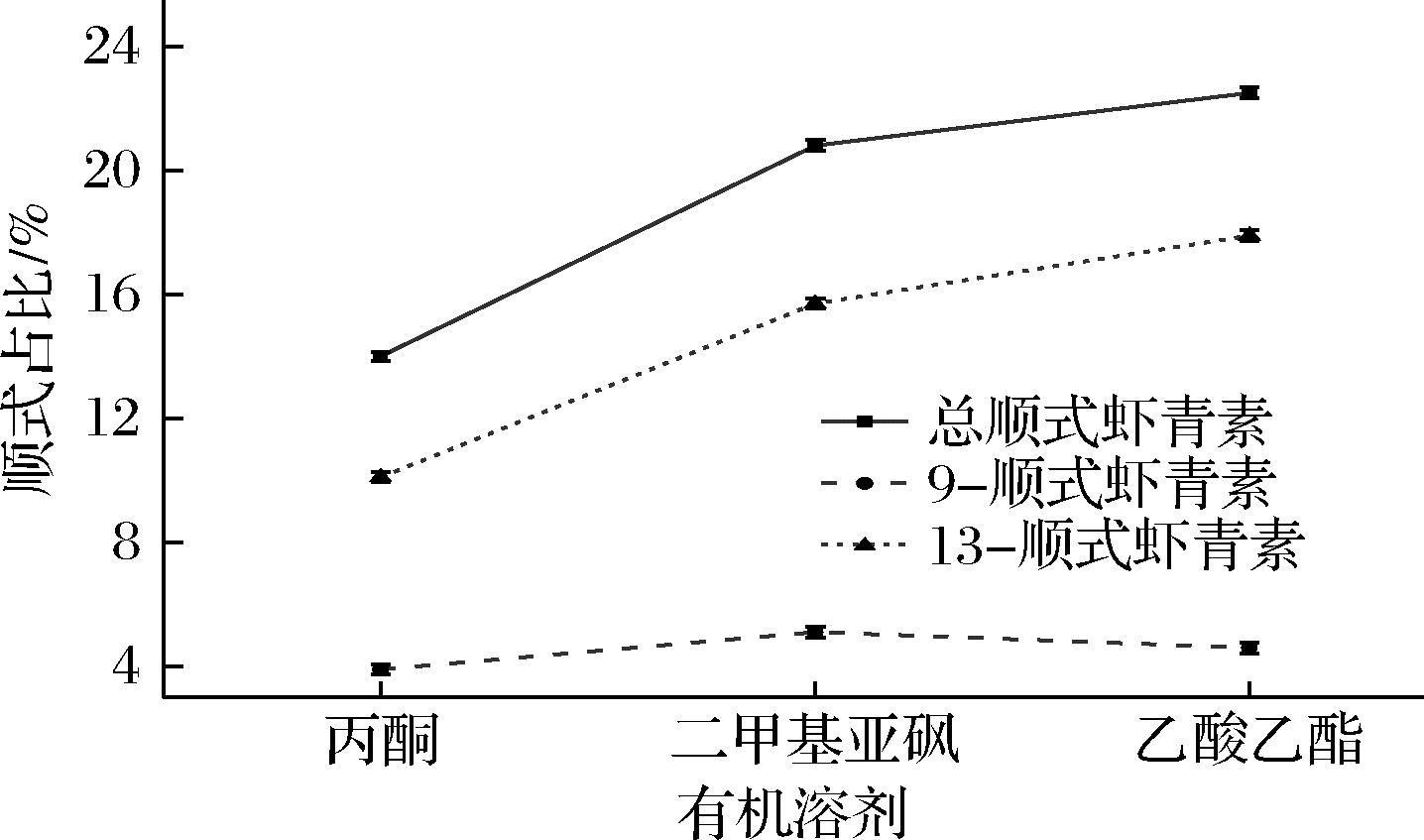
图3 不同有机溶剂对虾青素顺式占比的影响
Fig.3 Effects of different organic solvent on the cis-ratio of astaxanthin
2.2.2 催化剂对虾青素顺式占比的影响
当催化剂加入全反式虾青素溶液中微波加热处理后,虾青素的顺式异构化增强,其转化程度因催化剂不同而不同[27]。本文研究3种催化剂(二丙基三硫、异硫氰酸甲酯、异硫氰酸己酯)及其添加量对热处理后的虾青素顺式异构化的影响。由图4可知,添加60 mg/mL异硫氰酸甲酯催化效率最高,总顺式占比达到25.99%,其中9-顺式虾青素占8.39%,13-顺式虾青素占17.59%。随着催化剂质量浓度的增加,反应加速,进而促进了虾青素的顺式异构化反应,虾青素异构体的顺式比例有上升趋势,顺式异构体在催化剂质量浓度为60 mg/mL的时候趋于稳定。当质量浓度大于60 mg/mL时,加大催化剂质量浓度会影响虾青素异构化率。故选用60 mg/mL的异硫氰酸甲酯进行后续实验。
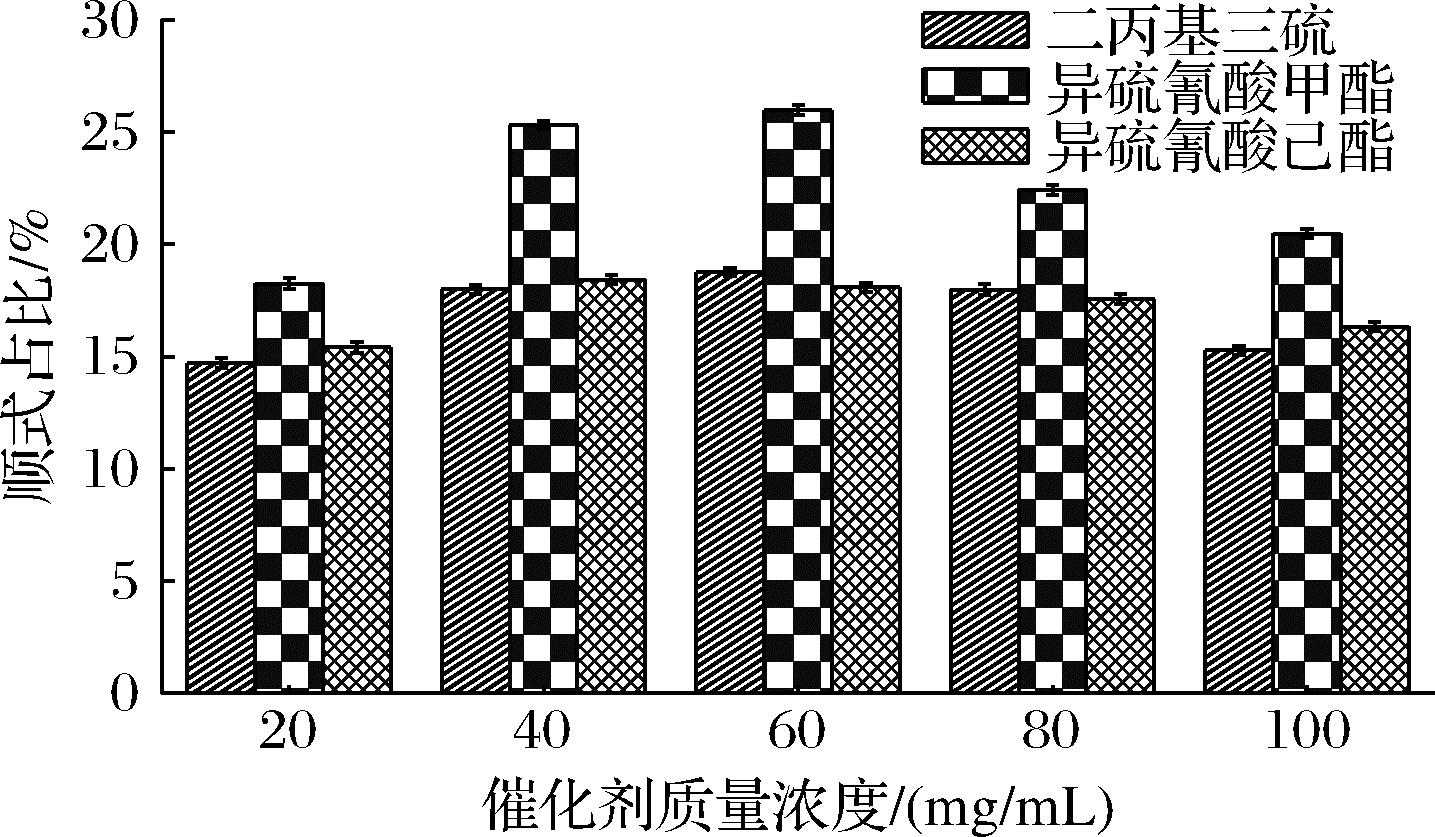
图4 不同催化剂对虾青素顺式占比的影响
Fig.4 Effects of different catalyst on the cis-ratio of astaxanthin
2.2.3 质量浓度对虾青素顺式占比的影响
图5为不同质量浓度的虾青素溶液,以乙酸乙酯为介质65 ℃下加热得到的顺式异构体占比。虾青素顺式比例随虾青素溶液质量浓度升高呈现先升高后降低的变化趋势。这是因为乙酸乙酯的处理能力有限,虾青素溶液质量浓度过高时会出现挂壁的现象,造成虾青素会有一部分损失,同时对异构化后的顺式占比产生影响。提高虾青素溶液质量浓度,可以明显提高顺式虾青素的生成效率进而促进虾青素异构化,虾青素溶液质量浓度提高到1.5 mg/mL时,虾青素的顺式异构体比例较高,异构化效果好。故选取1.5 mg/mL虾青素溶液进行后续实验。
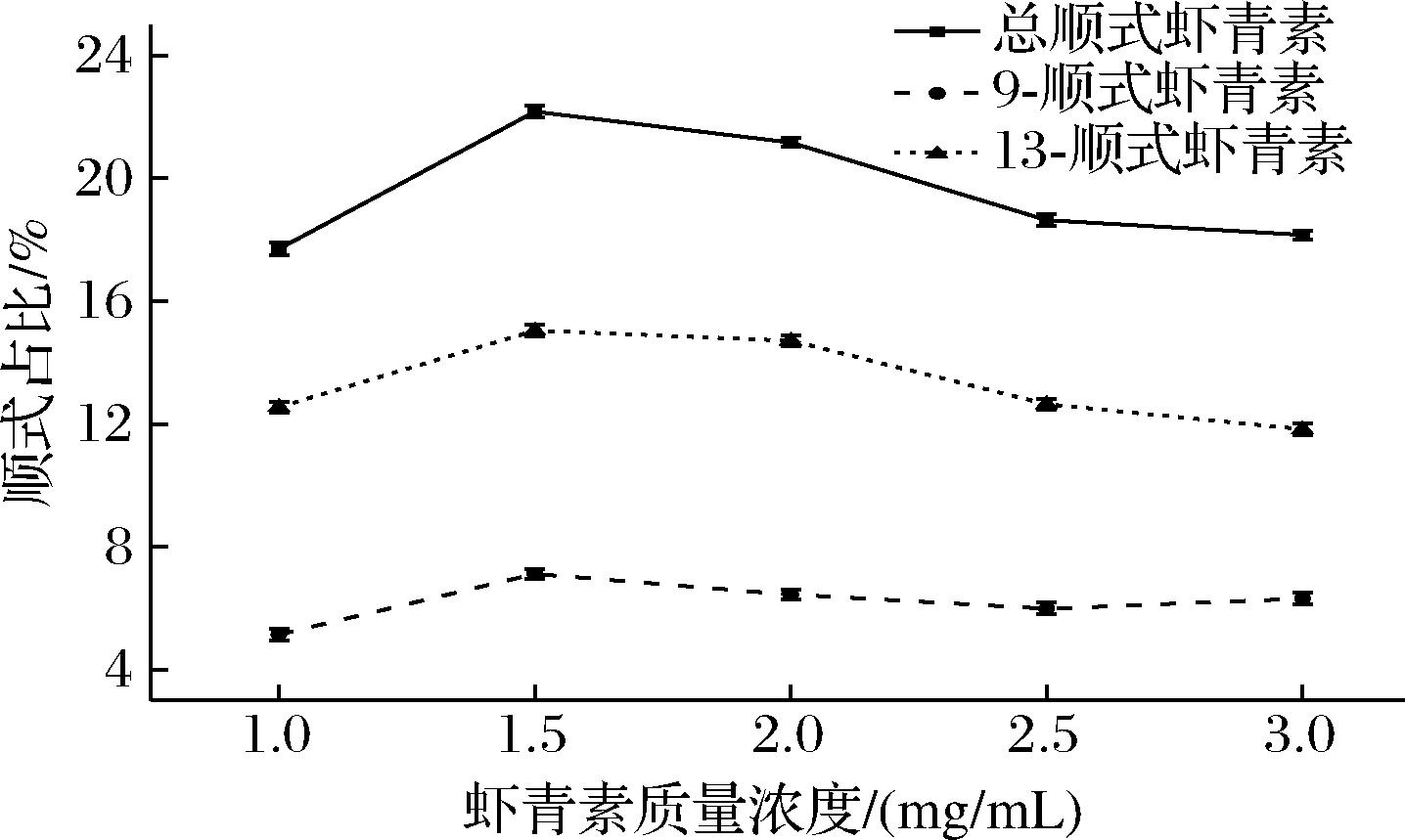
图5 不同虾青素溶液质量浓度对虾青素顺式占比的影响
Fig.5 Effect of different astaxanthin solution mass concentration on the cis-ratio of astaxanthin
2.2.4 微波时间对虾青素顺式占比的影响
虾青素异构化作用随热处理时间的延长而增强。不同顺式异构体在热处理时异构化程度不同,顺序上也有所不同[28-29]。由图6可知,微波加热20 min时,虾青素总顺式占比最高为43.48%,9-顺式虾青素含量增加到13.10%,13-顺式虾青素30.38%。在5~20 min,虾青素顺式比例随着时间延长呈上升趋势,而在加热时间大于20 min以上的时候,虾青素顺式占比呈下降趋势。加热时间的延长可以对虾青素的异构化起到促进作用。但是,在加热时间过长的情况下,其所形成的顺式异构体也会发生降解,从而造成虾青素总含量降低,虾青素顺式转化率降低。故选取微波时间20 min进行后续实验。
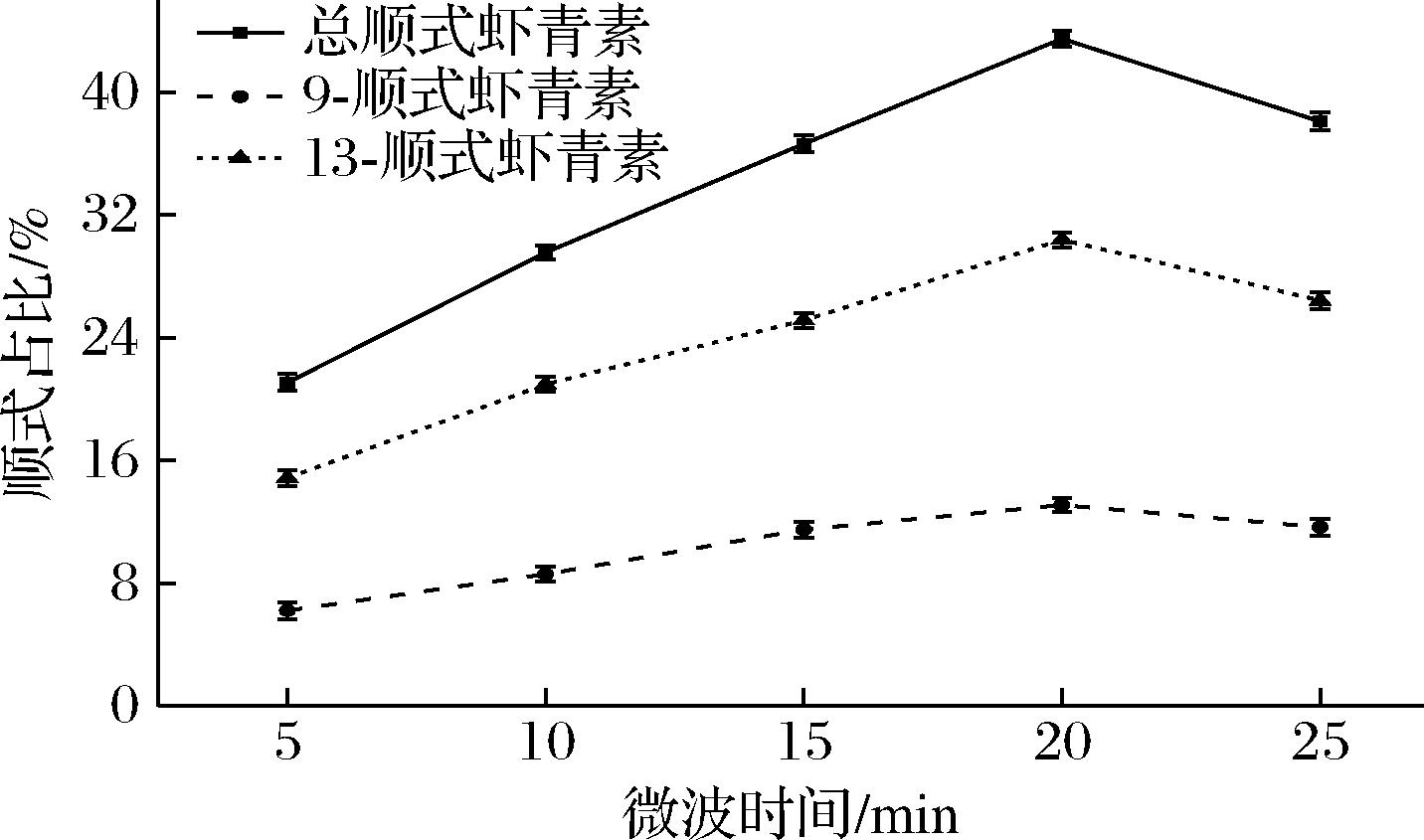
图6 不同微波时间对虾青素顺式占比的影响
Fig.6 Effects of different microwave time on cis-ration of astaxanthin
2.2.5 微波功率对虾青素顺式占比的影响
微波功率对虾青素的异构化程度具有一定的影响。由图7可知,微波功率为600 W时,虾青素总顺式占比最高为47.83%。在300~600 W,随着微波功率的增大,虾青素总顺式占比逐渐增大,其中9-顺式虾青素比例变化较小,而13-顺式虾青素的占比则持续增加。当超过600 W时,虾青素顺式占比不断下降。这是由于功率不断提升,对于虾青素异构化有促进作用,但功率过大会导致顺式虾青素的占比降低,虾青素异构化速率小于降解速率,从而对虾青素的顺式占比造成了影响。故选取600 W的功率进行实验。
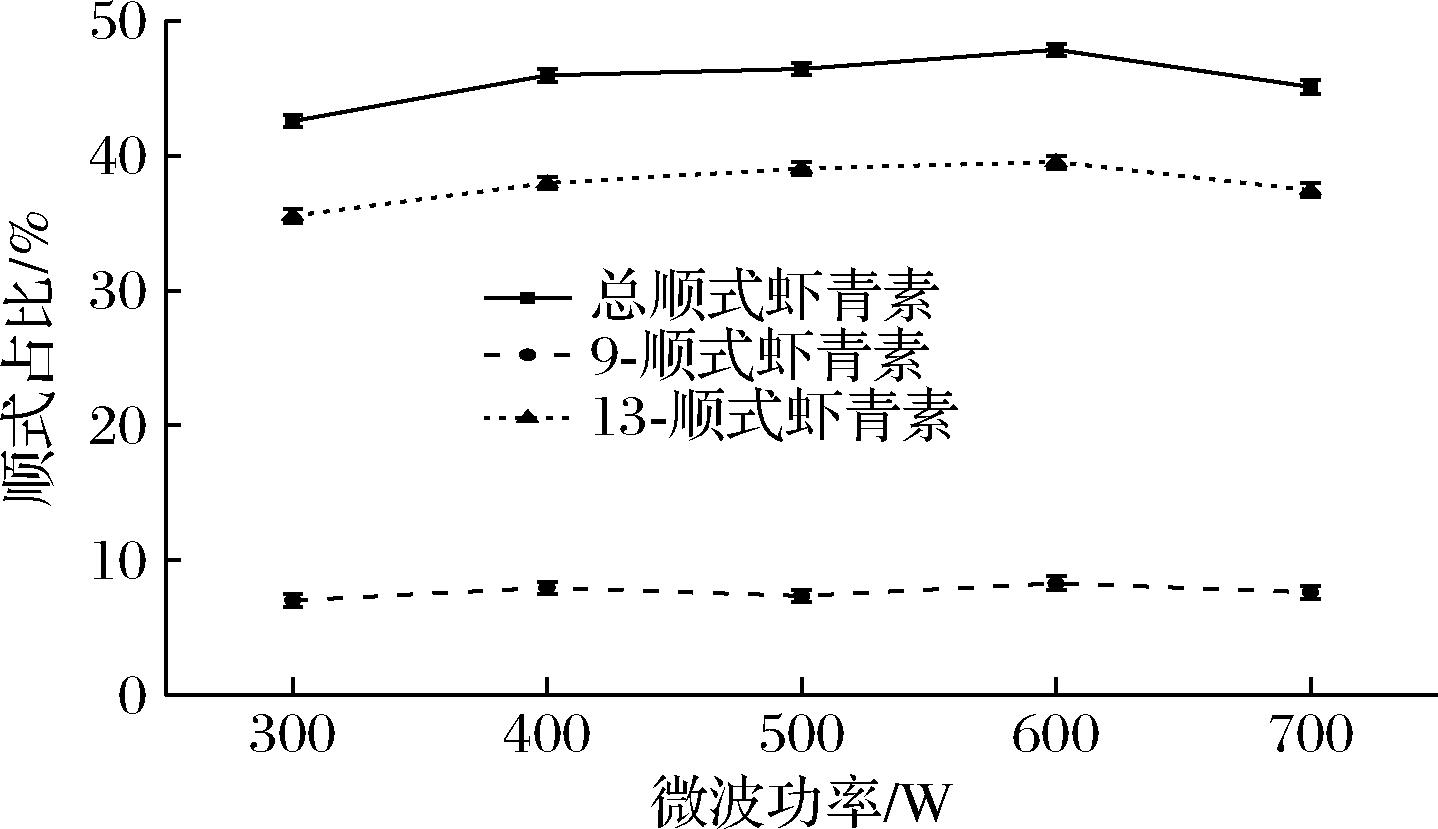
图7 不同微波功率对虾青素顺式占比的影响
Fig.7 Effects of different microwave power on cis-ration of astaxanthin
2.2.6 微波温度对虾青素顺式占比的影响
虾青素的异构化程度也取决于微波加热的温度[30]。由图8可得出,微波温度为70 ℃时,虾青素总顺式占比最高48.73%。温度较低时,9-顺式和13-顺式虾青素的比例上升速度比较缓慢;随微波温度的不断上升,9-顺式和13-顺式虾青素含量比例均呈上升趋势;但当微波温度超过70 ℃时,虾青素总顺式占比下降至43.88%。这是因为微波加热温度提高促进顺式异构体生成,且该温度范围内顺式异构体的降解速率相较缓慢;当温度过高时,全反式虾青素很快发生异构化反应,但是会因为顺式异构体的热不稳定降解[31],造成虾青素的损失,影响了虾青素顺式占比,故选取70 ℃的微波温度进行后续实验。

图8 不同微波温度对虾青素顺式占比的影响
Fig.8 Effects of different microwave temperature on cis-ration of astaxanthin
2.3 响应面试验结果分析
根据单因素试验,选择微波温度(A)、微波功率(B)、微波时间(C)、虾青素浓度(D),以顺式占比(Y)为响应值。按照Box-Behnken的设计试验,进行四因素三水平的试验,表3为试验设计和结果。
表3 Box-Behnken实验设计及结果
Table 3 Box-Behnken test design and results
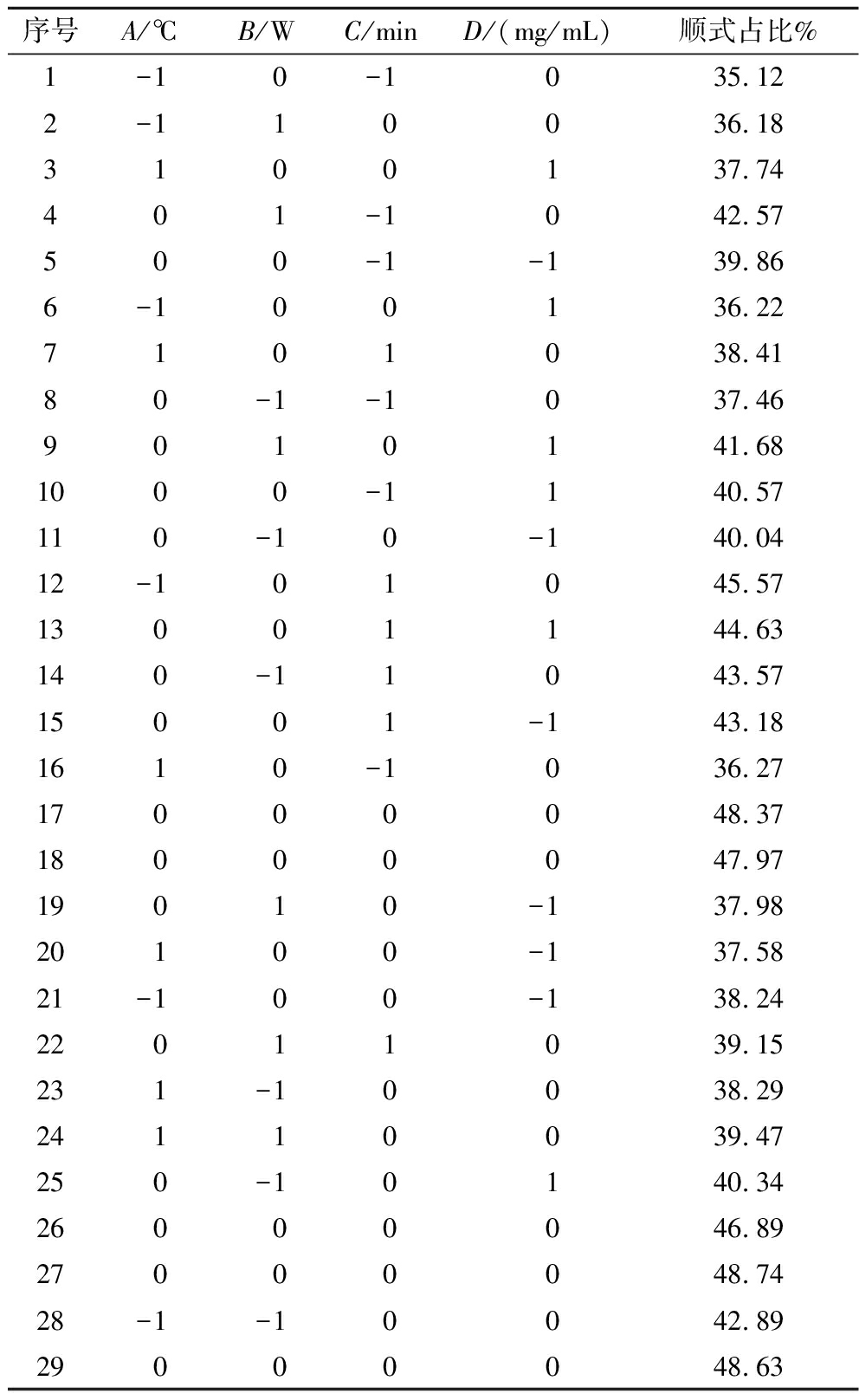
序号A/℃B/WC/minD/(mg/mL)顺式占比%1-1 0-1 035.122-110036.183100137.74401-1042.57500-1-139.866-100136.227101038.4180-1-1037.469010141.681000-1140.57110-10-140.0412-101045.5713001144.63140-11043.5715001-143.181610-1036.2717000048.3718000047.9719010-137.9820100-137.5821-100-138.2422011039.15231-10038.2924110039.47250-10140.3426000046.8927000048.7428-1-10042.8929000048.63
采用Design-Expert数据分析软件进行拟合分析,根据表4建立四因素三水平多元回归拟合,得到二次回归模型方程为:Y=48.49-0.54A-0.46B+1.89C+0.36D+1.97AB-2.08AC+0.55AD-2.38BC+0.85BD+0.19CD-6.21A2-4B2-3.16C2-4.2D2。根据表4可知模型F=10.81,P<0.000 1。说明所建立的模型达到显著水平(P<0.000 1),失拟性检验差异不显著,R2=0.915 3,表明所得模型的拟合程度较好,可用于预测分析。从各个因子F值大小可以看出,各个因子对虾青素顺式比例影响程度排序依次是:C(微波时间)>A(微波温度)>B(微波功率)>D(虾青素浓度)。微波温度和微波功率(AB),微波温度和微波时间(AC),微波功率和微波时间(BC)存在一定的交互作用,对虾青素顺式占比率具有显著影响。
表4 回归方程系数及显著性检验
Table 4 Regression equation coefficients and significance test
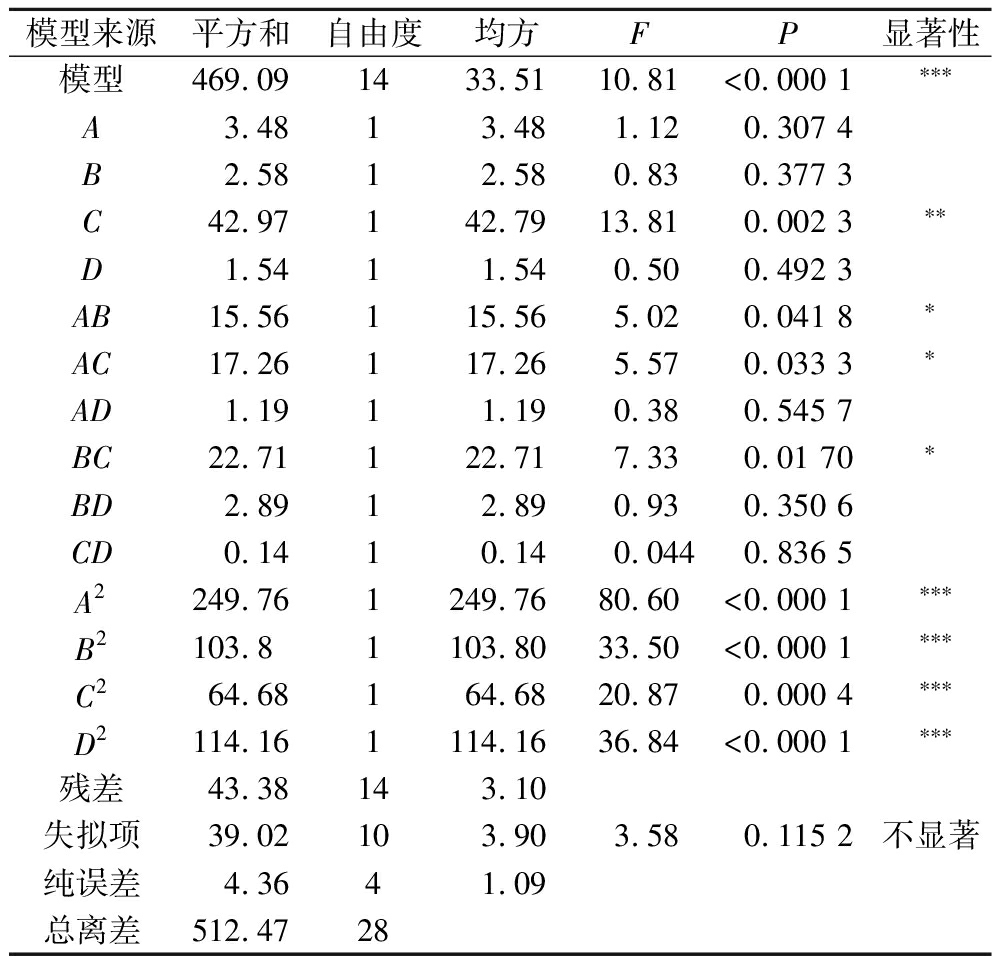
模型来源平方和自由度均方FP显著性模型469.091433.5110.81<0.000 1∗∗∗A3.4813.481.120.307 4B2.5812.580.830.377 3C42.97142.7913.810.002 3∗∗D1.5411.540.500.492 3AB15.56115.565.020.041 8∗AC17.26117.265.570.033 3∗AD1.1911.190.380.545 7BC22.71122.717.330.01 70∗BD2.8912.890.930.350 6CD0.1410.140.0440.836 5A2249.761249.7680.60<0.000 1∗∗∗B2103.81103.8033.50<0.000 1∗∗∗C264.68164.6820.870.000 4∗∗∗D2114.161114.1636.84<0.000 1∗∗∗残差43.38143.10失拟项39.02103.903.580.115 2不显著纯误差4.3641.09总离差512.4728
根据回归方程得出响应面图,分析任意两因素交互作用对虾青素顺式占比的影响。观察响应面图,因素的改变对响应值越明显,响应曲面坡度越弯。如图9所示,任意两因素对虾青素顺式占比的影响大小:微波功率和微波时间(BC)>微波温度和微波时间(AC)>微波温度和微波功率(AB)。在等高线图中,交互作用的强度能够从等高线图的形状反映出来,等高线图形越椭圆,响应面坡度愈陡,表示交互作用对于顺式占比有显著影响。
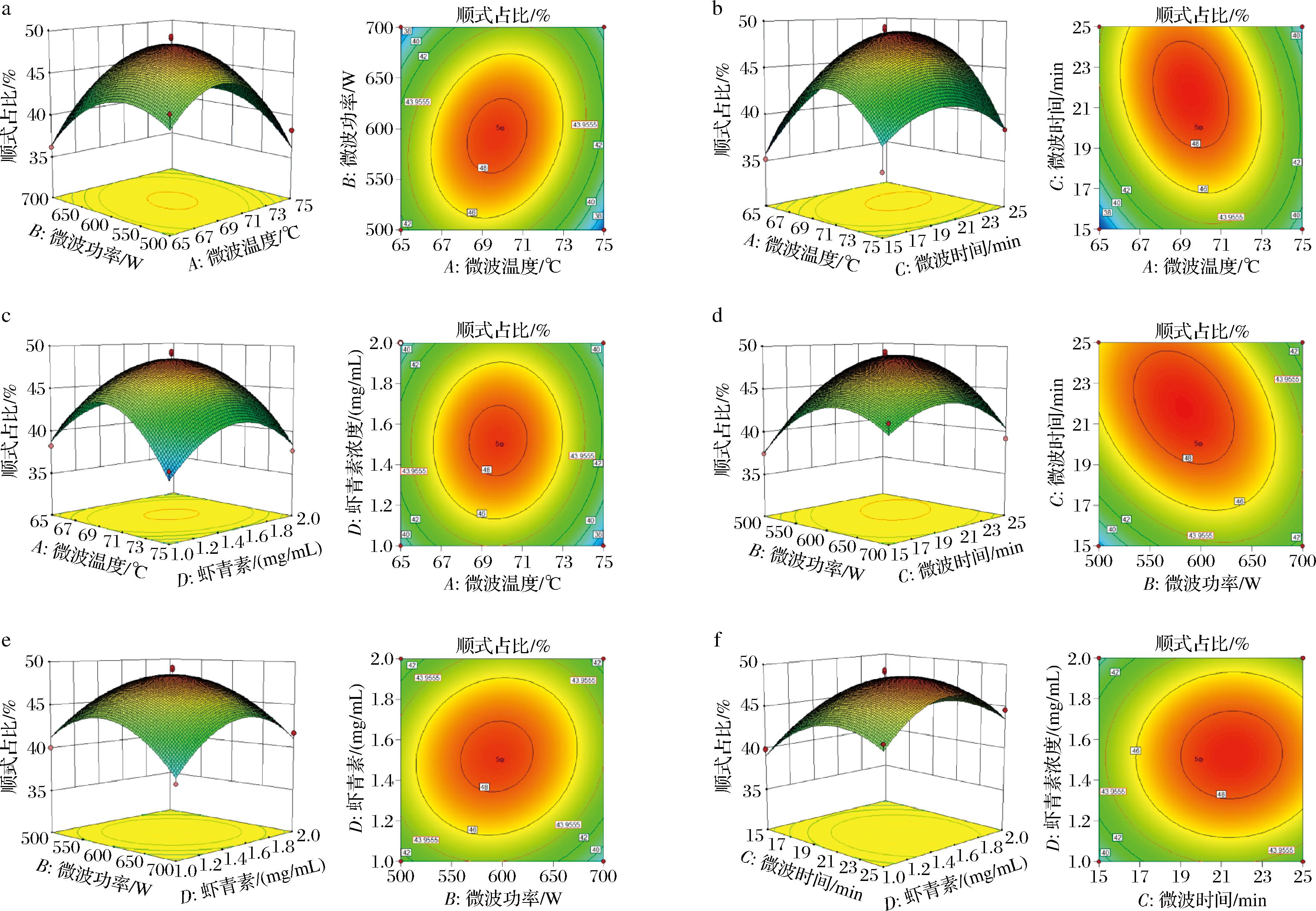
a-微波温度、微波功率交互作用;b-微波温度、微波时间交互作用;c-微波温度、虾青素浓度交互作用; d-微波功率、微波时间交互作用;e-微波功率、虾青素浓度交互作用;f-微波时间、虾青素浓度交互作用
图9 3D响应面图和等高线图
Fig.9 3D response surface maps and contour plots
2.4 最佳工艺条件与验证性实验
通过拟合模型方程,得到最佳条件:微波温度69.24 ℃,微波功率578 W,微波时间22.16 min,虾青素质量浓度1.51 mg/mL,虾青素顺式占比为48.99%。根据实际条件,对最佳条件进行调整:微波温度为69 ℃,微波功率为600 W,微波时间为22 min,虾青素的质量浓度为1.5 mg/mL,在此条件下进行3次平行验证实验,取其平均值,虾青素总顺式占比为49.34%、9-顺式虾青素占比为40.48%、13-顺式虾青素占比为8.86%,与模型无显著差异。
2.5 虾青素异构体结构鉴定
以上实验,全反式虾青素经过热异构化反应生成新物质,为了进一步证实产生的新物质是顺式构型虾青素,使用UPLC-MS检测,鉴定虾青素标准品样品,如图10所示。
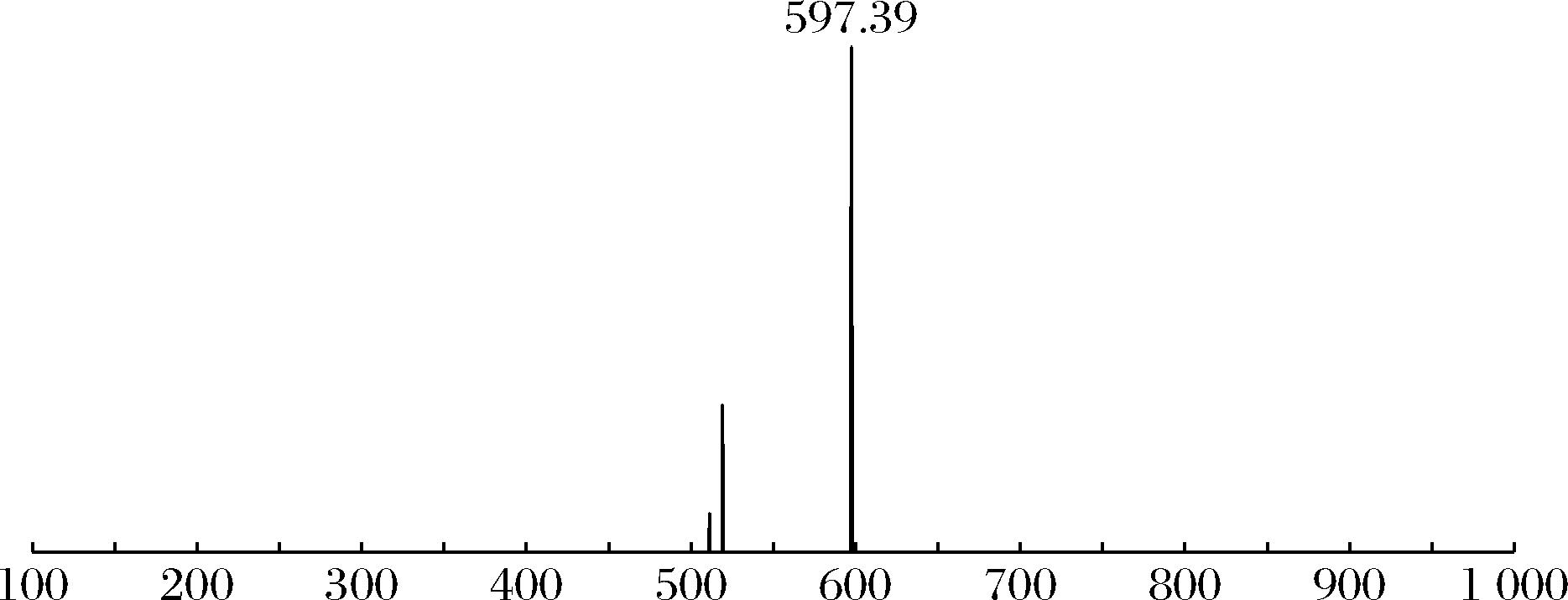
图10 虾青素标准品的质谱鉴定结果
Fig.10 Mass spectra of astaxanthin standard
对虾青素顺式异构化后的样品进行液相质谱检测,其质谱图如图11所示。
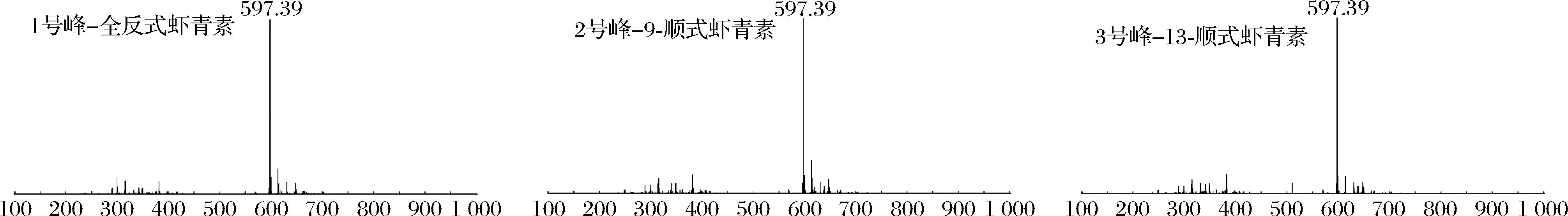
图11 虾青素异构体的质谱鉴定结果
Fig.11 Mass spectra of astaxanthin isomers
从虾青素异构体的HPLC结果可知1号峰是全反式虾青素,经液质检测发现如色谱图中峰2和峰3的质谱图和峰1的质谱图相似,他们具有共同的分子离子峰[M+H]+为597.39,且3个质谱图高度一致,基本可以断定2、3峰都属于虾青素的异构体,也就是3个峰的分子质量都和虾青素质荷比一致,从而推测这3种物质是虾青素的同分异构体。结合文献[7],通过匹配出峰保留时间,光谱图、Q值以及UPLC-MS等方法可以鉴定出峰1、2和3分别是全反式虾青素、9-顺式虾青素异构体、13-顺式虾青素异构体。
3 结论
本文通过单因素和响应面试验优化虾青素的异构化条件,确定了高顺式虾青素的制备方法;使用HPLC和LC-MS对虾青素几种不同几何构型进行了分析和鉴定。通过试验,得出最佳条件:60 mg/mL异硫氰酸甲酯,微波温度69 ℃,微波功率600 W,微波时间22 min,虾青素的质量浓度为1.5 mg/mL。在此条件下,虾青素总顺式占比率为49.34%。本研究在前人研究基础上进行优化,提供一种可以快速制备顺式虾青素的异构化方法,同时也提高了虾青素的顺式占比,可为虾青素在食品和药品等领域进一步的应用与发展提供一定参考,具有潜在应用价值。
[1] VISIOLI F, ARTARIA C.Astaxanthin in cardiovascular health and disease:Mechanisms of action, therapeutic merits, and knowledge gaps[J].Food &Function, 2017, 8(1):39-63.
[2] YUAN J P, PENG J A, YIN K, et al.Potential health-promoting effects of astaxanthin:A high-value carotenoid mostly from microalgae[J].Molecular Nutrition &Food Research, 2011, 55(1):150-165.
[3] YANG C, ZHANG L F, ZHANG H A, et al.Rapid and efficient conversion of all-E-astaxanthin to 9Z- and 13Z-isomers and assessment of their stability and antioxidant activities[J].Journal of Agricultural and Food Chemistry, 2017, 65(4):818-826.
[4] VIAZAU Y V, GONCHARIK R G, KULIKOVA I S, et al.E/Z isomerization of astaxanthin and its monoesters in vitro under the exposure to light or heat and in overilluminated Haematococcus pluvialis cells[J].Bioresources and Bioprocessing, 2021, 8(1):55.
[5] HONDA M, ZHANG Y L, GOTO M.Isothiocyanate-functionalized silica as an efficient heterogeneous catalyst for carotenoid isomerization[J].Food Chemistry, 2023, 410:135388.
[6] 陈晓枫. 不同几何构型虾青素抗氧化、延缓衰老活性差异及分子作用机理[D].广州:华南农业大学, 2017. CHEN X F.Differerces in antioxidant, anti-aging activities of astaxanthin isomers and molecular mechanism involved[D].Guangzhou:South China Agricultural University, 2017.
[7] 杨成. 含氧类胡萝卜素异构体的制备纯化,吸收代谢及对肠道功能的影响[D].无锡:江南大学, 2018. YANG C.Xanthophyll isomers:Rapid preparation, purification, metabolic fate and their effects on the intestinal function[D].Wuxi:Jiangnan University, 2018.
[8] LI H Y, DENG Z Y, LIU R H, et al.Ultra-performance liquid chromatographic separation of geometric isomers of carotenoids and antioxidant activities of 20 tomato cultivars and breeding lines[J].Food Chemistry, 2012, 132(1):508-517.
[9] 巩风英. 雨生红球藻中虾青素合成及几何异构体的分析研究[D].青岛:中国科学院大学(中国科学院海洋研究所), 2017. GONG F Y.A study on the systhesis of astaxanthin and the analysis of its geometric isomers in Haematococcus pluvialis[D].Qingdao:Institute of Oceanology, Chinese Academy of Sciences, 2017. [10] 耿兆艳, 孙翰, 管斌, 等.雨生红球藻粉虾青素的提取及稳定性研究[J].中国食品学报, 2017, 17(7):86-95. GENG Z Y, SUN H, GUAN B, et al.Study on the extraction of astaxanthin from Haematococcus pluvialis and the stability of astaxanthin[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(7):86-95.
[11] KULIKOV E A, KULIKOVA I S, VASILOV R G, et al.The effect of the solvent nature and lighting on isomerization and oxidative degradation of astaxanthin[J].Biophysics, 2020, 65(3):433-442.
[12] HONDA M, SOWA T, KAWASHIMA Y.Thermal- and photo-induced isomerization of all-E and Z-isomer-rich xanthophylls:Astaxanthin and its structurally-related xanthophylls, adonirubin, and adonixanthin[J].European Journal of Lipid Science and Technology, 2020, 122(5):1900462.
[13] ZHAO L Y, ZHAO G H, CHEN F, et al.Different effects of microwave and ultrasound on the stability of (all-E)-astaxanthin[J].Journal of Agricultural and Food Chemistry, 2006, 54(21):8346-8351.
[14] YUAN J P, CHEN F.Kinetics for the reversible isomerization reaction of trans-astaxanthin[J].Food Chemistry, 2001, 73(2):131-137.
[15] DUGAVE C, DEMANGE L.Cis-trans isomerization of organic molecules and biomolecules:Implications and applications[J].Chemical Reviews, 2003, 103(7):2475-2532.
[16] GAO Y L, KISPERT L D.Reaction of carotenoids and ferric chloride:Equilibria, isomerization, and products[J].The Journal of Physical Chemistry B, 2003, 107(22):5333-5338.
[17] YUAN J P, CHEN F.Purification of trans-astaxanthin from a high-yielding astaxanthin ester-producing strain of the microalga Haematococcus pluvialis[J].Food Chemistry, 2000, 68(4):443-448.
[18] QIU D, WU Y C, ZHU W L, et al.Identification of geometrical isomers and comparison of different isomeric samples of astaxanthin[J].Journal of Food Science, 2012, 77(9):C934-C940.
[19] GRYNBAUM M D, HENTSCHEL P, PUTZBACH K, et al.Unambiguous detection of astaxanthin and astaxanthin fatty acid esters in krill (Euphausia superba Dana)[J].Journal of Separation Science, 2005, 28(14):1685-1693.
[20] 赵英源, 舒澳, 张胜梦, 等.高效液相色谱法分析鉴定虾青素全反式、9-顺式、13-顺式几何异构体[J].中国海洋药物, 2022, 8(5):73-81. ZHAO Y Y, SHU A, ZHANG S M, et al.Analysis and identification of all-trans, 9-cis and 13-cis geometric isomers of astaxanthin by HPLC[J].Chinese Journal of Marine Drugs, 2022, 8(5):73-81.
[21] 孙伟红, 邢丽红, 冷凯良, 等.高效液相色谱法测定南极磷虾及其制品中虾青素的含量[J].食品安全质量检测学报, 2017, 8(4):1248-1253. SUN W H, XING L H, LENG K L, et al.Determination of astaxanthin in Antarctic krill and its products by high performance liquid chromatography[J].Journal of Food Safety &Quality, 2017, 8(4):1248-1253.
[22] YUAN J P, CHEN F.Isomerization of trans-astaxanthin to cis-isomers in organic solvents[J].Journal of Agricultural and Food Chemistry, 1999, 47(9):3656-3660.
[23] ZHAO L Y, CHEN F, ZHAO G H, et al.Isomerization of trans-astaxanthin induced by copper(II) ion in ethanol[J].Journal of Agricultural and Food Chemistry, 2005, 53(24):9620-9623.
[24] 金兴江, 吴月婵, 仇丹, 等.虾青素几何异构体的分离、鉴定及抗氧化性能研究[J].食品科技, 2010, 35(12):224-227;231. JIN X J, WU Y C, QIU D, et al.Isolation, identification and antioxidant activities of astaxanthin isomers[J].Food Science and Technology, 2010, 35(12):224-227;231.
[25] 仇丹, 陈志荣, 李浩然.β-胡萝卜素异构体的定性分析[J].食品科学, 2008, 29(4):50-53. QIU D, CHEN Z R, LI H R.Qualitative analysis of β-carotene isomers[J].Food Science, 2008, 29(4):50-53.
[26] LAMBELET P, RICHELLE M, BORTLIK K, et al.Improving the stability of lycopene Z-isomers in isomerised tomato extracts[J].Food Chemistry, 2009, 112(1):156-161.
[27] HONDA M, KAGEYAMA H, HIBINO T, et al.Isomerization of commercially important carotenoids (lycopene, β-carotene, and astaxanthin) by natural catalysts:Isothiocyanates and polysulfides[J].Journal of Agricultural and Food Chemistry, 2020, 68(10):3228-3237.
[28] COOPERSTONE J L, FRANCIS D M, SCHWARTZ S J.Thermal processing differentially affects lycopene and other carotenoids in cis-lycopene containing, tangerine tomatoes[J].Food Chemistry, 2016, 210:466-472.
[29] 丛心缘, 孙伟红, 张辉珍, 等.南极磷虾中不同形态虾青素的分离制备、结构鉴定及含量分析[J].食品与发酵工业, 2019, 45(2):174-178. CONG X Y, SUN W H, ZHANG H Z, et al.Separation, structure identification and content analysis of different forms of astaxanthin in Antarctic krill[J].Food and Fermentation Industries, 2019, 45(2):174-178.
[30] 郭红星, 高望, 周尽学.光照、加热对虾青素稳定性和抗氧化性的影响分析[J].科技视界, 2020(31):84-85. GUO H X, GAO W, ZHOU J X.Influence of light and heating on stability and oxidation resistance of astaxanthin[J].Science &Technology Vision, 2020(31):84-85.
[31] HONDA M.Application of E/Z-isomerization technology for enhancing processing efficiency, health-promoting effects, and usability of carotenoids:A review and future perspectives[J].Journal of Oleo Science, 2022, 71(2):151-165.