Pickering乳液是用固体颗粒代替传统乳化剂构成的乳液体系,常作为负载和输送目标物质的载体,应用于食品、药品以及化妆品领域[1]。与传统乳液相比,Pickering乳液具有安全性高、稳定性强、可控性强等优势[2]。随着Pickering乳液在食品领域的开发与应用,采用淀粉、纤维素、蛋白质等食品级固体颗粒作为乳化剂的Pickering乳液成为目前研究热点[3-4]。
木薯(Manihot esculenta)在我国资源丰富、价格低廉,木薯中杂质含量低,淀粉含量高,被誉为“淀粉之王”[5]。木薯淀粉黏性强、透明度高、成膜性好[6],在理化、功能特性及加工性能方面具有明显优势。但木薯淀粉亲水性较强,无法长时间稳定乳液,有研究表明,Pickering乳液的稳定性受颗粒自身尺寸影响很大,粒径小吸附动力快,乳液稳定性越强[1],纳米级淀粉颗粒能稳定吸附于油水界面形成物理屏障,得到稳定乳液[2]。纳米淀粉通常通过物理、化学及酶等方式分离得到[7],目前纳米淀粉制备方法中,沉淀法因操作简单、重现性好、耗能少、对环境无污染等优点,而被广泛应用[8-9]。
基于此,本研究以木薯淀粉为原料,沉淀法制备纳米淀粉,并将其用于稳定乳液,探究木薯纳米淀粉稳定乳液的效果,为木薯淀粉在食品工业等领域的应用提供一定的理论指导和现实依据。
1 材料与方法
1.1 试剂与仪器
木薯淀粉(食品级),江苏味门食品有限公司;无水乙醇(分析纯),广东光华科技股份有限公司;调和油(食品级),嘉里粮油有限公司。
XINYI-IID超声波细胞粉碎机,宁波新艺超声设备有限公司;FJS-4磁力搅拌水浴锅,金坛市西富威实验仪器厂;FD5-3冷冻干燥机,美国Gold-Sim公司;Zetasizer Nano ZS90型激光粒度仪,英国Malvern仪器有限公司;600 MHz核磁共振波谱仪,德国Bruker公司;Tescan MIRA LMS扫描电子显微镜,捷克Tescan公司;FJM-F200透射电子显微镜,日本电子株式会社;FJ200-SH实验室数显高速分散均质机,上海泸析实业有限公司。
1.2 实验方法
1.2.1 木薯纳米淀粉的制备
参照GE等[10]的方法,稍作修改。将木薯淀粉水溶液100 r/min、100 ℃恒温搅拌1 h至淀粉完全糊化。淀粉溶液冷却至室温后,650 W超声波处理15 min。在100 r/min的磁力搅拌下,缓慢匀速注入乙醇。纳米淀粉混合液8 000 r/min离心10 min,沉淀加20 mL无水乙醇离心洗涤3次。冷冻干燥,得木薯纳米淀粉。
1.2.2 制备条件对木薯纳米淀粉粒径的影响
纳米淀粉的粒径是影响其乳化性能的重要参数之一,为探究制备条件对木薯纳米淀粉粒径的影响,依次改变木薯淀粉添加量分别为3%、4%、5%、6%、7%(质量分数,下同),固定超声波振幅70%,乙醇体积分数60%,搅拌时间15 min;依次改变超声波振幅分别为60%、65%、70%、75%、80%,固定木薯淀粉添加量5%,乙醇体积分数60%,搅拌时间15 min;依次改变乙醇体积分数分别为40%、50%、60%、70%、80%,固定木薯淀粉添加量5%,超声波振幅70%,搅拌时间15 min;依次改变搅拌时间分别为5、10、15、20、25 min,固定木薯淀粉添加量5%,超声波振幅70%,乙醇体积分数60%。
1.2.3 粒径分析
采用纳米激光粒度仪在25 ℃测定纳米淀粉、乳液粒径及分布。
1.2.4 核磁共振氢谱(hydrogen nuclear magnetic resonance,1H-NMR)分析
核磁共振氢谱分析纳米淀粉化学结构。测定条件:采用DMSO-d6为溶剂,温度50 ℃,脉冲角30°,延迟时间10 s,采集时间2 s。
1.2.5 扫描电镜(scanning electron microscopy,SEM)分析
通过SEM对木薯淀粉形貌进行分析。取少量淀粉,用导电胶固定在样品台上,喷金,5 kV的加速电压,放大倍数2 000。
1.2.6 透射电镜(transmission electron microscopy,TEM)分析
通过TEM对木薯纳米淀粉形貌进行分析。将纳米淀粉与去离子水配制成0.5 g/L的纳米淀粉悬浮液,滴置于铜网进行观察。
1.2.7 乳化活性及乳化稳定性分析
乳液的乳化活性(emulsification activity,EAI)、乳化稳定性(emulsification stability,ESI)参考李佳慧[11]的方法,稍作修改。称取0.70 g样品与10 mL去离子水混合,50 ℃水浴2 min,加入4.50 mL调和油,14 000 r/min高速均质3 min,制得Pickering乳液。将新鲜制备的乳液(0 h)与静置72 h的乳液,5 000 r/min离心30 min。记录液体总高度、乳化层高度。采用公式(1)、公式(2)分别计算EAI、ESI:
(1)
(2)
式中:EAI,乳化活性,%;ESI,乳化稳定性,%;H,液体总高度,cm;h0,0 h乳化层高度,cm;h72,72 h乳化层高度,cm。
1.2.8 贮藏稳定性分析
将新鲜制备的淀粉乳液避光贮藏,15 d后观察乳液变化情况并拍照记录。
1.3 数据处理与分析
采用SPSS 25.0进行数据处理,Origin 2018软件绘图,ANOVA分析数据差异显著性(P<0.05),数据均为3次重复实验取平均值。
2 结果与分析
2.1 制备条件对木薯纳米淀粉粒径的影响
沉淀法制备纳米淀粉,淀粉应能溶解于溶剂,不溶于不良溶剂,溶剂与不良溶剂之间应具有良好的混溶性[12]。基于此条件,本研究以水为溶剂,乙醇为不良溶剂。并考察木薯淀粉添加量、超声波振幅、乙醇体积分数、搅拌时间对木薯纳米淀粉粒径的影响。
2.1.1 木薯淀粉添加量对木薯纳米淀粉粒径的影响
由图1可知,随木薯淀粉添加量的增加,木薯纳米淀粉粒径呈先下降后上升趋势。淀粉添加量3%~4%(质量分数,下同)时,纳米淀粉粒径较大。原因是淀粉添加量过少,淀粉溶液中水含量高,淀粉分子分散时容易发生团聚,得到粒径较大的纳米淀粉[13]。当淀粉添加量5%时,粒径最小(81.77 nm),添加量超过5%时,纳米淀粉粒径随淀粉添加量增大而上升;7%时,纳米淀粉粒径上升至289.00 nm,相对于淀粉添加量5%的样品,粒径显著上升(P<0.05)。原因为淀粉添加量过多,淀粉溶液黏度变大,阻碍淀粉溶液与乙醇之间的相互扩散,导致淀粉分散不均匀,形成大颗粒[14]。此外,高浓度淀粉溶液中单位体积淀粉链较多,淀粉链聚集缠绕,使纳米淀粉粒径上升[15]。淀粉添加量为5%时,木薯纳米淀粉粒径最小,因此选取5%的木薯淀粉添加量。
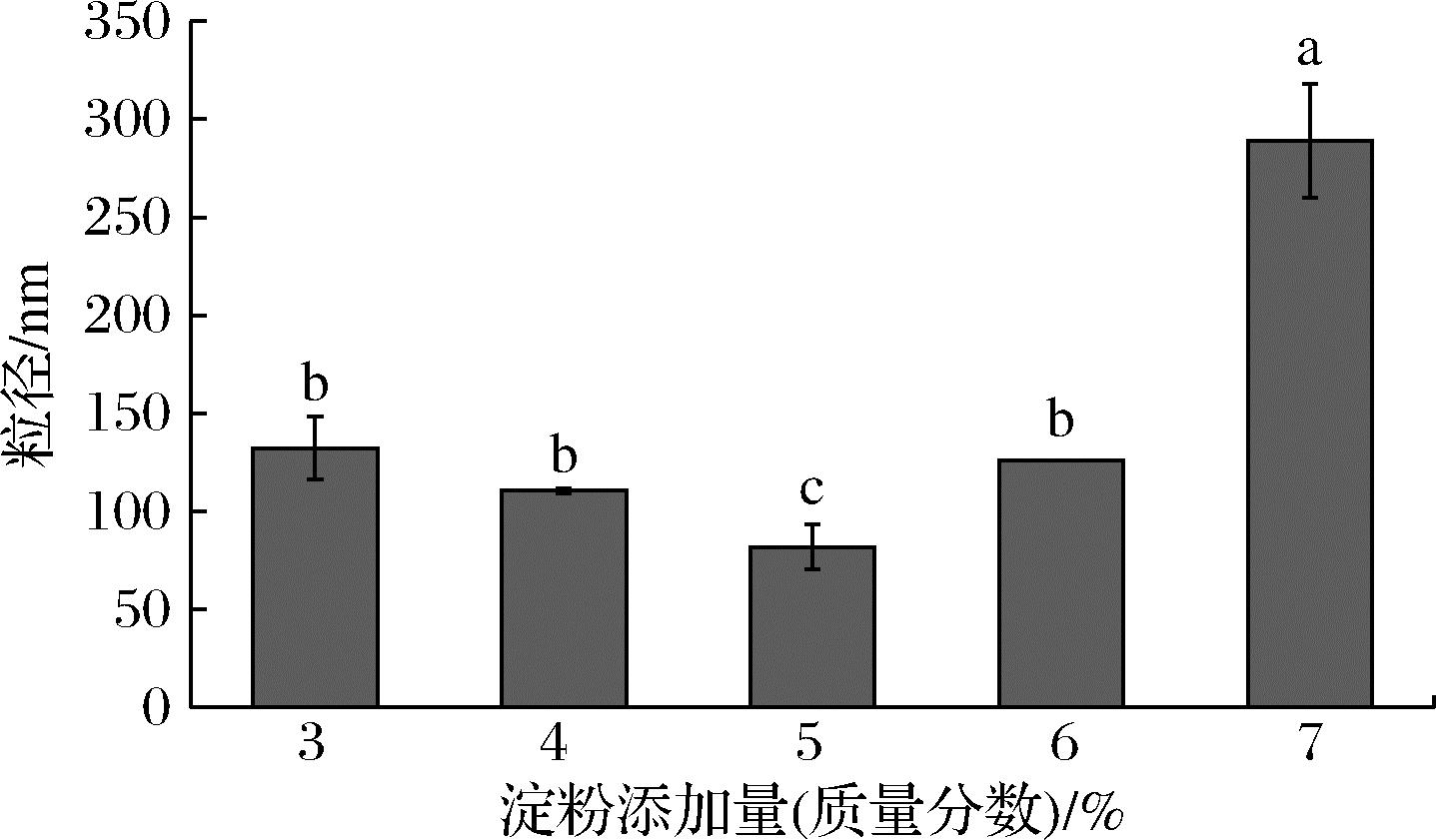
图1 木薯淀粉添加量对木薯纳米淀粉粒径的影响
Fig.1 Effect of cassava starch mass ratio on the particle size of cassava starch nanoparticles
注:不同小写字母表示组间具有显著性差异(P<0.05)(下同)。
2.1.2 超声波振幅对木薯纳米淀粉粒径的影响
研究发现木薯淀粉添加量过高会使淀粉溶液黏度过大,导致木薯纳米淀粉粒径上升。超声波辅助处理可降低淀粉溶液黏度,减小纳米淀粉粒径[16]。由图2可知,固定超声波功率650 W,振幅60%~75%时,木薯纳米淀粉粒径较小,超声波振幅的变化对粒径影响不显著(P>0.05);70%时粒径最小,为76.80 nm。当振幅超过75%,粒径显著上升(P<0.05),由82.47 nm上升到195.15 nm。原因是超声波作用可破坏淀粉分子间的相互作用力,聚集缠绕的淀粉链被打开,使淀粉溶液迅速向乙醇扩散,得到小粒径纳米淀粉。当超声波振幅过大(80%),淀粉受空穴作用,发生高速运动,颗粒间的碰撞增多,发生团聚,形成大颗粒纳米淀粉[17]。超声波振幅为70%时,木薯纳米淀粉粒径最小,因此本研究以70%作为超声波振幅。
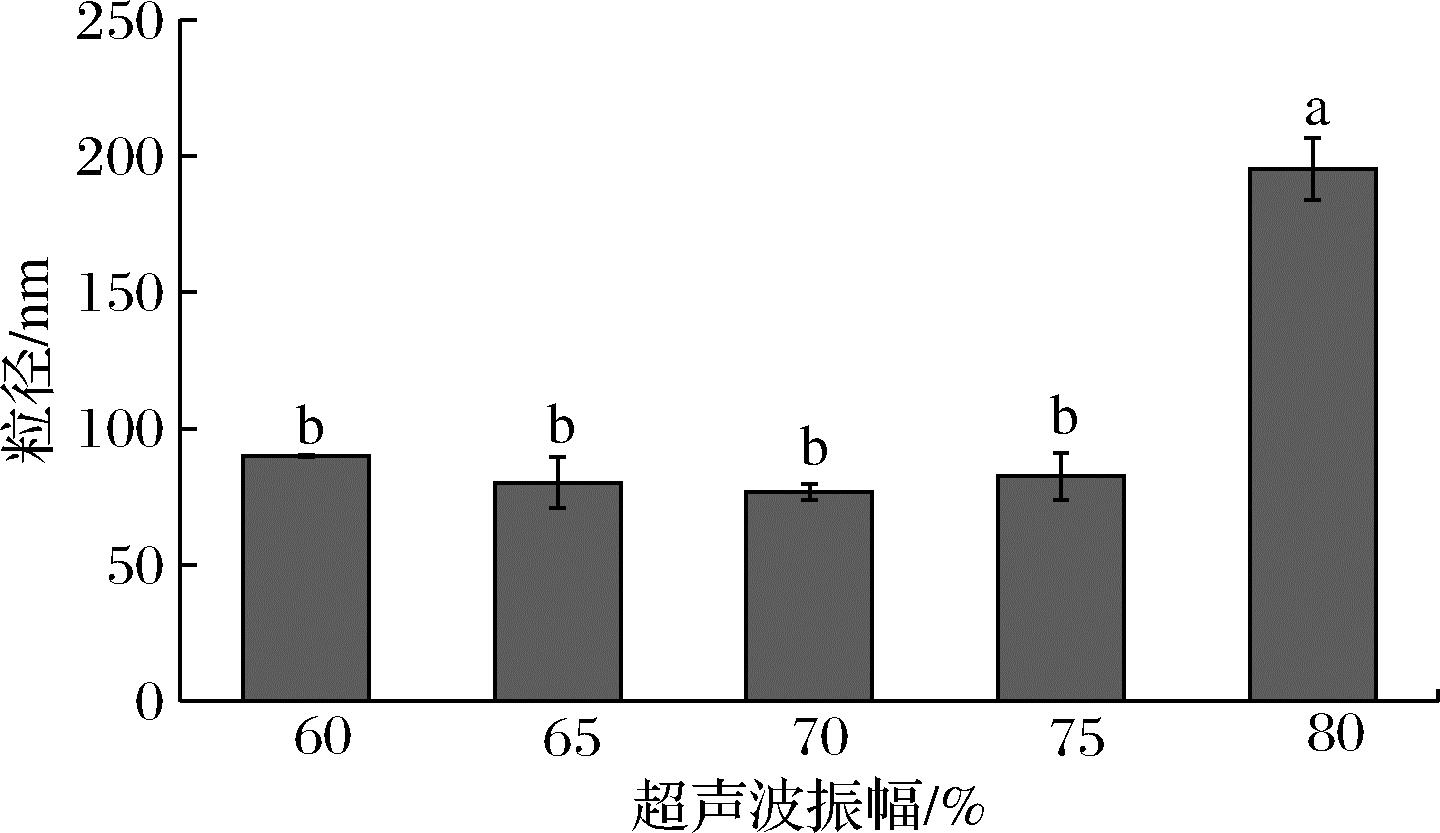
图2 超声波振幅对木薯纳米淀粉粒径的影响
Fig.2 Effect of ultrasonic amplitude on the particle size of cassava starch nanoparticles
2.1.3 乙醇体积分数对木薯纳米淀粉粒径的影响
由图3可知,乙醇体积分数40%~50%时,木薯纳米淀粉粒径随乙醇增加而显著下降(P<0.05),粒径由224.35 nm下降至87.62 nm。当乙醇体积分数>50%时,纳米淀粉粒径差异不显著(P>0.05);60%时粒径最小,为78.97 nm。原因为乙醇过少时,不能完全取代淀粉中的水分,残留的水分使淀粉分子间氢键作用力增强,出现团聚行为[18]。继续添加乙醇,乙醇迅速扩散使界面张力降低,纳米淀粉粒径减小[17]。乙醇体积分数为60%时,木薯纳米淀粉粒径最小,因此本研究选取的乙醇体积分数为60%。
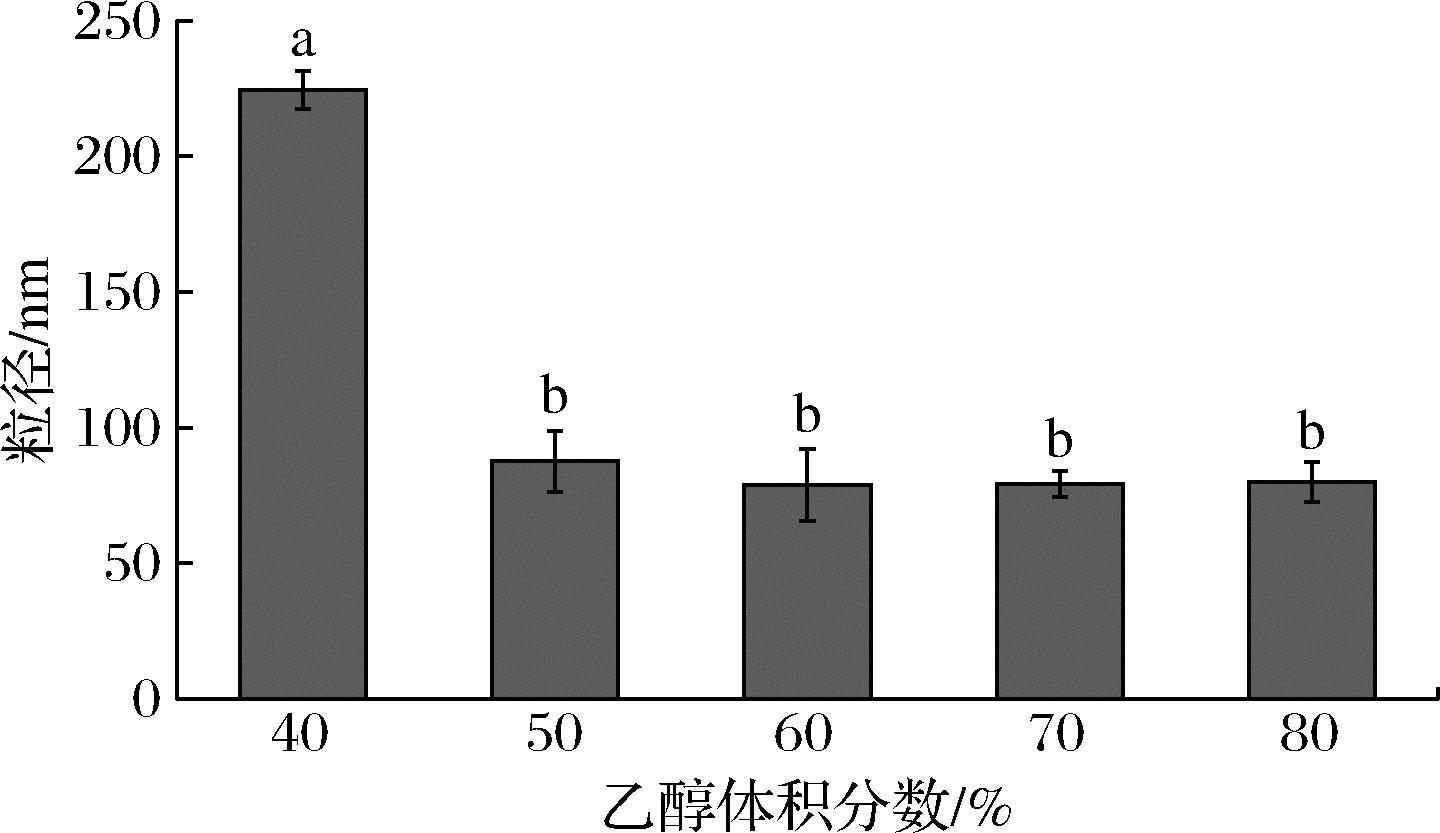
图3 乙醇体积分数对木薯纳米淀粉粒径的影响
Fig.3 Effect of ethanol volume fractions on the particle size of cassava starch nanoparticles
2.1.4 搅拌时间对木薯纳米淀粉粒径的影响
由图4可知,随搅拌时间的延长,木薯纳米淀粉粒径呈先下降后上升趋势。搅拌时间5~15 min时,纳米淀粉粒径随搅拌时间增大而下降。当搅拌时间超过15 min,纳米淀粉粒径显著上升(P<0.05);15 min时粒径最小,为75.91 nm。原因为搅拌时间过短,淀粉溶液与乙醇的混合时间短,接触不完全,使纳米颗粒析出缓慢,形成粒径较大的纳米淀粉[19]。随搅拌时间延长,淀粉溶液与乙醇混合更均匀,纳米淀粉粒径减小[13]。搅拌时间过长,大量纳米淀粉形成,颗粒间相互碰撞几率增大,易发生团聚使纳米淀粉粒径上升。搅拌时间为15 min时,木薯纳米淀粉粒径最小,因此选取15 min作为搅拌时间。
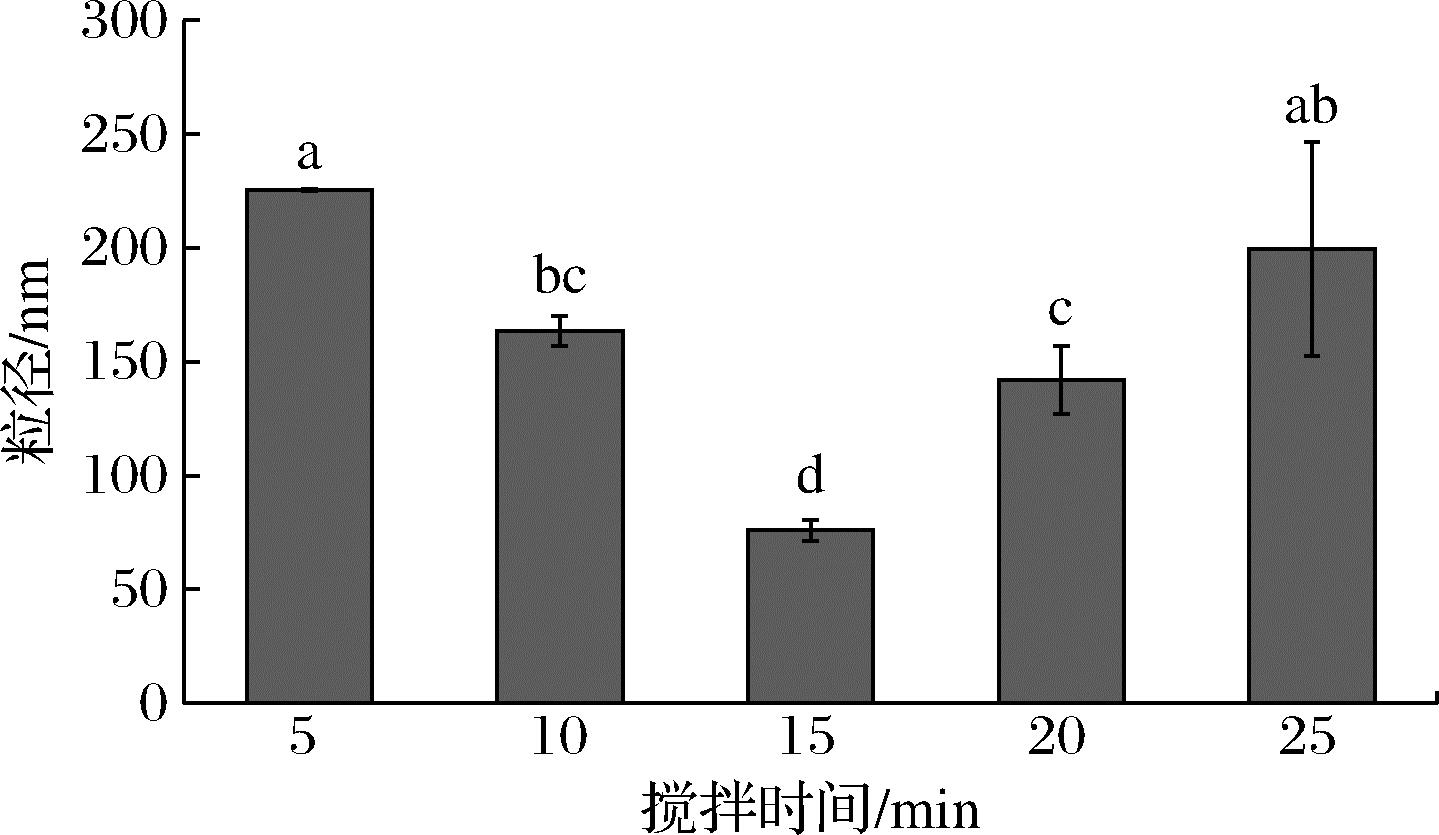
图4 搅拌时间对木薯纳米淀粉粒径的影响
Fig.4 Effect of stirring time on the particle size of cassava starch nanoparticles
综上,选取最适制备条件:木薯淀粉添加量5%、超声波振幅70%、乙醇体积分数60%、搅拌时间15 min,对该条件制备的木薯纳米淀粉化学结构、形貌及乳化性能进行分析。
2.2 1H-NMR分析
由图5可知,1H-NMR中,2.50、3.30 ppm分别为DMSO-d6、H2O的质子吸收峰,3.30~3.80 ppm之间出现的吸收峰为淀粉中葡萄糖单元上C2~C6质子峰,5.20 ppm为C1质子峰,5.30~5.60 ppm附近为C2、C3上的羟基质子峰,4.50 ppm为C6羟基质子峰[9]。木薯纳米淀粉与木薯淀粉各个氢的峰位基本一致,纳米淀粉H-1、H-2,3,4,5,6、OH-2,3、OH-6的面积比为1∶6∶2∶1与葡萄糖单元结构一致[20],表明沉淀法制备木薯纳米淀粉的过程中无新基团引入,纳米淀粉保留了淀粉的基本化学结构。
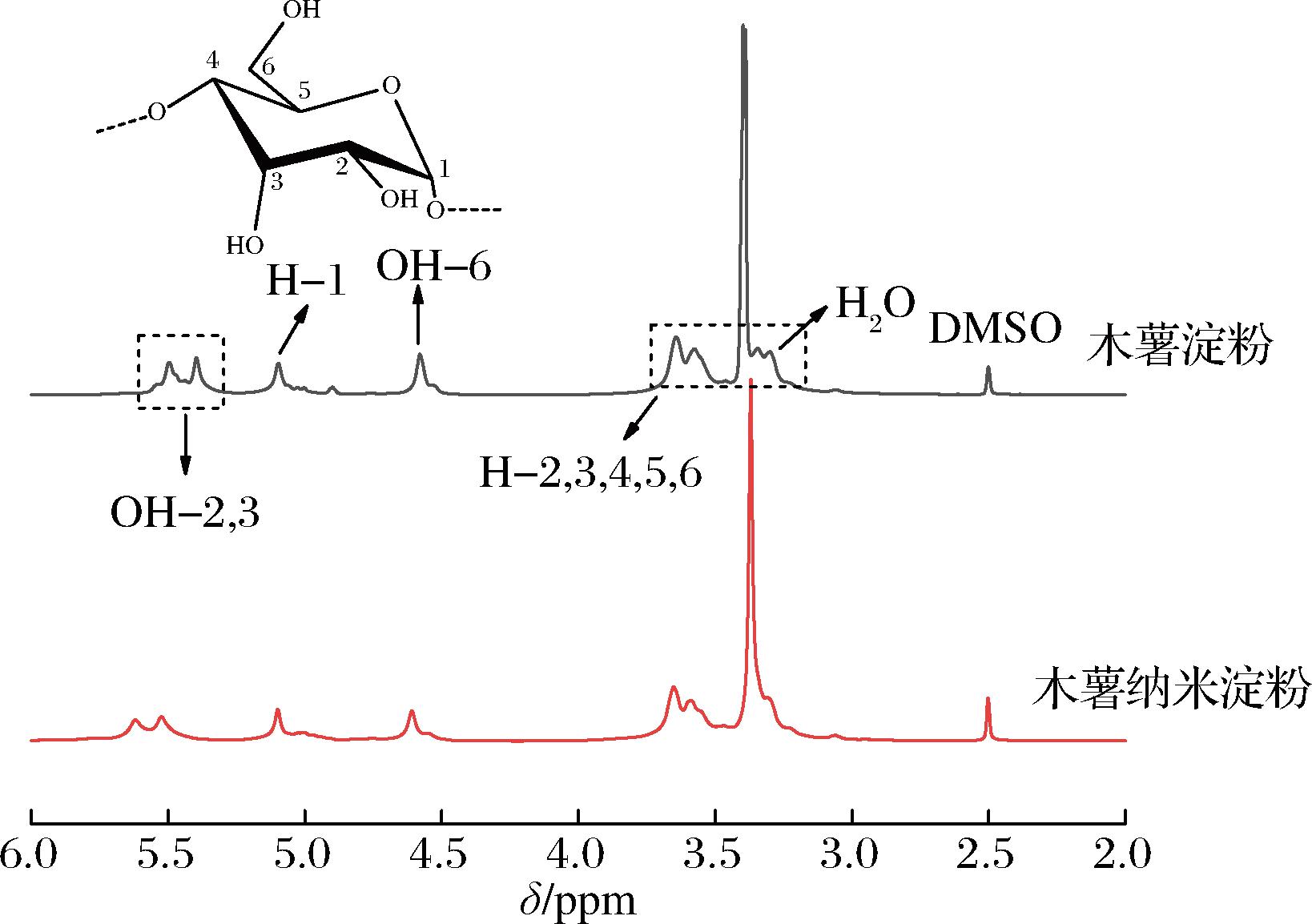
图5 木薯淀粉和木薯纳米淀粉的1H-NMR谱图
Fig.5 1H-NMR pattern of cassava starch and cassava starch nanoparticles
2.3 形貌分析
利用SEM、TEM对样品进行形貌分析。图6可见,木薯淀粉大多呈规则圆球状,有少数因破坏而形成不规则多面体存在,颗粒表面较光滑,有细微裂痕,粒径为5.00~18.00 μm。木薯纳米淀粉主要为圆球形,与原淀粉相比,粒径明显减小,为20.00~450.00 nm,结果表明沉淀法可以实现木薯淀粉的纳米化。此外,纳米淀粉易出现团聚现象[21],史永桂等[17]将其解释为由于去溶剂化作用,在乙醇挥发后,纳米淀粉中残留的水分增强了纳米淀粉的氢键作用力,颗粒间出现团聚行为,这也是观察到部分大粒径出现的原因。

a-木薯淀粉的SEM图(×2 000);b-木薯纳米淀粉的TEM图
图6 木薯淀粉和木薯纳米淀粉形貌图
Fig.6 The topography of cassava starch and cassava starch nanoparticles
2.4 Pickering乳液的粒径、EAI、ESI和贮藏稳定性分析
以木薯淀粉和木薯纳米淀粉作为固体颗粒乳化剂制备Pickering乳液,测定乳液粒径、EAI、ESI和贮藏稳定性,考察二者乳化性能的差别。由图7可见,纳米淀粉乳液粒径远小于原淀粉乳液。原淀粉乳液粒径分布较宽,为1 790.00~2 780.00 nm,平均粒径2 514.00 nm。纳米淀粉乳液粒径分布较窄,为198.00~741.90 nm,平均粒径308.40 nm。

图7 木薯淀粉乳液和木薯纳米淀粉乳液粒径分布
Fig.7 The particle size distribution of cassava starch-based emulsion and cassava starch nanoparticles-based emulsion
EAI、ESI是评价乳液功能特性的重要指标[22],由于离心作用可加速乳液的乳析过程,所以通过离心法测定EAI、ESI,可达到快速判断乳液稳定性的目的[23]。由表1可知,纳米淀粉乳液与原淀粉乳液相比,EAI、ESI均有所提升。原淀粉乳液的EAI、ESI分别为58.42%、54.17%,纳米淀粉乳液的EAI、ESI提升显著(P<0.05),分别为87.12%、86.47%。由图8可知,贮藏稳定性与EAI、ESI的结果一致,纳米淀粉乳液贮藏稳定性明显提升。原淀粉无法制备出稳定的乳液,油水分离明显,纳米淀粉能稳定乳液。随贮藏时间的延长,15 d时纳米淀粉乳液外观仍无明显变化,没有出现分层现象。
表1 木薯淀粉乳液和木薯纳米淀粉乳液EAI、ESI测试结果
Table 1 The EAI, ESI of cassava starch-based emulsion and cassava starch nanoparticles-based emulsion
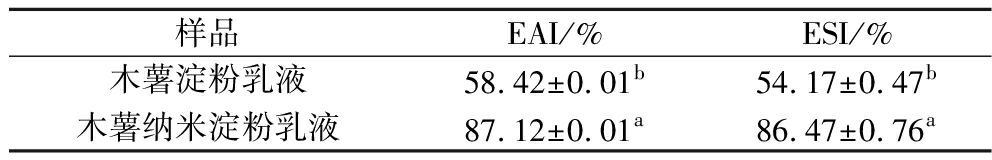
样品EAI/%ESI/%木薯淀粉乳液58.42±0.01b54.17±0.47b木薯纳米淀粉乳液87.12±0.01a86.47±0.76a
注:不同小写字母表示差异显著(P<0.05)。

图8 木薯淀粉乳液和木薯纳米淀粉乳液贮藏稳定性
Fig.8 The storage stability of cassava starch-based emulsion and cassava starch nanoparticles-based emulsion
注:a-木薯淀粉乳液;b-木薯纳米淀粉乳液。
综上所述,木薯淀粉的纳米化处理能有效地提升其乳化性能。原因是纳米淀粉粒径较小,能稳定吸附于油水界面,形成致密层,减小表面张力,从而阻碍液滴聚集,有效地稳定乳液。天然淀粉颗粒较大,吸附动力学慢,导致油水界面吸附障碍变大,填充效率变低,使淀粉难以稳定吸附,乳液失稳[24]。此外,乳液体系为了保持稳定状态,其粒径随淀粉粒径的减小而减小,乳液粒径减小的同时稳定性增强[25]。
2.5 反应机理
由图9可知,当乙醇引入淀粉溶液时,由于去溶剂化作用,淀粉在乙醇中迅速发生扩散和分裂,得到纳米淀粉[9]。纳米尺寸效应使纳米淀粉稳定吸附于油水界面形成固体微粒膜,从而稳定乳液(图10)。
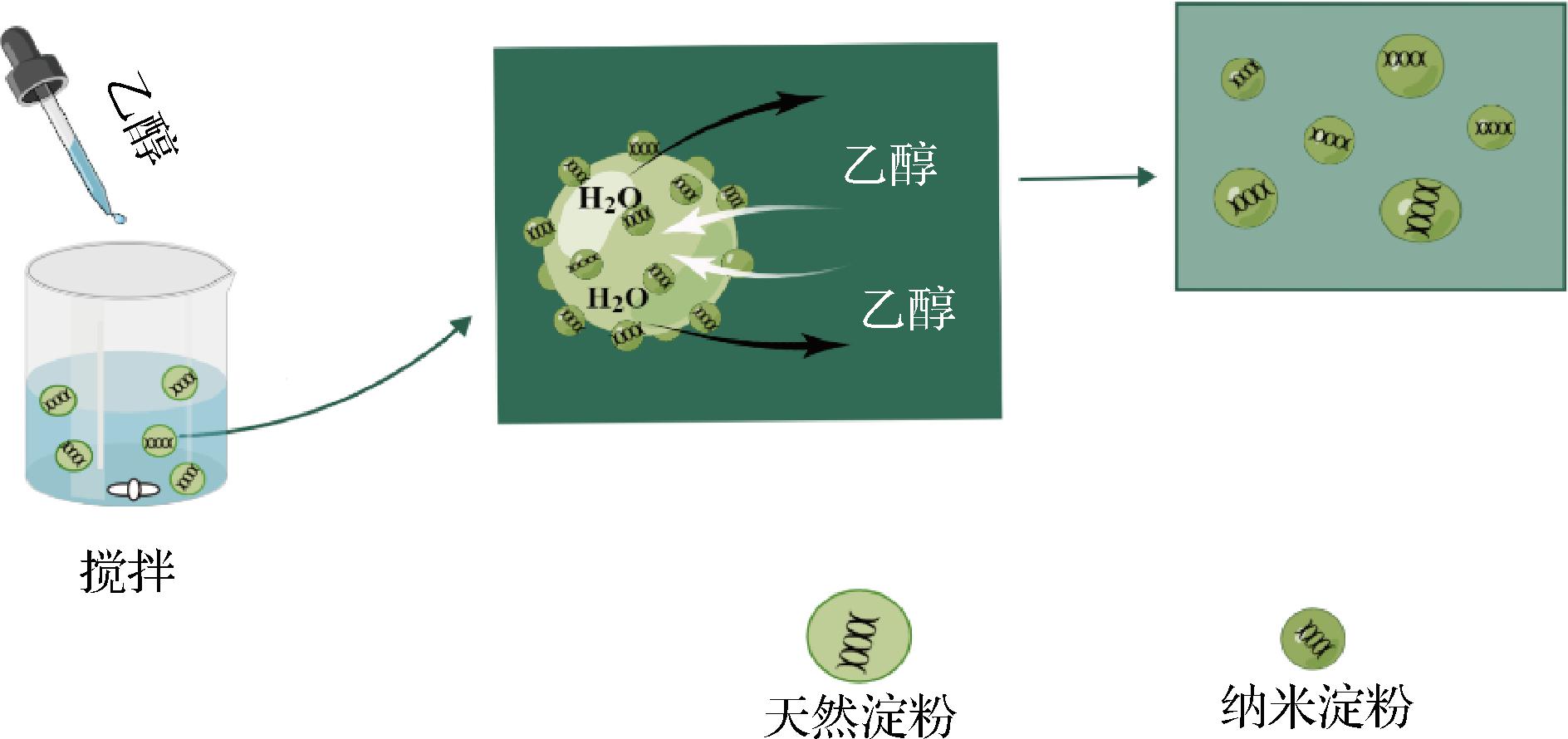
图9 纳米淀粉的形成机理
Fig.9 The formation mechanism of starch nanoparticles
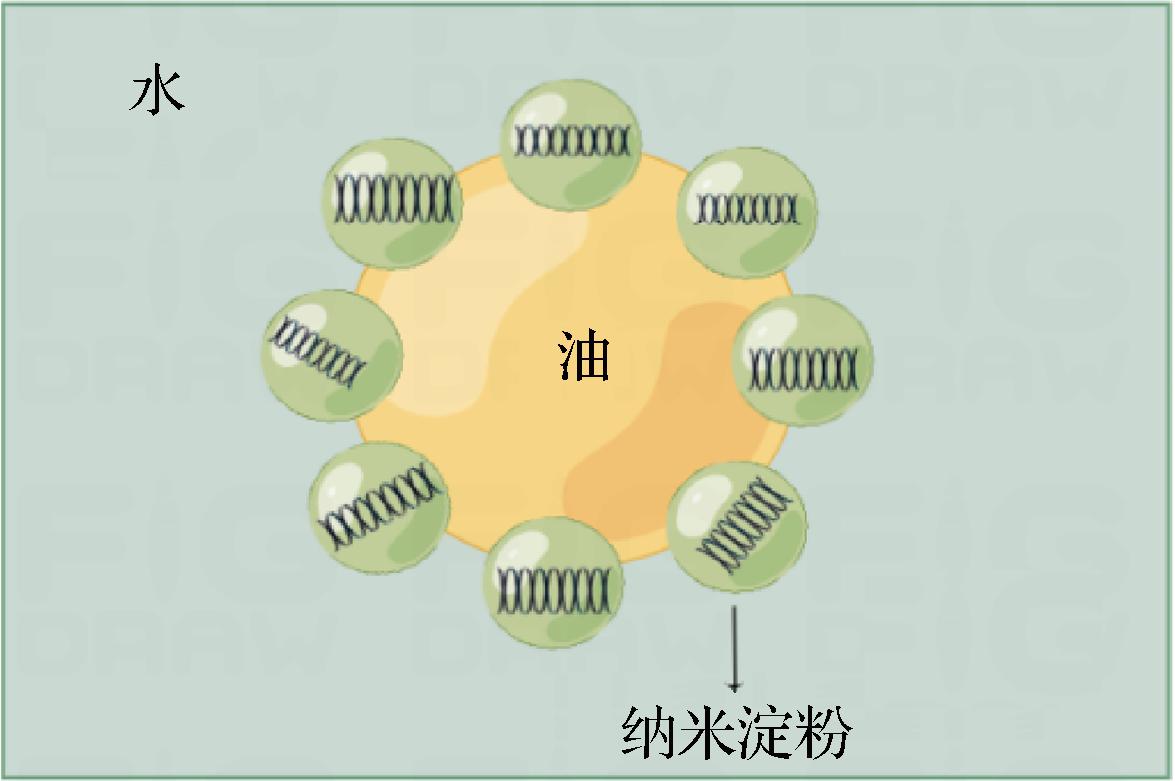
图10 纳米淀粉Pickering乳液示意图
Fig.10 The formation mechanism of starch nanoparticles-based Pickering emulsion
纳米级淀粉颗粒解吸能较高,发生在油水界面的吸附作用是不可逆的,能有效防止液滴间发生聚集,使乳液体系具有长期贮藏稳定性,不易受离子强度、pH及温度等因素的影响[1]。因此采用沉淀法制备木薯纳米淀粉,以此作为固体颗粒乳化剂制备Pickering乳液具有可行性,其良好的稳定性为今后扩展纳米级食品颗粒乳液的应用范围提供依据。
3 结论
木薯淀粉资源丰富,是一种非常具有开发价值的农产品资源。本研究以木薯淀粉为原料,沉淀法制备木薯纳米淀粉,其最优工艺条件为:淀粉添加量5%、超声波振幅70%、乙醇体积分数60%、搅拌时间15 min,此时,粒径最小75.91 nm。1H-NMR结果表明,淀粉纳米化处理未引入新的官能团,能保持淀粉基本化学结构。TEM结果表明,纳米淀粉粒径20.00~450.00 nm,为圆球形,出现团聚现象。通过粒径、EAI、ESI及贮藏稳定性分析发现,纳米淀粉乳液粒径较小,贮藏15 d仍保持均一乳液体系,EAI、ESI显著提升,分别为87.12%和86.47%(P<0.05)。综上所述,木薯淀粉可以通过沉淀法制备出纳米淀粉,并能有效提升其乳化性能。此结果为丰富木薯淀粉的利用途径和食品级固体颗粒乳化剂的开发提供参考。
[1] 张羽. 基于玉米醇溶蛋白/大米淀粉构建皮克林乳液及其营养输送特性研究[D].镇江:江苏大学, 2021. ZHANG Y.Construction of Pickering emulsion based on zein/rice starch and research of its nutrient delivery characteristics[D].Zhenjiang:Jiangsu University, 2021.
[2] 阮少龙, 周建伟, 高德, 等.纳米淀粉基皮克林乳液的研究进展[J].中国食品学报, 2021, 21(6):312-320. RUAN S L, ZHOU J W, GAO D, et al.Research progress on nanostarch-based Pickering emulsion[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(6):312-320.
[3] KALASHNIKOVA I, BIZOT H, CATHALA B, et al.New Pickering emulsions stabilized by bacterial cellulose nanocrystals[J].Langmuir, 2011, 27(12):7471-7479.
[4] XIAO J, LU X X, HUANG Q R.Double emulsion derived from kafirin nanoparticles stabilized Pickering emulsion:Fabrication, microstructure, stability and in vitro digestion profile[J].Food Hydrocolloids, 2017, 62:230-238.
[5] 薛慧. 木薯抗性淀粉的制备与性质研究[D].郑州:河南工业大学, 2013. XUE H.Studies on preparation and properties of cassava resistant starch[D].Zhengzhou:Henan University of Technology, 2013.
[6] 魏瑾雯, 孔祥颖, 张伟, 等.西兰花叶多酚-木薯淀粉/果胶复合膜对羊肉冷藏保鲜效果的影响[J].食品与发酵工业, 2022, 48(21):232-238. WEI J W, KONG X Y, ZHANG W, et al.Effect of broccoli leaf polyphenols-tapioca starch/pectin composite film on the refrigerated mutton[J].Food and Fermentation Industries, 2022, 48(21):232-238.
[7] 刘璐婕, 黄立新, 张彩虹, 等.纳米淀粉的制备、性质及应用的研究进展[J].材料导报, 2020, 34(19):19027-19033. LIU L J, HUANG L X, ZHANG C H, et al.Research progress in preparation, properties and application of nano-starch[J].Materials Reports, 2020, 34(19):19027-19033.
[8] 苏文, 杨辉.纳米淀粉制备方法研究进展[J].粮食与油脂, 2021, 34(10):5-7;31. SU W, YANG H.Research progress on the preparation methods of nano-starch[J].Cereals &Oils, 2021, 34(10):5-7;31.
[9] 吴修利. 玉米淀粉修饰及其纳米颗粒制备与表征[D].长春:吉林大学, 2015. WU X L.Modification of corn starch and preparation and characterization of nanoparticles[D].Changchun:Jilin University, 2015. [10] GE S J, XIONG L, LI M, et al.Characterizations of Pickering emulsions stabilized by starch nanoparticles:Influence of starch variety and particle size[J].Food Chemistry, 2017, 234:339-347.
[11] 李佳慧. 粳米淀粉辛烯基琥珀酸酯的制备、性质及其在纳米乳液中的应用研究[D].武汉:武汉轻工大学, 2021. LI J H.Study on the preparation, properties of rice starches octenyl succinate and its application in nanoemulsion[D].Wuhan:Wuhan Polytechnic University, 2021.
[12] 吴修利, 姜雪, 段蕾, 等.溶剂交换法制备淀粉纳米颗粒及表征[J].食品研究与开发, 2017, 38(24):7-10. WU X L, JIANG X, DUAN L, et al.Preparation and characterization of starch nanoparticles by solvent exchange method[J].Food Research and Development, 2017, 38(24):7-10.
[13] 王涛. 银杏纳米淀粉/槲皮素药物装载体系的构建及抗肿瘤活性研究[D].南京:南京林业大学, 2020. WANG T.Study on construction and anti-tumor activity of ginkgo nanoparticle/quercetin system[D].Nanjing:Nanjing Forestry University, 2020.
[14] KAKRAN M, SAHOO N G, LI L, et al.Fabrication of quercetin nanoparticles by anti-solvent precipitation method for enhanced dissolution[J].Powder Technology, 2012, 223:59-64.
[15] 张若娣. 乙酰化淀粉微球的制备研究[D].大连:大连理工大学, 2014. ZHANG R D.Preparation of acetylated starch microspheres[D].Dalian:Dalian University of Technology, 2014.
[16] CHANG Y J, YAN X X, WANG Q, et al.High efficiency and low cost preparation of size controlled starch nanoparticles through ultrasonic treatment and precipitation[J].Food Chemistry, 2017, 227:369-375.
[17] 史永桂, 林日辉, 焦思宇, 等.淀粉纳米颗粒的醇沉法制备与同步包埋山奈酚的研究[J].食品工业科技, 2022, 43(2):241-247. SHI Y G, LIN R H, JIAO S Y, et al.Preparation of starch nanoparticle by alcohol precipitation and simultaneous embedding of kaempferol[J].Science and Technology of Food Industry, 2022, 43(2):241-247.
[18] 孙锦, 刘芳, 何会泉, 等.微波超声波辅助制备木薯淀粉纳米颗粒及其特性表征[J].食品工业科技, 2018, 39(20):128-134;140. SUN J, LIU F, HE H Q, et al.Preparation and characterization of cassava starch nanoparticles with radiation of microwave and ultrasonic[J].Science and Technology of Food Industry, 2018, 39(20):128-134;140.
[19] JUNA S, HUBER A.Formation of nano- and micro-structures of various botanical sources of native starches investigated employing asymmetrical flow field-flow fractionation[J].Starch - Stärke, 2013, 65(11-12):1029-1037.
[20] ZHANG Z, SHAN H L, SUN J R, et al.Facile preparation of corn starchnanoparticles by alkali-freezing treatment[J].RSC Advances, 2013, 3(32):13406-13411.
[21] BOUFI S, BEL HAAJ S, MAGNIN A, et al.Ultrasonic assisted production of starch nanoparticles:Structural characterization and mechanism of disintegration[J].Ultrasonics Sonochemistry, 2018, 41:327-336.
[22] 赵国瑜, 范方宇, 槐晋东.纳米SiO2/明胶茶油微胶囊的制备及性能[J].精细化工, 2022, 39(2):367-374;402. ZHAO G Y, FAN F Y, HUAI J D.Preparation and properties of nano-SiO2/gelatin camellia oil microcapsules[J].Fine Chemicals, 2022, 39(2):367-374;402.
[23] 张琳琳, 朱宇竹, 江杨, 等.热改性莱阳芋头淀粉对乳液形成及稳定性的影响[J].食品科学, 2020, 41(6):51-57. ZHANG L L, ZHU Y Z, JIANG Y, et al.Effect of heat-modified starch from Laiyang taro on the formation and stability of emulsions[J].Food Science, 2020, 41(6):51-57.
[24] QI F, WU J, SUN G Q, et al.Systematic studies of Pickering emulsions stabilized by uniform-sized PLGA particles:Preparation and stabilization mechanism[J].Journal of Materials Chemistry B, 2014, 2(43):7605-7611.
[25] SAARI H, HERAVIFAR K, RAYNER M, et al.Preparation and characterization of starch particles for use in Pickering emulsions[J].Cereal Chemistry, 2016, 93(2):116-124.