吡咯喹啉醌(pyrroloquinoline quinine,PQQ)是目前已知催化效率最高的氧化还原辅酶[1],最早在细菌细胞中发现[2],随后的研究表明其在哺乳动物体内起到很重要的作用[3-4],日本的研究者认为PQQ符合维生素的特征,主张将其列为一种新的B族维生素[5]。目前的研究发现,PQQ具有促进细胞增殖[6]、促进神经生长因子合成[7]、抗氧化作用[8-9]、保护大脑[10]、保护心脏[11]、保护肝脏[12-13]、抑制淀粉样蛋白原纤化[14]等多种生理功能。目前的研究还没有发现动物和人类能够自身合成PQQ,可以认为动物和人类体内的PQQ都来源于细菌,但是动物和人类的肠道细菌不能合成PQQ或者合成量极少,无法满足自身需要,因此,动物和人类都需要从食物中摄取PQQ。因其具有多种积极的生理作用,PQQ已被美国FDA和欧盟食品安全局批准为一种安全的膳食补充剂[15],具有良好的开发前景。
PQQ的生产方法主要有化学合成法和微生物发酵法,其中,化学合成法是早期使用的生产方法,因其反应步骤多,生产成本高,现在已被淘汰。目前PQQ的生产方法主要是微生物发酵法,能大量合成PQQ的微生物主要有甲基杆菌属(Methylobacterium)、甲基单胞菌属(Methylomonas)、食甲基菌(Methylovorus)、黄色杆菌属(Xanthobacter)、生丝微菌属(Hyphomicrobium)等。而发酵工业上应用较多的是以生丝微菌属(Hyphomicrobium)作为生产菌种,以甲醇作为发酵碳源,以补料分批发酵法作为常用的发酵方法[16-17]。有学者通过发酵动力学的研究表明,生丝微菌发酵产PQQ属于生长部分偶联型发酵,较长的稳定期有利于提高PQQ的产量;生丝微菌分批培养过程的甲醇消耗动力学模型表明,甲醇大部分用于菌体生长,少部分用于PQQ合成,极少部分用于维持菌体的自身代谢需求,致使菌体生长稳定期很短,PQQ产量较低,分批补料培养过程中应该控制菌体的生长速率[18]。
因为生丝微菌发酵产PQQ属于生长部分偶联型发酵,PQQ的生物合成都会伴随着菌体生长,菌体生长由少到多是一个连续不断的过程,菌体浓度会不断增加,因此PQQ补料分批发酵法稳定期较短,制约了PQQ发酵产量的进一步提高。根据生丝微菌生长部分偶联型发酵产PQQ的特点,可以考虑用连续发酵的方法来提高其发酵产量,赵子刚等[19]开创性的使用了半连续发酵的方法生产PQQ,维持菌体浓度在合适的范围,延长了稳定期,提高了PQQ发酵产量。本文将进一步研究采用单级连续发酵法生产PQQ的方法。
1 材料与方法
1.1 菌种
生丝微菌(Hyphomicrobium sp.)DSM1869,北大医药重庆大新药业股份有限公司保藏菌种。
1.2 培养基配方
基础发酵培养基配方:(NH4)2SO4 3.0 g/L,NaH2PO4·12H2O 3.0 g/L,K2HPO4 1.4 g/L,MgSO4·7H2O 1.0 g/L,CaCl2·2H2O 21 mg/L,ZnSO4·7H2O 15.75 mg/L,FeSO4·7H2O 5.25 mg/L,MnSO4·4H2O 3.15 mg/L,CuSO4·5H2O 0.525 mg/L,NaCl 1.05 mg/L,(NH4)6Mo7O24·4H2O 21 μg/L,KI 21 μg/L,CoCl2·6H2O 21 μg/L,H3BO3 21 μg/L。
斜面培养基配方:在基础发酵培养基配方中添加20 g/L的琼脂,配制好后灭菌,冷却到60 ℃左右,再加入20 mL/L的甲醇摇匀,摆成斜面冷却待用。
种子培养基配方:将基础发酵培养基灭菌后添加10 mL/L的甲醇即为种子培养基。
1.3 仪器与设备
GUJS-5型发酵罐、GUJS-50型发酵罐,镇江东方生物工程设备技术有限责任公司;UV2400型紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;SBA-40D型生物传感分析仪,山东省科学院生物研究所;LC-2010CHT型高效液相色谱仪,岛津公司。
1.4 实验方法
1.4.1 种子培养
将保藏的生丝微菌菌种接种于斜面培养基,在29~31 ℃的培养箱中培养144~192 d;从斜面接种到种子瓶,种子瓶在29~31 ℃、250 r/min的摇床上培养40~48 h;将种子瓶中的种子液按照1%的比例接种到5 L种子罐中,种子罐装量为3 L,种子罐的培养条件:罐温29~31 ℃,通气量3 L/min,搅拌转速200 r/min,培养周期40~48 h。
1.4.2 补料分批发酵培养
将种子罐中的种子液按照10%的比例接种到50 L发酵罐中,发酵罐初始装量为30 L,补料分批发酵的培养条件:罐温29~31 ℃,通气量1 200~1 800 L/h,搅拌转速100~600 r/min,通过调整通气量和搅拌转速控制发酵液中的溶氧值在30%以上,通过补氨水控制发酵液的pH值在6.8~7.0,发酵周期264 h。补料分批发酵的补甲醇工艺:发酵罐接种后就开始用蠕动泵连续补料甲醇,每隔8 h取样用生物传感分析仪测定发酵液中的甲醇含量,根据测得的甲醇含量调整蠕动泵的补料速度,将发酵液中的甲醇质量浓度控制在0.1~1.0 g/L。
1.4.3 单级连续发酵培养
在补料分批发酵进行到一定阶段时,转到单级连续发酵,用蠕动泵以一定的速率分别补入甲醇、氨水和基础发酵培养基,同时用蠕动泵以一定的速率从罐底部的放料阀门连续放料,收集放料的发酵液送去提取工序。调整各补料和放料的速率,保持发酵罐体积不变,即实现单级连续发酵培养。
1.5 分析方法
1.5.1 发酵液中菌体浓度的检测
因为PQQ的发酵培养基由甲醇、可溶性的无机盐和微量维生素组成,无色透明,另外PQQ的发酵菌种生丝微菌为球状细菌,所以检测发酵液在一定波长下的光密度值即可代表发酵液中的菌体浓度。如有必要将发酵液样品适当稀释,以纯水作为对照,用分光光度计测定其在波长600 nm下的光密度值(OD600)。
1.5.2 发酵液中PQQ质量浓度的检测
发酵液中PQQ质量浓度的检测采用高效液相色谱法,将发酵液样品5 000 r/min离心10 min,取上清液用0.22 μm的微孔滤膜过滤,滤液进样HPLC测定。色谱条件为,色谱柱:Waters XBridge C18 Column(4.6 mm×150 mm,5 μm);流动相:甲醇(A)-水(B,用三氟乙酸调节pH值至1.0);洗脱条件(表1);流速1.0 mL/min;柱温25 ℃;检测波长365.8 nm;进样量10 μL[20]。
表1 洗脱条件
Table 1 Elution conditions

t/min溶剂A体积分数/%溶剂B体积分数/%洗脱 0~2.0595等度2.0~2.15→9595→5梯度2.1~15955等度
2 结果与分析
2.1 PQQ补料分批发酵
PQQ补料分批发酵实验中发酵液初始体积为30 L,发酵264 h结束发酵放罐,放罐发酵液的发酵单位为1 588 mg/L,放罐体积约35 L,共消耗碳源甲醇6 620 mL。每天的发酵单位、OD600值和补料的甲醇体积如表2所示。
2.2 PQQ补料分批发酵的过程分析
将表2中的发酵单位、OD600值绘制成发酵增长曲线,如图1所示。整个补料分批发酵的周期较长,共264 h,发酵前期(0~120 h),菌体生长较慢,消耗了大量的时间用于将菌体增殖到较高的浓度;发酵中期(120~192 h),发酵液OD600值达到40左右时,发酵单位的增长速度是最快的;发酵后期(192~264 h),发酵液OD600值增加到50以上后,发酵单位增长逐渐停滞。
表2 PQQ补料分批发酵每天OD600值、发酵 单位和碳源甲醇补料量
Table 2 Date of PQQ fed-batch fermentation
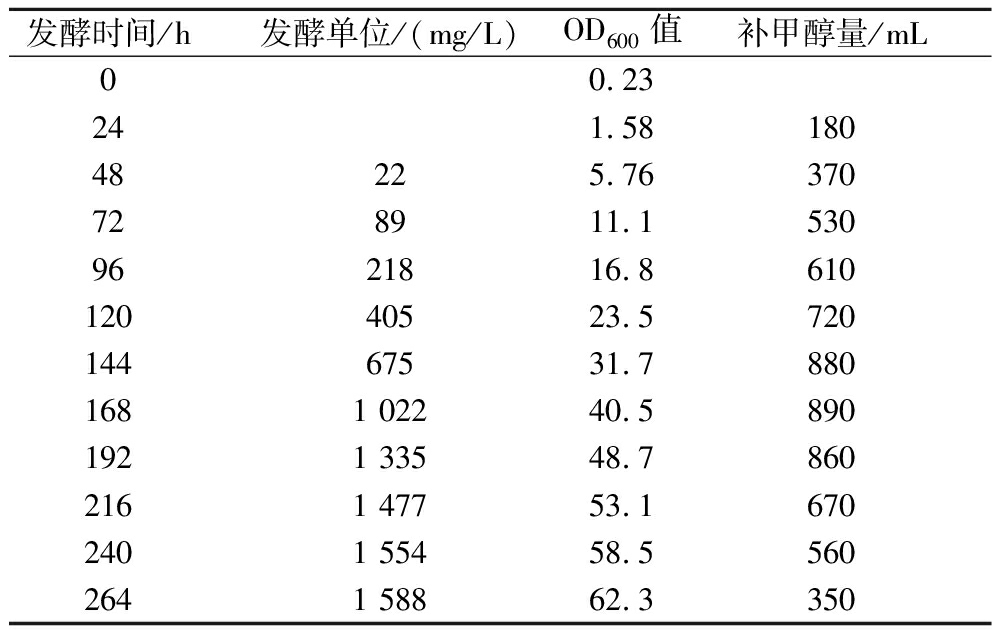
发酵时间/h发酵单位/(mg/L)OD600值补甲醇量/mL00.23241.5818048225.76370728911.15309621816.861012040523.572014467531.78801681 02240.58901921 33548.78602161 47753.16702401 55458.55602641 58862.3350
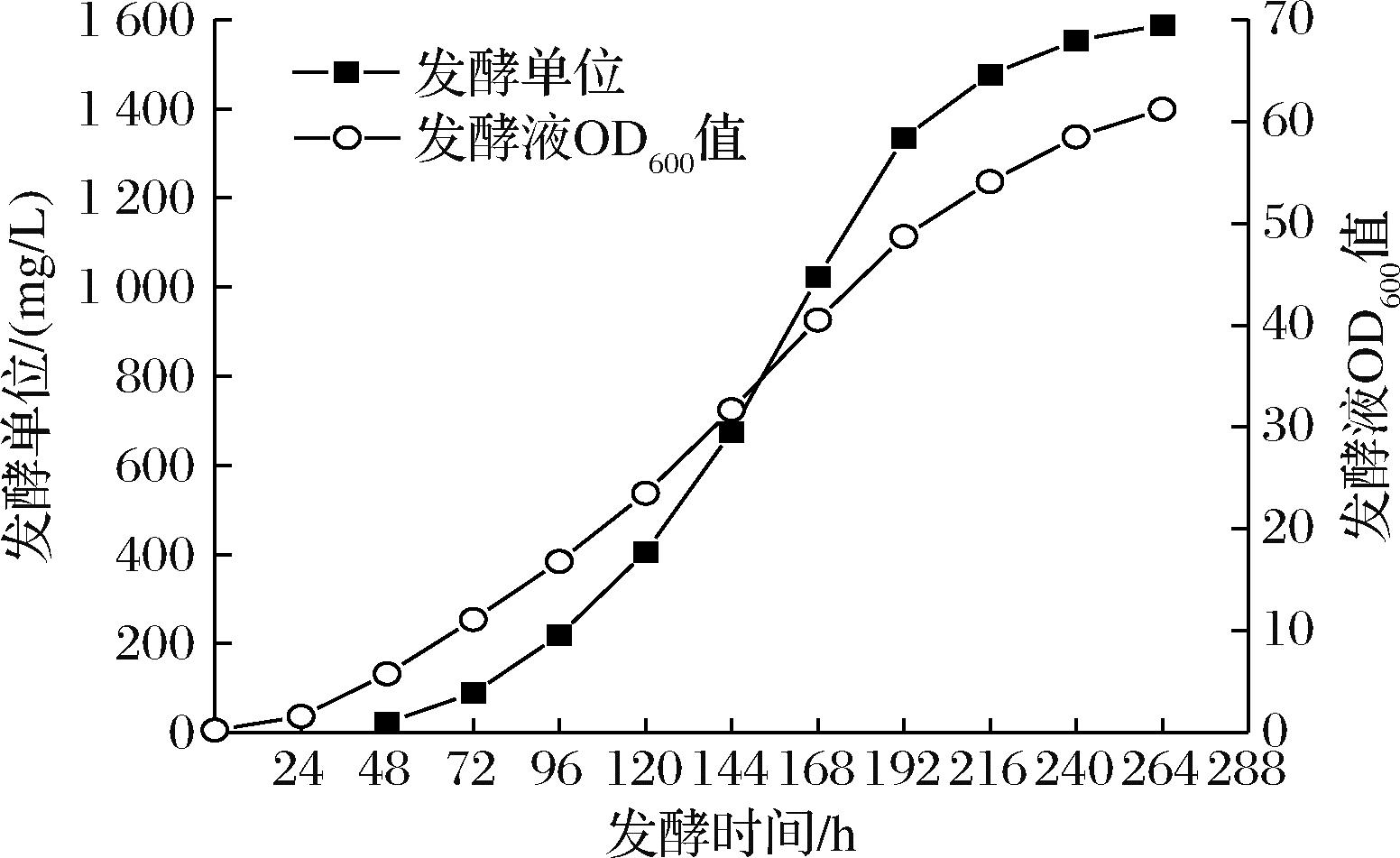
图1 PQQ补料分批发酵的发酵液OD600值和 发酵单位增长曲线
Fig.1 OD600 and PQQ concentration curve of PQQ fed-batch fermentation
PQQ补料分批发酵PQQ产量和甲醇消耗量,如图2所示。在发酵前期和后期,PQQ的生产效率低,而且甲醇单耗较高;在发酵中期144~192 h,PQQ的生产效率高,同时甲醇单耗最低。PQQ发酵生产的原料成本主要来自于甲醇,如果能将发酵周期中144~192 h的发酵液最佳生产状态延长,不仅能够提高PQQ生产效率,还将降低碳源甲醇的单位消耗,从而降低生产成本。
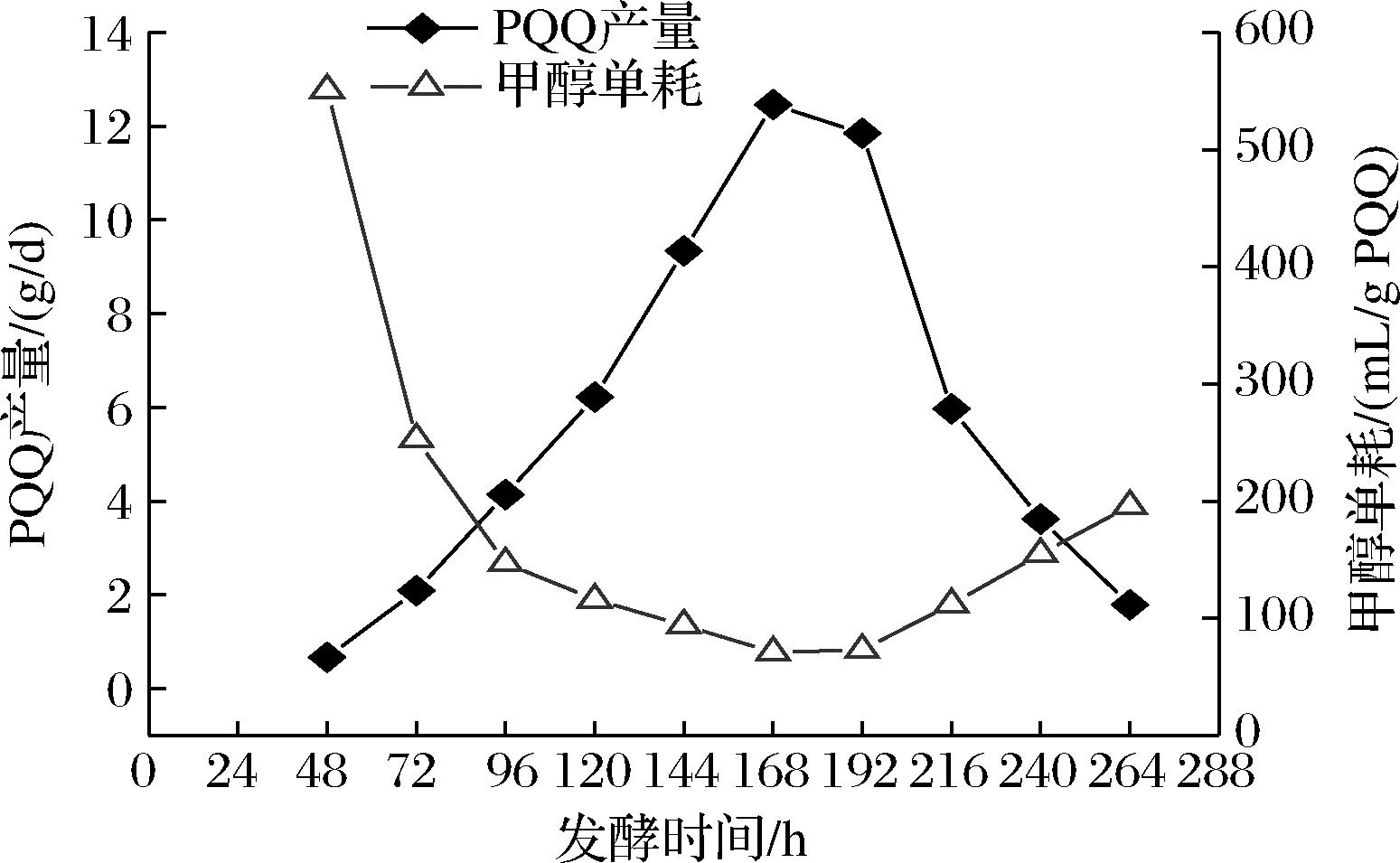
图2 PQQ补料分批发酵PQQ产量和甲醇消耗量
Fig.2 PQQ yield and methanol consumption of PQQ fed-batch fermentation
2.3 PQQ连续发酵
根据以上对PQQ补料分批发酵的分析考虑用连续发酵的方式来延长最佳生产状态,综合考虑,以补料分批发酵168 h时为连续发酵的起点(发酵液OD600值40.5,PQQ的质量浓度为1 022 mg/L),通过计算稀释率用蠕动泵以一定的速率连续补入甲醇、氨水和基础发酵培养基,同时用蠕动泵以一定的速率从发酵罐底部连续放出发酵液。
在连续发酵过程中,底物的补加速率会显著影响菌体的生长和产物的生产,因此稀释率是连续发酵的一个重要影响因素。在PQQ补料分批发酵中,发酵后期PQQ的产量下降,甲醇转化率也下降,分析有两个可能的原因,一个可能的原因是由于菌体不停增殖,菌体浓度过高导致菌体衰亡,造成PQQ的生产能力下降;另一个可能的原因是由于产物PQQ的质量浓度不断增高引起了反馈抑制,造成PQQ的生产能力下降。针对这两个可能的原因,就有两种稀释率方案,一种是恒浊法的稀释率,即维持发酵液菌体浓度(OD600值)恒定,以延缓菌体衰老;另一种是产物恒化法的稀释率,即维持发酵液中产物PQQ的质量浓度(发酵单位)恒定,以解除产物反馈抑制。
2.3.1 恒浊法连续发酵
PQQ的恒浊法连续发酵培养中,先沿用补料分批发酵工艺将发酵液培养到168 h,再转为恒浊法连续发酵培养,即通过额外补料基础发酵培养基对发酵液进行稀释,使发酵液中菌体浓度保持恒定。补料总速率按照以下步骤计算:
首先按照表2中的数据计算补料分批发酵在144~192 h的菌体比生长速率,近似为168 h时的菌体比生长速率,如公式(1)所示:
(1)
式中:μ,比生长速率,h-1;x,发酵液的OD600值;t,发酵时间,h。
由于要使菌体浓度维持恒定,则单级恒浊法连续发酵中,菌体的比生长速率和稀释率相等[21],如公式(2)所示:
![]()
(2)
式中:D,稀释率,h-1;F,料液流速,L/h;V,培养体积,L。
补料分批发酵到168 h时,发酵液体积为34.2 L,因此可以计算恒浊法的补料总速率,如公式(3)所示:
F=D×V=0.008 7 h-1×34.2 L=0.297 L/h
(3)
恒浊法连续发酵实验前期的工艺与补料分批发酵完全相同,到168 h时补碳源甲醇的速率为37.5 mL/h,补氨水的速率为3.5 mL/h,因此在恒浊法连续发酵开始时补甲醇和补氨水的速率不变,另外以256 mL/h的速率用蠕动泵连续补基础发酵培养基到罐中,以297 mL/h的速率用蠕动泵从罐底连续放料,连续发酵312 h后,PQQ的日产量下降明显,于是结束连续发酵放罐。发酵总过程持续了480 h,共消耗碳源甲醇15 960 mL,恒浊法连续发酵过程中OD600值和发酵单位增长情况如图3所示。
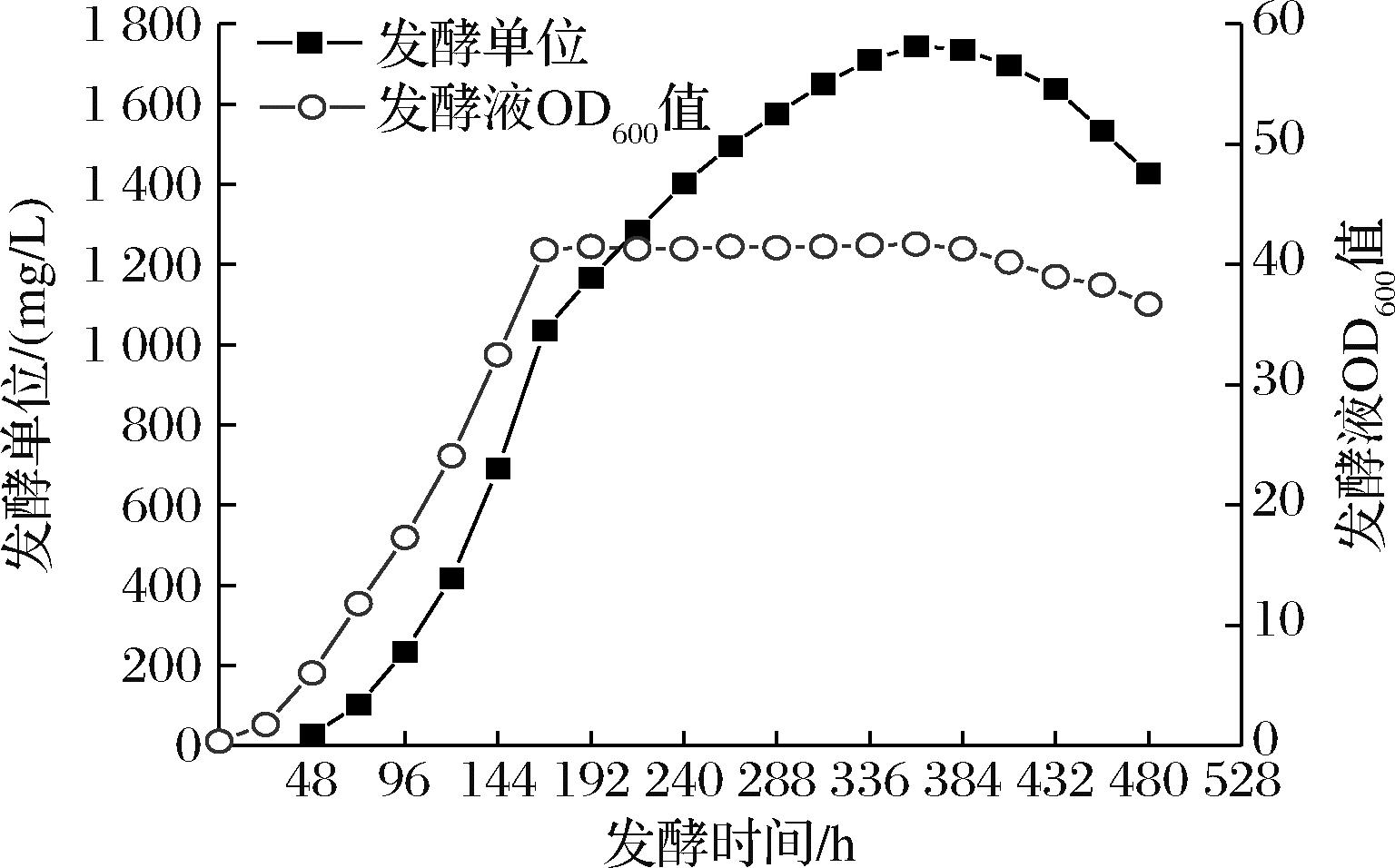
图3 PQQ恒浊法连续发酵中发酵液OD600值 和发酵单位增长曲线
Fig.3 OD600 and PQQ concentration curve of PQQ turbidostat
PQQ恒浊法连续发酵PQQ产量和甲醇消耗量,如图4所示。
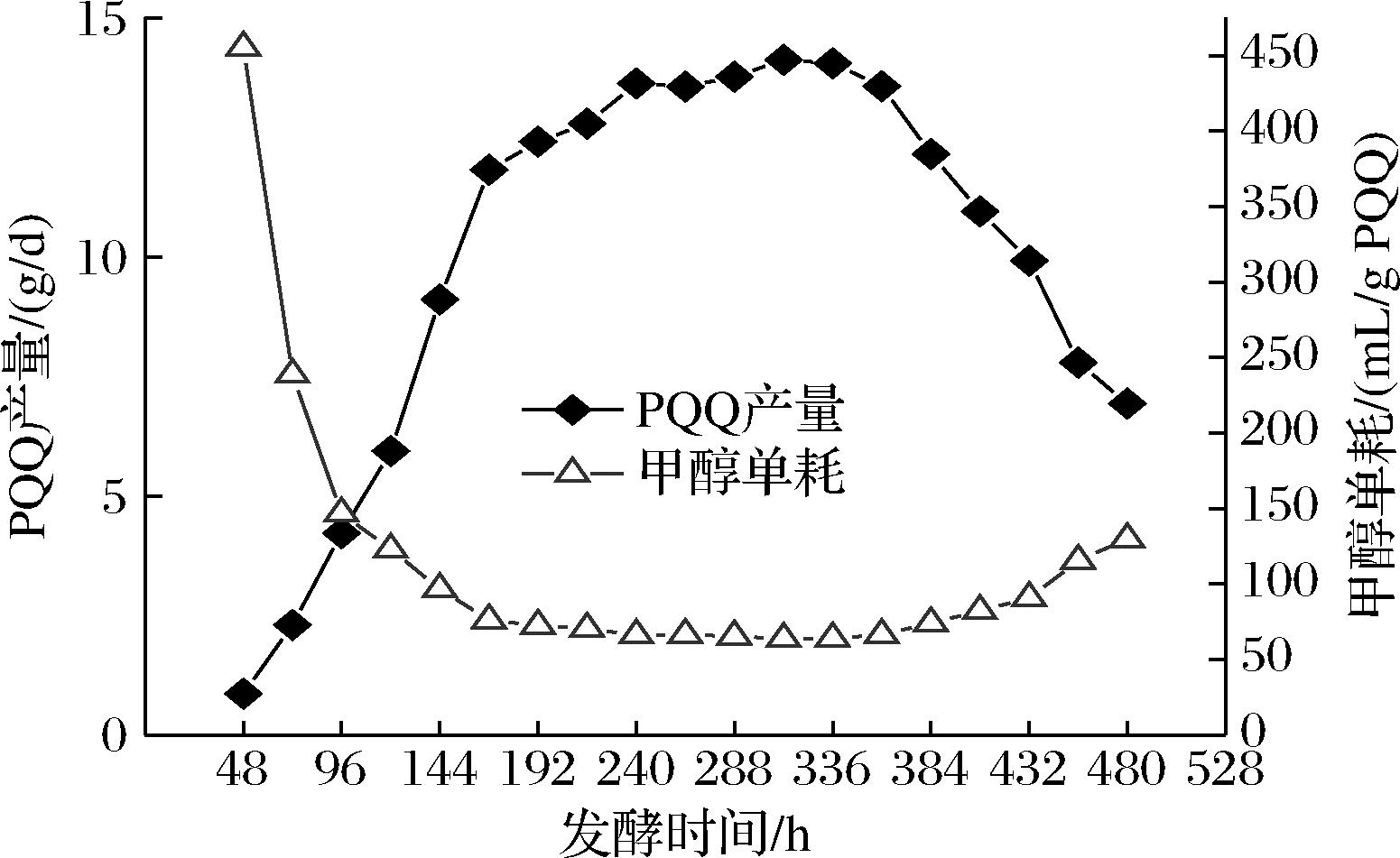
图4 PQQ恒浊法连续发酵PQQ产量和甲醇消耗量
Fig.4 PQQ yield and methanol consumption of PQQ turbidostat
2.3.2 恒化法连续发酵
本文中的PQQ恒化法连续发酵培养,是将发酵液中的产物PQQ质量浓度保持恒定,先沿用补料分批发酵工艺将发酵液培养到168 h,再转为恒化法连续发酵培养,即通过额外补料基础发酵培养基对发酵液进行稀释,使发酵液中PQQ质量浓度保持恒定。补料总速率按照以下步骤计算:
先按照表2中的数据计算补料分批发酵在144~192 h阶段的比产物生成速率,近似为168 h时的比产物生成速率,如公式(4)所示:
(4)
式中:μρ,比产物生成速率,h-1;ρ,发酵液中产物PQQ的质量浓度,mg/L;t,发酵时间,h。
要维持发酵液中PQQ的质量浓度恒定,则单级恒化法连续发酵中的稀释率应等于比产物生成速率,如公式(5)所示:
(5)
式中:D,稀释率,h-1;F,料液流速,L/h;V,培养体积,L。
补料分批发酵到168 h时,发酵液体积为34.2 L,因此可以计算出恒化法的补料总速率,如公式(6)所示:
F=D×V=0.013 4 h-1×34.2 L=0.458 L/h
(6)
恒化法连续发酵实验前期的工艺也与补料分批发酵完全相同,到168 h时补碳源甲醇的速率为37.5 mL/h,补氨水的速率为3.5 mL/h,因此在恒化法连续发酵开始时补甲醇和补氨水的速率不变,另外以417 mL/h的速率用蠕动泵连续补基础发酵培养基到罐中,以458 mL/h的速率用蠕动泵从罐底连续放料,连续发酵312 h后,发酵液OD600值下降较多,PQQ的日产量逐渐降低,于是结束连续发酵放罐,发酵总过程持续了480 h共消耗碳源甲醇15 370 mL,恒化法连续发酵过程中OD600值和发酵单位增长情况如图5所示。
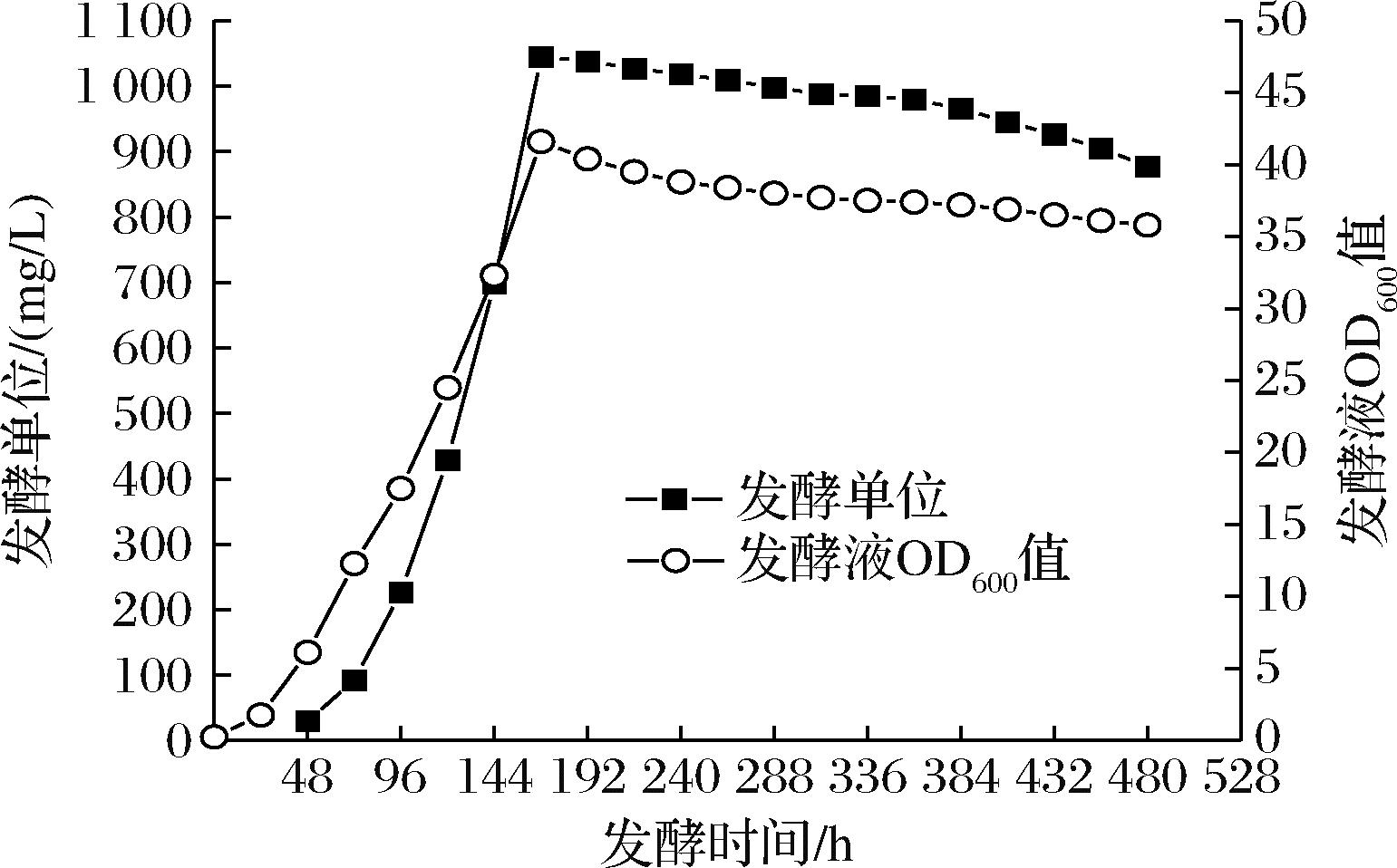
图5 PQQ恒化法连续发酵中发酵液OD600值和 发酵单位增长曲线
Fig.5 OD600 and PQQ concentration curve of PQQ chemostat
PQQ恒化法连续发酵PQQ产量和甲醇消耗量,如图6所示。
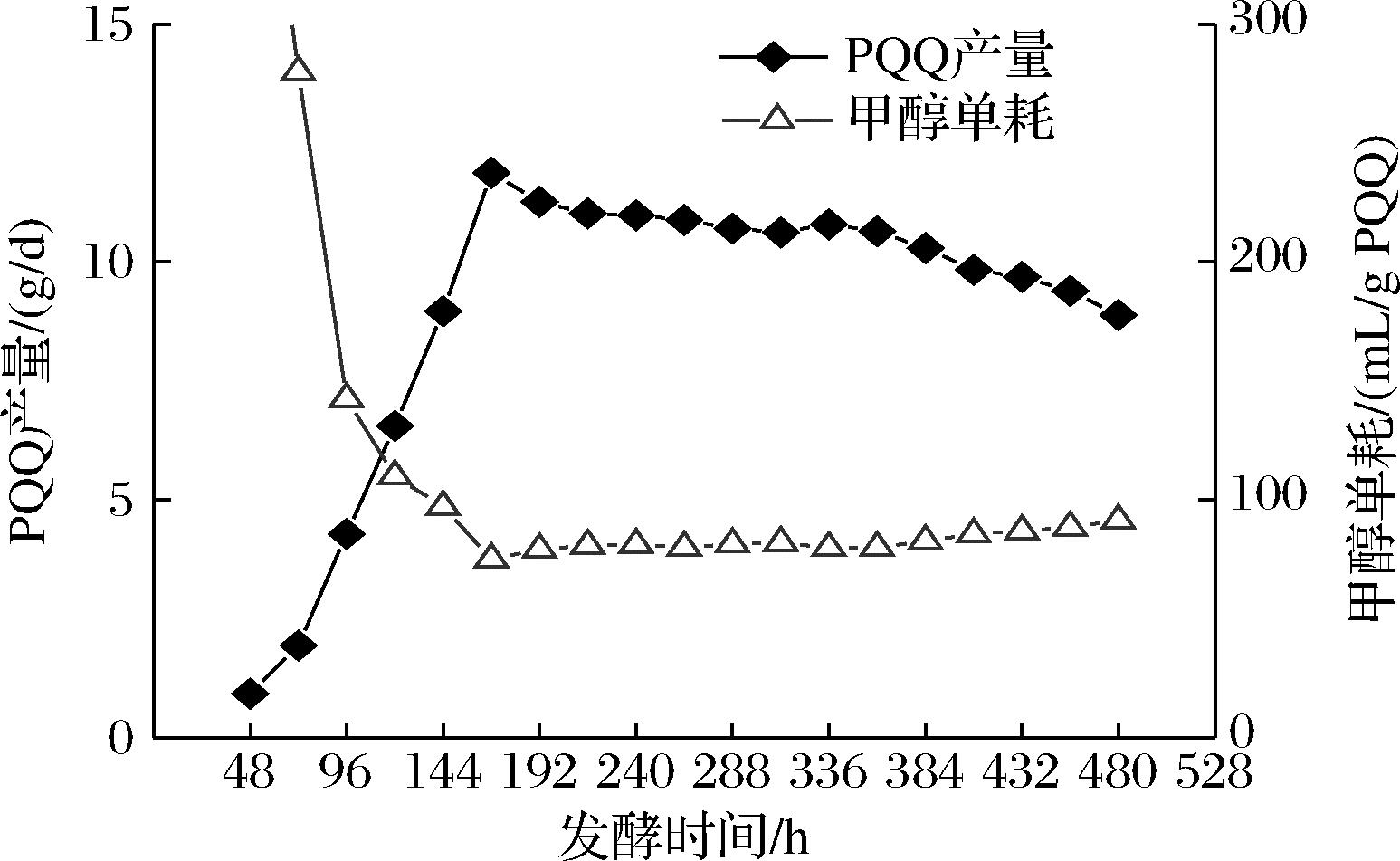
图6 PQQ恒化法连续发酵PQQ产量和甲醇消耗量
Fig.6 PQQ yield and methanol consumption of PQQ chemostat
2.3.3 三种发酵方法的对比
将PQQ的补料分批发酵和恒浊法、恒化法连续发酵的发酵总产量和甲醇总消耗量列于表3中。
根据表3中的数据,得出3种发酵方法的生产效率和甲醇平均转化率,如图7所示。
表3 三种发酵方法的发酵产量和甲醇消耗量
Table 3 PQQ yield and methanol consumption of 3 types of fermentation
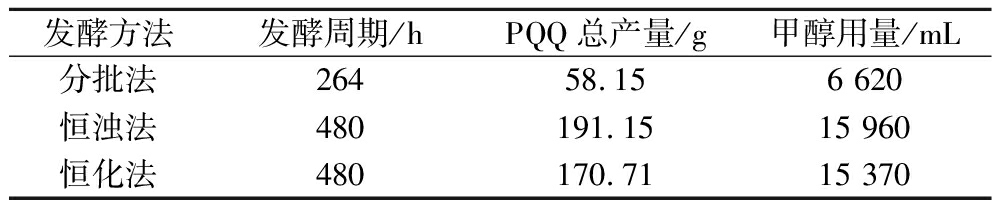
发酵方法发酵周期/hPQQ总产量/g甲醇用量/mL分批法26458.156 620恒浊法480191.1515 960恒化法480170.7115 370
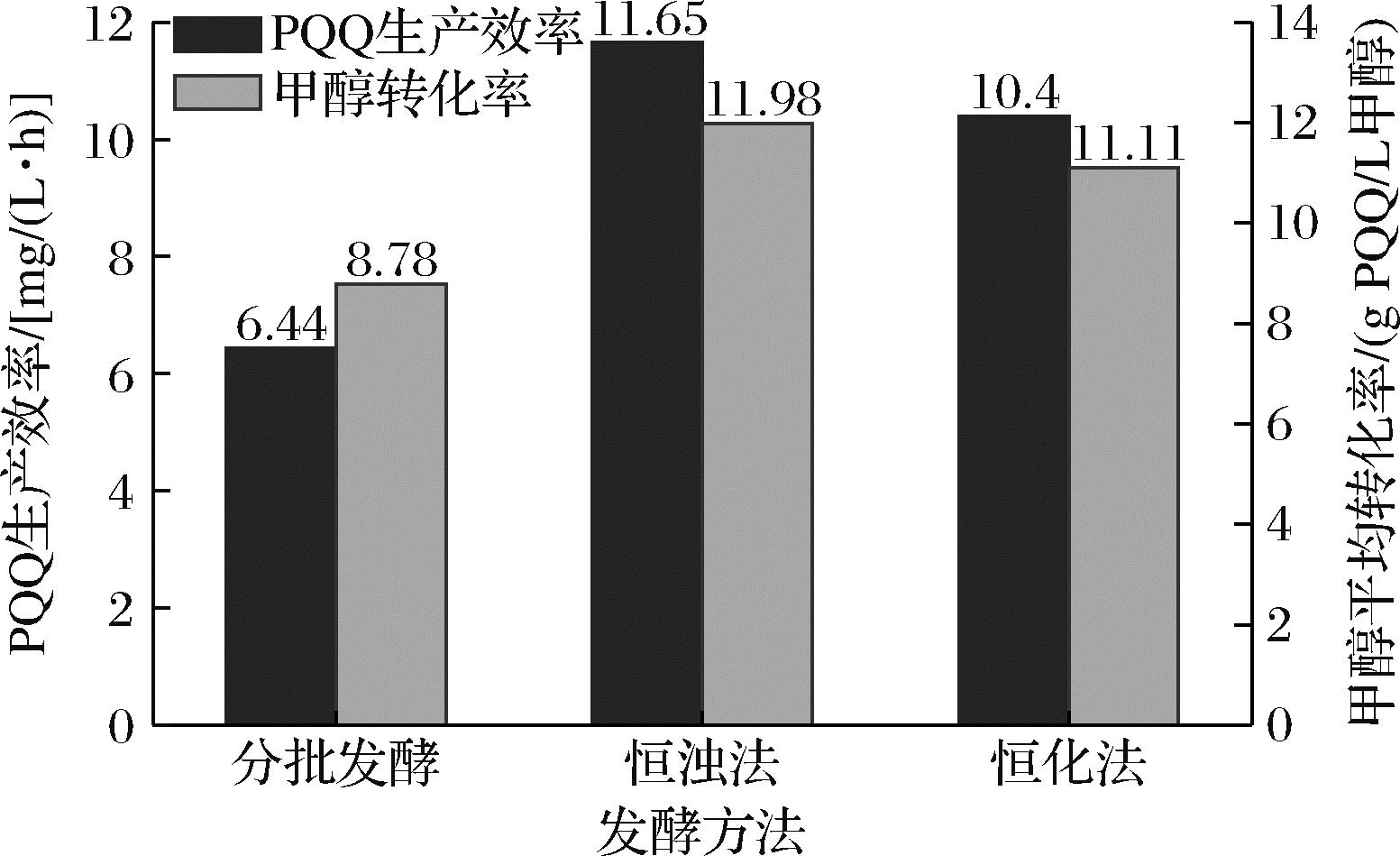
图7 PQQ 3种发酵方法的生产效率和甲醇转化率的对比
Fig.7 PQQ productivity and methanol conversion ratio of 3 types of fermentation
2种PQQ连续发酵方法的生产效率和甲醇平均转化率都远高于PQQ补料分批发酵,其中又以恒浊法连续发酵更优。在恒浊法连续发酵过程中,发酵单位可以达到比分批发酵高的多,说明在补料分批发酵过程中,发酵后期阻碍发酵单位继续增长的主要原因是菌体浓度累积的过高,造成菌体衰亡,而发酵产物PQQ的反馈抑制则是次要原因。在恒化法连续发酵过程中,由于稀释率过大,发酵液OD600值一直在下降,即菌体浓度下降,影响了产PQQ效率。因此用恒浊法连续发酵生产PQQ,可以维持合适的菌体浓度,大大延长了稳定期,从而维持了较高的产PQQ效率,又有部分解除产物抑制的效果,是较优的PQQ发酵方法。
3 结论与讨论
PQQ补料分批发酵过程中,菌体增殖的问题是贯穿始终的,发酵前期需要等待菌体缓慢增殖,该阶段菌体浓度还比较低,所以产PQQ效率也很低;发酵中期,菌体增殖到了合适的浓度,产PQQ效率也达到了高峰;到了发酵后期,由于菌体持续增殖,过高的菌体浓度造成菌体衰亡过快,产PQQ效率又迅速下降;综合来看,PQQ补料分批发酵中,稳定期较短,高效产PQQ期较短,造成整体生产效率较低。
本研究发现,以0.008 7 h-1的稀释率进行PQQ恒浊法单级连续发酵,能够较长时间维持发酵液合适的菌体浓度,延长了稳定期,从而较长时间维持PQQ的高效生产期,大幅提升了整体生产效率。与补料分批发酵相比,该恒浊法连续发酵可以提高PQQ的生产效率(80.7%),同时还提高了底物甲醇的转化率(36.5%),具有良好的工业应用前景。
[1] PAZ M A, FLÜCKIGER R, GALLOP P M.Comment:Redox-cycling is a property of PQQ but not of ascorbate[J].FEBS Letters, 1990, 264(2):283-284.
[2] SALISBURY S A, FORREST H S, CRUSE W B T, et al.A novel coenzyme from bacterial primary alcohol dehydrogenases[J].Nature, 1979, 280(5725):843-844.
[3] KILLGORE J, SMIDT C, DUICH L, et al.Nutritional importance of pyrroloquinoline quinone[J].Science, 1989, 245(4920):850-852.
[4] STEINBERG F, STITES T E, ANDERSON P, et al.Pyrroloquinoline quinone improves growth and reproductive performance in mice fed chemically defined diets[J].Experimental Biology and Medicine, 2003, 228(2):160-166.
[5] KASAHARA T, KATO T.A new redox-cofactor vitamin for mammals[J].Nature, 2003, 422(6934):832.
[6] KIMURA K, TAKADA M, ISHII T, et al.Pyrroloquinoline quinone stimulates epithelial cell proliferation by activating epidermal growth factor receptor through redox cycling[J].Free Radical Biology and Medicine, 2012, 53(6):1239-1251.
[7] LIU S Q, LI H H, OUYANG J P, et al.Enhanced rat sciatic nerve regeneration through silicon tubes filled with pyrroloquinoline quinone[J].Microsurgery, 2005, 25(4):329-337.
[8] HE K, NUKADA H, URAKAMI T, et al.Antioxidant and pro-oxidant properties of pyrroloquinoline quinone (PQQ):Implications for its function in biological systems[J].Biochemical Pharmacology, 2003, 65(1):67-74.
[9] OUCHI A Y, NAKANO M, NAGAOKA S I, et al.Kinetic study of the antioxidant activity of pyrroloquinolinequinol (PQQH(2), a reduced form of pyrroloquinolinequinone) in micellar solution[J].Journal of Agricultural and Food Chemistry, 2009, 57(2):450-456. [10] ZHANG Q, DING M, CAO Z, et al.Pyrroloquinoline quinine protects rat brain cortex against acute glutamate-induced neurotoxicity[J].Neurochemical Research, 2013, 38(8):1661-1671.
[11] TAO R, KARLINER J S, SIMONIS U, et al.Pyrroloquinoline quinone preserves mitochondrial function and prevents oxidative injury in adult rat cardiac myocytes[J].Biochemical and Biophysical Research Communications, 2007, 363(2):257-262.
[12] JONSCHER K R, STEWART M S, ALFONSO-GARCIA A, et al.Early PQQ supplementation has persistent long-term protective effects on developmental programming of hepatic lipotoxicity and inflammation in obese mice[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2017, 31(4):1434-1448.
[13] WU Y H, ZHAO M L, LIN Z H.Pyrroloquinoline quinone (PQQ) alleviated sepsis-induced acute liver injury, inflammation, oxidative stress and cell apoptosis by downregulating CUL3 expression[J].Bioengineered, 2021, 12(1):2459-2468.
[14] KIM J, KOBAYASHI M, FUKUDA M, et al.Pyrroloquinoline quinone inhibits the fibrillation of amyloid proteins[J].Prion, 2010, 4(1):26-31.
[15] TURCK D,JEAN-LOUIS B, BURLINGAME B,et al.Safety of pyrroloquinoline quinone disodium salt as a novel food pursuant to regulation (EC) No 258/97[J].EFSA Journal, 2017, 15(11):e05058.
[16] 张静, 刘孟粟, 秦志杰, 等.吡咯喹啉醌高产菌株选育及发酵优化[J].食品与发酵工业, 2022, 48(16):56-64. ZHANG J, LIU M S, QIN Z J, et al.Breeding and fermentation optimization of high titer pyrrorole-quinoline quinone strain[J].Food and Fermentation Industries, 2022, 48(16):56-64.
[17] 郑玲辉, 杜敏娜, 朱小容, 等.一种生丝微菌和吡咯喹啉醌的制备方法:中国, CN106282044A[P].2019-10-29. ZHENG L H, DU M N, ZHU X R, et al.A preparation method of Hyphomicrobium and pyrroloquinoline quinone:China, CN106282044A[P].2019-10-29.
[18] 柯崇榕. 吡咯喹啉醌的高产菌株选育、发酵制备及生物合成途径的研究[D].福州:福建师范大学, 2016. KE C R.Breeding, preparation and biosynthetic pathway analysis of pyrroloquinoline quinone[D].Fuzhou:Fujian Normal University, 2016.
[19] 赵子刚, 张葵.半连续发酵工艺生产吡咯喹啉醌的方法:中国, CN109628509B[P].2022-05-10. ZHAO Z G, ZHANG K.A semi-continuous fermentation process for producing pyrroloquinoline quinone:China, CN109628509B[P].2022-05-10.
[20] 魏静远, 李大攀, 赵炜楠, 等.高效液相色谱法分析吡咯喹啉醌[J].生物技术通讯, 2015, 26(2):241-244. WEI J Y, LI D P, ZHAO W N, et al.Determination of pyrroloquinoline quinine by high performance liquid chromatography[J].Letters in Biotechnology, 2015, 26(2):241-244.
[21] 叶勤. 发酵过程原理[M].北京:化学工业出版社, 2005:47. YE Q.Principles of Fermentation Process[M].Beijing:Chemical Industry Press, 2005:47.