还原糖与氨基酸参与的美拉德反应产生了包括香味成分在内的大量产物,根据反应条件的不同,美拉德反应产物风味也随之改变,其中2,3-二氢-3,5-二羟基-6-甲基-4(H)吡喃-4-酮(2,3-dihydro-3,5-dihydroxy-6-methyl-4H-pyran-4-one,DDMP),是美拉德反应极其重要的中间体之一,对美拉德反应的调控起到关键作用。对DDMP的研究始于二十世纪60年代末。1967年,TATUM等[1]报道了橙汁粉中存在的一种呋喃烯醇酮化合物,同年,SHAW等[2]在己糖酸降解产物中也发现了这种化合物。但直到1970年,MILLS等[3]对该化合物进行核磁、质谱表征,才证实了TATUM和SHAW所报道的是同一种化合物,并将其结构更正为2,3-dihydro-3,5-dihydroxy-6-methyl-4H-pyran-4-one(图1)。随后,在众多的天然和加工食品中也不断发现DDMP的存在。由于DDMP具有广泛的生理活性,降解产物对食品风味及安全性有重要的影响,作为香料前体物和药物具有良好的开发前景,近年来受到了极大的关注。
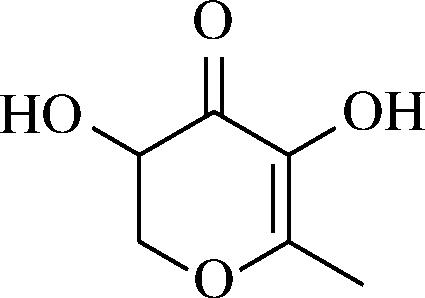
图1 DDMP结构
Fig.1 Structure of DDMP
1 DDMP的存在
DDMP广泛存在于天然食品、加工食品和一些药用植物及中药材中。GURAV等[4]利用GC-MS对印度花椒果实的甲醇提取物进行鉴定,无论是成熟还是完熟的花椒果实中均含有一定量的DDMP,且完熟的花椒果实中DDMP含量更高。SIDDEEG等[5]通过GC-MS分析了椰枣的挥发性成分,其中DDMP含量接近10%,可能是椰枣中抗氧化的关键成分。ALI等[6]比较了5个品种芒果果皮提取物成分差异,以及抗氧化和抗增殖活性,发现DDMP是芒果皮中主要的活性成分,在治疗人类宫颈癌以及作为抗氧化剂在食品和医药工业中有潜在的应用。PADMASHREE等[7]在旋花科植物海南薯中发现DDMP。研究者们从食用担子菌日本白雪茸中分离得到了DDMP,通过HPLC法测得其含量为3.5 mg/g,活性测试结果表明,DDMP为白雪茸中主要的抗氧化活性物质之一[8-9]。陈凡等[10]对番石榴果进行提取得到了芳香浸膏,并采用GC-MS对芳香浸膏进行成分分析, 鉴定出了5-羟甲基糠醛(71.47%)、DDMP(6.44%)、糠醛(4.69%)、乙酸(2.54%)、庚酸(1.70%) 等为番石榴浸膏的主要成分。RODRIGUEZ等[11]利用超临界CO2萃取对牛蒡根进行提取,并利用GC-MS对提取物进行分析,结果显示牛蒡提取物中的主要成分为邻苯二甲酸二异辛酯、DDMP、甘油和十五醛。
食品的热加工过程也会大量积累DDMP。BIN等[12]对全麦面包中苦味成分进行了研究,鉴定出了包括DDMP在内的8种化合物,其中DDMP的含量与面包皮中的感知苦味呈极显著相关(α=0.01),推测其为全麦面包苦味的主要呈味物质。PEREIRA等[13]发现咖啡湿加工过程会产生DDMP。SUN等[14]发现DDMP存在于经过热加工的大蒜油中。QIN等[15]利用GC-MS对玫瑰茶的挥发性成分进行分析,发现DDMP 含量仅次于苯乙醇和丁香酚,是玫瑰茶中的主要成分之一。LASEKAN[16]对油莎草油进行GC-MS分析,共鉴定出包括DDMP在内的75种气味活性挥发物,通过风味稀释因子和气味活性值对香气贡献进行量化,发现DDMP对油莎草油的香气有重要贡献。HWANG等[17]从加热过的洋葱中分离鉴定出了DDMP,并对其进行了抗氧化活性测试;HWANG等[18]又利用活性跟踪的手段,从经过热处理的沙梨果汁的乙酸乙酯提取部分分离鉴定出了DDMP。吕姗等[19]考察不同烘焙温度对大枣品质的影响,发现随着烘焙温度的升高,DDMP含量也不断提高,QIAO等[20]、SONG等[21]建立了顶空固相微萃取-气相色谱-串联质谱分析法,对烘焙红枣中的DDMP含量进行了测定,该方法标准曲线在0.01~100 μg/mL呈线性,检测限为0.1 ng/g,所测定的5种烘焙红枣中DDMP含量在4.55~46.50 μg/g。
在药用植物中也发现了DDMP的存在,一些中药材在炮制过程也会产生DDMP。RAGUPATHI RAJA KANNAN等[22]利用GC-MS对几种具有药用价值的海草成分进行分析,鉴定出包括DDMP在内的24种化合物,这也是首次发现DDMP存在于海草中。印度葛根是传统上被用作抗衰老保健食品,SHUKLA等[23]对其水提取物肾脏保护作用机制进行了研究,发现其作用是通过水提物中的抗氧化活性化合物抑制氧化应激和细胞凋亡来实现的,而DDMP是葛根水提物中含量最高的成分之一,对其活性起到关键作用。钱晓东等[24]研究加热炮制对不同来源当归药材新产生成分的影响,结果显示,当归加热炮制后,会生成5-羟甲基糠醛和DDMP 两个新的化学成分。
近年报道的部分DDMP来源及潜在功能见表1。
表1 DDMP来源及潜在功能
Table 1 Sources and potential functions of DDMP

序号来源功能文献1印度花椒(Zanthoxylum rhetsa)果实-[4]2椰枣(Phoenix dactylifera)果实抗氧化[5]3海南薯(Ipomoea staphylina)块茎-[7]4番石榴(Psidium guajava)果实-[10]5芒果(Mangifera indica)果皮-[6]6猕猴桃(Actinidia chinensis)果实-[25]7甜菜(Beta vulgaris)根皮抗氧化[26]8蜂蜜 抗氧化[27]9沙拐枣(Calligonum polygonoides)花[28]10牛蒡(Arctium lappa)根抗氧化[11]11日本白雪茸(Basidiomycetes-X)子实体抗氧化[8-9]12酸角(Tamarindus indica)果实心脏保护[29]13全麦面包 -[12]14咖啡-[13]15大蒜油-[14]16玫瑰茶-[15]17油莎草油-[16]18洋葱(热处理)抗氧化[17]19沙梨果汁(热处理)抗氧化[18]20烘焙大枣-[19-21]21可可-[30]22棕榈糖、红糖-[31]23干制西梅抗氧化[32]24油辣椒 -[33]25海草抗菌[22]26印度葛根(Pueraria tuberosa)抗氧化、抗肿瘤[23]27猴蔗西闭鞘姜(Costus afer)茎抗菌[34]28蒺藜(Tribulus terrestris)叶抗菌[35]29鸭嘴花(Adhatoda vasica)叶抗氧化[36]30柳叶木通(Callistemon lanceolatus)叶抗氧化、抗肿瘤[37]31辣木(Moringa oleifera)叶抗菌[38]32钩粉草(Pseuderanthemum palatife-rum)叶抗肿瘤[39]33星苹果(Chrysophyllum cainito)叶细胞周期蛋白依赖性激酶抑制剂[40]34大星果油藤(Plukenetia conophora)抗生殖毒性[41]35印度苦楝(Azadirachta indica)种子抗肿瘤[42]36当归(Angelica sinensis)-[24]
注:-表示文献未提及
2 DDMP的形成与降解
上述天然和加工食品中存在的DDMP,一般认为是通过美拉德反应及Amadori化合物降解产生,大多数研究认为来源于己糖降解,其中1-脱氧葡萄糖醛酮(1-deoxy-D-glucosone,1-DG)是形成DDMP的关键中间体。
ZHOU等[43]研究了固相美拉德反应体系中多种因素对DDMP形成的影响,比较了还原糖(葡萄糖或果糖)和几种氨基酸(L-脯氨酸、L-丙氨酸、L-天冬酰胺、L-苏氨酸、L-酪氨酸和L-赖氨酸)作为原料形成DDMP的反应活性。研究发现,在脯氨酸与葡萄糖反应体系中,DDMP生成量较大,且在葡萄糖与脯氨酸的物质的量比为2∶1时达到最高水平;氧气对DDMP的形成没有明显影响。DDMP形成的动力学研究表明,DDMP在形成的初始阶段为一级反应,其活化能为68.8 kJ/mol。这说明在美拉德反应中,DDMP的形成极大依赖于底物种类(糖、氨基酸)及底物的比例。
1-DG在己糖参与的美拉德反应中作为高活性中间体,对美拉德产物的形成起着重要作用。VOIGT等[44]对1-DG的降解进行研究,发现1-DG在O2存在下,其主要的降解产物为乳酸和甘油酸(图2)。而DDMP能够通过水合作用形成少量的1-DG,且DDMP在O2催化下的降解产物与1-DG完全相同。由此推测在美拉德反应中,糖与氨基酸首先形高活性中间体1-DG,1-DG随后降解形成DDMP。
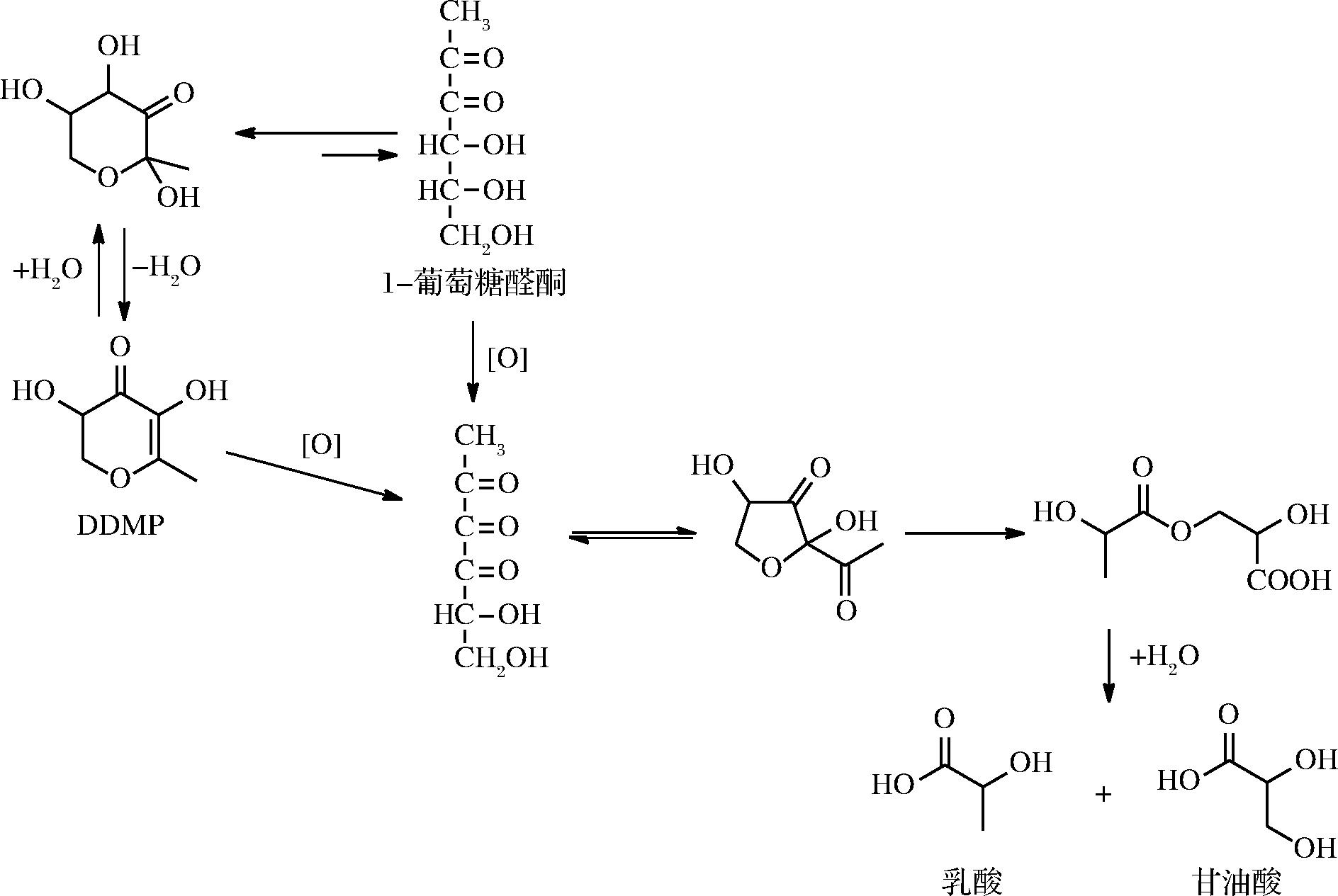
图2 1-DG的降解
Fig.2 Degradation of 1-DG
学者们对基于葡萄糖-氨基酸模型的固相和液相美拉德反应进行了研究,以进一步明确1-DG 形成DDMP的条件(图3)[45-47]。
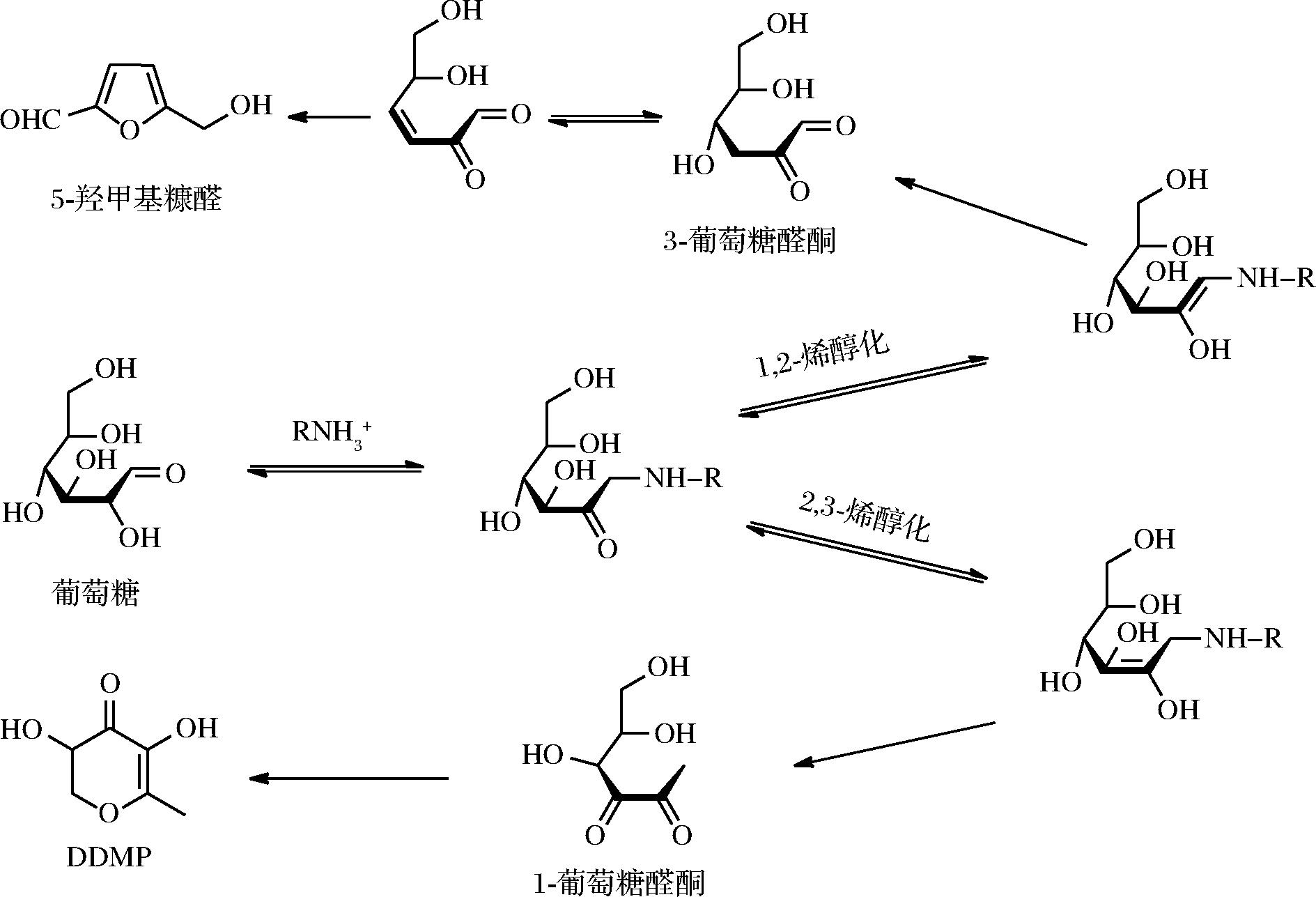
图3 DDMP的形成
Fig.3 Formation of DDMP
结果显示,赖氨酸和脯氨酸分别在液相和固相反应系统中促进了DDMP的产生,这表明反应强度和氨基酸性质是介导DDMP产生的主要因素。通过对DDMP形成的烯醇化前体物进行定量监测,表明其途径为2,3-烯醇化产生1-DG,1-DG进一步转化为DDMP,水分含量较低的条件下易于形成DDMP;相应的,在水分含量较高的体系中,由于2,3-烯醇化转变为1,2-烯醇化,其中间体为3-脱氧葡萄糖醛酮,最终转化为5-羟甲基糠醛。
KIM等[48]认为DDMP也只是美拉德反应的中间产物,为了证实这一点,他们对不同条件下的DDMP热解反应进行了研究,模拟了烘焙和弱酸性水溶液加热2种体系条件,通过同位素标记的方法,检测了DDMP的降解产物。结果表明,DDMP在pH 5.8的水溶液中150 ℃加热1 h,有30%发生降解,生成56种化合物,降解产物中2,3-戊二酮含量最高(19%),其次是2-甲基-3-呋喃酮(15.4%)、1-羟基丙酮(3.9%)等;当DDMP置于220 ℃下加热30 min,鉴定出了13种化合物,主要以5-羟基麦芽酚、麦芽酚、二氢麦芽酚、呋喃酮、2,4-二羟基-2,5-二甲基-3(2H)-呋喃酮等吡喃或呋喃烯醇酮类焦甜香物质为主,结合13C标记位置,可推测其形成途径如下(图4)。
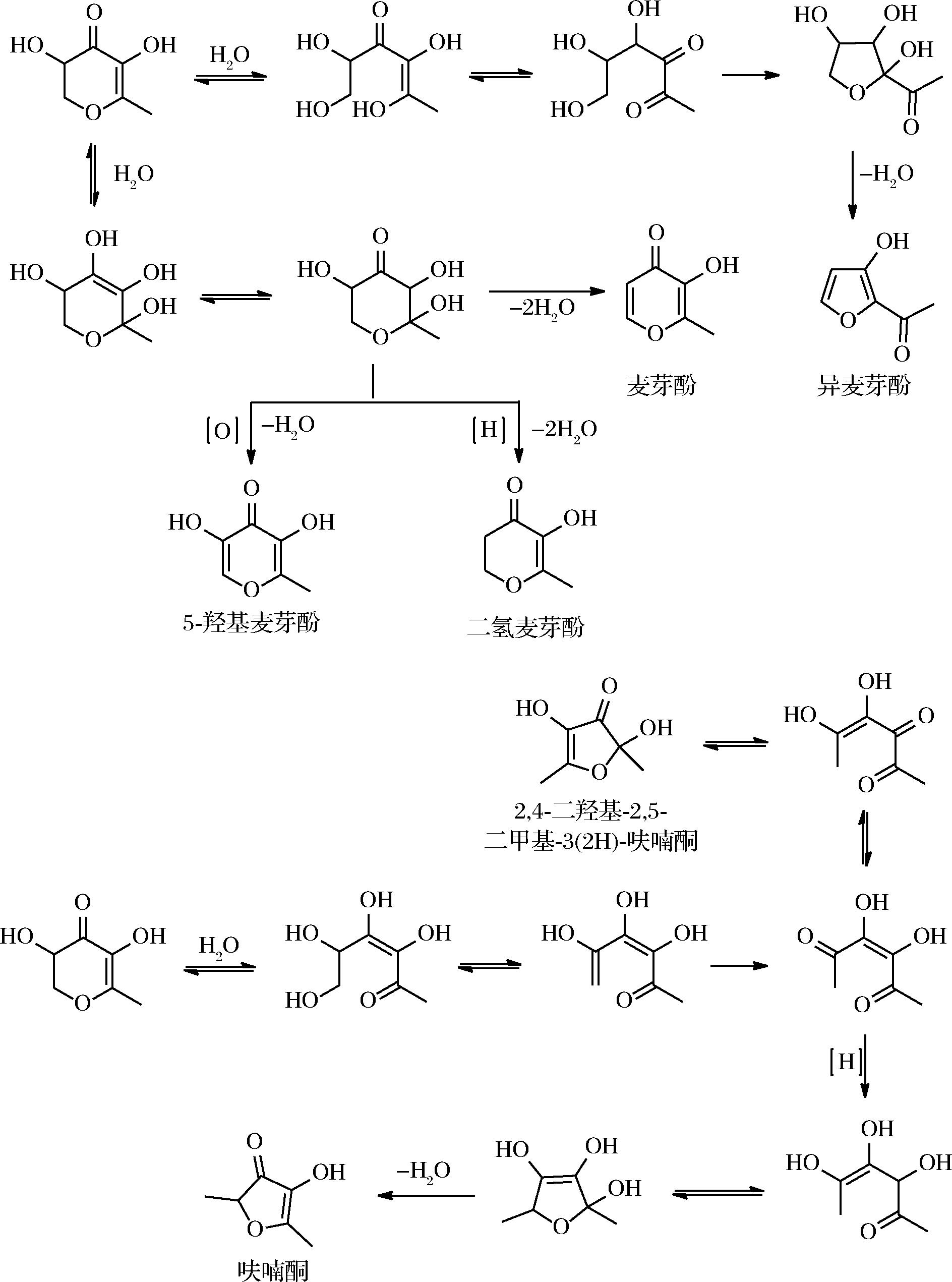
图4 DDMP在220 ℃条件下的降解途径及产物
Fig.4 Degrade pathway and products of DDMP under 220 ℃
由此可见,DDMP在美拉德反应中扮演着中间体的角色,还原糖首先与氨基酸经Amadori重排,继而通过1-DG生成DDMP,氨基酸和糖的种类,反应的湿度条件对DDMP的生成影响较大。而DDMP在氧化剂作用下降解生成小分子酸,在中性高温条件及潮湿酸性条件下可降解生成不同的呋喃、吡喃类风味物质,赋予美拉德反应特有的焦甜香风格。
3 DDMP的生理活性
3.1 抗氧化活性
美拉德反应产物具有广泛的抗氧化活性[49-50],但其中主要的活性化合物尚不完全清楚。YU等[51]对葡萄糖-组氨酸参与的美拉德反应产物的抗氧化物质基础进行了研究。采用Bio-gel P-2聚丙烯酰胺凝胶色谱柱对反应产物进行了分段,并对各段的抗氧化活性进行了评价。结果表明H7组分具有最强的抗氧化活性,通过GC-MS分析和HPLC分析确定了H7中的主要化合物为DDMP。对DDMP清除DPPH自由基、ABTS阳离子自由基能力和还原能力进行了测定,表明DDMP具有强抗氧化活性,对美拉德反应产物的抗氧化活性的贡献最大。
热加工食品由于涉及美拉德反应,在加工过程产生的DDMP同样会对食品的抗氧化能力产生影响。 ECHOVSK
ECHOVSK 等[32]研究了不同干燥温度下处理的西梅的抗氧化能力。结果显示低温干制(60 ℃)对西梅的抗氧化能力影响不明显,而高温(>75 ℃)干制促进西梅抗氧化能力显著提高。进一步研究表明,在高温干制过程中,DDMP含量明显增加,且其增加量和抗氧化能力呈正相关性。
等[32]研究了不同干燥温度下处理的西梅的抗氧化能力。结果显示低温干制(60 ℃)对西梅的抗氧化能力影响不明显,而高温(>75 ℃)干制促进西梅抗氧化能力显著提高。进一步研究表明,在高温干制过程中,DDMP含量明显增加,且其增加量和抗氧化能力呈正相关性。
有学者研究了DDMP结构与抗氧化能力之间的关系,发现当烯醇式羟基被键合后,DDMP失去了抗氧化活性,而当C-3位仲醇羟基被键合后,DDMP仍然保持抗氧化能力,说明DDMP的抗氧化能力与其烯醇酮结构密不可分[52-53]。通过核磁共振氢谱谱图可以看出,DDMP淬灭DPPH自由基按照1∶2的物质的量之比进行,由此推测DDMP抗氧化过程涉及2步反应(图5)。首先,DDMP被氧化为5-羟基-6-甲基-2H-吡喃-3,4-二酮,并迅速异构化为5-羟基麦芽酚,5-羟基麦芽酚继续被氧化,最终降解生成开环产物。通过核磁共振碳谱谱图δ 206~197和δ 174 ~168处的信号,可以看出开环产物主要是酮和酸。这与KANZLER等[54]的研究一致,即DDMP在起到抗氧化作用的同时,自身也被氧化降解为甘油酸和乳酸。

图5 DDMP抗氧化机理
Fig.5 Proposed antioxidant mechanism of DDMP
3.2 抗肿瘤活性
BAN等[55]研究了从洋葱中分离的DDMP通过调节NF-κB活性,从而诱导结肠癌细胞凋亡死亡的作用。结果显示,不同质量浓度的DDMP(0.5~1.5 mg/mL)作用不同时间(0~48 h)均能够抑制结肠癌细胞(SW620和HCT116)的生长,并呈剂量依赖关系。DDMP对肿瘤坏死因子α(TNF-α)和醋酸佛波醇诱导的NF-κB转录和DNA结合活性有调节作用。此外,DDMP也可抑制NF-κB靶向抗凋亡基因,同时诱导凋亡基因的表达。这些结果表明,洋葱中的DDMP通过抑制NF-κB而诱导细胞凋亡,从而起到抑制结肠癌细胞生长的作用。
3.3 神经活性
BEPPU等[56]报道了从戊糖乳杆菌菌株S-PT84培养上清液中分离到3个化合物,并对其对大鼠肾交感神经活性的影响进行了研究。其中DDMP增加大鼠的肾交感神经活性最高,增加量为408%。通过十二指肠注射DDMP可增加棕色脂肪组织交感神经活性[(118±15.3)%],而通过口腔内注射DDMP可使大鼠体温高于肩胛间棕色脂肪组织的温度[(0.72±0.13) ℃]。这些结果表明DDMP可以促进自主神经的活动。
3.4 抑菌活性
血红密孔菌是一种常见于热带及亚热带低中海拔林区的木材腐生菌,其次生代谢产物有很强的抑菌作用,可作为生物活性化合物的潜在来源。TEOH等[57]研究了麦芽提取物、酵母提取物、葡萄糖和麦芽糖作为培养基对血红密孔菌代谢产物抗菌活性的影响,并采用GC-MS分析了该菌提取物中的成分,结果表明DDMP是血红密孔菌发酵液的主要成分,也是起到抑菌作用的主要活性成分。
3.5 心脏保护活性
CORDERO等[30]研究了酸角果实在阿霉素诱导的心脏毒性模型中的心脏保护作用。与阳性对照缬沙坦相比,酸角果实提取物显著(P<0.05)降低了C反应蛋白、血清肌钙蛋白I、天冬氨酸转氨酶、乳酸脱氢酶和肌酐激酶MB、总胆固醇、甘油三酯和低密度脂蛋白含量,并能提高高密度脂蛋白含量。分子对接结果表明,酸角果实主要成分中的DDMP与人血管紧张素II 1型受体有很高的亲和性,说明DDMP是酸角果实中起到心脏保护作用的关键化合物。
4 DDMP感官特性
由于DDMP在热加工食品中广泛存在,其对食品感官上的影响不容忽视,长期以来,对DDMP感官感受一直存在争议。
DDMP属于吡喃烯醇酮类化合物,在结构上与常用焦糖香物质麦芽酚、呋喃酮等类似,具有挥发性,同时兼具较高的脂溶性和水溶性。PITTET等[58]认为,这类具有平面状烯醇-羰基结构的环状二碳基化合物往往具有焦糖样香味,因此DDMP在早期被描述为具有焦糖样气味,但SHAW等[59]通过反复重结晶得到的DDMP几乎没有气味,KIM等[48]也发现DDMP尽管无气味,但加热后会产生焦糖样以及融化的黄油气味。也有研究认为DDMP具有烘焙香气[60]。
随后对DDMP感官特性的研究主要集中在味觉上。周志磊[61]报道了DDMP在水溶液中的甜味阈值为0.25 g/L,并且和卷烟主流烟气的“甜感”呈显著的正相关。而BIN等[12]则认为,DDMP的含量与全麦面包皮中的苦味呈极显著相关,因此被认为是全麦面包皮中主要的苦味呈味物质。LI等[62-64]也认为,DDMP是焦糖化反应以及美拉德反应中的主要苦味物质,一些酚酸类物质如没食子酸、咖啡酸等,可以通过抑制1-DG的氧化降解从而阻止DDMP的生成。
对上述争议进行深入研究可以发现, DDMP感官评价的不确定性主要受所制备的DDMP对照样品纯度的影响。DDMP无商品化来源,其对照样品的制备无论是以葡萄糖为原料合成,还是以食品为原料进行分离得到,均基于美拉德或焦糖化反应,期间有大量的物质包括苦味物质生成,由于DDMP产率极低,在纯化时不可避免会引入苦味杂质。为此,CHEN等[65]以麦芽酚为原料合成了DDMP,避免了复杂的美拉德反应产物生成,感官评价表明,该方法合成的DDMP无任何味觉感受,而通过经典方法合成的DDMP确实有苦味。进一步分析发现,经典方法合成的DDMP通过LH-20凝胶纯化后,苦味消失,说明其苦味主要受美拉德反应所带来的副产物的影响,而纯净的DDMP为无味化合物。
5 DDMP的制备
作为美拉德反应中间体,DDMP的制备可通过美拉德反应实现。经典的合成方法以葡萄糖为原料,并通过二级胺和有机酸催化,使反应停留在DDMP生成阶段;由于美拉德反应产物复杂,DDMP的纯化同样重要。VAN DEN OUWELAND等[66]以葡萄糖为原料,哌啶和乙酸为催化剂,通过连续萃取、柱层析、重结晶等纯化步骤制得了DDMP,最终产率为5%;陈永宽等[67]参照上述合成条件,通过萃取、减压蒸馏、重结晶等步骤得到的DDMP产率为3%。由此可见,DDMP产率不仅受合成条件影响,同时很大程度上受纯化条件影响。
CHEN等[65]以麦芽酚为原料,通过酯化保护、氢化还原、乙酰氧化、酶水解和碱水解5步反应合成了DDMP(图6)。该合成路线的关键在于二乙酰基DDMP的水解,甲醇钠、NaOH、K2CO3、1,8-二氮杂双环[5.4.0]十一碳-7-烯(1,8-diazabicyclo[5.4.0]undec-7-ene,DBU)等常见碱水解体系使得产物极其复杂难以分离。通过对脂肪酶的筛选,确定了利用假丝酵母菌来源的脂肪酶可高效水解3位乙酰基,进而利用弱碱Na2CO3可水解掉5位乙酰基,反应总产率30%左右,利用该方法可获得高纯度DDMP。

图6 DDMP合成路线
Fig.6 Synthesis of DDMP from maltol
6 展望
食品中的美拉德反应以及后续反应非常复杂,在产生风味物质和活性物质的同时,也会产生一些有害物质,因此,对美拉德反应产物进行控制一直是研究的热点[68],但目前为止,尚没有可靠的调控方法,而DDMP作为美拉德反应中的重要中间体,是许多风味物质的前体,或许是美拉德反应调控的关键。目前,尽管已在模型水平上对DDMP形成及降解的影响因素和途径有了初步的研究,但在食品基质中研究尚未开展,因此,未来有必要进一步加强食品基质中DDMP的相关研究,从而更好的指导美拉德反应风味物质的靶向调控。
DDMP具有广泛的抗氧化、心脏保护等作用,作为食品功能添加剂和药物开发有着良好的前景;此外,DDMP受热释放呋喃酮、麦芽酚等香味物质,可作为特色焦甜香香料前体进行开发,应用于卷烟、食品等的缓释加香。目前DDMP产品产率偏低,因此,有必要进一步加强DDMP制备技术研究,以满足作为活性物质和香料开发的需求。
[1] TATUM J H, SHAW P E, BERRY R E.Some compounds formed during nonenzymic browning of orange powder[J].Journal of Agricultural and Food Chemistry, 1967, 15(5):773-775.
[2] SHAW P E, TATUM J H, BERRY R E.Acid-catalyzed degradation of D[J].Carbohydrate Research, 1967, 5(3):266-273.
[3] MILLS F D, WEISLEDER D, HODGE J E.2, 3-dihydro-3, 5-dihydroxy-6-methyl-4-pyran-4-one, a novel nonenzymatic browning product[J].Tetrahedron Letters, 1970, 11(15):1243-1246.
[4] GURAV K, JADHAV (RATHOD) V.Gas chromatography-mass spectrometry analysis of methanol extract of Zanthoxylum rhetsa DC.fruits[J].Asian Journal of Pharmaceutical and Clinical Research, 2018, 11(12):247.
[5] SIDDEEG A, ZENG X N, AMMAR A F, et al.Sugar profile, volatile compounds, composition and antioxidant activity of Sukkari date palm fruit[J].Journal of Food Science and Technology, 2019, 56(2):754-762.
[6] ALI M R, YONG M J, GYAWALI R, et al.Mango (Mangifera indica L.) peel extracts inhibit proliferation of HeLa human cervical carcinoma cell via induction of apoptosis[J].Journal of the Korean Society for Applied Biological Chemistry, 2012, 55(3):397-405.
[7] PADMASHREE M S, ASHWATHANARAYANA R, NAIKA R, et al.Antioxidant, cytotoxic and nutritive properties of Ipomoea staphylina Roem &Schult.plant extracts with preliminary phytochemical and GCMS analysis[J].Asian Journal of Pharmacy and Pharmacology, 2018, 4(4):473-492.
[8] SAKAMOTO T, LI Z S, NISHIDA A, et al.Identification of major antioxidant compounds from the edible mushroom Basidiomycetes-X (Echigoshirayukidake)[J].Frontiers in Bioscience-Elite, 2022, 14(2):10.
[9] MATSUGO S, SAKAMOTO T, WAKAME K, et al.Mushrooms as a resource for mibyou-care functional food;the role of Basidiomycetes-X (shirayukidake) and its major components[J].Nutraceuticals, 2022, 2(3):132-149. [10] 陈凡, 刘永红, 刘永琼, 等.番石榴果芳香浸膏的提取及成分分析[J].武汉工程大学学报, 2010, 32(12):13-17; 22. CHEN F, LIU Y H, LIU Y Q, et al.Extract and analysis aroma extract of guava fruit[J].Journal of Wuhan Institute of Technology, 2010, 32(12):13-17; 22.
[11] RODRIGUEZ J M F, DE SOUZA A R C, KRÜGER R L, et al.Kinetics, composition and antioxidant activity of burdock (Arctium lappa) root extracts obtained with supercritical CO2 and co-solvent[J].The Journal of Supercritical Fluids, 2018, 135:25-33.
[12] BIN Q, PETERSON D G.Identification of bitter compounds in whole wheat bread crumb[J].Food Chemistry, 2016, 203:8-15.
[13] PEREIRA L L, GUARÇONI R C, PINHEIRO P F, et al.New propositions about coffee wet processing:Chemical and sensory perspectives[J].Food Chemistry, 2020, 310:125943.
[14] SUN J E, SUN B G, REN F Z, et al.Influence of different frying processes on the flavor characteristics and sensory profile of garlic oil[J].Molecules, 2019, 24(24):4456.
[15] QIN H, LI B C, DAI W F, et al.Rapid determination of antioxidant molecules in volatiles of rose tea by gas chromatography-mass spectrometry combined with DPPH reaction[J].Journal of Food Science and Technology, 2019, 56(9):4009-4015.
[16] LASEKAN O.Volatile constituents of roasted tigernut oil (Cyperus esculentus L.)[J].Journal of the Science of Food and Agriculture, 2013, 93(5):1055-1061.
[17] HWANG I G, KIM H Y, LEE S H, et al.Isolation and identification of an antioxidant substance from heated onion (Allium cepa L.)[J].Journal of the Korean Society of Food Science and Nutrition, 2011, 40(3):470-474.
[18] HWANG I G, KIM H Y, WOO K S, et al.Isolation and identification of the antioxidant DDMP from heated pear (Pyrus pyrifolia nakai)[J].Preventive Nutrition and Food Science, 2013, 18(1):76-79.
[19] 吕姗, 凌敏, 董浩爽, 等.烘干温度对大枣香气成分及理化指标的影响[J].食品科学, 2017, 38(2):139-145. LÜ S, LING M, DONG H S, et al.Effect of drying temperature on the aroma components and physiochemical properties of jujube[J].Food Science, 2017, 38(2):139-145.
[20] QIAO Y N, BI J F, CHEN Q Q, et al.Rapid and sensitive quantitation of DDMP (2, 3-dihydro-3, 5-dihydroxy-6-methyl-4H-pyran-4-one) in baked red jujubes by HS-SPME-GC-MS/MS[J].Food Control, 2022, 135:108820.
[21] SONG J X, CHEN Q Q, BI J F, et al.GC/MS coupled with MOS e-nose and flash GC e-nose for volatile characterization of Chinese jujubes as affected by different drying methods[J].Food Chemistry, 2020, 331:127201.
[22] RAGUPATHI RAJA KANNAN R, ARUMUGAM R, ANANTHARAMAN P.Chemical composition and antibacterial activity of Indian seagrasses against urinary tract pathogens[J].Food Chemistry, 2012, 135(4):2470-2473.
[23] SHUKLA R, BANERJEE S, TRIPATHI Y B.Antioxidant and Antiapoptotic effect of aqueous extract of Pueraria tuberosa (Roxb.Ex Willd.) DC.On streptozotocin-induced diabetic nephropathy in rats[J].BMC Complementary and Alternative Medicine, 2018, 18(1):156.
[24] 钱晓东, 周桂芬, 吕圭源.不同产地当归炮制前后多糖与新产生成分5-羟甲基糠醛和5-羟基麦芽酚含量变化规律性研究[J].中华中医药学刊, 2014, 32(6):1320-1323. QIAN X D, ZHOU G F, LU G Y.Study on content change rules of polysaccharide and two chemical constituents after processing in Angelica sinensis from different sources[J].Chinese Archives of Traditional Chinese Medicine, 2014, 32(6):1320-1323.
[25] DONG S, BI H, ZHENG D, et al.Analysis of biodrugs extracted from kiwi fruit by FT-IR and GC-MS[J].Journal of Environmental Biology, 2019, 40(3(SI)):509-514.
[26] AL-HARBI L N, PANDURANGAN S B, AL-DOSSARI A M, et al.Beta vulgaris rubra L.(beetroot) peel methanol extract reduces oxidative stress and stimulates cell proliferation via increasing VEGF expression in H2O2 induced oxidative stressed human umbilical vein endothelial cells[J].Genes, 2021, 12(9):1380.
[27] ALOTIBI I A, HARAKEH S M, AL-MAMARY M, et al.Floral markers and biological activity of Saudi honey[J].Saudi Journal of Biological Sciences, 2018, 25(7):1369-1374.
[28] BERWAL M, HALDHAR S, RAM C, et al.GC-MS/MS-based phytochemical screening of therapeutic potential of Calligonum polygonoides L.flower bud against chronic diseases[J].Pharmacognosy Magazine, 2021, 17(5):68.
[29] AKTER H, RASHID M M, ISLAM M S, et al.Biometabolites of Tamarindus indica play a remarkable cardioprotective role as a functional food in doxorubicin-induced cardiotoxicity models[J].Journal of Functional Foods, 2022, 96:105212.
[30] CORDERO C, GUGLIELMETTI A, SGORBINI B, et al.Odorants quantitation in high-quality cocoa by multiple headspace solid phase micro-extraction:Adoption of FID-predicted response factors to extend method capabilities and information potential[J].Analytica Chimica Acta, 2019, 1052:190-201.
[31] SAPUTRO A D, VAN DE WALLE D, KADIVAR S, et al.Feasibility of a small-scale production system approach for palm sugar sweetened dark chocolate[J].European Food Research and Technology, 2017, 243(6):955-967.
[32]  ECHOVSK
ECHOVSK L, CEJPEK K, KONE
L, CEJPEK K, KONE N
N M, et al.On the role of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-(4H)-pyran-4-one in antioxidant capacity of prunes[J].European Food Research and Technology, 2011, 233(3):367-376.
M, et al.On the role of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-(4H)-pyran-4-one in antioxidant capacity of prunes[J].European Food Research and Technology, 2011, 233(3):367-376.
[33] SONG Y T, DING Z H, PENG Y Z, et al.Acrylamide formation and aroma evaluation of fried pepper sauce under different exogenous Maillard reaction conditions[J].Food Chemistry:X, 2022, 15:100413.
[34] UCHEGBU R, AKALAZU J, IBE C, et al.Chemical composition of the stem extract of Costus afer (bush cane) and its antimicrobial activity[J].British Journal of Pharmaceutical Research, 2016, 10(5):1-9.
[35] HAMZA L F, KADHIM S A H, HAMEED I H.Screening of natural bioactive chemical compounds of fruit extract of Tribulus terrestris and investigation of its anti-microbial effect[J].Indian Journal of Public Health Research &Development, 2018, 9(8):1299.
[36] ALI A, KHAN N, QADIR A, et al.Identification of the phytoconstituents in methanolic extract of Adhatoda vasica L.leaves by GC-MS analysis and its antioxidant activity[J].Journal of AOAC International, 2022, 105(1):267-271.
[37] AHMAD K, BIN HAFEEZ Z, BHAT A R, et al.Antioxidant and apoptotic effects of Callistemon lanceolatus leaves and their compounds against human cancer cells[J].Biomedicine &Pharmacotherapy, 2018, 106:1195-1209.
[38] KHANDELWAL S, PAUL KHURANA S M.Molecular docking studies and GC-MS analysis of the antimicrobial compounds isolated from leaves of Moringa oleifera[J].Medicinal Plants - International Journal of Phytomedicines and Related Industries, 2019, 11(1):95.
[39] DUNKHUNTHOD B, CHIRAATTHAKIT B, CHITSOMBOON B, et al.Apoptotic induction of the water fraction of Pseuderanthemum palatiferum ethanol extract powder in Jurkat cells monitored by FTIR microspectroscopy[J].ScienceAsia, 2021, 47(5):556.
[40] ANTONY PRABHU Y, KUMAR P K, PIRAMANAYAGAM S, et al.Molecular docking analysis of CDK-1 inhibitors from Chrysophyllum cainito leaves[J].Bioinformation, 2021, 17(5):550-556.
[41] OLANIYAN O T, KUNLE-ALABI O T, RAJI Y.Protective effects of methanol extract of Plukenetia conophora seeds and 4H-pyran-4-one 2, 3-dihydro-3, 5-dihydroxy-6-methyl on the reproductive function of male Wistar rats treated with cadmium chloride[J].JBRA Assisted Reproduction, 2018, 22(4):289-300.
[42] GUCHHAIT K C, MANNA T, BARAI M, et al.Antibiofilm and anticancer activities of unripe and ripe Azadirachta indica (neem) seed extracts [J].BMC Complementary Medicine and Therapies, 2022, 22:42.
[43] ZHOU Z L, XU Z Q, SHU J S, et al.Influence of various factors on formation of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4(H)-pyran-4-one (DDMP) in a solid-state model system of Maillard reaction[J].European Food Research and Technology, 2014, 239(1):31-40.
[44] VOIGT M, SMUDA M, PFAHLER C, et al.Oxygen-dependent fragmentation reactions during the degradation of 1-deoxy-D-erythro-hexo-2, 3-diulose[J].Journal of Agricultural and Food Chemistry, 2010, 58(9):5685-5691.
[45] LI H, TANG X Y, WU C J, et al.Formation of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4(H)-pyran-4-one (DDMP) in glucose-amino acids Maillard reaction by dry-heating in comparison to wet-heating[J].LWT, 2019, 105:156-163.
[46] LI H, YANG F H, ZHANG W C, et al.Effects of moisture content on the enolization products formation in glucose-proline Maillard reaction models[J].Journal of the Science of Food and Agriculture, 2022, 102(15):7249-7258.
[47] 王丹, 况丹妮, 刘若阳, 等.焦糖化与美拉德反应中DDMP、HMF及糠醛的生成研究[J].食品工业科技, 2022, 43(12):100-107. WANG D, KUANG D N, LIU R Y, et al.Formation of DDMP, HMF and furfural in caramelization and Maillard reaction[J].Science and Technology of Food Industry, 2022, 43(12):100-107.
[48] KIM M O, BALTES W.On the role of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4(H)-pyran-4-one in the Maillard reaction[J].Journal of Agricultural and Food Chemistry, 1996, 44(1):282-289.
[49] CAO J R, YAN H X, LIU L.Optimized preparation and antioxidant activity of glucose-lysine Maillard reaction products[J].LWT, 2022, 161:113343.
[50] 邱婷婷, 谭啸, 李若男, 等.壳聚糖-单糖美拉德反应产物的制备及其在抗菌和抗氧化中的应用研究进展[J].食品科学, 2020, 41(19):327-333. QIU T T, TAN X, LI R N, et al.Recent advances in preparation and antimicrobial and antioxidant activity of chitosan-monosaccharides Maillard reaction products[J].Food Science, 2020, 41(19):327-333.
[51] YU X Y, ZHAO M Y, LIU F, et al.Identification of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4H-pyran-4-one as a strong antioxidant in glucose-histidine Maillard reaction products[J].Food Research International, 2013, 51(1):397-403.
[52] CHEN Z F, LIU Q, ZHAO Z W, et al.Effect of hydroxyl on antioxidant properties of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4H-pyran-4-one to scavenge free radicals[J].RSC Advances, 2021, 11(55):34456-34461.
[53] 王清福, 蔡莉莉, 刘前进, 等.双羟基吡喃酮化合物的合成及清除自由基性能[J].精细化工, 2022, 39(6):1205-1211. WANG Q F, CAI L L, LIU Q J, et al.Synthesis and free radical scavenging properties of dihydroxypyranone compounds[J].Fine Chemicals, 2022, 39(6):1205-1211.
[54] KANZLER C, HAASE P T, SCHESTKOWA H, et al.Antioxidant properties of heterocyclic intermediates of the Maillard reaction and structurally related compounds[J].Journal of Agricultural and Food Chemistry, 2016, 64(41):7829-7837.
[55] BAN J O, HWANG I G, KIM T M, et al.Anti-proliferate and pro-apoptotic effects of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4H-pyranone through inactivation of NF-κB in human colon cancer cells[J].Archives of Pharmacal Research, 2007, 30(11):1455-1463.
[56] BEPPU Y, KOMURA H, IZUMO T, et al.Identificaton of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4H-pyran-4-one isolated from Lactobacillus pentosus strain S-PT84 culture supernatants as a compound that stimulates autonomic nerve activities in rats[J].Journal of Agricultural and Food Chemistry, 2012, 60(44):11044-11049.
[57] TEOH Y P, DON M M, UJANG S.Media selection for mycelia growth, antifungal activity against wood-degrading fungi, and GC-MS study by Pycnoporus sanguineus[J].BioResources, 2011, 6(3):2719-2731.
[58] PITTET A O, RITTERSBACHER P, MURALIDHARA R.Flavor properties of compounds related to maltol and isomaltol[J].Journal of Agricultural and Food Chemistry, 1970, 18(5):929-933.
[59] SHAW P E, TATUM J H, BERRY R E.2, 3-Dihydro-3, 5-dihydroxy-6-methyl-4H-pyran-4-one, a degradation product of a hexose[J].Carbohydrate Research, 1971, 16(1):207-211.
[60] ZHANG C P, WANG Y T, DING D, et al.Volatile profiles of Allium tenuissimum L.flower fried by four different oils, using SPME-GC-MS, and sensory evaluation coupled with partial least squares regression[J].Journal of Food Composition and Analysis.2022, 109:104461.
[61] 周志磊. 烤烟主流烟气中主要甜味物质的鉴别及其形成机理[D].无锡:江南大学, 2014. ZHOU Z L.Identification and formation mechanism of the main sweet compounds in flue-cured cigarette smoke[D].Wuxi:Jiangnan University, 2014.
[62] LI H, WU C J, TANG X Y, et al.Determination of four bitter compounds in caramel colors and beverages using modified QuEChERS coupled with liquid chromatography-diode array detector-mass spectrometry[J].Food Analytical Methods, 2019, 12(7):1674-1683.
[63] LI H, ZHANG W C, TANG X Y, et al.Identification of bitter-taste compounds in class-Ⅲ caramel colours[J].Flavour and Fragrance Journal, 2021, 36(3):404-411.
[64] LI H, WU C J, TANG X Y, et al.Insights into the regulation effects of certain phenolic acids on 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4(H)-pyran-4-one formation in a microaqueous glucose-proline system[J].Journal of Agricultural and Food Chemistry, 2019, 67(32):9050-9059.
[65] CHEN Z F, XI G L, FU Y F, et al.Synthesis of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4H-pyran-4-one from maltol and its taste identification[J].Food Chemistry, 2021, 361:130052.
[66] VAN DEN OUWELAND G A M, PEER H G.Synthesis of 3, 5-dihydroxy-2-methyl-5, 6-dihydropyran-4-one from aldohexoses and secondary amine salts[J].Recueil Des Travaux Chimiques Des Pays-Bas, 1970, 89(7):750-754.
[67] 陈永宽, 孔宁川, 武怡, 等.2, 3-二氢-3, 5-二羟基-6-甲基-4(H)吡喃-4-酮的合成及热裂解行为[J].化学研究与应用, 2003, 15(1):45-47. CHEN Y K, KONG N C, WU Y, et al.Study on synthesis and thermolysis of 2, 3-dihydro-3, 5-dihydroxy-6-methyl-4H-pyran-4-one[J].Chemical Research and Application, 2003, 15(1):45-47.
[68] SHAKOOR A, ZHANG C P, XIE J C, et al.Maillard reaction chemistry in formation of critical intermediates and flavour compounds and their antioxidant properties[J].Food Chemistry, 2022, 393:133416.