便秘是一种常见的胃肠动力障碍疾病,饮食结构、药物使用、生活方式、结肠推进或直肠排空障碍、菌群失调、代谢紊乱等因素均与便秘密切相关。便秘不仅造成人们生理不适,还易引起情绪障碍,已严重影响了人们的生活质量。其治疗的主要手段是饮食、生活方式干预、药物治疗(如渗透性泻药聚乙二醇、乳果糖、刺激性泻药番泻叶、促分泌药、促动力药物普芦卡必利)及手术治疗等。在全球,便秘的发生率高达11%~20%[1],而女性便秘的患病率几乎是男性的2倍[2]。值得注意的是,便秘在儿童和老人中患病率无差异,猜测性激素在便秘患病率中可能发挥着重要的影响作用。
女性比男性更易受到便秘的困扰,这种患病性别差异可能与性激素水平、心理承受能力以及活动量等因素有关。女性在怀孕期、月经期经常会出现便秘加重的症状,这就提示我们性激素可能是影响胃肠转运的重要因素。雌激素作为最主要的性激素之一,可以穿过细胞膜,与细胞质中的专一性受体结合,形成复合体。雌激素受体(estrogen receptor, ER)包括ERα和ERβ 2种亚型,而ERβ则是结肠中主要表达的ER[3]。研究表明,ERβ通过参与电解质的转运[4]增加钠吸收,上调钠/氢交换因子3(sodium/hydrogen exchanger 3, NHE3)影响孕期小鼠便秘。ERβ在便秘患者结肠黏膜层、肌间神经丛及黏膜下神经丛中的表达显著下调[5]。便秘大鼠结肠中ERβ蛋白也明显低于正常对照组[6]。这些研究均表明ERβ受体下调可能会影响便秘。有研究表明,敲除ERβ基因后雌性小鼠通过ERβ/PI3K/Akt通路下调大脑中脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)蛋白水平[7],BDNF继而通过BDNF-PLC-γ/DAG-IP3信号通路影响了肠神经与平滑肌重构。这又进一步说明ERβ受体下调会影响宿主的肠神经系统。
基于此,本文拟应用ERβ受体抑制剂(枸橼酸他莫昔芬)处理大鼠,以洛哌丁胺处理组作为阳性对照,通过检测粪便含水量、小肠推进率及排首粒黑便时间,判定ERβ受体抑制剂处理组是否可成功构建靶向女性便秘的动物模型。由于便秘同时伴有肠屏障的损伤,结合ERβ受体下调对肠神经系统的影响,本文拟通过进一步检测ERβ受体抑制剂(枸橼酸他莫昔芬)处理对大鼠肠屏障及肠神经系统的影响,最终探究ERβ在肠蠕动中发挥的重要作用,为构建靶向筛选缓解女性便秘的益生菌动物模型提供理论依据和基础支持。
1 材料与方法
1.1 材料与试剂
盐酸洛哌丁胺胶囊,西安杨森制药有限公司;枸橼酸他莫昔芬片,四川海汇药业有限公司;阿拉伯树胶粉、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、活性炭粉,国药集团化学试剂公司;大鼠5-羟色胺(5-hydroxytryptamine, 5-HT)ELISA试剂盒,上海酶联生物科技有限公司;大鼠S100β抗体,Abcam公司。
1.2 动物实验设计
24只6周龄雌性SPF级Sprague Dawley大鼠,南京维通利华实验动物技术有限公司;动物伦理委员会审核批准文号:JN.No20211115 s1200201[440],研究遵循的程序符合负责动物试验委员会(单位性的、地区性的或国家性的)所制订的伦理学标准。饲养环境温度20~26 ℃,相对湿度40%~70%,噪声控制在≤60 dB,动物照度应为15~20 LX。大鼠随机均分为4组:正常组(normal control, NC组)、盐酸洛哌丁胺组(LOP组)、枸橼酸他莫昔芬组(TAM组)、盐酸洛哌丁胺+枸橼酸他莫昔芬处理组(TAM+LOP组)。适应性饲养1周后进入干预期,干预期持续7 d,NC组每天灌胃1 mL生理盐水,LOP组每天灌胃1 mL盐酸洛哌丁胺悬液(10 mg/kg BW),TAM组每天灌胃1 mL枸橼酸他莫昔芬悬液(40 mg/kg BW),TAM+LOP组每天灌胃0.5 mL盐酸洛哌丁胺悬液(10 mg/kg BW)和0.5 mL枸橼酸他莫昔芬悬液(40 mg/kg BW)。动物实验按图1所示进行。试验期间各组大鼠均饲喂标准饲料,每周收集大鼠粪便,并尽快带回实验室,保存于-80 ℃冰箱备用。实验结束后,大鼠腹腔注射100 mg/kg BW的氯胺酮麻醉后,腹部主动脉取血至死。血液在4 ℃、3 000×g下离心10 min,取血清,-80 ℃冻存备用。

图1 动物实验流程
Fig.1 Animal experiment schedule
1.3 实验方法
1.3.1 粪便含水量
将每只大鼠单独放入透气笼盒中每周收集粪便,称重后使用冻干机冷冻干燥,粪便含水量的计算如公式(1)所示:
粪便含水量![]()
(1)
1.3.2 首粒黑便时间
将阿拉伯树胶与水以料液比1∶10(g∶mL)混合均匀后加热至透明,再加入100 g/L的活性炭粉,煮沸3次保证混合均匀。在实验结束前1 d测大鼠排首粒黑便时间,并在前1 d禁食不禁水12 h。测定时,每只大鼠灌胃1 mL活性炭溶液,记录每只大鼠从灌入活性炭溶液开始到排出第1粒黑便的时长,将此时长定义为排首粒黑便时间。比较各个处理组排首粒黑便时间与正常组之间的差异,用于说明各个药物处理组构建便秘模型的情况。
1.3.3 小肠推进率
大鼠处死前一天禁食不禁水12 h,在处死前1 h,每只大鼠灌胃1 mL上述活性炭溶液。处死后,小心剪取胃至回肠末端,小心展开全段小肠,避免拉扯,测量无拉伸的小肠总长度,以及活性炭墨汁自胃在小肠中推进的距离,大鼠小肠推进率的计算如公式(2)所示:
小肠推进率![]()
(2)
1.3.4 实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)
采用RT-qPCR测定大鼠结肠组织中水通道蛋白AQP3基因、AQP8基因、c-kit基因、Klf4基因、Atoh1基因、Claudin-5蛋白基因。
在NCBI网站(https://www.ncbi.nlm.nih.gov/)查找大鼠AQP3基因、AQP8基因、c-kit基因、Klf4基因、Atoh1基因、claudin-5蛋白基因引物序列,并委托上海生工生物科技有限公司进行合成,具体引物信息见表1。
表1 几种基因的引物序列及产物长度
Table 1 Length of primers and products

基因序列(5′→3′)产物长度/bpAQP3F-TTGATGAACCGTTGCGGGGAGAR-CTTGAGCCACGGAACCACAGCC118AQP8F-GGGTGCCGTCAATGAGAAGAR-GAGCAGTCCCACAAAGAGGC211Klf4F-GAAGGGAGAAGACACTGCGTR-CCGATTCCTGGTGGGATAGC261Atoh1F-GGACGCTTTGCACTTTCCAGR-CTCCGTCACTTCTGTGGGAC152Claudin-5F-CCATCTTTGGACCGATTGCTGR-TAATGCCCGAGCTCCGATG123GAPDHF-GGCCTTCCGTGTTCCTACCR-CGCCTGCTTCACCACCTTC103
取-80 ℃保藏的大鼠结肠(同一部位)20 mg左右,使用Trizol法提取结肠总RNA,通过测定RNA在OD260/280吸光度比值,检验其纯度及完整性。然后按照试剂盒中说明,以提取的总RNA为模板合成cDNA,进行RT-qPCR检测,根据HiScript III RTSuperMix for qPCR的说明配制体系并进行RT-qPCR程序运行。
1.3.5 苏木精和伊红(hematoxylin and eosin)病理染色
将固定后的结肠组织经流水过夜冲洗,样品脱水浸蜡后包埋。使用手动轮转切片机切出5 μm的薄片,放入40 ℃的去离子水中进行展片,用载玻片将其捞出。之后进行脱蜡、H&E染色、脱水与透明。染色完成后使用中性树胶进行封藏。待中性树胶完全凝固后,放入数字组织切片扫描机中进行观察。结肠组织的病变分析主要测定上皮细胞、隐窝和杯状细胞的形态、结构以及黏膜厚度。
1.3.6 酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)检测
分别从-80 ℃冰箱中取出约100 mg结肠组织,按料液比1∶9(g∶mL)加入PBS,加入锆珠并使用高通量组织破碎仪将结肠组织研磨破碎,5 000×g离心取上清液为组织匀浆。按照5-HT,P物质ELISA试剂盒的说明书进行操作,采用外标法制作标准曲线,根据吸光度计算出样品中所含待测物质的浓度。
1.3.7 免疫荧光检测
结肠石蜡切片经脱蜡水化处理后加S100β一抗(1∶100)孵育过夜,滴加(Cy3) Rabbit Anti-Goat标记的荧光IgG二抗(1∶500),用数字切片扫描仪观察并拍照,Image J图像分析系统分析单位面积内阳性染色的平均光密度值,以阳性染色的平均光密度变化评估肠神经胶质细胞数目。
1.3.8 统计分析
实验数据用Graphpad Prism 8.0软件统计,组间多重比较,分别用单因素方差分析及SNK-q检验,两组间单独比较用t检验,P<0.05表示差异有统计学意义。注:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1;ns表示无显著性,以上显著性均是与正常组(NC)比较。
2 结果与分析
2.1 应用ERβ受体抑制剂可构建便秘动物模型
通常,在构建便秘动物模型时,常用的药物为洛哌丁胺。如图2所示,洛哌丁胺(10 mg/kg BW)灌胃后,大鼠会呈现便秘的症状(小肠推进率和粪便含水量降低,排首粒黑便时间延长)。单独使用ERβ受体抑制剂(他莫昔芬,40 mg/kg BW)后,大鼠的粪便含水量显著降低,排首粒黑便时间显著延长,根据《保健食品检验与评价技术规范(2022版)》中有关通便功能检验方法阳性结果的判断标准可知:单独使用ERβ受体抑制剂他莫昔芬可成功构建便秘动物模型。灌胃(ERβ受体抑制剂40 mg/kg BW+洛哌丁胺10 mg/kg BW)后,大鼠同样呈现便秘的症状,上述2种结果均表明应用ERβ受体抑制剂处理大鼠可成功构建便秘模型。
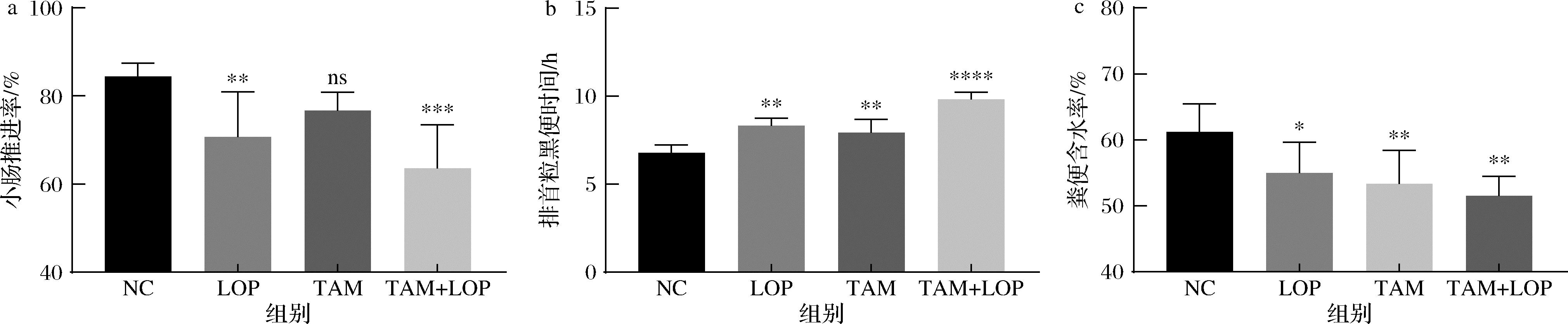
a-小肠推进率;b-排首粒黑便时间;c-粪便含水量
图2 大鼠便秘相关指标
Fig.2 Constipation-related indicators in rats
2.2 ERβ受体抑制剂造成肠屏障损伤
2.2.1 他莫昔芬对大鼠肠道生物屏障的影响
LOP组Chao1指数与observed-OTUs指数与空白组相比无显著性差异。而TAM组和TAM+LOP组则显著改变了大鼠肠道菌群α-多样性(Chao1指数、observed-OTUs)(P<0.05),这些结果表明他莫昔芬处理后,大鼠肠道内物种丰富度提高。根据主坐标分析图所反映的β多样性结果可知,不同药物处理后对大鼠肠道菌群的影响非常显著,且不同药物影响作用也不同(图3-c)。其中他莫昔芬上调了uncultured Bacteroidales bacterium,Bifidobacterium,Clostridium sensus tricto1,Turicibacter和Faecalibaculum的相对丰度(P<0.05)。相较于洛哌丁胺所引起的菌群改变,他莫昔芬显著增加了大鼠肠道中促炎菌Turicibacter的丰度,这与H&E病理染色结果中的炎症浸润现象一致。同时,他莫昔芬与洛哌丁胺处理组均降低了Blautia、Marvinbryantia、Fournierella、Lactococcus的相对丰度(P<0.05)。
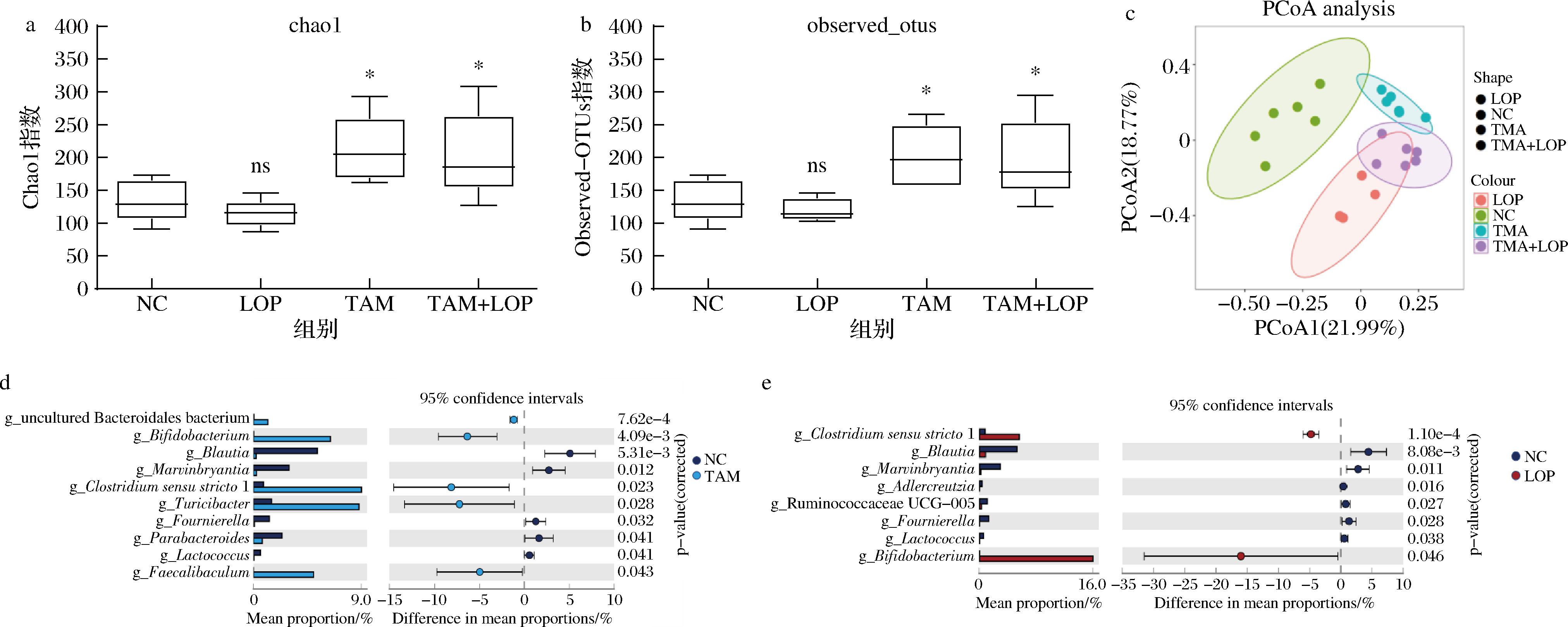
a-Chao 1指数;b-Observed-OTUs指数;c-主坐标分析;d-TAM组与NC组的差异菌株比较;e-LOP组与NC组的差异菌株比较
图3 大鼠肠道菌群α-多样性、β-多样性、不同组别的差异菌株
Fig.3 α-Diversity, β-diversity, and different strains of intestinal flora in rats
2.2.2 他莫昔芬对机械屏障影响
在H&E病理染色结果中,他莫昔芬导致结肠隐窝结构受损(深度变浅),杯状细胞明显减少,黏膜下层出现水肿浸润,黏膜层皱缩(图4)。

a-NC组;b-LOP组;c-TAM组;d-TAM+LOP组
图4 大鼠结肠H&E染色结果
Fig.4 Colonic H&E staining results of rats
但检测杯状细胞关键分化因子Klf4、Atoh1基因转录(图5)有下调趋势却无显著差异,故推测他莫昔芬处理可能是通过诱导杯状细胞的凋亡引起了杯状细胞数量的减少,从而破坏了大鼠肠道机械屏障。肠上皮细胞通过细胞间紧密排列有效阻挡细菌、病毒及内毒素的进入,形成机械屏障。qPCR结果显示洛哌丁胺与他莫昔芬均下调了紧密连接蛋白Claudin5的转录(图5),说明2种造模药物均对于肠道机械屏障造成了一定程度的损伤。这些结果均表明他莫昔芬处理后,大鼠不仅呈现出便秘的状态,同时肠道的机械屏障也出现了不同程度的损伤。
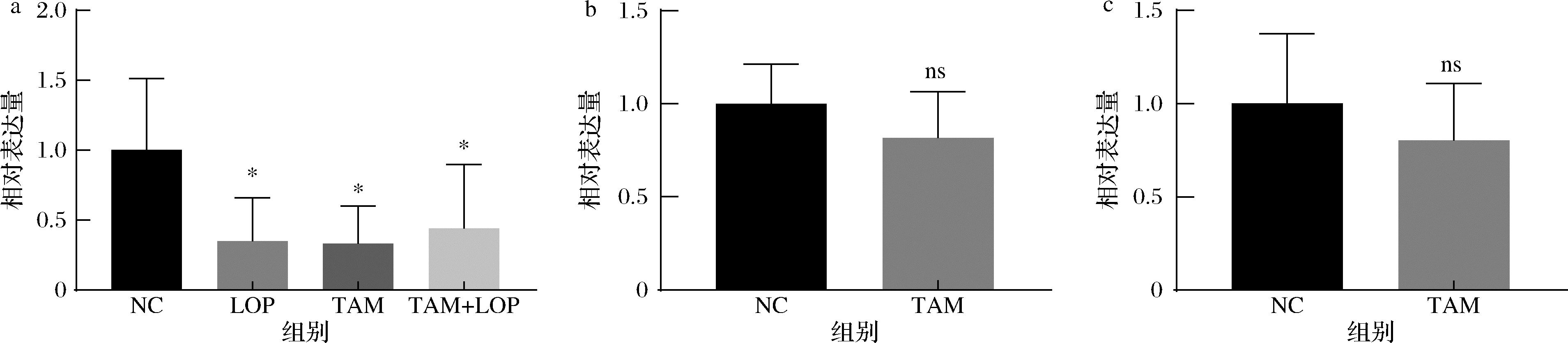
a-Claudin5;b-Klf4;c-Atoh1
图5 结肠中Claudin5、Klf4、Atoh1基因相对表达量
Fig.5 Relative expression levels of Claudin5, Klf4, and Atoh1 genes in colon
2.2.3 他莫昔芬对化学屏障影响
在TAM和LOP组,2种水通道蛋白AQP3和AQP8的转录水平都未出现显著改变,他莫昔芬也仅表现出上调AQP8转录的趋势(图6-a、图6-b),因此他莫昔芬下调大鼠粪便含水量可能并不由通过AQP3与AQP8主要介导。5-HT作为一种肠神经系统中关键的神经递质在调节肠道运动中起着重要作用,5-HT能刺激肠道的局部收缩,而实验结果显示洛哌丁胺减少5-HT的释放,他莫昔芬并不会引起结肠中5-HT的变化,甚至存在上调5-HT的趋势(图6-c)。说明,应用洛哌丁胺构建便秘模型和应用他莫昔芬构建的便秘模型对于5-HT相关信号通路的影响是不同的。此外,结肠中兴奋性胃肠活性肽P物质在TAM组、LOP组、TAM+LOP组均显著降低(图6-d,P<0.05),P物质或是他莫昔芬与洛哌丁胺导致便秘症状所涉及到的共同途径,可能都减少了该类神经递质的释放,对肠道平滑肌舒张收缩产生影响,抑制了肠道蠕动。

a-AQP3相对表达量;b-AQP8相对表达量;c-5-HT含量;d-P物质含量
图6 结肠中水通道蛋白AQP3、AQP8转录情况及5-HT、P物质蛋白表达
Fig.6 Transcription of aquaporin AQP3, AQP8 and expression of 5-HT and substance P protein in colon
2.2.4 抑制ERβ引起免疫屏障损伤
肠道黏膜炎症也与运动功能有着密切的关系,在TAM组和TAM+LOP组中大鼠的结肠都出现了淋巴细胞的聚集,表现出免疫炎症,而在LOP组未见明显的病理损伤(图4)。与此同时,如图7所示,血清中炎症性指标C反应蛋白在他莫昔芬处理后大幅上升,说明他莫昔芬激活了肠道炎症反应,对肠道黏膜免疫屏障造成了一定程度的破坏。
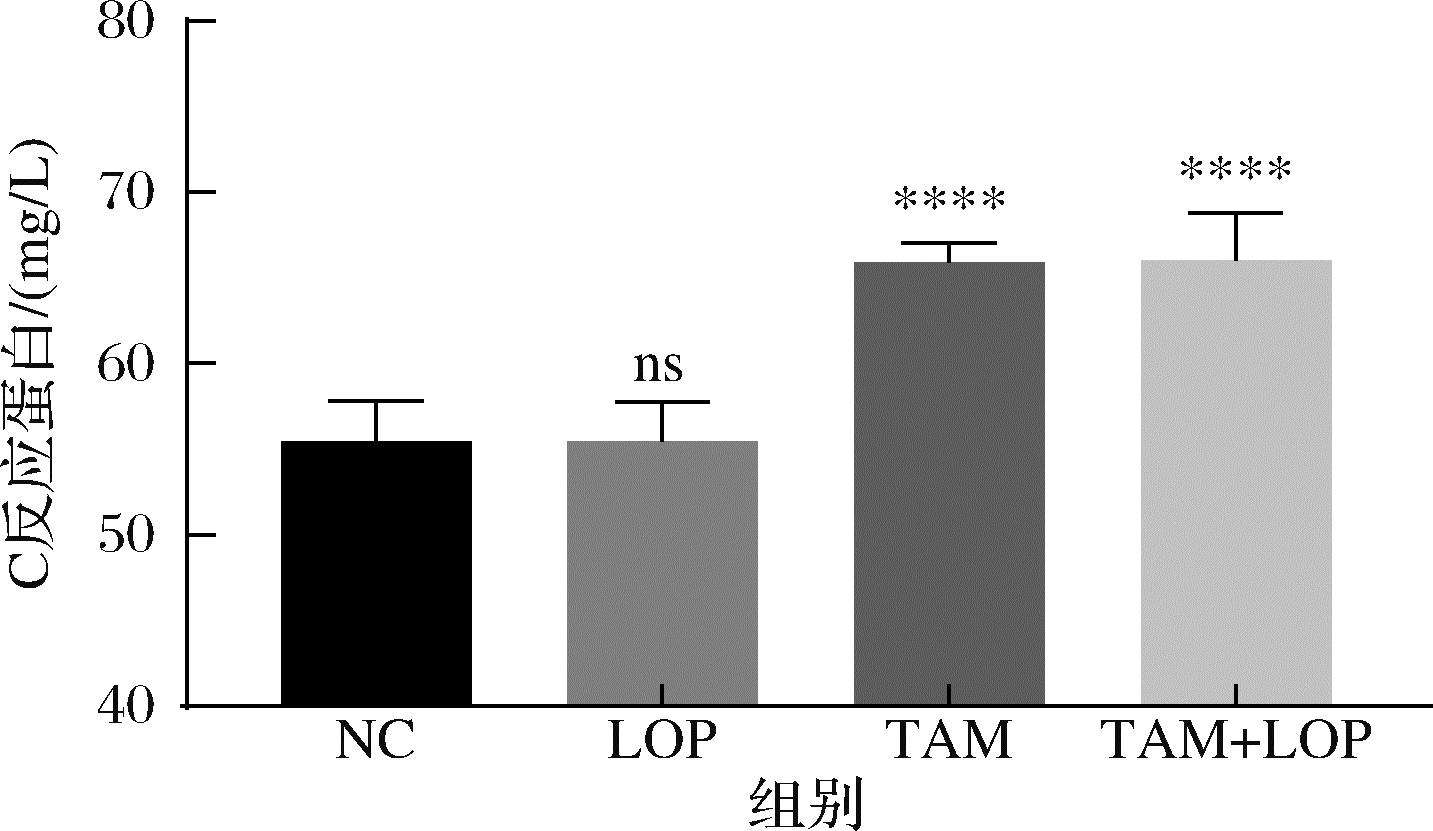
图7 血清中C反应蛋白含量
Fig.7 C-reactive protein content in serum
2.3 他莫昔芬损伤了结肠黏膜肌层与外肌层肠神经胶质细胞
在肠神经系统中,肠神经胶质细胞、肠神经元中都有着较高水平的ERβ表达[8]。S100β是一种钙结合蛋白,主要存在于神经胶质细胞中,使用S100β标记肠神经胶质细胞(图8中红色荧光)。免疫荧光结果显示,他莫昔芬处理后肠神经胶质细胞密度下降(图8),而洛哌丁胺在一定剂量范围内对肠神经胶质细胞数量无影响,故推测ERβ在引起便秘的同时也会对肠神经胶质细胞正常的神经发育及信号传递具有一定程度的影响。

a-NC组;b-LOP组;c-TAM组;d-TAM+LOP组
图8 大鼠S100β标记的结肠肠神经胶质细胞免疫荧光图
Fig.8 Immunofluorescence image of colonic intestinal glial cells labeled with S100β in rats
3 结论与讨论
便秘患者常表现为排便次数减少,粪便干硬,排便不充分等症状。应用药物构建便秘模型时,常用的药物为盐酸洛哌丁胺,作为一种阿片受体抑制剂,其会干扰神经递质的释放,抑制肠蠕动与收缩。本文旨在构建靶向女性便秘的动物模型,用于靶向筛选适合女性便秘的药物或益生菌。
前期研究发现激素尤其是雌二醇和/或其受体在女性便秘中发挥着重要的作用[9]。基于此,本文主要探讨激素受体特别是雌二醇受体对便秘的影响。研究发现,宿主肠道内主要为ERβ受体[3],因此我们假设应用雌激素β受体的特异性抑制剂他莫昔芬可构建靶向女性便秘的动物模型,并以洛哌丁胺作为阳性造模药物对照。通过检测小肠推进率、排首例黑便时间和粪便含水量3个指标来反映他莫昔芬对大鼠肠道转运能力的影响。结果表明应用他莫昔芬可成功构建便秘模型。
目前,影响肠蠕动的因素主要有神经系统(肠神经系统和自主神经系统)、免疫系统、肠道菌群及其代谢产物。这些方面的任何一个环节出现紊乱或功能障碍都会引起肠道能动性失调(便秘或腹泻)。因此,我们进一步解析了他莫昔芬在构建便秘模型后对大鼠上述系统,即肠道屏障功能及肠神经系统的影响。结肠黏液层厚度的减少会阻碍粪便的推进,黏液主要由杯状细胞分泌,覆盖肠上皮表面,杯状细胞的减少导致黏蛋白分泌不足,这主要是隐窝干细胞分化不足或杯状细胞凋亡增加的结果[10]。ERβ在结肠隐窝中有着较多表达,ERβ表达量的下降可能抑制了隐窝干细胞分化相关基因的表达,使隐窝干细胞分化不足[11]。同时他莫昔芬作为乳腺癌的临床用药抑制乳腺癌细胞增殖的同时或许诱导了杯状细胞的凋亡,从而导致结肠黏液分泌不足,粪便推进受阻,粪便含水量的下降。
葡聚糖硫酸钠处理后,ERβ敲除小鼠在粪便微生物群组成的α和β多样性方面表现出显著变化,并出现结肠炎和焦虑样行为的恶化[12]。ERβ的激活能调节自噬炎症小体途径,抑制白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的分泌,调节肠道微生物群,最终缓解结肠炎[13]。与诱导结肠炎后的雄性小鼠相比[14],雌性小鼠的Turicibacter和未分类梭菌科显著富集,这与我们的实验结果具有一致性。Turicibacter在肠道中异常增殖或能预示女性肠道菌群的紊乱以及潜在的胃肠疾病。氧化偶氮甲烷/葡聚糖硫酸钠处理后,缺失ERβ的小鼠富集了影响碳水化合物代谢和细胞运动的微生物群,同时减少了影响内分泌系统的微生物群[15]。变形杆菌门、拟杆菌门和厚壁菌门(包括乳酸杆菌门)的代表性顺序也因小鼠ERβ存在与否而异[16]。ERβ在重构肠道微生物群、缓解胃肠道疾病上发挥着重要作用。
雌激素的激活是在信号通路上与相关受体结合被触发活化的结果,雌激素的抗炎效应是通过激活ERβ受体介导[17]。GOODMAN等[18]研究证明ERβ通过调控GILZ转录因子介导了调节性T细胞对于炎症性肠病(inflammatory bowel disease, IBD)中免疫稳态的修复。IL-6和TNF-α在IBD患者中有显著的性别差异,男性明显高于女性,与对照组相比,ERβ在IBD患者中表达明显降低。便秘症状中ERβ表达与炎症相关因子IL-6、IL-10、TNF-α、MCP-1等之间的相关性也有待进一步研究,以解析ERβ通过免疫途径影响肠道运动的机制。
人类的ERβ蛋白存在于肌间神经丛和黏膜下神经丛的肠神经元中[19]。RASTELLI等[20]的体外实验结果显示ERβ的激动剂处理会促进肠神经胶质细胞的神经发生,本研究结果表明ERβ的抑制剂减少了结肠中肠神经胶质细胞的数量,抑制其对神经递质的反应,造成结肠动力不足。通过刺激ERβ的增殖或恢复ERβ在结肠中的表达或许能够促进肠神经胶质细胞数量及功能恢复到正常水平,达到缓解便秘的效果。
综上所述,应用ERβ受体抑制剂可成功构建靶向女性便秘的动物模型。同时ERβ受体抑制剂在造成便秘的同时也会造成结肠肠神经受损及肠屏障的损伤。总之,本研究为构建靶向筛选缓解女性便秘的益生菌动物模型提供了理论依据和基础支持。
[1] SCHILLER L R.Chronic constipation:New insights, better outcomes?[J].The Lancet Gastroenterology &Hepatology, 2019, 4(11):873-882.
[2] CAMILLERI M, FORD A C, MAWE G M, et al.Chronic constipation[J].Nature Reviews Disease Primers, 2017, 3:17095.
[3] SINHA T, VICH VILA A, GARMAEVA S, et al.Analysis of 1135 gut metagenomes identifies sex-specific resistome profiles[J].Gut Microbes, 2019, 10(3):358-366.
[4] CHOIJOOKHUU N, SATO Y, NISHINO T, et al.Estrogen-dependent regulation of sodium/hydrogen exchanger-3 (NHE3) expression via estrogen receptor β in proximal colon of pregnant mice[J].Histochemistry and Cell Biology, 2012, 137(5):575-587.
[5] BASSOTTI G, VILLANACCI V, BELLOMI A, et al.An assessment of enteric nervous system and estroprogestinic receptors in obstructed defecation associated with rectal intussusception[J].Neurogastroenterology and Motility, 2012, 24(3):e155-e161.
[6] 张广军, 王崇树, 魏寿江, 等.慢性传输性便秘模型大鼠血清性激素水平及结肠雌激素受体β的分布与表达研究[J].中国普通外科杂志, 2011, 20(10):1084-1087. ZHANG G J, WANG C S, WEI S J, et al.Serum sexual homones level, distribution and expression of estrogen receptor β in the colon of rats with slow transit constipation[J].Chinese Journal of General Surgery, 2011, 20(10):1084-1087.
[7] CHHIBBER A, WOODY S K, KARIM RUMI M A, et al.Estrogen receptor β deficiency impairs BDNF-5-HT2A signaling in the hippocampus of female brain:A possible mechanism for menopausal depression[J].Psychoneuroendocrinology, 2017, 82:107-116.
[8] BRANDENBERGER A W, TEE M K, LEE J Y, et al.Tissue distribution of estrogen receptors alpha (ER-α) and beta (ER-β) mRNA in the midgestational human fetus[J].The Journal of Clinical Endocrinology &Metabolism, 1997, 82(10):3509-3512.
[9] XIONG W J, JIANG Y, YU T, et al.Estrogen-regulated expression of SK3 channel in rat colonic smooth muscle contraction[J].Life Sciences, 2020, 263:118549. [10] VOLYNETS V, REICHOLD A, B RDOS G, et al.Assessment of the intestinal barrier with five different permeability tests in healthy C57BL/6J and BALB/cJ mice[J].Digestive Diseases and Sciences, 2016, 61(3):737-746.
RDOS G, et al.Assessment of the intestinal barrier with five different permeability tests in healthy C57BL/6J and BALB/cJ mice[J].Digestive Diseases and Sciences, 2016, 61(3):737-746.
[11] TAO Y, QIAO S M, LV C J, et al.Phytoestrogen arctigenin preserves the mucus barrier in inflammatory bowel diseases by inhibiting goblet cell apoptosis via the ERβ/TRIM21/PHB1 pathway[J].Phytotherapy Research, 2022, 36(8):3248-3264.
[12] MA Y Y, LIU T Y, LI X, et al.Estrogen receptor β deficiency impairs gut microbiota:A possible mechanism of IBD-induced anxiety-like behavior[J].Microbiome, 2022, 10(1):160.
[13] FAN W T, ZHANG S, WU Y T, et al.Genistein-derived ROS-responsive nanoparticles relieve colitis by regulating mucosal homeostasis[J].ACS Applied Materials &Interfaces, 2021, 13(34):40249-40266.
[14] JONES-HALL Y L, KOZIK A, NAKATSU C.Ablation of tumor necrosis factor is associated with decreased inflammation and alterations of the microbiota in a mouse model of inflammatory bowel disease[J].PLoS One, 2015, 10(3):e0119441.
[15] IBRAHIM A, HUGERTH L W, HASES L, et al.Colitis-induced colorectal cancer and intestinal epithelial estrogen receptor beta impact gut microbiota diversity[J].International Journal of Cancer, 2019, 144(12):3086-3098.
[16] MENON R, WATSON S E, THOMAS L N, et al.Diet complexity and estrogen receptor β status affect the composition of the murine intestinal microbiota[J].Applied and Environmental Microbiology, 2013, 79(18):5763-5773.
[17] GARCIA-VILLATORO E L, ALLRED C D.Estrogen receptor actions in colitis[J].Essays in Biochemistry, 2021, 65(6):1003-1013.
[18] GOODMAN W A, BEDOYAN S M, HAVRAN H L, et al.Impaired estrogen signaling underlies regulatory T cell loss-of-function in the chronically inflamed intestine[J].Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(29):17166-17176.
[19] CAMPBELL-THOMPSON M, LYNCH I J, BHARDWAJ B.Expression of estrogen receptor (ER) subtypes and ERbeta isoforms in colon cancer[J].Cancer Research, 2001, 61(2):632-640.
[20] RASTELLI D, ROBINSON A, LAGOMARSINO V N, et al.Diminished androgen levels are linked to irritable bowel syndrome and cause bowel dysfunction in mice[J].The Journal of Clinical Investigation, 2022, 132(2):e150789.