豆类蛋白是人类膳食中重要的蛋白质来源,其价格低廉,相对于谷物蛋白,不含有麸质等致敏性成分,且具有降血糖、预防心血管疾病等多种生理功能[1]。芸豆是重要的食用豆类资源之一,富含蛋白质和膳食纤维,脂肪含量低于其他常见的食用豆类[2]。芸豆中钙含量丰富,每100 g带皮芸豆中含钙349 mg,约是黄豆的2倍,是鸡肉的7倍;芸豆中的蛋白质含量与猪肉(约20%)相近,高于小米(8.8%),黑麦(13.3%)和高粱(13.6%)[3]。
芸豆蛋白含有18种氨基酸,其中包含人体所需的所有8种必需氨基酸,含量较高的为赖氨酸、亮氨酸、天冬氨酸、谷氨酸和精氨酸,其必需氨基酸组成符合 FAO/WHO 标准模式[4]。与大豆蛋白相比,芸豆蛋白的异亮氨酸、亮氨酸、苯丙氨酸、苏氨酸和缬氨酸的比例均更高,总必需氨基酸的比例(57%~62%)也高于大豆蛋白(47%),是优质的植物蛋白[5]。在功能特性方面,芸豆蛋白的溶解性和吸水性稍低于大豆蛋白,乳化性、起泡性、吸油性和胶凝性均接近或高于大豆蛋白[6]。利用物理、化学和生物等技术对芸豆蛋白加以改性,可以改变芸豆蛋白的空间结构,调节其功能特性,以满足肉食制品、乳制品、饮料、焙烤食品和保健食品等行业中的应用需求,开发高附加值产品,扩大其在食品工业中的应用范围。
在我国,芸豆目前主要以鲜食和干制等粗加工为主。相较于大豆蛋白、玉米蛋白等大宗植物蛋白,目前对芸豆蛋白的研究主要集中于蛋白质的分离提取,淀粉酶抑制剂、植物凝集素以及部分特定功能成分的利用,如芸豆提取物中的α-淀粉酶抑制剂可以有效阻断人体对于膳食中淀粉的吸收,达到控制体重的目的[7]。然而,芸豆蛋白的深度开发及综合性利用程度尚且不足,这也阻碍了其在食品工业中产品附加值的提升。在植物基食品研究和开发的大趋势下,对于芸豆蛋白功能特性及改性研究正在成为食品科研与工业领域的热点和焦点。本文将系统阐述芸豆蛋白的功能特性及其改性技术进展,并对未来利用改性修饰技术所生产出的多种芸豆蛋白产品的应用进行了展望,以期扩大芸豆蛋白在食品工业中的应用范围。
1 芸豆蛋白的提取
根据芸豆的品种不同,其所含蛋白质种类和氨基酸组成也有所区别,相应的功能特性和营养价值也存在差异。根据蛋白质分子形状和大小及带电性质的差异,溶解度、吸附性质和与其他分子的亲和能力的不同,芸豆蛋白可以使用湿法提取或干法提取,其中湿法提取主要包括碱溶酸沉法、溶剂浸提法、盐析法和分级提取法,而干法提取方法则主要包括静电分离法和空气筛分法[8]。
1.1 湿法提取
将芸豆粉分散于溶液体系中并加以分离的湿法提取是主流的提取方法,其主要优势在于蛋白质提取效率和产品纯度均较高,但是需要经过干燥处理才能得到粉状产品。
芸豆蛋白的湿法提取方式多样。碱溶酸沉法是利用蛋白质在等电点溶解度最小的性质实现蛋白质的提取,提取工艺简单,粗蛋白得率较高,但在提取过程中的酸碱处理可能会导致蛋白质的变性,进而影响其功能特性。ROY等[9]利用碱溶酸沉法从深红芸豆中提取芸豆蛋白,通过调节脱脂芸豆粉溶液的pH值,在等电点沉淀并分离蛋白质,最终得到蛋白得率达82.34%的芸豆蛋白粉。乙醇法和水提法分别使用乙醇和水作为溶剂,前者提取的醇溶蛋白得率高,操作简单,但能耗较高,且会导致蛋白质一定程度的变性,后者利用萃取温度的不同分离不同蛋白组分,适用于芸豆蛋白的精细化提取分离。YANG等[10]采用乙醇法从大白芸豆、小白芸豆、光斑芸豆、红斑芸豆、黑色斑点芸豆、黑芸豆和红芸豆中提取醇溶蛋白,当使用70%~80%(体积分数)的乙醇溶剂提取时,可以得到蛋白质含量为59.4%~67.2%的醇溶蛋白。不同的提取方式能够直接影响蛋白质组分及其氨基酸组成,盐提取法是利用芸豆蛋白在不同盐离子浓度下溶解度不同将不同的蛋白组分分离,提取出的蛋白组分纯度较高,但盐离子添加可能会改变蛋白质的空间结构进而影响其功能特性。UDEH等[11]采用盐提取法制备芸豆白蛋白和球蛋白,同时采用碱性提取法制备芸豆分离蛋白,所得蛋白的蛋白质含量分别为49.3%、95.7%和83.7%,白蛋白中蛋白质含量低的原因是其中存在较多的可溶性糖,通过测定氨基酸组成谱发现,球蛋白的疏水性氨基酸含量(41%)高于芸豆白蛋白(39%)和芸豆分离蛋白(36%),但它们具有相似(11%)的芳香族氨基酸。多种提取方法分级提取是将单一的提取方法相互配合,分级提取芸豆蛋白中的不同组分,提取的组分种类更多,纯度更高,但操作耗时较长,能耗较高。陈晓萌等[12]利用Osborne分级提取法分离出英国大红芸豆和山西小红芸豆中不同种类的蛋白质,发现大红芸豆和小红芸豆在最佳蛋白提取温度(65 ℃和45 ℃)提取得到的可溶性蛋白中,清蛋白分别占74.08%和66.50%,球蛋白分别占10.08%和13.05%,谷蛋白分别占7.23%和7.24%,醇溶蛋白分别占6.79%和6.12%。随着对蛋白质提取研究的深入,湿法提取也从简单的碱溶酸沉法或醇提法获取粗蛋白逐渐发展为分级提取纯化蛋白质中的组分。
1.2 干法提取
相较于较为常用的湿法提取,干法提取可以避免蛋白质提取过程中化学物质的添加,并且在提取后不需要经过干燥处理,减少了水和能源的消耗,还保留了蛋白质的天然结构和功能,但缺点在于所得蛋白质的纯度和得率均较低[13]。
TABTABAEI等[14]使用连续式的静电分离方法对白芸豆粉进行分离提取,所得产品中蛋白质含量为36%~38%,占总可提取蛋白的43%,所得产品具有良好的乳化稳定性和起泡性。此外,TABTABAEI等[15]还研究并使用了一种两阶段静电分离方法提取紫花芸豆中的蛋白质,所得产品中蛋白质含量为37.8%,占总可提取蛋白的59.9%。由于蛋白得率低以及相关技术和设备的限制,干法提取在芸豆蛋白的提取中应用尚且较少,这也是包括芸豆蛋白在内的蛋白分离提取领域未来的研究方向之一。
2 芸豆蛋白的功能特性
在芸豆蛋白中,储藏蛋白是蛋白质的主要组分,占可提取蛋白总量的95%以上,储藏蛋白主要由球蛋白(55%~80%)、清蛋白(10%~20%)、少量的醇溶蛋白和谷蛋白组成[16],其中球蛋白可以进一步细分为7S和11S球蛋白,7S球蛋白是芸豆中的主要储藏蛋白,占蛋白质总量的75%~82%,7S球蛋白是50 kDa亚基的三聚体,通过非共价相互作用关联,这些低聚球蛋白具有良好的乳化性和起泡性[17]。蛋白质的一级结构很大程度上决定了其高级结构,高级结构的变化则使得蛋白质具备不同的功能特性,豆科蛋白功能特性的产生机制及影响因素如表1所示。
表1 豆科植物蛋白功能特性的产生机制及影响因素
Table 1 Mechanism and influencing factors of functional characteristics of legume protein

性质产生机制影响因素溶解性[18]亲水性疏水氨基酸残基暴露位点乳化性[19]界面吸附和吸附膜的形成蛋白质的分子大小、亲水/疏水性、分子柔性、带电特性和聚集状态起泡性[20]界面吸附和吸附膜的形成分子柔性、分子构象和分子大小持水性和持油性[21-22]氢键、离子水合作用、疏水相互作用亲水/疏水氨基酸残基暴露位点凝胶性[23]网络结构的形成、疏水相互作用蛋白质浓度、分子间作用力成膜性[24-25]分子间相互作用蛋白质分子大小、分子间作用力
不同的食品体系对芸豆蛋白功能特性要求不同,根据食品特点有针对性地利用芸豆蛋白的不同功能性质,可以改善食品的质构与营养特性,并增加产品的市场适应性。
2.1 溶解性
溶解性是蛋白质在食品体系中发挥各种功能特性的重要前提,乳化性、起泡性和胶凝性等功能特性都依赖于其溶解性,溶解性也是开发植物蛋白饮料等产品时应首要考虑的功能特性。蛋白质的溶解性与其疏水相互作用(蛋白质-蛋白质分子之间)和离子相互作用(水-蛋白质分子之间)有关,溶解性较高的蛋白质的疏水性氨基酸残基一般被包埋在其分子内部,当疏水性残基更多地暴露于蛋白质分子表面时,蛋白质的溶解性降低[18]。HOJILLA- EVANGELISTA等[26]比较研究了黑芸豆、大红芸豆、大白芸豆、斑点芸豆蛋白的溶解度差异,证明了芸豆蛋白在pH 1~3和pH 7~10时溶解性良好,而在pH 4~6时溶解性较差,其中大白芸豆蛋白在pH值为4.4时具有最小溶解度,而黑芸豆蛋白和斑点芸豆蛋白的最小溶解度处于pH 3.0~6.0。由此可见,芸豆品种是影响其溶解度的重要因素。热变性程度对于蛋白质的溶解度也有着很大的影响,TANG等[27]在95 ℃加热芸豆蛋白15~30 min,使蛋白质的结构适度展开,7S球蛋白向11S球蛋白转化,从而增加了芸豆蛋白的溶解性,但超过60 min的热处理则会导致蛋白聚集体的形成,改变分子表面的亲水/疏水性平衡,降低蛋白质的溶解性。SHEVKANI等[28]对比研究了芸豆蛋白和豌豆蛋白,发现在pH 2.0和pH 5.0时芸豆蛋白溶解性均优于豌豆蛋白,因此芸豆蛋白适合作为酸性植物蛋白基饮料的豆科蛋白原料。
2.2 乳化性
蛋白质的乳化性通常指它们形成和稳定乳液的能力,是影响冰激凌、焙烤制品、植物基调味酱等产品品质的关键特性。乳化性受多种因素的影响,包括蛋白质的分子大小、亲水/疏水性、分子柔性、带电特性和聚集状态等,蛋白质的解聚会导致疏水氨基酸残基暴露和构象柔韧性增加,从而增强油-水界面活性和蛋白质的吸附能力[19]。SHEVKANI等[20]比较了9种来自印度的芸豆品种,发现具有较好乳化性的芸豆蛋白是由于其所具有的蛋白质组分拥有较低的分子质量和较大的分子柔性。杨柳等[29]的研究表明,紫花芸豆蛋白的乳化性受温度和pH影响很大,在等电点(pH 4~5)附近最差,而在pH 7~8、温度为40~70 ℃的条件下较好,这主要是由于pH变化改变了蛋白质的二级结构所导致的。SHEN等[30]发现红芸豆蛋白质量分数在0.25%~1.0%时,其乳化性和乳化稳定性都显著优于同浓度的红豆和绿豆蛋白,作者认为这是由于在较低蛋白浓度时芸豆蛋白分子具有更好的分子柔性。LIU等[31]利用芸豆分离蛋白良好的乳化性,将芸豆分离蛋白作为微胶囊的壁材,结果表明微胶囊产品的保油效果显著优于使用大豆分离蛋白作为壁材的同类产品,这是由于芸豆蛋白的良好乳化性使得其具有更高的界面蛋白浓度。
2.3 起泡性
蛋白质起泡性和泡沫稳定性的优劣决定了其是否能够在冰淇淋、蛋糕和酥皮点心等食品中良好应用。起泡性会受到分子柔性、分子构象和分子大小的影响,而芸豆中具有良好表面活性的蛋白质组分具有很好的形成和稳定泡沫的作用[20]。SHEVKANI等[28]的研究表明,芸豆蛋白的起泡性与其溶解性和乳化性相似,也和pH值有关,9种来自印度的芸豆蛋白在pH 4.0~5.0的起泡性较差,这与蛋白质在其等电点附近溶解性较差有关。GE等[21]研究了黑芸豆蛋白和斑点芸豆蛋白在pH 3.0~9.0的起泡性和泡沫稳定性,发现在两种芸豆蛋白的起泡性和泡沫稳定性都显著优于大豆蛋白和豌豆蛋白,这归因于芸豆蛋白具有更小的分子质量和柔性更好的分子结构。
2.4 持水性和持油性
蛋白质的持水性和持油性与产品质地、口感和风味保持均有关。具有高持水性的蛋白质有利于减少产品的水分流失,并保持良好的新鲜度和湿润的口感,而具有高持油性的蛋白质则有利于改善产品的口感并且有助于风味物质的保留[21-22]。蛋白质的持油性通常与其乳化性关联,这对于食品乳化体系的构建十分重要。MUNDI等[32]发现红芸豆蛋白中所含不同蛋白组分具有不同的功能特性,球蛋白的持水性和持油性均显著高于白蛋白。GE等[21]研究了黑芸豆和斑点芸豆蛋白在pH 3.0~9.0的持水性和持油性,发现pH 5.0时两种芸豆蛋白的持水性和持油性均为最低;而在pH 3.0和pH 7.0时芸豆蛋白的持油性均显著高于持水性,可归因于此两种pH条件下蛋白质的构象更有利于疏水基团的暴露。RATNAWATI等[6]比较了红芸豆蛋白与大豆蛋白和绿豆蛋白的持水性和持油性,发现红芸豆蛋白具有相对更好的持水性,而大豆蛋白的持油性则更胜一筹;WANI等[33]比较了芸豆蛋白和绿豆蛋白的持水性和持油性也发现芸豆蛋白的持水性更好,而二者持油性的差别不大。
2.5 凝胶性
蛋白质的凝胶性与香肠、豆腐和部分糕点等食品的品质密切相关,其取决于蛋白质的组成成分、浓度以及蛋白质分子间的各种化学键,包括二硫键、氢键、疏水键和范德华力等[23]。不同芸豆蛋白的组成成分不同,形成凝胶的能力也不同,与白蛋白相比,球蛋白的凝胶形成能力更强,这是由于白蛋白所能形成的分子间相互作用力较弱[22]。郭增旺等[34]测得来自红芸豆、白芸豆、黑芸豆和紫花芸豆的蛋白质所形成凝胶所需的最低蛋白质量分数分别为14%、10%、12%和12%,这种差异是由于蛋白质分子结构和组成不同导致的,芸豆蛋白中11S球蛋白的含量越高,其凝胶性越好,而7S/11S的比例越小,所形成凝胶的黏度和硬度越大。陈玲等[35]的研究证明了来自红芸豆的7S球蛋白在pH 2.0且NaCl浓度为30 mmol/L时,仅需1.0%(质量分数)的蛋白质就可以通过热诱导形成凝胶,该质量分数远低于一般中性条件下形成蛋白热凝胶所需的蛋白质质量分数,这是由于芸豆蛋白在酸性条件下形成了纤维状聚集体。
2.6 成膜性
同大豆分离蛋白、玉米醇溶蛋白相似,芸豆醇溶蛋白同样具备成膜性,由于芸豆蛋白拥有复杂的空间结构,单纯的蛋白溶液无法直接通过静电纺丝成膜,常需加入具有可纺性的高分子聚合物进行共混纺丝。杨豫斐[24]利用聚乙烯醇对具有较强疏水性的白花芸豆醇溶蛋白进行静电纺丝,制成了可用于食品保鲜的生物可降解电纺膜。CHOE等[25]对芸豆蛋白浓缩物进行了pH偏移处理、pH偏移联合超声或热处理,研究表明pH偏移联合适当的热处理可以促使芸豆蛋白聚集体形成,有效减小紧密堆积的表面区域,有利于高黏弹性蛋白薄膜的形成。
3 改性对芸豆蛋白功能特性的影响
蛋白质的分子大小、表面电荷、亲水/疏水性和分子柔性对其功能特性有很大的影响。因此,通过物理、化学和生物(酶法)改性的方法改变蛋白质的分子结构,从而改变蛋白质的功能特性,可以大幅度拓宽蛋白质在食品工业中的应用范围。豆科植物蛋白的多种功能特性都可以通过物理、化学和生物改性方法来调整,其改性后的结构变化及其在食品体系中的应用情况如表2所示。
表2 豆科植物蛋白的改性方式及改性后的结构变化与在食品体系中的应用
Table 2 Modification methods of legume protein, structural changes after modification and application in foods

性质改性方式改性后结构变化食品体系中的应用溶解性物理改性、化学改性、酶法改性分子大小、亲水/疏水性蛋白粉[36]、饮料[37]乳化性物理改性、化学改性、酶法改性亲水/疏水性冰激凌[38]、焙烤制品[39]、纯素食调味酱[40]起泡性物理改性、化学改性、酶法改性分子大小、分子柔性奶油[41-42]持水性和持油性物理改性、酶法改性亲水/疏水性香肠[43]、调味料[44]凝胶性化学改性、酶法改性氨基酸组成豆腐[45]、肉制品[46]成膜性物理改性分子大小包装膜[33-35]
3.1 物理改性
蛋白质的物理改性通常是利用机械处理、加热、冷冻、电场或磁场等物理作用方式,改变蛋白质的高级结构和分子间的聚集方式,一般不涉及蛋白质一级结构的改变。物理改性通常具有成本低、操作时间短和营养品质损失小等优点。受控的热处理、超声处理和高压处理是常见的芸豆蛋白物理改性方法[47]。物理改性方法对蛋白质功能特性的影响如表3所示。
表3 物理改性对芸豆蛋白功能特性的改变及作用方式
Table 3 Physical modification on the functional properties of kidney bean protein and its mechanism

修饰方法功能特性变化作用方式热处理[48]溶解性、持水性和持油性蛋白质结构舒展,暴露亲水/疏水基团,增强了蛋白质与水/油的相互作用超声处理[49-50]溶解性、乳化性蛋白质分子间的缔合遭到破坏,内部的疏水基团暴露,二硫键数量减少,游离巯基增加高压处理[51]溶解性、乳化性、持水性和成膜性蛋白质分子解离重聚,破坏维系三、四级结构的氢键和疏水相互作用射流空化处理[52]溶解性、乳化性蛋白质二级结构中α-螺旋和β-折叠占比减少,分子结构致密性降低
受控的热处理不仅可以改变芸豆蛋白的功能特性,还可以提高芸豆的可消化性,灭活部分抗营养因子,提高必需氨基酸的利用率,从而增加芸豆蛋白的营养价值。CHOE等[5]的研究表明湿热处理比干热处理能够有效提高芸豆蛋白的持水性,这是由于羟基基团的暴露;而干热处理则能够有效提高芸豆蛋白的持油性,这是由于疏水基团的暴露。周荣荣等[48]分别利用蒸制和煮制两种热处理方式对芸豆蛋白进行改性,热处理后蛋白结构变得松散从而增强了蛋白质与水的相互作用,增加了芸豆蛋白的溶解性。热处理的方式和程度会直接影响芸豆蛋白分子构象,进而影响其溶解性,因此,蛋白质的适度热处理在食品工业生产中应用广泛。
超声处理能够显著增强蛋白质与水的相互作用,使蛋白质结构展开,通常可以提高芸豆蛋白的溶解性。BYANJU等[49]的研究表明,使用高功率超声对芸豆进行处理,可以使所提取的芸豆蛋白中游离巯基的含量增加,蛋白质结构展开程度增大,从而显著提高了蛋白质的溶解性。KILICLI等[50]分别使用常规浸泡和超声波辅助浸泡分别处理芸豆,结果表明,超声波辅助浸泡可以更有效地改变蛋白质结构,所提取芸豆蛋白起泡性较常规浸泡提高了133%。超声处理的功率和时间都会对芸豆蛋白的功能特性产生影响,适宜的超声功率、时间会破坏蛋白质分子间的缔合,暴露更多的疏水/亲水基团,增加蛋白的乳化性。
高压处理能够改变蛋白质的二级结构,从而改善其持水性、乳化性及发泡性。AHMED等[51]对红芸豆蛋白进行了高压处理,结果表明,随着压力从200 MPa增加到600 MPa,芸豆蛋白的二级结构发生变化,导致分子发生聚集,蛋白质的持水性和乳化性增加,而起泡性降低。GUO等[37]的研究也得到了类似的结论,适当程度的高压处理可以促使芸豆蛋白形成可溶性聚集体,从而可以提升其溶解性和乳化性。通过高压处理,芸豆蛋白发生变性聚集,形成可溶性聚集体,进而可能提升其溶解度、乳化性、持水性及成膜性。
射流空化处理是一种新型的蛋白质物理改性方法,该方法通过将水射流技术与空化效应相结合可以改变蛋白质的表面电荷、亲水/疏水性和分子柔性,从而提升蛋白质的溶解性和乳化性。王馨等[52]使用射流空化技术对芸豆蛋白进行了改性,芸豆蛋白的溶解性和乳化性分别增加了27.5%和140%,这是由于蛋白质二级结构中α-螺旋和β-折叠所占比例下降,也就是分子结构致密性降低造成的。随着新型物理改性技术应用于芸豆蛋白,其在食品工业中的应用范围变得更加广泛。
3.2 化学改性
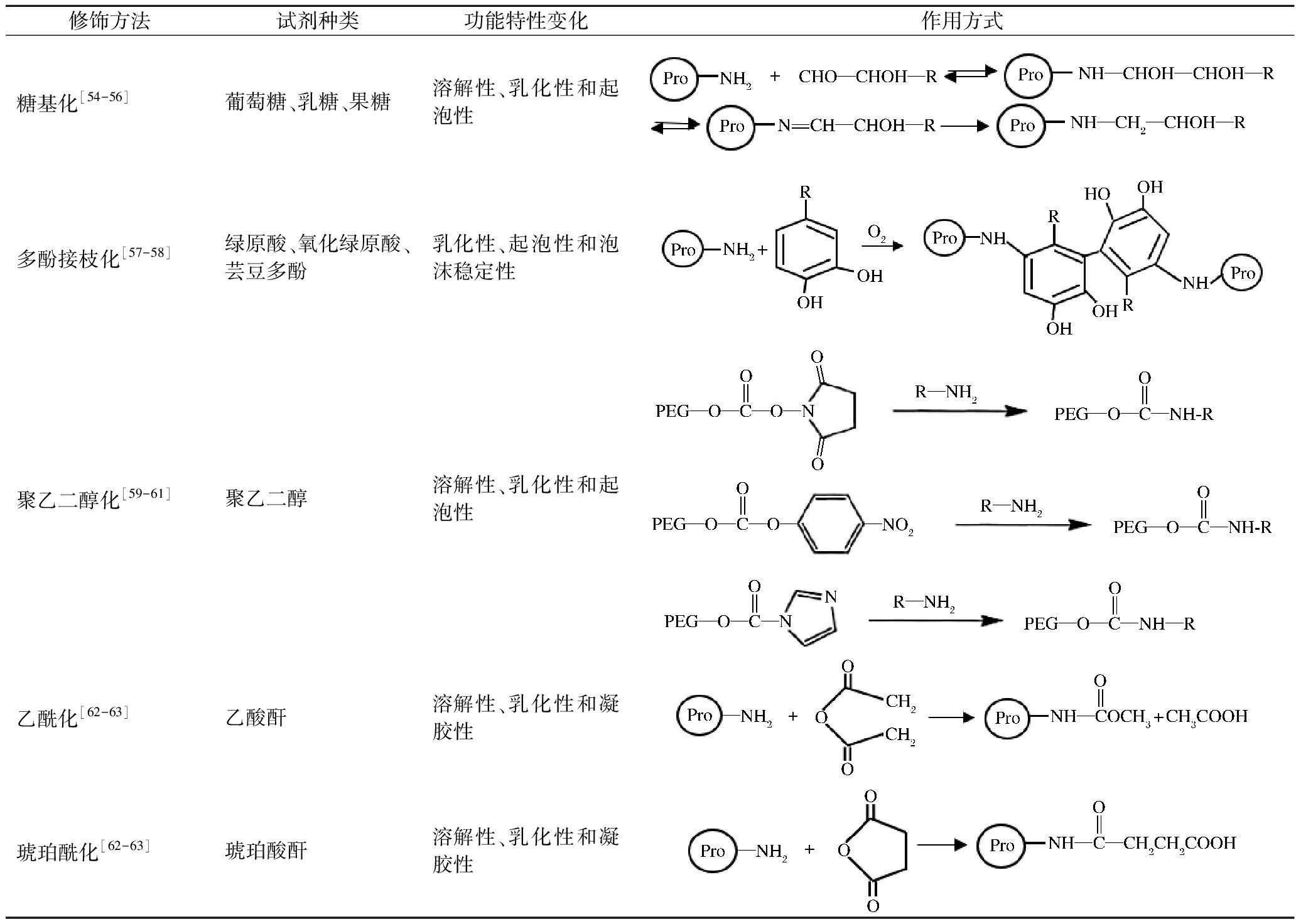
化学改性通常是通过化学试剂作用于蛋白质,引入新的基团或者消除蛋白质结构中的已有基团,从而达到改变蛋白质功能特性的目的。但是,化学改性需要加入特定试剂处理样品,工艺过程较为复杂,安全性相对低于物理改性。目前常用的化学改性主要包括脱酰胺作用、磷酸化作用、糖基化作用、酰化作用、多酚接枝和聚乙二醇作用等。其中,糖基化处理、多酚接枝处理、聚乙二醇化处理和乙酰/琥珀酰化处理是常见的芸豆蛋白化学改性方法[53]。化学改性方法对蛋白质功能特性的影响及作用方式如表4所示。
糖基化处理可以通过改变蛋白质分子的构象,提升芸豆蛋白的溶解性、乳化性和起泡性。吴海涛等[54]的研究表明,糖基化改性后,芸豆蛋白的溶解性、乳化性、乳化稳定性和起泡性均显著提高,更适合添加到香肠中以提高产品的弹性并改善风味品质。冯玉超等[55]在对芸豆蛋白进行糖基化处理后发现其溶解性、乳化性和乳化稳定性都显著提升,这是由于糖基化使得蛋白质二级结构发生变化,蛋白分子的亲水/疏水性发生改变造成的。林巍等[56]的研究也得到了类似的结果,芸豆蛋白在与果糖发生美拉德反应后,其乳化性和乳化稳定性分别提高了163%和69.9%。
多酚接枝处理能够改变芸豆蛋白的空间结构,从而提高芸豆蛋白乳化性、起泡性和泡沫稳定性,还有利于改善其抗氧化活性。李杨等[57]使用绿原酸对黑芸豆蛋白进行共价接枝后,蛋白质的乳化性显著提升,这是由于接枝后蛋白质的多肽链发生延展,从而改变了亲水/疏水性导致的。刘研兵等[58]则使用芸豆多酚和芸豆蛋白进行共价接枝,结果表明,80 ℃是最适合提高接枝复合物抗氧化活性的温度,芸豆蛋白在接枝后的溶解性、乳化性和起泡性也都显著提升。
聚乙二醇化处理使聚乙二醇与蛋白质偶联,从而屏蔽蛋白质中的疏水基团,可以改善蛋白质的溶解性、乳化性和发泡性。聚乙二醇化改性对芸豆蛋白功能特性的影响如图1所示[59-61]。HE等[60]使用聚乙二醇琥珀酰亚胺基碳酸酯(PEGylation succinimidyl carbonate,PEG-SC)、聚乙二醇琥珀酰亚胺基琥珀酸酯(PEGylation succinimidyl succinate,PEG-SS)和聚乙二醇琥珀酰亚胺基丙酸酯(PEGylation succinimidyl propionate,PEG-SPA)对黑芸豆蛋白进行偶联,所得到的聚乙二醇化黑芸豆蛋白的溶解度、乳化性和发泡性均得到改善,热力学稳定性也有显著提高。YANG等[61]使用甲氧基聚乙二醇对黑芸豆蛋白进行聚乙二醇化处理,结果表明,甲氧基聚乙二醇链对疏水基团的屏蔽作用可以使蛋白质获得良好的凝胶性。
表4 化学改性对芸豆蛋白功能特性的改变及作用方式
Table 4 Chemical modification on the functional properties of kidney bean protein and its mechanism
修饰方法试剂种类功能特性变化作用方式糖基化[54-56]葡萄糖、乳糖、果糖溶解性、乳化性和起泡性多酚接枝化[57-58]绿原酸、氧化绿原酸、芸豆多酚乳化性、起泡性和泡沫稳定性聚乙二醇化[59-61]聚乙二醇溶解性、乳化性和起泡性乙酰化[62-63]乙酸酐溶解性、乳化性和凝胶性琥珀酰化[62-63]琥珀酸酐溶解性、乳化性和凝胶性
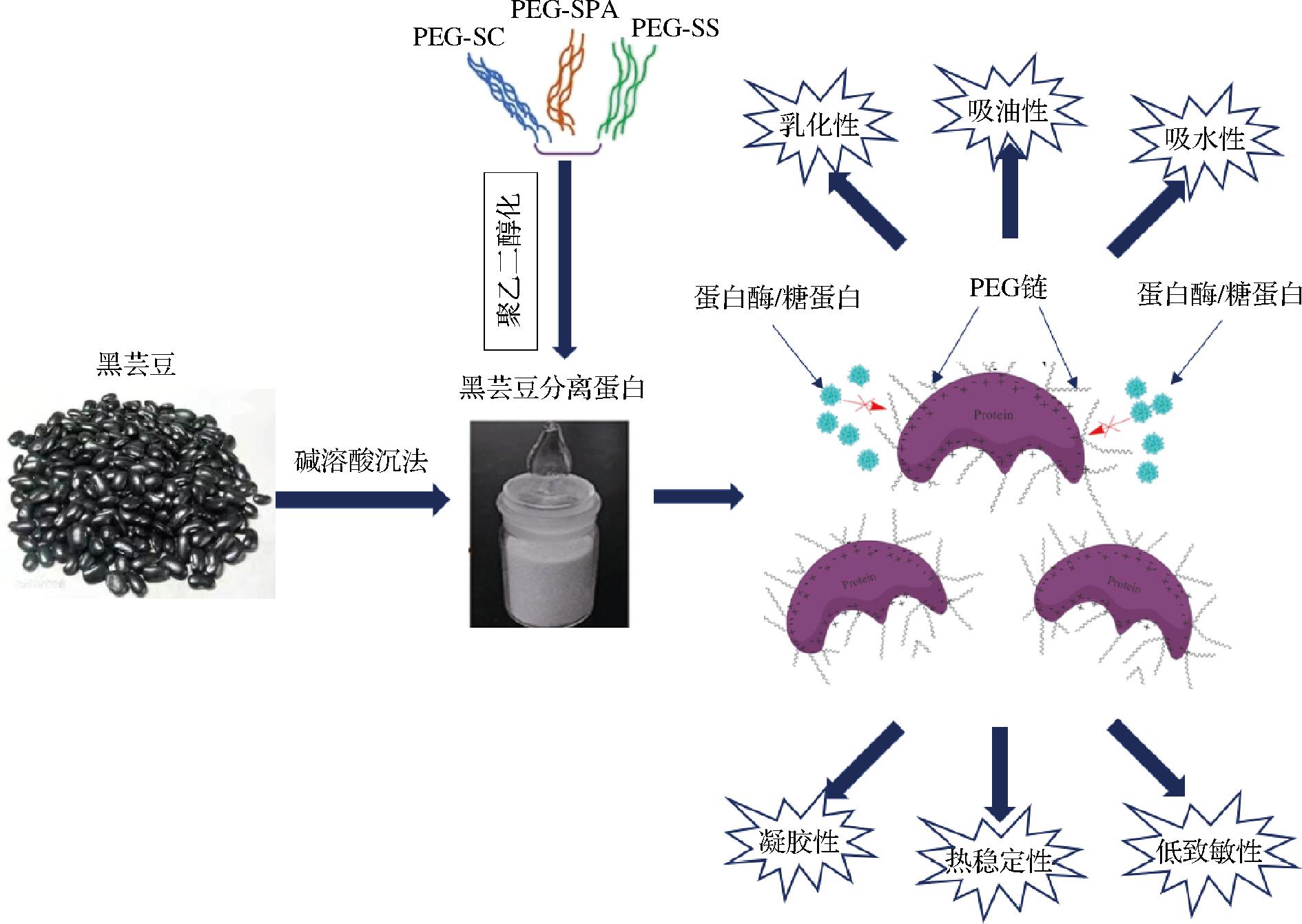
图1 聚乙二醇化改性对芸豆蛋白功能特性的影响[59-61]
Fig.1 Effect of polyethylene glycol modification on functional properties of kidney bean protein[59-61]
乙酰/琥珀酰化处理可以改变芸豆蛋白的二级和三级结构,从而影响蛋白质的溶解性、乳化性和凝胶性。YIN等[62]的研究表明,芸豆蛋白的溶解性和乳化性可以通过乙酰化或琥珀酰化显著提升,特别是琥珀酰化还可以增加芸豆蛋白的凝胶性,这是由于蛋白质分子表面带电性的改变以及多肽链结构的展开造成的。左锋等[63]采用乙酰化处理对芸豆分离蛋白进行改性处理,显著提高蛋白质的凝胶性和在中性pH条件下的溶解性。
3.3 酶法改性
酶法改性是通过蛋白酶的限制性酶解或酶促交联使蛋白质的氨基酸残基和多肽链发生变化,从而达到调控蛋白质功能特性的目的。相较于化学改性,酶法改性具有专一性强、效率高、毒副作用小等优点,因而更为常用。酶法改性对蛋白质功能特性的影响及原理如表5所示。
表5 酶法改性对芸豆蛋白功能特性的改变及作用方式
Table 5 Enzymatic modification on the functional properties of kidney bean protein and its mechanism

修饰方法酶的种类功能特性变化作用方式限制性酶解[64-66]碱性蛋白酶、木瓜蛋白酶、胃蛋白酶溶解性、持水性、持油性、乳化性和起泡性分子质量减小,可电离组分增加,非特异性氨基酸残基暴露酶促交联[67-69]转谷氨酰胺酶乳化性、凝胶性破坏蛋白质分子间的缔合,内部的疏水基团暴露,游离巯基增加复合改性[70]碱性蛋白酶、胰蛋白酶、胃蛋白酶乳化性、起泡性、持水性和凝胶性蛋白质解聚,内部亲水基团释放,分子结构致密性降低
对芸豆蛋白进行限制性酶解改性时,通常使用碱性蛋白酶、胃蛋白酶、木瓜蛋白酶和胰蛋白酶等单独或者复合进行酶解。由于不同蛋白酶的酶切位点不同,使用它们所得的改性产物会具有不同的功能特性和抗氧化能力[64]。在蛋白酶催化的限制性酶解后,蛋白质的平均分子质量有所减小,结构致密性也有所降低,蛋白质的溶解性得到提高[62]。SAAD等[65]使用碱性蛋白酶Alcalase分别酶解白、红和黑芸豆蛋白后获得3种芸豆蛋白的酶解产物,黑芸豆蛋白酶解产物功能特性的提升最为显著,其溶解性、持油性和起泡性分别增加了约30%、35%和40%,使用黑芸豆蛋白酶解产物作为涂层,可以有效延长冷藏生鸡肉的保质期并提高其感官品质。WANI等[43]使用木瓜蛋白酶对芸豆分离蛋白进行改性,所得改性产物的溶解度、持水性、持油性、起泡性、乳化性和乳化稳定性均较改性前有所提升,特别是在pH 4~5时也拥有了良好的乳化性和起泡性。限制性酶解可以使芸豆蛋白应用于低pH的食品中。毛小雨等[66]使用胃蛋白酶对紫花芸豆蛋白进行酶解改性,改变了蛋白质的二级结构并增加了其亲水能力,从而提高了蛋白质的溶解性,此外,发现酶解产物的抗氧化能力也呈现出与溶解性相同的变化趋势,这是由非特异性氨基酸残基的暴露造成的。
除了使用最为广泛的限制性酶解改性,酶促交联改性也是提高蛋白质功能特性的方法之一。TANG等[67]的研究表明使用谷氨酰胺转氨酶对芸豆蛋白进行交联改性可以提高蛋白质的热稳定性和凝胶性,但是会降低其溶解性和乳化性。何庆燕等[68]的研究表明,鸡肉蛋白与芸豆蛋白在转谷氨酰胺酶作用下可发生共价交联,酶能催化芸豆蛋白自身发生共价交联,从而使乳化性提升187%,也可以催化鸡肉蛋白与芸豆蛋白这两种异源蛋白之间的交联, 生成大分子聚集体,提高混合蛋白的乳化性和凝胶性。综上,酶促交联改性可以改善蛋白质的凝胶性和乳化性,还可以改变蛋白质质构的柔韧性,有效扩大蛋白质的应用范围[69]。
由于单一的酶法改性改变芸豆蛋白功能特性的效果较为受限,复合改性能优化改性结果或者弥补单一改性方法的不足之处。AL-RUWAIH等[70]发现高压处理可以辅助促进芸豆蛋白的Alcalase酶解改性,相较单独使用酶解改性的产物,复合改性所得产物的持水性进一步提升,可能是由于适度的高压使得在酶解过程中蛋白质解聚,亲水基团更多地释放到了分子表面,高压辅助酶解处理对芸豆蛋白功能特性的影响如图2所示。由此可见,物理方法和酶法联合使用改性芸豆蛋白可以更为有效地改变其结构,提高蛋白质的乳化性、起泡性、持水性和凝胶性,从而扩大芸豆蛋白的应用范围。
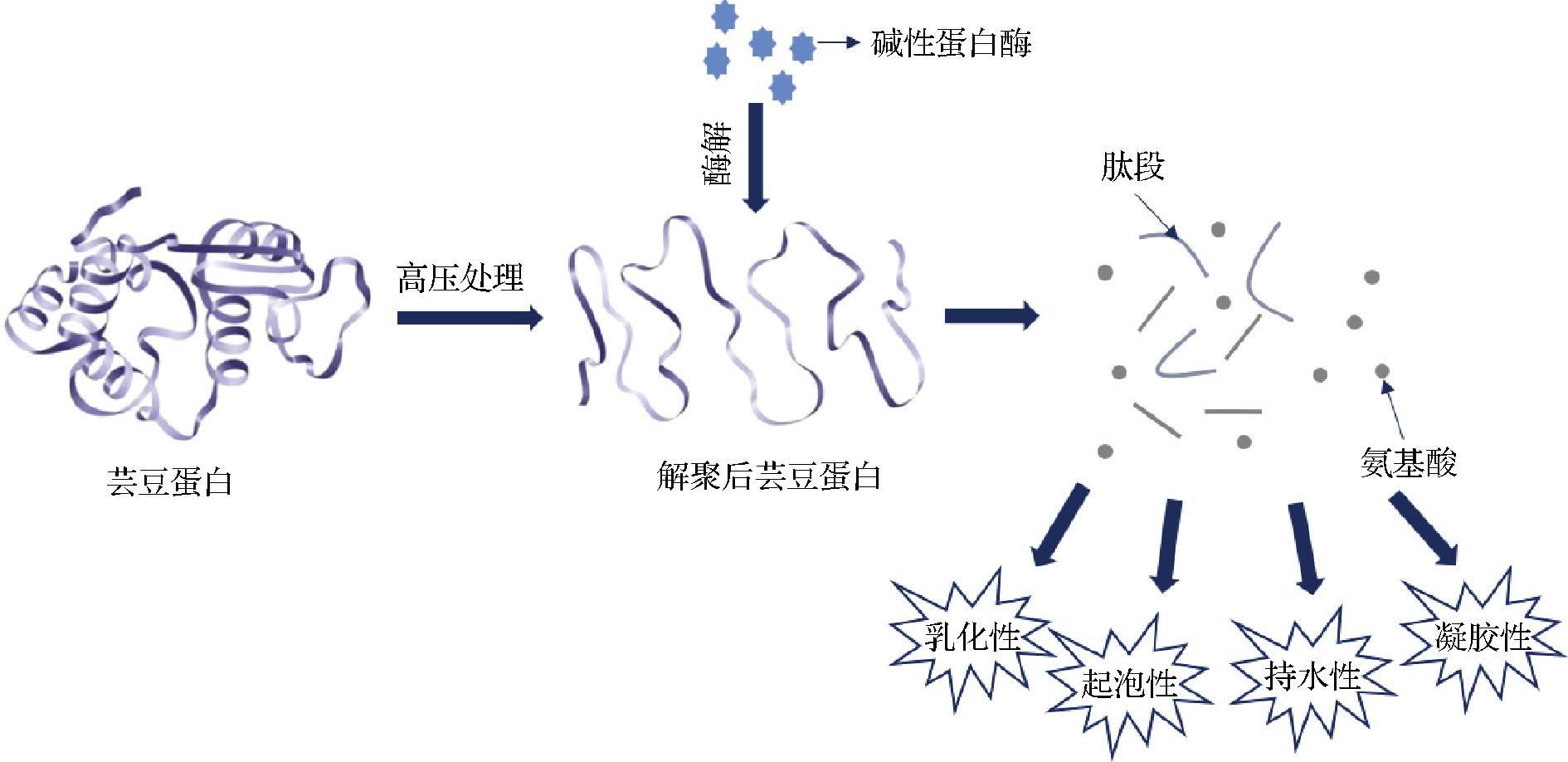
图2 高压辅助酶解处理对芸豆蛋白功能特性的影响
Fig.2 Effect of high pressure assisted enzymatic hydrolysis on functional properties of kidney bean protein
4 结论与展望
芸豆蛋白具有良好的功能特性和营养价值,在食品工业中用途广泛,既能够作为营养强化剂、膳食补充剂和生物活性肽的来源,也可以作为天然乳化剂、质构改良剂、可食用涂层材料和食用微胶囊的壁材,应用范围十分广泛。芸豆蛋白在乳化性和起泡性等功能特性上具有独特优势,在持水性和凝胶性等方面也不逊于大豆、豌豆等其他豆类蛋白。但是,芸豆蛋白在食品工业中的应用现状与其自身具备的优势并不匹配,利用蛋白质的分离和多种改性技术生产出具备特定优异功能特性的芸豆蛋白产品的研究还相对薄弱,芸豆蛋白的凝胶性和成膜性等功能特性的提升空间仍然很大。因此,通过改性提高芸豆蛋白的功能特性,可以拓展其在现有食品以及新型食品中的应用范围,提高芸豆蛋白加工的产业附加值。
芸豆蛋白功能特性以及改性相关领域未来几年的研究方向将聚焦于以下的3个方面:其一,复合方法改性:现有芸豆蛋白的改性方法大多是基于单一的物理、化学或生物方法,功能特性的调控效果受到局限,多种方法的合理选择和搭配有助于更有效且有针对性地提高芸豆蛋白的功能特性,制得具有适宜消费者需要的功能特性的改性芸豆蛋白;其二,应用范围的拓展:与目前广泛应用于植物蛋白饮料、植物肉等产品中的大豆蛋白、花生蛋白相比,芸豆蛋白的应用范围还十分有限,这需要在蛋白提取及改性等诸多方面进行应用基础研究;其三,伴随物抗营养因子的消除:芸豆蛋白中伴随有植物凝集素等致敏性成分和胰蛋白酶抑制剂等抗消化成分存在,针对这些抗营养成分的分离和淬灭消除方法尚且存在各种局限,常用的浸泡煮沸方法在消除抗营养因子的同时往往会降低蛋白质的功能特性,化学或生物改性方法将有可能在消除抗营养因子的同时降低对蛋白质功能特性的不良影响,使得芸豆蛋白在更广泛的食品体系中安全有效地作为营养强化剂和膳食补充剂使用。
[1] WEN C T, LIU G Y, REN J Y, et al.Current progress in the extraction, functional properties, interaction with polyphenols, and application of legume protein[J].Journal of Agricultural and Food Chemistry, 2022, 70(4):992-1002.
[2] NAKAMURA A, OHBOSHI H, SAKAI M, et al.Extraction of water-soluble polysaccharides from kidney beans and examination of their protein dispersion and stabilization properties under acidic conditions[J].Food Research International, 2021, 144:110357.
[3] KAMBABAZI M R, OKOTH M W, NGALA S, et al.Evaluation of nutrient content in red kidney beans, amaranth leaves, sweet potato roots and carrots cultivated in Rwanda[J].African Journal of Food, Agriculture, Nutrition and Development, 2021, 21(4):17801-17814.
[4] HAN F, MOUGHAN P J, LI J T, et al.Digestible indispensable amino acid scores (DIAAS) of six cooked Chinese pulses[J].Nutrients, 2020, 12(12):3831.
[5] CHOE U, OSORNO J M, OHM J B, et al.Modification of physicochemical, functional properties, and digestibility of macronutrients in common bean (Phaseolus vulgaris L.) flours by different thermally treated whole seeds[J].Food Chemistry, 2022, 382:132570.
[6] RATNAWATI L, DESNILASARI D, SURAHMAN D N, et al.Evaluation of physicochemical, functional and pasting properties of soybean, mung bean and red kidney bean flour as ingredient in biscuit[J].IOP Conference Series:Earth and Environmental Science, 2019, 251:012026.
[7] 汪云吉, 刘丽娅, 佟立涛, 等.无凝集活力花芸豆α-淀粉酶抑制剂提取物的制备及其对主食eGI的影响[J].食品与发酵工业, 2021, 47(13):112-118. WANG Y J, LIU L Y, TONG L T, et al.Preparation of α-amylase inhibitor without lectin activity from kidney bean and its effect on eGI of staple food[J].Food and Fermentation Industries, 2021, 47(13):112-118.
[8] SCHUTYSER M A I, VAN DER GOOT A J.The potential of dry fractionation processes for sustainable plant protein production[J].Trends in Food Science &Technology, 2011, 22(4):154-164.
[9] ROY M, SARKER A, AZAD M A K, et al.Evaluation of antioxidant and antimicrobial properties of dark red kidney bean (Phaseolus vulgaris) protein hydrolysates[J].Journal of Food Measurement and Characterization, 2020, 14(1):303-313. [10] YANG Y F, HE S D, ZHANG Y, et al.Comparison of crude prolamins from seven kidney beans (Phaseolus vulgaris L.) based on composition, structure and functionality[J].Food Chemistry, 2021, 357:129748.
[11] UDEH C, IFIE I, AKPODIETE J, et al.Kidney bean protein products as potential antioxidative and antihypertensive alternatives for non-pharmacological inhibition of angiotensin-converting enzymes[J].Scientific African, 2021, 11:e00693.
[12] 陈晓萌, 王常青, 訾艳, 等.2种红芸豆蛋白的提取及组分分析[J].食品科学, 2015, 36(2):149-154. CHEN X M, WANG C Q, ZI Y, et al.Extraction and analysis of proteins from red kidney beans from different growing regions[J].Food Science, 2015, 36(2):149-154.
[13] FERREIRA K C, BENTO J, CALIARI M, et al.Dry bean proteins:Extraction methods, functionality, and application in products for human consumption [J].Cereal Chemistry, 2022, 99(1):67-77.
[14] TABTABAEI S, KONAKBAYEVA D, RAJABZADEH A R, et al.Functional properties of navy bean (Phaseolus vulgaris) protein concentrates obtained by pneumatic tribo-electrostatic separation[J].Food Chemistry, 2019, 283:101-110.
[15] TABTABAEI S, VITELLI M, RAJABZADEH A R, et al.Analysis of protein enrichment during single- and multi-stage tribo-electrostatic bioseparation processes for dry fractionation of legume flour[J].Separation and Purification Technology, 2017, 176:48-58.
[16] SAAD A M, OSMAN A O M, MOHAMED A S, et al.Enzymatic hydrolysis of Phaseolus vulgaris protein isolate:Characterization of hydrolysates and effect on the quality of minced beef during cold storage[J].International Journal of Peptide Research and Therapeutics, 2020, 26(1):567-577.
[17] LIANG H N, TANG C H.Emulsifying and interfacial properties of vicilins:Role of conformational flexibility at quaternary and/or tertiary levels[J].Journal of Agricultural and Food Chemistry, 2013, 61(46):11140-11150.
[18] ZHU X Q, ZENG J H, SUN B Y, et al.Extraction, conformation characteristics and functional properties of soybean lipophilic proteins[J].Food Bioscience, 2022, 49:101907.
[19] MA K K, GREIS M, LU J K, et al.Functional performance of plant proteins[J].Foods, 2022, 11(4):594.
[20] SHEVKANI K, KAUR R, SINGH N, et al.Colour, composition, digestibility, functionality and pasting properties of diverse kidney beans (Phaseolus vulgaris) flours[J].Current Research in Food Science, 2022, 5:619-628.
[21] GE J, SUN C X, MATA A, et al.Physicochemical and pH-dependent functional properties of proteins isolated from eight traditional Chinese beans[J].Food Hydrocolloids, 2021, 112:106288.
[22] MIRZANAJAFI-ZANJANI M, YOUSEFI M, EHSANI A.Challenges and approaches for production of a healthy and functional mayonnaise sauce[J].Food Science &Nutrition, 2019, 7(8):2471-2484.
[23] GE J, SUN C X, CHANG Y Y, et al.Understanding the differences in heat-induced gel properties of twelve legume proteins:A comparative study[J].Food Research International, 2023, 163:112134.
[24] 杨豫斐. 芸豆醇溶蛋白粗提物组成鉴定及电纺成膜特性研究[D].合肥:合肥工业大学, 2021. YANG Y F. Identification of crude prolamin extract from kidney bean (Phaseolus vulgaris L.) and study on its electrospinning characteristics[D].Hefei:Hefei University of Technology, 2021.
[25] CHOE U, CHANG L Y, OHM J B, et al.Structure modification, functionality and interfacial properties of kidney bean (Phaseolus vulgaris L.) protein concentrate as affected by post-extraction treatments[J].Food Hydrocolloids, 2022, 133:108000.
[26] HOJILLA-EVANGELISTA M P, SUTIVISEDSAK N, EVANGELISTA R L, et al.Composition and functional properties of saline-soluble protein concentrates prepared from four common dry beans (Phaseolus vulgaris L.)[J].Journal of the American Oil Chemists’ Society, 2018, 95(8):1001-1012.
[27] TANG C H, MA C Y.Heat-induced modifications in the functional and structural properties of vicilin-rich protein isolate from kidney (Phaseolus vulgaris L.) bean[J].Food Chemistry, 2009, 115(3):859-866.
[28] SHEVKANI K, SINGH N, KAUR A, et al.Structural and functional characterization of kidney bean and field pea protein isolates:A comparative study[J].Food Hydrocolloids, 2015, 43:679-689.
[29] 杨柳, 覃小丽, 李依灿, 等.超声处理对肾豆蛋白乳化活性和结构的影响[J].食品与发酵工业, 2018, 44(11):117-123. YANG L, QIN X L, LI Y C, et al.Effects of ultrasonic treatment on emulsifying activity and structure of kidney bean protein[J].Food and Fermentation Industries, 2018, 44(11):117-123.
[30] SHEN L, TANG C H.Emulsifying properties of vicilins:Dependence on the protein type and concentration[J].Food Hydrocolloids, 2014, 36:278-286.
[31] LIU F, CHEN Z, TANG C H.Microencapsulation properties of protein isolates from three selected Phaseolus legumes in comparison with soy protein isolate[J].LWT - Food Science and Technology, 2014, 55(1):74-82.
[32] MUNDI S, ALUKO R E.Physicochemical and functional properties of kidney bean albumin and globulin protein fractions[J].Food Research International, 2012, 48(1):299-306.
[33] WANI I A, ANDRABI S N, SOGI D S, et al.Comparative study of physicochemical and functional properties of flours from kidney bean (Phaseolus vulgaris L.) and green gram (Vigna radiata L.) cultivars grown in Indian temperate climate[J].Legume Science, 2020, 2(1):e11.
[34] 郭增旺, 陆涛, 瞿东杨, 等.四种芸豆蛋白的理化与功能特性分析[J].中国食品添加剂, 2016(8):199-204. GUO Z W, LU T, QU D Y, et al.Analysis of physicochemical and functional properties of four kinds of kidney bean protein[J].China Food Additives, 2016(8):199-204.
[35] 陈玲, 唐传核.热致芸豆7S球蛋白透明凝胶性能研究[J].现代食品科技, 2010, 26(5):433-436. CHEN L, TANG C H.Heat-induced transparent gels of 7S globulin storage proteins from red kidney bean[J].Modern Food Science and Technology, 2010, 26(5):433-436.
[36] MESFIN N, BELAY A, AMARE E.Effect of germination, roasting, and variety on physicochemical, techno-functional, and antioxidant properties of chickpea (Cicer arietinum L.) protein isolate powder[J].Heliyon, 2021, 7(9):e08081.
[37] GUO Z W, HUANG Z X, GUO Y N, et al.Effects of high-pressure homogenization on structural and emulsifying properties of thermally soluble aggregated kidney bean (Phaseolus vulgaris L.) proteins[J].Food Hydrocolloids, 2021, 119:106835.
[38] KUMAR M, TOMAR M, PUNIA S, et al.Plant-based proteins and their multifaceted industrial applications[J].LWT, 2022, 154:112620.
[39] SINGH M, BYARS J A, LIU S X.Navy bean flour particle size and protein content affect cake baking and batter quality [J].Journal of Food Science, 2015, 80(6):E1229-E1234.
[40] CERRO D A, MALDONADO A P, MATIACEVICH S B.Comparative study of the physicochemical properties of a vegan dressing-type mayonnaise and traditional commercial mayonnaise[J].Grasas y Aceites, 2021, 72(4):e439.
[41] KAMANI M H, SEMWAL J, MOUSAVI KHANEGHAH A.Functional modification of grain proteins by dual approaches:Current progress, challenges, and future perspectives[J].Colloids and Surfaces B:Biointerfaces, 2022, 211:112306.
[42] NINGTYAS D W, BHANDARI B, PRAKASH S.Modulating the fat globules of plant-based cream emulsion:Influence of the source of plant proteins[J].Innovative Food Science &Emerging Technologies, 2021, 74:102852.
[43] WANI I A, SOGI D S, SHIVHARE U S, et al.Physico-chemical and functional properties of native and hydrolyzed kidney bean (Phaseolus vulgaris L.) protein isolates[J].Food Research International, 2015, 76:11-18.
[44] ALICE A, KAYODE A, SUBUOLA F, et al.Assessment of physico-chemical, micro-biological and sensory properties of seasoning developed from mushroom and locust bean[J].Australian Journal of French Studies, 2012, 6:524-528.
[45] WANG F, MENG J, SUN L, et al.Study on the tofu quality evaluation method and the establishment of a model for suitable soybean varieties for Chinese traditional tofu processing[J].LWT, 2020, 117:108441.
[46] KUREK M A, ONOPIUK A, POGORZELSKA-NOWICKA E, et al.Novel protein sources for applications in meat-alternative products:Insight and challenges[J].Foods, 2022, 11(7):957.
[47] SUN C X, DAI L, LIU F G, et al.Simultaneous treatment of heat and high pressure homogenization of zein in ethanol-water solution:Physical, structural, thermal and morphological characteristics[J].Innovative Food Science &Emerging Technologies, 2016, 34:161-170.
[48] 周荣荣, 庄柯瑾, 梁得福, 等.不同热处理方式对芸豆蛋白提取及其体外消化性能的影响[J].食品科技, 2021, 46(12):186-190. ZHOU R R, ZHUANG K J, LIANG D F, et al.Effects of different heat treatments on extraction and in vitro digestibility of kidney bean protein[J].Food Science and Technology, 2021, 46(12):186-190.
[49] BYANJU B, RAHMAN M M, HOJILLA-EVANGELISTA M P, et al.Effect of high-power sonication pretreatment on extraction and some physicochemical properties of proteins from chickpea, kidney bean, and soybean[J].International Journal of Biological Macromolecules, 2020, 145:712-721.
[50] KILICLI M, TOKER O S.Some physicochemical and technological properties of cooking water of pulses as a canned industry waste:Effect of ultrasound treatment during soaking[J].International Journal of Food Engineering, 2022, 18(2):105-118.
[51] AHMED J, AL-RUWAIH N, MULLA M, et al.Effect of high pressure treatment on functional, rheological and structural properties of kidney bean protein isolate[J].LWT, 2018, 91:191-197.
[52] 王馨, 郭亚男, 曹铭, 等.射流空化处理对芸豆蛋白的影响[J].粮食科技与经济, 2020, 45(2):63-65;73. WANG X, GUO Y N, CAO M, et al.Effect of jet cavitation on kidney bean protein[J].Grain Science and Technology and Economy, 2020, 45(2):63-65;73.
[53] WANG Y F, HE S D, ZHOU F L, et al.Detection of lectin protein allergen of kidney beans (Phaseolus vulgaris L.) and desensitization food processing technology[J].Journal of Agricultural and Food Chemistry, 2021, 69(49):14723-14741.
[54] 吴海涛, 富天昕, 张舒, 等.改性芸豆蛋白添加量对香肠品质影响的研究[J].农产品加工, 2019(17):10-15. WU H T, FU T X, ZHANG S, et al.Study on the effect of modified kidney bean protein addition on sausage quality[J].Farm Products Processing, 2019(17):10-15.
[55] 冯玉超, 王长远, 李玉琼, 等.芸豆蛋白与糖基化芸豆蛋白结构与功能特性研究[J].中国食品学报, 2019, 19(7):99-107. FENG Y C, WANG C Y, LI Y Q, et al.Studies on the structure and functional characteristics of the kidney bean protein and the modified kidney bean protein[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(7):99-107.
[56] 林巍, 刘晓兰, 任健, 等.3种还原糖对芸豆清蛋白糖基化改性产物乳化性及结构的影响[J].食品与机械, 2019, 35(10):170-173. LIN W, LIU X L, REN J, et al.Effect of three reducing sugars on emulsifying property and structure of Maillard products of kidney bean protein[J].Food &Machinery, 2019, 35(10):170-173.
[57] 李杨, 闫世长, 齐宝坤, 等.绿原酸改性黑芸豆蛋白抗氧化活性与乳化性能研究[J] 农业机械学报, 2020, 51(5):356-362. LI Y, YAN S C, QI B K, et al.Emulsifying properties and antioxidant activities of black kidney bean protein modified by chlorogenic acid[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(5):356-362.
[58] 刘妍兵, 陶阳, 苗雪, 等.芸豆加工过程中蛋白-多酚复合物功能性质的变化[J].中国粮油学报, 2021, 36(11):57-64. LIU Y B, TAO Y, MIAO X, et al.Changes of functional properties of protein-polyphenol complex during processing of kidney bean[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(11):57-64.
[59] 刘杰, 周浩, 黄郁芳, 等.聚乙二醇化学改性的大豆分离蛋白凝胶[J].高等学校化学学报, 2018, 39(2):390-396. LIU J, ZHOU H, HUANG Y F, et al.Polyethylene glycol chemically modified soy protein isolate hydrogel[J].Chemical Journal of Chinese Universities, 2018, 39(2):390-396.
[60] HE Q, SUN X B, HE S D, et al.PEGylation of black kidney bean (Phaseolus vulgaris L.) protein isolate with potential functironal properties[J].Colloids and Surfaces B:Biointerfaces, 2018, 164:89-97.
[61] YANG Y F, HE Q, SUN H J, et al.PEGylation may reduce allergenicity and improve gelling properties of protein isolate from black kidney bean (Phaseolus vulgaris L.)[J].Food Bioscience, 2018, 25:83-90.
[62] YIN S W, TANG C H, WEN Q B, et al.The relationships between physicochemical properties and conformational features of succinylated and acetylated kidney bean (Phaseolus vulgaris L.) protein isolates[J].Food Research International, 2010, 43(3):730-738.
[63] 左锋, 王振忠, 钱丽丽, 等.乙酰化改性对芸豆分离蛋白凝胶特性的影响[J].中国农业大学学报, 2018, 23(8):95-100. ZUO F, WANG Z Z, QIAN L L, et al.Effects of acetylated modification on the gel properties of red kidney bean protein isolation[J].Journal of China Agricultural University, 2018, 23(8):95-100.
[64] OHARA A, CASON V G, NISHIDE T G, et al.Improving the antioxidant and antidiabetic properties of common bean proteins by enzymatic hydrolysis using a blend of proteases[J].Biocatalysis and Biotransformation, 2021, 39(2):100-108.
[65] SAAD A M, SITOHY M Z, AHMED A I, et al.Biochemical and functional characterization of kidney bean protein alcalase-hydrolysates and their preservative action on stored chicken meat[J].Molecules, 2021, 26(15):4690.
[66] 毛小雨, 许馨予, 杨鹄隽, 等.紫花芸豆蛋白体外消化产物的抗氧化活性及结构特征分析[J].食品科学, 2021, 42(3):56-62. MAO X Y, XU X Y, YANG H J, et al.Antioxidant activity and structural characteristics of in vitro digestion products of purple speckled kidney bean(Phaseolus vulgaris L.) protein[J].Food Science, 2021, 42(3):56-62.
[67] TANG C H, SUN X, YIN S W, et al.Transglutaminase-induced cross-linking of vicilin-rich kidney protein isolate:Influence on the functional properties and in vitro digestibility[J].Food Research International, 2008, 41(10):941-947.
[68] 何庆燕, 洪永祥, 周红, 等.鸡肉蛋白与芸豆蛋白酶联重组及其功能性质的研究[J].中国食品学报, 2018, 18(7):83-89. HE Q Y, HONG Y X, ZHOU H, et al.Enzyme-linked restructuring of myofibrillar/kidney bean proteins and functional properties[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(7):83-89.
[69] CAN KARACA A.Modification of Legume Proteins for Improved Functionality[M].Grain and Seed Proteins Functionality.IntechOpen, 2021:1-13.
[70] AL-RUWAIH N, AHMED J, MULLA M F, et al.High-pressure assisted enzymatic proteolysis of kidney beans protein isolates and characterization of hydrolysates by functional, structural, rheological and antioxidant properties[J].LWT, 2019, 100:231-236.