柑橘类水果是柑、橘、橙、柚、柠檬等的总称,是世界第一大类水果,在全球范围内140多个国家广泛栽种,年均产量高达1亿t[1],在世界水果经济与贸易中占有重要的地位。我国是柑橘类水果的生产和出口大国,种植面积超过4 000万亩,产量超4 000万t,占世界柑橘类水果总产量22%[2-3],其中以南方地区种植面积最广,广西、湖南、湖北产量位居全国前三。柑橘类水果富含多种营养成分(如碳水化合物、维生素C、矿物质等)和多种天然生物活性成分(如胡萝卜素、黄酮类化合物等)[4]。柑橘类水果消费需求逐年增长,消费者对其高品质更加渴望。
尽管我国柑橘类水果种植生产处于世界前列,但产后处理技术与装备研发应用较滞后,使得我国柑橘类水果在参与国际市场和贸易方面缺乏足够竞争力,世界市场占有率并不是很高[5]。目前对柑橘类水果产后内外部品质、分类分级、病虫害等多方面检测大多采用传统意义上的有损方法,即破坏性检测,操作繁琐且仅适合小批量抽样检测使用[6]。为了实现大批量样本的快速无损检测,提升柑橘类水果产业的后处理水平,国内外学者相继提出并研究了许多新的检测方法,如机器视觉技术[7]、超声波技术[8]、电子鼻技术[9]、低磁场共振技术[10]、光谱技术[11]等。其中,近红外(near-infrared,NIR)光谱技术可实现便捷、快速、无损检测,被大量用于各种农产品/食品检测研究[12]。
近红外光是一种波长在780~2 526 nm的电磁波,可分为短波近红外(SW-NIR, 780~1 100 nm)和长波近红外(LW-NIR, 1 100~2 526 nm)两个区域。NIR光谱是分子振动光谱,具有较强穿透力,主要是对含氢基团X—H(X![]() C、N、O)振动的倍频和合频吸收[13]。NIR光谱分析包括定性分析和定量分析,其中定性分析用于确定物质组成与结构,定量分析用于确定物质组分的含量或是物质属性。NIR光谱分析法是一种间接分析技术,是用化学计量学方法在NIR光谱数据和样品待测属性值之间建立一种联系(即模型),然后利用建立的模型预测未知样品。所建模型性能一般使用相关系数、误差、偏差等参数进行评价[14]。
C、N、O)振动的倍频和合频吸收[13]。NIR光谱分析包括定性分析和定量分析,其中定性分析用于确定物质组成与结构,定量分析用于确定物质组分的含量或是物质属性。NIR光谱分析法是一种间接分析技术,是用化学计量学方法在NIR光谱数据和样品待测属性值之间建立一种联系(即模型),然后利用建立的模型预测未知样品。所建模型性能一般使用相关系数、误差、偏差等参数进行评价[14]。
NIR光谱技术在水果中的无损检测研究已被大量报道,为全面了解NIR光谱技术在柑橘类水果中的应有优势及潜力,本文归纳总结了近五年来NIR光谱技术在柑橘类水果内部成分、外部缺陷、活性物质、病害、品种、分类、产地等方面的最新检测研究及应用进展,为设计研发专业化的水果检测仪器和设备提供更多数据支撑,同时也为NIR光谱技术的拓展应用研究提供新的思路。
1 NIR光谱技术用于柑橘类水果内部品质评价
柑橘类水果富含多种营养成分,其质量优劣可用多个内部品质指标进行评价,如可溶性固形物含量(soluble solid content, SSC)、酸度、成熟度等。SSC是柑橘类水果营养成份的基础,主要成分是可溶性糖[15],直接影响水果的甜度、色泽和风味,常被用于评价水果糖度和成熟度[16]。这类内部品质的评价常采用化学法[17]。为了寻找一种快速评价方法,诸多学者开展了基于NIR光谱技术的柑橘类水果内部品质检测研究。
近年来基于NIR光谱技术预测柑橘SSC含量的研究较多,但效果大不相同(表1)。以发光二极管(light emitting diode,LED)灯作为光源,使用NIR光谱预测柑橘SSC含量效果不是很理想[18-19](RP=0.84),但LED光源在节省能量方面有优势。大部分NIR研究柑橘糖度依然采用卤素灯作为光源,配以合适的光谱预处理和最优波长,预测效果也各不相同,CAVACO等[20]和THEANJUMPOL等[21]的研究结果显示,柑橘SSC含量和SW-NIR光谱之间的相关性较低![]() 这可能与试验样品来自不同地方导致试验样品差异很大有关。在几乎相同的波长范围内,有5个课题组选用不同方法预处理光谱并筛选出最优波长构建PLS模型预测柑橘SSC,模型检测效果有了明显提升(RP>0.79)[22-26],其中HUANG等[25]的研究结果最好(RP=0.987,RMSEP=0.19 °Brix),这说明光谱预处理和波长筛选对柑橘SSC预测影响很大。除了SSC获得大量研究外,柑橘的成熟度、酸度、风味、坚实度、果皮厚度、总蛋白及一些形态参数也获得了少量的NIR预测研究,其中酸度和成熟度[23]以及风味[27]的预测效果相对较好,其他质量指标的预测效果不是很理想[20, 28-29],研究数量也相对较少。
这可能与试验样品来自不同地方导致试验样品差异很大有关。在几乎相同的波长范围内,有5个课题组选用不同方法预处理光谱并筛选出最优波长构建PLS模型预测柑橘SSC,模型检测效果有了明显提升(RP>0.79)[22-26],其中HUANG等[25]的研究结果最好(RP=0.987,RMSEP=0.19 °Brix),这说明光谱预处理和波长筛选对柑橘SSC预测影响很大。除了SSC获得大量研究外,柑橘的成熟度、酸度、风味、坚实度、果皮厚度、总蛋白及一些形态参数也获得了少量的NIR预测研究,其中酸度和成熟度[23]以及风味[27]的预测效果相对较好,其他质量指标的预测效果不是很理想[20, 28-29],研究数量也相对较少。
表1 NIR光谱技术在柑橘类水果内部品质评价方面的应用
Table 1 Application of NIR spectroscopy in internal quality evaluation of citrus fruits
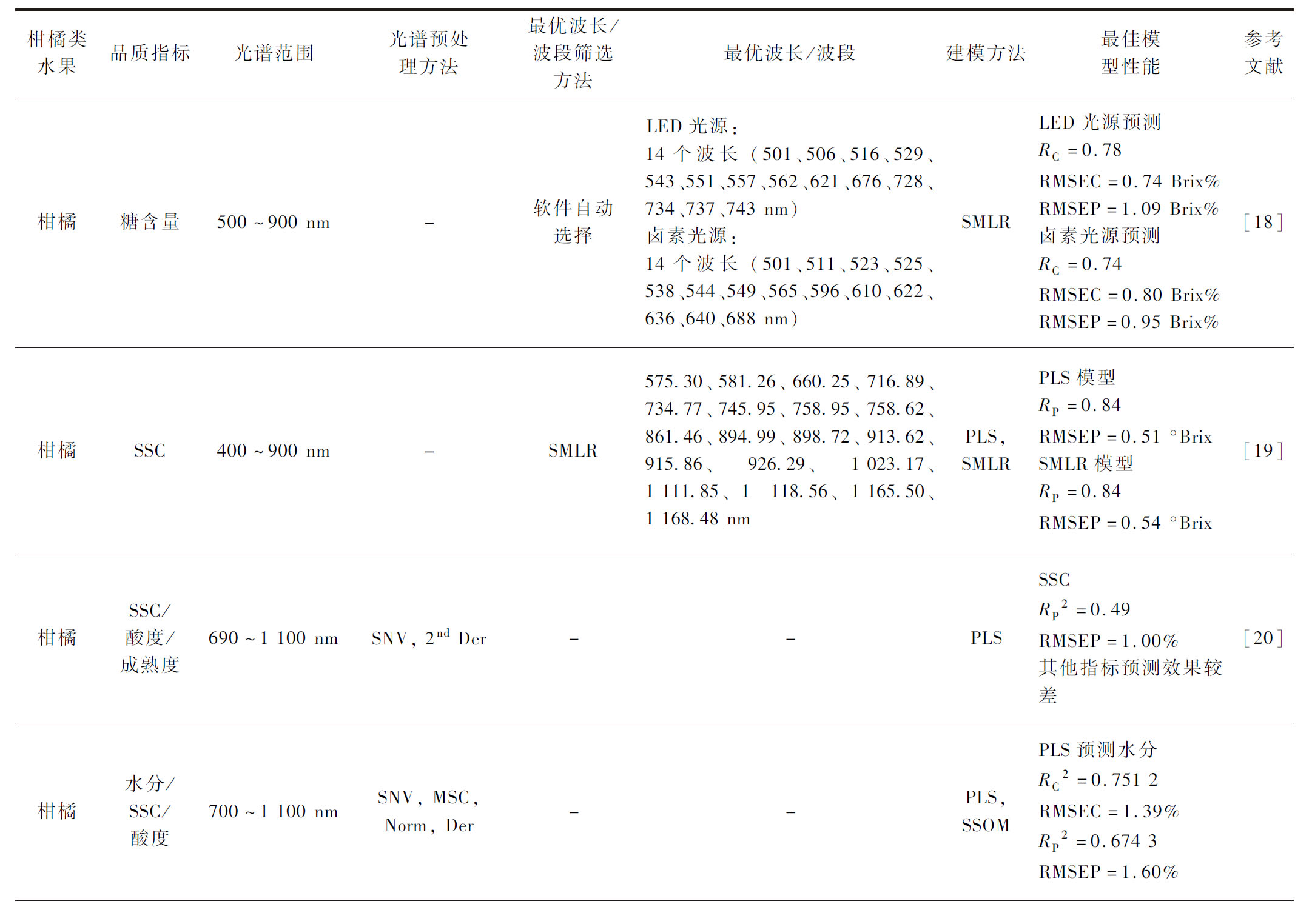
柑橘类水果品质指标光谱范围光谱预处理方法最优波长/波段筛选方法最优波长/波段建模方法最佳模型性能参考文献柑橘糖含量500~900 nm-软件自动选择LED光源:14个波长 (501、506、516、529、543、551、557、562、621、676、728、734、737、743 nm)卤素光源:14个波长 (501、511、523、525、538、544、549、565、596、610、622、636、640、688 nm)SMLRLED光源预测RC=0.78RMSEC=0.74 Brix%RMSEP=1.09 Brix%卤素光源预测RC=0.74RMSEC=0.80 Brix%RMSEP=0.95 Brix%[18]柑橘SSC400~900 nm-SMLR575.30、581.26、660.25、716.89、734.77、745.95、758.95、758.62、861.46、894.99、898.72、913.62、915.86、926.29、1 023.17、1 111.85、1 118.56、1 165.50、1 168.48 nmPLS, SMLRPLS模型RP=0.84RMSEP=0.51 °BrixSMLR模型RP=0.84RMSEP=0.54 °Brix[19]柑橘SSC/酸度/成熟度690~1 100 nmSNV, 2nd Der--PLSSSCRP2=0.49RMSEP=1.00%其他指标预测效果较差[20]柑橘水分/SSC/酸度700~1 100 nmSNV, MSC, Norm, Der--PLS,SSOMPLS预测水分RC2=0.751 2RMSEC=1.39%RP2=0.674 3RMSEP=1.60%
续表1
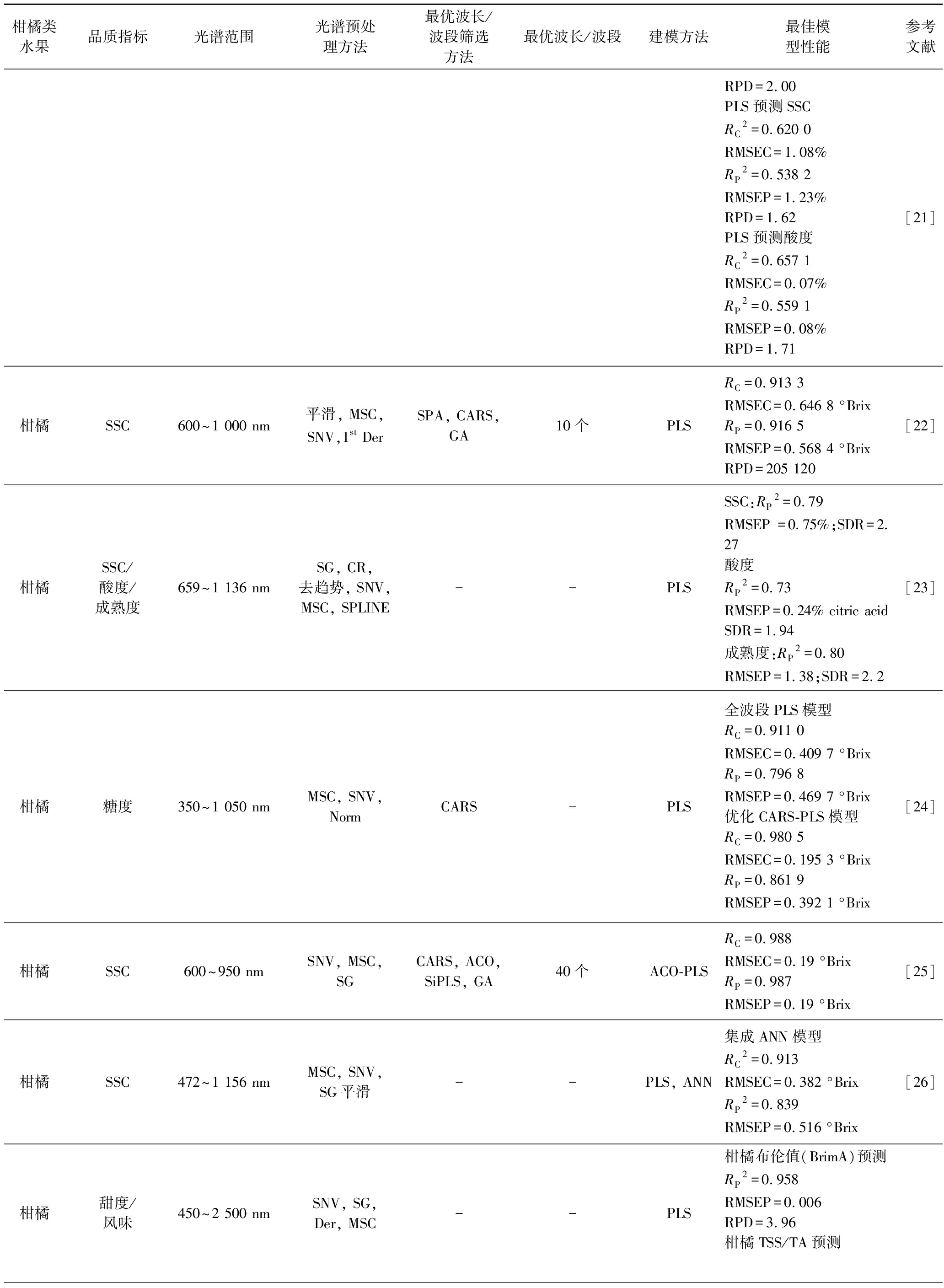
柑橘类水果品质指标光谱范围光谱预处理方法最优波长/波段筛选方法最优波长/波段建模方法最佳模型性能参考文献RPD=2.00PLS预测SSCRC2=0.620 0RMSEC=1.08%RP2=0.538 2RMSEP=1.23%RPD=1.62PLS预测酸度RC2=0.657 1RMSEC=0.07%RP2=0.559 1RMSEP=0.08%RPD=1.71[21]柑橘SSC600~1 000 nm平滑, MSC, SNV,1st DerSPA, CARS, GA10个PLSRC=0.913 3RMSEC=0.646 8 °BrixRP=0.916 5RMSEP=0.568 4 °BrixRPD=205 120[22]柑橘SSC/酸度/成熟度659~1 136 nmSG, CR, 去趋势, SNV, MSC, SPLINE--PLSSSC:RP2=0.79RMSEP =0.75%;SDR=2.27酸度RP2=0.73RMSEP=0.24% citric acidSDR=1.94成熟度:RP2=0.80RMSEP=1.38;SDR=2.2[23]柑橘糖度350~1 050 nmMSC, SNV, NormCARS-PLS全波段PLS模型RC=0.911 0RMSEC=0.409 7 °BrixRP=0.796 8RMSEP=0.469 7 °Brix优化CARS-PLS模型RC=0.980 5RMSEC=0.195 3 °BrixRP=0.861 9RMSEP=0.392 1 °Brix[24]柑橘SSC600~950 nmSNV, MSC, SGCARS, ACO, SiPLS, GA40个ACO-PLSRC=0.988RMSEC=0.19 °BrixRP=0.987RMSEP=0.19 °Brix[25]柑橘SSC472~1 156 nmMSC, SNV, SG平滑--PLS, ANN集成ANN模型RC2=0.913RMSEC=0.382 °BrixRP2=0.839RMSEP=0.516 °Brix[26]柑橘甜度/风味450~2 500 nmSNV, SG, Der, MSC--PLS柑橘布伦值(BrimA)预测RP2=0.958RMSEP=0.006RPD=3.96柑橘TSS/TA预测
续表1
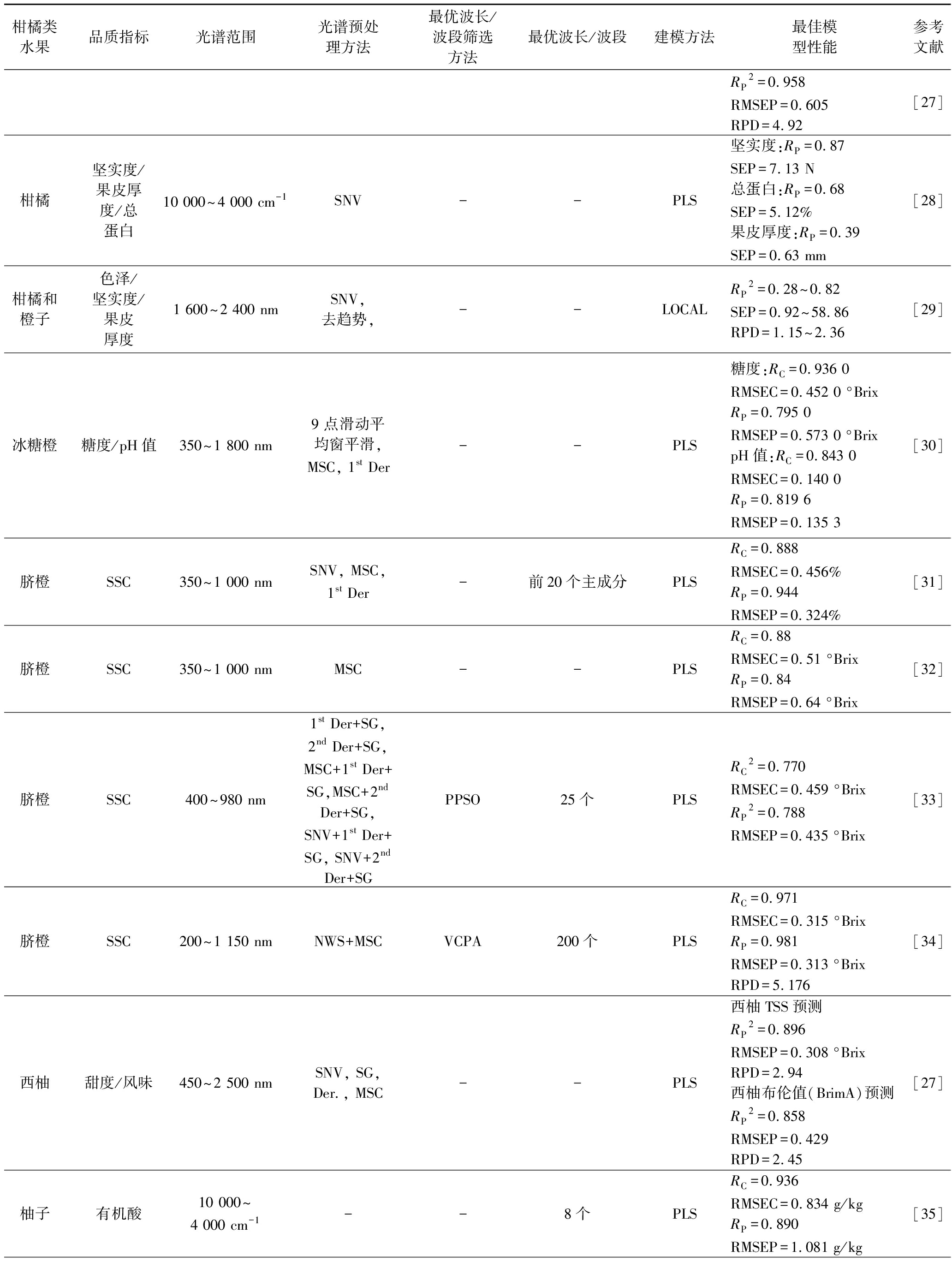
柑橘类水果品质指标光谱范围光谱预处理方法最优波长/波段筛选方法最优波长/波段建模方法最佳模型性能参考文献RP2=0.958RMSEP=0.605RPD=4.92[27]柑橘坚实度/果皮厚度/总蛋白10 000~4 000 cm-1SNV--PLS坚实度:RP=0.87SEP=7.13 N总蛋白:RP=0.68SEP=5.12%果皮厚度:RP=0.39SEP=0.63 mm[28]柑橘和橙子色泽/坚实度/果皮厚度1 600~2 400 nmSNV, 去趋势, --LOCALRP2=0.28~0.82SEP=0.92~58.86RPD=1.15~2.36[29]冰糖橙糖度/pH值350~1 800 nm9 点滑动平均窗平滑, MSC, 1st Der--PLS糖度:RC=0.936 0RMSEC=0.452 0 °BrixRP=0.795 0RMSEP=0.573 0 °BrixpH值:RC=0.843 0RMSEC=0.140 0RP=0.819 6RMSEP=0.135 3[30]脐橙SSC350~1 000 nmSNV, MSC, 1st Der-前20个主成分PLSRC=0.888RMSEC=0.456%RP=0.944RMSEP=0.324%[31]脐橙SSC350~1 000 nmMSC--PLSRC=0.88RMSEC=0.51 °BrixRP=0.84RMSEP=0.64 °Brix[32]脐橙SSC400~980 nm1st Der+SG, 2nd Der+SG, MSC+1st Der+SG,MSC+2ndDer+SG, SNV+1st Der+SG, SNV+2ndDer+SGPPSO25个PLSRC2=0.770RMSEC=0.459 °BrixRP2=0.788RMSEP=0.435 °Brix[33]脐橙SSC200~1 150 nmNWS+MSCVCPA200个PLSRC=0.971RMSEC=0.315 °BrixRP=0.981RMSEP=0.313 °BrixRPD=5.176[34]西柚甜度/风味450~2 500 nmSNV, SG, Der., MSC--PLS西柚TSS预测RP2=0.896RMSEP=0.308 °BrixRPD=2.94西柚布伦值(BrimA)预测RP2=0.858RMSEP=0.429RPD=2.45[27]柚子有机酸10 000~4 000 cm-1--8个PLSRC=0.936RMSEC=0.834 g/kgRP=0.890RMSEP=1.081 g/kg[35]
续表1

柑橘类水果品质指标光谱范围光谱预处理方法最优波长/波段筛选方法最优波长/波段建模方法最佳模型性能参考文献蜜柚糖度400~1 700 nmSGPCA前6个主成分PLSRC2=0.893RMSEC=0.254 °BrixRP2=0.914RMSEP=0.226 °Brix[36]柚子SSC400~1 170 nmSNV, Norm, MSC, 1st Der, 2nd Der, SGCARS81个PLSRC=0.94RMSEC=0.26%RP=0.93RMSEP=0.25%RPD`=2.62[37]
注:RC:校正集相关系数;RCV:交叉验证集相关系数;RCV2:交叉验证集决定系数;RP:验证集相关系数;RC2:校正集决定系数;RP2:预测集决定系数;SEP:标准偏差;RMSEC:校正集均方根误差;RMSECV:交叉验证集均方根误差;RMSEP:预测集均方根误差;PLS:偏最小二乘;1st Der:一阶导数;2nd Der:二阶导数;Norm:归一化;SNV:标准正态变量变换;MSC:多元散射校正;SPA:连续投影算法;CARS:竞争性自适应加权算法;ACO:蚁群优化算法;SiPLS:协同区间偏最小二乘;GA:遗传算法;ANN:人工神经网络;PCA:主成分分析;SMLR:逐步多元线性回归;SG:卷积平滑;CR:包络线去除;SPLINE:弧线平滑;TA:可滴定酸度;MI:成熟指数;NWS:Norris-Williams平滑;VCPA:变量组合总体分析;PPSO:分段粒子群优化(下同)。
NIR光谱预测橙子SSC的研究也不少,王旭[30]使用更宽范围的可见/近红外(VIS/NIR)光谱信息(350~1 800 nm)预测冰糖橙SSC,校正模型优于预测模型(RP=0.795 0,RMSEP=0.573 0 °Brix),模型预测精度有待进一步提高。相比之下,脐橙中SSC的NIR预测研究更多,孙通等[31]和刘燕德等[32]基于相同的可见/短波(VIS/SW)NIR光谱(350~1 000 nm)构建PLS模型预测脐橙SSC,校正模型效果几乎相同,但是前者预测模型效果更好(RP=0.944,RMSEP=0.324%);SONG等[33]和HAO等[34]基于筛选的最优波长构建PLS模型预测脐橙SSC,后者所建模型的预测效果明显优于前者(RP=0.981,RMSEP=0.313 °Brix),这可能源于后者使用了更多的波长变量(200个),保留了更多与SSC预测相关的NIR光谱信息。
柚子作为一种柑橘类水果,其理化组分也可通过挖掘NIR光谱信息实现快速检测。NCAMA等[27]研究了VIS/NIR光谱技术检测西柚甜度和风味的可行性,效果良好,这为西柚质量评价提供了一种快速方法。使用10 000~4 000 cm-1光谱检测柚子有机酸的效果也可接受,最优波长筛选需进一步研究[35],以提高检测精度。VIS/NIR(400~1 700 nm)与VIS/SW-NIR(400~1 170 nm)两个波段光谱信息在预测柚子SSC方面表现稍有不同[36-37],前者效果更好![]() °Brix),这可能与长波NIR光谱(1 170~1 700 nm)中蕴含着与柚子糖度预测相关的重要信息有关。
°Brix),这可能与长波NIR光谱(1 170~1 700 nm)中蕴含着与柚子糖度预测相关的重要信息有关。
总之,NIR光谱技术用于检测柑橘类水果内部品质指标具有可行性和潜在应用性。从近年来的统计结果可以看出,柑橘的NIR检测研究最多,橙子和柚子相对较少。柑橘、橙子、柚子等柑橘类水果中的SSC依然是NIR光谱技术研究的重点和主要内容,这与SSC直接影响水果口感有关,SSC差异在2 °Brix以上,水果口感差异明显[27]。同时,这些研究也间接反映出柑橘类水果市场更加关注SSC。顺应柑橘类水果市场需求,实现快速评价柑橘类水果内部品质将有助于提升柑橘市场的健康发展。
2 NIR光谱技术用于柑橘类水果病害检测和冻害识别
柑橘果实采后贮藏期间常发生两大类病害:一类是由真菌引起的侵染性病害(如霉心病),这是导致柑橘腐烂的主要因素[38];一类是因生理失调引起的生理性病害[39],如枯水。柑橘类水果病害及其快速鉴定是面临的挑战之一。GHOOSHKHANEH等[40]采集橙子茎端、赤道端和花柱端3个区域的VIS/NIR反射光谱(400~1 100 nm)用以鉴别由链格孢菌引发的霉心病(图1-a),构建的反向传播神经网络(back propagation neural network,BPNN)模型对Thompson品种的训练集、验证集和测试集样品的鉴别正确率分别为94%、90%和93%,对Jaffa品种的训练集、验证集和测试集样品的鉴别正确率分别为97%、91%和97%(表2),该模型具有潜在的推广应用价值。
柑橘枯水主要发生在果实成熟期和贮藏期,果实干而无水、化渣性差、糖酸等风味物质降低,是目前生产上比较常见的一种生理性病害。发病后果实外观并无明显变化,很难分辨出,其病症表现主要在果实内部。THEANJUMPOL等[21]利用SW-NIR光谱(700~1 100 nm)构建非线性的监督自组织图谱(supervision self-organizing map,SSOM)模型识别柑橘枯水病害等级(图1-b),并进行分类研究,SSOM对测试样本的预测能力、模型稳定性和分类正确率分别达到93.7%、95.3%和94.0%。以不同季节收获的柑桔为独立外部样本验证SSOM模型,分类正确率为78.4%,模型效果有待提高。
“浮皮”作为一种常见柑橘外部缺(图1-c),也是一种生理病害,多出现在表皮薄而软、容易剥离的宽皮类柑橘中,主要发生在柑橘果实成熟后期。李轶凡[41]提出采用VIS/NIR漫透射技术研究柑橘浮皮的检测可行性。作者分别建立主成分分析(principal component analysis, PCA)、反向传播人工神经网络(back propagation artificial neural network,BP-ANN)、最小二乘支持向量机(least squares support vector machine, LS-SVM)和偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)等4种判别模型,经测试样本验证的判别正确率可达100%。
皮凹陷常发生于水果收获后3~5周内(图1-d),是一种果皮生理紊乱导致,在商业化生产的分级分拣中很难被发现,对水果品质和消费产生很大的消极影响。NCAMA等[42]探索了基于VIS/NIR光谱的西柚皮凹陷快速无损检测方法,基于西柚冠层位置和果皮点蚀易感性,PCA可成功用于分离出果实。总体近年来NIR用于检测果实病害的研究较少,大多数集中在果树和树叶病害方面[45-46]。
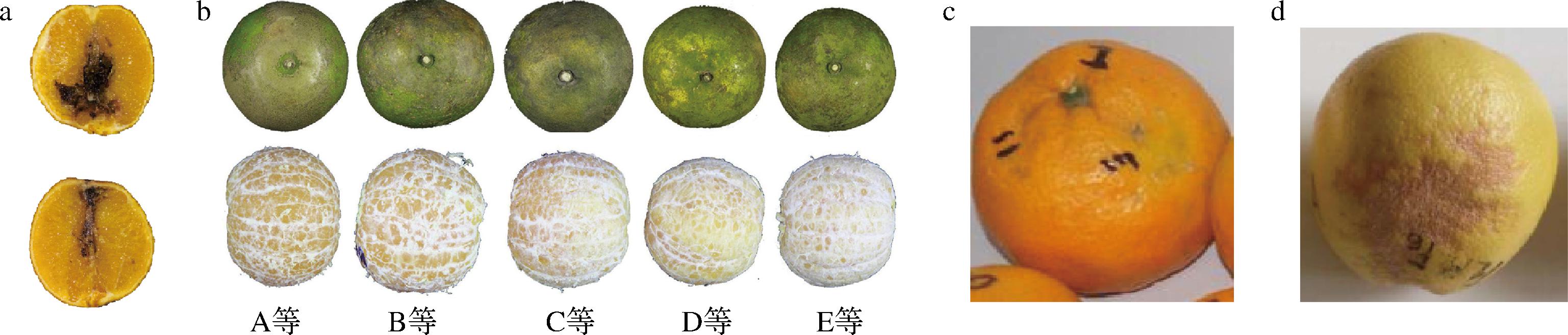
a-橙子霉心病[40];b-柑橘枯水等级[21];c-柑橘浮皮果[41];d-西柚皮凹陷[42]
图1 柑橘类水果病害示例图
Fig.1 Example images of disease in citrus fruits
表2 NIR光谱技术在柑橘类水果病害和冻害方面的检测应用
Table 2 Application of NIR spectroscopy in detection of diseases and classification of freezing damages in citrus fruits
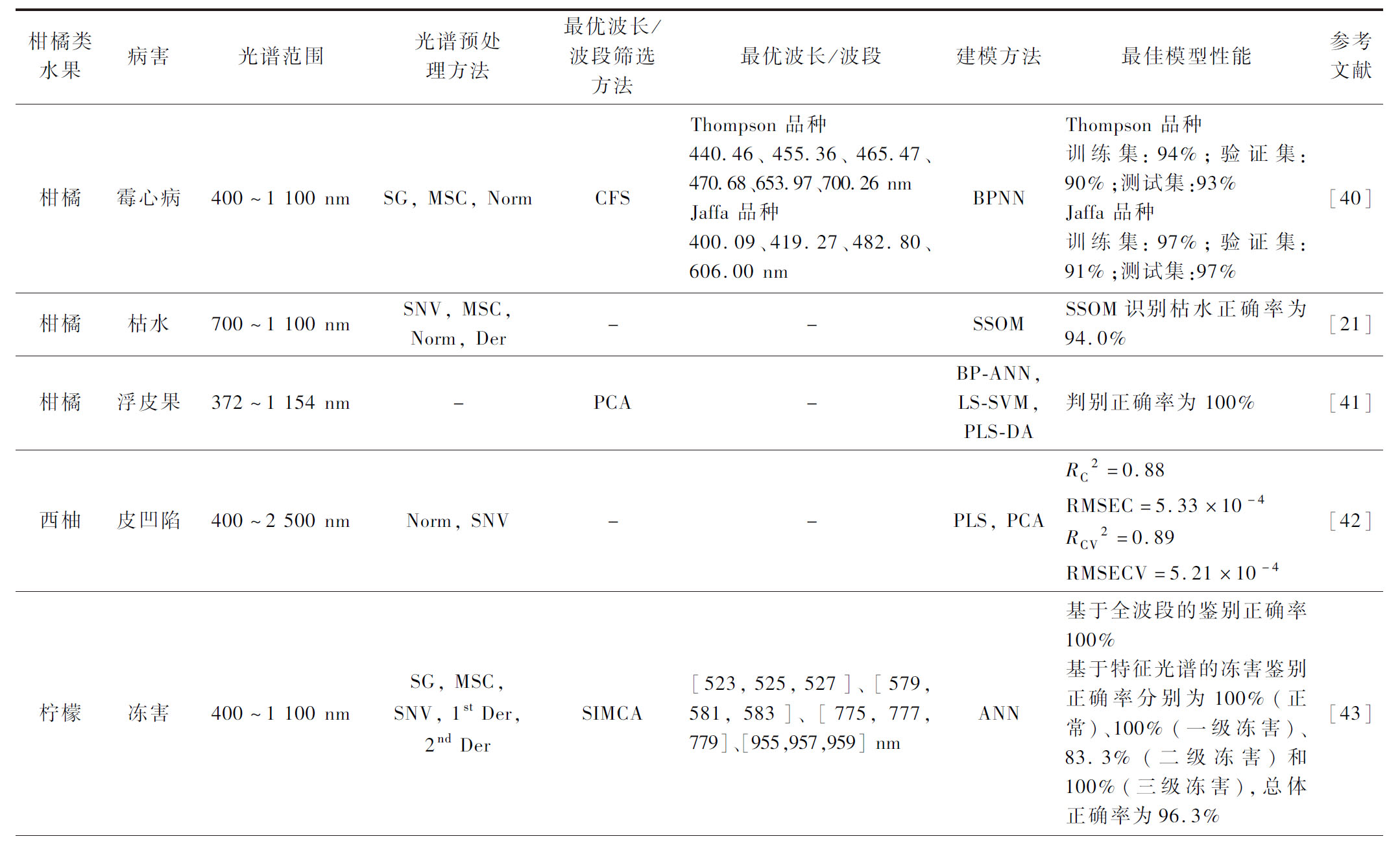
柑橘类水果病害光谱范围光谱预处理方法最优波长/波段筛选方法最优波长/波段建模方法最佳模型性能参考文献柑橘霉心病400~1 100 nmSG, MSC, NormCFSThompson 品种440.46、455.36、465.47、470.68、653.97、700.26 nmJaffa 品种400.09、419.27、482.80、606.00 nmBPNNThompson 品种训练集:94%;验证集:90%;测试集:93%Jaffa 品种训练集:97%;验证集:91%;测试集:97%[40]柑橘枯水700~1 100 nmSNV, MSC, Norm, Der--SSOMSSOM识别枯水正确率为94.0%[21]柑橘浮皮果372~1 154 nm-PCA-BP-ANN,LS-SVM,PLS-DA判别正确率为 100%[41]西柚皮凹陷400~2 500 nmNorm, SNV--PLS, PCARC2=0.88RMSEC=5.33×10-4RCV2=0.89RMSECV=5.21×10-4[42]柠檬冻害400~1 100 nmSG, MSC,SNV, 1st Der, 2nd DerSIMCA[523,525,527]、[579,581,583]、[775,777,779]、[955,957,959] nmANN基于全波段的鉴别正确率100%基于特征光谱的冻害鉴别正确率分别为100%(正常)、100%(一级冻害)、83.3%(二级冻害)和100%(三级冻害),总体正确率为96.3%[43]
续表2

柑橘类水果病害光谱范围光谱预处理方法最优波长/波段筛选方法最优波长/波段建模方法最佳模型性能参考文献柑橘冻害644~900 nmDCM, MSC,SNVCARS, SPA649、663、686、752、759、791、795、798、805、806、809、810、812、815、817 nmPLSDA, 1D-CNN冻害柑橘和未冻害鉴别正确率分别为95.15%和88.54%,总体正确率为91.96%[44]
注:CFS:基于相关性的特征选择算法;DCM:直径校正方法;1D-CNN:一维卷积神经网络(下同)。
当温度低于冰点的时候,柑橘水果在树上或在采后运输储藏中易发生冻害,其品质受到很大影响,因此,冻害的快速识别显得尤为重要。MOOMKESH等[43]通过研究3种模式(反射、半透射和全透射)的SW-NIR光谱(400~1 100 nm)检测柠檬冻害(图2-a),经对比发现,半透射光更适用于早期识别柠檬冻害,且全波段主成分-人工神经网络(PCA-ANN)模型鉴别正确率可达100%。基于簇类独立软模式(soft independent modeling of class analogies,SIMCA)筛选特征光谱后,ANN模型检测效果优于SVM模型,对不同程度的柠檬冻害鉴别正确率分别为100%(正常)、100%(一级冻害)、83.3%(二级冻害)和100%(三级冻害),总体正确率为96.3%,和全波段相比,虽然有所降低,但更少的光谱更有利于开发在线冻害检测系统。
与之不同,TIAN等[44]自行设计研发了一套VIS/NIR光谱测量系统(644~900 nm)用于在线识别柑橘冻害(图2-b),并且提出一种直新的直径校正方法(diameter calibration method,DCM)预处理光谱信息,可有效消除水果大小对透射光谱的影响。基于DCM构建的全波段PLS-DA和SVM模型均表现良好,识别正确率在78.95~85.53%。为了进一步提高精度,作者提出构建基于DCM的一维卷积神经网络(one dimensional convolutional neural network,1D-CNN)模型,对早期冻害和未冻害柑橘识别正确率可达95.15%和88.54%。柑橘冻害的NIR研究较少,但现有的研究结果说明NIR光谱在柑橘冻害的早期诊断方面具有一定应用价值。

a-柠檬冻害[43];b-柑橘冻害[44]
图2 柑橘类水果病害和冻害示例图
Fig.2 Example images of freezing damage in citrus fruits
3 NIR光谱技术用于柑橘类水果品种产地及分类鉴别
不同品种、不同地理来源的柑橘品质存在显著差异,品种及产地鉴别对于柑橘产业的健康发展有着重要作用。不同产地的柑橘内部品质和价格有所不同,但其外观差别较小,通过肉眼很难实现准确鉴别。NIR光谱技术作为一种快速无损检测技术,已被用于柑橘类水果的品种和产地鉴别分析,如但松健[47]采集16个不同地区的柑橘NIR光谱数据后,分别基于机器学习、SVM和L1范数线性回归3种方式建模进行柑橘产地鉴别研究,遗传算法(genetic algorithm,GA)筛选最优波长后构建的GA-SVM模型产地鉴别准确度最高(94.58%),其他两种方式略差一些,这是因为SVM 采用了非线性的核映射方法,在处理NIR光谱中非线性的噪声影响且在样本充足的情况下,可获得更优于其他基于线性分类器的识别结果。李尚科[48]分别使用台式和便携式NIR光谱仪采集不同品种柑橘(沃柑及橙子)的反射光谱信息,试验发现,赤道线、梗部及其底部的6个光谱采集点的平均光谱数据更适用于鉴别分析,这与柑橘的梗部、底部中同样携带着柑橘中的重要信息有关。无需任何光谱预处理,线性判别分析(linear discriminant analysis,LDA)模型可100%鉴别柑橘产地和品种。相同NIR光谱范围内(10 000~4 000 cm-1),姚婉清等[49]采集3类金柚表皮的光谱信息,进行金柚品种的定性识别研究,构建的判别分析(discriminant analysis,DA)模型,可100%正确识别白柚、红柚和沙田柚,为金柚分级分类提供了一种有效方法。该波段的光谱与不同柠檬品种(Ovale di Sorrento和Sfusato Amalfitano)、产地之间存在的定性关系也进行了研究[50],结果发现构建的LDA模型更适合于鉴别单生产年的品种,2018年和2019年的品种鉴别正确率分别为66%和63%,鉴别Ovale di Sorrento品种和Sfusato Amalfitano品种产地正确率分别为81%和74%,总体鉴别正确率不是很高,这与不同年份的气变化导致品种差异有关。
分类分级有助于最大化水果的经济价值,可更好的实现柑橘优质优价。利用NIR光谱技术对柑橘类水果进行分类分级也有少量报道,如ZHANG等[51]旨在通过挖掘VIS/SW-NIR光谱信息(200~900 nm)鉴别健康的和有缺陷的脐橙,基于蚁群算法(ant colony optimization,ACO)筛选出6个最佳波长构建的树型SVM模型可有效鉴别各种缺陷脐橙(图3),鉴别正确率均高于90%。汁胞粒化是柑橘类水果中汁液囊的一种生理失调现象,会导致水果内部品质降低。孙潇鹏等[52]采用NIR透射光谱与机器视觉技术相结合快速无损检测分级蜜柚汁胞粒化程度。通过连续投影算法(successive projections algorithm, SPA)筛选出17个最优波长,构建K临近(K-nearest neighbor,KNN)模型对5个等级蜜柚进行分类预测,准确性、敏感性和特异性分别达到0.970 0、0.923 1和0.987 4以上,为水果在线分选提供了数据参考。具体各研究结果见表3。

图3 脐橙的典型桔皮瑕疵示例图[51]
Fig.3 Example images of typical blemished citrus peel of navel oranges[51]
表3 NIR光谱技术在柑橘类水果品种产地及分类鉴别应用
Table 3 Application of NIR spectroscopy in origin and varieties classification of citrus fruits
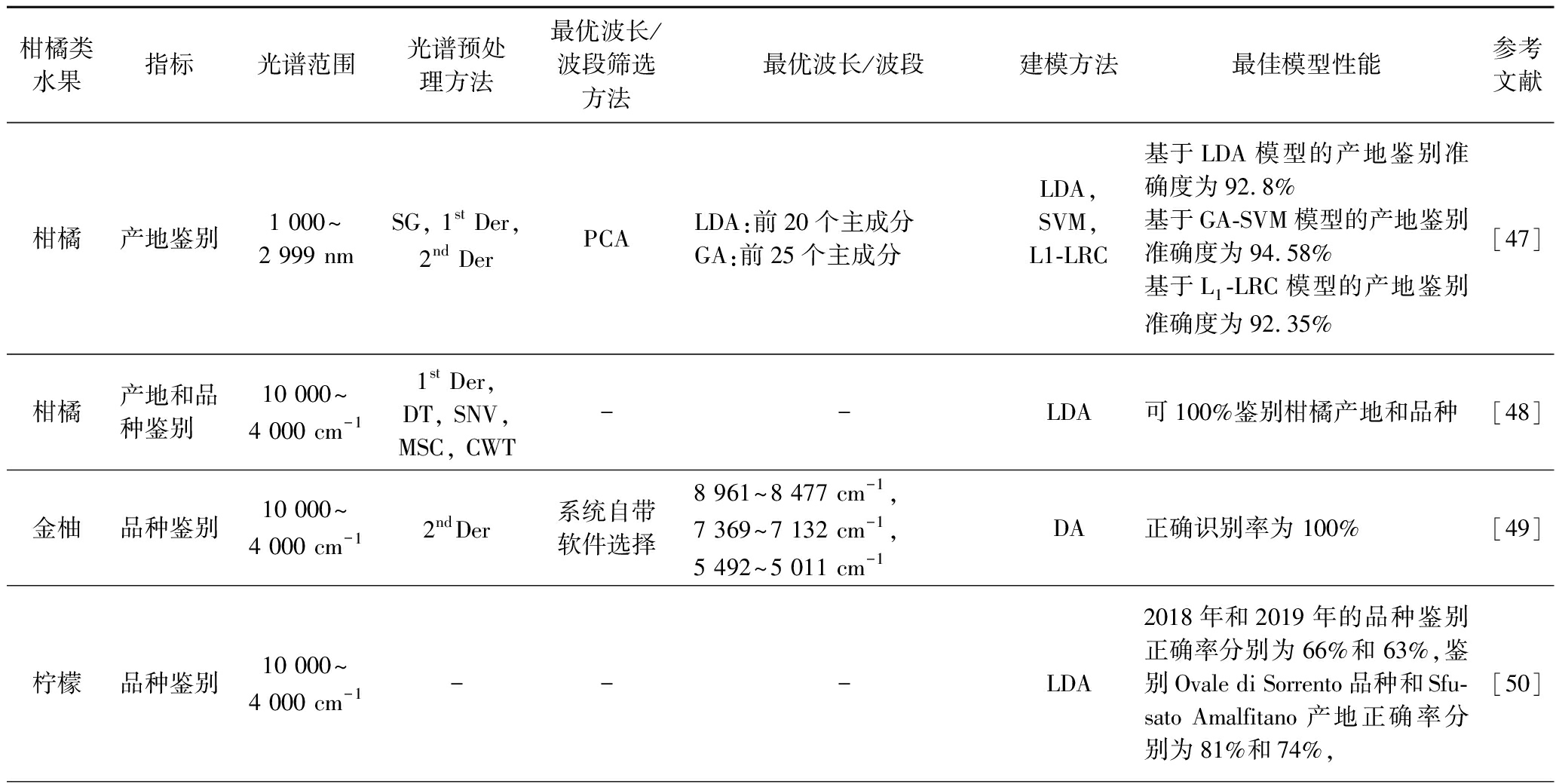
柑橘类水果指标光谱范围光谱预处理方法最优波长/波段筛选方法最优波长/波段建模方法最佳模型性能参考文献柑橘产地鉴别1 000~2 999 nmSG, 1st Der, 2nd DerPCALDA:前20个主成分GA:前25个主成分LDA,SVM,L1-LRC基于LDA模型的产地鉴别准确度为92.8%基于GA-SVM模型的产地鉴别准确度为94.58%基于L1-LRC模型的产地鉴别准确度为92.35%[47]柑橘产地和品种鉴别10 000~4 000 cm-11st Der, DT, SNV, MSC, CWT--LDA可100%鉴别柑橘产地和品种[48]金柚品种鉴别10 000~4 000 cm-12ndDer系统自带软件选择8 961~8 477 cm-1, 7 369~7 132 cm-1, 5 492~5 011 cm-1DA正确识别率为 100%[49]柠檬品种鉴别10 000~4 000 cm-1---LDA2018年和2019年的品种鉴别正确率分别为66%和63%,鉴别Ovale di Sorrento品种和Sfu-sato Amalfitano产地正确率分别为81%和74%,[50]
续表3
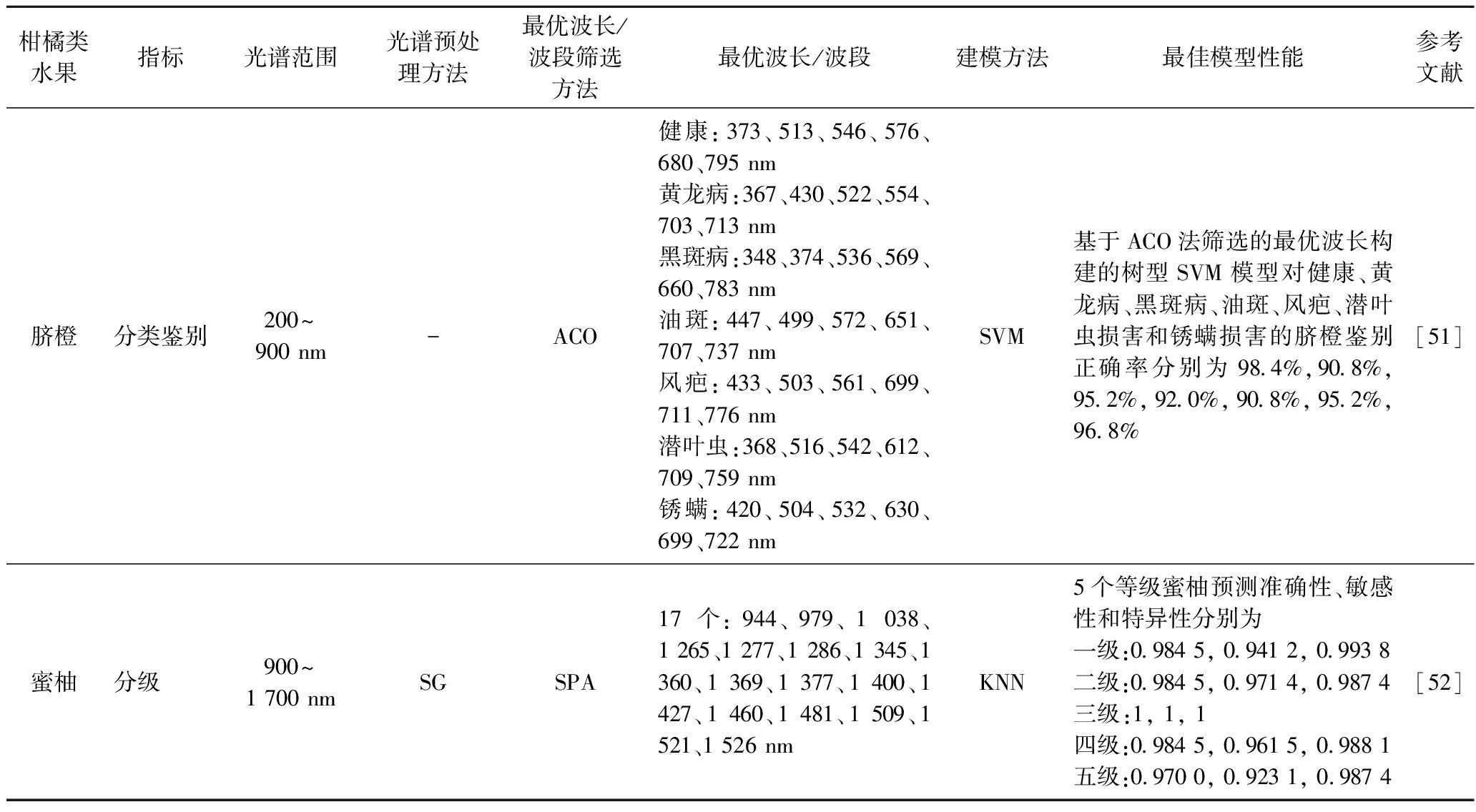
柑橘类水果指标光谱范围光谱预处理方法最优波长/波段筛选方法最优波长/波段建模方法最佳模型性能参考文献脐橙分类鉴别200~900 nm-ACO健康:373、513、546、576、680、795 nm黄龙病:367、430、522、554、703、713 nm黑斑病:348、374、536、569、660、783 nm油斑:447、499、572、651、707、737 nm风疤:433、503、561、699、711、776 nm潜叶虫:368、516、542、612、709、759 nm锈螨:420、504、532、630、699、722 nmSVM基于ACO法筛选的最优波长构建的树型SVM模型对健康、黄龙病、黑斑病、油斑、风疤、潜叶虫损害和锈螨损害的脐橙鉴别正确率分别为98.4%,90.8%,95.2%,92.0%,90.8%,95.2%,96.8%[51]蜜柚分级900~1 700 nmSGSPA17个:944、979、1 038、1 265、1 277、1 286、1 345、1 360、1 369、1 377、1 400、1 427、1 460、1 481、1 509、1 521、1 526 nmKNN5个等级蜜柚预测准确性、敏感性和特异性分别为一级:0.984 5, 0.941 2, 0.993 8二级:0.984 5, 0.971 4, 0.987 4三级:1, 1, 1四级:0.984 5, 0.961 5, 0.988 1五级:0.970 0, 0.923 1, 0.987 4[52]
注:LDA:线性判别分析;DT:去趋势;CWT:连续小波变换;ACO:蚁群算法;KNN:K邻近算法(下同)。
相比内部品质和病冻害,柑橘品种产地的NIR研究较少,鉴于不同产地气候对果实的光谱信息影响较大,如何正确筛选试验样本将有助于提升鉴别模型的适用性。
4 NIR光谱技术用于柑橘类水果生物活性成分检测
柑橘类水果富含多种生物活性物质,常见的有类黄酮、类胡萝卜素、类柠檬苦素、香豆素等,这些化合物具有良好的抗氧化、抗病等保健功效[53-55]。常规方法测定这些生物活性物质主要有高效液相色谱法[56]、液相色谱与质谱联用法[57]、超高效液相色谱与四级杆飞行时间质谱联用法等[58]。NIR光谱技术用于柑橘生物活性物质的快速检测研究报道相对较少,但效果比较理想,如NCAMA等[42]通过在400~2 500 nm 筛选有效的NIR波段,构建PLS模型可以实现对西柚生物活性成分β胡萝卜素、总类胡萝卜素、叶绿素a、叶绿素b以及糖类含量的快速检测,其中β胡萝卜素的预测效果最好(RCV2=0.99,RMSECV =0.002),其他成分预测详见表4。尽管该模型预测结果比较理想,但是该研究并未设置独立的测试集样品进行模型的外部验证,模型效果有待进一步探讨。
表4 NIR光谱技术在柑橘类水果生物活性成分检测中的应用
Table 4 Application of NIR spectroscopy in detection of bioactive ingredients in citrus fruits
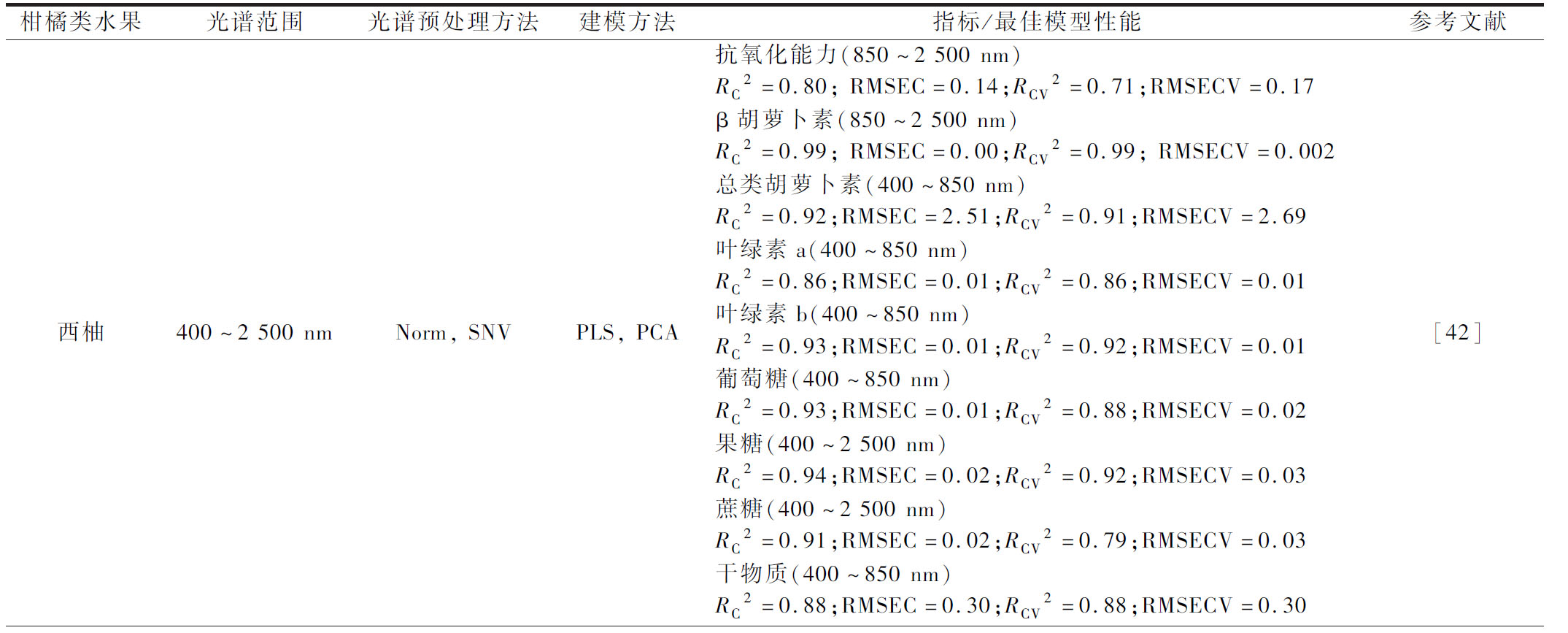
柑橘类水果光谱范围光谱预处理方法建模方法指标/最佳模型性能参考文献西柚400~2 500 nmNorm, SNVPLS, PCA抗氧化能力(850~2 500 nm)RC2=0.80; RMSEC=0.14;RCV2=0.71;RMSECV=0.17β胡萝卜素(850~2 500 nm)RC2=0.99; RMSEC=0.00;RCV2=0.99; RMSECV=0.002总类胡萝卜素(400~850 nm)RC2=0.92;RMSEC=2.51;RCV2=0.91;RMSECV=2.69叶绿素a(400~850 nm)RC2=0.86;RMSEC=0.01;RCV2=0.86;RMSECV=0.01叶绿素b(400~850 nm)RC2=0.93;RMSEC=0.01;RCV2=0.92;RMSECV=0.01葡萄糖(400~850 nm)RC2=0.93;RMSEC=0.01;RCV2=0.88;RMSECV=0.02果糖(400~2 500 nm)RC2=0.94;RMSEC=0.02;RCV2=0.92;RMSECV=0.03蔗糖(400~2 500 nm)RC2=0.91;RMSEC=0.02;RCV2=0.79;RMSECV=0.03干物质(400~850 nm)RC2=0.88;RMSEC=0.30;RCV2=0.88;RMSECV=0.30[42]
续表4

柑橘类水果光谱范围光谱预处理方法建模方法指标/最佳模型性能参考文献西柚400~2 500 nmSGPLS蔗糖(400~2 500 nm)RC2=0.99;RMSEC=0.11 g/kg;RP2=0.99;RMSECV=0.11 g/kg; RPD=11.42葡萄糖(400~2 500 nm)RC2=0.99;RMSEC=0.69 g/kg;RP2=0.99;RMSECV=0.77 g/kg; RPD=11.35果糖(400~2 500 nm)RC2=0.99;RMSEC=0.90 g/kg;RP2=0.99;RMSECV=0.99 g/kg; RPD=14.23总酚(400~2 500 nm)RC2 =0.96;RMSEC=0.08 g/kg;RP2 =0.97;RMSECV=0.07 g/kg; RPD=5.96总黄酮(400~2 500 nm)RC2 =0.99;RMSEC=0.07 g/kg;RP2 =0.94;RMSECV=0.07 g/kg; RPD=12.37维生素C(400~2 500 nm)RC2 =0.95;RMSEC=0.16 g/kg;RP2 =0.96;RMSECV=0.16 g/kg; RPD=4.60DPPH自由基(400~2 500 nm)RC2 =0.92;RMSEC=1.24 %;RP2 =0.93;RMSECV=1.16 %;RPD=3.68叶绿素a(400~700 nm)RC2 =0.95;RMSEC=0.37 g/kg;RP2 =0.96;RMSECV=0.36 g/kg; RPD=3.88叶绿素b(400~700 nm)RC2 =0.97;RMSEC=1.83 g/kg;RP2 =0.97;RMSECV=1.76 g/kg; RPD=5.85总类胡萝卜素(400~700 nm)RC2 =0.97;RMSEC=0.80 g/kg;RP2 =0.97;RMSECV=0.79 g/kg; RPD=5.49[59]柠檬柚子柑橘橙子8 000~4 000 cm-1SNV, 1st DerPLS地奥司明RCV2=0.988;RMSECV=14.42 mg橘皮苷RCV2=0.992;RMSECV=30.38 mg[60]
在相同的波长范围内,OLAREWAJU等[59]对两个不同产地的西柚生物活性成分也进行了NIR预测研究,PLS模型验证结果显示400~700 nm光谱信息更适合于预测西柚叶绿素a、叶绿素b和总类胡萝卜素含量,模型性能表现良好,决定系数R2均在0.95以上;而400~2 500 nm波段适合预测蔗糖、葡萄糖、果糖、总酚、总黄酮、维生素C等的含量,模型相关系数R2也均在0.95以上。
除了果实,柑橘果皮中也富含多种生物活性物质,对其充分利用可有效提高果皮附加值。果皮生物活性成分的快速检测可加速果皮再利用。SHAWKY等[60]利用8 000~4 000 cm-1波段信息预测9种柑橘皮中的黄酮类物质地奥司明(Diosmin)和橘皮苷(Hesperidin)含量,这两种生物活性物质的NIR预测值与真实值之间的相关性极高(R2>0.98),这为快速开发柑橘皮药用价值提供了有效的检测手段。
5 展望与结语
综合近五年来NIR光谱技术在柑橘类水果中的检测应用研究结果发现,绝大部分NIR研究集中在柑橘内部品质评价方面,且主要为检测柑橘SSC(糖度);而病冻害识别、品种产地鉴别及生物活性物质检测等方面的研究相对较少。此外,这些研究使用的波段覆盖了VIS/NIR区域,但SW-NIR光谱信息使用更多,且大部分结果表现良好,揭示了NIR光谱技术在柑橘类水果检测方面的应用潜力。同时,NIR光谱技术在柑橘检测应用中也存在诸多困难需要克服:1)柑橘果实因产地、品种不同,对NIR光吸收有差异,如何构建样本数据库值得探讨;2)构建高精度模型需要大量样本参与,同时也要筛选特征光谱以提高预测效率,如何挖掘获取有效且代表性很强的光谱信息或构建有效的光谱数据库需要深入研究;3)柑橘NIR模型易受到样本本身特性如表面颗粒大小、表皮厚度等的影响较大,采用哪种方法可最大可能消除这些影响有必要继续探究;4)在多元化需求的时代背景下,开发市场需求的专业化检测设备已是趋势,如何提高模型的稳定性和适用性将是重中之重。
我国已成为世界柑橘生产消费第一大国,柑橘市场活跃且衍生需求旺盛,优质优价柑橘当属消费者最重要之期望,柑橘市场健康可持续发展需要先进的技术提供保障,NIR光谱技术已展现出独有的快速无损特点和优势,部分柑橘品质检测专业化NIR设备已经问世且实现了生产应用,如糖度、酸度、干物质等的检测,但大多为进口设备,具有自主知识产权且高精度高稳定性的柑橘NIR检测设备依然缺乏,“卡脖子”技术攻关刻不容缓,未来NIR柑橘检测必是便捷智能化走向。
[1] 王苗苗. 响应柑橘黄龙病的MAPK基因和PR基因鉴定及遗传转化[D].重庆:西南大学, 2018. WANG M M.Identification and genetic transformation of citrus MAPK genes and PR genes induced by Huanglongbing[D].Chongqing:Southwest University, 2018.
[2] 易图永, 王运生, 谭小平, 等.柑橘主要病害成灾机理及绿色防控关键技术与应用[J].中国科技成果, 2020(20):11-13. YI T Y, WANG Y S, TAN X P, et al.Disaster mechanism of main citrus diseases and key technologies and applications of green prevention and control[J].China Science and Technology Achievements, 2020(20):11-13.
[3] 尤有利, 彭抒昂, 邓秀新, 等.柑橘黄龙病防控"永春模式"构建与示范推广[J].中国科技成果, 2020, 21(8):26-27. YOU Y L, PENG S A, DENG X X, et al.Construction and demonstration of "Yongchun model" for the prevention and control of citrus greening disease[J].China’s Scientific and Technological Achievements, 21(8):26-27.
[4] LADANIYA M.Nutritive and Medicinal Value of Citrus Fruits[M]//Citrus Fruit.Amsterdam:Elsevier, 2023:693-720.
[5] 温成韬. 中国水果竞争力国际比较分析[J].现代营销, 2020, (12):106-108. WEN C T.International Comparative analysis of Chinese fruit competitiveness[J].Modern Marketing, 2020, (12):106-108.
[6] ZACARIAS L, CRONJE P J R, PALOU L.Postharvest Technology of Citrus Fruits.In The Genus Citrus[M], 2020, 421-446.
[7] IQBAL Z, KHAN M A, SHARIF M, et al.An automated detection and classification of citrus plant diseases using image processing techniques:A review[J].Computers and Electronics in Agriculture, 2018, 153:12-32.
[8] JIANG Q Y, ZHANG M, XU B G.Application of ultrasonic technology in postharvested fruits and vegetables storage:A review[J].Ultrasonics Sonochemistry, 2020, 69:105261.
[9] WEN T, ZHENG L Z, DONG S, et al.Rapid detection and classification of citrus fruits infestation by Bactrocera dorsalis (Hendel) based on electronic nose[J].Postharvest Biology and Technology, 2019, 147:156-165. [10] SUN Q, ZHANG M, YANG P Q.Combination of LF-NMR and BP-ANN to monitor water states of typical fruits and vegetables during microwave vacuum drying[J].LWT, 2019, 116:108548.
[11] LUO W, FAN G Z, TIAN P, et al.Spectrum classification of citrus tissues infected by fungi and multispectral image identification of early rotten oranges[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2022, 279:121412.
[12] POREP J U, KAMMERER D R, CARLE R.On-line application of near infrared (NIR) spectroscopy in food production[J].Trends in Food Science &Technology, 2015, 46(2):211-230.
[13] PASQUINI C.Near infrared spectroscopy:A mature analytical technique with new perspectives: A review[J].Analytica Chimica Acta, 2018, 1026:8-36.
[14] ALISHAHI A, FARAHMAND H, PRIETO N, et al.Identification of transgenic foods using NIR spectroscopy:A review[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2010, 75(1):1-7.
[15] ZHANG D, ZHAO Z F, ZHANG S Y, et al.Accurate identification of soluble solid content in citrus by indirect laser-induced breakdown spectroscopy with its leaves[J].Microchemical Journal, 2021, 169:106530.
[16] HIJAZ F, GMITTER F G Jr, BAI J H, et al.Effect of fruit maturity on volatiles and sensory descriptors of four mandarin hybrids[J].Journal of Food Science, 2020, 85(5):1548-1564.
[17] MOLT E, BLASCO J.Quality Evaluation of Citrus Fruits[M]//Computer Vision Technology for Food Quality Evaluation.Amsterdam:Elsevier, 2008:243-264.
E, BLASCO J.Quality Evaluation of Citrus Fruits[M]//Computer Vision Technology for Food Quality Evaluation.Amsterdam:Elsevier, 2008:243-264.
[18] FU X P, WANG X Y, RAO X Q.An LED-based spectrally tuneable light source for visible and near-infrared spectroscopy analysis:A case study for sugar content estimation of citrus[J].Biosystems Engineering, 2017, 163:87-93.
[19] 汪小耀. 基于LED光源的柑橘糖度可见/近红外光谱检测研究[D].杭州:浙江大学, 2017. WANG X Y.Study on visible/near infrared spectrum detection of citrus sugar content based on LED light source[D].Hangzhou:Zhejiang University, 2017.
[20] CAVACO A M, PIRES R, ANTUNES M D, et al.Validation of short wave near infrared calibration models for the quality and ripening of ‘Newhall’ orange on tree across years and orchards[J].Postharvest Biology and Technology, 2018, 141:86-97.
[21] THEANJUMPOL P, WONGZEEWASAKUN K, MUENMANEE N, et al.Non-destructive identification and estimation of granulation in ‘Sai Num Pung’ tangerine fruit using near infrared spectroscopy and chemometrics[J].Postharvest Biology and Technology, 2019, 153:13-20.
[22] TIAN X, LI J B, YI S L, et al.Nondestructive determining the soluble solids content of citrus using near infrared transmittance technology combined with the variable selection algorithm[J].Artificial Intelligence in Agriculture, 2020, 4:48-57.
[23] PIRES R, GUERRA R, CRUZ S P, et al.Ripening assessment of ‘Ortanique’ (Citrus reticulata Blanco x Citrus sinensis (L) Osbeck) on tree by SW-NIR reflectance spectroscopy-based calibration models[J].Postharvest Biology and Technology, 2022, 183:111750.
[24] 韩龙波. 柑橘光谱信息感知参数化平台设计及糖度无损检测研究[D].长沙:中南林业科技大学,2021. HAN L B.Research on the design of citrus spectral information perception parameterized platform and nondestructive testing of sugar content[D].Changshao:Central South University of Forestry and Technology, 2021.
[25] HUANG C J, CAI J R, ZHOU Y, et al.Fusion models for detection of soluble solids content in mandarin by Vis/NIR transmission spectroscopy combined external factors[J].Infrared Physics &Technology, 2022, 124:104233.
[26] KIM S Y, HONG S J, KIM E, et al.Application of ensemble neural-network method to integrated sugar content prediction model for citrus fruit using VIS/NIR spectroscopy[J].Journal of Food Engineering, 2023, 338:111254.
[27] NCAMA K, OPARA U L, TESFAY S Z, et al.Application of Vis/NIR spectroscopy for predicting sweetness and flavour parameters of ‘Valencia’ orange (Citrus sinensis) and ‘Star Ruby’ grapefruit (Citrus x paradisi Macfad)[J].Journal of Food Engineering, 2017, 193:86-94.
[28] BIZZANI M, FLORES D W M, COLNAGO L A, et al.Non-invasive spectroscopic methods to estimate orange firmness, peel thickness, and total pectin content[J].Microchemical Journal, 2017, 133:168-174.
[29] TORRES I, PÉREZ-MAR N D, DE LA HABA M J, et al.Developing universal models for the prediction of physical quality in citrus fruits analysed on-tree using portable NIRS sensors[J].Biosystems Engineering, 2017, 153:140-148.
N D, DE LA HABA M J, et al.Developing universal models for the prediction of physical quality in citrus fruits analysed on-tree using portable NIRS sensors[J].Biosystems Engineering, 2017, 153:140-148.
[30] 王旭. 冰糖橙可溶性固形物和pH值近红外光谱检测[J].食品研究与开发, 2017, 38(3):143-146. WANG X.Detecting of soluble solid content and pH of Bingtang orange by near-infrared spectroscopy[J].Food Research and Development, 2017, 38(3):143-146.
[31] 孙通, 莫欣欣, 刘木华.果皮对脐橙可溶性固形物可见/近红外检测精度的影响[J].光谱学与光谱分析, 2018, 38(5):1406-1411. SUN T, MO X X, LIU M H.Effect of pericarp on prediction accuracy of soluble solid content in navel oranges by visible/near-infrared spectroscopy[J].Spectroscopy and spectral Analysis, 2018, 38(5):1406-1411.
[32] 刘燕德, 饶宇, 孙旭东, 等.尺寸差异对脐橙糖度可见近红外光谱检测模型影响[J].光谱学与光谱分析, 2020, 40(10):3241-3246. LIU Y D, YAO Y, SUN X D, et al.Size effect on the near-infrared spectroscopy detection model of navel orange[J].Spectroscopy and spectral Analysis,2020, 40(10):3241-3246.
[33] SONG J, LI G L, YANG X D, et al.Rapid analysis of soluble solid content in navel orange based on visible-near infrared spectroscopy combined with a swarm intelligence optimization method[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2020, 228:117815.
[34] HAO Y, WANG Q M, ZHANG S M.Online accurate detection of soluble solids content in navel orange assisted by automatic orientation correction device[J].Infrared Physics &Technology, 2021, 118:103871.
[35] CHEN H Z, LIN B, CAI K, et al.Quantitative analysis of organic acids in pomelo fruit using FT-NIR spectroscopy coupled with network kernel PLS regression[J].Infrared Physics &Technology, 2021, 112:103582.
[36] 孙潇鹏, 刘灿灿, 陆华忠, 等.基于可见-近红外透射光谱的蜜柚检测中影响因素分析[J].包装与食品机械, 2022, 40(4):1-7. SUN X P, LIU C C, LU H Z, et al.Analysis of influencing factors in the detection of honey pomelo based on visible-near infrared transmittance spectroscopy[J].Packaging and Food Machinery, 2022, 40(4):1-7.
[37] TIAN H, XU H R, YING Y B.Can light penetrate through pomelos and carry information for the non-destructive prediction of soluble solid content using VIS-NIRS?[J].Biosystems Engineering, 2022, 214:152-164.
[38] GRAHAM J, FEICHTENBERGER E.Citrus phytophthora diseases:Management challenges and successes[J].Journal of Citrus Pathology, 2015, 2(1):1-11.
[39] MAGWAZA L S, OPARA U L, CRONJE P, et al.Nonchilling physiological rind disorders in citrus fruit:A review[J].Horticultural Reviews, 2013, 41(41):131-176.
[40] GHOOSHKHANEH G N, GOLZARIAN M R, MOLLAZADE K.VIS-NIR spectroscopy for detection of citrus core rot caused by Alternaria alternata[J].Food Control, 2023, 144:109320.
[41] 李轶凡. 水果缺陷和内部品质同时在线检测方法研究[D].南昌:华东交通大学, 2016. LI Y F.Simultaneous and online detection of fruit defect and internal quality based on visible-near infared tranmittance spectroscopy[D].Nanchang:East China Jiaotong University, 2016.
[42] NCAMA K, TESFAY S Z, FAWOLE O A, et al.Non-destructive prediction of ‘Marsh’ grapefruit susceptibility to postharvest rind pitting disorder using reflectance VIS/NIR spectroscopy[J].Scientia Horticulturae, 2018, 231:265-271.
[43] MOOMKESH S, AHMAD MIREEI S, SADEGHI M, et al.Early detection of freezing damage in sweet lemons using Vis/SWNIR spectroscopy[J].Biosystems Engineering, 2017, 164:157-170.
[44] TIAN S, WANG S, XU H R.Early detection of freezing damage in oranges by online Vis/NIR transmission coupled with diameter correction method and deep 1D-CNN[J].Computers and Electronics in Agriculture, 2022, 193:106638.
[45] AFONSO A M, GUERRA R, CAVACO A M, et al.Identification of asymptomatic plants infected with Citrus tristeza virus from a time series of leaf spectral characteristics[J].Computers and Electronics in Agriculture, 2017, 141:340-350.
[46] 贺胜晖, 李灵巧, 刘彤, 等.柑橘黄龙病检测的近红外光谱集成建模方法[J].分析科学学报, 2020, 36(2):287-290. HE S H, LI L Q, LIU T, et al.Near-infrared spectroscopy based ensemble modeling method for Huanglongbing detection[J].Journal of Analytical Science, 2020, 36(2):287-290.
[47] 但松健. 基于NIR光谱分析的柑橘产地鉴别及品质检测技术研究[D].重庆:重庆大学,2017. DAN S J.A study on determination of the geographical origins and internal qualities of oranges based on NIR spectroscopy analysis[D].Chongqing:Chongqing University, 2017.
[48] 李尚科. 柑橘类水果和陈皮光学无损检测及软件开发[D].长沙:湖南农业大学,2020. LI S K.Optical nondestructive analysis of citrus and citri reticulatae pericarpium and software development[D].Changsha:Hunan Agricultural University, 2020.
[49] 姚婉清, 彭梦侠, 刘婷.梅州金柚品种的近红外无损鉴别[J].食品研究与开发, 2019, 40(11):166-169. YAO W Q, PENG M X, LIU T.Nondestructive identification of golden pomelo varieties in Meizhou based on near infrared spectroscopy[J].Food Research and Development, 2019, 40(11):166-169.
[50] RUGGIERO L, AMALFITANO C, DI VAIO C, et al.Use of near-infrared spectroscopy combined with chemometrics for authentication and traceability of intact lemon fruits[J].Food Chemistry, 2022, 375:131822.
[51] ZHANG Y, LEE W S, LI M Z, et al.Non-destructive recognition and classification of citrus fruit blemishes based on ant colony optimized spectral information[J].Postharvest Biology and Technology, 2018, 143:119-128.
[52] 孙潇鹏, 刘灿灿, 陆华忠, 等.基于近红外透射光谱与机器视觉的蜜柚汁胞粒化分级检测[J].食品科学技术学报, 2021, 39(1):37-45. SUN X P, LIU C C, LU H Z, et al.Detection of honey pomelo in different granulation levels based on near-infrared transmittance spectroscopy combined with machine vision[J].Journal of Food Science and Technology, 2021, 39(1):37-45.
[53] GAO Z, GAO W, ZENG S L, et al.Chemical structures, bioactivities and molecular mechanisms of citrus polymethoxyflavones[J].Journal of Functional Foods, 2018, 40:498-509.
[54] SHI Y S, ZHANG Y, LI H T, et al.Limonoids from citrus:Chemistry, anti-tumor potential, and other bioactivities[J].Journal of Functional Foods, 2020, 75:104213.
[55] LIU N, LI X, ZHAO P, et al.A review of chemical constituents and health-promoting effects of citrus peels[J].Food Chemistry, 2021, 365:130585.
[56] COSTA R, ALBERGAMO A, ARRIGO S, et al.Solid-phase microextraction-gas chromatography and ultra-high performance liquid chromatography applied to the characterization of lemon wax, a waste product from citrus industry[J].Journal of Chromatography A, 2019, 1603:262-268.
[57] DADWAL V, JOSHI R, GUPTA M.A comparative metabolomic investigation in fruit sections of Citrus medica L.and Citrus maxima L.detecting potential bioactive metabolites using UHPLC-QTOF-IMS[J].Food Research International, 2022, 157:111486.
[58] ZHENG H, ZHEN X T, CHEN Y, et al.In situ antioxidation-assisted matrix solid-phase dispersion microextraction and discrimination of chiral flavonoids from citrus fruit via ion mobility quadrupole time-of-flight high-resolution mass spectrometry[J].Food Chemistry, 2021, 343:128422.
[59] OLAREWAJU O O, MAGWAZA L S, NIEUWOUDT H, et al.Model development for non-destructive determination of rind biochemical properties of ‘Marsh’ grapefruit using visible to near-infrared spectroscopy and chemometrics[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 209:62-69.
[60] SHAWKY E, SELIM D A.NIR spectroscopy-multivariate analysis for discrimination and bioactive compounds prediction of different citrus species peels[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 219:1-7.