运动损伤发生后,除了第一时间采用常规治疗方法外,最佳饮食非常重要,采用最佳饮食和消炎抗氧化饮食可以加快伤口愈合。运动损伤发生后抗氧化和自由基之间的平衡会影响伤口的愈合时间,而使自由基失去活性的化学物质作为抗氧化剂又是机体必须的营养素。当提及营养素其核心仍是围绕“六大营养素”的价值功效展开。其中,宏量营养素涉及免疫细胞的代谢和蛋白质的合成,而微量营养素涉及免疫细胞应答和抗氧化防御作用。在常规的运动损伤恢复中,通过积极的休息、冰敷、伸展、康复治疗等方法促进恢复,同时,营养手段的实施在结合项目特点(有氧无氧)、代谢需要(重塑组织、保证能量需求)和营养补充计划下对运动损伤恢复就具有重要的意义。因此,运动损伤恢复的应用策略中营养作为主要的恢复手段之一,越来越被精细化地要求和管理,任何有助于运动损伤早期抑制过度炎症或加速后续阶段修复、愈合过程的策略都值得考虑。因为通过营养手段能够实现其营养摄入与能量消耗之间的平衡状态[1],该平衡状态对维持机体健康营养素的需求和对促进运动损伤恢复具有双重效果。
1 运动损伤恢复过程
1.1 运动损伤恢复分期
1.1.1 炎症、静止、萎缩阶段
运动过程中产生的自由基,活性氧自由基和活性氮自由基可导致骨骼肌损伤和疲劳,进而产生严重的运动损伤。运动损伤产生机理多在于人体组织损伤,往往是过度训练和离心收缩造成。运动损伤依据解剖学结构、诊断和治疗大体分为关节损伤、肌肉骨骼损伤、急性损伤、过度使用伤害等。损伤后机体的恢复通常有2个主要阶段,且这2个阶段均受营养补充的影响。运动损伤初期炎症反应开始,被认为是适当愈合所必需的,表现出炎症、静止和萎缩。这一炎症阶段可能持续数小时至数天,具体取决于损伤情况,根据损伤的类型和严重程度,伤肢固定可以持续几天到几个月。在该阶段,由于运动损伤疼痛抑制和制动引起的肌肉活动减少,损伤会导致肌肉活动受损。同时,不活动导致的组织代谢变化会出现肌肉力量和肌肉功能的丧失[2-3](图1)。该阶段因受伤诱导的制动导致机体代谢和功能产生变化,表现在肌肉大小和强度、肌肉和肌腱蛋白质合成的减少以及肌腱结构和功能迅速而显著地下降。
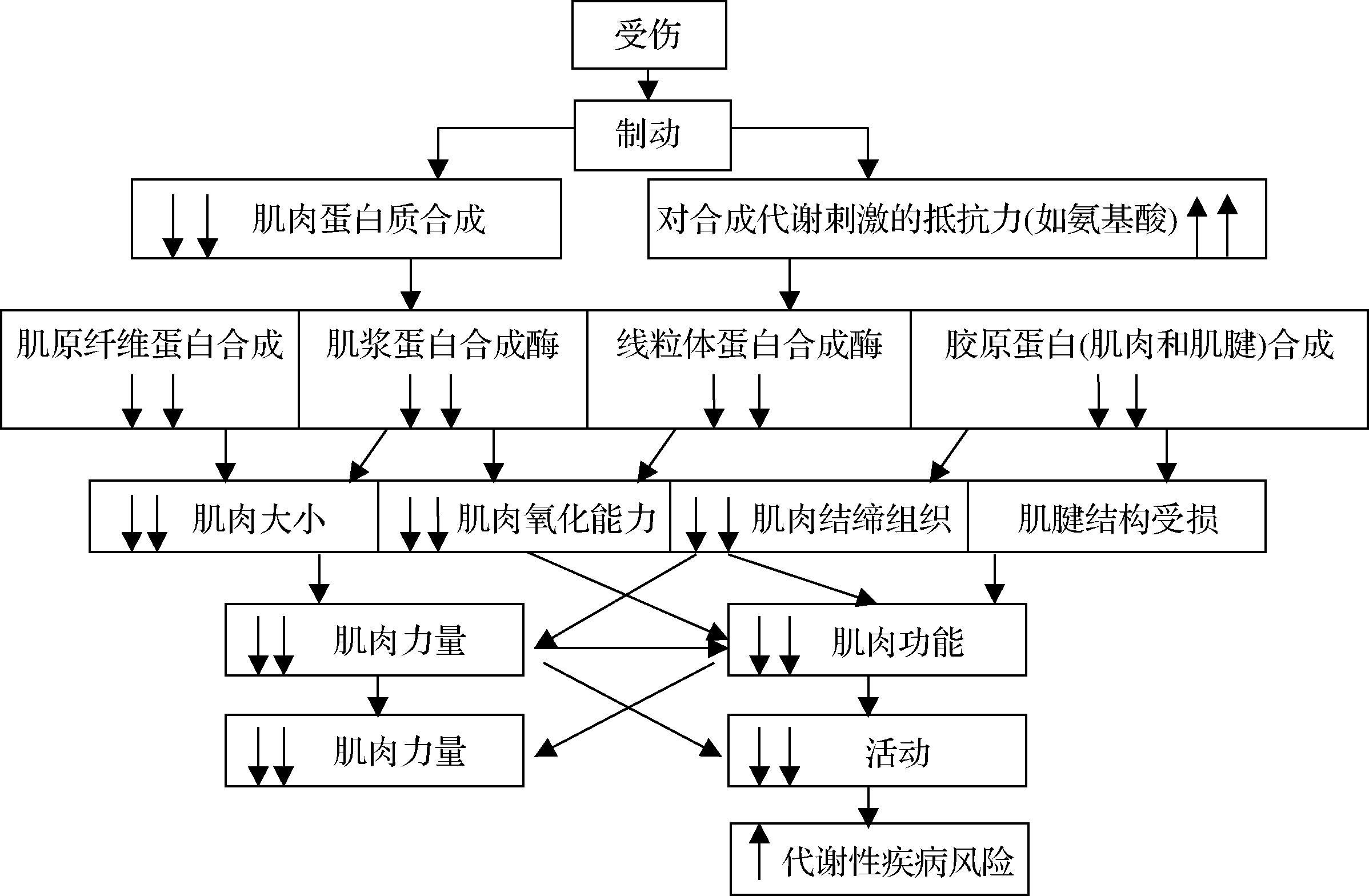
图1 受伤诱导的制动后代谢和功能变化的流程
Fig.1 Process of metabolic and functional changes after braking induced by injury
注:图中方框内双向下箭头表示大幅减少,单向下箭头表示少量减少;双向上箭头表示大幅增加,单向上箭头表示少量增加
1.1.2 受伤肢体的康复和活动增加阶段
受伤肢体的康复和活动增加阶段是在运动能力恢复之后,出现肌肉肥大和功能恢复。显然,受伤导致的制动后完全恢复肌肉力量和功能所需的时间比失去它们所需的时间要长得多。此阶段再生肌肉组织和巩固愈合过程是其主要的任务。鉴于此,运动损伤后恢复的2个阶段通过营养干预提供了可能。运动损伤后在2个阶段补充营养素时需要考虑促进恢复过程的营养补充,应按照如下顺序进行:能量平衡/可用性——宏量营养素——微量营养素——水合作用——营养时机——补剂。如果机体摄入的营养素在第1阶段(对抗炎症)可以抑制过度炎症,那么营养素在运动损伤第1阶段在理论上是有用且科学的,第2阶段在肌腱修复后增强肌腱与骨骼连接过程中,营养物质的摄入可能特别有用。这些假说,将通过以下营养素对运动损伤恢复的效果探究其实质。
1.2 运动损伤恢复营养素补充的影响因素
1.2.1 对抗炎症——在炎症、静止、萎缩阶段的营养素补充
运动损伤后炎症是愈合过程的一部分,避免过度炎症应是合理的。以往当受伤疼痛或运动损伤时,非甾体类抗炎药(nonsteroidal anti-inflammatory drugs nsaids, NSAIDs)则成为“首选”药物,然而长期使用该类药会存在潜在的弊端,如发生胃肠道出血的几率较高。同时,NSAIDs可以延迟肌肉再生,并可能减少韧带、肌腱和软骨的愈合,使再次损伤或慢性损伤的风险增大[4-6]。鉴于此,现有研究着眼于天然植物化合物的研究[7],这些化合物能够对抗炎症、加速机体损伤的恢复,可以起到预防多种退行性疾病和相关炎症疾病的作用,该类营养素属于植物营养素,也叫植物性矿物。如姜黄素对关节疼痛和僵硬患者作用的广泛临床试验表明:它可以在4周内减轻疼痛并改善功能,因为具有抗氧化和抗炎活性,在治疗关节疼痛和关节炎上效果明显[8];酸樱桃汁的花青素作为天然植物化学抗氧化化合物起到抗炎和减轻疼痛作用,通过抑制体内炎症的生化途径,可能提供了比阿司匹林更有效的抗炎作用[9-10];又如生姜中的生物合成物具有抑制前列腺素的作用,具有类似于新型双作用NSAID的药理特性,但其副作用显著低于传统NSAID[11-12]。同时,在随后的几项动物研究中表明,干姜或生姜提取物可以减轻急性炎症[13-14]。在人类身上,一些临床研究支持生姜治疗骨关节炎的价值,能显著减轻膝关节疼痛[15-17]。所以,运动损伤后抗炎作为愈合过程的一部分,对于营养素的补充应考虑到对抗炎症的重要性。
1.2.2 总能量摄入——在康复和增加活动阶段的营养素补充
对于运动损伤后总能量的摄入在运动损伤导致机体相对制动过程中,活动程度的降低可能会导致总能量消耗大幅减少,因为此时运动更为困难或者行动不便。这也就不难解释,为什么许多受伤运动员在伤病期间会大幅减少能量摄入以避免体重增加过快。但有研究表明[18-19],在损伤愈合过程中,能量消耗会增加20%,尤其是在损伤早期和较严重的情况下。这就为运动损伤期间如何进行能量的摄入提出了更高的要求。鉴于总能量摄入不足会损害肌肉蛋白质合成,导致更大的肌肉组织损失和损伤愈合过程中更高的能量消耗(增加20%),要实现两者之间的相对平衡,少量的体重增加可能比缺乏能量摄入更好。其一,它能支持适当的肌肉愈合和阻止肌肉蛋白质的流失,有利于运动损伤的良好恢复;其二,能够避免能量摄入和能量消耗之间的不平衡,发生低能量可用性(low energy availability, LEA),而LEA可诱发运动中相对能量不足从而避免宏量、微量营养素缺乏症的潜在风险。所以,运动损伤后随着炎症的逐渐愈合,摄入的营养素在机体处于恢复过程中需要实现能量平衡,这为营养素对运动损伤的恢复提供了可能。
2 运动损伤补充宏量营养素
2.1 宏量营养素脂肪补充的抗炎作用
在运动损伤的恢复过程中,脂肪是一种重要的能量来源,它可以产生激素,有效减少炎症。运动损伤后炎症会产生更多自由基,自由基损伤肌肉细胞并进一步触发炎症反应和脂质过氧化反应。在宏量营养素的摄入中加入可发生抗氧化反应的膳食脂肪将更有利于运动损伤的恢复。机体健康有2种必需脂肪:α-亚麻酸(omega-3)和亚油酸(omega-6),这2种脂肪酸不仅对机体构建健康的细胞膜至关重要,其化学结构还可以用来制造身体内类似激素的物质,即前列腺素,后者继续调节许多其他功能。ω-3多不饱和脂肪酸包括二十二碳六烯酸(docosahexaenoic, DHA)、二十碳五烯酸(eicosapentaenoic acid, EPA)、α-亚麻酸(α-linolenic acid, ALA)3种脂肪。其中,ALA存在于坚果和种子等植物性食物中,EPA和DHA存在于多脂肪的鱼类中,这3种ω-3脂肪酸都被认为对人类健康有益,而补充EPA和DHA潜在的免疫调节和抗炎作用尤其明显[20-22]。DHA和EPA在炎症和免疫方面的研究始于上世纪八十年代。早期研究发现,DHA和EPA通过竞争性作用抑制前列腺素E2的生成,生成系列消退素并抑制促炎因子,表现出明显的抗炎作用,同时,在协同作用下,EPA和DHA衍生的炎症介质,如前列腺素、白三烯、脂蛋白、溶解素和保护素在抗炎中发挥作用。DHA衍生物CRBM-0244能抑制NF-κB途径的激活,还可以减少NF-κB途径的蛋白激活,减少炎性细胞因子的产生[23]。这与普遍存在的ω-6脂肪和氨基酸形成对比,后者是一种已知的NF-κB活性刺激物。有研究发现[24],EPA降低促炎激素——前列腺素E2需要每天摄入1.35~2.75 g多不饱和脂肪酸,该剂量远高于大多数饮食提供的量,即使用了膳食补充剂。为此,在运动损伤后的急性期,建议运动员增加ω-3多不饱和脂肪酸摄入量,减少ω-6多不饱和脂肪酸摄入量。除了食用ω-3多不饱和脂肪酸(EPA和DHA)补充剂外,食用更多高脂肪鱼类(鲑鱼、鳟鱼、沙丁鱼、鲱鱼等)、亚麻籽油、核桃、南瓜籽等,同时减少ω-6脂肪的摄入(如玉米、向日葵等植物油,含有ω-6脂肪的加工食品和掺假的油脂)将会产生积极的作用。因此,ω-3多不饱和脂肪酸,在机体运动损伤处于炎症、静止、萎缩阶段对失控的免疫系统具有“制动作用”。综上所述,宏量营养素脂肪的补充表现出较好的缓解炎症作用。
2.2 宏量营养素蛋白补充对肌肉损失的逆转
运动损伤后蛋白质摄入是刺激肌肉蛋白质合成和促进修复的关键。损伤诱导的“制动”使机体处于相对静止,最明显的变化是肌肉质量减少,从而导致肌肉功能降低。运动损伤后骨骼肌衰减征与静息的生活方式、营养缺乏、细胞外氨基酸代谢失衡及氧自由基损伤等诸多因素有关[25],而导致肌肉丧失的主要代谢因素是肌肉蛋白质,尤其是肌原纤维蛋白合成的减少。因此,增加蛋白质摄入通常是肌肉损失的首要营养对策。有研究表明,当给予充足的蛋白质食物时,老年人蛋白质合成率与年轻人相当,而当减少蛋白质供给时,老年个体的蛋白质合成率减弱,这种合成率抵抗被认为是衰老引起的亮氨酸敏感性降低,若增加亮氨酸的比例可以提高蛋白质合成率[26]。近年来,有学者认为支链氨基酸(如亮氨酸)对运动所致肌肉损伤具有一定的保护作用[27-28]。为此,已有研究通过在老年人群中增加亮氨酸的摄入来增强克服合成代谢过程中,由于代谢效应长时间固定化所诱导的合成代谢抵抗的现象[29]。如给予老年群体的蛋白质食物中含46%的亮氨酸,相对于乳清蛋白中26%的亮氨酸,亮氨酸含量高的食物更有利于蛋白质合成恢复。现有研究已经证实,口服亮氨酸能刺激大鼠多种肌肉蛋白质在体内的合成[30],此外,对处于分解代谢状态大鼠的研究表明,补充亮氨酸可以逆转肌肉蛋白质的损失,通常会使肌肉蛋白质合成恢复到正常水平[31]。同时,支链氨基酸、亮氨酸的摄入已被证明可以促进肌肉的合成及其质量的增加,且运动前后添加50 g含蛋白质的碳水化合物,可减少肌肉的分解[32]。因为,食用富含亮氨酸的蛋白质在促进皮肤、伤口、骨头愈合和刺激肌肉组织合成方面优于其他蛋白质,主要是亮氨酸的摄入激活了营养感知因子雷帕霉素机制性靶蛋白,具有促进翻译启始和肌肉蛋白合成的作用,能在肌肉中大量进行转氨基作用,形成谷氨酰胺,而谷氨酰胺能最大限度促进肌肉蛋白质的合成。所以,运动损伤处于炎症、静止、萎缩阶段,补充宏量营养素蛋白质(含亮氨酸)含量丰富的食物具有弥补蛋白降解、促进肌肉生长、加强肌肉损失逆转的作用。
2.3 宏量营养素蛋白质/碳水化合物补充对维持能量平衡的重要性
运动损伤后进入康复和增加活动的第2阶段营养补充时,营养素的摄入需要考虑优化控制肌肉肥大和避免最大限度地减少肌肉损失,这提示该阶段对于蛋白质的摄入量仍将继续。蛋白质摄入量为2 g/(kg BW·d)应视为最低量,因肌肉蛋白质合成消耗巨大,这将进一步增加能量需求。蛋白质为核心营养成分之一,乳清蛋白作为传统营养素,符合生酮和低碳水化合物饮食,对于运动损伤补充的同时可以较好地促进运动恢复和维持能量平衡。此外,随着康复和活动的增加,总能量摄入也需要相应增加,此时特别要确保充足的碳水化合物摄入。碳水化合物作为中等强度活动的主要能量来源可以维持葡萄糖水平,通过直接或间接机制为免疫细胞提供燃料底物,避免应激激素对免疫功能的毒害作用[33]。一般人日常能量来源的45%~48%应来自碳水化合物,10%~35%应来自蛋白质,20%~35%应来自脂肪[34]。碳水化合物的摄入对运动损伤者在康复和增加活动阶段同样具有重要作用。关于肌肉损伤和恢复的研究还表明,运动后立即食用蛋白质和碳水化合物可以进一步增强肌肉组织的合成[35-36]。至于摄入蛋白质的时间和频率,一项重要的研究比较了3种不同频率的乳清蛋白在训练后12 h内的恢复和肌肉修复以及初始恢复的饮用量情况[37],每1.5 h服用8剂量10 g乳清蛋白,每3 h服用4剂量20 g乳清蛋白,每4 h服用20 g乳清蛋白,每6 h服用2剂量40 g乳清蛋白,结果每4 h服用20 g乳清蛋白效果最好。同时,2013版《中国居民膳食营养素参考摄入量》中主要根据稳定性同位素示踪技术开展的我国成年人蛋白质需要量的直接研究,修订了成年人蛋白质的平均需要量和推荐摄入量[38]。0.25 g/(kg BW·d)高质量蛋白质(如乳清)是一个充足的量。同时,少量的蛋白质[0.2~0.4 g/(kg·h)]与较少的碳水化合物[0.8 g/(kg·h)]联合摄入,可补充内源性基质储存、促进肌肉损伤的修复[39-40]。所以,该阶段表现出运动损伤后对营养素蛋白质、碳水化合物的最大需求,以此来促进肌糖原的储备和机体积极恢复,并维持机体能量平衡。
2.4 宏量营养素水的补充促进良好的水合作用发生
依据运动损伤后促进恢复过程的营养补充考虑因素和顺序,水合作用及有利于恢复的补剂也可以对运动损伤的恢复产生促进作用。水能调节体温、润滑关节、运输营养物质,在运动损伤阶段,保持机体足够的水分有利于刺激血液流向肌肉,从而减少肌肉的疼痛。此外,水合作用可以帮助加剧肌肉酸痛毒素的排出。
3 微量营养素对运动损伤恢复的重要性
3.1 微量营养素的抗炎功效
微量营养素包括维生素和矿物质,具有帮助运动损伤消炎的特性。同时,植物营养素也叫植物性矿物,是植物产生的化学物质,它也可以帮助恢复。有研究表明,姜黄中提取的天然活性物质姜黄素具有抗氧化和抗炎止痛的价值功效。姜黄素能够直接中和自由基,能刺激机体抗氧化酶的产生,同时姜黄素可影响NF-κB信号通路调节基因表达,进而影响到各种不同的生物学过程,包括适应性免疫、炎症、应激反应等,对其治疗和预防一系列退行性疾病和炎症相关疾病有积极作用。研究表明[41-42],姜黄素具有抗肿瘤、护肝、调节免疫功能、降血脂等药理特性,与几种神经递质系统和参与情绪调节的细胞内信号通路相互作用,此外,姜黄素具有抗炎、抗氧化和神经营养作用。大量研究表明,与惰性安慰剂相比,姜黄素作为一种补充剂,可以减轻关节疼痛并改善活动性,而这些改善与下调炎症递质和炎症性细胞因子以及清除氧自由基等有关[43-44]。研究人员在关节镜下治疗全身冈上肌肌腱撕裂的受试者群体中使用了一种含有姜黄的膳食补充剂,结果显示,在术后第1周,补充剂中添加姜黄素受试者的总体疼痛评分明显低于安慰剂组[45]。
3.2 微量营养素与愈合的证据
有研究指出某些微量营养素在支持肌腱和软组织生长和再生中具有影响作用。研究试图确定氨基酸、维生素是否对肌肉、肌腱愈合有影响,是通过何种生理组织和机制产生的影响[46]。对12项符合研究纳入标准:其中有8项检查肌腱愈合,4项检查肌肉愈合,所有的研究都使用了动物模型,除了2个人体试验使用了联合整合器。结果表明维生素C和牛磺酸通过抗氧化活性间接影响肌腱愈合,维生素A和甘氨酸通过影响细胞外基质信号通路促进肌肉蛋白质合成,维生素E对胶原沉积具有抗增殖作用,亮氨酸直接影响信号通路促进肌肉蛋白质合成。另一项研究着眼于运动损伤后肌腱愈合中微量营养素的普遍使用[47],研究表明,各种营养素,如蛋白质、氨基酸(亮氨酸、精氨酸、谷氨酰胺)、维生素C、维生素D、锰、铜、锌和植物化学物质均可能有助于促进肌腱生长和愈合,但因添加了促进肌腱健康需要的多种营养素,多种营养素的干预可能比单一营养素策略更有效,这需要更多有关营养素和肌腱健康的实践研究。所以,微量营养素摄入与运动损伤愈合的证据更多倾向于理论,在实践中有关多种微量营养素促进运动损伤后肌肉、肌腱的愈合研究仍需进一步的深入。
4 微量营养素补充对运动损伤的价值功效
4.1 营养素锌
微量营养素作为体内酶系统的激活剂发挥作用,使生化过程发生。营养素锌能激活体内与蛋白质酶(氨基酸)转换有关的许多酶。其中一类酶是基质金属蛋白酶家族,锌参与正常生理过程中细胞外基质的分解,如胚胎发育、生殖和组织重塑以及骨关节炎相关的关节软骨周转和软骨病理生理学,不仅影响肌肉组织的发育、构成和修复,还影响能量的产生和免疫[48-49]。尽管机体每天对锌的需求量只有15 mg左右,但锌轻度不足就会抑制这些酶的激活,对蛋白质周转产生负面影响,进而影响运动损伤修复进程。素餐或动物蛋白含量低而纤维含量高的膳食都会减少人体的锌摄入量,缺锌与甲状腺激素水平、静息代谢率和蛋白质利用率的降低相关。同时,心肺功能的减弱、肌肉力量的减小和耐力的降低也与锌贮备不足有关。日常生活中膳食锌的最佳来源是优质蛋白质食品,如瘦肉(牛肉、猪肉、鸡肉等)、动物肝脏、贝类、坚果和种子、鸡蛋等。然而,由于过量的锌会妨碍其他元素(如铁、铜等)的摄入,可能导致高密度脂蛋白胆固醇的减少和营养失衡[50-51]。鉴于营养素锌的价值功效和需求量,对其补充应重视单次的剂量。
4.2 维生素D
维生素D对骨骼健康的重要性早已为人所知,尤其是它对骨骼矿化和维持骨骼完整性的作用最为凸显,在钙稳态中也发挥重要作用。有研究表明,维生素D缺乏会增加新兵股骨和胫骨应力骨折的风险,补充维生素D有助于应力骨折后运动损伤处的愈合[52]。运动损伤后,骨折(压力或其他)的运动员应考虑维生素D状况的评估并在必要时补充。同时,维生素D对肌腱损伤也有帮助。维生素D的活性代谢物1,25-二羟维生素D3影响成骨细胞的增殖和分化。同样,维生素D通过增加骨密度和加强骨骼肌,在肌腱和骨骼愈合过程中也发挥重要作用。有研究观察了肩袖修复术后肌腱到骨的愈合情况,通常术后愈合失败率高达20%~94%,究其原因发现,维生素D水平是骨和肌肉增殖和愈合的重要影响因素[53]。维生素D3与心肌细胞上的维生素D受体结合,刺激生长和增殖,维生素D3成功地影响骨骼和肌肉愈合,增加肌腱和骨骼修复的机会。另有研究分析了女性桡骨远端骨折后握力的恢复情况[54]。研究进行了多变量分析,以确定独立预测受伤后6个月握力恢复的因素。结果表明,虽然基线维生素D水平和握力恢复之间没有显著相关性,但基线维生素D水平与未受伤侧的握力相关,补充维生素D和手腕活动范围较大与受伤后6个月握力恢复较好独立相关,说明补充维生素D可能有助于受伤手臂握力的恢复。同时,在高强度运动和训练期间自然发生的肌肉纤维急性微损伤会增加肌肉组织中维生素D受体的表达,这表明肌肉已做好吸收更多维生素D(用于运动损伤愈合)的准备。所以,维生素D已被证明成功地影响骨和肌肉愈合,在运动损伤后的恢复期,补充微量营养素维生素D将促进运动损伤恢复。
4.3 钙
钙和维生素D都是实现和维持骨骼健康所必需的。在伤害预防和运动损伤恢复方面,补充钙和维生素D可降低应力性骨折的发生率。因此,钙也应被视为一种重要的营养素。一项针对年轻女性跑步者的研究表明,随着膳食钙摄入量的增加,应力性骨折的发生率降低,骨密度增加。研究结果表明,钙摄入量增加使得骨密度提高和骨折风险降低,同时,一项针对女性军人新兵的随机试验表明,补充钙和维生素D降低了应激性骨折的发生率。两项研究结果表明,每天摄入超过1 500 mg钙的人其应力性骨折损伤明显减少[55]。但是,针对男性和青少年以及应激性骨折损伤发生率较高的运动项目参与者的研究仍需深入。钙和维生素D被公认为是实现和维持骨骼健康所需的2种营养成分,二者已被清楚地显示可以提高骨密度,预防运动损伤各年龄段的骨折风险。
5 运动损伤后恢复的补剂
补剂可以帮助机体加强修复。运动损伤后有利于恢复的补剂也能够产生积极作用,但前提是保证基础(能量、宏量、微量、水分和时机)营养素的充足。若饮食中有50%~70%充足的植物性营养素就有可能保证微量营养素的足够摄入,而不需要依赖补剂[56]。依据运动损伤诱导制动后,代谢和功能变化可对补剂在肌肉、肌腱和骨骼修复中发挥作用进行分类,在运动损伤恢复中进行有针对性的补充。其中对肌肉修复的良好补剂有:羟甲基丁酸钙(β-羟基-β-甲基丁酸钙盐)3 g/d、鱼油4 000 mg/d、一水肌酸5 000 mg/d,连续5 d(分剂量),多酚(来自植物性食物微量营养素)、D-核糖(能够快速修复细胞促进修复肌肉)。酸樱桃汁补充剂已被证实有助于肌肉修复和缓解疼痛,同时有助于去除体内尿酸。对肌腱修复的良好补剂有胶原蛋白或明胶10 g/d、乳清蛋白20~40 g/d(大约3~5 g亮氨酸)、硝酸盐(来自食物如甜菜)能增加血液循环、氨基酸复合物——瓜氨酸苹果酸6 000~8 000 mg/d。对骨质修复的良好补剂有充足的蛋白质和碳水化合物、钙1 200 mg/d、维生素D(40~60 ng/mL)。
6 结束语
因运动损伤与修复发生的基因传导信号不一致,通过恢复策略营养补充可以达到恢复治疗的目的。运动损伤恢复开始阶段(即炎症、静止、萎缩阶段)主要任务是对抗炎症,而受伤肢体的康复和活动增加阶段主要任务是再生肌肉组织和巩固愈合。本文分析营养素补充对运动损伤恢复在对抗炎症和总能量摄入这2个重要因素的影响。在此基础上,进一步阐述了运动损伤后营养素补充的重要意义,并分别从宏量营养素、微量营养素补充对运动损伤恢复的重要性进行分析。其中,宏量营养素脂肪(ω-3多不饱和脂肪酸)具有抗炎作用、蛋白补充对肌肉损失的逆转作用、蛋白质/碳水化合物补充对维持能量平衡的重要性、水补充对机体良好的水合作用;微量营养素对运动损伤恢复的重要性从促进愈合和抑制炎症2个方面阐述,认为微量营养素作为体内酶系统的激活剂发挥作用,使生化过程发生。并就微量营养素锌、维生素D和钙在运动损伤恢复中的积极作用进行探讨。综上,对运动损伤机理和损伤后分期恢复以及营养素补充对运动损伤恢复的重要性分析,认为运动损伤后营养素的补充也需要更加精细化的要求和管理,从而能使对抗炎症和营养摄入与能量消耗之间保持动态平衡。最后,结合实践提出营养素补充和部分天然替代品可指导各类人群运动损伤后的恢复治疗,对重塑被损伤组织具有促进作用。
[1] 周迎松, 陈小平.六大营养素与体能[J].中国体育科技, 2014, 50(4):91-101. ZHOU Y S, CHEN X P.Six major nutritients and physical fitness[J].China Sport Science and Technology, 2014, 50(4):91-101.
[2] 徐金成, 矫玮, 高颀, 等.急性闭合性软组织运动损伤早期处理方法的发展:从PRICE到POLICE[J].中国运动医学杂志, 2013, 32(4):360-363. XU J C, JIAO W, GAO Q, et al.Development of early treatment methods for acute closed soft tissue sports injury—From PRICE to POLICE[J].Chinese Journal of Sports Medicine, 2013, 32(4):360-363.
[3] KUNZ R I, CORADINI J G, SILVA L I, et al.Effects of immobilization and remobilization on the ankle joint in Wistar rats[J].Brazilian Journal of Medical and Biological Research, 2014, 47(10):842-849.
[4] DUFRESNE S, FRENETTE J, DUMONT N A.Inflammation and muscle regeneration, a double-edged sword[J].Médecine/Sciences, 2016, 32(6-7):591-597.
[5] DURANTON B, SCHLEIFFER R, GOSSE F, et al.Preventive administration of ornithine alpha-ketoglutarate improves intestinal mucosal repair after transient ischemia in rats[J].Critical Care Medicine, 1998, 26(1):120-125.
[6] MIKKELSEN U R, MACKEY A, MAGNUSSON S, et al.Rehabilitation of muscle after injury:The role of anti-inflammatory drugs[J].Scandinavian Journal of Medicine &Science in Sports, 2012, 22(4):e8-e14.
[7] SERRANO A, ROS G, NIETO G.Bioactive compounds and extracts from traditional herbs and their potential anti-inflammatory health effects[J].Medicines, 2018, 5(3):76.
[8] KÖHNE J L, ORMSBEE M J, MCKUNE A J.The effects of a multi-ingredient supplement on markers of muscle damage and inflammation following downhill running in females[J].Journal of the International Society of Sports Nutrition, 2016, 13:44.
[9] MCCORMICK R, PEELING P, BINNIE M, et al.Effect of tart cherry juice on recovery and next day performance in well-trained Water Polo players[J].Journal of the International Society of Sports Nutrition, 2016, 13:41. [10] C SEDAS G, LES F, G
SEDAS G, LES F, G MEZ-SERRANILLOS M P, et al.Bioactive and functional properties of sour cherry juice (Prunus cerasus)[J].Food &Function, 2016, 7(11):4675-4682.
MEZ-SERRANILLOS M P, et al.Bioactive and functional properties of sour cherry juice (Prunus cerasus)[J].Food &Function, 2016, 7(11):4675-4682.
[11] ALI B H, BLUNDEN G, TANIRA M O, et al.Some phytochemical, pharmacological and toxicological properties of ginger (Zingiber officinale Roscoe):A review of recent research[J].Food and Chemical Toxicology, 2008, 46(2):409-420.
[12] CHRUBASIK S, PITTLER M H, ROUFOGALIS B D.Zingiberis rhizoma:A comprehensive review on the ginger effect and efficacy profiles[J].Phytomedicine, 2005, 12(9):684-701.
[13] OJEWOLE J A O.Analgesic, antiinflammatory and hypoglycaemic effects of ethanol extract of Zingiber officinale (Roscoe) Rhizomes (Zingiberaceae) in mice and rats[J].Phytotherapy Research:PTR, 2006, 20(9):764-772.
[14] AIMBIRE F, PENNA S C, RODRIGUES M, et al.Effect of hydroalcoholic extract of Zingiber officinalis rhizomes on LPS-induced rat airway hyperreactivity and lung inflammation[J].Prostaglandins, Leukotrienes and Essential Fatty Acids, 2007, 77(3-4):129-138.
[15] ARAYA-QUINTANILLA F, GUTIERREZ-ESPINOZA H, MUNOZ-YANEZ M J, et al.Effectiveness of ginger on pain and functionin knee osteoarthritis:A PRISMA Systematic Review and meta-analysis[J].Pain Physician, 2020, 23(2):E151-E163.
[16] HAGHIGHI M, KHALVAT A, TOLIAT T, et al.Comparing the effects of ginger (Zingiber officinale) extract and ibuprofen on patients with osteoarthritis[J].Archives of Iranian Medicine, 2005, 8(4):267-271.
[17] OZGOLI G, GOLI M, MOATTAR F.Comparison of effects of ginger, mefenamic acid, and ibuprofen on pain in women with primary dysmenorrhea[J].Journal of Alternative and Complementary Medicine, 2009, 15(2):129-132.
[18] TIPTON K D.Nutrition for acute exercise-induced injuries[J].Annals of Nutrition and Metabolism, 2011, 57(Suppl.2):43-53.
[19] MATSUDA T, CLARK N, HARIYANI G D, et al.The effect of burn wound size on resting energy expenditure[J].The Journal of Trauma:Injury, Infection, and Critical Care, 1987, 27(2):115-118.
[20] CALDER P C.Polyunsaturated fatty acids, inflammatory processes and inflammatory bowel diseases[J].Molecular Nutrition &Food Research, 2008, 52(8):885-897.
[21] HARIZI H, CORCUFF J B, GUALDE N.Arachidonic-acid-derived eicosanoids:Roles in biology and immunopathology[J].Trends in Molecular Medicine, 2008, 14(10):461-469.
[22] CALDER P C.n-3 Polyunsaturated fatty acids and inflammation:From molecular biology to the clinic[J].Lipids, 2003, 38(4):343-352.
[23] 扶志敏, 王正.ω-3多不饱和脂肪酸抗炎机制研究进展[J].医药导报, 2009, 28(9):1174-1176. FU Z M, WANG Z.Research progress on anti-inflammatory mechanism of ω-3 polyunsaturated fatty acids[J].Herald of Medicine, 2009, 28(9):1174-1176.
[24] MORIN C, FORTIN S, CANTIN A M, et al.Docosahexaenoic acid derivative prevents inflammation and hyperreactivity in lung[J].American Journal of Respiratory Cell and Molecular Biology, 2011, 45(2):366-375.
[25] REES D, MILES E A, BANERJEE T, et al.Dose-related effects of eicosapentaenoic acid on innate immune function in healthy humans:A comparison of young and older men[J].The American Journal of Clinical Nutrition, 2006, 83(2):331-342.
[26] 冯钰, 史仍飞.运动、蛋白质补充与骨骼肌衰减征[J].军事体育学报, 2017, 36(4):115-119. FENG Y, SHI R F.Protein supplementation, exercise and sarcopenia[J].Journal of Military Physical Education and Sports, 2017, 36(4):115-119.
[27] CHAN R K, VERNA N, AFNAN J, et al.Attenuation of skeletal muscle reperfusion injury with intravenous 12 amino acid peptides that bind to pathogenic IgM[J].Surgery, 2006, 139(2):236-243.
[28] XIA Z, CHOLEWA J, ZHAO Y, et al.Hypertrophy-promoting effects of leucine supplementation and moderate intensity aerobic exercise in pre-senescent mice[J].Nutrients, 2016, 8(5):246.
[29] KATSANOS C S, KOBAYASHI H, SHEFFIELD-MOORE M, et al.A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly[J].American Journal of Physiology-Endocrinology and Metabolism, 2006, 291(2):E381-E387.
[30] LANG C H.Elevated plasma free fatty acids decrease basal protein synthesis, but not the anabolic effect of leucine, in skeletal muscle[J].American Journal of Physiology-Endocrinology and Metabolism, 2006, 291(3):E666-E674.
[31] RIBEIRO C B, CHRISTOFOLETTI D C, PEZOLATO V A, et al.Leucine minimizes denervation-induced skeletal muscle atrophy of rats through akt/mtor signaling pathways[J].Frontiers in Physiology, 2015, 6:73.
[32] 夏贤峰, 王新颖.亮氨酸调节骨骼肌蛋白质合成代谢的研究进展[J].中华医学杂志, 2013, 93(22):1755-1757. XIA X F, WANG X Y.Research progress of leucine regulating skeletal muscle protein anabolism[J].National Medical Journal of China, 2013, 93(22):1755-1757.
[33] 李莹, 李进华.运动、营养和免疫功能:宏量营养素和氨基酸[J].沈阳体育学院学报, 2013, 32(4):82-86. LI Y, LI J H.Exercise, nutrition and immunity:Macronutrients and amino acid[J].Journal of Shenyang Sport University, 2013, 32(4):82-86.
[34] Institute of Medicine.Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids[M].Washington:National Academies Press, 2005.
[35] LUNN W R, PASIAKOS S M, COLLETTO M R, et al.Chocolate milk and endurance exercise recovery:Protein balance, glycogen, and performance[J].Medicine and Science in Sports and Exercise, 2012, 44(4):682-691.
[36] ROWLANDS D S, NELSON A R, PHILLIPS S M, et al.Protein-leucine fed dose effects on muscle protein synthesis after endurance exercise[J].Medicine &Science in Sports &Exercise, 2015, 47(3):547-555.
[37] MORI H.Effect of timing of protein and carbohydrate intake after resistance exercise on nitrogen balance in trained and untrained young men[J].Journal of Physiological Anthropology, 2014, 33(1):24.
[38] 中国营养学会. 中国居民膳食营养素参考摄入量:2013版[M].北京:科学出版社, 2014.
[39] KOOPMAN R, PANNEMANS D L E, JEUKENDRUP A E, et al.Combined ingestion of protein and carbohydrate improves protein balance during ultra-endurance exercise[J].American Journal of Physiology.Endocrinology and Metabolism, 2004, 287(4):E712-E720.
[40] KOOPMAN R, WAGENMAKERS A J M, MANDERS R J F, et al.Combined ingestion of protein and free leucine with carbohydrate increases postexercise muscle protein synthesis in vivo in male subjects[J].American Journal of Physiology-Endocrinology and Metabolism, 2005, 288(4):E645-E653.
[41] JANKUN J, ![]()
![]() TKOWSKA M, DETTLAFF K, et al.Determining whether curcumin degradation/condensation is actually bioactivation (Review)[J].International Journal of Molecular Medicine, 2016, 37(5):1151-1158.
TKOWSKA M, DETTLAFF K, et al.Determining whether curcumin degradation/condensation is actually bioactivation (Review)[J].International Journal of Molecular Medicine, 2016, 37(5):1151-1158.
[42] CHIN K Y.The spice for joint inflammation:Anti-inflammatory role of curcumin in treating osteoarthritis[J].Drug Design, Development and Therapy, 2016, 10:3029-3042.
[43] 李琦, 金剑, 许颖.姜黄素的药理作用及其临床应用进展[J].现代中西医结合杂志, 2012, 21(12):1366-1368. LI Q, JIN J, XU Y.Pharmacological action of curcumin and its clinical application progress[J].Modern Journal of Integrated Traditional Chinese and Western Medicine, 2012, 21(12):1366-1368.
[44] MEROLLA G, DELLABIANCIA F, INGARDIA A, et al.Co-analgesic therapy for arthroscopic supraspinatus tendon repair pain using a dietary supplement containing Boswellia serrata and Curcuma longa:A prospective randomized placebo-controlled study[J].Musculoskeletal Surgery, 2015, 99(1):43-52.
[45] TACK C, SHORTHOUSE F, KASS L.The physiological mechanisms of effect of vitamins and amino acids on tendon and muscle healing:A systematic review[J].International Journal of Sport Nutrition and Exercise Metabolism, 2018, 28(3):294-311.
[46] PANDAREESH M D, SHRIVASH M K, NAVEEN KUMAR H N, et al.Curcumin monoglucoside shows improved bioavailability and mitigates rotenone induced neurotoxicity in cell and Drosophila models of Parkinson’s disease[J].Neurochemical Research, 2016, 41(11):3113-3128.
[47] AYDO DU O A, UMUT T, GÜMÜS M, et al.Zinc-coated foam with negative pressure wound therapy in the treatment of challenging wounds:A new alternative interface material[J].Wounds:a Compendium of Clinical Research and Practice, 2016:WNDS20160815-2.
DU O A, UMUT T, GÜMÜS M, et al.Zinc-coated foam with negative pressure wound therapy in the treatment of challenging wounds:A new alternative interface material[J].Wounds:a Compendium of Clinical Research and Practice, 2016:WNDS20160815-2.
[48] KOGAN S, SOOD A, GARNICK MARK S.Zinc and wound healing:A review of zinc physiology and clinical applications[J].Wounds:a Compendium of Clinical Research and Practice, 2017, 29(4):102-106.
[49] LUKASKI H C.Vitamin and mineral status:Effects on physical performance[J].Nutrition, 2004, 20(7-8):632-644.
[50] 沙亚宾, 续海燕.高锌摄入对机体血脂脂蛋白及载脂蛋白代谢的影响[J].微量元素与健康研究, 2004, 21(3):7-8. SHA Y B,XUN Haiyan.The effects of high level Zn intake on metabolism in blood lipids, density lipoprotein and apolipoprotein[J].Studies of Trace Elements and Health, 2004, 21(3):7-8.
[51] 康杰. 营养与运动表现:国际奥委会2012年运动营养指南解读[J].体育科研, 2016, 37(4):1-10. KANG J.Nutrition and athletic performance:Interpreting the most recent IOC sports nutrition guide[J].Sport Science Research, 2016, 37(4):1-10.
[52] INKLEBARGER J, GRIFFIN M, TAYLOR M J D, et al.Femoral and tibial stress fractures associated with vitamin D insufficiency[J].Journal of the Royal Army Medical Corps, 2014, 160(1):61-63.
[53] DOUGHERTY K A, DILISIO M F, AGRAWAL D K.Vitamin D and the immunomodulation of rotator cuff injury[J].Journal of Inflammation Research, 2016, 9:123-131.
[54] LEE H J, GONG H S, SONG C H, et al.Evaluation of vitamin D level and grip strength recovery in women with a distal radius fracture[J].The Journal of Hand Surgery, 2013, 38(3):519-525.
[55] TENFORDE A S, SAYRES L C, SAINANI K L, et al.Evaluating the relationship of calcium and vitamin D in the prevention of stress fracture injuries in the young athlete:A review of the literature[J].PM&R, 2010, 2(10):945-949.
[56] KAUR H, PATRO I, TIKOO K, et al.Curcumin attenuates inflammatory response and cognitive deficits in experimental model of chronic epilepsy[J].Neurochemistry International, 2015, 89:40-50.