近年来,氧化应激和神经炎症在神经疾病中的作用受到广泛关注。氧化应激是指机体对活性氧(reactive oxygen species, ROS)的清除效率低于其产生效率,导致机体、组织及细胞受到氧化损伤[1]。生物体内与氧代谢有关的含氧自由基和易形成自由基的过氧化物统称为ROS。其含有不成对的电子,因而具有较高的化学反应活性。为了防止氧化损伤,机体内的抗氧化系统会消除ROS的毒性影响,抗氧化系统主要包括超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和过氧化氢酶(catalase, CAT)等抗氧化酶和非酶类抗氧化剂谷胱甘肽(glutathione, GSH)等[2]。健康机体的细胞行使正常功能需要ROS和抗氧化系统处于一个相对平衡的状态,过量的ROS会导致细胞大分子(DNA、脂质和蛋白质)受损[3],当打破这一平衡,ROS会攻击细胞膜导致细胞分子结构改变从而造成细胞功能障碍,也可以使蛋白质交联导致蛋白质变性及酶的失活。
氧化应激和神经炎症是两种病理状态,但它们相互关联并相互影响[4]。当机体的还原和氧化反应处于平衡状态时,炎症反应可以作为一种防御机制发挥作用。ROS水平过高时,氧化应激会造成能量代谢受损、细胞信号传导和细胞周期改变、细胞转运机制受损及生物活性功能失调,产生炎症反应[5]。ROS可以进一步引起主要大分子的修饰,在复杂的生物体中,氧化的蛋白质可能通过形成细胞毒性聚集体而获得毒性功能。氧化后的蛋白质、核酸和脂质等大分子直接影响关键神经炎症介质,而神经炎症可以诱导NADPH氧化酶的表达及其活性的增加,导致产生高度氧化的环境[6]。另外,ROS的积累和线粒体功能障碍与中枢神经系统的疾病有关[7]。过度的氧化应激可能会使大脑功能丧失,TELEANU等[4]发现ROS与抗氧化剂之间的不平衡以及氧化应激通过影响细胞稳态、Aβ和р-tau的形成上调来影响阿尔兹海默症的发生。
植物多酚是一种广泛存在于植物中的次生代谢物,具有极好的抗氧化能力。有研究表明,多酚及其衍生的代谢产物能够有效地减少氧化应激和炎症,改善神经系统疾病[8-9]。另外,前期研究发现小米多酚通过抑制氧化应激发挥神经保护作用,而奎宁酸是小米多酚的主要成分之一[10]。虽然奎宁酸已被广泛的用于合成具有抗氧化和抗菌作用的药物[11],但对于奎宁酸在神经细胞中的抗氧化功能和抗炎作用并没有太多的报道。因此本研究采用H2O2诱导的SH-SY5Y神经细胞氧化应激损伤模型验证奎宁酸的抗氧化活性和神经保护作用,为进一步探讨奎宁酸在预防和治疗氧化应激相关疾病中的作用机制提供研究基础。
1 材料与方法
1.1 材料与试剂
人神经母细胞瘤细胞株SH-SY5Y,中国科学院;奎宁酸,上海源叶生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、DMEM-F12培养基、青霉素链霉素、胰酶、引物序列(Primer Premier 5.0 软件设计)、PIPA裂解液,上海生工生物工程股份有限公司;H2O2,上海国药集团化学试剂有限公司;BCA蛋白浓度试剂盒、动物RNA抽提试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、GSH试剂盒、MTT细胞增殖及细胞毒性测定试剂盒、SOD试剂盒、BeyoColorTM彩色预染蛋白分子质量标准(10~170 kDa)、聚偏二氟乙烯膜、鼠抗肿瘤坏死因子(TNF-α)、兔抗白介素-1β(IL-1β)、极超敏ECL化学发光试剂盒,上海碧云天生物技术有限公司;Taq Pro Universal SYBR qPCR Master Mix、HiScript III RT SuperMix for qPCR(+gDNA wiper),南京诺唯赞生物科技股份有限公司。
1.2 仪器与设备
MCO-20AIC型CO2细胞培养箱,日本三洋;BSC-1300IIA2型超净工作台,江苏净化设备有限公司;HH-W-600水浴锅,金坛市江南仪器厂;S1000TM Thermal Cycler梯度PCR仪、ChemiDocTM Imaging System凝胶成像系统,美国BIO-RAD;TGL-25M高速冷冻离心机,美国ALPHA公司;Thermo Lifetech ABI QuantStudio3,美国Thermo;Synergy HTX多功能酶标仪,美国Berten;WH-861涡旋混合器,太仓华立达公司;碎花冰制冰机,松下冷链(大连)有限公司;电泳仪,北京六一生物科技有限公司;脱色摇床,海门市其林贝尔仪器制造有限公司;LE104E/02电子天平,梅特勒-托力多仪器(上海)有限公司;PH-140A电热鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 SH-SY5Y细胞的培养
在37 ℃下,SH-SY5Y细胞在5%(体积分数)CO2的细胞培养箱中生长至对数期。培养基为含有10%胎牛血清(fetal bovine serum,FBS)的DMEM-F12培养基。另外,SH-SY5Y细胞具有中等水平的多巴胺β羟化酶活性,其起源于神经母细胞瘤。在用于后续的实验前应用10 μmol/L全反式维甲酸(all-transretinoic acid,ATRA)诱导SH-SY5Y细胞48 h,使其向神经元分化,细胞形态及生理功能等随之发生改变,与成熟的神经细胞非常相似。
1.3.2 H2O2诱导的氧化应激模型的建立及奎宁酸处理
实验分为空白对照组(Control)、过氧化氢组(H2O2)、奎宁酸组(H2O2+Quinic)。参考文献[12]中方法,H2O2+Quinic组先用奎宁酸(50、100、200、300 μg/mL)诱导SH-SY5Y细胞12 h 后,再用300 μmol/L的H2O2诱导SH-SY5Y细胞15 h,建立氧化应激模型。对照组不经任何处理,H2O2组仅用300 μmol/L的H2O2处理。
1.3.3 细胞活力测定
通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)细胞增殖及细胞毒性测试评估奎宁酸对H2O2诱导的SH-SY5Y细胞活力的影响。将生长密度为90%的细胞先用Hanks洗涤,然后使用胰蛋白酶将其消化,并按数量为104个细胞/孔接种在细胞96孔板中,培养24 h使其完全贴壁。根据MTT说明书方法,MTT与SH-SY5Y细胞反应后,通过酶标仪测定其在570 nm处的吸光度。最后结果为实验组与对照组相比得出。
1.3.4 SH-SY5Y细胞内抗氧化指标的测定
将培养至对数期的SH-SY5Y细胞转移至6孔板中,用10 μmol/L全反式维甲酸处理48 h后,再更换新的DMEM-F12培养基培养12 h。按照1.3.2节的方法经奎宁酸和H2O2处理后收集细胞,按照相应的试剂盒说明书测定MDA、GSH含量和SOD活性。
1.3.5 RNA提取及实时荧光定量PCR分析
采用实时荧光定量PCR检测不同组SH-SY5Y细胞抗氧化酶因子和炎症因子的相对表达量。将培养好的SH-SY5Y细胞弃去培养基,加入适量的Hanks清洗两遍,使用RNA提取试剂盒提取各SH-SY5Y细胞总RNA,依据逆转录说明书将其逆转录为cDNA,进行后续的实时荧光定量PCR检测。内参基因为β-actin,抗氧化酶Sod1、Sod2、Cat、Gpx2以及炎症因子IL-1β和TNF-α等基因的引物序列(5′-3′)见表1,ΔΔCt用于计算基因的相对表达量。
表1 实时定量PCR引物序列
Table 1 Real time quantitative PCR primer sequence

基因名称引物序列β-actinFPCATGAGATTGGCATGGCTTTRPCACCTTCACCGTTCCAGTTTTNF-αFPCTATCTGGGAGGGGTCTTCCRPATGTTCGTCCTCCTCACAGGIL-1βFPGGACAAGCTGAGGAAGATGCRPTCGTTATCCCATGTGTCGAASod1FPTGGCCGATGTGTCTATTGAARPACCTTTGCCCAAGTCATCTGSod2FPATGGAACCTCACATCAACGCRPCCTGGTACTTCTCCTCGGTGCatFPGTAGGGCTAGGCACTGTTCGRPCTCACCACGCTGGAGTGTAAGpx2FPTTGCCAAACCCTAAATCCTGRPGTGCCATAACAGCAGAGCAA
1.3.6 蛋白印迹分析细胞炎症因子表达
采用蛋白免疫印迹法检测不同分组中SH-SY5Y细胞炎症因子TNF-α和IL-1β的蛋白表达情况。H2O2造模结束后的SH-SY5Y细胞,使用RIPA细胞裂解液提取细胞总蛋白,用BCA试剂盒测定细胞蛋白浓度,加入蛋白上样缓冲液煮沸变性10 min。按照之前报道的方法进行Western blot检测[13]。配制SDS-PAGE用于分离各样品中等量的蛋白质。浓缩电压为80 V,分离电压为120 V。200 mA×1.5 h转膜后,使用50 g/L脱脂牛奶将聚偏二氟乙烯膜封闭2 h。封闭结束后,分别与β-actin、TNF-α和IL-1β抗体(稀释倍数为1∶1 000)在4 ℃冰箱孵育过夜。孵育结束后TBST每10 min洗膜1次,3次过后,与对应的二抗(稀释倍数为1∶10 000)室温孵育2 h,TBST缓冲液洗膜3次后使用极超敏ECL发光试剂盒对蛋白条带呈像,并利用Image J软件计算灰度值。
1.4 数据分析
本研究采用3次重复实验,使用GraphPadTM Prism 8.0版和SPSS Statistics 25等软件对实验数据进行分析和处理,最终结果以平均值±标准差表示,以P<0.05表示组间差异具有统计学意义。
2 结果与分析
2.1 奎宁酸可提高SH-SY5Y细胞在氧化应激下的活力
H2O2是一种强氧化剂,低浓度的H2O2是一种信号分子可以调控细胞的生长,而一定量的H2O2可以使SH-SY5Y细胞的细胞膜脂质过氧化,可导致细胞凋亡。在细胞实验中,作为重要的氧化应激诱导物,H2O2对细胞模型中的氧化应激机制的研究具有重要的意义[14]。因此,建立H2O2诱导的SH-SY5Y细胞以评估奎宁酸的保护作用。
如图1所示,在300 μmol/L H2O2处理细胞15 h后,检测细胞活力,发现H2O2组细胞活力显著降低(P<0.01),说明H2O2诱导的SH-SY5Y细胞氧化应激模型建立成功。而当利用不同浓度奎宁酸处理后细胞活力有显著上升,其中经过100 μg/mL奎宁酸处理的SH-SY5Y细胞的活力最强,但更高质量浓度(200、300 μg/mL)的奎宁酸处理并没有显著的作用,说明100 μg/mL是奎宁酸的最适质量浓度。该实验结果表明,奎宁酸预处理可抑制氧化应激引起的细胞活性下降,对SH-SY5Y细胞起到保护作用。
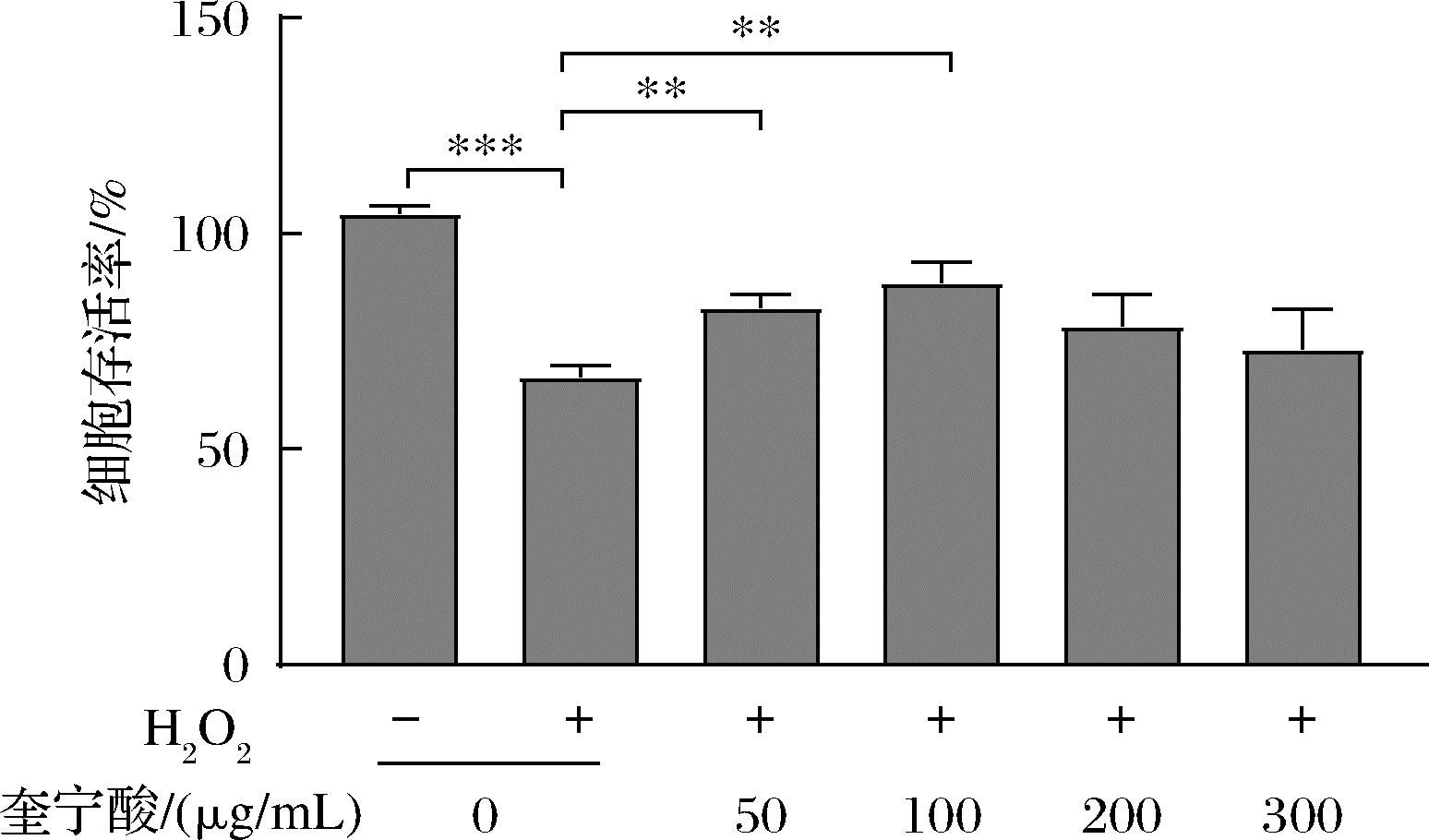
图1 不同浓度奎宁酸对H2O2诱导下SH-SY5Y 细胞活力的影响
Fig.1 Effect of different concentrations of quinic acid on the cell viability of SH-SY5Y under the inducation of H2O2
注:**表示P<0.01,***表示P<0.001;n=3(下同)。
2.2 奎宁酸对H2O2诱导的SH-SY5Y细胞抗氧化功能的影响
抗氧化剂的抗氧化能力取决于分子结构,其苯环上的—OH位置和数量决定了清除自由基的能力,自由基可以从酚羟基得到氢原子或单个电子,使其失去氧化性,变成稳定的自由基[15]。有研究证明奎宁酸衍生物具有发挥抗氧化活性的主要官能团及对各种自由基的清除能力[16]。除了抗氧化剂外,机体自身的抗氧化能力也是对抗氧化应激损伤的重要防御系统。抗氧化酶活力的高低代表着清除体内自由基的能力,其中抗氧化酶活力越高,抗氧化能力越强,能够有效地清除体内的自由基。另外,当体内MDA含量开始降低时,则表明机体的抗氧化状态得到了改善。
为了进一步研究奎宁酸对细胞抗氧化能力的影响,本研究测定了在100 μg/mL奎宁酸处理下,SH-SY5Y细胞中SOD、GSH和MDA的含量(图2)。实验结果显示,H2O2抑制了细胞中SOD的活性,降低了GSH在细胞中的水平(图2-a、图2-b),并增加了MDA含量(图2-c),表明H2O2使SH-SY5Y细胞的氧化应激水平增加、抗氧化能力下降;而奎宁酸预处理显著上调了SOD的活性和GSH的水平,并降低了MDA水平,说明奎宁酸预处理抑制了H2O2引起的SH-SY5Y细胞氧化应激水平的升高并加强了细胞的抗氧化能力。
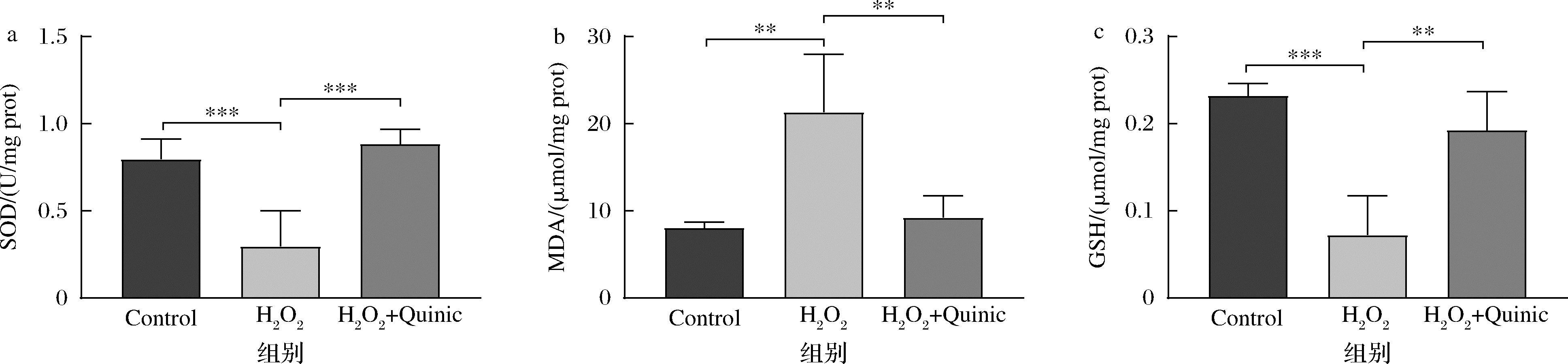
a-SOD;b-MDA;c-GSH
图2 奎宁酸对H2O2诱导SH-SY5Y细胞抗氧化能力的影响
Fig.2 Effect of quinic acid on the antioxidant ability of H2O2 induced SH-SY5Y cells
对于氧化应激相关基因表达水平的检测也进一步证实了奎宁酸对神经细胞抗氧化能力的调控作用(图3)。Sod1、Sod2、Cat、Gpx2的相对表达量在H2O2处理后降低,而奎宁酸预处理恢复了Sod1、Sod2、Cat、Gpx2的表达水平。以上结果表明,奎宁酸可显著提高神经细胞面对氧化应激的抗氧化能力,在H2O2诱导的氧化应激中发挥了重要的抗氧化作用。
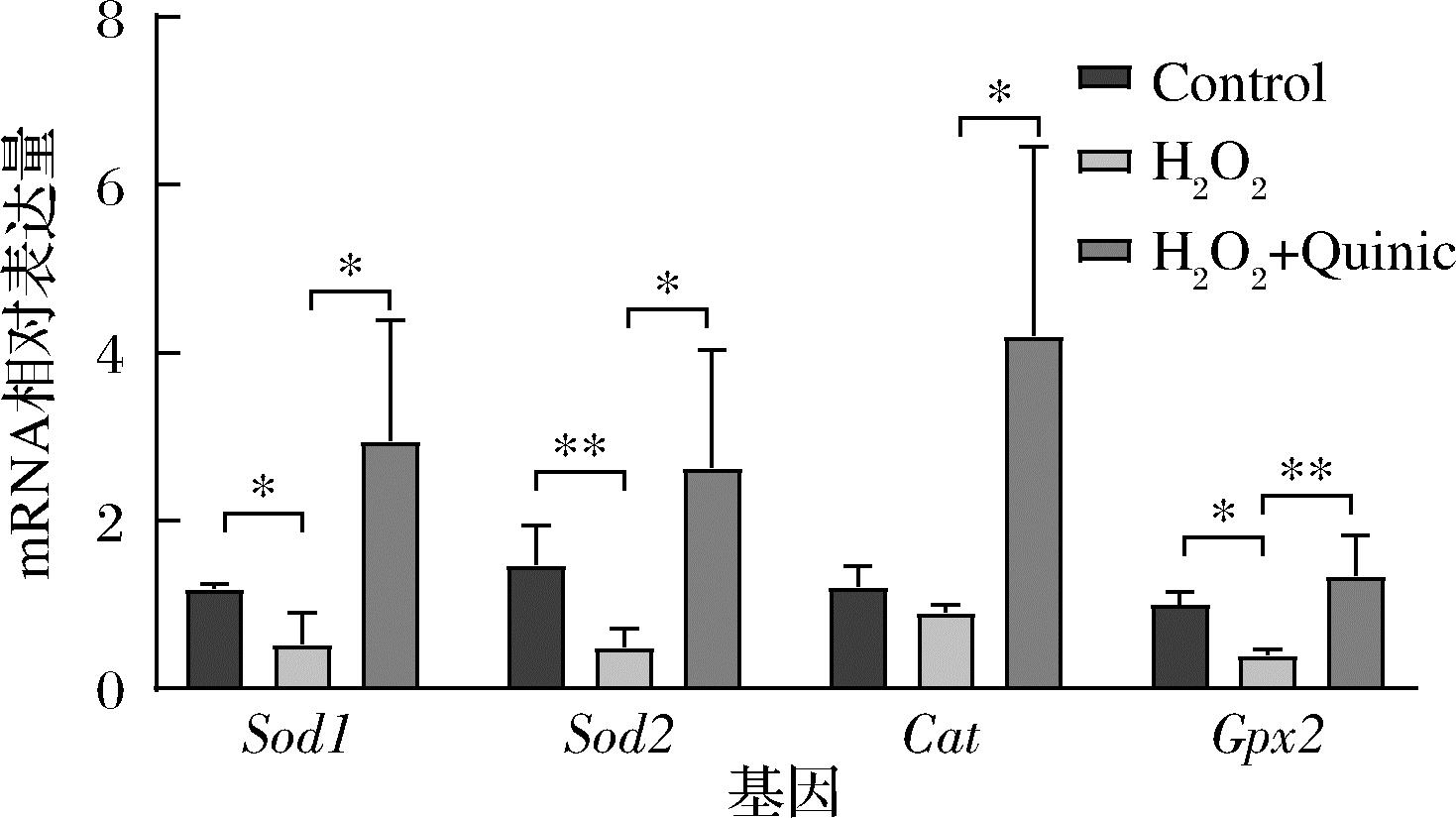
图3 细胞抗氧化相关基因表达水平的变化
Fig.3 Changes in the expression levers of antioxidant-related genes in cells
注:*表示P<0.05(下同)。
2.3 奎宁酸对H2O2诱导SH-SY5Y细胞中炎症因子表达的影响
由于氧化应激的增加会使氧反应性物质(oxygen reactive substance,ORS)和氮反应性物质(nitrogen reactive substance,NRS)水平升高,从而进一步刺激促炎因子和趋化因子在细胞中得到释放,引起细胞炎症水平升高,加重神经损伤[17]。已有研究证明小米多酚的摄入具有抗炎作用[9],因此本研究利用实时荧光定量PCR进一步研究了奎宁酸对H2O2诱导的神经细胞中炎症因子表达的调控作用。结果表明,H2O2诱导使SH-SY5Y细胞中促炎因子IL-1β和TNF-α的表达显著升高,而奎宁酸处理则显著抑制了促炎因子的表达(图4)。
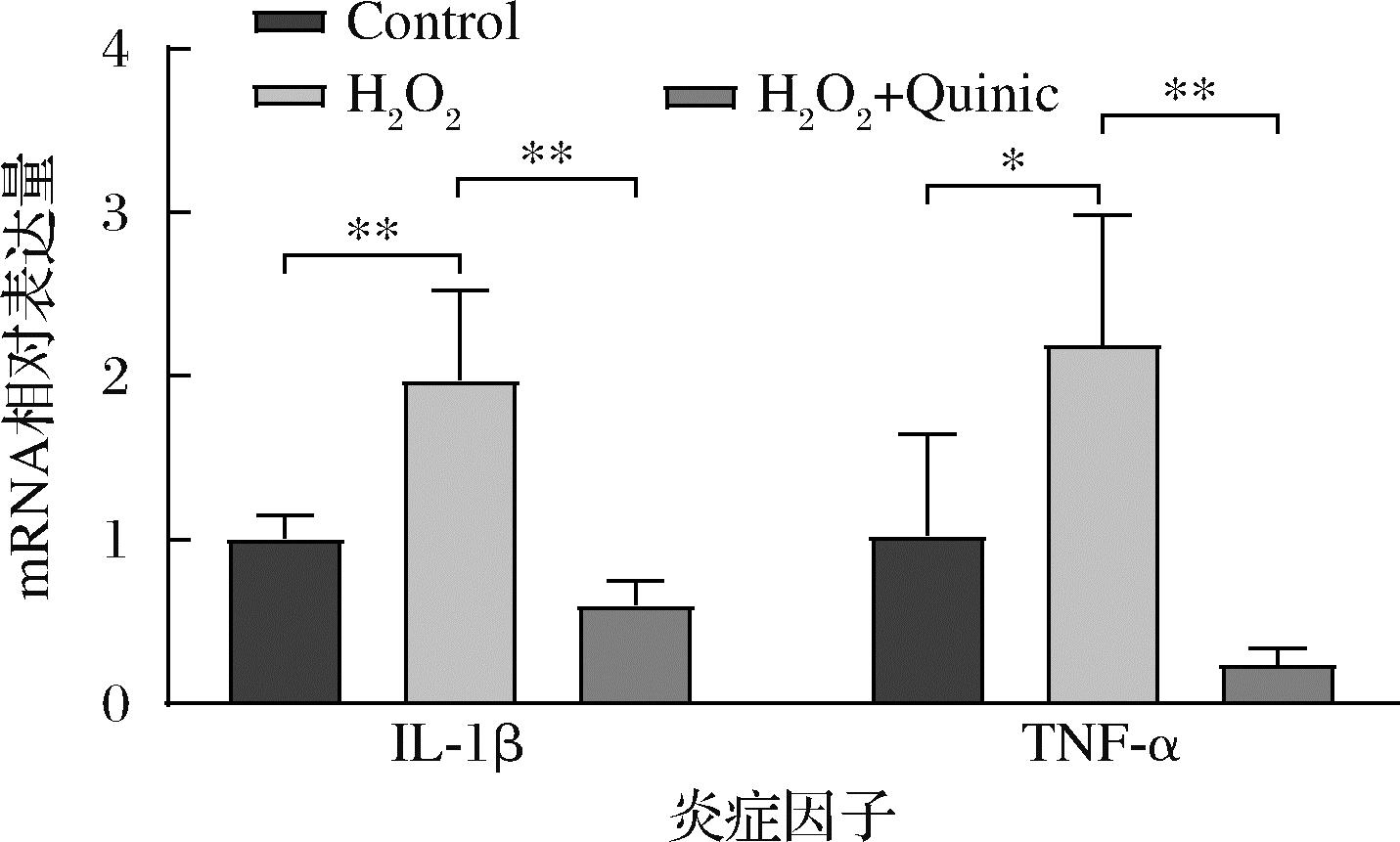
图4 SH-SY5Y细胞炎症因子表达水平的变化
Fig.4 Change of the expression level of inflammatory factors in SH-SY5Y cells
对炎症因子的蛋白水平免疫印迹检测发现,与对照组相比,经H2O2处理后,炎症因子TNF-α和IL-1β在蛋白水平上的表达量相比于Control组有显著性提高(P<0.05),而经过奎宁酸预处理后,均明显降低(P<0.05)(图5)。以上结果表明,奎宁酸可以通过抑制氧化应激引起的炎症对神经细胞起到保护作用。
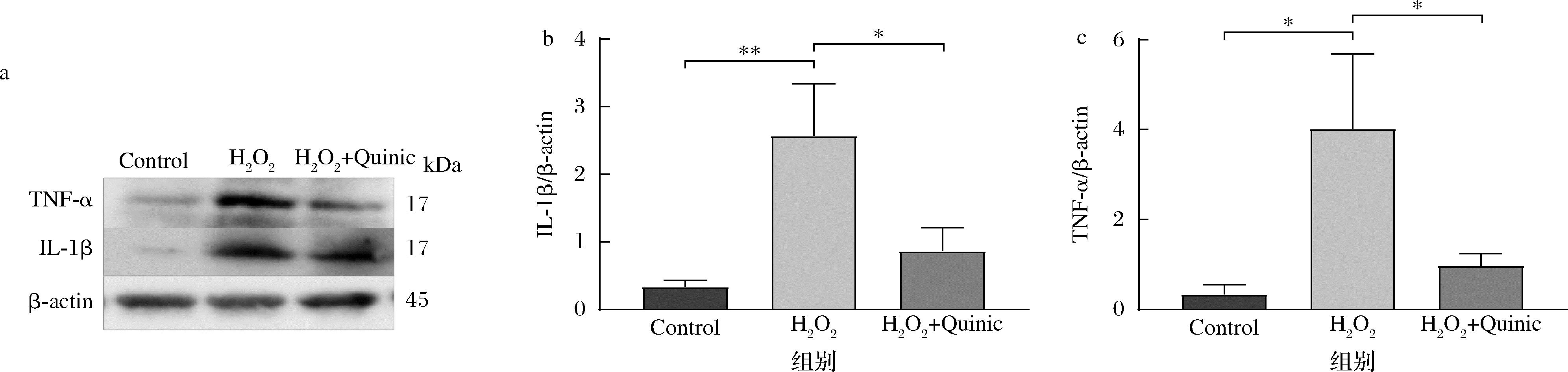
a-Western blot检测TNF-α、IL-1β蛋白水平;b-IL-1β定量分析;c-TNF-α定量分析
图5 奎宁酸对H2O2诱导的SH-SY5Y细胞中炎症因子蛋白表达量的影响
Fig.5 Effect of quinic acid on the protein level of inflammatory factors in SH-SY5Y cells induced by H2O2
3 结论与讨论
多酚是膳食中重要的功能因子,具有优异的抗氧化性能。关于小米多酚中重要活性物质-奎宁酸及其衍生物的炎症抑制作用已有报道。例如,ÅKESSON等[18]和AHN等[19]发现奎宁酸及其衍生物可以抑制NF-κB活化来抑制炎症的发生。PERO等[20]研究表明奎宁酸可以通过胃肠道菌群转化为色氨酸和烟酰胺,最终抑制NF-κB的活性,并使得DNA修复增强。1,5-二咖啡酰奎宁酸可以通过抑制α-synuclein的过度表达来减轻PC12细胞的氧化应激[21],部分奎宁酸代谢物可以抑制小胶质细胞的活化从而起到神经保护作用[22]。而目前缺乏奎宁酸对神经细胞的保护作用的直接证据,奎宁酸单体对神经细胞氧化应激和炎症的抑制作用仍需进一步研究。
本研究以小米多酚中的奎宁酸为研究对象,采用H2O2诱导SH-SY5Y细胞,通过MTT细胞增殖及细胞毒性测试,发现在加入奎宁酸培养后,面对H2O2诱导的氧化应激,SH-SY5Y细胞的活力与H2O2组相比显著升高。对于奎宁酸的抗氧化功能的研究发现,奎宁酸提高了SH-SY5Y细胞中抗氧化酶SOD的活性、GSH水平并降低MDA的含量,并且提高了抗氧化相关基因Sod1,Sod2,Cat和Gpx的表达水平,增强了SH-SY5Y细胞的抗氧化能力。同时,奎宁酸可通过抑制促炎因子IL-1β和TNF-α的表达来抑制氧化应激引起的炎症水平升高,起到对SH-SY5Y细胞的神经保护作用。
综上,本研究的实验结果表明了奎宁酸的抗氧化和神经保护作用,为奎宁酸在预防和治疗氧化应激相关神经系统疾病提供了理论基础。
[1] PELUSO I, MORABITO G, URBAN L, et al.Oxidative stress in atherosclerosis development:The central role of LDL and oxidative burst[J].Endocrine, Metabolic &Immune Disorders-Drug Targets, 2012, 12(4):351-360.
[2] HABTEMARIAM S.Modulation of reactive oxygen species in health and disease[J].Antioxidants, 2019, 8(11):513.
[3] SENONER T, DICHTL W.Oxidative stress in cardiovascular diseases:Still a therapeutic target?[J].Nutrients, 2019, 11(9):2090.
[4] TELEANU D M, NICULESCU A G, LUNGU I I, et al.An overview of oxidative stress, neuroinflammation, and neurodegenerative diseases[J].International Journal of Molecular Sciences, 2022, 23(11):5938.
[5] NEWSHOLME P, CRUZAT V F, KEANE K N, et al.Molecular mechanisms of ROS production and oxidative stress in diabetes[J].Biochemical Journal, 2016, 473(24):4527-4550.
[6] TIMOTHY F, MANISHA P.Crosstalk between neuroinflammation and oxidative stress in epilepsy[J].Frontiers in Cell and Developmental Biology, 2022, 10:976953.
[7] FILIPA S D, NUNO E, MORAIS C S, et al.Neurodegenerative microbially-shaped diseases:Oxidative stress meets neuroinflammation[J].Antioxidants, 2022, 11(11):2141.
[8] KALIVARATHAN J, CHANDRASEKARAN S P, KALAIVANAN K, et al.Apigenin attenuates hippocampal oxidative events, inflammation and pathological alterations in rats fed high fat, fructose diet[J].Biomedicine &Pharmacotherapy, 2017, 89:323-331.
[9] KARAMAN M, TESANOVIC K, GORJANOVIC S, et al.Polarography as a technique of choice for the evaluation of total antioxidant activity:The case study of selected Coprinus comatus extracts and quinic acid, their antidiabetic ingredient[J].Natural Product Research, 2021, 35(10):1711-1716. [10] LI S, XIAN F R, GUAN X, et al.Neural protective effects of millet and millet polyphenols on high-fat diet-induced oxidative stress in the brain[J].Plant Foods for Human Nutrition, 2020, 75(2):208-214.
[11] USAMI Y, HATSUNO C, YAMAMOTO H, et al.Synthesis of the epimer of pericosine B from (-)-quinic acid[J].Chemical and Pharmaceutical Bulletin, 2004, 52(9):1130-1133.
[12] 梁婷, 陆奕成, 刘彤, 等.两种产地黄小米多酚的提取及其对神经细胞氧化损伤的保护作用[J].食品与发酵工业, 2022, 48(2):139-143. LIANG T, LU Y C, LIU T, et al.Polyphenols extraction from two kinds of origins of millet yellow and their protective effects on oxidative injury on nerve cells[J].Food and Fermentation Industries, 2022, 48(2):139-143.
[13] ZHOU Y J, HUANG N Q, LI Y Y, et al.Effect of icaritin on autophagy-related protein expression in TDP-43-transfected SH-SY5Y cells[J].PeerJ, 2022, 10:e13703.
[14] HURST J, KUEHN S, JASHARI A, et al.A novel Porcine ex vivo retina culture model for oxidative stress induced by H2O2[J].Alternatives to Laboratory Animals, 2017, 45(1):11-25.
[15] SANDOVAL-ACU A C, FERREIRA J, SPEISKY H.Polyphenols and mitochondria:An update on their increasingly emerging ROS-scavenging independent actions[J].Archives of Biochemistry and Biophysics, 2014, 559:75-90.
A C, FERREIRA J, SPEISKY H.Polyphenols and mitochondria:An update on their increasingly emerging ROS-scavenging independent actions[J].Archives of Biochemistry and Biophysics, 2014, 559:75-90.
[16] 李佳银, 于欢, 石伯阳, 等.甘薯茎叶中异槲皮苷及咖啡酰基奎宁酸类衍生物的抗氧化活性[J].食品科学, 2013, 34(7):111-114. LI J Y, YU H, SHI B Y, et al.Antioxidant activity of isoquercitrin and caffeoylquinic acid derivatives from sweet potato stems and leaves[J].Food Science, 2013, 34(7):111-114.
[17] YANG D L, ELNER S G, BIAN Z M, et al.Pro-inflammatory cytokines increase reactive oxygen species through mitochondria and NADPH oxidase in cultured RPE cells[J].Experimental Eye Research, 2007, 85(4):462-472.
[18] ÅKESSON C, LINDGREN H, PERO R W, et al.Quinic acid is a biologically active component of the Uncaria tomentosa extract C-Med-100®[J].International Immunopharmacology, 2005, 5(1):219-229.
[19] AHN J H, PARK Y, JO Y H, et al.Organic acid conjugated phenolic compounds of hardy kiwifruit (Actinidia arguta) and their NF-κB inhibitory activity[J].Food Chemistry, 2020, 308:125666.
[20] PERO RONALD W, HARALD L, TOMAS L.Antioxidant metabolism induced by quinic acid.Increased urinary excretion of tryptophan and nicotinamide[J].Phytotherapy Research:PTR, 2009, 23(3):335-46.
[21] 曹旭, 肖海兵, 李慧, 等.1, 5-二咖啡酰奎宁酸对MPP+所致PC12细胞损伤的保护作用[J].华中科技大学学报(医学版), 2010, 39(4):435-438;465. CAO X, XIAO H B, LI H, et al.Protective effects of 1, 5-dicaffeoylquinic acid against MPP+ induced neurotoxicity of PC12 cells[J].Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2010, 39(4):435-438;465.
[22] LEE S Y, MOON E, KIM S Y, et al.Quinic acid derivatives from Pimpinella brachycarpa exert anti-neuroinflammatory activity in lipopolysaccharide-induced microglia[J].Bioorganic &Medicinal Chemistry Letters, 2013, 23(7):2140-2144.