幽门螺杆菌(Helicobacter pylori)是一种带有鞭毛的革兰氏阴性微需氧细菌,通常会感染胃黏膜上皮细胞,导致胃炎、胃癌和胃及十二指肠溃疡[1]。报告称,全球感染幽门螺杆菌的人口约44亿,超过世界一半以上的人口[2]。随着生活水平及医疗水平的提高,发达国家感染率逐渐下降,但发展中国家感染率依然很高。早期治疗以抗生素为主,通常采用标准三联疗法(包含克拉霉素和甲硝唑或阿莫西林与质子泵抑制剂的组合)。但是,由于抗生素的广泛使用,标准三联疗法的疗效急剧下降,根除率低至50%~70%[3]。幽门螺杆菌的抗生素耐药性逐渐增强,除此之外,抗生素还会对人体产生副作用,增加治疗成本。因此,人们积极寻找有效的抗幽门螺杆菌药物,其中关于天然植物提取物抑制幽门螺旋杆菌的研究逐渐增多,其优点是对人体没有副作用,且不会增加细菌耐药性。
迄今为止,已发现的抗幽门螺杆菌植物有240余种。天然植物活性成分治疗幽门螺旋杆菌感染已成为食品、药学等学科领域的研究热点。IBRAHIM等[4]使用羽穗草醇提物与连续萃取物(乙醚、氯仿、乙酸乙酯和正丁醇)进行抑制幽门螺杆菌活性实验,结果发现乙醚萃取物抗幽门螺杆菌效果最好,其对临床分离出75%的幽门螺杆菌具有抑制作用。此外,研究报道腺毛岩白菜根乙酸乙酯相提取物抗幽门螺杆菌效果优于甲醇粗提物,可能是由于纯化提高了活性成分的效力[5]。目前,已有多名学者从细胞水平上探究植物提取物对幽门螺杆菌的抑菌机制,如抗生物膜形成[6]、脲酶抑制[7]、增强细胞外膜通透性[8]、细菌结构破坏[9]等。沙棘(Hippophae rhamnoides L.)是胡颓子科、沙棘属落叶灌木,其作为一种天然植物资源,广泛分布在亚洲和欧洲,果实富含维生素C、黄酮类、有机酸、生育酚和其他酚类化合物[10],具有很高的药用及食用价值,在中国民间常用于治疗胃部疾病。沙棘提取物在抗动脉粥样化、抗肿瘤、保护肝脏、保护心血管、保护皮肤以及保护胃肠道等方面都有重要作用[10]。而关于沙棘对幽门螺杆菌抑制作用的相关研究相对较少,早在2005年,LI等[11]研究发现沙棘叶乙醇提取物和水提物对幽门螺杆菌有抑制作用。2015年,MAMEDOV等[12]对沙棘果油和沙棘籽油进行了抗幽门螺杆菌实验,发现沙棘油对幽门螺杆菌的抑制效果不明显。最近,常应九[13]发现沙棘果乙醇提取物对幽门螺杆菌具有较强的抑制活性,还发现沙棘果提取物通过非竞争性抑制方式抑制脲酶活性,降低脲酶相关基因表达。而关于沙棘果提取物抑制幽门螺杆菌的化学成分以及细胞水平上的抑菌机制鲜有报道。
本文前期工作对沙棘果进行乙醇超声提取,得到乙醇粗提物后用有机溶剂石油醚、乙酸乙酯、正丁醇对乙醇粗提物依次进行液-液萃取,分别得到石油醚萃取物、乙酸乙酯萃取物、正丁醇萃取物和水相组分,对4种萃取组分进行抑制幽门螺杆菌活性测定,结果显示,沙棘乙酸乙酯萃取物抑制幽门螺杆菌效果最好,其最小抑菌浓度为2.5 mg/mL,最小杀菌浓度为5 mg/mL。因此,本研究基于前期工作,利用高效液相色谱法测定了沙棘乙酸乙酯萃取物中的化学成分,并从膜结构、脲酶活性以及细胞微观结构等方面深入探讨其抑菌机制,为沙棘活性物质抗幽门螺杆菌研究提供一定的参考。
1 材料与方法
1.1 材料及试剂
野生沙棘(属中国沙棘亚种)鲜果采摘于青海省海东市(海拔高度3 000~3 300 m,36.37°N,102.27°E);幽门螺杆菌标准株(ATCC 43504),购自美国菌种保藏中心,保存于青海大学实验室-80 ℃冰箱。
布氏肉汤培养基、1×PBS(pH 7.2~7.4)、尿素、KI,索莱宝生物科技有限公司;N-苯基-1萘胺(N-phenyl-1-naphthylamine,NPN)、戊二醛固定液,上海麦克林生化科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO),天津富宇精细化工有限公司;EDTA,天津市致远化学试剂有限公司;结晶紫、甲酚红,上海展云化工有限公司;胎牛血清,浙江天杭生物科技有限公司;甲醇、乙腈(色谱级),西格玛奥德里奇(上海)贸易有限公司;磷酸,国药集团化学试剂有限公司。
1.2 仪器与设备
SW-CJ-2FD洁净工作台,苏州安泰空气技术有限公司;YM50立式压力蒸汽灭菌器,上海三申医疗器械有限公司;Varioskan LUX多功能酶标仪,美国Thermo Fisher公司;JSM-7900F场发射扫描电镜,日本电子株式会社;LC-10 Avp 高效液相色谱,日本Shimadzu有限公司;THZ-103B恒温培养摇床,上海一恒科学仪器有限公司。
1.3 沙棘乙酸乙酯萃取物制备
采用95%乙醇超声提取,得到乙醇提取物浸膏,浸膏经过石油醚萃取后,萃余相用乙酸乙酯萃取并将萃取物减压浓缩,将萃取物放置在通风橱将溶剂挥干,得到乙酸乙酯萃取物,置于4 ℃冰箱备用。
1.4 幽门螺杆菌培养
将H.pylori菌种接种至含有6%胎牛血清(体积分数,下同)和少量抗生素的布氏肉汤培养基中[13],在37 ℃微需氧环境下培养2~3 d,使用微需氧产气袋和2.5 L密闭培养盒达到所需微需氧环境。
1.5 沙棘乙酸乙酯萃取物抑菌机理的研究
1.5.1 对生物膜形成的影响
参考文献[14]并稍做修改。将H. pylori培养48 h,用含6%胎牛血清布氏肉汤培养基稀释菌液,使OD600值为0.15后加入96孔板中。在上述孔中加入不同质量浓度(0.625、1.25、2.5、5 mg/mL)乙酸乙酯萃取物,并以未加乙酸乙酯萃取物的处理组作对照。37 ℃静置培养48 h后,抽吸培养基,用PBS冲洗2次,37 ℃孵育10 min至干燥。将250 μL 0.1%结晶紫加入孔,染色反应5 min后吸去结晶紫并用PBS洗涤2次,在37 ℃烘箱烘至干燥,加入洗脱剂无水乙醇于570 nm处测定吸光值,按公式(1)计算生物膜形成率:
生物膜形成率![]()
(1)
式中:A样品与A对照分别为沙棘乙酸乙酯萃取物处理组和对照组在570 nm处的吸光值。
1.5.2 细胞外膜渗透率的影响
采用NPN摄取法测定沙棘乙酸乙酯萃取物对幽门螺杆菌外膜的渗透能力[8]。将H.pylori培养48 h后,4 500 r/min离心10 min,并在PBS中洗涤2次后重悬于PBS,使其OD600=1.0±0.02。在菌悬液中加入不同质量浓度(0.625、1.25、2.5、5 mg/mL)的乙酸乙酯萃取物,以DMSO作为对照,在37 ℃生化培养箱中培养4 h,用PBS洗涤2次,在96孔板中加入菌液和40 μmol/L NPN后,在37 ℃孵育30 min后进行荧光测量。荧光测量使用多功能酶标仪,激发波长为350 nm,发射波长为420 nm,激发带宽5 nm。所有测定均为3个重复。
1.5.3 细胞膜完整性的影响
参考TANG等[15]的方法,检测胞质成分(如DNA、RNA和蛋白质)的释放来评价细菌细胞膜的完整性。将培养48 h的H. pylori菌液,6 000 r/min离心10 min,用PBS洗涤2次后再次离心5 min,得到菌体。将菌体重悬到PBS中,使得OD600=1.0±0.02。将H. pylori菌悬液与乙酸乙醇提取物(0.625、1.25、2.5、5 mg/mL)混合,在37 ℃下孵育12 h,离心取上清液。采用酶标仪在260 nm和280 nm处测定吸光值,以DMSO作为对照,以PBS作为参比。
1.5.4 膜蛋白的影响
根据LI等[16]的方法稍作修改。将培养48 h的H. pylori菌液,在4 500 r/min离心10 min收集菌体,用PBS洗涤菌体2次,菌体重悬在PBS中,使其OD600=1.0±0.02。吸取200 μL菌液与50 μL不同浓度的0.9%生理盐水配制的KI(0、0.005、0.010、0.015、0.020、0.025、0.030 mol/L)或乙酸乙醇提取物(0.625、1.25、2.5、5 mg/mL)在25 ℃孵化1 h,以DMSO作为对照。在激发波长(色氨酸)280 nm、(酪氨酸)296 nm处测定细菌的荧光发光值。
1.5.5 脲酶活性的影响
参考文献[7]并稍做修改,将H. pylori培养48 h后,收集菌体,并用0.9%生理盐水稀释至OD600=1.00±0.02,将菌液与含有不同浓度的乙酸乙酯萃取物(0.625、1.25、2.5、5 mg/mL)的培养基混合。在37 ℃培养2 h后,加入1.5 g/L尿素、1 g/L EDTA与0.2 g/L甲酚红混合溶液,在37 ℃下孵育20 min。以DMSO作为对照。采用酶标仪在590 nm处测定吸光值。每组实验重复3次。
1.5.6 细胞微观结构的影响
参考文献[9]并稍做修改。用不同质量浓度(0、2.5、5 mg/mL)乙酸乙酯萃取物处理OD600=0.5的细菌培养液。用5 mL乙酸乙酯萃取物与15 mL菌液在37 ℃孵育12 h,取5 mL菌液于10 mL离心管中,以4 500 r/min离心10 min,弃去上清液,加2.5%戊二醛溶液固定,涡旋振荡5 min,在4 ℃冰箱黑暗处放置12 h,4 500 r/min离心5 min。弃去上清液加入1×PBS(pH 7.2~7.4)涡旋振荡5 min,4 500 r/min离心10 min,弃去上清液,重复操作洗涤3次。离心后,用30%乙醇涡旋振荡5 min,静置5 min,4 500 r/min室温离心5 min,弃去上清液。再依次使用50%、70%、80%、90%和100%乙醇进行洗脱。将样品放在载玻片上,进行冷冻真空干燥,干燥后将样品固定在样品台上,真空下溅射镀金,然后用场发射扫描电镜观察。
1.6 乙酸乙酯萃取物化学成分分析
采用配备waters 2996紫外检测器的waters 2695型高效液相色谱仪测定乙酸乙酯萃取物的化学成分。根据参考文献[17]并稍做修改,测定乙酸乙酯萃取物中6种黄酮类物质,异鼠李素、槲皮素、山奈酚、儿茶素、没食子酸和芦丁。色谱柱Diamonsil C18(4.6 mm×250 mm,5 μm),流速1 mL/min,柱温30 ℃,检测波长280/360 nm,流动相甲醇-0.1%磷酸,标准品进样量10 μL,样品进样量10 μL,没食子酸和儿茶素在280 nm检测波长下测定;芦丁、槲皮素、山奈酚和异鼠李素在360 nm检测波长下测定。梯度洗脱程序如表1所示。
表1 六种黄酮类物质的梯度洗脱程序
Table 1 Gradient elution procedure of six flavonoids
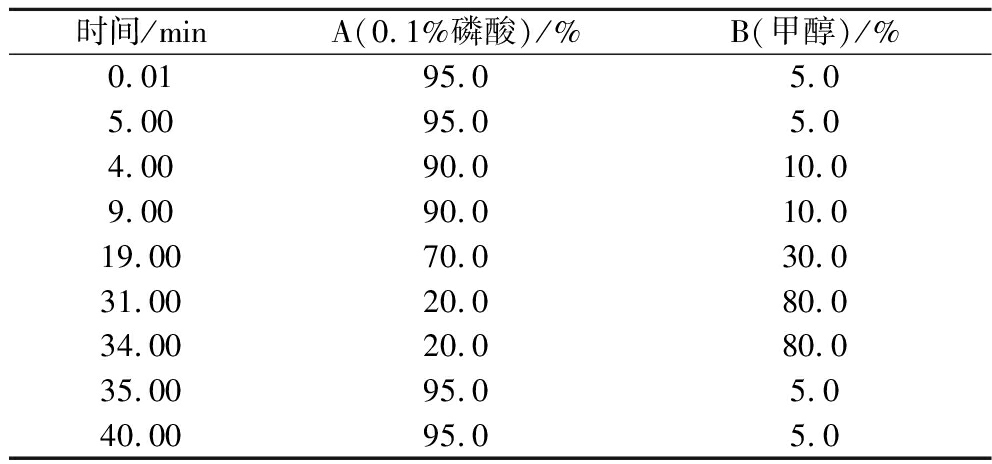
时间/minA(0.1%磷酸)/%B(甲醇)/%0.0195.05.05.0095.05.04.0090.010.09.0090.010.019.0070.030.031.0020.080.034.0020.080.035.0095.05.040.0095.05.0
苹果酸测定根据王芮东等[18]的方法并稍做修改,色谱柱ODS(4.6 mm×250 mm,35 μm),流速1.0 mL/min,柱温25 ℃,检测波长210 nm,流动相甲醇-0.01 mol/L KH2PO4(3∶97,体积比)(用磷酸调节pH值为2.80),等度洗脱20 min。
通过对比样品中不同化合物与异鼠李素、槲皮素、山奈酚、儿茶素、没食子酸、芦丁和苹果酸等标准品的保留时间,定性确定化合物种类。通过测定不同浓度标准品的峰面积进行标准曲线的绘制,求得回归方程和相关系数。化合物的含量以每g萃取物中含有的mg形式表示(即mg/g)。
1.7 数据统计分析
所有数据用平均值±标准差形式表示,使用SPSS 22.0 进行数据分析,采用Origin 2021进行绘图。处理组数据与对照组数据进行t检验,*、**、***分别表示处理组与对照组相比,在0.05、0.01、0.001水平上差异显著,即P<0.05、P<0.01和P<0.001。
2 结果与分析
2.1 沙棘乙酸乙酯萃取物对生物膜形成的影响
幽门螺杆菌分泌蛋白质、多糖、胞外DNA和其他分子,在胃黏膜定居后产生胞外聚合物,这些聚合物被细菌包裹并黏附在一起形成生物膜。与浮游细菌相比,能形成生物膜的菌落对不利环境(如抗生素、高酸性)具有很高的抵抗力[19]。生物膜的存在使得幽门螺杆菌对抗生素的耐药性增强,因此减少生物膜合成可使幽门螺杆菌抵抗力减弱。如图1所示,当萃取物质量浓度≥0.625 mg/mL时,生物膜形成率与对照存在差异(P<0.01),说明在此浓度时,萃取物对生物膜的形成产生影响,降低了生物膜的形成。生物膜形成率随着萃取物浓度的增加而降低,当萃取物质量浓度为5 mg/mL时,生物膜形成率低至28.23%。
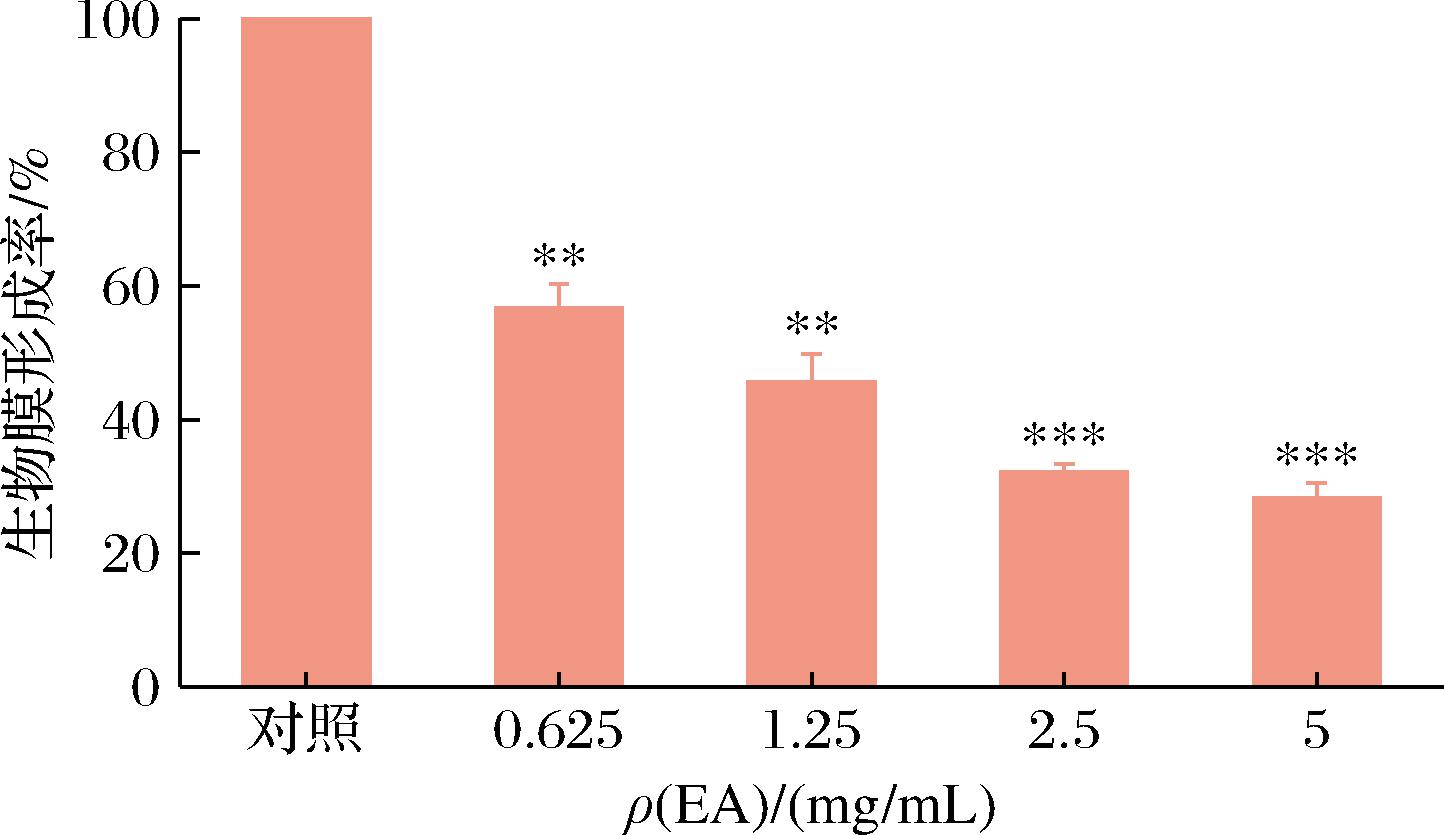
图1 乙酸乙酯萃取物对生物膜形成的影响
Fig.1 Inhibition of EA on biofilm formation
本结果表明,沙棘乙酸乙酯萃取物对幽门螺杆菌生物膜形成具有很强的抑制率,说明沙棘乙酸乙酯萃取物通过抑制幽门螺杆菌生物膜的形成减弱其对外环境的抵抗力,更容易被杀死。此外,PRASAD等[6]观察到菖蒲水提物能够抑制幽门螺杆菌生物膜的形成。因此,破坏幽门螺杆菌生物膜的形成是一种抑制或杀死幽门螺杆菌的方式,沙棘乙酸乙酯萃取物还可以与抗生素一起使用,能更有效地抑制幽门螺杆菌。
2.2 沙棘乙酸乙酯萃取物对细胞外膜渗透率的影响
革兰氏阴性菌由内膜和外膜两层膜包被,完整的外膜是渗透屏障。NPN在水环境中有微弱的荧光,但在非极性或疏水性环境中有强荧光[20]。外膜结构一旦损坏,NPN可以进入磷脂层,从而产生明显的荧光现象。因此,幽门螺杆菌对NPN的摄取能力反应了细胞外膜结构及通透性的变化。
由图2可见,乙酸乙酯萃取物处理后,细胞内NPN的荧光强度持续增加。0.625~5 mg/mL样品处理组荧光强度明显高于对照组(P<0.01),说明经过萃取物处理后,幽门螺杆菌外膜通透性增强。与对照组相比,高剂量组(5 mg/mL处理组)NPN摄取率提高2.45倍,说明乙酸乙酯萃取物在杀菌浓度下破坏了细菌膜,细胞外膜通透性明显增加。此结果与ZHOU等[8]发现HF-18肽能够增加幽门螺杆菌外膜通透性的研究结果类似,都是通过增强细胞外膜通透性,进而影响幽门螺杆菌的生长。
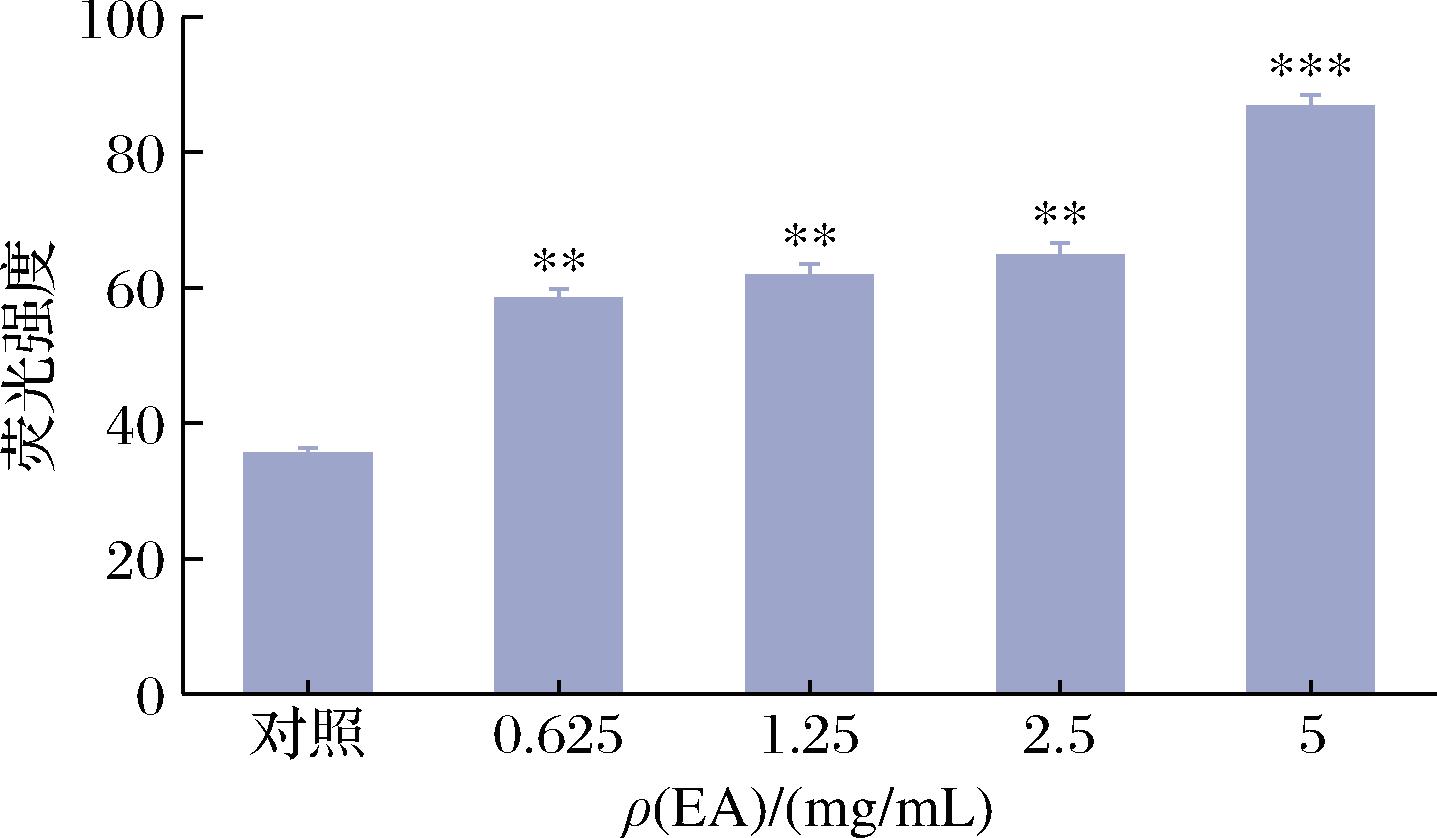
图2 不同质量浓度乙酸乙酯萃取物对幽门螺杆菌 细胞外膜的影响
Fig.2 Effect of different concentrations of EA on the outer cell membrane of H. pylori
2.3 沙棘乙酸乙酯萃取物对细胞膜完整性的影响
细胞膜的完整性是细菌生长的关键因素。蛋白质和核酸是存在于细胞膜和细胞质的生物大分子,蛋白质主要提供结构功能,而核酸携带大量的遗传信息。细胞渗漏的评价指标包括细胞内容物核酸在260 nm处的吸光度和蛋白质在280 nm处的吸光度,可以作为评价膜完整性的指标[15]。
从图3可知,萃取物质量浓度为0.625 mg/mL时,核酸虽有泄露,但与对照比,差异不显著(P>0.05),说明在此浓度的萃取物对核酸泄露的影响不显著。与对照比,在2.5 mg/mL时,核酸泄露严重(P<0.05)。在5 mg/mL时,核酸泄露极其严重(P<0.05),是对照的3.28倍。随着萃取物浓度的增加,蛋白质泄露逐渐增加。与对照比,在
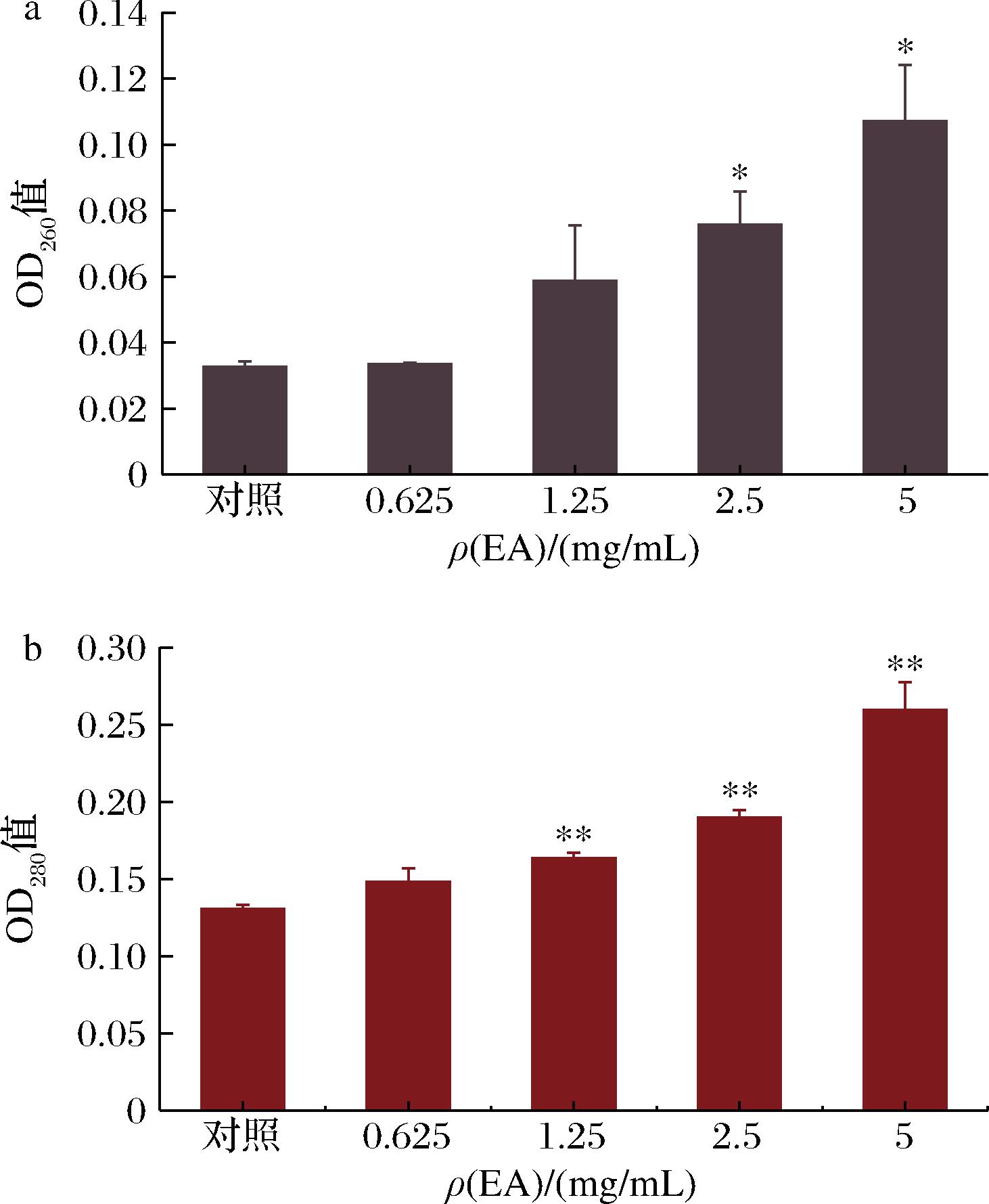
a-细胞内核酸泄露测定;b-细胞内蛋白质泄露测定
图3 细胞内容物外漏
Fig.3 Leakage of H.pylori cell inclusion
0.625 mg/mL时,蛋白质虽有泄露,但差异不显著(P>0.05),说明蛋白质泄露不明显。当质量浓度达到2.5 mg/mL时,蛋白质泄露率达到45.15%。当质量浓度为5 mg/mL时,蛋白质泄露最为严重,泄露率高达98.72%。总之,当乙酸乙酯萃取物质量浓度达到2.5 mg/mL时,细胞内容物泄露严重,这可能是因为细胞膜结构遭到破坏甚至细胞裂解死亡。此结果与TANG等[15]发现黑胡椒提取物破坏李斯特菌和沙门氏菌细胞膜完整性的结果类似。
2.4 沙棘乙酸乙酯萃取物对膜蛋白的影响
沙棘乙酸乙酯萃取物可以使细胞外膜通透性增加及细胞膜受损,研究某些特定蛋白质的在膜中的位置可以进一步解释细菌细胞膜蛋白的结构是否发生改变。色氨酸(Trp)和酪氨酸(Tyr)等氨基酸残基是膜蛋白中主要的荧光载体。KI是一种荧光猝灭剂,可以猝灭膜蛋白表面残基的荧光,但对位于膜蛋白内部或缝隙中残基的荧光光谱不产生影响[21]。因此,测定Trp和Tyr荧光光谱的变化可以定性地确定两种氨基酸在膜中的位置。
如图4-a和图4-b所示,随着KI含量的增加,Trp和Tyr残基没有明显的猝灭作用,表明Trp和Tyr残基主要位于膜内,结果与WU等[21]研究结果一致。
随着萃取物浓度增加,Trp和Tyr残基的最大发射强度逐渐降低(图4-c和图4-d),这表明沙棘乙酸乙酯萃取物与膜蛋白发生了相互作用,改变了膜蛋白的结构,使Trp、Tyr的位置从细胞膜内到细胞膜外,将残基暴露出来,从而使更多的沙棘乙酸乙酯萃取物能够与Trp和Tyr接触并猝灭其荧光。根据本研究结果,沙棘乙酸乙酯萃取物可能通过与细胞膜上的蛋白质相互作用而改变膜蛋白的构象,进而影响细胞膜的通透性。
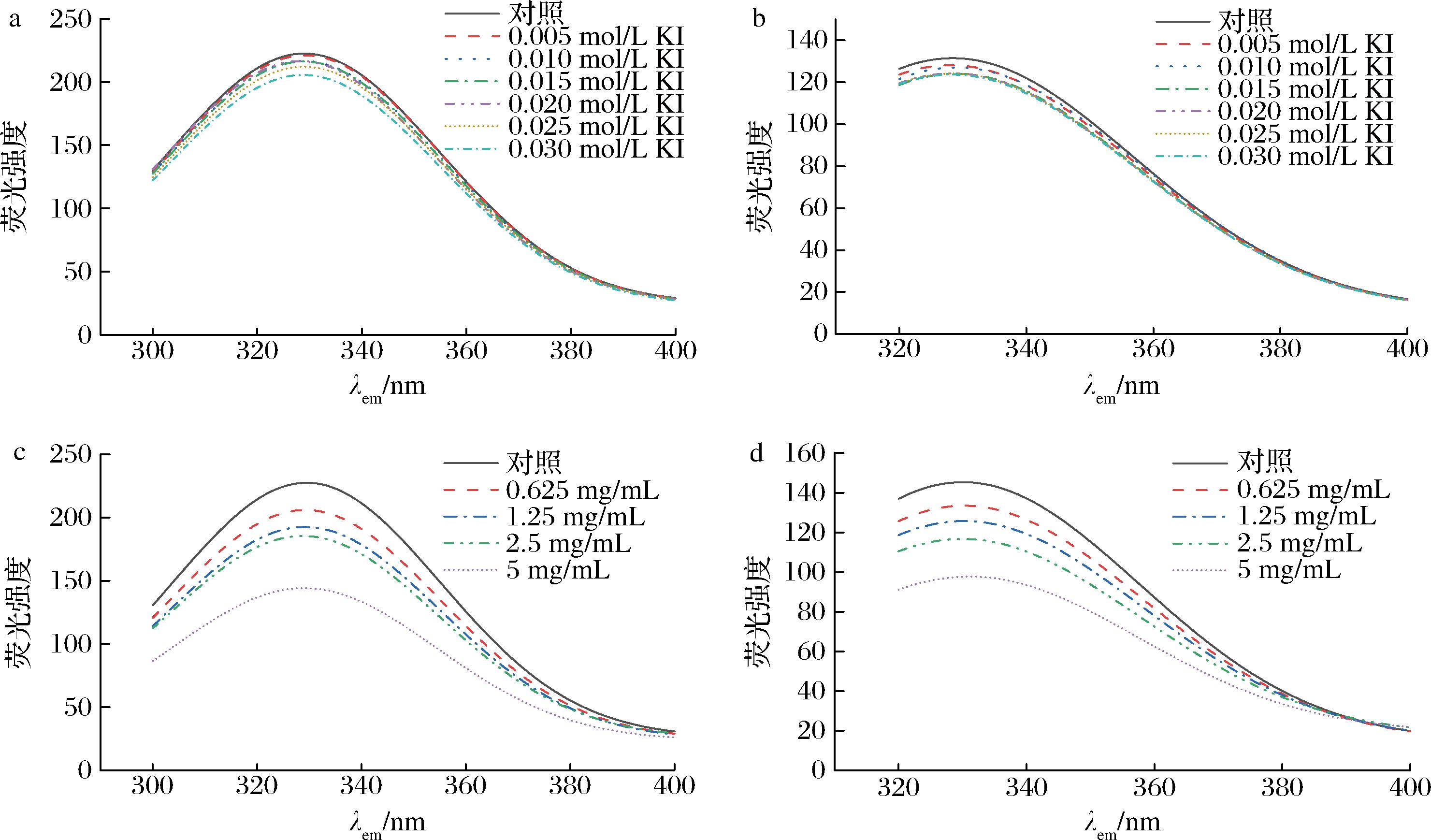
a-不同浓度KI对色氨酸荧光光谱的影响;b-不同浓度KI对酪氨酸荧光光谱的影响;c-不同浓度沙棘乙酸乙酯萃取 相对色氨酸荧光光谱的影响;d-不同浓度沙棘乙酸乙酯萃取相酪氨酸荧光光谱的影响
图4 沙棘乙酸乙酯萃取相对幽门螺杆菌膜蛋白氨基酸残基荧光光谱的影响
Fig.4 Fluorescence spectra of H.pylori membrane protein amino acid residue
2.5 沙棘乙酸乙酯萃取物对脲酶活性的影响
脲酶是幽门螺杆菌在胃内成功定植的关键因素之一,在高酸环境下,幽门螺杆菌可以产生大量脲酶[22]。脲酶可以将尿素分解为氨,氨能中和胃酸,创造出适合幽门螺杆菌生长的环境。因此,通过抑制脲酶的活性可以达到抑制幽门螺杆菌生长的目的。由图5可见,幽门螺杆菌脲酶活性与乙酸乙酯萃取物剂量之间呈现剂量依赖递减,在0.625~5 mg/mL时脲酶活性与对照相比,脲酶活性极显著降低(P<0.01)。在质量浓度为5 mg/mL时脲酶活性降低了
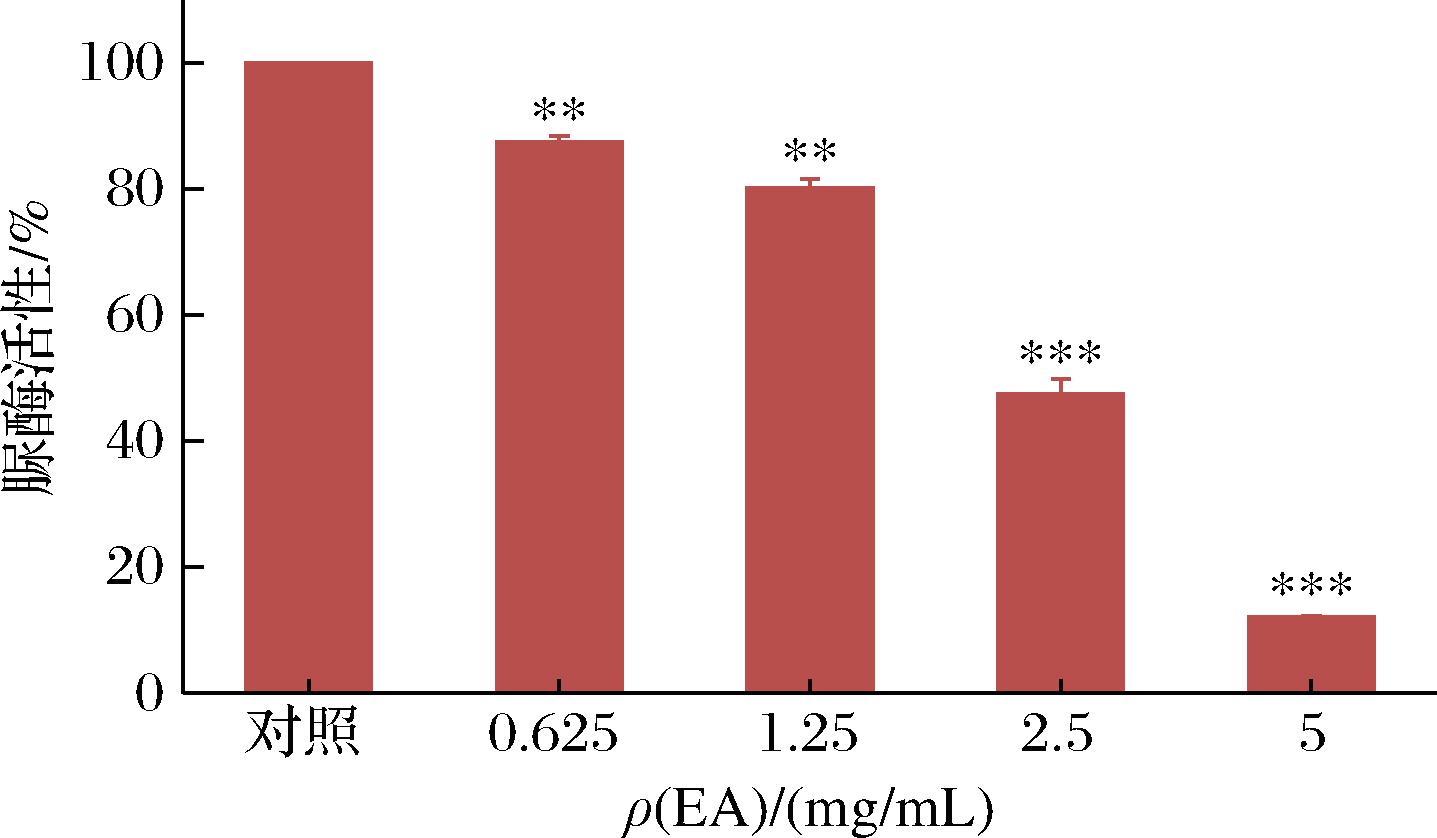
图5 沙棘乙酸乙酯萃取物对幽门螺杆菌脲酶活性的影响
Fig.5 Effect of EA on the urease activity of H. pylori
87.89%。结果表明,沙棘乙酸乙酯萃取物对幽门螺杆菌脲酶活性具有明显的抑制作用。此结果与常应九[13]报道的沙棘水提物抑制脲酶活性的结果相一致。LEE等[7]研究表明来檬提取物通过降低脲酶活性能够抑制幽门螺杆菌的生长繁殖。
2.6 沙棘乙酸乙酯萃取物对幽门螺杆菌细胞结构的影响
如图6-a所示,对照组幽门螺杆菌细胞呈杆状,边界清晰,表面光滑。经2.5 mg/mL的沙棘乙酸乙酯萃取物处理12 h后,细胞表面粗糙,细胞表现为畸形,出现褶皱(图6-b)。5 mg/mL沙棘乙酸乙酯萃取物处理12 h后,细胞形态被破坏,部分细胞呈球状,部分细胞裂解,细胞表面黏附颗粒(图6-c)。这一结果说明沙棘乙酸乙酯萃取物可以抑制幽门螺杆菌生长,改变细胞形态,破坏细胞膜结构,最终导致细胞死亡。此结果与YANG等[9]报道的山奈酚破坏细胞形态结果表现一致,也从另一个方面验证了沙棘乙酸乙酯萃取物可以改变膜结构。
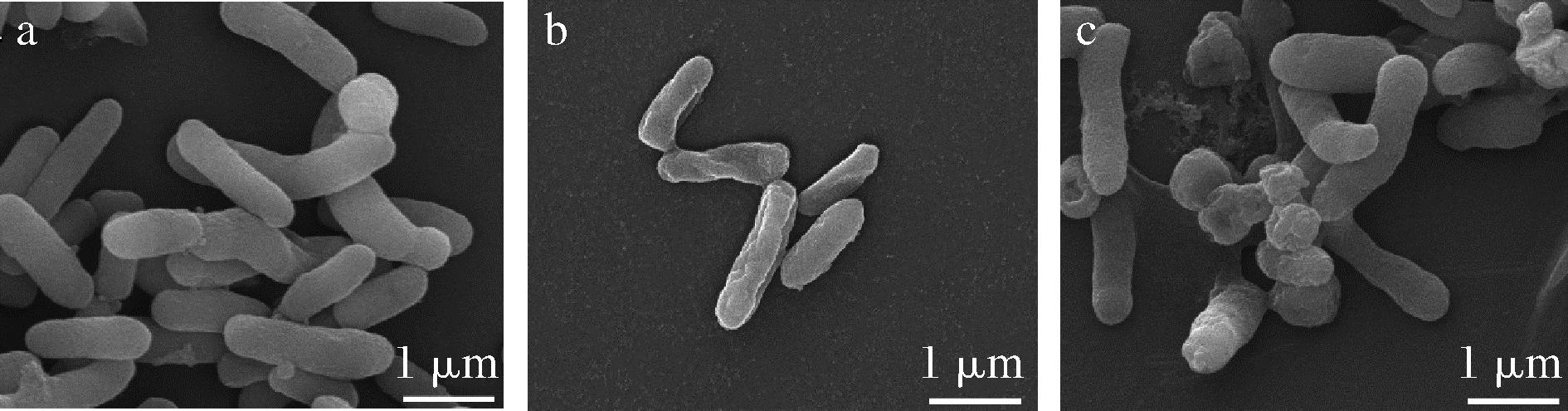
a-对照组;b-2.5 mg/mL样品处理组;c-5 mg/mL样品处理组
图6 幽门螺杆菌扫描电镜观察
Fig.6 Representative SEM images of H.pylori incubated with EA
2.7 沙棘乙酸乙酯萃取物化学成分
由表2结果可知,沙棘乙酸乙酯萃取物中不含有儿茶素,其他5种黄酮类物质都存在于沙棘乙酸乙酯萃取物中,其中芦丁和异鼠李素含量较高。现有研究表明芦丁[23]、异鼠李素[24]、槲皮素[25]和山奈酚[26]均能抑制幽门螺杆菌生长,其最小抑菌浓度分别为600、3.9、128、14.312 μg/mL。没食子酸含量在乙酸乙酯萃取物占比较低,但其也具有抗幽门螺杆菌的能力[27]。从表2中可以看出,苹果酸的含量最高,同时苹果酸也具有抑制幽门螺杆菌的能力。
表2 沙棘乙酸乙酯萃取物中黄酮类物质和苹果酸的化学物质含量
Table 2 Content of flavonoids and malic acid in EA

物质名称保留时间/min动态范围/(μg/mL)标准曲线拟合度(R2)含量/(mg/g)苹果酸4.228500~5 000y=191 719x-5 461.90.999 6872.97±3.21没食子酸10.20.1~100y=47 678x-203.360.999 88.30±1.00儿茶素20.40.1~100y=11 802x+2 4090.999 9 NA芦丁28.00.1~100y=24 315x-1 111.10.999 8141.58±6.68槲皮素30.80.1~100y=76 994x+24 9500.999 947.98±3.23山奈酚32.30.1~100y=62 754x+698.110.999 814.93±1.02异鼠李素32.60.1~100y=80 823x-1 251.11.000 097.80±5.83
注:NA表示未检出。
从图7-c中可以观察到,在保留时间为29.27 min时,出现最高峰,其化学结构未得到鉴定,将其定义为未鉴定的化合物,这种未鉴定的化合物也可能具有抑制幽门螺杆菌的效果。
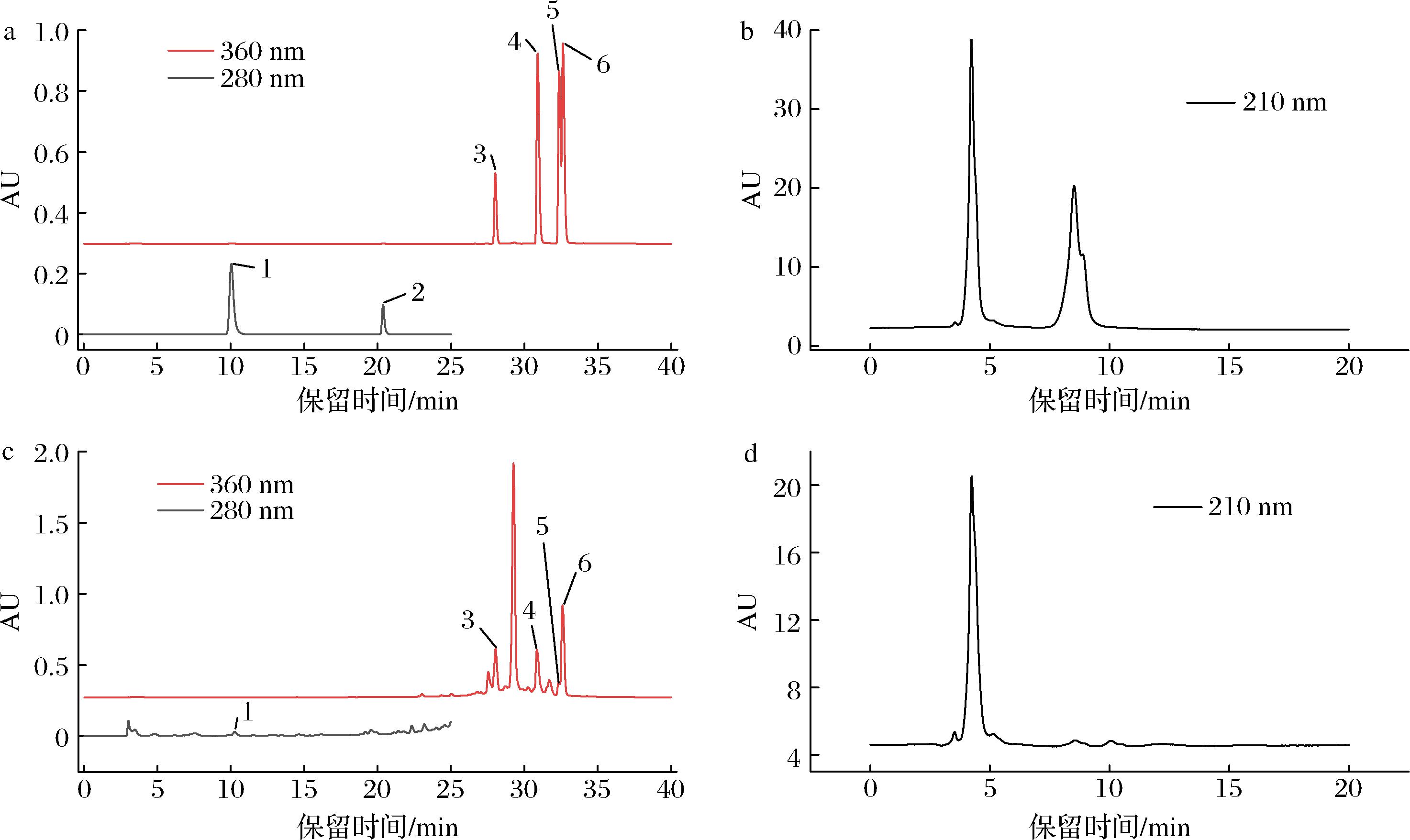
a-6种黄酮类物质标准品色谱图;b-苹果酸标准品色谱图;c-沙棘乙酸乙酯萃取物中黄酮类物质色谱图;d-沙棘乙酸乙酯萃取物中苹果酸色谱图
图7 六种黄酮类物质和苹果酸的标准品和乙酸乙酯萃取物色谱图
Fig.7 Chromatogram of 6 flavonoids and malic acid in the standard and EA
注:1为没食子酸;2为儿茶素;3为芦丁;4为槲皮素;5为山奈酚;6为异鼠李素。
3 结论
综上所述,沙棘乙酸乙酯萃取物通过破坏幽门螺杆菌生物膜、改变膜结构域蛋白质、增加细胞外膜及内膜的通透性、改变细胞结构和降低脲酶活性抑制幽门螺杆菌生长。沙棘乙酸乙酯萃取物中的化学成分主要是苹果酸、芦丁、槲皮素、山奈酚和异鼠李素,已有研究报道这些物质均具有抗幽门螺杆菌活性。但关于沙棘乙酸乙酯萃取物对幽门螺旋杆菌的抑制效果是单一物质的高抑菌效果,还是这些物质的协同作用,需要进一步深入研究。
[1] WANG C C, YUAN Y H, HUNT R H.The association between Helicobacter pylori infection and early gastric cancer:A meta-analysis[J].The American Journal of Gastroenterology, 2007, 102(8):1789-1798.
[2] HOOI J K Y, LAI W Y, NG W K, et al.Global prevalence of Helicobacter pylori infection:Systematic review and meta-analysis[J].Gastroenterology, 2017, 153(2):420-429.
[3] GONZ LEZ A, CASADO J, LANAS
LEZ A, CASADO J, LANAS  .Fighting the antibiotic crisis:Flavonoids as promising antibacterial drugs against Helicobacter pylori infection[J].Frontiers in Cellular and Infection Microbiology, 2021, 11:709749.
.Fighting the antibiotic crisis:Flavonoids as promising antibacterial drugs against Helicobacter pylori infection[J].Frontiers in Cellular and Infection Microbiology, 2021, 11:709749.
[4] IBRAHIM N H, AWAAD A S, ALNAFISAH R A, et al.In-vitro activity of Desmostachya bipinnata (L.) Stapf successive extracts against Helicobacter pylori clinical isolates[J].Saudi Pharmaceutical Journal, 2018, 26(4):535-540.
[5] ALI E, ARSHAD N, BUKHARI N I, et al.Linking traditional anti-ulcer use of rhizomes of Bergenia ciliata (Haw.) to its anti-Helicobacter pylori constituents[J].Natural Product Research, 2020, 34(4):541-544.
[6] PRASAD A, DEVI A T, NAGENDRA PRASAD M N, et al.Phyto anti-biofilm elicitors as potential inhibitors of Helicobacter pylori[J].3 Biotech, 2019, 9(2):53.
[7] LEE S M, PARK S Y, KIM M J, et al.Key lime (Citrus aurantifolia) inhibits the growth of triple drug resistant Helicobacter pylori[J].Gut Pathogens, 2018, 10(1):16.
[8] ZHOU C Y, JIANG M L, YE X Y, et al.Antibacterial activities of peptide HF-18 against Helicobacter pylori and its virulence protein CagA[J].International Journal of Peptide Research and Therapeutics, 2022, 28(2):63.
[9] YANG R J, LI J J, WANG J R, et al.Kaempferol inhibits the growth of Helicobacter pylori in a manner distinct from antibiotics[J].Journal of Food Biochemistry, 2022, 46(9):e14210. [10] REN R R, LI N, SU C, et al.The bioactive components as well as the nutritional and health effects of sea buckthorn[J].RSC Advances, 2020, 10(73):44654-44671.
[11] LI Y, XU C, ZHANG Q, et al.In vitro anti-Helicobacter pylori action of 30 Chinese herbal medicines used to treat ulcer diseases[J].Journal of Ethnopharmacology, 2005, 98(3):329-333.
[12] MAMEDOV N A, URBANOWSKI M, CRAKER L E.Study of antimicrobial activity of sea buckthorn oil (Hippophae rhamnoides L.) against Helicobacter pylori[J].Acta Horticulturae, 2015(1098):91-94.
[13] 常应九. 沙棘提取物对胃肠微生物影响的研究[D].西宁:青海大学, 2020. CHANG Y J.Study on the effect of seabuckthorn extract on gastrointestinal microbes[D].Xining:Qinghai University, 2020.
[14] HATHROUBI S, SERVETAS S L, WINDHAM I, et al.Helicobacter pylori biofilm formation and its potential role in pathogenesis[J].Microbiology and Molecular Biology Reviews, 2018, 82(2):e1-18.
[15] TANG H, CHEN W X, DOU Z M, et al.Antimicrobial effect of black pepper petroleum ether extract for the morphology of Listeria monocytoge nes and Salmonella typhimurium[J].Journal of Food Science and Technology, 2017, 54(7):2067-2076.
[16] LI L, SONG X, YIN Z Q, et al.The antibacterial activity and action mechanism of emodin from Polygonum cuspidatum against Haemophilus parasuis in vitro[J].Microbiological Research, 2016, 186-187:139-145.
[17] KARUPPUSAMY A, AMILCAR S D, EDUARDA P, et al.Cochlospermum regium (Mart.ex Schrank) Pilg.:Evaluation of chemical profile, gastroprotective activity and mechanism of action of hydroethanolic extract of its xylopodium in acute and chronic experimental models[J].Journal of Ethnopharmacology, 2019, 233:101-114.
[18] 王芮东, 李楠, 卫博慧, 等.高效液相色谱法测定甘蓝泡菜发酵过程中的有机酸[J].食品工业科技, 2018, 39(6):236-240. WANG R D, LI N, WEI B H, et al.Determination of organic acids in the fermentation process of cabbage kimchi by HPLC[J].Science and Technology of Food Industry, 2018, 39(6):236-240.
[19] YONEZAWA H, OSAKI T, HOJO F, et al.Effect of Helicobacter pylori biofilm formation on susceptibility to amoxicillin, metronidazole and clarithromycin[J].Microbial Pathogenesis, 2019, 132:100-108.
[20] HELANDER I M, MATTILA-SANDHOLM T.Fluorometric assessment of Gram-negative bacterial permeabilization[J].Journal of Applied Microbiology, 2000, 88(2):213-219.
[21] WU Y P, BAI J R, ZHONG K, et al.A dual antibacterial mechanism involved in membrane disruption and DNA binding of 2R, 3R-dihydromyricetin from pine needles of Cedrus deodara against Staphylococcus aureus[J].Food Chemistry, 2017, 218:463-470.
[22] ANSARI S, YAMAOKA Y.Survival of Helicobacter pylori in gastric acidic territory[J].Helicobacter, 2017, 22(4):e12386.
[23] QAZI N G, KHAN A U, ABBASI S W, et al.Pharmacological basis of Rumex hastatus D.don in gastrointestinal diseases with focusing effects on H+/K+-ATPase, calcium channels inhibition and PDE mediated signaling:Toxicological evaluation on vital organs[J].Molecules, 2022, 27(18):5919.
[24] USTÜN O, OZÇELIK B, AKYÖN Y, et al.Flavonoids with anti-Helicobacter pylori activity from Cistus laurifolius leaves[J].Journal of Ethnopharmacology, 2006, 108(3):457-461.
[25] BROWN J C, WANG J, KASMAN L, et al.Activities of muscadine grape skin and quercetin against Helicobacter pylori infection in mice[J].Journal of Applied Microbiology, 2011, 110(1):139-146.
[26] JI Y M, HO L M, DO HYUN K, et al.Anti-inflammatory effects of Kaempferol on Helicobacter pylori-induced inflammation[J].Bioscience, Biotechnology, and Biochemistry, 2019, 83(1):166-173.
[27] D AZ-G
AZ-G MEZ R, L
MEZ R, L PEZ-SOL
PEZ-SOL S R, OBREQUE-SLIER E, et al.Comparative antibacterial effect of Gallic acid and catechin against Helicobacter pylori[J].LWT - Food Science and Technology, 2013, 54(2):331-335.
S R, OBREQUE-SLIER E, et al.Comparative antibacterial effect of Gallic acid and catechin against Helicobacter pylori[J].LWT - Food Science and Technology, 2013, 54(2):331-335.