刺梨(Rosa roxburghii Tratt,RRT)被誉为“维C之王”,既有药用价值,又可食用,是一种具有保健和治疗功能的营养珍果[1-2]。刺梨有多种药理作用,如消炎、抗氧化、降血糖、降血脂、镇静等,具有一定的临床应用潜力[3-4]。刺梨果榨汁后剩下的部分占其果实质量的50%左右,但大多数加工企业却未能有效地利用,而是直接将其废弃,造成了一定的资源浪费[5]。而在果渣中,有一种被认为是膳食纤维的多糖:阿拉伯木聚糖(arabinoxylan, AX)[6],它的分子结构由两种葡萄糖苷单元组成,即β-D-木糖苷和α-L-阿拉伯糖苷。它们以β-(1→4)键连接成线性木聚糖骨架,其中一些取代基通过O-2和O-3原子与木聚糖残基相连[7]。
AX具有许多生理功能和健康益处。包括可以增强免疫系统,降低疾病发生的可能性,减少肝脏器官损害,提高肠道中益生菌的数量等[8]。AX可以抵抗人类酶的消化,并依赖于微生物酶进行消化,肠道微生物会对AX进行发酵,从而产生能量,最终产物如短链脂肪酸(short-chain fatty acids, SCFAs),主要是醋酸、丙酸和丁酸,这些产物对宿主的健康有深远的影响[9]。多糖在降糖方面也有着广泛研究,有研究表明其能通过竞争结合位点减缓α-葡萄糖苷酶和α-淀粉酶代谢、分解葡萄糖,显示出良好的降糖药效[10]。NIE等[11]研究表明,通过调节肠道微生态的平衡,AX能够提高有益菌的数量,同时也能影响肠道的代谢物,从而缓解2型糖尿病的病理状况。基于此,本文研究了刺梨果渣中AX的降糖活性与酵解特征,为刺梨果渣的高效利用以及在功能活性方面的研究提供理论参考。
1 材料与方法
1.1 材料与仪器
刺梨果渣,贵州省龙里县;木糖、α-淀粉酶、木聚糖酶、纤维素酶、纤维素DEAE-52、Sephadex G-100、阿卡波糖、α-葡萄糖苷酶、L-半胱氨酸、地衣酚、粘液蛋白,上海源叶生物科技有限公司;乙酸、丙酸、己酸、丁酸、戊酸、异戊酸、异丁酸,Sigma-aldrich(上海)贸易有限公司;4-硝基苯-α-D-吡喃半乳糖苷(4-nitrophenyl α-D-galactopyranoside,PNPG)、可溶性淀粉、阿拉伯半乳糖、三氯甲烷、正丁醇、醋酸钠、苯酚、DNS显色剂、乙醚,上海阿拉丁生化科技股份有限公司。
BILKON-FD5BD真空冷冻干燥机,上海比朗克仪器制造有限公司;Multiskan SkyHigh酶标仪、Thermo Trace 1300气相色谱仪,ThermoFisher Scientific科技(中国)有限公司;HL-2恒流泵、BSZ-100全自动部分收集器,上海青浦沪西仪器厂;LC-20A高效液相色谱仪,日本岛津公司;F-280荧光分光光度计,天津岗东科技股份有限公司。
1.2 试验方法
1.2.1 AX的提取
参考谷春梅等[12]和马福敏等[13]的方法。实验以刺梨果渣作为原材料,采用超声辅助酶法提取刺梨果渣中AX,其中纤维素酶(50 u/mg)与木聚糖酶(6 000 u/mg)酶活力比1∶1,复合酶添加量30 mg、料液比为1∶20(g/mL)、超声波温度85 ℃、超声波时间65 min、超声波功率260 W。AX样品提取率计算如公式(1)所示:
AX提取率![]()
(1)
AX提取工艺如下:
刺梨果渣→酶处理→超声→离心→醇沉→离心→冷冻干燥
1.2.2 AX的纯化
参考姜玉莹[14]和刘磊等[15]的方法,稍作修改。纯化流程如下:
粗提物→脱蛋白→DEAE cellulose-52阴离子交换柱层析→Sephadex G-100葡聚糖凝胶柱层析法→纯化物
纯度计算参考赵梦丽[16]的方法,稍作改动。采用地衣酚-盐酸法测定AX纯度。分别移取不同浓度木糖溶液3 mL,加入3 mL质量分数0.1% FeCl3溶液(用质量分数37%左右HCl溶解)和0.3 mL质量分数1%地衣酚(无水乙醇溶解)混匀,沸水浴30 min冷却后,定容至10 mL,以OD值(A670nm-A580nm)和木糖含量绘制标准曲钱:y=0.001 4x+0.015 2,R2=0.992 3。
称取0.1 g样品加入2 mol/L HCl 20 mL,具塞试管于沸水浴中酸解120 min。冷却后用滤纸过滤,收集滤液(可适当稀释),吸取3 mL样品液采用标曲测定方法测定其AX含量。计算如公式(2)所示:
(2)
式中:X,阿拉伯木聚糖含量,g/100 g;c,由标曲所得AX含量,μg;0.88,转换系数;n,稀释倍数;m,样品干重,g。
1.2.3 AX的降糖活性
1.2.3.1 阿拉伯糖(arabinose,Ara)、木聚糖(xylan,Xyl)、AX与α-淀粉酶的分子对接模拟
从RCSB PDB下载α-淀粉酶(PDB ID:6M4K),平台(https://pubchem.ncbi.nIm.nih.gov)下载Xyl(PubChem CID:129539666)、Ara(PubChem CID:439195)和AX(PubChem CID:405238652),随后将小分子sdf格式用OpenBable软件转化为mol2格式。在Pymol软件中打开蛋白质的大分子模型,移除水分子和原来的配体,把结果存成PDB格式的文档备用。使用AutodockTools 1.5.6对大分子进行加氢、计算电荷、确定分子的刚性类型,保存为PDBQT格式备用。打开Pymol,导入对接好的文件,改变配体颜色以便于区分大分子,显示氢键与氢键长度、显示蛋白残基棍状结构与残基名称,随后降低大分子颜色,可视化完成。
1.2.3.2 酶抑制活性测定
参考王闪[17]的方法,稍作修改。取不同质量浓度待测液(1、2、3、4、5 mg/mL)0.25 mL,加入α-淀粉酶(6 U/mL)溶液,37 ℃水浴10 min,加入0.5 mL质量分数1%淀粉溶液,恒温5 min,加入1 mL DNS显色剂,沸水浴5 min后,冷却定容至10 mL,于520 nm处测A1,对照组用PBS代替待测液(A0),基数组用PBS代替底物(A2)。计算如公式(3)所示:
抑制率![]()
(3)
1.2.3.3 抑制动力学研究
参考林宝妹等[18]的方法,稍作修改。将1 mg/mL的α-淀粉酶配制成不同质量分数(0.2、0.4、0.6、0.8、1%),测定不同AX质量浓度(0.4、0.8、1.2、2 mg/mL)酶促反应速率,用Lineweaver-Burk双倒数曲线图,判断抑制类型。
1.2.3.4 荧光光谱分析
参考李琼等[19]和ZHANG等[20]的方法,稍作修改。分别取0、10、20、40、60、80 μg/mL AX溶液与1 mg/mL淀粉酶溶液混合,18、37 ℃下水浴30 min,之后进行荧光光谱扫描。在激发波长为280 nm,狭缝宽度为5 nm条件下进行检测。用Stern-Volmer方程表示荧光猝灭,如公式(4)所示:
![]() =1+KSV[Q]=1+Kqτ0[Q]
=1+KSV[Q]=1+Kqτ0[Q]
(4)
式中:F0、F,α-淀粉酶与AX相互作用前后的荧光强度;[Q],AX质量浓度,mg/mL;τ0,荧光物质在无猝灭剂影响下的平均寿命,生物大分子的τ0值一般为10-8 s;Kq,猝灭速率常数;KSV,Stern-Volmer猝灭常数。
1.2.4 体外模拟酵解
参考陈光静[21]的方法,稍作修改。粪便样本来自3名健康的志愿者(1名男性,2名女性,平均年龄为23.7)。他们必须满足以下所有要求:1)至少3个月未服用任何抗生素;2)良好的饮食习惯;3)没有消化系统疾病。将各粪便样本按1∶1(质量比)的比例混合,并立即密封,保证为厌氧环境。在粪便样本中加入无菌磷酸盐缓冲盐水(0.1 mol/L,pH值为7.2)。用消毒玻璃棒搅拌每种混合物5 min,然后通过2层粗棉布过滤。随后,将0.005 g FeSO4·7H2O、0.08 g CaCl2、0.4 g胆汁酸、0.5 g K2HPO4、0.69 g MgSO4·H2O、0.8 g L-半胱氨酸、1 g瓜尔胶、1.5 g NaHCO3、2 g阿拉伯半乳糖、2 g果胶、3 g酪蛋白、4 g粘液蛋白、4.5 g KCl、4.5 g NaCl、4 mL重青素(质量分数0.025%)和1 mL Tween 80溶解在1 L去离子水中制备碱性培养基。将粪便浆液(质量分数10%)与发酵培养基(5 mg/mL的AX溶液)按1∶1(体积比)的比例混合成AX发酵组,在37 ℃厌氧条件下孵育24 h,其中空白对照组以无菌水替代。分别在0、3、6、12、18、24 h取样,冷却后,在4 ℃下保存20 min。然后收集上清液备用,测定每个时间段的pH值及SCFAs含量。
1.2.4.1 发酵液pH的测定
使用pH计测定空白组及AX发酵液的pH值。
1.2.4.2 发酵液中SCFAs的测定
色谱条件:Thermo Trace 1300气相系统,色谱柱为Agilent HP-INNOWAX 毛细管柱(30 m×0.25 mm×0.25 μm);进样量1 μL,分流比10∶1。进样口250 ℃;离子源300 ℃;传输线250 ℃。程序起始温度90 ℃;以10 ℃/min升至120 ℃后,以5 ℃/min升至150 ℃;再以25 ℃/min升至250 ℃,维持2 min。氦气载气流速1.0 mL/min。
标准品配制:取乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸标准品配制成100 mg/mL的储备液,稀释储备液得到6种酸的系列工作标准溶液;取己酸标准品适量用乙醚配制成100 mg/mL的储备液,并用乙醚稀释储备液得到己酸系列工作标准溶液。内标(4-甲基戊酸)用乙醚配制成75 μg/mL,200 μL 6种酸的系列工作标准溶液、100 μL 15%磷酸、20 μL己酸系列工作标准溶液、20 μL内标和260 μL乙醚混合配制成0.02、0.1、0.5、1、2、5、10、25、50、100、250、500 μg/mL 12个标曲工作液。储备液保存于-20 ℃备用。以标准品的浓度为横坐标、峰面积比值为纵坐标得到的SCFAs的线性回归方程见表1(相关系数R2>0.99)。
表1 短链脂肪酸线性回归方程
Table 1 Linear regression equation of SCFAs
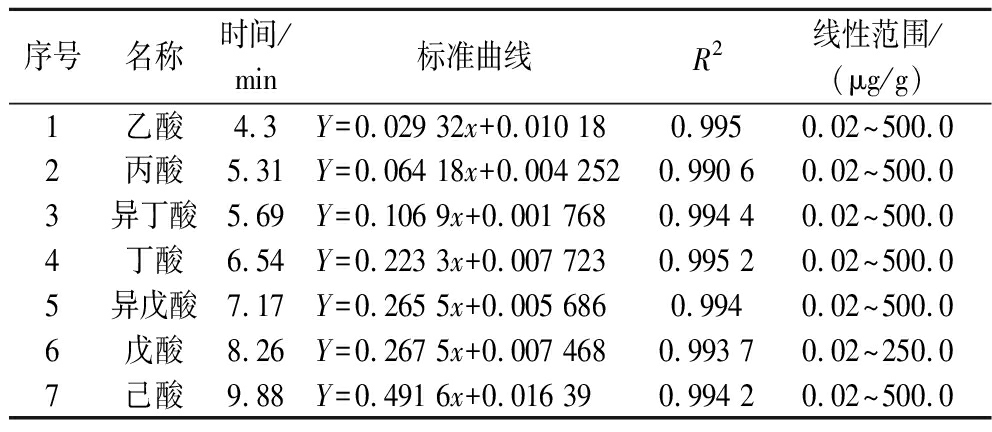
序号名称时间/min标准曲线R2线性范围/(μg/g)1乙酸4.3Y=0.029 32x+0.010 180.9950.02~500.02丙酸5.31Y=0.064 18x+0.004 2520.990 60.02~500.03异丁酸5.69Y=0.106 9x+0.001 7680.994 40.02~500.04丁酸6.54Y=0.223 3x+0.007 7230.995 20.02~500.05异戊酸7.17Y=0.265 5x+0.005 6860.9940.02~500.06戊酸8.26Y=0.267 5x+0.007 4680.993 70.02~250.07己酸9.88Y=0.491 6x+0.016 390.994 20.02~500.0
样品配制:取适量样本于2 mL离心管中,加50 μL质量分数15%磷酸,再加75 μg/mL的内标(异己酸)溶液10 μL和乙醚140 μL匀浆1 min,于4 ℃ 12 000 r/min离心10 min,取上清液上机测试。
1.3 数据处理
采用Execl、SPSS 26、Minitab 17和Design-Expert 12软件对数据进行处理分析,采用Origin 2018制图。
2 结果与分析
2.1 分子对接模拟结果
实验采用复合酶法提取AX的得率为(4.31±0.07)%,地衣酚-盐酸法测得刺梨果渣AX粗提物纯度为25.60%,纯化物纯度为75.92%,实验以纯化后的AX原料进行降糖及酵解特征研究。其中分子对接结果表明,α-淀粉酶能与Ara、Xyl、AX结合(表2)。
表2 α-淀粉酶与Ara、Xyl、AX分子对接结果
Table 2 α-Docking results of amylase with Ara, Xyl, AX

化合物结合能/(kJ/mol)氢键数键长氢键作用残基Ara-14.518 292.2、2.1、2.4、2.1、2.1、2.2、2.3、1.9、2.8GLU-502、ASN-500、ARG-483Xyl-6.73652.6、2.9、2.7、3.3、2.4GLU-461、PHE-511、ARG-437AX-12.133 682.6、2.1、2.2、2.7、1.9、2.9、2.5、1.8THR-450、GLN-451、ALA-448、ASP-446
其中Ara与与α-淀粉酶结合性最好,结合能为-14.518 2 kJ/mol,有9条氢键,Ara共与α-淀粉酶3个残基相连,分别是GLU-502、ASN-500和ARG-483。其中Xyl与α-淀粉酶结合性最低,结合能为-6.736 kJ/mol,共5条氢键,Xyl共与α-淀粉酶3个残基相连,分别是GLU-461、PHE-511和ARG-437。α-淀粉酶与Ara、Xyl、AX残基结合图如图1所示。
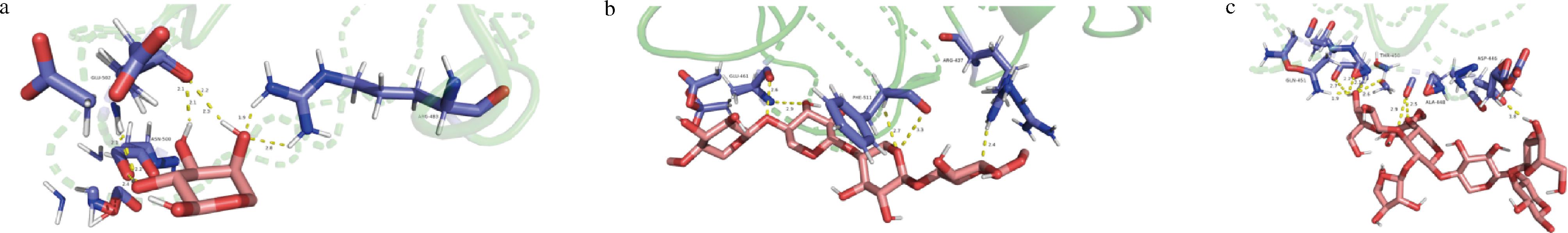
a-Ara;b-Xyl;c-AX
图1 Pymol中阿拉伯糖、木聚糖、阿拉伯木聚糖与α-淀粉酶蛋白残基结合图
Fig.1 Ara, Xyl, AX and α- amylase protein residue binding diagram
注:图中黄色虚线代表氢键,绿色表示蛋白结构,蓝色表示蛋白残基结构,粉色代表各配体。
2.2 AX对α-淀粉酶的抑制活性
抑制α-淀粉酶的活性是探讨降糖作用机制的有效手段之一,而模拟分子对接试验结果也为其提供了理论依据,因此在分子对接实验基础上研究了不同浓度的AX对α-淀粉酶的抑制作用。由图2可知,在纯化前和纯化后,AX对α-淀粉酶的抑制率都随着AX的浓度增加而增加,这说明AX对α-淀粉酶有一定的浓度依赖性,后期可以再详细探讨AX对α-淀粉酶的最佳抑制浓度。当AX的质量浓度达到5 mg/mL时,纯化前和纯化后的AX对α-淀粉酶的抑制率分别为53.81%和50.83%,表明纯化过程并没有显著改变AX对α-淀粉酶的抑制效果。然而,无论是纯化前还是纯化后,AX对α-淀粉酶的抑制率都低于0.2 mg/mL的阳性对照药物阿卡波糖的抑制率,这说明AX对α-淀粉酶的抑制能力相较于阳性对照有限。此外,纯化后的AX对α-淀粉酶的制率略低于纯化前的AX,这可能是因为在纯化过程中除去了一些对降糖活性有协同作用的物质,导致纯化后的AX降糖活性稍有降低。
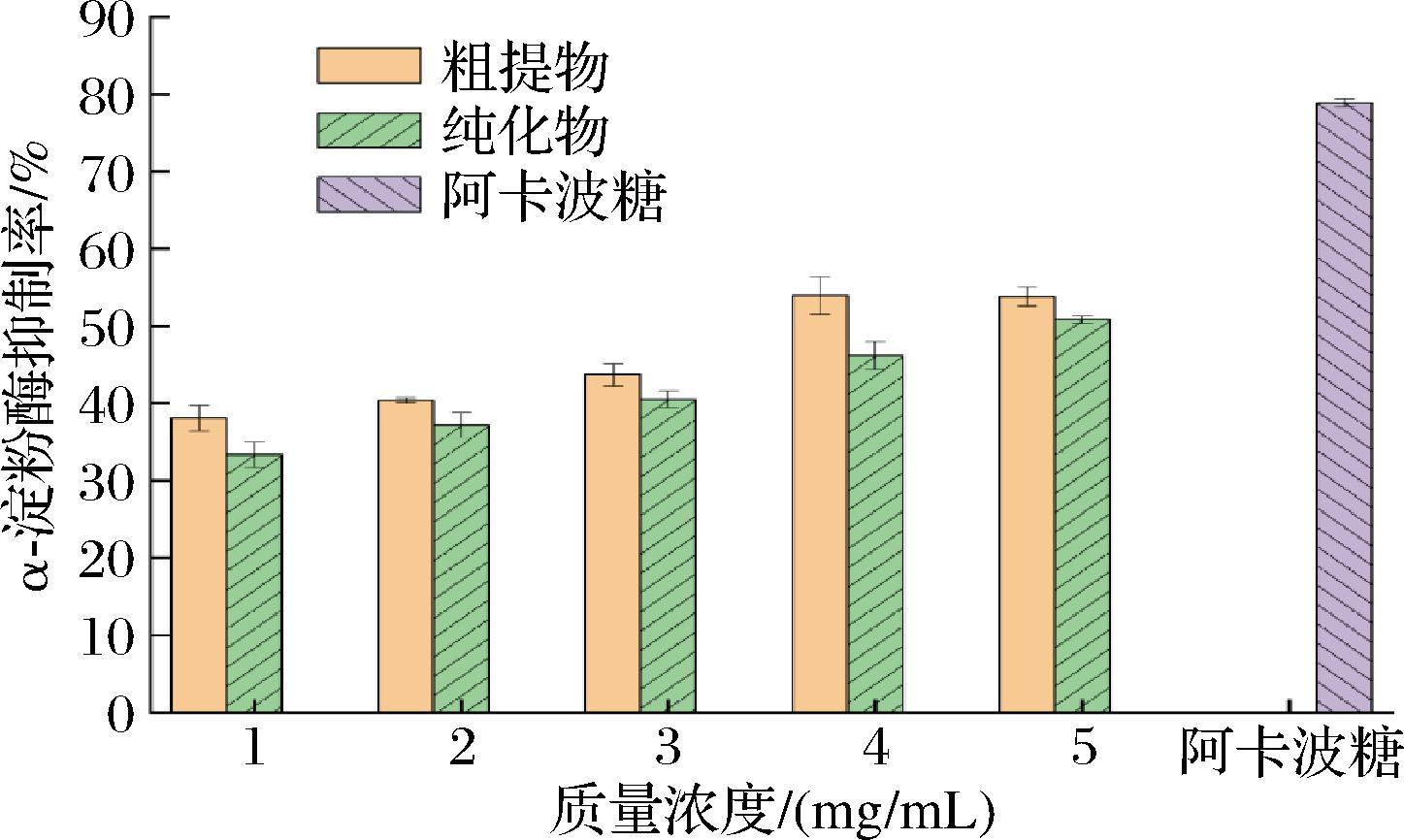
图2 不同质量浓度的AX对α-淀粉酶的抑制情况
Fig.2 Inhibition of α-amylase by different concentrations of AX
2.3 酶促反应动力学分析
抑制作用的双倒数图是一种分析酶的抑制剂类型和解离常数的方法。不同类型的抑制剂会导致双倒数图上直线的斜率、截距和交点发生变化。实验对AX纯化物进行了酶促反应动力学分析,Lineweaver Burk曲线图中,因Km和Vmax的比值为斜率,1/Vmax值为y轴截距。由图3抑制作用双倒数图可知,斜率随样品浓度增加逐渐增大,1/[S]与1/V存在良好的线性关系,1/V随着1/[S]逐渐增大,并且两者的线性回归方程延长线交于第三象限,x轴截距都随浓度增加而减小,y轴截距都随浓度增加而增大。因此根据酶抑制类型的判断原理,表明AX对α-淀粉酶为竞争非竞争混合型抑制。
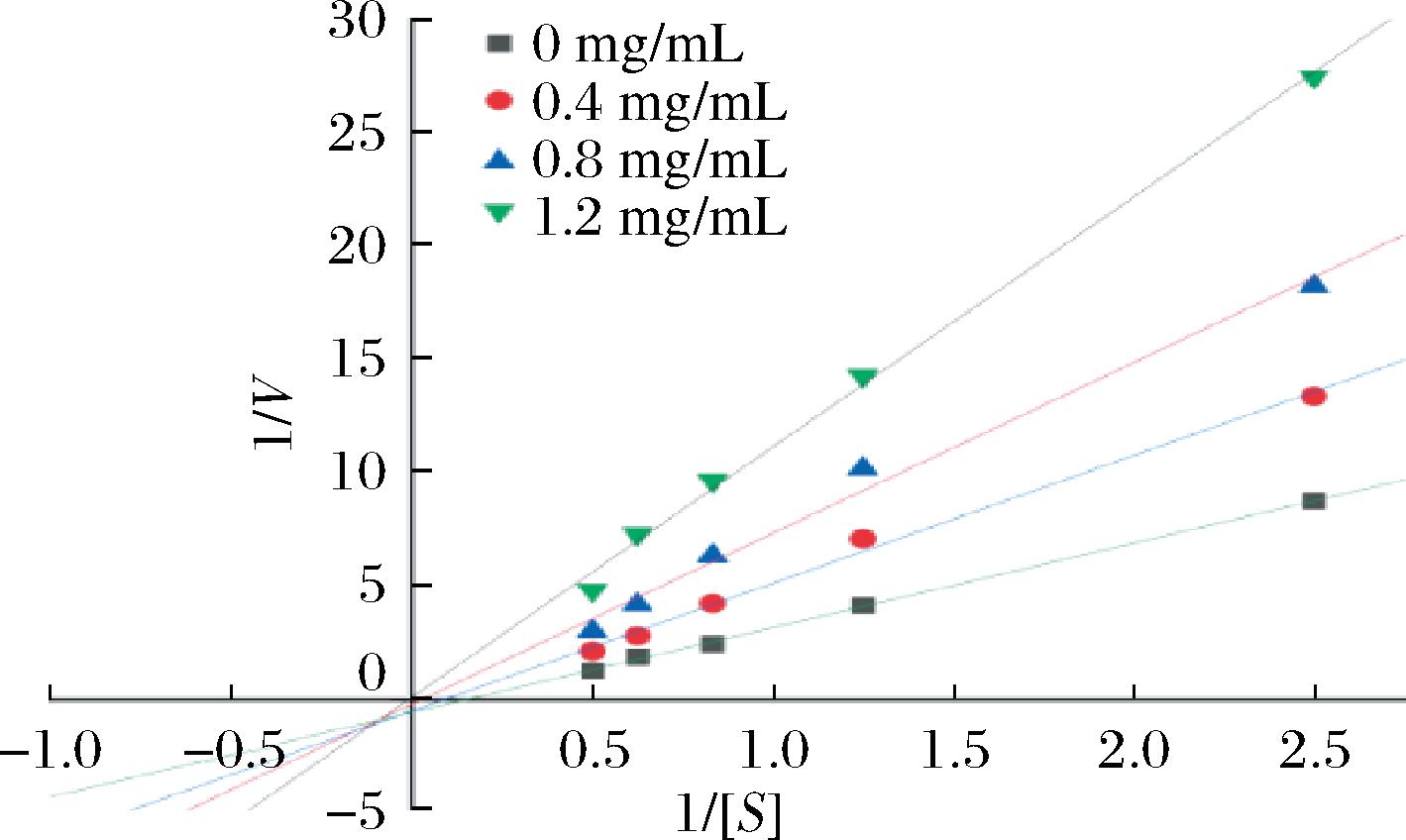
图3 抑制作用的双倒数图
Fig.3 Double reciprocal diagram of inhibition
2.4 荧光光谱分析
酶抑制作用的荧光光谱分析是一种利用荧光标记的检测技术,可以研究酶与抑制剂之间的结合情况和动力学参数[22]。荧光光谱法分动态猝灭和静态猝灭两种,前者是荧光物质与猝灭剂激发态碰撞降低荧光强度,后者是荧光物质与猝灭剂基态配合降低荧光强度和吸收光谱。比较吸收光谱和发射光谱可判断酶抑制作用的猝灭类型[23]。由图4可知,在波长300~400 nm,荧光强度均随AX浓度的增加而减小,且经公式(4)计算,AX与α-淀粉酶在18 ℃和37 ℃的猝灭速率常数Kq分别为1.02×1011和1.28×1011,随温度增加而减小,且大于最大散射碰撞淬灭常数2×1010 L/(mol·s)。因此AX与α-淀粉酶发生了静态猝灭[24]。并且,随着AX浓度的变化,荧光猝灭效果更加明显,AX浓度的增加,可能会促进更多蛋白酶残基参与AX的结构嵌合,使复合物结合更牢固。
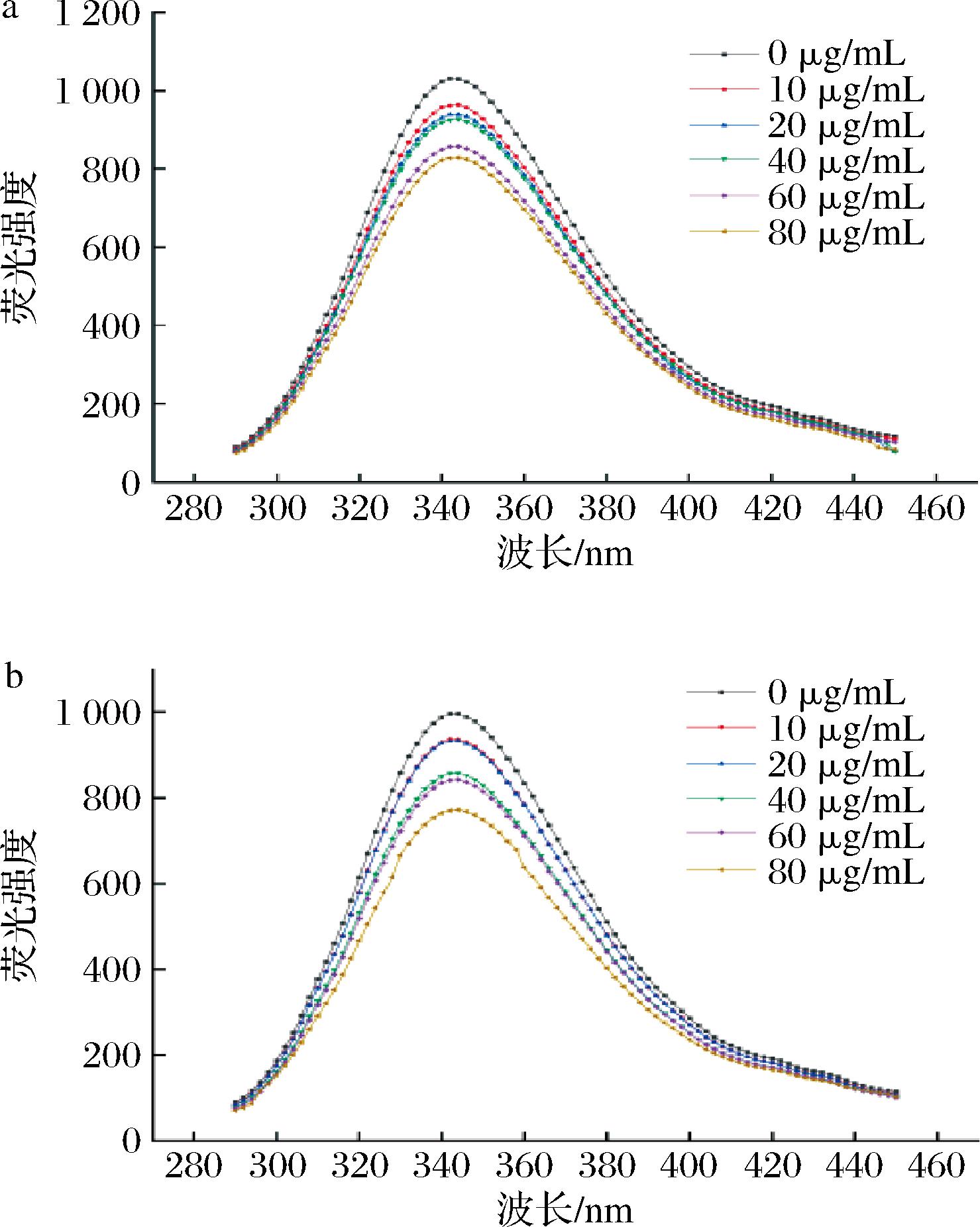
a-18 ℃;b-37 ℃
图4 AX粗提物、纯化物与α-淀粉酶在18 ℃和 37 ℃的荧光光谱图
Fig.4 AX crude extract, purified substance and α-fluorescence spectra of amylase at 18 ℃ and 37 ℃
2.5 酵解过程中pH的变化分析
实验研究了AX纯化物的酵解特征,其中pH的变化是模拟人粪便发酵模型的关键指标之一,可以反映AX的发酵过程和程度,并评价AX的性能[25]。图5为不同时间点的pH变化情况,可以观察到在结肠发酵的过程中,2组样品的pH值都有明显的下降趋势。与空白对照相比,样品组从初始的8.8降到24 h时的5.1左右。而且在相同的发酵时间条件下,AX组的pH值普遍低于对照组的pH值,其实验结果与KAUR等[26]实验结果一致,这可能是由于AX组在发酵过程中产生了更多的SCFAs,从而降低了培养液的pH值。这一结果说明,AX具有调节结肠发酵环境的pH值的作用。
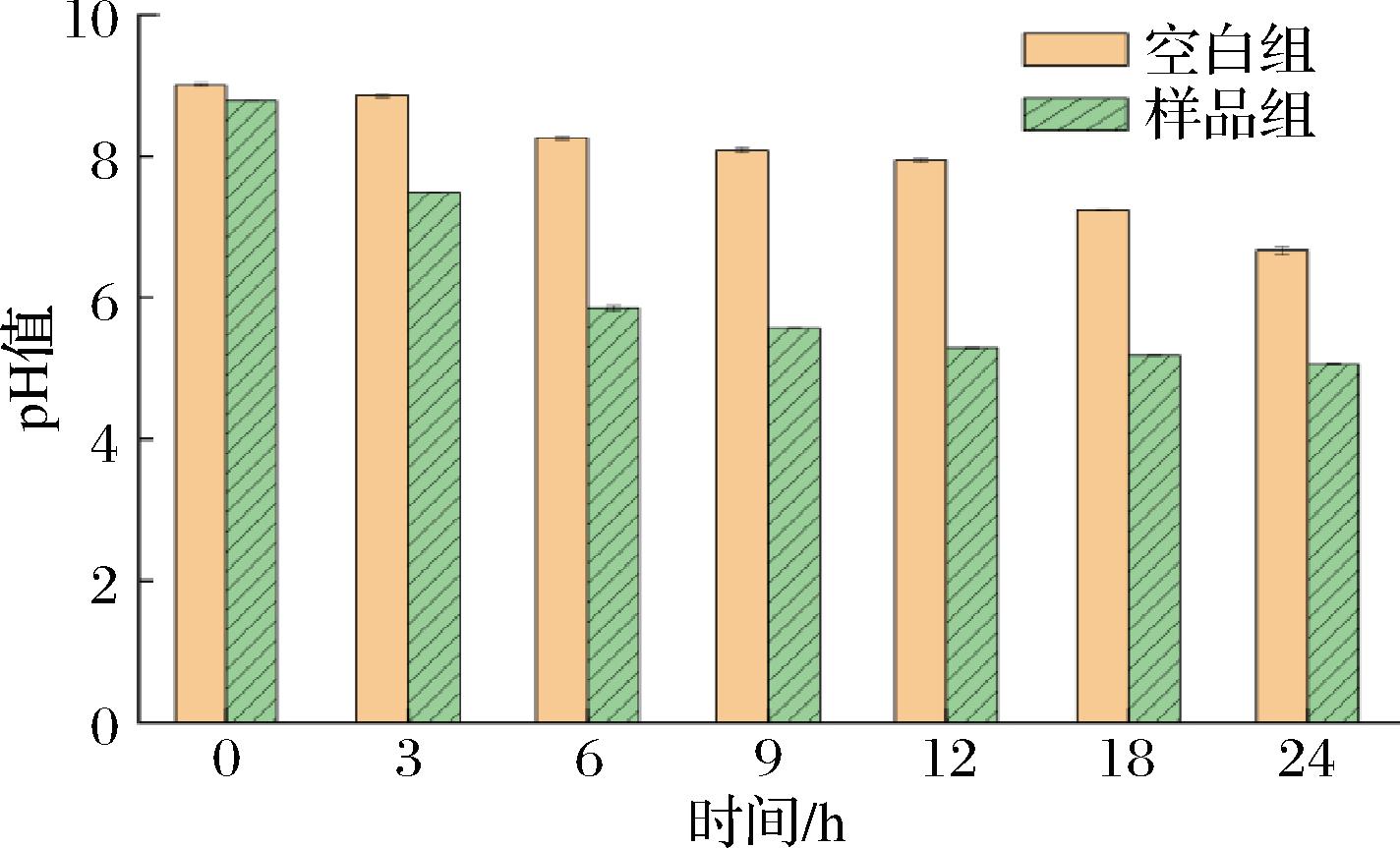
图5 不同时间内pH变化情况
Fig.5 pH change in different time
2.6 酵解过程中SCFAs的变化分析
SCFAs作为发酵的主要代谢产物,在肠道屏障功能中发挥重要作用,它通过调节腔内pH值、黏液产生,为上皮细胞提供燃料和影响黏膜免疫功能来实现[27]。因为SCFAs是肠道内稳态的一个重要指标,与人类健康之间有很强的联系。近年来,SCFAs是代谢靶点的观点被广泛接受。因此,实验采用气相色谱法测定发酵过程中(0、3、6、12、18、24 h)中SCFAs的产生,以评估AX对肠道微环境的潜在影响(图6)。
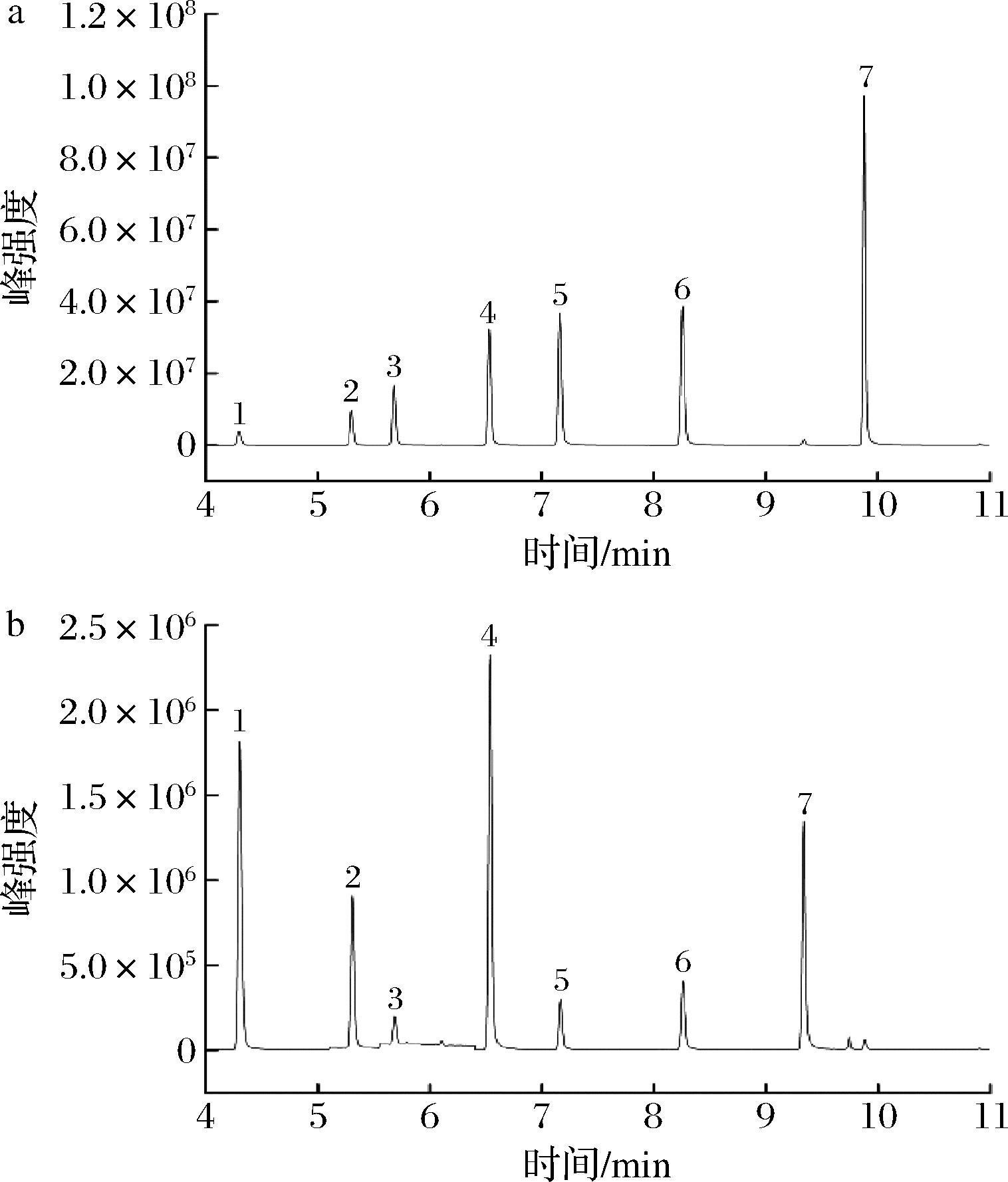
a-混标液;b-样品
图6 SCFAs混标液及样品气相色谱图
Fig.6 Gas chromatogram of SCFAs standard curve and sample
注:1为乙酸,2为丙酸,3为异丁酸,4为丁酸,5为异戊酸, 6为戊酸,7为己酸。
由表3可知,在实验期间,AX结肠发酵组的总SCFAs含量随着发酵时间的延长而增加,在发酵24 h后,SCFAs总含量达到最高值,为1 705.74 μg/mL,是初始发酵组的3.5倍。而空白对照(未添加AX)在不同时间内SCFAs总含量与初始发酵组相比无明显变化。结肠发酵组中含量最高、变化最大的是乙酸、丙酸、丁酸等,占SCFAs总含量的90%以上,而已酸无明显变化。WONG等[28]研究表明,在结肠中,膳食纤维发酵成SCFAs(尤其是乙酸、丙酸和丁酸)能够改善菌群组成并降低患结肠相关疾病以及某些代谢综合征(如肥胖、糖尿病、慢性肾脏疾病和全身性炎症)的风险。SCFAs中,特别是丙酸和丁酸,具有良好的生理活性。除了为结肠细胞提供能量外,还在信号传递中发挥重要作用。SCFAs可刺激肠道L细胞分泌饱腹感诱导激素肽酪氨酸酪氨酸、胰高血糖素样肽-1,抑制炎症反应。丙酸被门静脉吸收后,在肝脏中抑制一个或多个代谢途径,通过减少羟甲基戊二酰辅酶A还原酶活性和抑制乙酰辅酶A还原酶催化乙酸变成乙酰辅酶A的过程,从而降低血浆胆固醇含量、降低患心血管疾病的风险。丁酸可以抑制癌细胞的增殖和加快凋亡,而不影响正常上皮细胞的增殖和分化。丁酸的存在被认为对结肠癌患者有保护作用。因此,将适当的AX引入肠道,以确保肠道细菌产生更高的丁酸或丙酸是有益的。并且根据AX在不同发酵时间内SCFAs的变化情况表明,AX能够显著促进肠道微生物产生SCFAs,有利于维持肠道健康和代谢平衡。
表3 不同发酵时间内各发酵液中SCFAs含量 单位:μg/mL
Table 3 Content of SCFAs in fermentation broth at different fermentation time
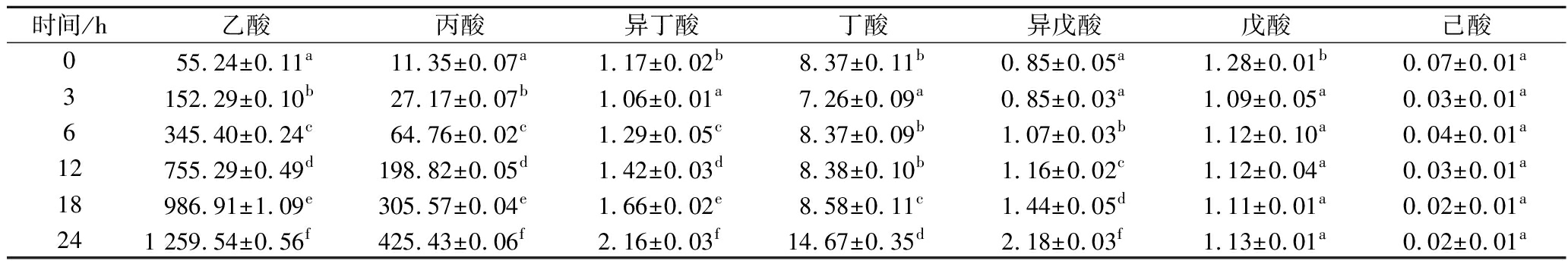
时间/h乙酸丙酸异丁酸丁酸异戊酸戊酸己酸055.24±0.11a11.35±0.07a1.17±0.02b8.37±0.11b0.85±0.05a1.28±0.01b0.07±0.01a3152.29±0.10b27.17±0.07b1.06±0.01a7.26±0.09a0.85±0.03a1.09±0.05a0.03±0.01a6345.40±0.24c64.76±0.02c1.29±0.05c8.37±0.09b1.07±0.03b1.12±0.10a0.04±0.01a12755.29±0.49d198.82±0.05d1.42±0.03d8.38±0.10b1.16±0.02c1.12±0.04a0.03±0.01a18986.91±1.09e305.57±0.04e1.66±0.02e8.58±0.11c1.44±0.05d1.11±0.01a0.02±0.01a241 259.54±0.56f425.43±0.06f2.16±0.03f14.67±0.35d2.18±0.03f1.13±0.01a0.02±0.01a
注:不同小写字母表示差异显著(P<0.05)。
3 结论
实验研究了从刺梨果渣中提取的AX的降糖及酵解特征。在降糖活性研究中,采用了多种实验方法,包括分子对接、酶抑制、酶动力学、荧光光谱,从不同角度评价AX对α-淀粉酶的抑制能力及作用原理。分子对接结果显示小分子与α-淀粉酶之间通过氢键等作用结合而发挥抑制活性。体外酶抑制实验表明,AX对α-淀粉酶具有一定的抑制作用,其抑制类型为混合型抑制,且AX与酶发生静态猝灭。在结肠发酵的过程中,AX发酵前后pH值有明显的下降趋势。从初始的8.8降到24 h时的5.1左右。而且在相同的发酵时间条件下,AX组的pH值普遍低于对照组,SCFAs含量在发酵过程中显著增加,24 h后达到1 705.74 μg/mL,是初始发酵组的3.5倍。其中含量最高、变化最大的是乙酸、丙酸、丁酸等,占SCFAs总含量的90%以上,而已酸无明显变化。因AX对α-淀粉酶有较好的抑制能力,且SCFAs在维持宿主肠道稳态和健康状态方面起着关键作用,以上表明AX有望成为一种具有降糖及促进肠道健康的功能性食品。总之,研究结果揭示了AX的潜在健康益处,为进一步研究和开发提供参考,但刺梨果渣中富含多种功能活性成分,除了本文所研究的降糖、体外模拟酵解,还可以进行抑菌、抗肿瘤、降尿酸等研究,从而更好地开发利用刺梨果渣。
[1] 潘泓伊. 刺梨果实中主要成分的提取分离及提取机制研究[D].哈尔滨:东北林业大学, 2021. PAN H Y.Enhanced extraction and separation process of main phytochemicals from Rosa roxburghii Tratt and extraction mechanism[D].Harbin:Northeast Forestry University, 2021.
[2] 韩会庆, 朱健, 苏志华.气候变化对贵州省刺梨种植气候适宜性影响[J].北方园艺, 2017(5):161-164. HAN H Q, ZHU J, SU Z H.Effects of climate change on climate suitability of Rosa roxburghii cultivation in Guizhou Province[J].Northern Horticulture, 2017(5):161-164.
[3] 付阳洋, 刘佳敏, 卢小鸾, 等.刺梨主要活性成分及药理作用研究进展[J].食品工业科技, 2020, 41(13):328-335;342. FU Y Y, LIU J M, LU X L, et al.Research progress on main active components and pharmacological effects of Rosa roxburghii Tratt[J].Science and Technology of Food Industry, 2020, 41(13):328-335;342.
[4] 吕佳敏, 刘同亭, 田瑛.刺梨的主要医学功效及应用研究进展[J].实用医药杂志, 2018, 35(4):370-372. LV J M, LIU T T, TIAN Y.Research progress on main medical effect and application of Cili[J].Practical Journal of Medicine &Pharmacy, 2018, 35(4):370-372.
[5] 张灿, 郭依萍, 田艾,等.刺梨果渣及其膳食纤维提取物对面条品质的影响[J].食品与发酵工业, 2023, 49(8):105-112. ZHANG C, GUO Y P, TIAN A, et al.Effects of Rosa roxburghii Tartt pomace and dietary fiber extract on noodle quality[J].Food and Fermentation Industries, 2023, 49(8):105-112.
[6] MENDIS M, LECLERC E, SIMSEK S.Arabinoxylans, gut microbiota and immunity[J].Carbohydrate Polymers, 2016, 139:159-166.
[7] CHEN Z Y, LI S S, FU Y F, et al.Arabinoxylan structural characteristics, interaction with gut microbiota and potential health functions[J].Journal of Functional Foods, 2019, 54:536-551.
[8] POLO A, ALBIAC M A, DA ROS A, et al.The effect of hydrolyzed and fermented Arabinoxylan-oligo saccharides (AXOS) intake on the middle-term gut microbiome modulation and its metabolic answer[J].Nutrients, 2023, 15(3):590.
[9] SCHUPFER E, PAK S C, WANG S Y, et al.The effects and benefits of arabinoxylans on human gut microbiota:A narrative review[J].Food Bioscience, 2021, 43:101267. [10] WANG L, ZHANG B, XIAO J, et al.Physicochemical, functional, and biological properties of water-soluble polysaccharides from Rosa roxburghii Tratt fruit[J].Food Chemistry, 2018, 249:127-135.
[11] NIE Q X, HU J L, CHEN H H, et al.Arabinoxylan ameliorates type 2 diabetes by regulating the gut microbiota and metabolites[J].Food Chemistry, 2022, 371:131106.
[12] 谷春梅, 尹佳玉, 姜雷.酶法提取对玉米皮阿拉伯木聚糖组成及分子质量分布的影响[J].食品科学, 2019, 40(6):28-34. GU C M, YIN J Y, JIANG L.Influence of enzymatic extraction on the composition and molecular mass distribution of arabinoxylans in maize bran[J].Food Science, 2019, 40(6):28-34.
[13] 马福敏, 顾佳.复合酶法提取鲜玉米皮阿拉伯木聚糖的研究[J].食品研究与开发, 2019, 40(24):106-109. MA F M, GU J.Study on double-enzymatic extraction of arabinoxylan from fresh corn fiber[J].Food Research and Development, 2019, 40(24):106-109.
[14] 姜玉莹. 玉米麸皮阿拉伯木聚糖的提取、纯化及抗炎活性研究[D].长春:吉林农业大学, 2019. JIANG Y Y.Extraction, purification and anti-inflammatory activity of corn bran arabinoxylan[D].Changchun:Jilin Agricultural University, 2019.
[15] 刘磊, 李科, 郝霞, 等.黄芪药渣中阿拉伯木聚糖(AX-Ⅰ-1)的提取纯化、结构分析及体外抗氧化作用[J].高等学校化学学报, 2016, 37(12):2168-2175. LIU L, LI K, HAO X, et al.Extraction, separation, structural analysis and antioxidant activity in vitro of arabinoxylans(AX-Ⅰ-1) from the residue of Astragalus root[J].Chemical Journal of Chinese Universities, 2016, 37(12):2168-2175.
[16] 赵梦丽. 小麦阿拉伯木聚糖益生与免疫调节活性研究[D].北京:中国农业科学院, 2015. ZHAO M L.Study on prebiotic activity and immunomodulatory activity of wheat arabinoxylans[D].Beijing:Chinese Academy of Agricultural Sciences, 2015.
[17] 王闪. 酶法合成绿原酸酰化衍生物及其抗氧化和α-淀粉酶/葡萄糖苷酶抑制活性研究[D].无锡:江南大学, 2021. WANG S.Study on antioxidant andα-amylase/glucosidase inhibition properties of Ca acylated derivatives synthetized by enzyme[D].Wuxi:Jiangnan University, 2021.
[18] 林宝妹, 洪佳敏, 邱珊莲, 等.嘉宝果果皮提取物体外降糖活性研究[J].南方农业学报, 2020, 51(2):376-384. LIN B M, HONG J M, QIU S L, et al.In vitro studies on the hypoglycemic effect of jaboticaba peel extract[J].Journal of Southern Agriculture, 2020, 51(2):376-384.
[19] 李琼, 陈磊, 韦庆益,等.柚皮素与α-淀粉酶相互作用的研究[J].现代食品科技, 2014,30(2):58-61;94. LI Q, CHEN L, WEI Q Y, et al.Interaction of naringenin and α-amylase[J].Modern Food Science and Technology, 2014,30(2):58-61;94.
[20] ZHANG J J, DING W Z, TANG Z P, et al.Identification of the effective α-amylase inhibitors from Dalbergia odorifera:Virtual screening, spectroscopy, molecular docking, and molecular dynamic simulation[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2022, 280:121448.
[21] 陈光静. 方竹笋的加工废笋渣中多糖的分离纯化和结构解析及其生物活性研究[D].重庆:西南大学, 2019. CHEN G J.Isolation, purification, structural identification and bioactivity of polysaccharides from bamboo shoots(Chimonobambusa quadrangularis)processing by-products[D].Chongqing:Southwest University, 2019.
[22] ZENG L, DING H F, HU X, et al.Galangin inhibits α-glucosidase activity and formation of non-enzymatic glycation products[J].Food Chemistry, 2019, 271:70-79.
[23] 肖会芝. 天然多酚对胰蛋白酶和α-葡萄糖苷酶抑制机制的研究[D].重庆:重庆大学, 2016. XIAO H Z.Comparative evaluation of natural polyphenols inhibiting α-glucosidase and trypsin[D].Chongqing:Chongqing University, 2016.
[24] FEI Q Q, GAO Y, ZHANG X, et al.Effects of Oolong tea polyphenols, EGCG, and EGCG3″Me on pancreatic α-amylase activity in vitro[J].Journal of Agricultural and Food Chemistry, 2014, 62(39):9507-9514.
[25] LIU C, DU P, CHENG Y L, et al.Study on fecal fermentation characteristics of aloe polysaccharides in vitro and their predictive modeling[J].Carbohydrate Polymers, 2021, 256:117571.
[26] KAUR A, ROSE D J, RUMPAGAPORN P, et al.In vitro batch fecal fermentation comparison of gas and short-chain fatty acid production using “slowly fermentable” dietary fibers[J].Journal of Food Science, 2011, 76(5):H137-H142.
[27] BLAAK E E, CANFORA E E, THEIS S, et al.Short chain fatty acids in human gut and metabolic health[J].Beneficial Microbes, 2020, 11(5):411-455.
[28] WONG J M W, DE SOUZA R, KENDALL C W C, et al.Colonic health:Fermentation and short chain fatty acids[J].Journal of Clinical Gastroenterology, 2006, 40(3):235-243.