全蛋液的传统巴氏杀菌过程主要以传导加热为主,为保证管路中心达到蛋液杀菌温度,会导致管壁区域物料的过度加热并造成热量冗余。高强度热处理会使全蛋液中热敏性蛋白质变性,致使全蛋液的功能特性受损、品质劣变。此外,管路内部温度梯度方向也加剧了管路结焦现象的发生,从而导致管路清洗难度增大和能效降低等问题。在保障微生物安全性的前提下,降低热敏蛋白质在巴氏杀菌处理过程中的热损伤程度,对全蛋液的加工及在食品领域中的应用尤为重要。
微波作为一种新型的物理场加工方式,凭借其体积式靶向加热原理,能够实现无需传热介质的选择性加热过程,在缩短热处理时间的同时可以针对性的改善传统巴氏杀菌方法的缺陷。微波的冷热点现象一直是影响其进一步应用与发展的障碍。连续式微波热处理通过改善内部电磁场分布情况,可以有效改善温度分布均匀性,减少热失控[1-2]。目前连续式微波巴氏杀菌技术的研究多集中在牛奶和果汁上,尽管在一定程度上证明了其商业可行性,但连续式微波巴氏杀菌技术的产业化应用还处于起步阶段,鲜有适用于流体食品的实验室或工业规模的连续式微波处理系统;针对不同类型食品的微波巴氏杀菌方法的工艺开发并不充分;亦缺乏全蛋液的连续式微波杀菌的研究,对于杀菌效果和热敏蛋白质的影响还需要进一步探究[3]。
因此,本研究首先构建了全蛋液的连续式微波巴氏杀菌系统,探究了不同微波功率-温度组合下的微生物致死效果、微波杀菌动力学及全蛋液蛋白质变化,全蛋液微波巴氏杀菌的研究有助于解决传统巴氏杀菌方法的痛点,为工业生产提供导向性。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
全蛋液,苏州欧福蛋业股份有限公司;生鸡蛋,北京正大蛋业有限公司;大肠杆菌CGMCC1.8745、金黄色葡萄球菌CGMCC1.1861、沙门氏菌CICC21482,保藏于江南大学生物技术中心。
1.1.2 试剂
去离子水,无锡华晶飘之霖有限公司;Tris、甘氨酸、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS),国药集团化学试剂有限公司;DTNB,美国西格玛奥德里奇有限公司;BCA蛋白浓度增强型测定试剂盒,赛默飞世尔科技有限公司;LB、结晶紫中性红胆盐琼脂(violet red bile agar,VRBA)、木糖赖氨酸脱氧胆酸盐(xylose lysine desoxycholate,XLD)、胰蛋白胨大豆肉汤(tryptone soy broth,TSB)培养基,青岛海博生物技术有限公司。
1.2 仪器与设备
UV-3600紫外分光光度计,日本Shimazu公司;F-7000荧光光谱仪,美国HORIBA公司;FX36型高速乳化均质机,德国弗鲁克公司;XO-SM400微波反应体系,南京先欧仪器制造有限公司;WT600-2J蠕动泵,苏州诺方科精密设备有限公司;FOT-L-SD光纤温度传感器,加拿大FISO公司;MLS-3750高压蒸汽灭菌锅,三洋电子有限公司;BSC-1000 A2生物安全柜,苏州安泰空气技术有限公司;HWS-150型恒温恒湿培养箱,上海森信实验仪器有限公司;ZQZY-HC型振荡培养箱,上海知楚仪器。
1.3 实验方法
1.3.1 蛋液原料制备
活化后菌液离心5 min(6 000×g,4 ℃),菌泥重新悬浮于全蛋液中,使样品中的菌体浓度达到107~108 CFU/mL,用于杀菌实验。用低速搅拌器对生鸡蛋进行均质处理,过80目筛网除杂,得到新鲜均一的全蛋液用于品质特性实验。
1.3.2 微波巴氏杀菌系统构建
如图1所示,体系主要包括:原料桶、磁力搅拌器、蠕动泵、微波腔体(0.5 m×0.5 m×0.5 m)、4个矩形波导及磁控管、硅胶管、温度传感器、水浴锅、酒精灯等。管路内径为0.010 m,外径为0.015 m,螺旋管匝数为3.5,直径为0.130 m,螺距为0.030 m。微波腔内管路的有效长度为2.56 m。为了建立微波加热的稳态流动条件,全蛋液在体系中预循环一段时间后开启微波,通过调节流速和微波功率使蛋液达到所需杀菌温度(56、60、64 ℃),腔体出口处设置取样点,当蛋液达到所需温度时立即取样,迅速置于水浴锅中密封保温处理(1、2、3 min),随后置于冰水浴中冷却。试验中所使用的器材均经过灭菌处理,取样处放置酒精灯保证无菌环境,所有接种、涂布等操作步骤均在生物安全柜中进行。6组微波巴氏杀菌条件LPT 56 ℃、LPT 60 ℃、LPT 64 ℃、HPT 56 ℃、HPT 60 ℃和HPT 64 ℃对应流速分别为0.146、0.131、0.119、0.292、0.263、0.239 m/s。低功率微波巴氏杀菌(low power treatment,LPT)和高功率微波巴氏杀菌(high power treatment,HPT)分别指实验所用微波功率密度8 W/mL和16 W/mL,56、60、64 ℃指杀菌温度,例如LPT 56 ℃指的是在8 W/mL的微波功率密度下使蛋液样品达到56 ℃的处理条件,RAW指未处理全蛋液。
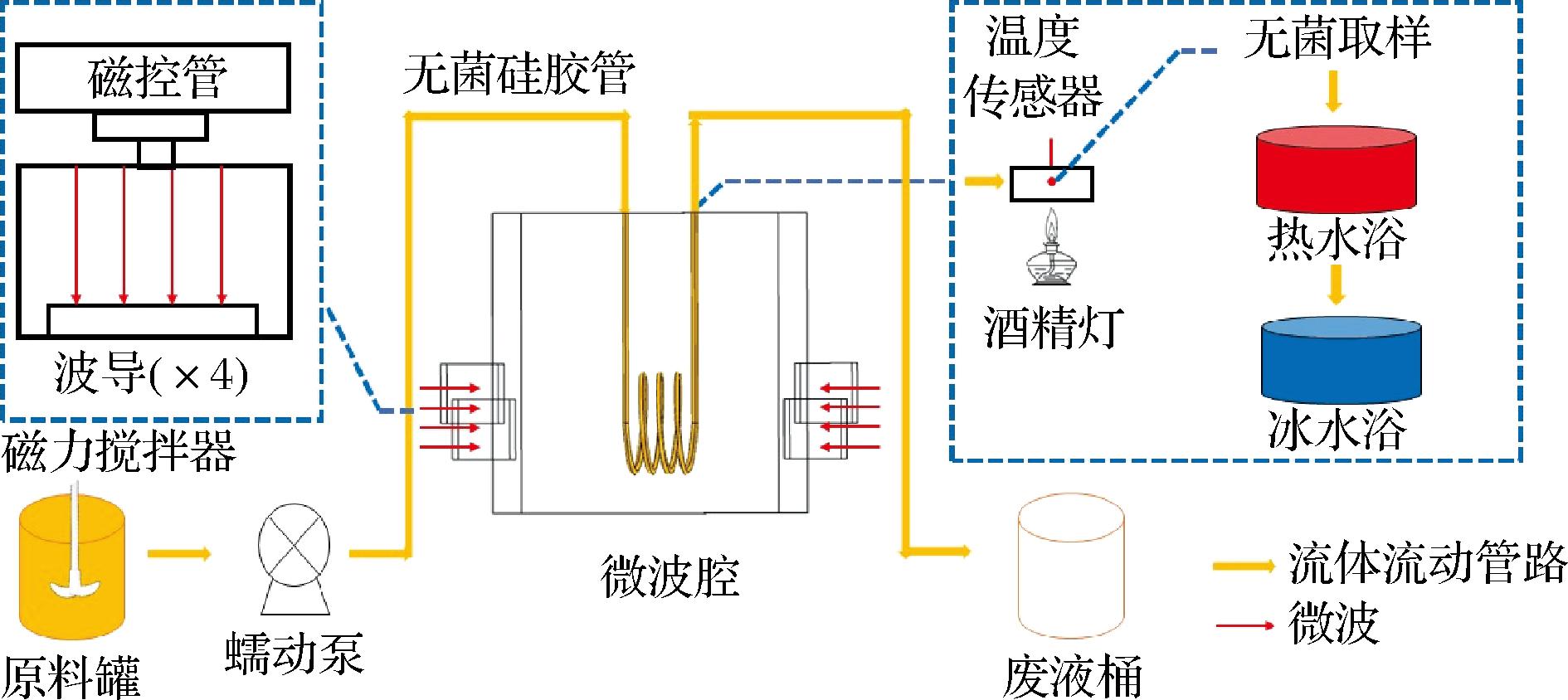
图1 微波巴氏杀菌系统原理图
Fig.1 Schematic diagram of the microwave pasteurization system
1.3.3 微生物培养与计数
根据GB 4789.1—2016《食品安全国家标准 食品微生物学检验 总则》进行微生物的培养与计数,培养基选择:大肠杆菌-VRBA;沙门氏菌-XLD;金黄色葡萄球菌-TSB。
1.3.4 杀菌动力学
杀菌动力学的计算如公式(1)~公式(4)所示:
Log-Logistic模型[4]:
(1)
Log-linear+Shoulder模型[5]:
(2)
Log-linear+Tail模型[6]:
log10(N)=log10{[10log10(N0)-10log10(Nres)]× e(-kmax×t)+10log10(Nres)}
(3)
用均方根误差(root mean square error,RMSE)和R2来评价杀菌动力学模型的预测优度:
(4)
式中:α,曲线上渐近线,lg CFU/mL;ω,曲线下渐近线,lg CFU/mL;σ,最大失活速率,min-1;τ,最大失活速率对应杀菌时间的对数值;kmax,曲线对数线性部分的失活率,min-1;Sl,肩长,min;log10(N0),初始菌群预测对数,CFU/mL;log10(Nres),剩余菌群预测对数,CFU/mL;n,观测值的数量,个。
1.3.5 溶解度测定
样品离心15 min(10 000×g,4 ℃),取上清液和原样进行蛋白质含量测定,溶解度的计算如公式(5)所示[7]:
溶解度![]()
(5)
1.3.6 内源荧光光谱测定
首先用PBS(0.01 mol/L,pH 7.2)将样品稀释到0.5 mg/mL。激发和发射波长分别设定为280、300~500 nm,狭缝宽5 nm,扫描速度1 200 nm/min。PBS(0.01 mol/L,pH 7.2)作为空白对照[8]。
1.3.7 表面疏水性测定
用ANS荧光探针法对表面疏水性进行测定,用外源荧光强度大小来表示疏水性大小。取40 μL的8.0 mmol/L ANS溶液加入4 mL的稀释后的样品溶液中。室温下避光孵育20 min后进行荧光扫描。激发及发射波长分别为390、400 nm,狭缝宽5 nm,扫描速度1 200 nm/min[9]。
1.3.8 游离巯基含量测定
将样品与Tris-甘氨酸缓冲液以体积比1∶3混匀,加入40 μL Ellman试剂混匀,25 ℃水浴保温30 min后测定吸光度。Ellman试剂用作空白对照[10],游离巯基含量测定的计算如公式(6)所示:
游离巯基含量![]()
(6)
式中:A412为412 nm处吸光度;ρ为样品质量浓度,mg/mL;D为稀释倍数。
1.4 数据分析
每项实验至少重复3次,数据以均值±标准差的形式记录。使用Origin 2018C进行绘图,SPSS 21.0进行统计分析。使用Duncan’s multiple range test分析实验数据之间的显著性差异(P<0.05)。
2 结果与分析
2.1 微波巴氏杀菌动力学分析
螺旋连续式微波巴氏杀菌系统可以避免因电磁场分布不均匀和微波穿透深度短引起的加热不均匀现象,有效改善传质传热速率和温度分布均匀性,实现对全蛋液的均匀高效加热[11-12]。微波巴氏杀菌升温迅速,可在50 s内到达稳态(图2)。不同微波巴氏杀菌条件下大肠杆菌、沙门氏菌和金黄色葡萄球菌的存活率分别降低3.84~5.85 log10、4.11~6.19 log10和3.11~5.54 log10。金黄色葡萄球菌对巴氏杀菌处理的抗性略高于大肠杆菌和沙门氏菌,可能与革兰氏阳性和阴性细菌在结构和细胞壁分子组织上的差异有关,革兰氏阳性菌细胞壁上较厚的肽聚糖结构可以抑制失活[13]。
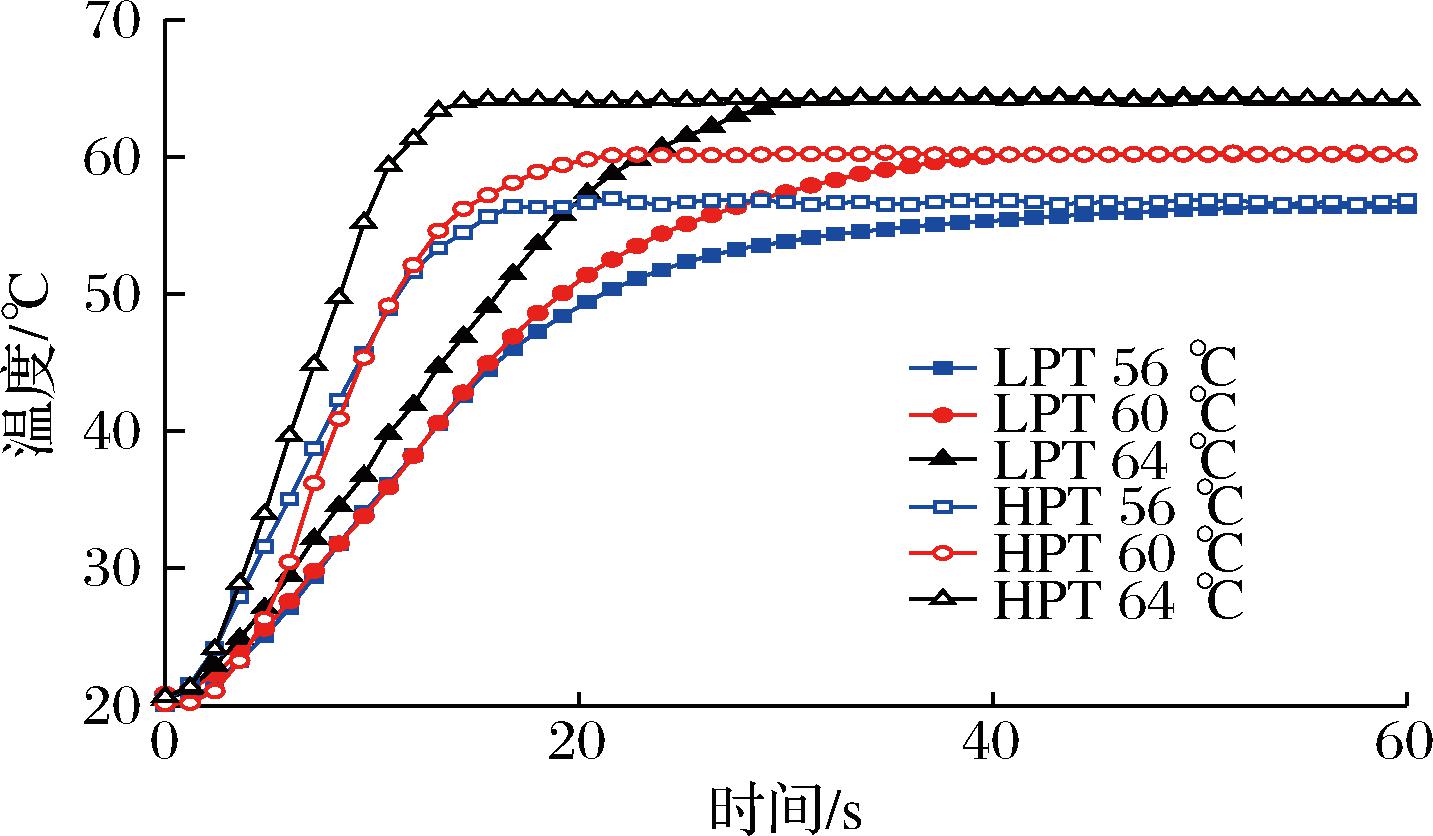
图2 微波巴氏杀菌处理升温曲线
Fig.2 Temperature-rising curve of microwave pasteurization treatments
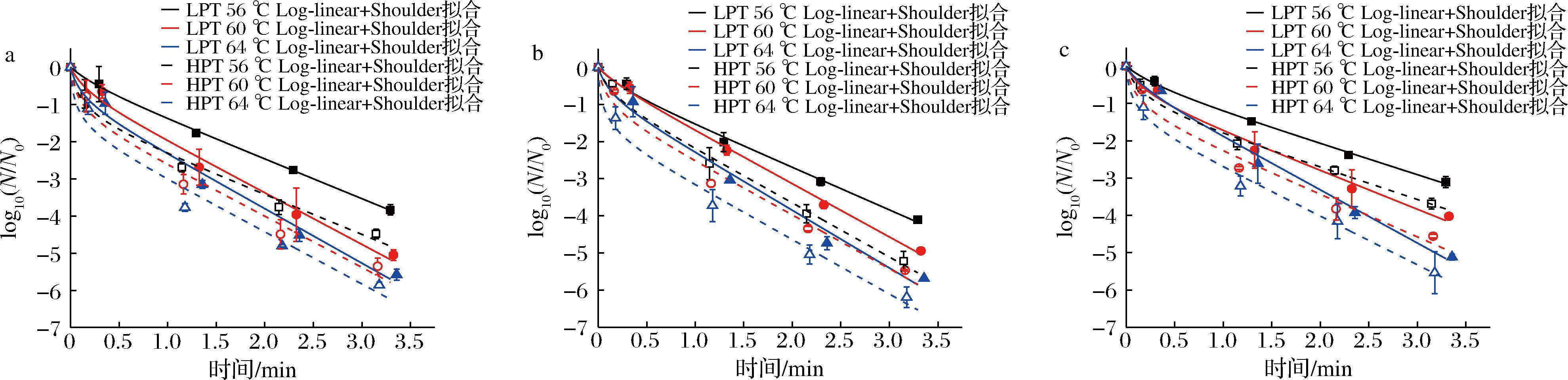
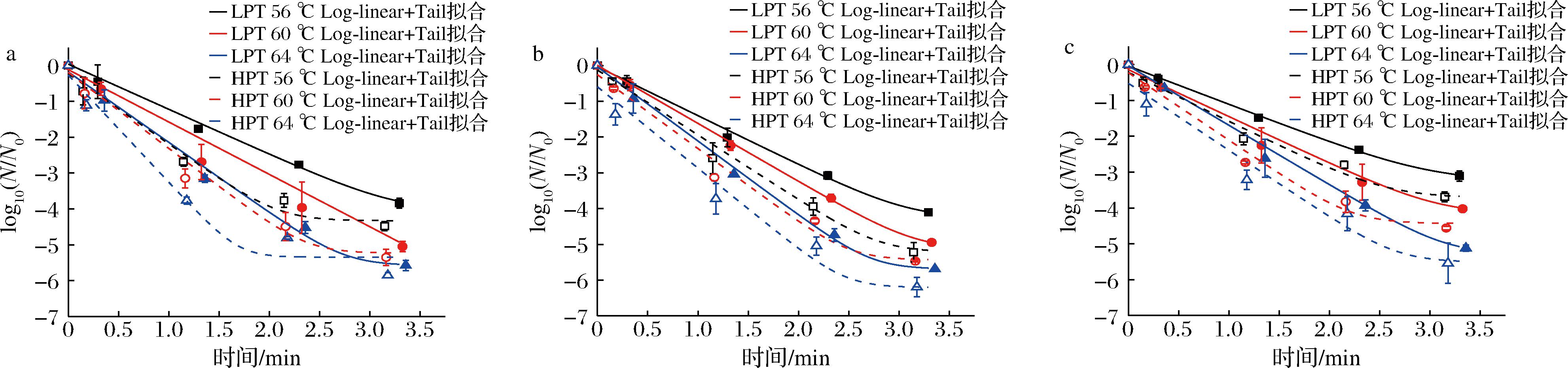
传统一级线性动力学模型只与时间相关,认为存活曲线呈线性趋势,然而非等温微波巴氏杀菌过程中,存活曲线呈现明显的非线性趋势(图3),这会导致使用线性模型拟合可能发生致死率过高或过低程度的预测,不能准确描述微生物的失活行为,因而本文使用3种非线性模型进行回归拟合分析[4-5]。图4~图6可以看出,Log-Logistic模型具有最好的拟合精度和稳定性(R2:0.998~0.999,RMSE:0.002~0.072),其次是Log-linear+Tail模型(R2:0.982~0.999,RMSE:0.026~0.298),Log-linear+Shoulder模型拟合效果相对较差(R2:0.980~0.999,RMSE:0.041~0.314)。本研究中存活曲线出现轻微拖尾现象,可能是由于较高耐热性的微生物细胞亚群的存在[14-15]。
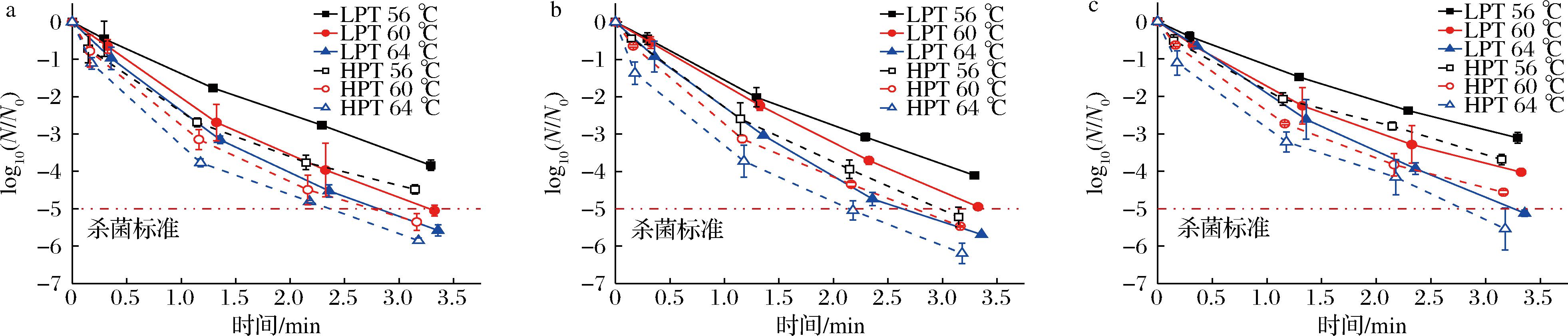
a-大肠杆菌;b-沙门氏菌;c-金黄色葡萄球菌
图3 微波巴氏杀菌处理下微生物存活曲线
Fig.3 Survival curves of microorganisms under microwave pasteurization treatments
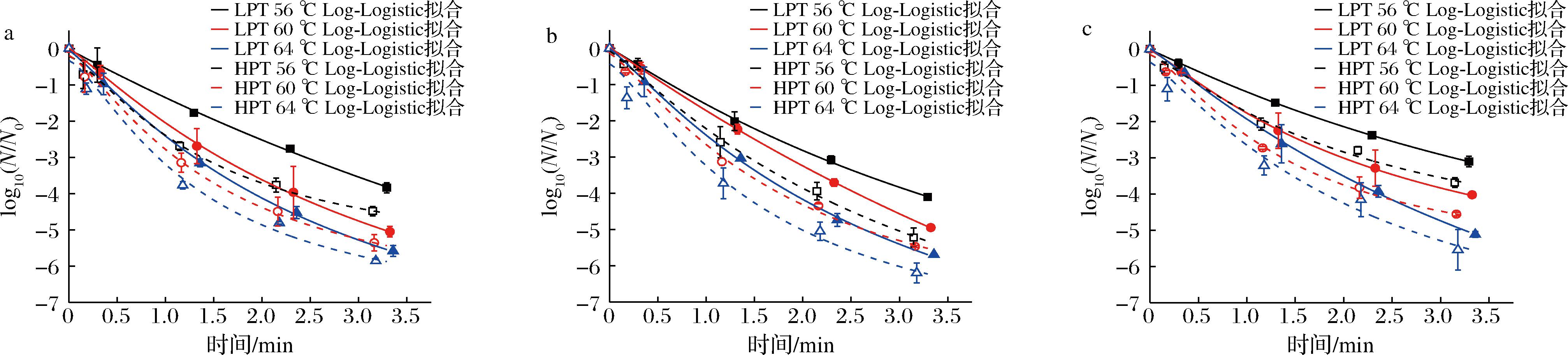
a-大肠杆菌;b-沙门氏菌;c-金黄色葡萄球菌
图4 微波巴氏杀菌处理下Log-Logistic模型拟合曲线
Fig.4 Fitting curves of the Log-Logistic model of microorganisms under microwave pasteurization treatments
a-大肠杆菌;b-沙门氏菌;c-金黄色葡萄球菌
图5 微波巴氏杀菌处理下Log-linear+Shoulder模型拟合曲线
Fig.5 Fitting curves of the Log-linear+Shoulder model of microorganisms under microwave pasteurization treatments
a-大肠杆菌;b-沙门氏菌;c-金黄色葡萄球菌
图6 微波巴氏杀菌处理下Log-linear+Tail模型拟合曲线
Fig.6 Fitting curves of the Log-linear+Tail model of microorganisms under microwave pasteurization treatments
2.2 微波巴氏杀菌对全蛋液蛋白质的影响
2.2.1 微波巴氏杀菌对蛋白质溶解度的影响
如表1所示,相较于未处理样品,微波巴氏杀菌并未使全蛋液的蛋白质溶解度降低。LPT处理下,蛋白质溶解度显著提高(P<0.05),功率密度相同处理温度不同的组别溶解度无显著差异(P>0.05),HPT处理下样品溶解度略低于LPT处理,但与未处理样品相比溶解度无显著差异(P>0.05)。
表1 微波巴氏杀菌全蛋液蛋白质溶解度
Table 1 Solubility of proteins in liquid whole egg under microwave pasteurization treatments
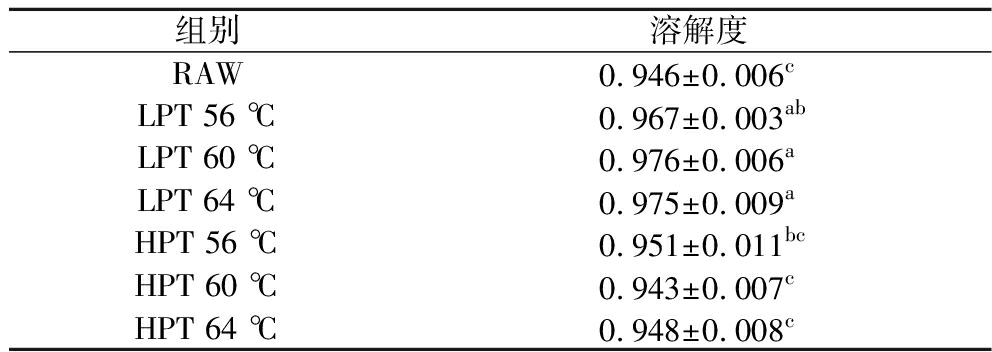
组别溶解度RAW0.946±0.006cLPT 56 ℃0.967±0.003abLPT 60 ℃0.976±0.006aLPT 64 ℃0.975±0.009aHPT 56 ℃0.951±0.011bcHPT 60 ℃0.943±0.007cHPT 64 ℃0.948±0.008c
注:小写字母为不同处理条件之间的显著差异(P<0.05)(下同)。
2.2.2 微波巴氏杀菌对蛋白质结构的影响
蛋白质荧光光谱图的变化有效表征其三级结构的变化。内源荧光光谱利用蛋白质自身具有的发色基团来检测荧光强度的变化[16],微波处理后样品的最大波长蓝移,表明微波处理影响了内部微环境的极性(图7)。微波处理后全蛋液样品的荧光强度降低,可能是由于微波促使蛋白质分子内部包埋的色氨酸残基暴露在强极性水溶液中,微环境极性增加,激发态和基态显色基团的能量受影响,从而造成本征荧光强度降低。
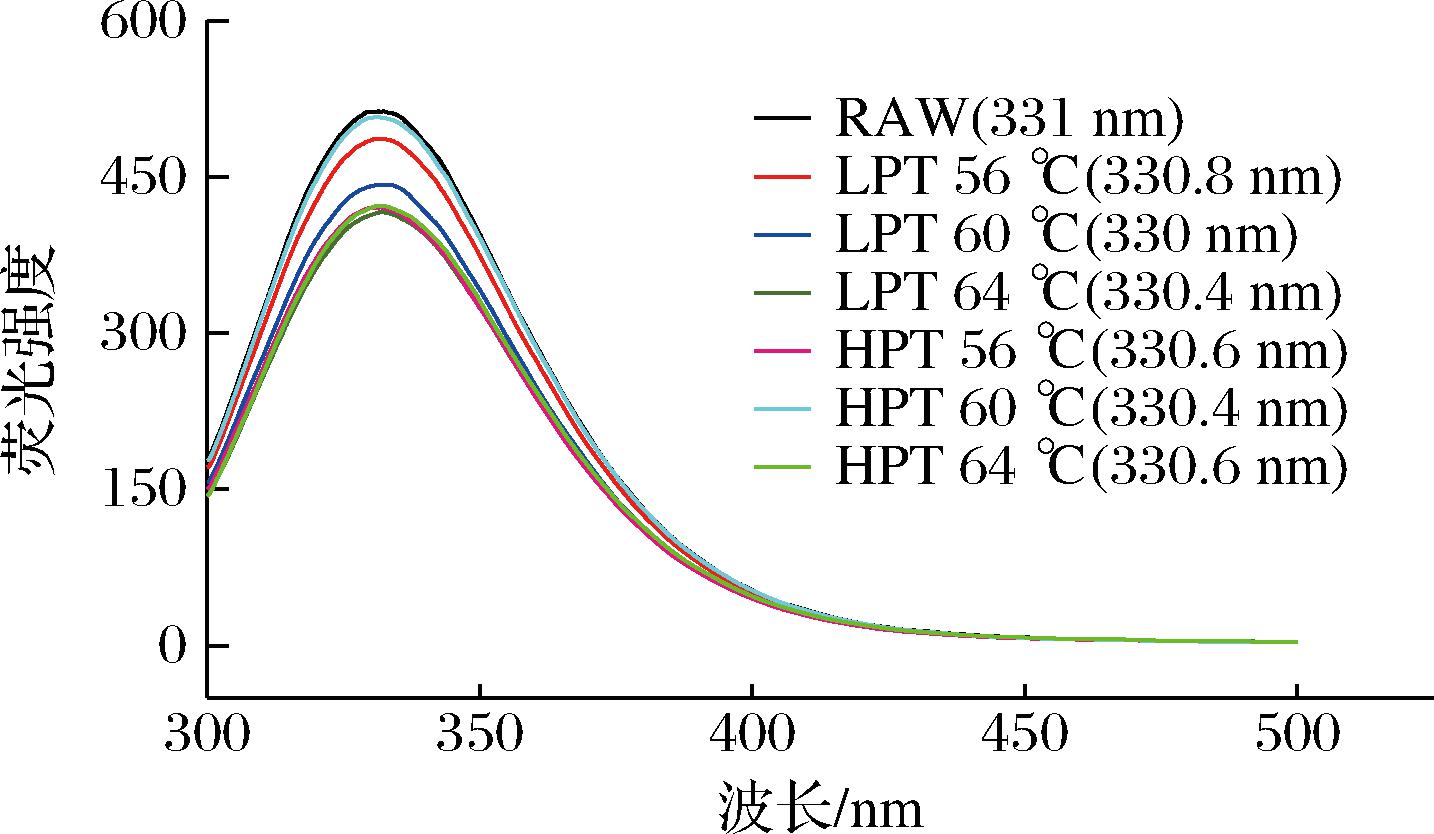
图7 微波巴氏杀菌全蛋液蛋白质内源荧光光谱
Fig.7 Endogenous fluorescent spectrometry of proteins in liquid whole egg under microwave pasteurization treatments
2.2.3 微波巴氏杀菌对蛋白质表面疏水性的影响
如图8所示,微波巴氏杀菌处理后全蛋液样品的外源荧光强度增加,说明微波巴氏杀菌处理促进了蛋白质分子展开,埋藏在分子内部的疏水链暴露,表面疏水性增加,有利于功能特性的改善[17]。
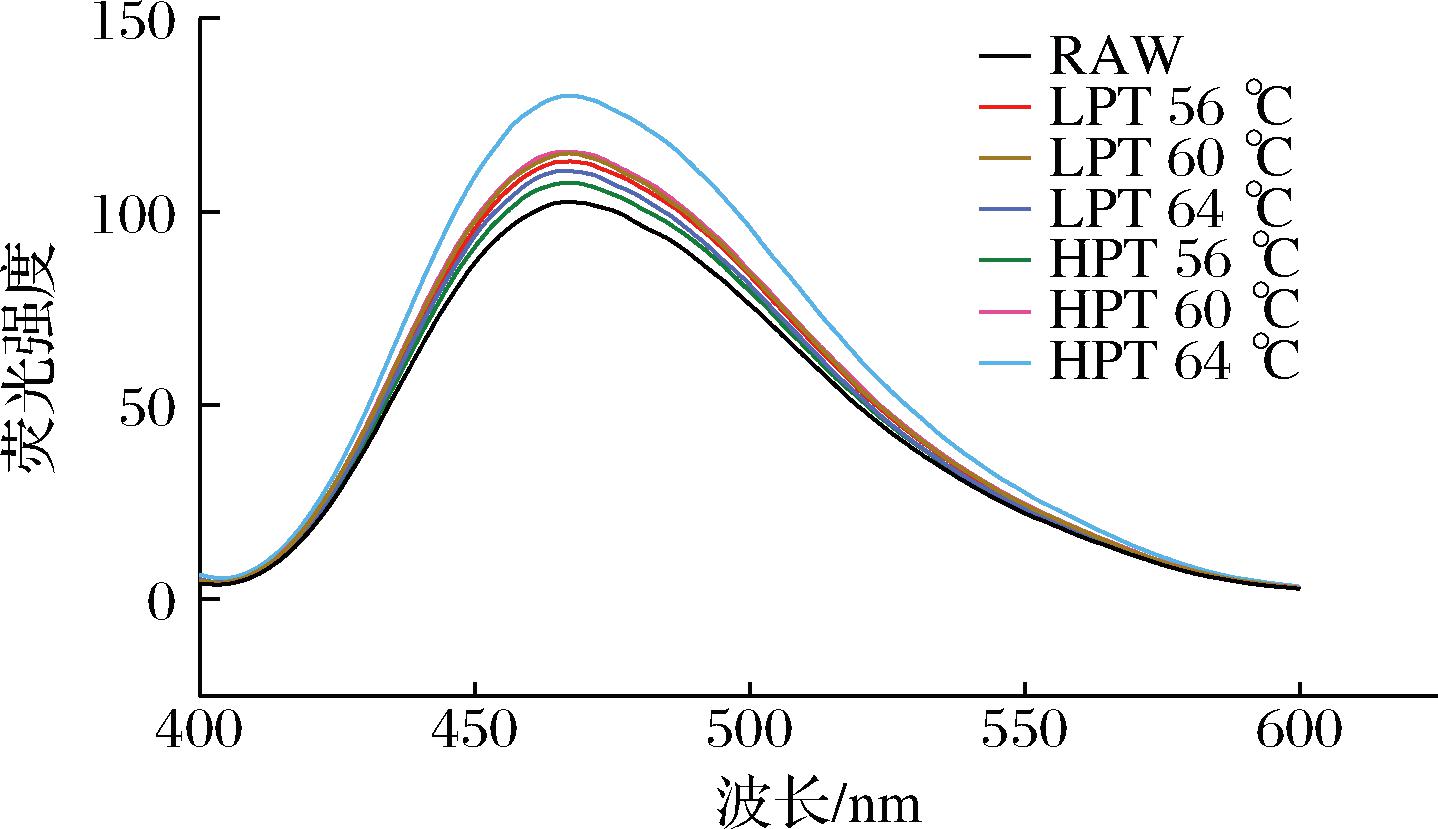
图8 微波巴氏杀菌全蛋液蛋白质表面疏水性
Fig.8 Surface hydrophobicity of proteins in liquid whole egg under microwave pasteurization treatments
2.2.4 微波巴氏杀菌对巯基含量的影响
巯基在蛋白质的凝胶、泡沫等特定结构的形成中起重要作用[7]。与未处理样品相比(表2),微波巴氏杀菌处理后的全蛋液样品巯基含量呈上升趋势,随着微波功率和处理温度的增加,巯基含量整体呈增加趋势(P<0.05)。可能是由于微波巴氏杀菌处理使蛋白质去折叠或离子化程度有所增加,游离巯基暴露,巯基含量增加[18-19]。
表2 微波巴氏杀菌全蛋液蛋白质巯基含量
Table 2 Sulfhydryl contents of proteins in liquid whole egg under microwave pasteurization treatments
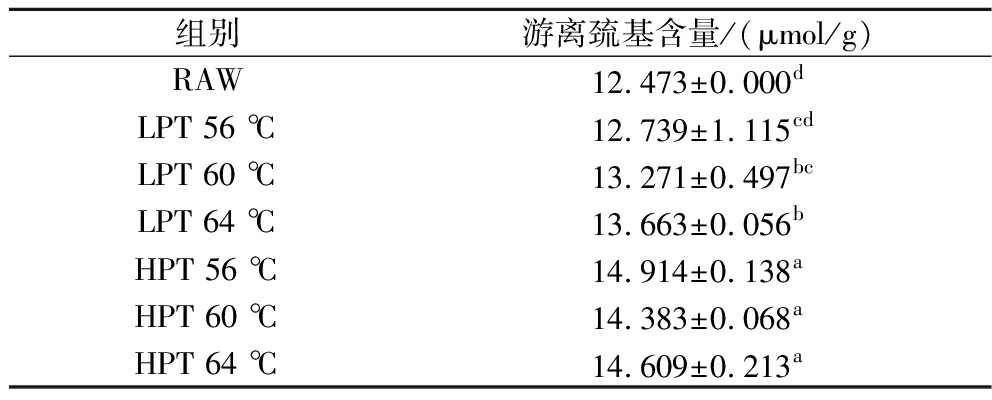
组别游离巯基含量/(μmol/g)RAW12.473±0.000dLPT 56 ℃12.739±1.115cdLPT 60 ℃13.271±0.497bcLPT 64 ℃13.663±0.056bHPT 56 ℃14.914±0.138aHPT 60 ℃14.383±0.068aHPT 64 ℃14.609±0.213a
3 结论与讨论
本文研究了全蛋液的微波巴氏杀菌,探究了不同微波功率-温度组合下的微生物致死效果、微波杀菌动力学及全蛋液蛋白质变化,具体内容如下:
a)微波巴氏杀菌升温时间短,可以有效缩短全蛋液在巴氏杀菌过程中的非等温加热滞后期。通过对微波功率密度及杀菌温度的调控,微波巴氏杀菌可以使大肠杆菌、沙门氏菌和金黄色葡萄球菌存活率降低5 log10以上,杀菌效果显著。
b)非线性模型是拟合非等温微波巴氏杀菌过程的有效模型(R2≥0.980,RMSE≤0.314)。Log-Logistic模型拟合精度和稳定性最好,Log-linear+Tail模型拟合效果好且变量少。模型拟合结果与存活曲线趋势呈现良好的一致性,进一步证明非线性模型的准确性和有效性。
c)微波诱导蛋白质分子适度展开,更多带电和极性基团暴露,溶解度有所提高,游离巯基含量增加,有利于全蛋液品质特性的改善。
微波巴氏杀菌针对性地弥补了全蛋液传统巴氏杀菌方法的缺陷,通过降低高温处理时间和热加工程度,减少全蛋液在热敏温度下的停留时间,降低蛋白质热损伤程度,有助于全蛋液品质的改善以及在食品加工领域的进一步应用。全蛋液微波巴氏杀菌的研究有助于解决传统巴氏杀菌方法的痛点,为工业生产提供导向性。连续式微波加热模式的开发以及在全蛋液杀菌领域中的应用,对黏稠态热敏性流体食品高效微波热处理技术的开发具有重要意义。
[1] GUZIK P, KULAWIK P, ZAJ![]() C M, et al.Microwave applications in the food industry:An overview of recent developments[J].Critical Reviews in Food Science and Nutrition, 2022, 62(29):7989-8008.
C M, et al.Microwave applications in the food industry:An overview of recent developments[J].Critical Reviews in Food Science and Nutrition, 2022, 62(29):7989-8008.
[2] 杨化宇, 张宇皓, 闫博文, 等.液态食品连续化微波加热过程的仿真模拟[J].中国食品学报, 2021, 21(7):170-178. YANG H Y, ZHANG Y H, YAN B W, et al.Simulation of continuous-flow microwave heating process of liquid foods[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(7):170-178.
[3] WU Y R, MU R Y, LI G H, et al.Research progress in fluid and semifluid microwave heating technology in food processing[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(4):3436-3454.
[4] MENDES-OLIVEIRA G, DEERING A J, SAN MARTIN-GONZALEZ M F, et al.Microwave pasteurization of apple juice:Modeling the inactivation of Escherichia coli O157:H7 and Salmonella typhimurium at 80-90 ℃[J].Food Microbiology, 2020, 87:103382.
[5] SONG W J, KANG D H.Influence of water activity on inactivation of Escherichia coli O157:H7, Salmonella typhimurium and Listeria monocytogenes in peanut butter by microwave heating[J].Food Microbiology, 2016, 60:104-111.
[6] IZQUIER A, G MEZ-L
MEZ-L PEZ V M.Modeling the pulsed light inactivation of microorganisms naturally occurring on vegetable substrates[J].Food Microbiology, 2011, 28(6):1170-1174.
PEZ V M.Modeling the pulsed light inactivation of microorganisms naturally occurring on vegetable substrates[J].Food Microbiology, 2011, 28(6):1170-1174.
[7] SHENG L, ZU L L, MA M H.Study of high pressure carbon dioxide on the physicochemical, interfacial and rheological properties of liquid whole egg[J].Food Chemistry, 2021, 337:127989.
[8] CHANG C H, SU Y J, GU L P, et al.Microwave induced glycosylation of egg white protein:Study on physicochemical properties and baking performance[J].Food Hydrocolloids, 2021, 118:106569.
[9] SHENG L, TANG G Y, WANG Q, et al.Molecular characteristics and foaming properties of ovalbumin-pullulan conjugates through the Maillard reaction[J].Food Hydrocolloids, 2020, 100:105384. [10] VAN DER PLANCKEN I, VAN LOEY A, HENDRICKX M E.Combined effect of high pressure and temperature on selected properties of egg white proteins[J].Innovative Food Science &Emerging Technologies, 2005, 6(1):11-20.
[11] ZHANG Y H, YANG H Y, YAN B W, et al.Continuous flow microwave system with helical tubes for liquid food heating[J].Journal of Food Engineering, 2021, 294:110409.
[12] TUTA S, PALAZO LU T K.Finite element modeling of continuous-flow microwave heating of fluid foods and experimental validation[J].Journal of Food Engineering, 2017, 192:79-92.
LU T K.Finite element modeling of continuous-flow microwave heating of fluid foods and experimental validation[J].Journal of Food Engineering, 2017, 192:79-92.
[13] JOHNSON ESUA O, SUN D W, AJANI C K, et al.Modelling of inactivation kinetics of Escherichia coli and Listeria monocytogenes on grass carp treated by combining ultrasound with plasma functionalized buffer[J].Ultrasonics Sonochemistry, 2022, 88:106086.
[14] GURTLER J B, JUNEJA V K, JONES D R, et al.Thermal inactivation kinetics of three heat-resistant Salmonella strains in whole liquid egg[J].Journal of Food Protection, 2019, 82(9):1465-1471.
[15] BAPTISTA I, ROCHA S M, CUNHA  , et al.Inactivation of Staphylococcus aureus by high pressure processing:An overview[J].Innovative Food Science &Emerging Technologies, 2016, 36:128-149.
, et al.Inactivation of Staphylococcus aureus by high pressure processing:An overview[J].Innovative Food Science &Emerging Technologies, 2016, 36:128-149.
[16] ZHAO J, TIAN Z, CHEN L.Effects of deamidation on aggregation and emulsifying properties of barley glutelin[J].Food Chemistry, 2011, 128(4):1029-1036.
[17] GAO J Y, SHI Q, YE Y, et al.Effects of guar gum or xanthan gum addition in conjunction with pasteurization on liquid egg white[J].Food Chemistry, 2022, 383:132378.
[18] SHENG L, HUANG M J, WANG J, et al.A study of storage impact on ovalbumin structure of chicken egg[J].Journal of Food Engineering, 2018, 219:1-7.
[19] FERN NDEZ-MART
NDEZ-MART N F, PÉREZ-MATEOS M, DADASHI S, et al.Impact of magnetic assisted freezing in the physicochemical and functional properties of egg components.Part 1:Egg white[J].Innovative Food Science &Emerging Technologies, 2017, 44:131-138.
N F, PÉREZ-MATEOS M, DADASHI S, et al.Impact of magnetic assisted freezing in the physicochemical and functional properties of egg components.Part 1:Egg white[J].Innovative Food Science &Emerging Technologies, 2017, 44:131-138.