发酵酒精饮料在世界范围内被广泛消费,并被认为是最具经济价值与文化价值的发酵食品之一[1]。酒文化作为中国传统文化的重要组成部分,贯穿在中国人的日常生活中,近代科技的发展促进了酿酒科技的进步,使得人们对于白酒的认识不仅止步于嗜好品,饮酒与健康成为现代人最关注的话题之一[2]。虽然长期酒精暴露会导致肝损伤,但是白酒独特而复杂的多菌种固态发酵与固态蒸馏过程导致其中含有上千种微量组分[3],其中许多成分具有重要的生物活性,例如有机酸、酚类、吡嗪类、萜烯类及不挥发脂肽类等物质,并已被证明对健康有积极影响[4];一些物质还被认为可以通过调节肠道微生物改善酒精造成的损伤[5-7]。
Akkermansia muciniphila是一种专性厌氧的革兰氏阴性菌,隶属疣微菌门疣微菌科中的Akkermansia属[8],由荷兰学者DERRIEN于2004年在人类粪便中首次发现并命名[9]。它通过将黏蛋白作为唯一的氮和碳源来定植于肠道,为哺乳动物肠道中最丰富的微生物之一[10]。近年来的研究发现,A.muciniphila具有调节免疫、保护肠屏障功能、维持黏液层厚度及抗炎等多种有益生理功能,因而被认为是“下一代益生菌”[11]。A.muciniphila在发现至今不到20年时间里,研究已从小鼠模型观察发展到代谢综合征患者干预,是其他“下一代益生菌”无法比拟的,因而在食品工业领域和学术界获得了极大关注[12]。
近年来的研究发现,A.muciniphila是改善酒精相关疾病的关键肠道微生物[13],直接灌胃补充A.muciniphila能够通过保护肠屏障完整性改善酒精摄入引起的肝损伤[14]以及酒精相关的抑郁症[15];大黄提取物与硬脂酸干预可通过增加肠道A.muciniphila丰度从而改善酒精诱导的肝损伤[16-17];另外,在我们的前期研究中也发现,与纯酒精喂养相比,白酒喂养可以通过减缓肠道A.muciniphila相对丰度的降低,从而减轻肠道屏障破坏和肝损伤程度[18]。然而,以上研究都是基于高通量测序观察A.muciniphila的相对丰度,A.muciniphila在肠道中的准确数量并不清楚,A.muciniphila随白酒干预时间的变化规律也尚无文献报道。
本研究通过纯培养手段从小鼠粪便中筛选到一株A.muciniphila模式菌株ATCC BAA-835,并建立了基于实时荧光定量PCR测定肠道A.muciniphila数量的方法;同时通过建立白酒干预的小鼠动物模型,探究了肠道A.muciniphila随白酒干预的变化规律,并比较了与酒精干预之间的差异。本研究对开发A.muciniphila作为新一代益生菌防治酒精性肝损伤具有理论意义和应用前景,同时对挖掘白酒中有益活性物质以及阐明活性物质的作用机制提供了理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料
实验菌株:大肠杆菌(JM109)为实验室保存;A.muciniphila (ATCC BAA-835)从小鼠粪便样本中分离得到。
实验动物:SPF级雄性C57BL/6 J小鼠(8周,20~22 g),斯莱克实验动物(上海)有限公司。
1.1.2 试剂和仪器
实验所用白酒和食用级乙醇均来自本实验室贮存;BHI培养基,海博生物技术(青岛)有限公司;猪胃黏蛋白,Sigma-Aldrich(德国)公司;N-乙酰-D-氨基葡萄糖,麦克林生物科技(上海)有限公司;苏氨酸、琼脂、L-半胱氨酸盐酸盐、吐温80、LB培养基,国药集团化学试剂有限公司;TOPO-Blunt Cloning Kit,天霖生物科技(上海)有限公司;PrimeStar Max DNA Polymerase,宝日医生物技术(北京)有限公司;DNA Gel Extractuon Kit、PCR Product Purification Kit、Plasmid Mini-PREPS Kit、0.1 mL 8 Strip Real-time PCR Tubes,生工生物工程(上海)股份有限公司;TIANamp Bacteria DNA Kit、TIANamp Stool DNA Kit,天根生化科技(北京)有限公司;2×Rapid Taq Master Mix、ChamQ SYBR qPCR Master Mix,诺唯赞生物科技(南京)股份有限公司;MGC 7 L厌氧盒、MGC 3.5 L厌氧产气袋、MGC氧气指示剂,三菱化学(日本)株式会社;Bugbox厌氧工作站,贝克(英国)公司;NanoDrop 8000超微量分光光度计,赛默飞世尔科技(美国)公司;StepOne荧光定量PCR仪,应用生物系统(美国)公司。
筛菌所用培养基:富集培养基参考翟齐啸等[19]研究设置;液体初筛培养基参考朱永亮等[20]研究设置,成分为BHI培养基30 g、L-半胱氨酸盐酸盐1.5 g、苏氨酸5.0 g、N-乙酰-D-氨基葡萄糖5.0 g、吐温80 0.5 mL、加水定容至1 L;固体分离培养基在液体初筛培养基基础上加入琼脂18 g。
1.1.3 引物
16S通用引物27F:5′-AGAGTTTGATCCTGGCCTCA-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′;参考文献[21]合成特异性引物,正向引物AM1:5′-CAGCACGTGAAGGTGGGGAC-3′;反向引物AM2:5′-CCTTGCGGTTGGCTTCAGAT-3′,安升达(天津)生物科技有限公司合成。
1.2 实验方法
1.2.1 菌种筛选
1.2.1.1 样品均质与富集
选取8只正常小鼠的粪便。每日上午灌胃前将每只小鼠单独放置于空笼,按照编号对小鼠粪便进行单独采集,每管3~5颗小鼠粪便。取3~5颗小鼠粪便加入10 mL PBS中进行均质,记作10-1,梯度稀释均质液至10-5,吸取各梯度均质液500 μL加入4.5 mL富集培养基中,将富集管放置于37 ℃厌氧恒温培养箱中培养72 h。选取较为均一、悬浊、无沉淀与丝状物的较高稀释度的富集管,吸取1 mL培养液12 000 r/min离心5 min后弃上清液,使用50~200 μL无菌水重悬,沸水浴煮沸10~15 min,12 000 r/min离心1 min,取上清液为模板使用AM1与AM2为引物进行PCR检测有无阳性条带,目标片段长度为329 bp,反应采用10 μL体系,扩增条件为2×Rapid Taq Master Mix 5 μL,AM1与AM2各0.2 μL,模板0.1 μL,ddH2O 4.5 μL;反应条件为95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,32个循环;72 ℃终延伸10 min。
1.2.1.2 分离培养
将得到阳性条带的富集管菌液使用PBS缓冲液进行梯度稀释,吸取10-5~10-8各稀释度200 μL分别涂布至固体分离培养基,每个稀释度涂布3个平板;将涂布完成的平板放置于厌氧盒,放入2个三菱瓦斯化学株式会社(Mitsubishi Gas Chemical Company,MGC)3.5 L厌氧产气袋与1个氧气指示剂,迅速将盒子密封,置于37 ℃恒温培养箱中培养2周。
1.2.1.3 初筛鉴定
选择培养完成的固体平板上直径在1 mm以内、乳白色、黏稠状单菌落,挑取菌落接种于5 mL液体初筛培养基中,于37 ℃厌氧恒温培养箱中培养24 h。选择浑浊初筛管,使用AM1与AM2引物扩增特异性片段,1%琼脂糖凝胶电泳鉴定阳性条带。选取有阳性条带的初筛管菌液使用16S通用引物27F与1492R进行扩增,目标片段长度为1 500~1 600 bp,反应采用10 μL体系,扩增条件为2×Rapid Taq Master Mix 5 μL,27F与1492R各0.2 μL,模板0.1 μL,ddH20 4.5 μL;反应条件为95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,32个循环;72 ℃终延伸10 min。对所得PCR产物进行测序,对序列结果进行BLAST搜索比对并保存菌种。
1.2.2 菌种活化与培养
A.muciniphila:在超净工作台中,使用接种环蘸取保存管中的菌液,在BHI固体培养基上进行平板划线后,在厌氧工作站中37 ℃静置培养36 h。挑取平板上的单菌落接种于BHI液体培养基过夜活化18 h,取2%(体积分数)接种量进行培养24 h。
1.2.3 T-Akk标准质粒构建
采用TIANamp Bacteria DNA Kit提取A.muciniphila细菌基因组DNA,严格按照说明书操作,提取的DNA模板于-20 ℃保存备用。参考前人研究进行质粒构建[22],使用PrimeStar Max DNA Polymerase扩增出A.muciniphila特异DNA序列,反应采用50 μL体系,扩增条件为1×PrimeStar Max Mix 25 μL,引物AM1与AM2各1 μL,模板200 ng,ddH2O补充至总体系50 μL,反应条件为94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃终延伸10 min。将扩增产物进行琼脂糖凝胶电泳后切胶回收目标条带,纯化后使用NanoDrop 8000超微量分光光度计测定DNA浓度,使用TOPO-Blunt Cloning Kit将扩增目的基因插入TOPO载体,克隆反应体系为10 μL,按照载体、目的片段摩尔比1∶3,室温孵育5 min。将反应产物转化至大肠杆菌(JM109)感受态细胞,细菌恢复至正常生长状态吸取菌液涂布抗生素平板。使用抗生素平板筛选阳性克隆菌落,挑取单一菌落至抗生素LB液体培养基中培养8 h,提取标准质粒进行测序。利用NCBI中BLAST与SnapGene软件比对测序结果与A.muciniphila基因组,并保存目标菌种T-Akk大肠杆菌。
1.2.4 动物实验造模
所有小鼠自由进食,水与饲料充足。适应1周后,将小鼠随机分为3组:对照组(8只)、白酒组(8只)、酒精组(8只)分别给予无菌水、白酒以及食用酒精。为保证白酒组和乙醇组之间小鼠摄入的酒精剂量一致,使用酒精计测定白酒酒精含量后,按照设定的酒精含量计算稀释倍数,灌胃前使用无菌水将每种白酒和乙醇稀释至相同酒精浓度。灌胃酒精剂量采用梯度增加的方式进行:初始酒精剂量为每天3.2 g/kg,此后每5 d梯度增加0.6 g/kg,直至第20天达到5.6 g/kg,保持此剂量至实验结束(图1)。造模方法参考课题组前期研究[18,23]。
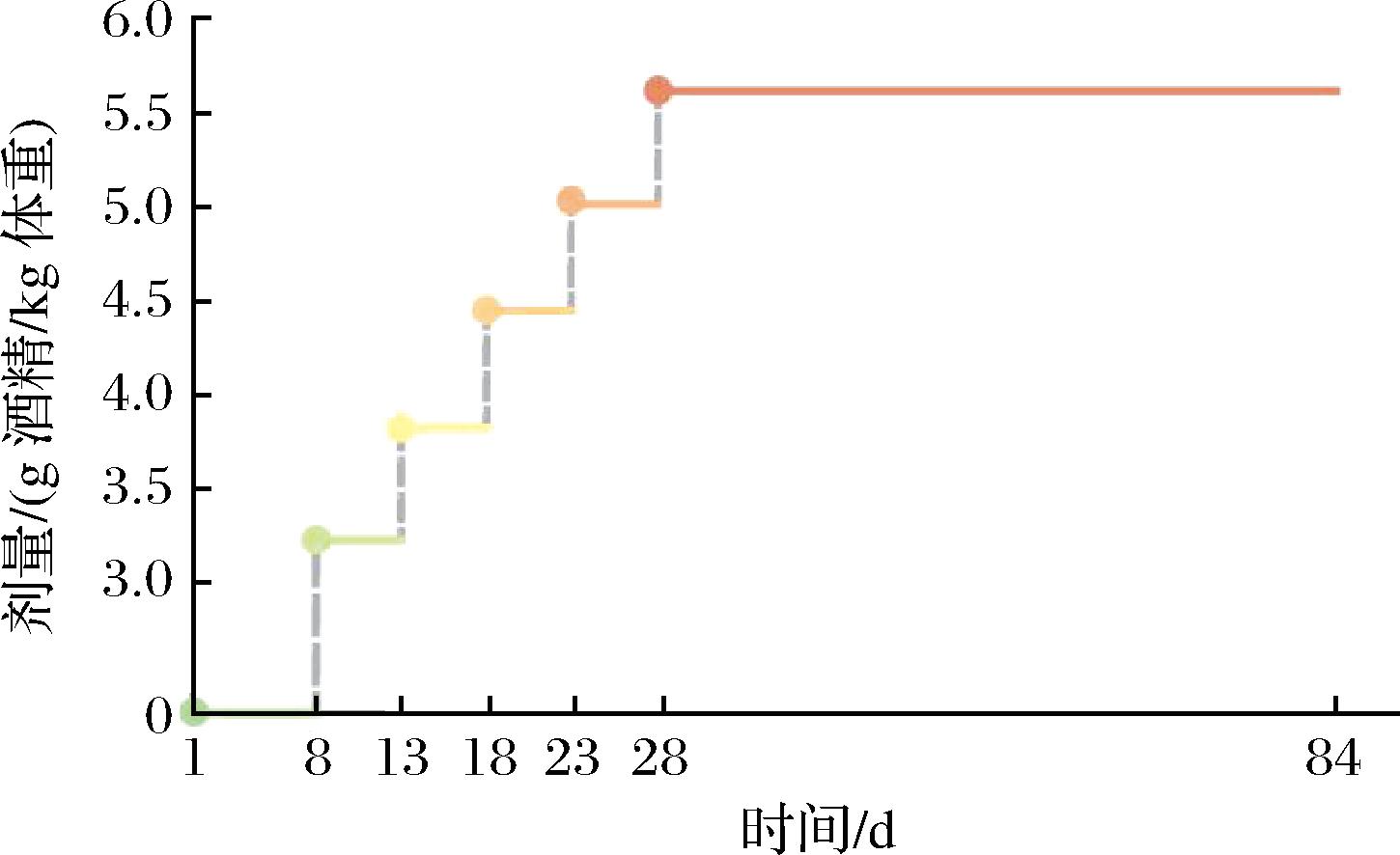
图1 动物造模方案
Fig.1 Animal modeling scheme
1.2.5 实时荧光PCR
参考文献[24]使用SYBR Green I作为荧光指示剂,PCR反应体系采用20 μL,扩增条件为ChamQ SYBR qPCR Master Mix 10 μL,AM1与AM2各0.4 μL,模板1 μL,ddH2O补充体系至20 μL;反应条件为95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火40 s,72 ℃延伸30 s,40个循环;72 ℃终延伸5 min。在72 ℃设置荧光信号采集。反应结束设置65~95 ℃溶解曲线,温度以0.5 ℃/5 s递增。
1.2.6 标准曲线建立
参考前人研究建立标准曲线[25-26]。培养T-Akk大肠杆菌12 h,按照说明书使用Plasmid Mini-PREPS Kit提取T-Akk质粒并测定DNA浓度,根据公式(1)计算拷贝数,将拷贝数稀释为101~109九个浓度梯度作为标准品进行实时荧光PCR实验,各设3个平行样,建立标准曲线。
拷贝数![]()
(1)
式中:DNA质量浓度,ng/μL;载体长度,bp;靶DNA长度,bp。
1.2.7 样本收集与基因组提取
收集第1、3、5、8、12周白酒、酒精及对照组的小鼠粪便于冻存管,不立即使用则贮存于-20 ℃。精确称取小鼠粪便质量,使用TIANamp Stool DNA Kit提取基因组DNA。空白对照以ddH2O代替模板DNA。每组设置3个生物学平行,每1个生物学平行设置3个技术平行。
1.2.8 数据分析
图形制作均采用Origin 2023进行绘制。数据分析采用SPSS软件进行统计学分析,所有实验结果均以平均值±标准差表示。
2 结果与分析
2.1 A.muciniphila模式菌株筛选
经富集、分离、初筛培养,选择浑浊初筛管,使用AM1与AM2引物扩增特异性片段,10 g/L琼脂糖凝胶电泳鉴定阳性条带(图2)。结果发现,除泳道3外,其余泳道均有阳性条带,进一步对阳性条带进行测序比对发现,所有阳性条带与A.muciniphila ATCC BAA-835的相似度均为100%,表明本研究所使用的C57BL/6 J小鼠肠道中的A.muciniphila为模式菌株ATCC BAA-835。

图2 初筛菌液特异性片段扩增
Fig.2 Specific fragment amplification of the primary screening solution
2.2 标准质粒构建
以A.muciniphila基因组DNA为模板,使用引物对AM1/AM2进行PCR扩增,获得一条与目的基因片段长度(329 bp)相符的特异性扩增条带(图3),对目的片段进行胶回收和纯化,并测定DNA浓度,加入40 ng目的片段至10 μL克隆反应体系中孵育。
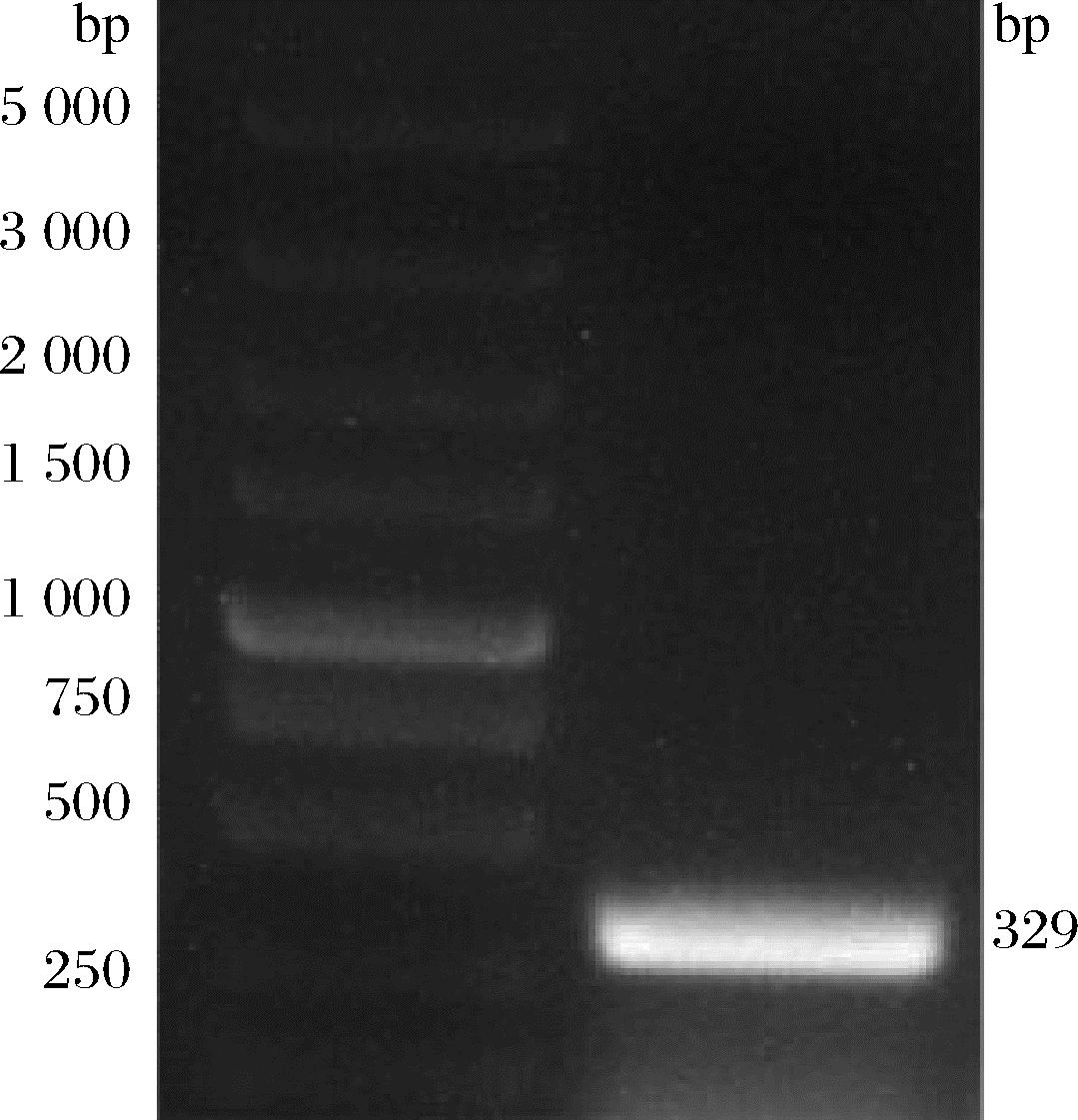
图3 目的基因片段扩增
Fig.3 Target fragment amplification
吸取菌液提取质粒进行PCR与10 g/L琼脂糖凝胶电泳鉴定,重组质粒鉴定结果均为阳性(图4-a)。4个阳性菌落测序结果均与A.muciniphila特异性片段一致(图4-b),表明目标片段成功插入TOPO载体中,T-Akk质粒构建完成。
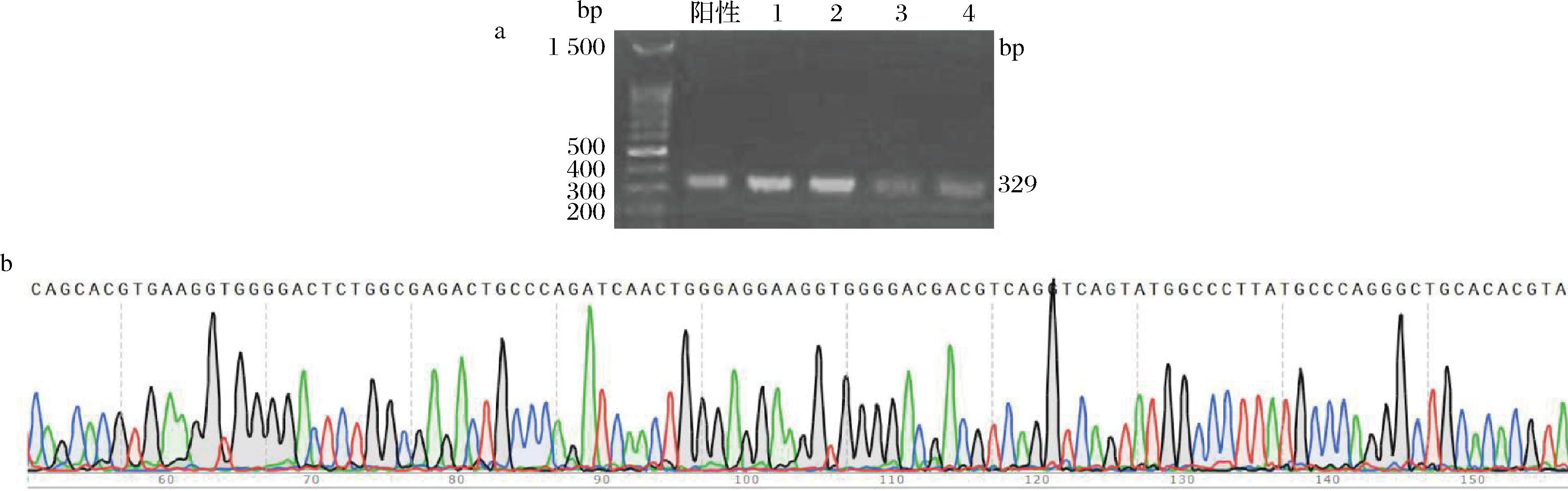
a-阳性菌落鉴定结果;b-菌落测序结果(部分序列)
图4 菌落鉴定及测序结果
Fig.4 Colony identification and sequencing results
2.3 标准曲线建立
以数量级为101~109的T-Akk质粒DNA拷贝数作为标准品进行实时荧光定量PCR测定对应Ct值。以DNA拷贝数的对数值为横坐标,Ct值为纵坐标建立标准曲线,线性关系为Ct=-3.361x+38.89,相关系数R2=0.999 1(图5),线性关系良好,表明可进一步用于肠道A.muciniphila定量分析。
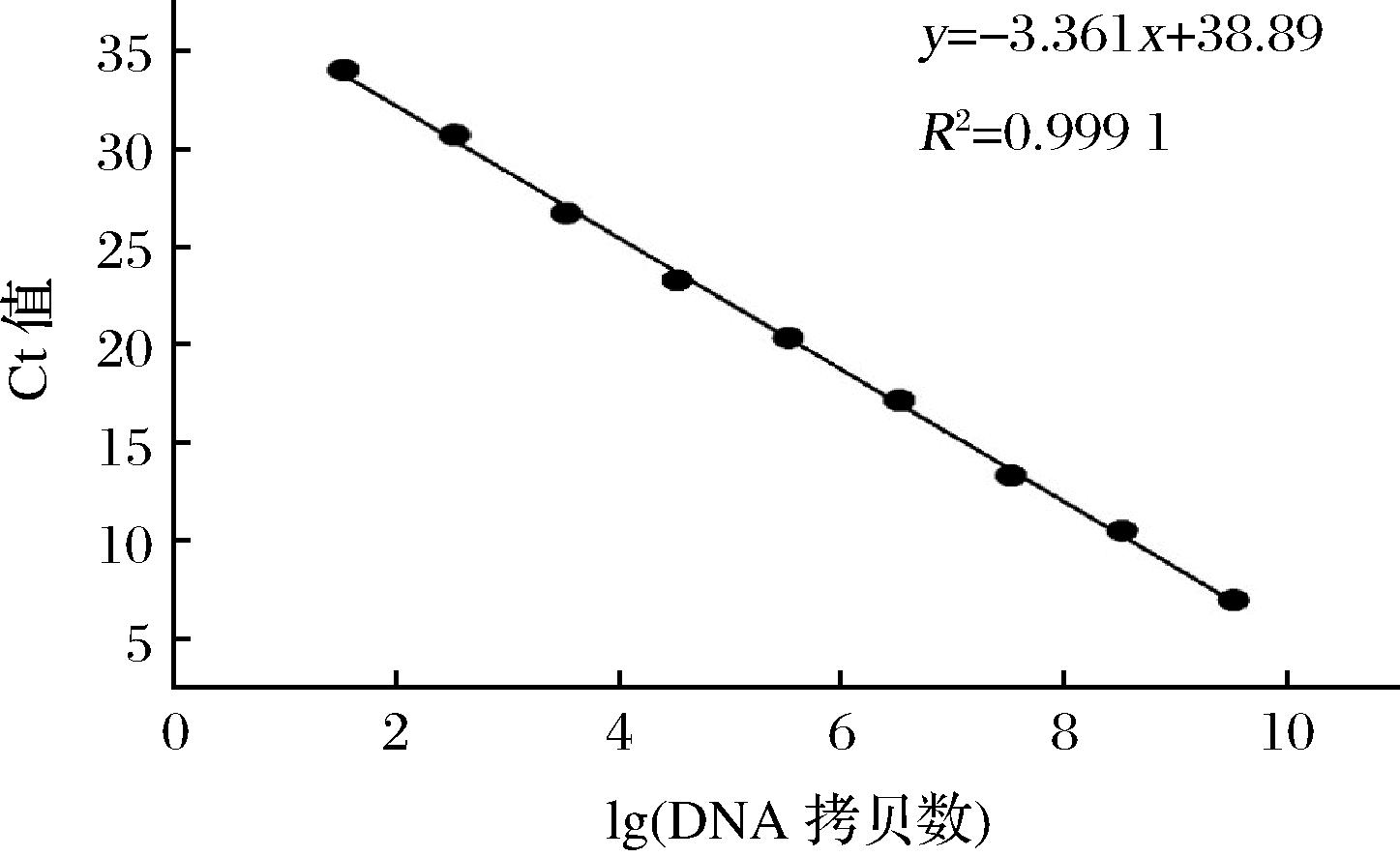
图5 标准曲线
Fig.5 Standard curve
2.4 肠道A.muciniphila随白酒和酒精干预的变化规律
通过以上方法对造模第1、3、5、8和12周小鼠粪便中的A.muciniphila进行定量分析,结果发现对照组小鼠粪便中A.muciniphila丰度趋于平稳,酒精组与白酒组小鼠粪便中A.muciniphila丰度随造模时间呈现下降趋势;且与酒精组相比,白酒组小鼠粪便中A.muciniphila数量下降趋势较缓(图6)。
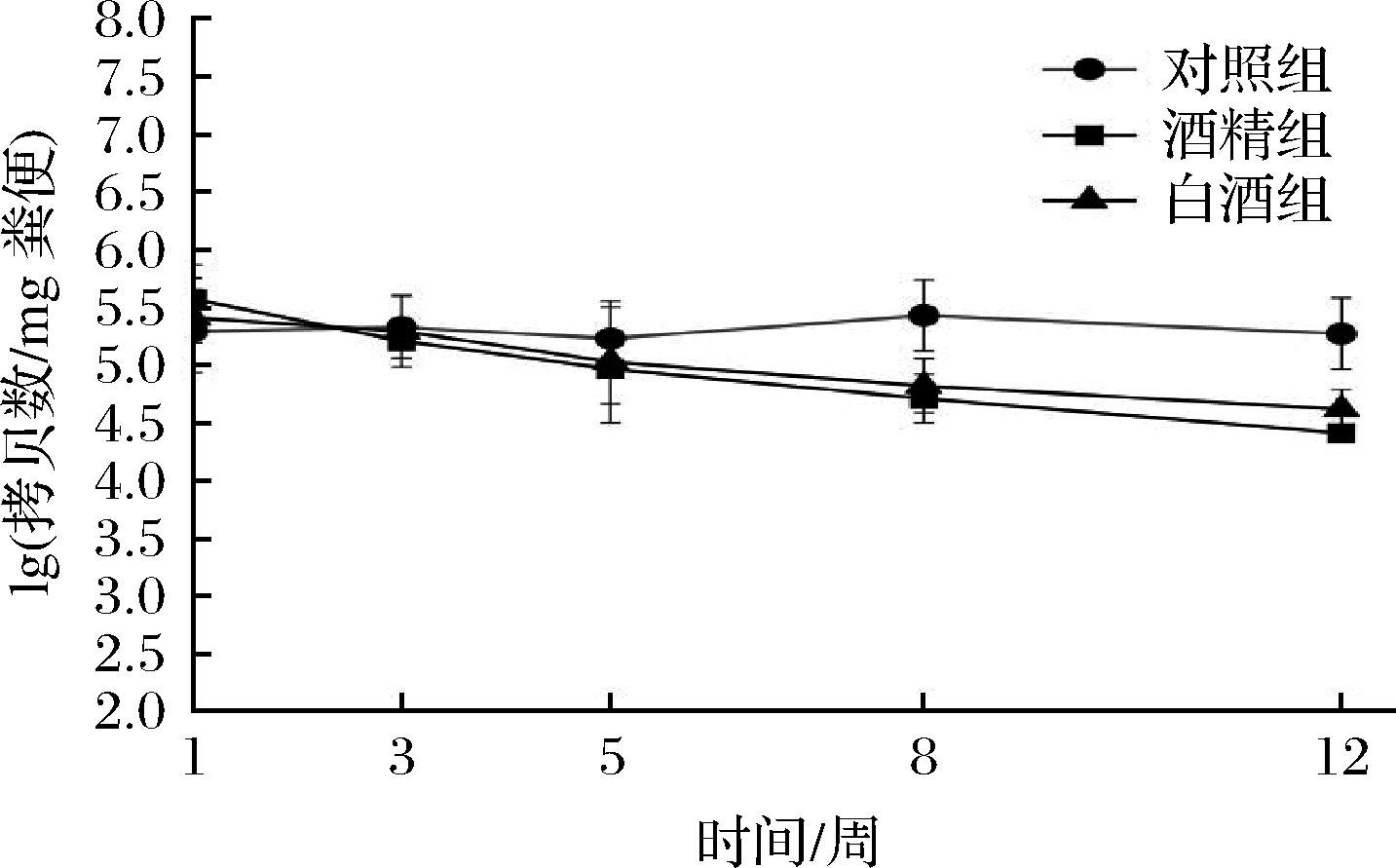
图6 小鼠粪便中A.muciniphila丰度随时间变化规律
Fig.6 Changes in the abundance of A.muciniphila in mice faeces over time
适应期结束后(第1周),酒精组小鼠A.muciniphila的数量为[(5.56±0.30) lg(copies/mg)],白酒组小鼠A.muciniphila数量为[(5.40±0.22) lg(copies/mg)],略低于酒精组;造模结束后,酒精组与白酒组小鼠粪便中A.muciniphila数量均低于对照组,说明白酒和酒精摄入均会导致肠道A.muciniphila数量降低。酒精组小鼠A.muciniphila数量为[(4.41±0.06) lg(copies/mg)],白酒组小鼠A.muciniphila数量为[(4.61±0.17) lg(copies/mg)],略高于酒精组(图6);酒精组下降比率高于白酒组(表1)。
表1 干预前后小鼠粪便中A.muciniphila丰度下降比率
Table 1 The decrease rate of A.muciniphila before and after intervention

组别lg(copies/mg)第1周(干预前)第12周(干预结束)下降比/%酒精5.56±0.304.41±0.0620.57±2.62白酒5.40±0.224.61±0.1714.62±0.27
综上所述,在相同酒精摄入剂量条件下,白酒喂养与纯酒精喂养相比能够减缓A.muciniphila的损失程度,这与FANG等[18]研究结果相似,表明白酒中活性成分可能是通过保护酒精诱导的A.muciniphila丰度的降低,从而减轻肠道屏障功能的破坏和肝损伤。
3 结论
本研究通过纯培养的方法筛选到了一株A.muciniphila模式菌株ATCC BAA-835,采用实时荧光定量PCR方法并使用重组质粒T-Akk作为标准品构建了标准曲线,并建立了肠道A.muciniphila的绝对定量方法,同时通过建立为期12周慢性白酒灌胃干预小鼠模型,测定了小鼠粪便中A.muciniphila的数量,探究了白酒干预对小鼠肠道中A.muciniphila数量的影响以及与酒精干预之间的差异。
本研究使用重组质粒作为标准品进行标准曲线构建,相比于传统方式中使用A.muciniphila基因组为标准品制备标准曲线更为简便、快速。结果发现,白酒与酒精摄入均会导致小鼠肠道A.muciniphila数量的降低;相同酒精摄入剂量条件下,白酒喂养与纯酒精喂养相比能够减缓A.muciniphila的损失程度,说明白酒中含有可以增加A.muciniphila数量的活性物质。然而白酒中何种生物活性物质保护了A.muciniphila数量的下降及其保护机制仍需进一步探索。本研究体现了挖掘白酒中生物活性物质的价值与必要性,并为A.muciniphila作为下一代益生菌改善酒精引起的各种损伤提供了科学依据。
[1] TAMANG J P,COTTER P D,ENDO A,et al.Fermented foods in a global age:East meets west[J].Comprehensive Reviews in Food Science and Food Safety,2020,19(1):184-217.
[2] 郭旭.中国近代酒业发展与社会文化变迁研究[D].无锡:江南大学,2015.
GUO X.The research of alcohol industry development and social cultural changes in modern China[D].Wuxi:Jiangnan University,2015.
[3] 方程.基于组学的白酒肝损伤和肠道菌群干预调节机制研究[D].无锡:江南大学,2019.
FANG C.Study on the mechanism of Baijiu-induced liver injury and regulation of intestinal flora based on omic approaches[D].Wuxi:Jiangnan University,2019.
[4] 黄蕴利,黄永光,郭旭.白酒中的主要生物活性功能成分研究进展[J].食品工业科技,2016,37(15):375-379.
HUANG Y L,HUANG Y G,GUO X.Bioactive functional components in Chinese liquor[J].Science and Technology of Food Industry,2016,37(15):375-379.
[5] FANG C,ZHOU Q W,LIU Q Y,et al.Crosstalk between gut microbiota and host lipid metabolism in a mouse model of alcoholic liver injury by chronic baijiu or ethanol feeding[J].Food &Function,2022,13(2):596-608.
[6] JI M,FANG C,JIA W,et al.Regulatory effect of volatile compounds in fermented alcoholic beverages on gut microbiota and serum metabolism in a mouse model[J].Food &Function,2021,12(12):5576-5590.
[7] FANG C,LU W,LIU Q Y,et al.Comparative study between the effects of aged and fresh Chinese baijiu on gut microbiota and host metabolism[J].Food Bioscience,2022,49:101859.
[8] 周鑫,张雪,陈耀凯,等.Akkermansia muciniphila作为下一代益生菌的潜力[J].中国微生态学杂志,2023,35(2):239-244.
ZHOU X,ZHANG X,CHEN Y K,et al.Akkermansia muciniphila:Potentiality as a next-generation probiotic[J].Chinese Journal of Microecology,2023,35(2):239-244.
[9] DERRIEN M,VAUGHAN E E,PLUGGE C M,et al.Akkermansia muciniphila gen.nov.,sp nov.,a human intestinal mucin-degrading bacterium[J].International Journal of Systematic and Evolutionary Microbiology,2004,54(Part 5):1469-1476.
[10] ZHAO Q X,YU J D,HAO Y,et al.Akkermansia muciniphila plays critical roles in host health[J].Critical Reviews in Microbiology,2023,49(1):82-100.
[11] GHAFFARI S,ABBASI A,SOMI M H,et al.Akkermansia muciniphila:From its critical role in human health to strategies for promoting its abundance in human gut microbiome[J].Critical Reviews in Food Science and Nutrition,2023,63(25):7357-7377.
[12] CANI P D,DEPOMMIER C,DERRIEN M,et al.Akkermansia muciniphila:Paradigm for next-generation beneficial microorganisms[J].Nature Reviews Gastroenterology &Hepatology,2022,19(10):625-637.
[13] CASLIN B,MAGUIRE C,KARMAKAR A,et al.Alcohol shifts gut microbial networks and ameliorates a murine model of neuroinflammation in a sex-specific pattern[J].Proceedings of the National Academy of Sciences of the United States of America,2019,116(51):25808-25815.
[14] GRANDER C,ADOLPH T E,WIESER V,et al.Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic liver disease[J].Gut,2018,67(5):891-901.
[15] GUO D M,PARK C,LI Y,et al.Akkermansia muciniphila ameliorates depressive disorders in a murine alcohol-LPS (mALPS) model[J].Food &Function,2022,13(24):12766-12776.
[16] NEYRINCK A M,ETXEBERRIA U,TAMINIAU B,et al.Rhubarb extract prevents hepatic inflammation induced by acute alcohol intake,an effect related to the modulation of the gut microbiota[J].Molecular Nutrition &Food Research,2017,61(1):10.1002/mnfr.201500899.
[17] NIE W,XU F R,ZHOU K,et al.Stearic acid prevent alcohol-induced liver damage by regulating the gut microbiota[J].Food Research International,2022,155:111095.
[18] FANG C,DU H,ZHENG X,et al.Solid-state fermented Chinese alcoholic beverage (baijiu) and ethanol resulted in distinct metabolic and microbiome responses[J].FASEB Journal,2019,33(6):7274-7288.
[19] 翟齐啸,陈卫,冯赛赛,等.一种阿克曼氏菌特异性筛选培养基及其制备方法和应用:中国,CN109355349B[P].2021-03-26.
ZHAI Q X,CHEN W,FENG S S,et al.Specific screening medium for Akkermansia muciniphila and preparation method and application thereof:China,CN109355349B[P].2021-03-26.
[20] 朱永亮,宋伟群,朱浩.一种培养嗜黏蛋白阿克曼氏菌的培养基及其使用方法和应用:中国,CN111304133B[P].2023-01-13.
ZHU Y L,SONG W Q,ZHU H.Culture medium for culturing Akkermansia muciniphila,and application method and applications of culture medium:China,CN111304133B[P].2023-01-13.
[21] LOPEZ-SILES M,ENRICH-CAP N,ALDEGUER X,et al.Alterations in the abundance and co-occurrence of Akkermansia muciniphila and Faecalibacterium prausnitzii in the colonic mucosa of inflammatory bowel disease subjects[J].Frontiers in Cellular and Infection Microbiology,2018,8:281.
N,ALDEGUER X,et al.Alterations in the abundance and co-occurrence of Akkermansia muciniphila and Faecalibacterium prausnitzii in the colonic mucosa of inflammatory bowel disease subjects[J].Frontiers in Cellular and Infection Microbiology,2018,8:281.
[22] EARLEY H,LENNON G,BALFE  ,et al.The abundance of Akkermansia muciniphila and its relationship with sulphated colonic mucins in health and ulcerative colitis[J].Scientific ReportS,2019,9(1):15683.
,et al.The abundance of Akkermansia muciniphila and its relationship with sulphated colonic mucins in health and ulcerative colitis[J].Scientific ReportS,2019,9(1):15683.
[23] 纪媚.白酒主要挥发性组分对哺乳动物肠道微生物及宿主代谢的影响解析[D].无锡:江南大学,2021.
JI M.The influence of main volatile compounds in Baijiu on gut microbiota and host metabolism[D].Wuxi:Jiangnan University,2021.
[24] 秦倩倩,张玲,王国庆.实时荧光PCR定量检测粪便中Akkermansia muciniphila方法研究[J].四川大学学报(医学版),2018,49(1):93-97.
QIN Q Q,ZHANG L,WANG G Q.Quantitative detection of Akkermansia muciniphila in fecal samples by real-time PCR[J].Journal of Sichuan University(Medical Sciences),2018,49(1):93-97.
[25] ZHANG L,SHI M X,TIAN M L,et al.Guidelines for absolute quantitative real-time PCR for microbial determination in in vitro gastrointestinal digestion[J].Food Frontiers,2020,1(2):200-204.
[26] DU R B,WU Q,XU Y.Chinese liquor fermentation:Identification of key flavor-producing Lactobacillus spp.by quantitative profiling with indigenous internal standards[J].Applied and Environmental Microbiology,2020,86(12):e00456-e00420.