人体是由真核细胞与体内共生的微生物共同组成的“超级生物体”[1]。肠道菌群与宿主健康密切相关,甚至被认为是“被忽略的人体器官”。肠道菌群通过调节免疫功能[2]、保护肠道[3]、调节各类营养素代谢[4]等对机体健康产生重要影响。大量疾病和身体不适与肠道微生物息息相关。
益生菌可以定植在肠道内,从而影响肠道菌群的组成,其对于外源病原微生物的抵抗作用得到越来越多的重视。益生菌抑菌的作用机理包括竞争性代谢相互作用、宿主的免疫反应和抑制肠道黏附[5];此外,也有研究发现,有些益生菌存在信号分子干扰机制,通过释放某些信号分子从而将病原微生物从肠道内排除[6]。
益生元是一类可以供益生菌选择性利用的基质,可以赋予某些健康益处[7],最为常见的益生元有低聚果糖(fructooligosaccharides,FOS)和低聚半乳糖(galactooligosaccharides,GOS),它们发挥作用的主要方式是定向的增殖乳酸杆菌或双歧杆菌。这些低聚糖很容易被乳酸菌中普遍存在的β-果糖苷酶、β-半乳糖苷酶降解[8],通过定向的被某些菌株利用,从而增加这部分菌株在肠道微生物群落中的占比。另外,来自母乳的低聚糖也被认为对新生儿肠道微生物群和免疫系统发育有着至关重要的作用[9-10],2′-岩藻糖基乳糖(2′-focusllactose,2′-FL)是常见的一类人乳低聚糖,2′-FL在肠胃道水平上具有增强肠道免疫和屏障的功能[11-12]。但是不同低聚糖对不同益生菌菌株抑菌能力的影响作用仍待探究。
植物乳杆菌AUH2103是一株分离自母乳的菌株,本研究拟探究2′-FL等低聚糖对植物乳杆菌AUH2103致病菌的抑制能力的影响作用和机制。
1 材料与方法
1.1 材料与试剂
低聚果糖(FOS)、低聚半乳糖(GOS):纯度>95%,量子高科(中国)生物股份有限公司;(2′-FL):纯度>95%,德国BASF公司。
MRS培养基(g/L):葡萄糖 20,蛋白胨 10,无水乙酸钠 5,MgSO4·7H2O 0.2,MnSO4·7H20 0.05,K2HPO4·7H2O 2,柠檬酸二铵 2,酵母膏 5,牛肉膏 10,吐温-80 1 mL。固体培养基添加2%(质量分数)琼脂粉。
低聚糖MRS培养基:以20 g/L的低聚糖代替MRS培养基中的葡萄糖。
LB培养基(g/L):葡萄糖10,酵母粉5,氯化钠10。固体培养基添加2%琼脂粉。
DMEM完全培养液:80%(体积分数)DMEM,20%(体积分数)优质胎牛血清。
1.2 仪器与设备
BXP-16恒温培养箱,上海力辰邦仪器科技有限公司;JF-SX-500型全自动灭菌锅,日本TOMY公司;SW-CJ-1FD型超净工作台,苏州净化设备有限公司;HERACELL二氧化碳培养箱,美国Thermo公司。
1.3 实验方法
1.3.1 菌株和细胞株的培养
植物乳杆菌AUH2103是由江苏省乳品生物技术与安全控制重点实验室分离自母乳(CGMCC 23527)。将该菌株以3%的接种量在37 ℃的MRS肉汤中培养18 h,在MRS固体平板中分离纯化3次后,备用。
大肠杆菌ATCC 25922T,鼠伤寒沙门氏菌CMCC 50115T,蜡样芽胞杆菌ATCC 11778T和金黄色葡萄球菌ATCC 6538T是由江苏省乳品生物技术与安全控制重点实验室保存的,将这些菌株在LB肉汤摇床培养12 h后,在LB固体平板中分离纯化3次后,备用。
Caco-2(人结肠腺癌)细胞是由江苏省乳品生物技术与安全控制重点实验室保存。Caco-2细胞在补充有10%胎牛血清的DMEM培养基中培养。培养结束后,使用无菌PBS清洗3次,从塑料培养瓶中去除未贴壁的细胞,然后用0.25%(体积分数)的胰蛋白酶处理,传代至15~20代。将细胞密度调整为5×106 cells/mL,接种200 μL至24孔板中,在37 ℃ 5%(体积分数)CO2的条件下允许细胞完全生长分化并形成完整的屏障。
1.3.2 植物乳杆菌AUH2103的培养抑菌能力
采用单层琼脂平板扩散法[13],将30 mL灭菌的LB固体培养基倾注于培养皿中,待其充分凝固后用无菌三角涂布棒将预先稀释至1×107 CFU/mL的4种致病菌菌悬液100 μL均匀涂布。用打孔器均匀等距打孔,向各孔内注入200 μL待测样品,并做好标记。加样结束后将培养皿正置于18 ℃培养箱,待其充分扩散过夜,再将平板移至37 ℃培养箱培养,培养结束后测量抑菌圈直径。
1.3.3 植物乳杆菌AUH2103的黏附能力测定
参照文献方法[14]并改进,补充有10%(体积分数)FBS的DMEM用于培养细胞。将Caco-2细胞接种在24孔板中,并在37 ℃下孵育直至形成单层膜。在含有不同种类不同浓度的低聚糖的PBS中洗涤菌体2次,并以终浓度109 CFU/mL进行重悬;将100 μL细菌悬浮液加入Caco-2培养板孔中,并在37 ℃下孵育2 h;用PBS洗涤Caco-2细胞3次以去除未黏附的细菌,然后加入50 μL 0.25%胰蛋白酶-EDTA以裂解细胞。最后,将每个孔的混合物接种在MRS琼脂平板上以计数黏附的细菌。
1.3.4 低聚糖对黏附能力的影响
为了研究不同种类,不同质量浓度的低聚糖对于植物乳杆菌AUH2103对Caco-2细胞的黏附能力的影响,将不同质量浓度不同种类的低聚糖进行复配,观察复配后低聚糖是否具有更好的促进Caco-2细胞黏附能力的作用。使用含有不同质量浓度的低聚糖组合的PBS溶液洗涤菌体(表1),并以终浓度109 CFU/mL进行重悬,按照1.3.3节的方法培养细胞并进行黏附试验。
表1 复配低聚糖各组别中的低聚糖占比
Table 1 Proportion of oligosaccharides in each group of complex oligosaccharides
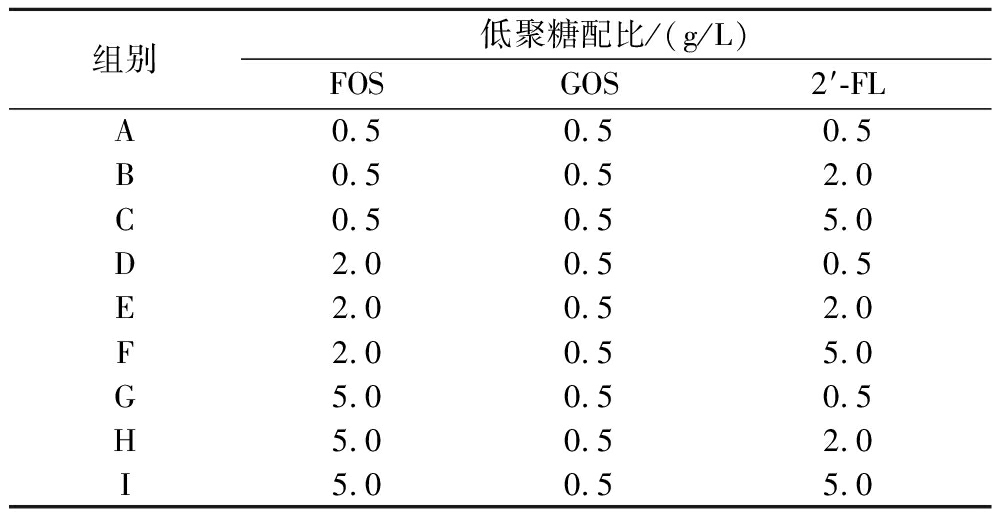
组别低聚糖配比/(g/L)FOSGOS2′-FLA0.50.50.5B0.50.52.0C0.50.55.0D2.00.50.5E2.00.52.0F2.00.55.0G5.00.50.5H5.00.52.0I5.00.55.0
1.3.5 致病菌黏附
按照以往的研究进行改进[15],植物乳杆菌AUH2103在37 ℃下培养18 h后,离心取菌体,使用PBS清洗2次后,使用对应的低聚糖溶液重悬菌体,备用。
大肠杆菌、沙门氏菌、金黄色葡萄球菌和蜡样芽胞杆菌在摇床上培养以37 ℃,160 r/min的条件下培养12 h后,离心取菌体,使用PBS溶液清洗2次后,使用对应的低聚糖溶液重悬菌体,备用。
单独黏附:用PBS(pH 7.2)清洗单层细胞2次,每孔加入200 μL的致病菌悬液(约为1.5×109 CFU),悬浮溶液分别为PBS、含2′-FL PBS以及含低聚糖组合PBS,在37 ℃,5%CO2和95%相对湿度的条件下与细胞共同孵育2 h。用PBS(pH 7.2)洗涤3次单层膜,以除去未结合的细菌,加入150 μL 0.25%胰蛋白酶消化液,在37 ℃下消化 15 min后,向每个孔中加入350 μL补充有10%胎牛血清的DMEM培养液终止消化。连续10倍梯度稀释,采用平板菌落计数法检验活菌数,所计活菌数即为黏附于细胞上的细菌数目。
竞争黏附:用PBS(pH 7.2)清洗单层细胞2次,每孔加入200 μL的致病菌和AUH2103混合菌悬液(指示菌约为1.5×109 CFU),悬浮溶液分别为PBS、含2′-FL PBS(5 g/L)以及含低聚糖组合PBS,在37 ℃,5% CO2和95%相对湿度的条件下与细胞共同孵育2 h。用PBS(pH 7.2)洗涤3次单层膜,以除去未结合的细菌,加入150 μL 0.25%胰蛋白酶消化液,在37 ℃下消化15 min后,向每个孔中加入350 μL补充有10%胎牛血清的DMEM培养液终止消化。连续10倍梯度稀释,采用平板菌落计数法检验活菌数,所计活菌数即为黏附于细胞上的细菌数目。
排斥黏附:用PBS(pH 7.2)清洗单层细胞2次,每孔先后加入200 μL的致病菌(经测定含致病菌约为1.5×109 CFU)和AUH2103混合菌,悬液悬浮溶液分别为PBS、含2′-FL PBS以及含低聚糖组合PBS,在37 ℃,5% CO2和95%相对湿度的条件下与细胞共同各孵育1 h。用PBS(pH 7.2)洗涤3次单层膜,以除去未结合的细菌,加入150 μL 0.25%胰蛋白酶消化液,在37 ℃下消化15 min后,向每个孔中加入350 μL补充有10%胎牛血清的DMEM培养液终止消化。连续10倍梯度稀释,采用平板菌落计数法检验活菌数,所计活菌数即为黏附于细胞上的细菌数目。
2 结果与分析
2.1 植物乳杆菌AUH2103发酵液的抑菌能力
为了评估不同低聚糖对于植物乳杆菌AUH2103发酵液抑制致病菌能力的影响,本实验将MRS培养基中的碳源由葡萄糖替换为等比例的低聚糖进行发酵,最后使用单层琼脂扩散法测试发酵液的抑菌能力。测试结果如表2所示,替换碳源对于发酵液抑菌效果的能力影响较小,对于蜡样芽孢杆菌而言,将碳源替换GOS后的抑菌效果与MRS组无显著性差异(P>0.05),对于金黄色葡萄球菌而言,将碳源替换为FOS或GOS后的抑菌效果均与MRS组无显著性差异(P>0.05),对于大肠杆菌和沙门杆菌而言,结果与上述的情况类似,MRS组均具有较好的抑菌效果,碳源替换为GOS和FOS后的抑菌效果出现了变化,但这种变化较小,但是,对于所有4种指示菌而言,将碳源替换为2′-FL后,抑菌效果均不明显。这与植物乳杆菌AUH2103对碳源的利用能力有关,植物乳杆菌AUH2103在以2′-FL作为碳源的培养基中生长不良[16],发酵液的pH值无法降低,从而没有抑菌效果。本实验结果表明,植物乳杆菌AUH2103发酵液的主要抑菌原理为产酸抑制,对于培养基中碳源的利用能力是影响发酵液pH的主要因素。对GOS和FOS的利用可能并未产生额外的抑菌物质。
表2 不同碳源对于植物乳杆菌AUH2103抑菌能力的影响
Table 2 Effects of different carbon sources on the antibacterial ability of L.plantarum AUH2103
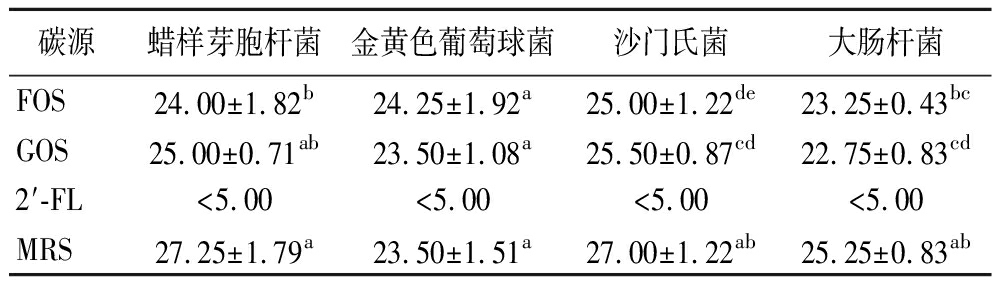
碳源蜡样芽胞杆菌金黄色葡萄球菌沙门氏菌大肠杆菌FOS24.00±1.82b24.25±1.92a25.00±1.22de23.25±0.43bcGOS25.00±0.71ab23.50±1.08a25.50±0.87cd22.75±0.83cd2′-FL<5.00<5.00<5.00<5.00MRS27.25±1.79a23.50±1.51a27.00±1.22ab25.25±0.83ab
注:抑菌能力以抑菌圈直径表示(mm);同一列不同上标字母表示有显著性差异(P<0.05)(下同)。
2.2 低聚糖对植物乳杆菌AUH2103细胞黏附的促进作用
2.2.1 单种低聚糖的作用
以往的研究表明,益生菌与致病菌在体内的相互作用,除了直接产酸抑制致病菌生长外,还可以通过黏附肠道细胞形成肠道屏障后,阻止致病菌与肠道细胞的接触,例如中性高分子质量和低分子质量的寡糖(主要是岩藻糖基化的)抑制了单核细胞增生李斯特菌对Caco-2的黏附力[17]。细菌对于上皮细胞的黏附被认为是益生菌菌株的选择标准之一,而Caco-2细胞是目前应用较为广泛的细胞系[18-20]。本试验考察在不同浓度、不同种类的低聚糖存在的情况下,植物乳杆菌AUH2103对于Caco-2细胞黏附能力的影响,这可以模拟体内益生菌形成保护肠道细胞的肠道黏膜的情况。表3结果显示,在添加FOS的组别中,当FOS的浓度为5 g/L时,植物乳杆菌AUH2103的黏附能力最强,黏附后的活菌数达到了6.43×107 CFU/mL;在添加GOS的组别中,当GOS浓度为5 g/L时,植物乳杆菌AUH2103的黏附能力最强,黏附后的活菌数达到了6.13×107 CFU/mL;在添加2′-FL的组别中,当2′-FL浓度为5 g/L时,植物乳杆菌AUH2103的黏附能力最强,黏附后的活菌数达到了5.68×107 CFU/mL。黏附机制则通常分为两方面,一些菌株可以与细胞上的特定位点进行特异性的相互作用而结合,而另一些菌株则是由于非特异性作用所导致的[21]。部分研究发现,乳酸菌通常是通过表面相关蛋白或其他因素与宿主细胞进行黏附或直接作用从而引发下游反应[22]。因此,可能低聚糖通过触发与细胞相互作用的表面黏附蛋白的基因表达,进而促进乳酸菌对Caco-2细胞的黏附能力[23]。
表3 植物乳杆菌AUH2103进行细胞黏附时添加低聚糖的影响
Table 3 Effect of oligosaccharide addition on the adhesion ability of L.plantarum AUH2103
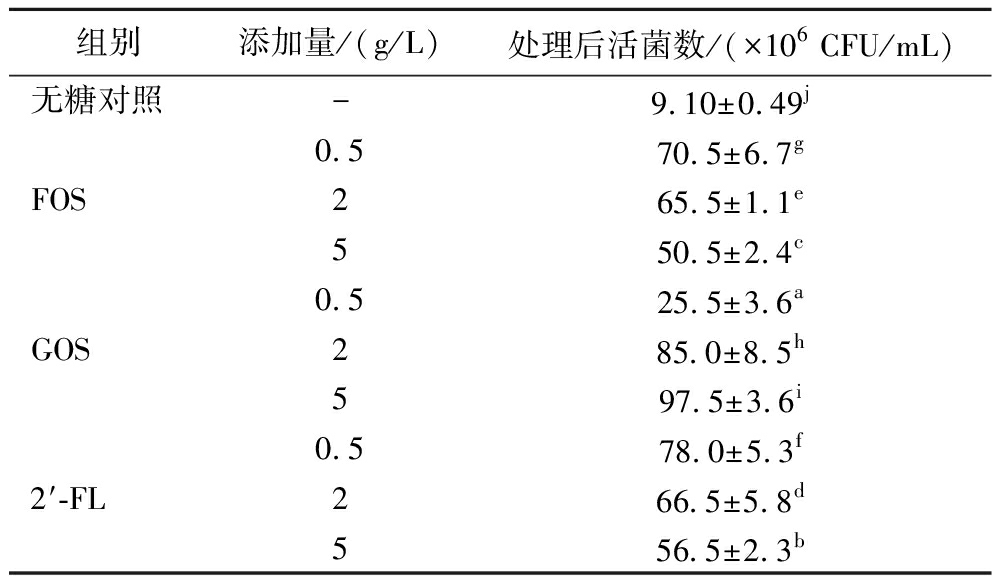
组别添加量/(g/L)处理后活菌数/(×106 CFU/mL)无糖对照-9.10±0.49jFOS0.570.5±6.7g265.5±1.1e550.5±2.4cGOS0.525.5±3.6a285.0±8.5h597.5±3.6i2′-FL0.578.0±5.3f266.5±5.8d556.5±2.3b
注:-表示未添加。
2.2.2 复配低聚糖对黏附的促进作用
低聚糖经过复配后,可能存在协同作用,由表4可知,在所有组别中,组别B对于植物乳杆菌AUH2103的黏附能力提高效果最好,黏附的活菌数达到了1.45×108 CFU/mL,显著高于其他组别(P<0.05)。在植物乳杆菌AUH2103孵育时添加复配低聚糖可以显著提高菌株细胞黏附能力,其中植物乳杆菌AUH2103在组别B的黏附的活菌数最高,即FOS含量为0.5 g/L、GOS含量为0.5 g/L和2′-FL 含量为2 g/L时,可以显著提高植物乳杆菌AUH2103对于Caco-2细胞的体外黏附能力。这项结果显示,在Caco-2细胞与植物乳杆菌AUH2103共同孵育时添加低聚糖,可以提高植物乳杆菌AUH2103的黏附能力。
表4 添加复配低聚糖对植物乳杆菌AUH2103对细胞黏附能力的影响
Table 4 Effect of addition of complex oligosaccharide on cell adhesion ability of L.plantarum AUH2103

组别黏附后活菌数/(×107CFU/mL)A13.4±0.19bB14.5±0.11aC3.43±0.04hD12.5±0.06cE3.52±0.10gF1.67±0.10iG8.88±0.25eH5.55±0.32fI9.05±0.31d
2.3 复配低聚糖和植物乳杆菌AUH2103对致病菌黏附的抑制
益生菌在肠道细胞中形成肠道屏障后,可以有效阻止侵袭型的肠道病原菌与肠道细胞接触,从而降低病原菌侵袭肠道从而导致疾病的概率。此前通过Caco-2细胞黏附试验已经证明,在低聚糖存在的情况下,植物乳杆菌AUH2103对于Caco-2细胞的黏附能力有所提高。选择此前试验中已经确认可以显著提高黏附能力的低聚糖配方和目前研究较多的2′-FL作为低聚糖干预组,观察其是否具有保护Caco-2细胞免受病原微生物黏附的能力。黏附试验模拟2种常见的情况,第一种为竞争性黏附,即乳酸菌与病原微生物同时存在的情况下,观察乳酸菌的存在是否会降低病原微生物的黏附效果。第二种为排斥性黏附,即乳酸菌先对Caco-2细胞进行黏附后,观察致病菌的黏附是否有所降低。
2.3.1 低聚糖对于致病菌黏附的影响
结果图1所示,对比不添加低聚糖的单独黏附组,对于大肠杆菌和蜡样芽孢杆菌而言,添加2′-FL干预可以促进其黏附能力;而添加复配低聚糖则可以促进沙门氏菌对于细胞的黏附;金黄色葡萄球菌的黏附则被2种添加的低聚糖抑制。结果显示出了明显的菌株特异性,这种情况在目前的研究中较为常见,例如FACINELLI等[24]的研究显示,在存在6′-岩藻糖基乳糖和2′-唾液酸乳糖的情况下,大肠杆菌对于Caco-2细胞的黏附显着降低。2种低聚糖对非伤寒沙门氏菌未观察到积极影响。CILIEBORG等[25]的研究显示,使用2′-FL可以抑制大肠杆菌F18对于肠上皮细胞的体外黏附。
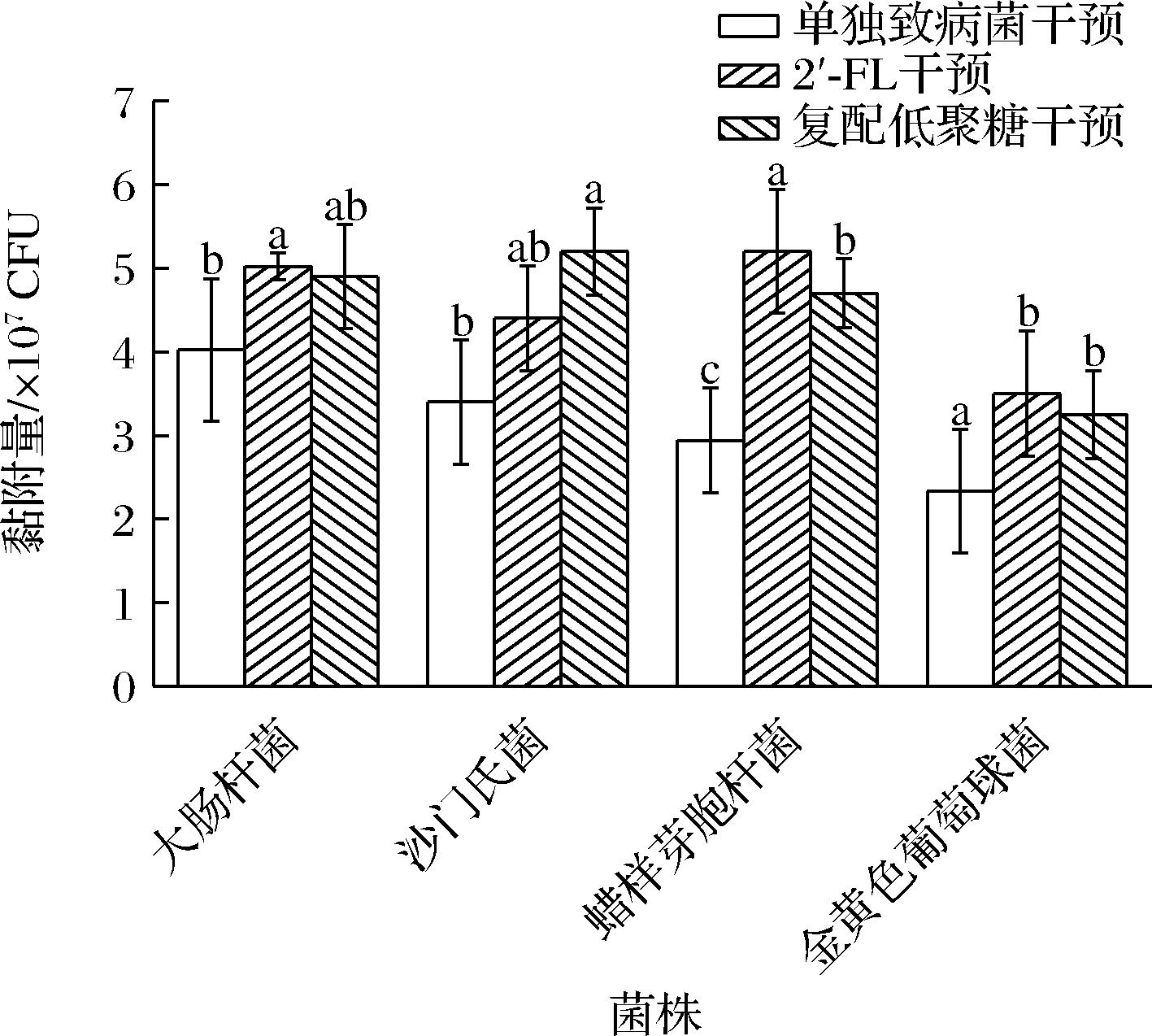
图1 低聚糖对致病菌黏附能力的影响
Fig.1 Effect of oligosaccharides on the adhesion ability of pathogenic bacteria
注:不同字母表示有显著性差异(P<0.05)(下同)。
2.3.2 低聚糖对植物乳杆菌AUH2103与致病菌竞争黏附影响
竞争性黏附试验如图2所示,添加2′-FL后,致病菌的黏附数下降的最多,显著低于其他组别(P<0.05)。沙门氏菌和金黄色葡萄球菌的黏附结果显示,低聚糖干预可以有效降低沙门氏菌的黏附量,但是两种低聚糖干预后的结果并无显著性差异(P>0.05)。蜡样芽胞杆菌的结果则显示,无论添加低聚糖与否,对于其黏附能力均无显著影响。结果显示出了明显的菌株特异性。
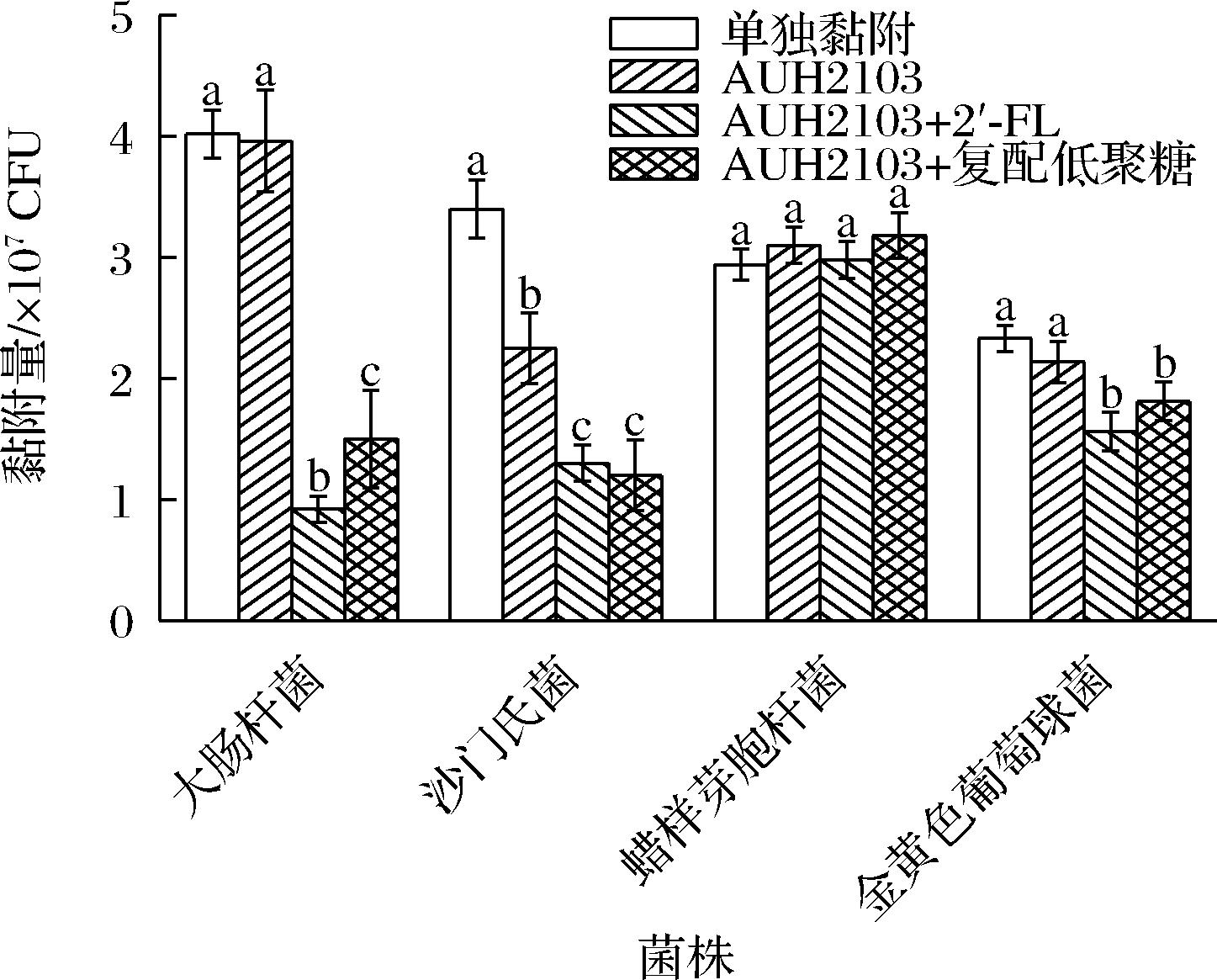
图2 低聚糖对植物乳杆菌AUH2103竞争黏附抑菌能力的影响
Fig.2 Effect of oligosaccharide on the competitive adhesion inhibitory ability of L.plantarum AUH2103
此外,JANKOWSKA等[26]的研究发现,益生菌对于致病菌的竞争性抑制存在着时效性,当孵化时间不同时,竞争性抑制的效果会发生变化。竞争性抑制存在着较为明显的菌株特异性,不同的益生菌对于不同的致病菌菌株的结果差异较大。
2.3.3 低聚糖对植物乳杆菌AUH2103与致病菌排斥黏附的影响
排斥黏附的结果如图3所示,提前使用植物乳杆菌AUH2103进行黏附后,对于所有致病菌的黏附效果均有显著的降低效果。这种降低效果也存在的很明显的菌株特异性,对于大肠杆菌和沙门氏菌而言,添加低聚糖与直接使用菌株干预并无显著性差异(P>0.05),蜡样芽胞杆菌的黏附结果显示,使用2′-FL干预后,其黏附数量与其他项组别相比显著下降(P<0.05)。金黄色葡萄球菌的结果则显示,低聚糖可以有效降低其黏附数,但是量种低聚糖之间并无显著性差异(P>0.05)。在JAYASHREE等[27]的研究中,发现一株发酵乳杆菌也具有排斥耐甲氧西林金黄色葡萄球菌黏附Caco-2细胞的现象,而COCONNIER等[28]的研究则发现,一株嗜酸乳杆菌以浓度依赖性的方式抑制了鼠伤寒沙门氏菌和肠道致病性大肠杆菌(EPEC)对于Caco-2细胞的结合,这种抑制的机制可能是是由于乳酸菌阻止了致病菌与细胞上的受体相结合,而不是通过特异性的阻断受体导致的。
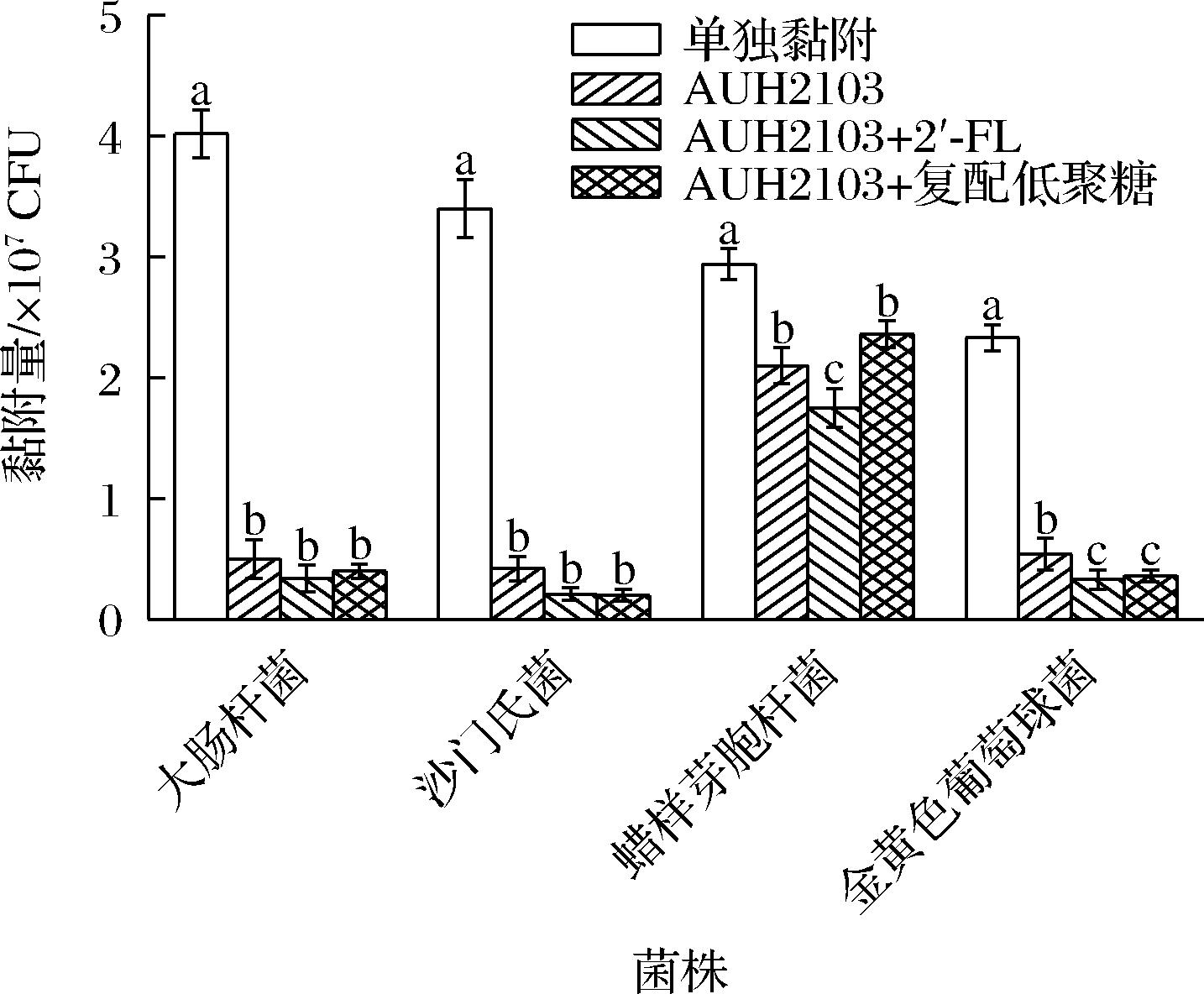
图3 低聚糖对植物乳杆菌AUH2103排斥黏附抑菌能力的影响
Fig.3 Effect of oligosaccharides on the ability of L.plantarum AUH2103 to repel adhesion and inhibit bacteria
3 结论与讨论
植物乳杆菌AUH2103在以不同低聚糖为主要碳源时,对致病菌的抑制能力与低聚糖的利用能力有关。在低聚糖存在的情况下,植物乳杆菌AUH2103可以更好地黏附Caco-2细胞;竞争性黏附和排斥性黏附试验表明,在低聚糖存在的情况下,植物乳杆菌AUH2103可以有效抑制致病菌对于Caco-2细胞的黏附效果。低聚糖,尤其是2′-FL通过协助黏附,与植物乳杆菌AUH2103发挥协同抑菌作用。本文提供了植物乳杆菌AUH2103在体外对致病菌黏附细胞具有抑制效果的作用,以此为基础可以进一步进行动物实验对植物乳杆菌AUH2103在体内是否具有相关作用进行探索。
[1] ECKBURG P B,BIK E M,BERNSTEIN C N,et al.Diversity of the human intestinal microbial flora[J].Science,2005,308(5728):1635-1638.
[2] FURCI F,CAMINATI M,CRISAFULLI E,et al.The intriguing possibility of using probiotics in allergen-specific immunotherapy[J].World Allergy Organization Journal,2023,16(2):100751.
[3] HANEISHI Y,FURUYA Y,HASEGAWA M,et al.Inflammatory bowel diseases and gut microbiota[J].International Journal of Molecular Sciences,2023,24(4):3817.
[4] QI Y,WANG X F.The role of gut microbiota in high-fat-diet-induced diabetes:Lessons from animal models and humans[J].Nutrients,2023,15(4):922.
[5] KAMADA N,CHEN G Y,INOHARA N,et al.Control of pathogens and pathobionts by the gut microbiota[J].Nature Immunology,2013,14:685-690.
[6] PIEWNGAM P,ZHENG Y,NGUYEN T H,et al.Pathogen elimination by probiotic Bacillus via signalling interference[J].Nature,2018,562:532-537.
[7] GIBSON G R,HUTKINS R,SANDERS M E,et al.Expert consensus document:The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics[J].Nature Reviews Gastroenterology and Hepatology,2017,14(8):491-502.
[8] ROBERFROID M,GIBSON G R,HOYLES L,et al.Prebiotic effects:Metabolic and health benefits[J].The British Journal of Nutrition,2010,104(Suppl 2):1-63.
[9] GARRIDO D,RUIZ-MOYANO S,LEMAY D G,et al.Comparative transcriptomics reveals key differences in the response to milk oligosaccharides of infant gut-associated bifidobacteria[J].Scientific Reports,2015,5:13517.
[10] OOZEER R,VAN LIMPT K,LUDWIG T,et al.Intestinal microbiology in early life:Specific prebiotics can have similar functionalities as human-milk oligosaccharides1[J].The American Journal of Clinical Nutrition,2013,98(2):561S-571S.
[11] RUIZ-PALACIOS G M,CERVANTES L E,RAMOS P,et al.Campylobacter jejuni binds intestinal H(O) antigen (Fuc alpha 1,2Gal beta 1,4GlcNAc),and fucosyloligosaccharides of human milk inhibit its binding and infection[J].The Journal of Biological Chemistry,2003,278(16):14112-14120.
[12] YU Z T,NANTHAKUMAR N N,NEWBURG D S.The human milk oligosaccharide 2′-fucosyllactose quenches Campylobacter jejuni-induced inflammation in human epithelial cells HEp-2 and HT-29 and in mouse intestinal Mucosa1[J].The Journal of Nutrition,2016,146(10):1980-1990.
[13] BOHORA A A,KOKATE S R,KHEDKAR S,et al.Antimicrobial activity of probiotics against endodontic pathogens:A preliminary study[J].Indian Journal of Medical Microbiology,2019,37(1):5-11.
[14] ALIZADEH BEHBAHANI B,NOSHAD M,FALAH F.Inhibition of Escherichia coli adhesion to human intestinal Caco-2 cells by probiotic candidate Lactobacillus plantarum strain L15[J].Microbial Pathogenesis,2019,136:103677.
[15] SINGH T P,KAUR G,KAPILA S,et al.Antagonistic activity of Lactobacillus reuteri strains on the adhesion characteristics of selected pathogens[J].Frontiers in Microbiology,2017,8:486.
[16] 王鹏,刚梦萱,张臣臣,等.母乳源乳酸菌的低聚糖利用特性研究[J].食品与发酵工业,2022,48(11):101-106.
WANG P,GANG M X,ZHANG C C,et al.Oligosaccharide utilization characteristics of lactic acid bacteria from breast milk[J].Food and Fermentation Industries,2022,48(11):101-106.
[17] COPPA G V,BRUNI S,ZAMPINI L,et al.Oligosaccharides of human milk inhibit the adhesion of listeria monocytogenes to Caco-2 cells[J].The Italian Journal of Pediatrics,2003,29(1):61-68.
[18] ELO S,SAXELIN M,SALMINEN S.Attachment of Lactobacillus casei strain GG to human colon carcinoma cell line Caco-2:Comparison with other dairy strains Lett[J].Letters in Applied Microbiology,1991,13(3):154-156.
[19] CHAUVIERE G,COCONNIER M H,KERNEIS S,et al.Adhesion of human Lactobacillus acidophilus strain LB to human enterocyte-like Caco-2 cells[J].Journal of General Microbiology,1992,138(8):1689-1696.
[20] BERNET M F,BRASSART D,NEESER J R,et al.Adhesion of human bifidobacterial strains to cultured human intestinal epithelial cells and inhibition of enteropathogen-cell interactions[J].Applied and Environmental Microbiology,1993,59(12):4121-4128.
[21] BEACHEY E H.Bacterial adherence:Adhesin-receptor interactions mediating the attachment of bacteria to mucosal surfaces[J].The Journal of Infectious Diseases,1981,143(3):325-345.
[22] GRIGORYAN S,BAZUKYAN I,TRCHOUNIAN A.Aggregation and adhesion activity of lactobacilli isolated from fermented products in vitro and in vivo:A potential probiotic strain[J].Probiotics and Antimicrobial Proteins,2018,10(2):269-276.
[23] ENDO H,TAMURA K,FUKASAWA T,et al.Comparison of fructooligosaccharide utilization by Lactobacillus and Bacteroides species[J].Bioscience,Biotechnology,and Biochemistry,2012,76(1):176-179.
[24] FACINELLI B,MARINI E,MAGI G,et al.Breast milk oligosaccharides:Effects of 2′-fucosyllactose and 6′-sialyllactose on the adhesion of Escherichia coli and Salmonella fyris to Caco-2 cells[J].The Journal of Maternal-Fetal and Neonatal Medicine,2019,32(17):2950-2952.
[25] CILIEBORG M S,SANGILD P T,JENSEN M L,et al.α1,2-Fucosyllactose does not improve intestinal function or prevent Escherichia coli F18 diarrhea in newborn pigs[J].Journal of Pediatric Gastroenterology and Nutrition,2017,64(2):310-318.
[26] JANKOWSKA A,LAUBITZ D,ANTUSHEVICH H,et al.Competition of Lactobacillus paracasei with Salmonella enterica for adhesion to Caco-2 cells[J].Journal of Biomedicine and Biotechnology,2008,2008:357964.
[27] JAYASHREE S,KARTHIKEYAN R,NITHYALAKSHMI S,et al.Anti-adhesion property of the potential probiotic strain Lactobacillus fermentum 8711 against methicillin-resistant Staphylococcus aureus (MRSA)[J].Frontiers in Microbiology,2018,9:411.
[28] COCONNIER M H,BERNET M F,KERNÉIS S,et al.Inhibition of adhesion of enteroinvasive pathogens to human intestinal Caco-2 cells by Lactobacillus acidophilus strain LB decreases bacterial invasion[J].FEMS Microbiology Letters,1993,110(3):299-305.