近年来随着人们对老茶风味的追求,独具陈香、口感醇厚、兼具一定健康功效的陈香型铁观音[1]逐渐受到更多的关注。但陈香型铁观音的自然陈化周期漫长,这不仅增加工厂的生产成本,也不利于陈香型铁观音的推广和文化传承,因此缩短铁观音的陈化周期具有重要的经济和文化价值。茶叶中的香气化合物由多种前体降解生成,来源于类胡萝卜素的降解产物是最重要的香气化合物之一[2-3],其对贮存的茶叶中木香等陈香有关香韵的形成有利,如贮存5年内祁门红茶中类胡萝卜素降解产物含量显著增加,尤其是二氢猕猴桃内酯浓度较高且与茶叶的木香得分具有一致趋势,被推断在祁门红茶独特木香的形成中起到重要作用[4];贮存的绿茶[5]和茯砖茶[6]中酮类化合物是主要的挥发性化合物,其被认为可能通过类胡萝卜素降解途径生成,并能为茯砖茶提供特殊的花香和木香风味;在贮存的普洱茶中[7]α-紫罗兰酮、β-紫罗兰酮、二氢猕猴桃内酯等类胡萝卜素降解产物也是特征陈香物质之一。因此,推测增加铁观音茶中类胡萝卜素降解产物是加速铁观音陈化和获取陈香的潜在方式。
类胡萝卜素结构高度不饱和、易发生降解,与物理和化学降解方式相比,生物降解具有条件温和、绿色友好、产率高等特点[8],利用生物降解类胡萝卜素增加香气物质含量的研究也逐渐增多。如蔡程晨[9]从土壤中筛选到一株降解类胡萝卜素的枯草芽孢杆菌,并将其应用于芒果汁发酵,结果显示类胡萝卜素降解产物含量有所增加;田争福等[10]使用具有类胡萝卜素降解能力的库特氏菌发酵液辅助枸杞酒发酵,发酵结束后其香气成分改善。这些研究也表明通过生物降解类胡萝卜素改良产品风味特征是可行的策略。
茶叶中的类胡萝卜素主要是β-胡萝卜素和叶黄素[11],目前对β-胡萝卜素的研究颇多。因此本研究以β-胡萝卜素为底物,在铁观音中筛选出具有β-胡萝卜素降解能力的菌株,并将菌株应用于铁观音的发酵以增加类胡萝卜素降解产物含量,实现铁观音陈香风味和品质的提升。
1 材料与方法
1.1 材料与试剂
2022年生产的铁观音新茶,铁观音陈茶(陈化时间为3、7、11、15、19、23年),来自福建安溪铁观音集团股份有限公司;β-胡萝卜素(97%),上海源叶生物科技有限公司;酵母粉、蛋白胨、麦芽粉,Oxoid公司;其他未列出试剂均为国产分析纯。
LB固体培养基(g/L):酵母粉5,蛋白胨10,NaCl 10,琼脂20,121 ℃灭菌15 min。
ISP2固体培养基(g/L):酵母粉4,葡萄糖4,麦芽粉10,琼脂20,121 ℃灭菌15 min。
PDA培养基(g/L):马铃薯浸粉6,葡萄糖20,琼脂20,121 ℃灭菌15 min。
富集培养基(g/L):K2HPO4 1,MgSO4·7H2O 0.5,NaNO3 3,FeSO4·7H2O 0.01,KCl 0.5,蔗糖30,酵母粉3,121 ℃灭菌15 min。
分离培养基:在富集培养基配方的基础上添加1 g/L β-胡萝卜素和20 g/L琼脂。
发酵培养基:在富集培养基配方的基础上添加1 g/L β-胡萝卜素。
1.2 仪器与设备
HDPF-256恒温培养箱,上海跃进医疗器械有限公司;GI80T高压蒸汽灭菌锅,致微(厦门)仪器有限公司;C1000 TouchTMPCR仪,美国Bio-Rad公司;DYY-6D核酸电泳仪,北京六一电泳仪厂;UVmini-1280紫外分光光度计,岛津仪器(苏州)有限公司;BXS-400S恒温恒湿培养箱,上海博迅医疗生物仪器股份有限公司;50/30 μm DVB/CAR/PDMS固相微萃取(solid-phase microextraction,SPME)纤维头,美国Supelco公司;SCIONSQ-456-GCGC-MS仪器,美国Burker公司。
1.3 实验方法
1.3.1 降解β-胡萝卜素菌株的筛选
初筛:称量2 g铁观音陈茶混合样在100 mL无菌生理盐水中,在4 ℃、220 r/min条件下洗涤24 h;吸取2 mL洗涤液和称取2 g陈茶混合样于50 mL富集培养基中,在30 ℃、220 r/min条件下培养48 h。吸取上清液用生理盐水稀释至10-1~10-5浓度并涂布于分离培养基中,置于30 ℃培养箱避光培养72 h,挑选出生长周围透明圈明显的菌株进行复筛。
复筛:划线纯化初筛菌株,挑取单一菌落至发酵培养基中,在30 ℃、220 r/min条件下避光发酵48 h,测定β-胡萝卜素的降解率。
β-胡萝卜素母液的配制,参考段焰青等[12]的方法:称量0.5 g的β-胡萝卜素于10 mL二氯甲烷中,彻底溶解后加入1 g吐温-80搅拌乳化。放置于避光条件下过夜彻底挥发二氯甲烷,再加入100 mL无菌水复溶,过滤后得到β-胡萝卜素母液。
β-胡萝卜素含量的测定:测定β-胡萝卜素溶液在454 nm波长处的标准曲线为y=1.700 8x+0.002 3,R2=0.999 2。测定发酵上清液在454 nm波长的吸光度,根据β-胡萝卜素的标准曲线计算质量浓度(g/L)。
β-胡萝卜素降解率的计算方法在龙章德等[13]的方法上略作修改:在发酵培养基中接种菌株培养48 h作为实验组,同样培养条件但未接种的发酵培养基作为对照组。为了排除培养基与菌株发酵液的颜色干扰,在发酵48 h后,以接种的富集培养基作为空白测定实验组的吸光度,以未接种的富集培养基作为空白测定对照组的吸光度,并分别计算出β-胡萝卜素的浓度,降解率(R)计算如公式(1)所示:
(1)
1.3.2 降解β-胡萝卜素菌株的鉴定
将复筛得到的菌株在真菌培养基和细菌培养基上划线分离出单菌落,进行菌落形态观察与鉴定。
真菌使用ITS1和ITS4通用引物进行PCR扩增,扩增体系为:15 μL Rapid Taq Mater Mix,1 μL ITS1(10 μmol/L),1 μL ITS4(10 μmol/L),1 μL 菌液,12 μL ddH2O,扩增程序为:94 ℃ 5 min(预变性),94 ℃ 30 s(变性),55 ℃ 30 s(退火),72 ℃ 15 s(延伸),变性-退火-延伸步骤重复35个循环,然后72 ℃延伸10 min结束扩增。细菌使用27F和1492R通用引物进行PCR扩增,扩增体系同真菌扩增体系,扩增程序为:94 ℃ 5 min(预变性),94 ℃ 30 s(变性),55 ℃ 30 s(退火),72 ℃ 30 s(延伸),变性-退火-延伸步骤重复35个循环,然后72 ℃延伸10 min结束扩增。
PCR扩增产物使用2%的琼脂糖凝胶验证条带,将条带大小正确的扩增产物送至生工生物工程(上海)股份有限公司测序,测序引物同扩增引物。测序结果经过双向拼接后,在NCBI上进行BLAST比对,并利用MEGA11软件构建系统发育树。
1.3.3 茶叶强化发酵实验
菌液的制备:细菌使用LB液体培养基中在30 ℃,220 r/min培养24 h,离心得到菌体沉淀,使用生理盐水重悬菌体沉淀并调节浓度至OD600=1。真菌使用PDA培养基30 ℃培养5~7 d,然后使用生理盐水冲洗收集孢子,并将孢子液通过4层纱布过滤除去菌丝体,经平板计数后调整孢子液浓度为1×107 CFU/mL。
茶叶强化发酵工艺:称量200 g铁观音新茶,按照2%接种量接入浓度适宜的菌液,施加无菌水使茶叶潮水量达到20%,在恒温恒湿培养箱中,控制温度为30 ℃,湿度为40%,发酵21 d。以相同处理条件下只施加无菌水达到潮水量20%的茶叶作为对照(CK)。发酵结束后80 ℃烘干茶叶至易脆折的程度。
1.3.4 茶叶挥发性化合物的分析
挥发性化合物的提取和分离,参考ZHANG等[14]的方法:称量2 g茶叶于萃取瓶,加入5 mL沸水冲泡并放置在60 ℃水浴中,使用SPME纤维头顶空吸附30 min,每个样品萃取3次。采用GC-MS仪器分析挥发性化合物,并使用DB-Wax柱(30.0 m×0.25 mm×0.25 μm)分离化合物。在分流模式下,进样口的温度为250 ℃。以1 mL/min的恒定流速使用高纯氦气作为载气,使用程序升温模式,烘箱初始温度为40 ℃保持3 min,以8 ℃/min升温至120 ℃,然后以10 ℃/min 升温至230 ℃,并保持10 min。质谱仪是在电子碰撞模式下运行的,轰击能为70 eV,质量扫描范围是33~450原子质量单位。传输线温度为250 ℃,离子源温度为200 ℃。
挥发性化合物的鉴定和含量分析:将质谱结果与NIST库中的标准质谱比对,保留匹配度高于800的化合物,并使用质谱检测的峰面积比较不同化合物的相对含量。本课题组曾使用癸酸乙酯作为内标计算化合物浓度,但检测到其峰面积总是不稳定,在之前的研究中也报道过这种情况,可能是由于茶叶颗粒本身吸附内标[15]会导致误差较大,因此本研究使用峰面积进行化合物的含量变化研究,并使用R 4.0.0软件“pheatmap”和“RColorBrewer”包来完成挥发性化合物含量热图的绘制,便于分析化合物在样品间的变化情况。
1.3.5 感官品评
邀请3位具有陈香型铁观音品评资格的品评员,按照GB/T 23776—2018《茶叶感官审评方法》乌龙茶的盖碗审评法对茶叶进行感官品评。品评员经过讨论和分析后确定以下6个指标对茶叶的香韵特征进行定量描述,分别为:花香、果香、甜香、酸香、陈香、总体评价,并采用5分制进行打分。
2 结果与分析
2.1 降解β-胡萝卜素菌株的筛选结果
将富集的茶叶微生物群落在分离培养基上培养,共获得300余株生长良好的菌株。经过比较平板透明圈大小和对菌落多次纯化,获得3株生长周围有明显透明圈的菌株,分别命名为HA,Hb,Hc。如图1所示,将菌株接入发酵培养基,观察到菌株对β-胡萝卜素具有良好的降解能力,溶液颜色明显减轻。经测定HA、Hb、Hc菌株对β-胡萝卜素的降解率具有显著差异且分别达到94.54%、72.97%、61.26%。

a-未接种的发酵培养基(对照组);b-接种HA的发酵培养基;c-接种Hb的发酵培养基;d-接种Hc的发酵培养基
图1 菌株发酵48 h对β-胡萝卜素降解效果
Fig.1 Degradation effects of β-carotene by strains fermentation for 48 h
2.2 降解β-胡萝卜素菌株的鉴定结果
菌株的形态如图2所示,HA菌株在PDA培养基上生长良好,呈厚绒状,培养初期菌落为白色,中心有淡黄色区域,后期孢子大量繁殖,菌落表面覆盖黑色颗粒,菌落背面为白色中心带有黄色,符合典型的黑曲霉菌落特征,初步判定为一株黑曲霉。Hb菌株在LB固体培养基上生长形成浅黄色、圆形、不透明的菌落,菌落表面有褶皱、中心凹陷呈现火山口状,黏液少,符合典型的芽孢杆菌属的菌落特征,初步判定为一株芽孢杆菌属细菌。Hc菌株在ISP2固体培养基上生成广泛的浅橙色的基质菌丝体,表面覆盖白色、弯曲呈钩状的气生菌丝,中心存在空菌丝间隔,有球形孢子链,菌落没有扩散的色素产生,与培养基结合紧密难以挑起,符合典型的糖多孢菌属菌落特征[16],初步判定为一株糖多孢菌属细菌。
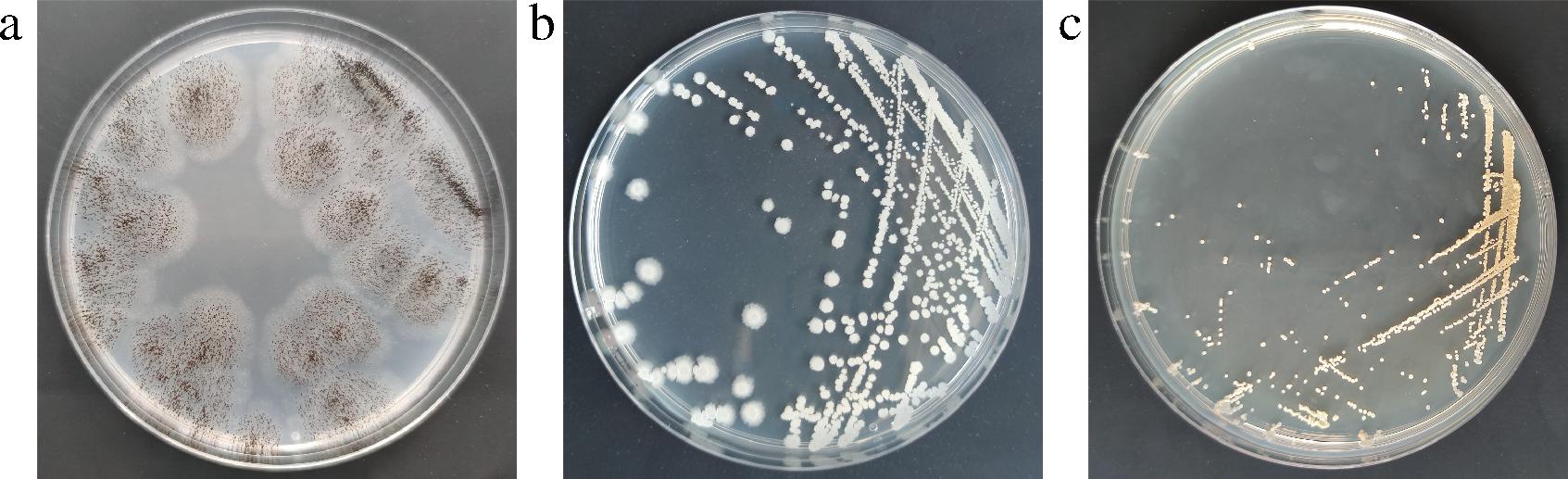
a-HA菌株在PDA平板的菌落形态;b-Hb菌株在LB平板的菌落形态;c-Hc菌株在ISP2平板的菌落形态
图2 菌株在固体培养基上的形态
Fig.2 Morphologies of strains on solid media
将HA、Hb、Hc菌株双向测序序列在NCBI库中进行BLAST比对,分别选择相似度前10的序列构建系统发育树。结果如图3所示,HA菌株与黑曲霉(Aspergillus niger)具有很高的相似性,其中与Aspergillus niger (MT597434.1)和Aspergillus niger (MK886749.1)具有最高的同源性,相似性分别为99.01%和99.5%,因此判定HA菌株为一株黑曲霉(Aspergillus niger)。Hb菌株与芽孢杆菌属细菌具有很高的相似性,其中与Bacillus methylotrophicus (JN700125.1)具有最高同源性,与Bacillus velezensis (OK605053.1)具有第二高度的同源性,相似性分别达到了99.79%和99.86%,这2株菌都是贝莱斯芽孢杆菌种的微生物[17],因此判定Hb菌株为一株贝莱斯芽孢杆菌(Bacillus velezensis)。Hc菌株与糖多孢菌属细菌具有很高的相似性,其中与Saccharopolyspora gregorii (KT720280.1)具有最高的同源性,且相似形达到了99.64%,结合形态学结果判定Hc菌株为一株Saccharopolyspora gregorii。

a-HA菌株的系统发育树;b-Hb菌株的系统发育树;c-Hc菌株的系统发育树
图3 菌株的系统发育树
Fig.3 Phylogenetic trees of strains
2.3 茶样的挥发性化合物分析
本研究采用顶空固相微萃取结合气相色谱-质谱联用技术对茶样进行挥发性成分的鉴定和分析,共检测出36种挥发性化合物,它们的香气特征及含量如表1所示。挥发性化合物可以分为七类,包括醇类10种、碳氢化合物8种、含氮化合物6种、酮类6种、酯类3种、酸类2种、醛类1种,醇类化合物是种类最多的挥发性化合物,而碳氢化合物是含量最多的挥发性化合物,占总化合物含量的38.65%。将所有的挥发性化合物含量以热图展示(图4),其中红色表示挥发性化合物含量高,蓝色表示含量低。与添加水的对照茶样相比(CK),添加菌株的发酵茶样中挥发性化合物总量都有增加,且发酵茶样中的挥发性化合物含量变化各不相同,说明本实验筛选的3株微生物都能促进茶叶香气生成,并且3株菌的效果不重叠。
表1 茶样中挥发性化合物的香气特征及含量
Table 1 Aroma characteristics and content of volatile compounds in tea samples
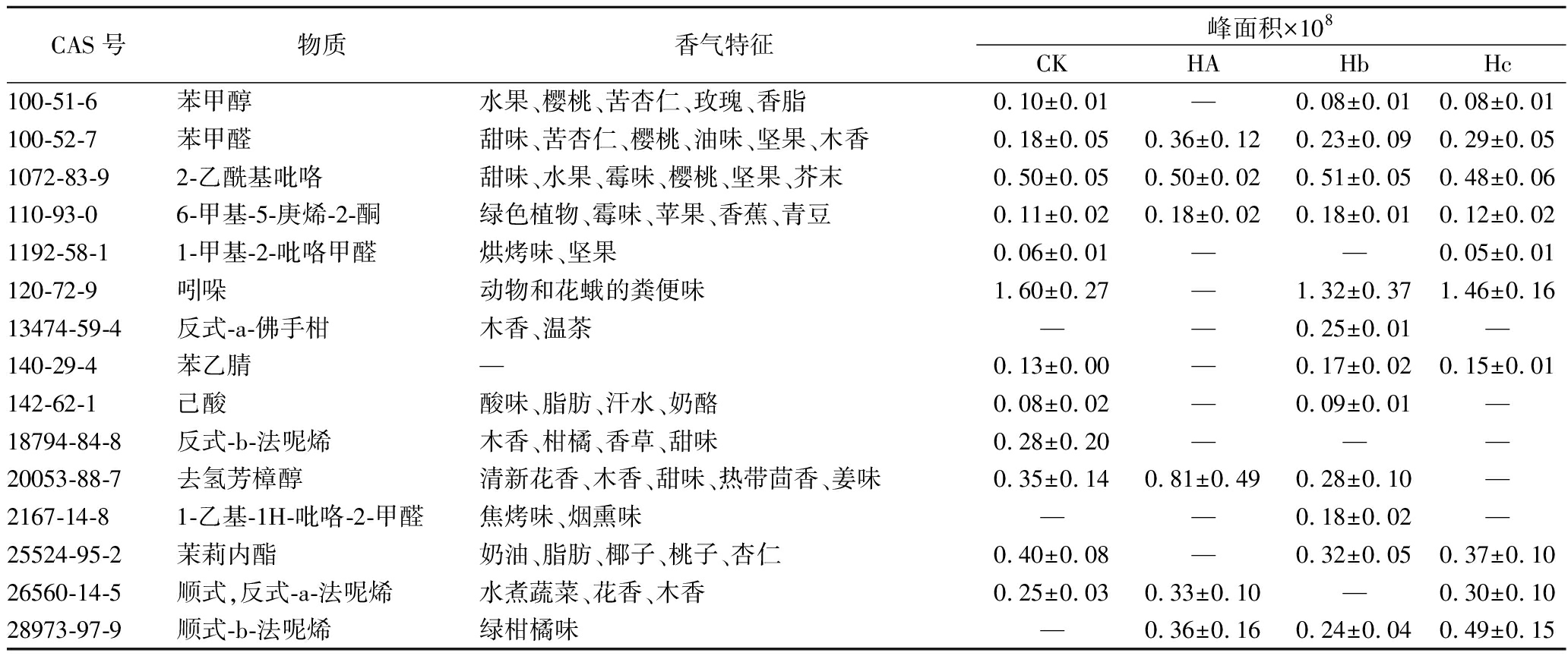
CAS号物质香气特征峰面积×108CKHAHbHc100-51-6苯甲醇水果、樱桃、苦杏仁、玫瑰、香脂0.10±0.01—0.08±0.010.08±0.01100-52-7苯甲醛甜味、苦杏仁、樱桃、油味、坚果、木香0.18±0.050.36±0.120.23±0.090.29±0.051072-83-92-乙酰基吡咯甜味、水果、霉味、樱桃、坚果、芥末0.50±0.050.50±0.020.51±0.050.48±0.06110-93-06-甲基-5-庚烯-2-酮绿色植物、霉味、苹果、香蕉、青豆0.11±0.020.18±0.020.18±0.010.12±0.021192-58-11-甲基-2-吡咯甲醛烘烤味、坚果0.06±0.01——0.05±0.01120-72-9吲哚动物和花蛾的粪便味1.60±0.27—1.32±0.371.46±0.1613474-59-4反式-a-佛手柑木香、温茶——0.25±0.01—140-29-4苯乙腈—0.13±0.00—0.17±0.020.15±0.01142-62-1己酸酸味、脂肪、汗水、奶酪0.08±0.02—0.09±0.01—18794-84-8反式-b-法呢烯木香、柑橘、香草、甜味0.28±0.20———20053-88-7去氢芳樟醇清新花香、木香、甜味、热带茴香、姜味0.35±0.140.81±0.490.28±0.10—2167-14-81-乙基-1H-吡咯-2-甲醛焦烤味、烟熏味——0.18±0.02—25524-95-2茉莉内酯奶油、脂肪、椰子、桃子、杏仁0.40±0.08—0.32±0.050.37±0.1026560-14-5顺式,反式-a-法呢烯水煮蔬菜、花香、木香0.25±0.030.33±0.10—0.30±0.1028973-97-9顺式-b-法呢烯绿柑橘味—0.36±0.160.24±0.040.49±0.15
续表1
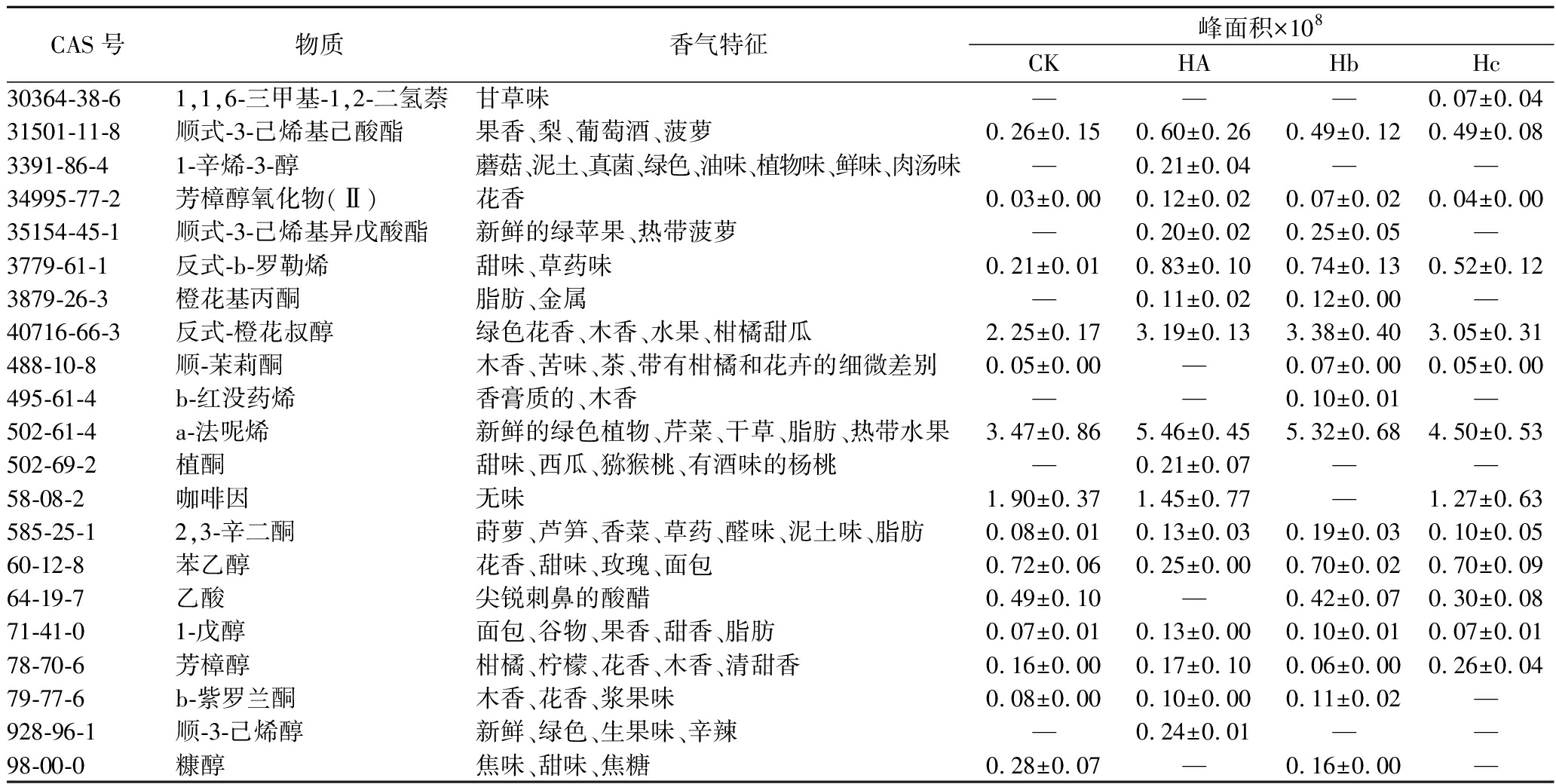
CAS号物质香气特征峰面积×108CKHAHbHc30364-38-61,1,6-三甲基-1,2-二氢萘甘草味———0.07±0.0431501-11-8顺式-3-己烯基己酸酯果香、梨、葡萄酒、菠萝0.26±0.150.60±0.260.49±0.120.49±0.083391-86-41-辛烯-3-醇蘑菇、泥土、真菌、绿色、油味、植物味、鲜味、肉汤味—0.21±0.04——34995-77-2芳樟醇氧化物(Ⅱ)花香0.03±0.000.12±0.020.07±0.020.04±0.0035154-45-1顺式-3-己烯基异戊酸酯新鲜的绿苹果、热带菠萝—0.20±0.020.25±0.05—3779-61-1反式-b-罗勒烯甜味、草药味0.21±0.010.83±0.100.74±0.130.52±0.123879-26-3橙花基丙酮脂肪、金属—0.11±0.020.12±0.00—40716-66-3反式-橙花叔醇绿色花香、木香、水果、柑橘甜瓜2.25±0.173.19±0.133.38±0.403.05±0.31488-10-8顺-茉莉酮木香、苦味、茶、带有柑橘和花卉的细微差别0.05±0.00—0.07±0.000.05±0.00495-61-4b-红没药烯香膏质的、木香——0.10±0.01—502-61-4a-法呢烯新鲜的绿色植物、芹菜、干草、脂肪、热带水果3.47±0.865.46±0.455.32±0.684.50±0.53502-69-2植酮甜味、西瓜、猕猴桃、有酒味的杨桃—0.21±0.07——58-08-2咖啡因无味1.90±0.371.45±0.77—1.27±0.63585-25-12,3-辛二酮莳萝、芦笋、香菜、草药、醛味、泥土味、脂肪0.08±0.010.13±0.030.19±0.030.10±0.0560-12-8苯乙醇花香、甜味、玫瑰、面包0.72±0.060.25±0.000.70±0.020.70±0.0964-19-7乙酸尖锐刺鼻的酸醋0.49±0.10—0.42±0.070.30±0.0871-41-01-戊醇面包、谷物、果香、甜香、脂肪0.07±0.010.13±0.000.10±0.010.07±0.0178-70-6芳樟醇柑橘、柠檬、花香、木香、清甜香0.16±0.000.17±0.100.06±0.000.26±0.0479-77-6b-紫罗兰酮木香、花香、浆果味0.08±0.000.10±0.000.11±0.02—928-96-1顺-3-己烯醇新鲜、绿色、生果味、辛辣—0.24±0.01——98-00-0糠醇焦味、甜味、焦糖0.28±0.07—0.16±0.00—
注:“—”代表香气特征未查询到或挥发性化合物未检测到;香气特征主要参考网站:http://www.thegoodscentscompany.com/search3.php;https://www.femaflavor.org/flavor-library/search?fulltext=932-66-1。
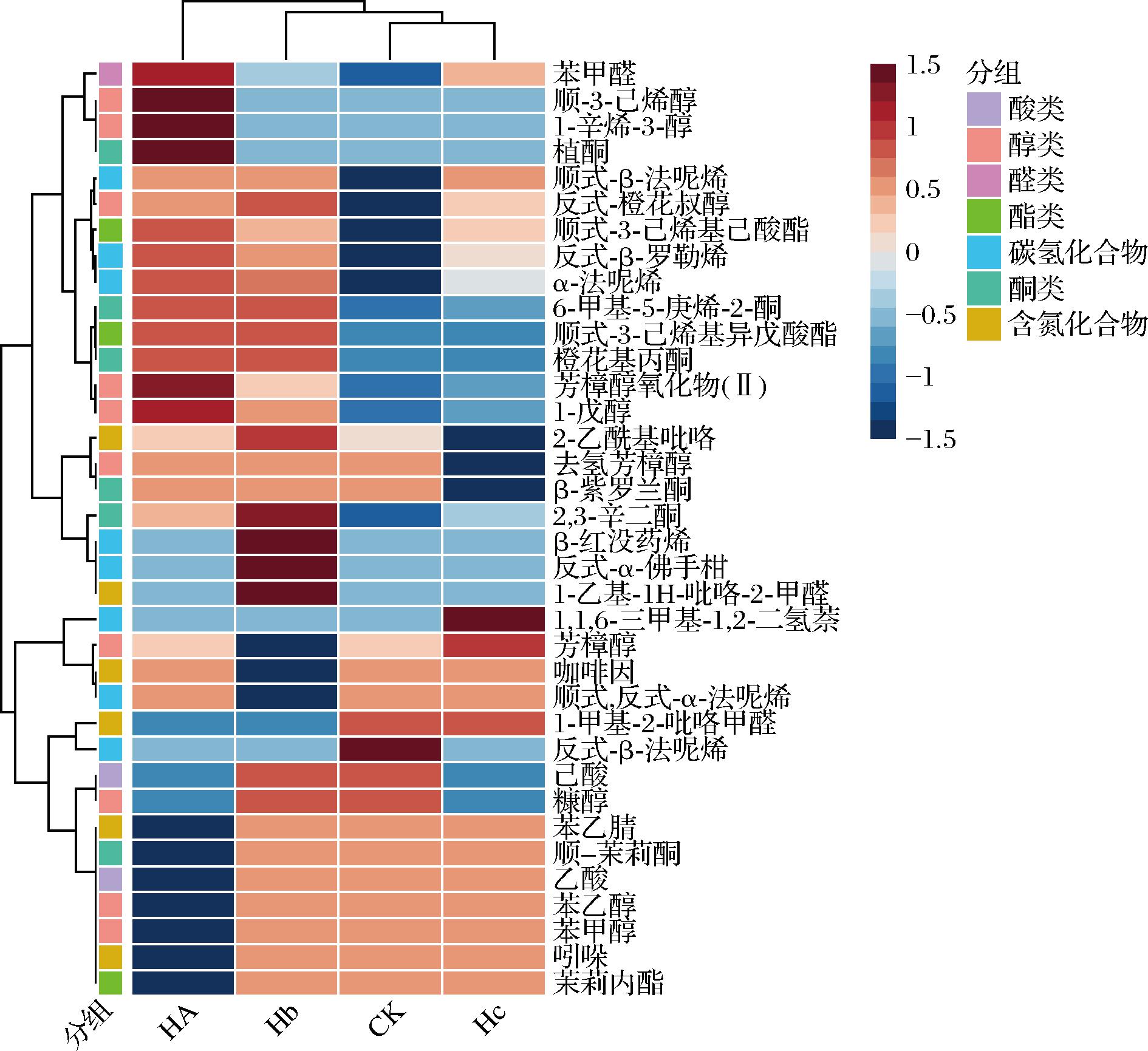
图4 茶样中挥发性化合物的热图展示
Fig.4 Heat map showing of volatile compounds in tea samples
茶样中不同种类挥发性化合物含量如图5所示,与对照相比,HA发酵茶样中碳氢化合物、醇类化合物和酮类化合物含量有显著提升(P<0.05),且酯类化合物和醛类化合物含量也有增加,其中提升幅度最大的是酮类化合物,相对于对照提升了128.12%;Hb发酵茶样中碳氢化合物、酯类化合物和酮类化合物含量较对照有显著的提升(P<0.05),醇类化合物和醛类化合物含量也有增加,其中酮类化合物幅度提升最大为109.38%;Hc发酵茶样中不同种类挥发性化合物含量没有显著提升,但Hc发酵茶样中的碳氢化合物、醇类化合物、酯类化合物和醛类化合物含量均较对照有一定程度的提升,其中醛类化合物提升幅度最大,相对于对照提升了61.11%。酮类和醛类化合物是氧化型化合物,被认为是铁观音陈茶区别于新茶的重要风味物质[18],因此施加菌株强化发酵茶叶能够一定程度上加速铁观音的陈化。在发酵茶样中酸类化合物和含氮化合物含量下降,酸类化合物可能是发生酯化反应生成酯类化合物[19],如己酸含量下降,而衍生物顺式-3-己烯基己酸酯含量增加;投入菌株的发酵茶样中微生物数量增加,消耗更多的还原糖,会导致部分美拉德反应产物减少,如1-甲基-2-吡咯甲醛在3个发酵茶样中含量均下降。吲哚是一种信号分子可以调节微生物的生理状态[20],微生物数量的增加可能会利用更多的吲哚使其含量下降。
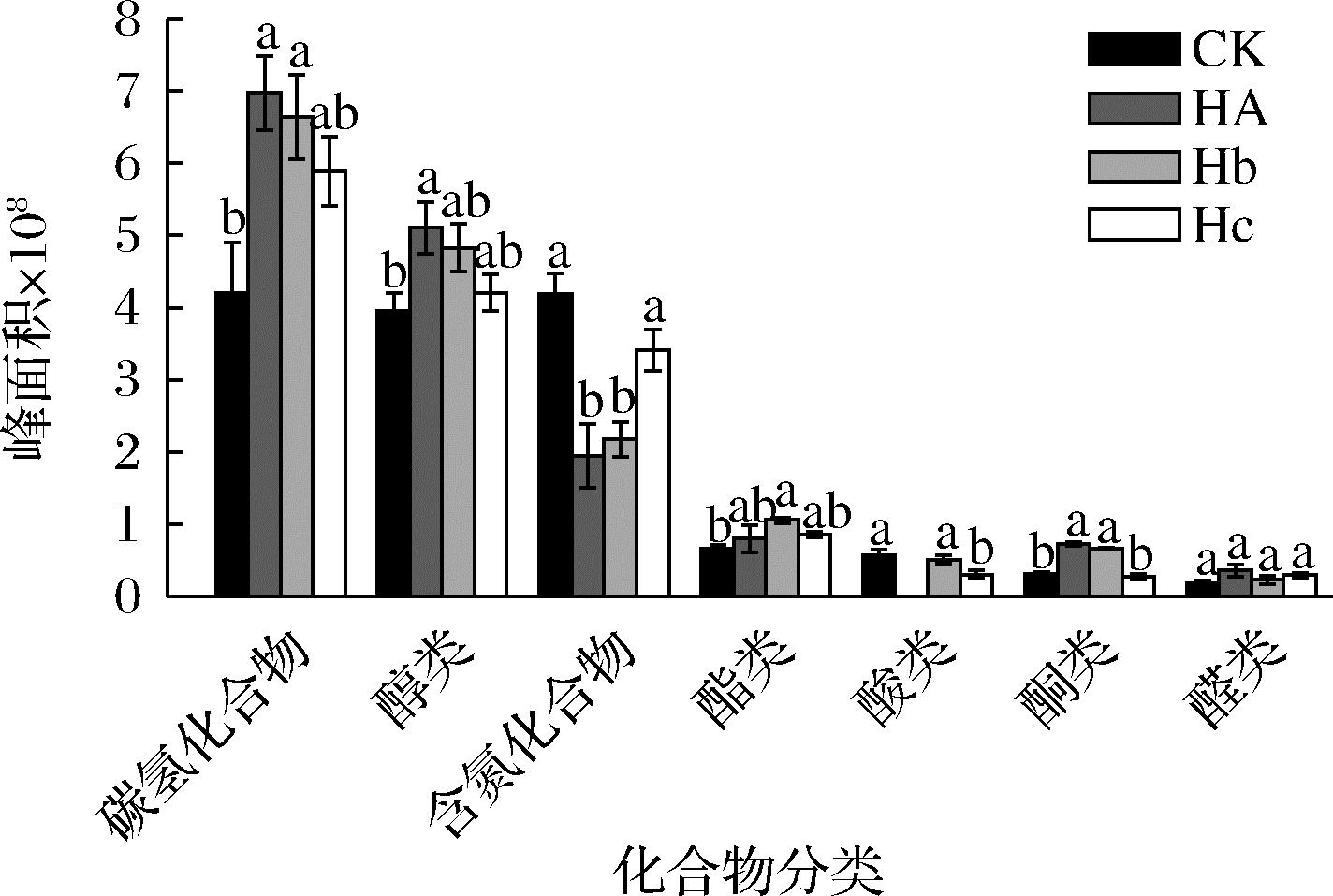
图5 茶样中不同种类挥发性化合物含量
Fig.5 Content of different categories of volatile compounds in tea samples
注:不同小写字母代表同一种类的挥发性化合物含量在不同茶样中差异显著性(P<0.05)。
为考察3株菌株在发酵过程中对β-胡萝卜素类物质的降解情况,本研究重点关注了茶样中类胡萝卜素降解产物的含量变化。如表2所示,4个茶样中共检测到13种类胡萝卜素降解产物,有12种物质在施加菌株的发酵茶叶中含量提升,说明投入的微生物生长良好、能够发挥其降解类胡萝卜素的能力。唯一下降的产物是反式-β-法呢烯,推测其可能转化为顺式,反式-α-法呢烯、顺式-β-法呢烯、α-法呢烯,从而导致含量下降。在HA、Hb、Hc发酵茶样中含量均提升的类胡萝卜素降解产物是6-甲基-5-庚烯-2-酮、顺式-β-法呢烯、芳樟醇氧化物(Ⅱ)、反式-橙花叔醇、α-法呢烯,原因可能是这些物质在类胡萝卜素降解途径中较易生成。HA发酵茶样中含量增加的有11种类胡萝卜素降解产物,其独有含量增加的降解产物为去氢芳樟醇和植酮;Hb发酵茶样中含量增加的有7种类胡萝卜素降解产物,没有独有增加的降解产物;Hc发酵茶样中含量增加的有8种类胡萝卜素降解产物,其独有增加的降解产物为1,1,6-三甲基-1,2-二氢萘。出现不同发酵茶样中独有的含量增加的降解产物的情况,可能是因为微生物所产降解类胡萝卜素的酶不完全一致[21],导致底物降解程度不同。与对照相比,HA、Hb、Hc发酵茶样中的类胡萝卜素降解产物总量分别提高了1.6、1.4、1.3倍,产物含量高低与菌株降解类胡萝卜素的能力大小相一致。
表2 茶样中类胡萝卜素降解产物含量
Table 2 Content of carotenoid degradation products in tea samples
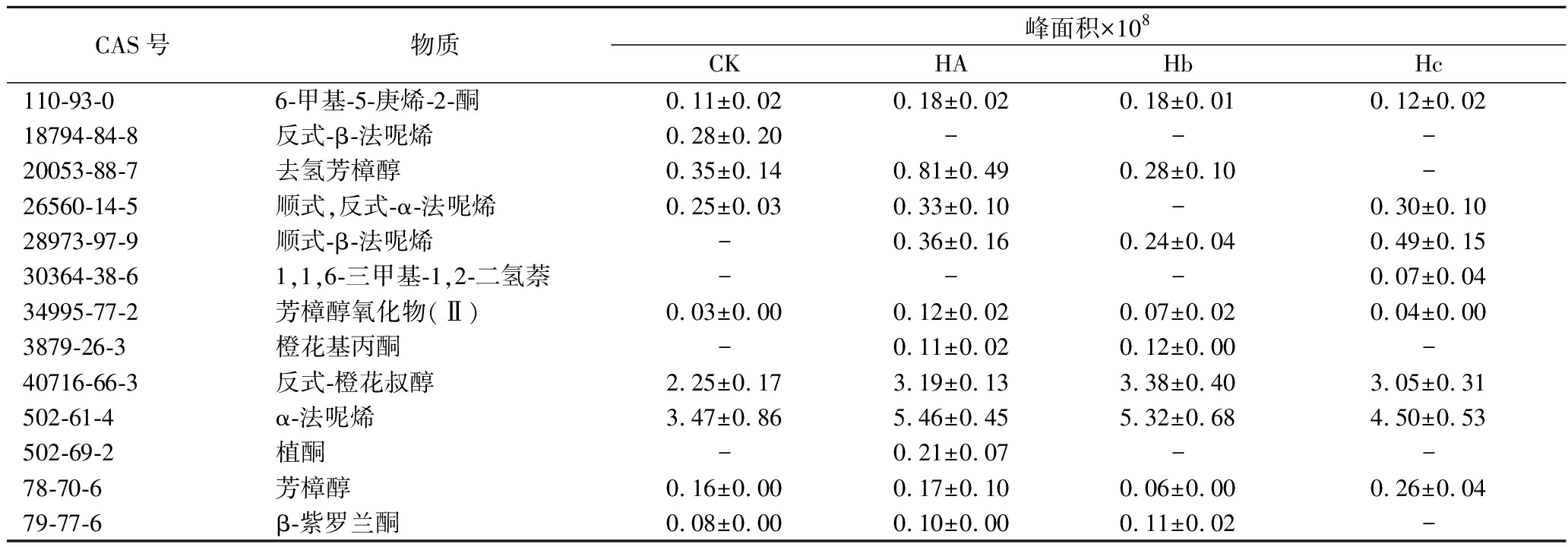
CAS号物质峰面积×108CKHAHbHc110-93-06-甲基-5-庚烯-2-酮0.11±0.020.18±0.020.18±0.010.12±0.0218794-84-8反式-β-法呢烯0.28±0.20---20053-88-7去氢芳樟醇0.35±0.140.81±0.490.28±0.10-26560-14-5顺式,反式-α-法呢烯0.25±0.030.33±0.10-0.30±0.1028973-97-9顺式-β-法呢烯-0.36±0.160.24±0.040.49±0.1530364-38-61,1,6-三甲基-1,2-二氢萘---0.07±0.0434995-77-2芳樟醇氧化物(Ⅱ)0.03±0.000.12±0.020.07±0.020.04±0.003879-26-3橙花基丙酮-0.11±0.020.12±0.00-40716-66-3反式-橙花叔醇2.25±0.173.19±0.133.38±0.403.05±0.31502-61-4α-法呢烯3.47±0.865.46±0.455.32±0.684.50±0.53502-69-2植酮-0.21±0.07--78-70-6芳樟醇0.16±0.000.17±0.100.06±0.000.26±0.0479-77-6β-紫罗兰酮0.08±0.000.10±0.000.11±0.02-
注:“-”表示挥发性化合物在该样本中未检测到。
2.4 茶样感官品评分析
茶样的感官得分如图6所示,HA、Hb、Hc发酵茶样均得到了高于对照的总体评价,说明筛选的菌株能够加速茶叶的发酵、生成更多的风味物质,提高了茶叶的品质。HA菌株投入的发酵茶样提高了1.7倍的甜香香韵得分,苯甲醛、去氢芳樟醇、反式-β-罗勒烯、植酮、1-戊醇和芳樟醇具有甜香香气特征,并且大部分在HA发酵茶样中的含量较对照有较大的提升幅度,推测可能是这些挥发性化合物促进了HA发酵茶样的甜香香韵增加,如芳樟醇在烟叶中能够赋予其清甜香韵[22]。
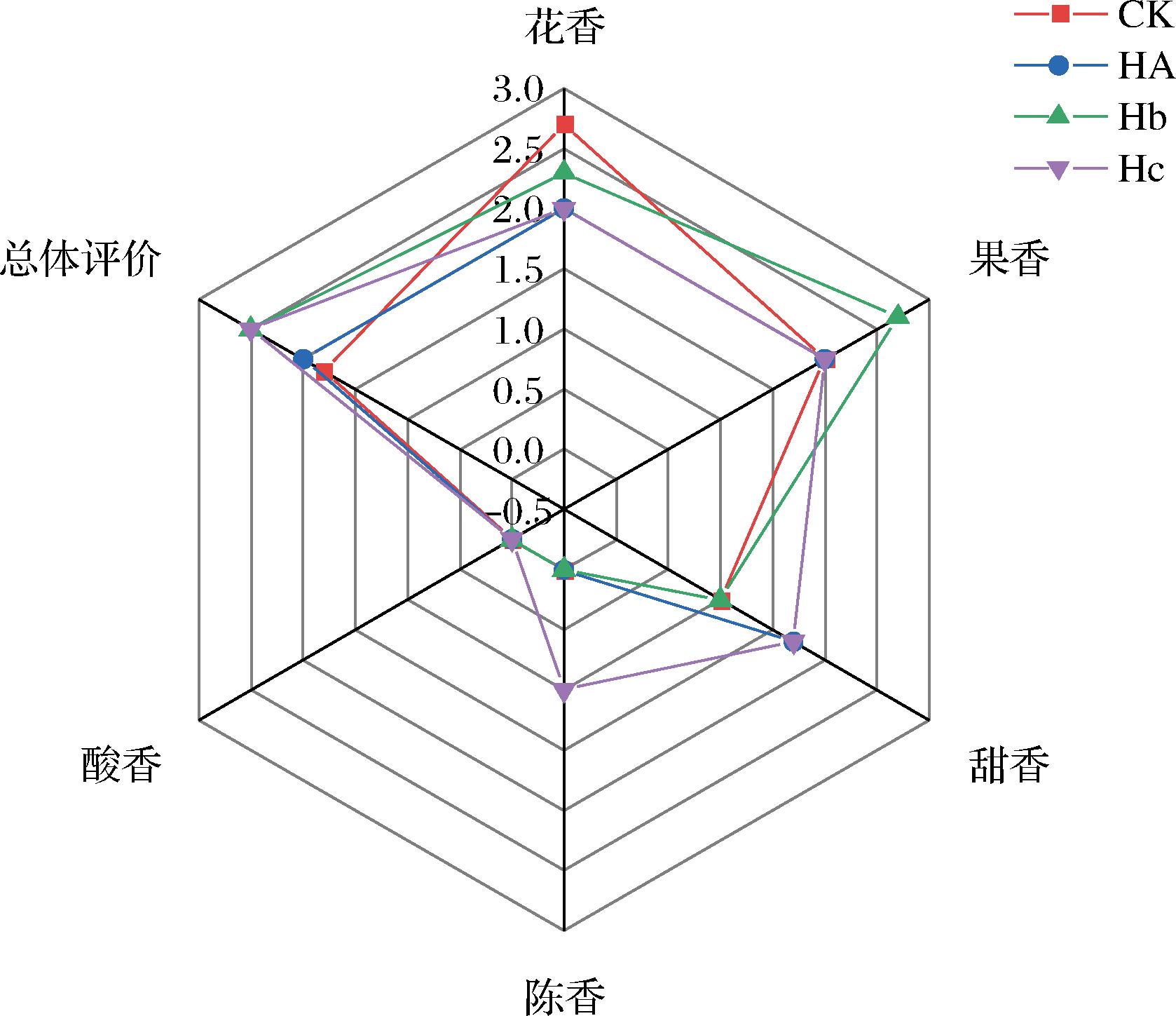
图6 茶样的感官得分
Fig.6 Sensory scores of tea samples
Hb菌株投入的发酵茶样提高了1.4倍的果香香韵得分,在Hb发酵茶样中检测到带有果香特征、含量提高的化合物包括苯甲醛、2-乙酰基吡咯、6-甲基-5-庚烯-2-酮、顺式-β-法呢烯、顺式-3-己烯基己酸酯、顺式-3-己烯基异戊酸酯、反式-橙花叔醇、α-法呢烯、1-戊醇和β-紫罗兰酮,推测可能是这些挥发性化合物促进了Hb发酵茶样的果香香韵增加。尤其是Hb发酵茶样中酯类化合物含量显著高于对照(P<0.05),而酯类化合物通常对于果香的形成具有很大贡献[23]。
Hc发酵茶样的甜香香韵提高了1.7倍,并首次得到了陈香香韵得分,实现了铁观音的陈香品质提升。Hc发酵茶样中具有甜香特征的苯甲醛、反式-β-罗勒烯和芳樟醇含量增加较多,推测可能是这3种挥发性化合物促进了Hc发酵茶样的甜香得分增加。木香与药香通常被与陈香香韵联系在一起[1,24-25],为探究Hc发酵茶样陈香提高原因,本研究重点关注Hc发酵茶样中带有木香或药香特征并含量提升的挥发性化合物,得到6种符合要求的化合物:苯甲醛、顺式,反式-α-法呢烯、反式-橙花叔醇、芳樟醇、反式-β-罗勒烯和2,3-辛二酮。本研究还观测到一种仅在Hc发酵茶样中检测到的化合物:1,1,6-三甲基-1,2-二氢萘,其被报道是陈年葡萄酒的典型香气化合物[26],因此推测上述6种木香或药香特征的挥发性化合物和1,1,6-三甲基-1,2-二氢萘对铁观音陈香品质提升具有促进作用。虽然HA、Hb菌株降解类胡萝卜素能力强于Hc菌株,但微生物可以产生多种降解类胡萝卜素的裂解酶[8,27],Hc菌株可能产生了更复杂但未被检测到的类胡萝卜素降解产物,因此其发酵茶样的香韵提升多样化。除此以外,Hc菌株可能具有复杂的生理功能,能够与茶叶本身的微生物协同发挥效用,对陈香相关风味物质有综合性的提升。
一些挥发性化合物具有多样化的香气特征,在多种香韵的提升中都有作用,如苯甲醛对应甜香、果香、陈香香韵,反式-β-罗勒烯和芳樟醇对应甜香、陈香香韵,反式-橙花叔醇对应果香和陈香香韵,1-戊醇对应甜香和果香香韵,这些化合物可能对茶叶发酵茶样的总体评价提升具有重要作用。所有样品中仅检测到2种酸类化合物,且酸类物质总量未有提升,因此样品没有酸香香韵或酸香低于感官品评阈值而没有品评得分。花香是挥发性化合物常见的香气特征,本研究中共检测到36种挥发性化合物,其中,8种化合物具有花香香气特征,这些化合物在对照样中都被检测到并具有一定的含量,因此对照样含有较高的花香得分,微生物本身带有一些不良的风味,可能会对清新的花香影响较大而致强化发酵茶样花香得分有所降低。
3 结论
本研究从铁观音陈茶中筛选获得3株具有β-胡萝卜素降解能力的菌株,它们的降解率分别为94.54% (Aspergillus niger,HA)、72.97% (Bacillus velezensis,Hb)、61.26% (Saccharopolyspora gregorii,Hc)。将菌株接入铁观音新茶实施强化发酵,发酵结束后测定茶样的挥发性化合物成分并进行感官品评。所有茶样共检测出36种挥发性化合物,与对照相比,菌株强化发酵的茶样中碳氢化合物、醇类、酯类和醛类化合物含量均有增加,并且类胡萝卜素降解产物总量在HA、Hb、Hc发酵茶样中分别提高了1.6、1.4、1.3倍,提升幅度大小与菌株降解能力呈正相关。强化发酵的茶样风味丰富,整体感官得分均高于对照,在Hc发酵茶样中成功获得陈香香韵,实现了短期内铁观音的陈香品质提升。虽然HA与Hb菌株能够促进茶叶中较多挥发性化合物含量增加,但菌株具有较重的异味,未来HA与Hb菌株在茶叶发酵中的工艺优化将是研究的重点,有望获得典型的陈香品质。
[1] 谢辉煌.陈香型铁观音烘焙及贮存关键技术的研究[J].中国茶叶加工,2022 (2):22-26.
XIE H H.Research on the key technology of baking and storage of aging Tieguanyin[J].China Tea Processing,2022 (2):22-26.
[2] 查旻昱,吴悠,张梁.茶叶中挥发性香气物质研究进展[J].食品安全质量检测学报,2020,11(13):4298-4303.
ZHA M Y,WU Y,ZHANG L.Research advances on volatile aroma compounds of tea[J].Journal of Food Safety and Quality,2020,11(13):4298-4303.
[3] 陈丽,叶玉龙,王春燕,等.茶叶中类胡萝卜素香气前体研究进展[J].食品与发酵工业,2019,45(5):266-273.
CHEN L,YE Y L,WANG C Y,et al.Research progress on carotenoid aroma precursors in tea[J].Food and Fermentation Industries,2019,45(5):266-273.
[4] TAO M,XIAO Z P,HUANG A,et al.Effect of 1-20 years storage on volatiles and aroma of Keemun congou black tea by solvent extraction-solid phase extraction-gas chromatography-mass spectrometry[J].LWT,2021,136:110278.
[5] DAI Q Y,JIN H Z,GAO J,et al.Investigating volatile compounds′ contributions to the stale odour of green tea[J].International Journal of Food Science and Technology,2020,55(4):1606-1616.
[6] LV S D,WU Y S,LI C W,et al.Comparative analysis of Pu-erh and Fuzhuan teas by fully automatic headspace solid-phase microextraction coupled with gas chromatography-mass spectrometry and chemometric methods[J].Journal of Agricultural and Food Chemistry,2014,62(8):1810-1818.
[7] 王秋霜,吴华玲,凌彩金,等.普洱茶理化品质及特征“陈香”物质基础研究[J].食品工业科技,2017,38(5):308-314.
WANG Q S,WU H L,LING C J,et al.Research of physical and chemical quality and characteristic ‘Chenxiang’ material basis of pu-erh Tea[J].Science and Technology of Food Industry,2017,38(5):308-314.
[8] 朱明明,樊明涛,何鸿举.类胡萝卜素降解方式的研究进展[J].食品科学,2017,38(11):308-317.
ZHU M M,FAN M T,HE H J.Advances in methods for the degradation of carotenoids[J].Food Science,2017,38(11):308-317.
[9] 蔡程晨.生物转化类胡萝卜素菌株的筛选及其在芒果汁中应用研究[D].海口:海南大学,2022.
CAI C C.Screening of biotransforming carotenoids strain and its application in mango juice[D].Haikou:Hainan University,2022.
[10] 田争福,申鹏森,赵璐,等.类胡萝卜素降解对枸杞酒特征香气的影响[J].食品与生物技术学报,2022,41(9):78-84.
TIAN Z F,SHEN P S,ZHAO L,et al.Effect of carotenoid degradation on characteristic aroma of wolfberry wine[J].Journal of Food Science and Biotechnology,2022,41(9):78-84.
[11] 冯琳,龚自明,郑鹏程,等.茶类胡萝卜素研究进展[J].植物科学学报,2018,36(6):899-905.
FENG L,GONG Z M,ZHENG P C,et al.Advances in studies on carotenoids in Camellia sinensis[J].Plant Science Journal,2018,36(6):899-905.
[12] 段焰青,杜刚,党立志,等.纸葡萄穗霉降解β-胡萝卜素的产香研究[J].中国酿造,2017,36(5):105-108.
DUAN Y Q,DU G,DANG L Z,et al.Aroma production with β-carotene degraded by Stachybotrys chartarum[J].China Brewing,2017,36(5):105-108.
[13] 龙章德,王敏,薛云,等.烟叶中β-胡萝卜素高效降解菌株的筛选鉴定及发酵条件优化[J].轻工学报,2022,37(4):86-93.
LONG Z D,WANG M,XUE Y,et al.Screening and identifying of β-carotene degrading strains from tobacco leaves and its optimization of fermentation conditions[J].Journal of Light Industry,2022,37(4):86-93.
[14] ZHANG H,WANG J J,ZHANG D D,et al.Aged fragrance formed during the post-fermentation process of dark tea at an industrial scale[J].Food Chemistry,2021,342:128175.
[15] LV H P,ZHONG Q S,LIN Z,et al.Aroma characterisation of Pu-erh tea using headspace-solid phase microextraction combined with GC/MS and GC-olfactometry[J].Food Chemistry,2012,130(4):1074-1081.
[16] 吴冬冬,张建丽.糖多孢菌属的多相分类[J].微生物学杂志,2007,27(1):55-58.
WU D D,ZHANG J L.Polyphasic taxonomy of Saccharopolyspora[J].Journal of Microbiology,2007,27(1):55-58.
[17] 张彩文,程坤,张欣,等.贝莱斯芽胞杆菌(Bacillus velezensis)分类学及功能研究进展[J].食品与发酵工业,2019,45(17):258-265.
ZHANG C W,CHENG K,ZHANG X,et al.Taxonomy and functions of Bacillus velezensis:A review[J].Food and Fermentation Industries,2019,45(17):258-265.
[18] 陈林,林清霞,张应根,等.不同风味类型铁观音乌龙茶香气组成化学模式识别研究[J].茶叶科学,2018,38(3):253-262.
CHEN L,LIN Q X,ZHANG Y G,et al.Aroma profiling of Tieguanyin Oolong tea with different flavor characteristics based on chemical pattern recognition[J].Journal of Tea Science,2018,38(3):253-262.
[19] 姚红,尹小庆,颜宇鸽,等.鲊辣椒生香酵母的分离筛选鉴定及其应用研究[J].食品与发酵工业,2023,49(17):145-152.
YAO H,YIN X Q,YAN Y G,et al.Application of an aroma-producing yeast isolated from natural fermented Zha-chili[J].Food and Fermentation Industries,2023,49(17):145-152.
[20] 曲媛媛,戴春晓,张旭旺,等.吲哚-种间及跨界信号分子新成员[J].生物工程学报,2019,35(11):2177-2188.
QU Y Y,DAI C X,ZHANG X W,et al.A new interspecies and interkingdom signaling molecule-Indole[J].Chinese Journal of Biotechnology,2019,35(11):2177-2188.
[21] AHRAZEM O,G MEZ-G
MEZ-G MEZ L,RODRIGO M J,et al.Carotenoid cleavage oxygenases from microbes and photosynthetic organisms:Features and functions[J].International Journal of Molecular Sciences,2016,17(11):1 781.
MEZ L,RODRIGO M J,et al.Carotenoid cleavage oxygenases from microbes and photosynthetic organisms:Features and functions[J].International Journal of Molecular Sciences,2016,17(11):1 781.
[22] 晁江涛,曹建敏,吴新儒,等.烤烟特征香韵品系8号清甜香韵的形成机制研究[J].中国烟草科学,2022,43(6):82-87.
CHAO J T,CAO J M,WU X R,et al.Study on the formation of fresh-sweet flavor in tobacco mutant T8[J].Chinese Tobacco Science,2022,43(6):82-87.
[23] 吕想,高甜甜,刘伟,等.基于GC-IMS分析非酿酒酵母与酿酒酵母混合发酵脐橙酒挥发性香气成分[J].食品工业科技,2023,44(17):139-148.
LYU X,GAO T T,LIU W,et al.Analysis of volatile aroma components of navel orange wine produced by mixed fermentation of non Saccharomyces cerevisiae and Saccharomyces cerevisiae based on GC-IMS[J].Science and Technology of Food Industry,2023,44(17):139-148.
[24] 温立香,张芬,何梅珍,等.陈香六堡茶品质特征及香气质量评价方法建立[J].食品工业科技,2021,42(2):230-236.
WEN L X,ZHANG F,HE M Z,et al.Quality characteristics of stale flavor Liupao teas and establishment for evaluation method of aroma quality[J].Science and Technology of Food Industry,2021,42(2):230-236.
[25] 王梦倩,盛玉泊,范怡航,等.不同仓储条件下普洱茶关键成分分析及品质评价[J].食品研究与开发,2022,43(16):35-43.
WANG M Q,SHENG Y B,FAN Y H,et al.Key components and quality evaluation of Pu-erh Tea with different storage conditions[J].Food Research and Development,2022,43(16):35-43.
[26] MENDES-PINTO M M.Carotenoid breakdown products the-norisoprenoids-in wine aroma[J].Archives of Biochemistry and Biophysics,2009,483(2):236-245.
[27] LIANG M H,HE Y J,LIU D M,et al.Regulation of carotenoid degradation and production of apocarotenoids in natural and engineered organisms[J].Critical Reviews in Biotechnology,2021,41(4):513-534.