纳米技术是现代科学发展比较迅猛的一个重要领域,纳米粒子的尺寸大约为1~100 nm,而纳米技术涉及到纳米粒子的合成、表征和应用等[1]。纳米材料因具有独特的物理化学性质而闻名,广泛应用于抗菌[2]、抗病毒[3]、抗肿瘤、抗真菌[4]、抗氧化和抗寄生虫[5]等领域。
在众多的金属纳米粒子中,由于纳米银(AgNPs)独特的属性而被用于不同的领域,如生物医学(快速诊断、成像、组织再生和药物输送,以及新医疗产品的开发)[6]、纺织业[7]、食品包装[8]、化妆品业、催化剂、传感器、生物学、抗菌性、DNA测序、表面增强拉曼反射(surface-enhanced raman scattering,SERS)、能源生产和信息存储等。各种物理和化学方法已被用来制备AgNPs,如微波合成[9]、纳米粒子气相合成[10]、光催化还原[11]、化学还原[12]等。化学方法具有成本高、而且会产生各种有毒和有害物质导致生物风险。因此,近年来提出了基于绿色化学原理的新合成路线。比如藻类、真菌、酵母、细菌、病毒和植物提取物等生物在特定目标的纳米粒子合成中发挥了突出的作用[1]。MUTHUSAMY等[13]利用螺旋藻藻绿成功制备了AgNPs,并进行了抗菌研究,结果表明该方法制备的AgNPs具有良好的抗菌性。ABDELGAWAD等[14]使用大豆蛋白绿色合成AgNPs,通过室温下的固态反应,进行银纳米粒子的高通量绿色合成。其结果对于制备更清洁、更大规模和更稳定的银纳米粒子提供了希望。GOVARTHANAN等[15]使用椰子油饼提取物绿色制备AgNPs,这是一种低成本且环保的制备AgNPs的方法。MYTHILI等[16]揭示了一种使用市场上的绿色蔬菜废物合成高效抗微生物活性纳米颗粒的有效方法,最大限度地减少了蔬菜市场上固体废物的积累。使用植物提取物作为还原剂和稳定剂合成银纳米粒子是绿色生产纳米粒子最常用的方法。它具有分布广泛、易于获得、处理更安全的特殊优点。因此,利用植物提取物合成银纳米粒子是传统化学方法的最佳绿色替代方法。
百香果原产于美洲热带地区,目前在中国南方地区广泛栽培,其中广西已经成为中国最大的百香果生产基地。百香果中富含多种营养物质,其果皮中含有大量的生物活性物质,如多糖、果胶、多酚、黄酮等。多酚及黄酮等活性物质具有抗炎症、抗癌、抗氧化及抗菌性。由于百香果果皮中的纤维含量较大,易成为环境负担,因此,使用其果皮提取液制备AgNPs,不仅是对百香果废弃物的充分利用,更是对环境的保护,是一种百香果高附加值产品的开发[17-18]。
利用植物提取物制备银纳米粒子的方法相对于其他方法具有一定的优势,目前还没有使用百香果果皮提取物制备AgNPs的先例。本实验采用百香果果皮提取物作为还原剂和稳定剂来合成AgNPs,通过红外光谱和拉曼散射光谱分析合成机理,并通过多种表征方法对合成的AgNPs进行研究。此外,还研究了不同提取液添加量对AgNPs生物合成的影响,并用绿色合成的AgNPs对大肠杆菌和金黄色葡萄球菌的抗菌性能进行了评估,以期为提升百香果的综合利用度和附加值提供新的途径。
1 材料与方法
1.1 材料与试剂
本研究所用百香果从广西桂林市雁山区农贸市场获得;氢氧化钠,成都Kelong化学试剂厂(中国,成都);硝酸银(AR,≥99.8%),西陇科学有限公司(中国,汕头);抗菌、抗真菌活性试验所用营养肉汤,青岛Hope生物技术有限公司(中国,青岛)。
1.2 仪器与设备
GBOF20CN2L-B8(R0)型微波炉,广东格兰仕微波电器制造有限公司;TU-1950型紫外可见分光光度计,北京谱析通用仪器有限责任公司;NICOLET型傅里叶红外光谱分析仪,天津市能谱科技有限公司;Thermo Fisher Scientific DXR 型拉曼散射光谱,赛默飞世尔科技有限公司;ZS90型纳米粒度分析仪,英国Malvern公司;XPeter3 Powder型X射线衍射分析仪,荷兰帕纳科公司;JEM-2100F型场发射透射电子显微镜、SU5000型扫描电子显微镜,北京欧波同光学技术有限公司;SDT Q600型同步TGA/DSC分析仪,海群弘仪器设备有限公司;UlVAC-PHI型X-射线光电子能谱,日本UlVACPHI公司;iMark型酶标仪,伯乐生命医学产品有限公司。
1.3 实验方法
1.3.1 植物提取液的制备
取新鲜百香果果皮洗净后晾干,准确称取10 g,粉碎后放入100 mL烧杯中,加入50 mL蒸馏水,置于90 ℃的水浴锅中加热20 min,冷却后过滤得到百香果果皮提取液,并加入蒸馏水将提取液定容至50 mL。将提取液置于冰箱中,在4 ℃条件下保存,并且在3 d之内用完。
1.3.2 纳米银粒子的合成
在室温下,取10 mL果皮提取液,加入质量浓度为1 g/L的氢氧化钠溶液至100 mL,充分溶解后加入2 mL浓度为0.5 mol/L硝酸银溶液。将制备液置于微波炉中,微波辅助反应,功率为480 W,时间为2 min。微波后摇匀,静置10 min。取反应后的液体在室温下高速离心,转速10 000 r/min,离心时间20 min。取其沉淀,加入适量蒸馏水,重复离心2次,去除上清液,后将沉淀置于50 ℃烘箱中烘干,获得纳米银粒子。
1.3.3 纳米银表征
紫外可见(UV-Vis)吸收光谱,将未离心的AgNPs液体使用蒸馏水稀释50倍,以蒸馏水为空白组,在300~600 nm 波长测其紫外可见吸收光谱。
傅里叶红外光谱法(Fourier transform infrared spectrometer,FTIR):将干燥的KBr粉末分别与纳米银粉末以200∶1的质量比研磨,移取适量粉末于压片模具中,20 MPa压力压片成型,检测波数为4 000~450 cm-1。
拉曼散射光谱:将适量粉末状样品均匀置于载玻片上,轻轻压平后放于激光共聚焦显微镜光学台上,待测。使用780激光发光源,光谱范围为70~2 000 cm-1。
Zeta电位检测,Zeta电位分析其稳定性。将待测的AgNPs溶液加入样品池中,然后放入分析仪中进行检测。检测参数:AgNPs溶液折光率为1.330;分散剂为水;在25 ℃温度下重复测试3次,每次12轮。
X-射线衍射(X-ray diffraction,XRD):粉末样品的颗粒度大小在320目左右,将样品研磨成适合衍射实验用的粉末,再把样品粉末放入专用载玻片的槽位中,制成平整平面的试片进行检测。
透射电子显微镜表征(transmission electron microscope,TEM):将AgNPs溶液超声分散后,用移液枪吸取4~5滴AgNPs样品溶液于铜网中,真空干燥1 h以上,干燥后进行TEM观察。
扫描电子显微镜(scanning electron microscope,SEM):将10 mg/mL液体样品超声20 min后,滴加数滴于硅片上烘干12 h。将导电胶固定于样品台上,导电胶面积不超过0.5 cm×1 cm,再将硅片覆盖在导电胶上固定,即可进行SEM扫描。
能量色散光谱(energy dispersive spectrometer,EDS):将10 mg/mL液体样品超声20 min后,滴加数滴于硅片上烘干12 h。将导电胶固定于样品台上,导电胶面积不超过0.5 cm×1 cm,再将硅片覆盖在导电胶上固定,即可进行EDS分析。
热重分析(thermogravimetric analysis,TGA):TGA是使用热重分析仪TAINSTRUNT(SDT Q 600 V20.9 Build 20)测试,在氧化铝坩埚中进行。每个样品约含10 mg,温度变化为25~800 ℃,在氮气中加热速度为10 ℃/min。
动态光散射(dynamic light scattering,DLS):将待检测的AgNPs溶液加入样品池中,然后放入分析仪中进行检测。检测参数:AgNPs溶液的折射率为1.330;分散剂为水;试验在25 ℃下重复3次,每次12轮。
X-射线光电子能谱(X-ray photoelectron spectroscopy,XPS):将约10 mg粉末样品均匀铺在黏有导电胶的铝箔上,取另一片铝箔覆盖住样品。将上述制好带有样品的铝箔置于模具中,转移到压片机上,10 MPa压力压片成型。
1.3.4 抑菌实验
菌悬液的制备:根据前人方法[19-20],大肠杆菌、金黄色葡萄球菌菌悬液:称取1.25 g LB肉汤液体培养基,溶于50 mL蒸馏水中。在121 ℃下灭菌20 min,灭菌结束后取出放入超净工作台中进行接种。用灭菌后的接种环挑取适量制备好的大肠杆菌、金黄色葡萄球菌放入冷却后的LB肉汤培养基中,于37 ℃的振荡培养箱中摇瓶培养18~24 h获得活化菌液。
最低抑菌浓度(minimum inhibitory concentration,MIC):是指在特定环境下孵育24 h,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性测定方法:称取所得银纳米粒子样品3.2 mg,溶于1 mL的LB肉汤中,即质量浓度为3.2 mg/mL。依此为原液稀释制备出一系列的质量浓度梯度:0、0.1、0.2、0.4、0.8、1.6、3.2 mg/mL。将0.2 mL肉汤、0.05 mL纳米银肉汤和0.05 mL大肠杆菌或金黄色葡萄球菌菌悬液,菌悬液浓度控制在107 CFU/mL左右,充分混合加入到细胞板上,体系中纳米银质量浓度为0、16.7、33.3、66.7、133.3、266.7、533.3 μg/mL。培养时间0、3、6、9、12、15、24 h,用酶标仪检测吸光值(600 nm)。
1.4 数据处理
每个实验至少重复3次,数据采用“平均值±标准差”表示。用Origin 2021 进行作图,SPSS 22.0 软件进行显著检验(P<0.05)。
2 结果与分析
2.1 不同提取液添加量对合成纳米银的影响
一般来讲,不同的纳米粒子在UV-Vis光谱中吸收峰的位置会不相同,例如,纳米铜在600~650 nm处有较强的吸收峰,纳米金的吸收峰处于500~600 nm处,而纳米银在410 nm左右表现出很强的吸收峰[21-22]。因此,可以通过UV-Vis光谱来确定所制备的纳米粒子的种类。同时,对于同种溶胶可以通过峰的位置及形状判断溶胶中纳米粒子的大小和形貌。
在本研究中,百香果果皮提取物被用作银离子的还原剂及稳定剂。将百香果果皮提取物溶于氢氧化钠溶液,加入硝酸银溶液后,可以通过样品颜色变成深棕色来证明纳米银颗粒的形成。这一现象可以用紫外光谱仪显示出来。通过加入5、10、15、20 mL的提取液制备纳米银,UV-Vis在波长为300~600 nm进行光谱扫描。由图1可以看出,所有样品均在410 nm附近出现比较强的吸收峰,表明溶液中出现纳米银粒子。如图1所示,在使用10 mL提取液所制得的纳米银吸光值最高且出现明显蓝移,表明在该条件下,所制备的纳米银析出率最高,粒径最小[23]。
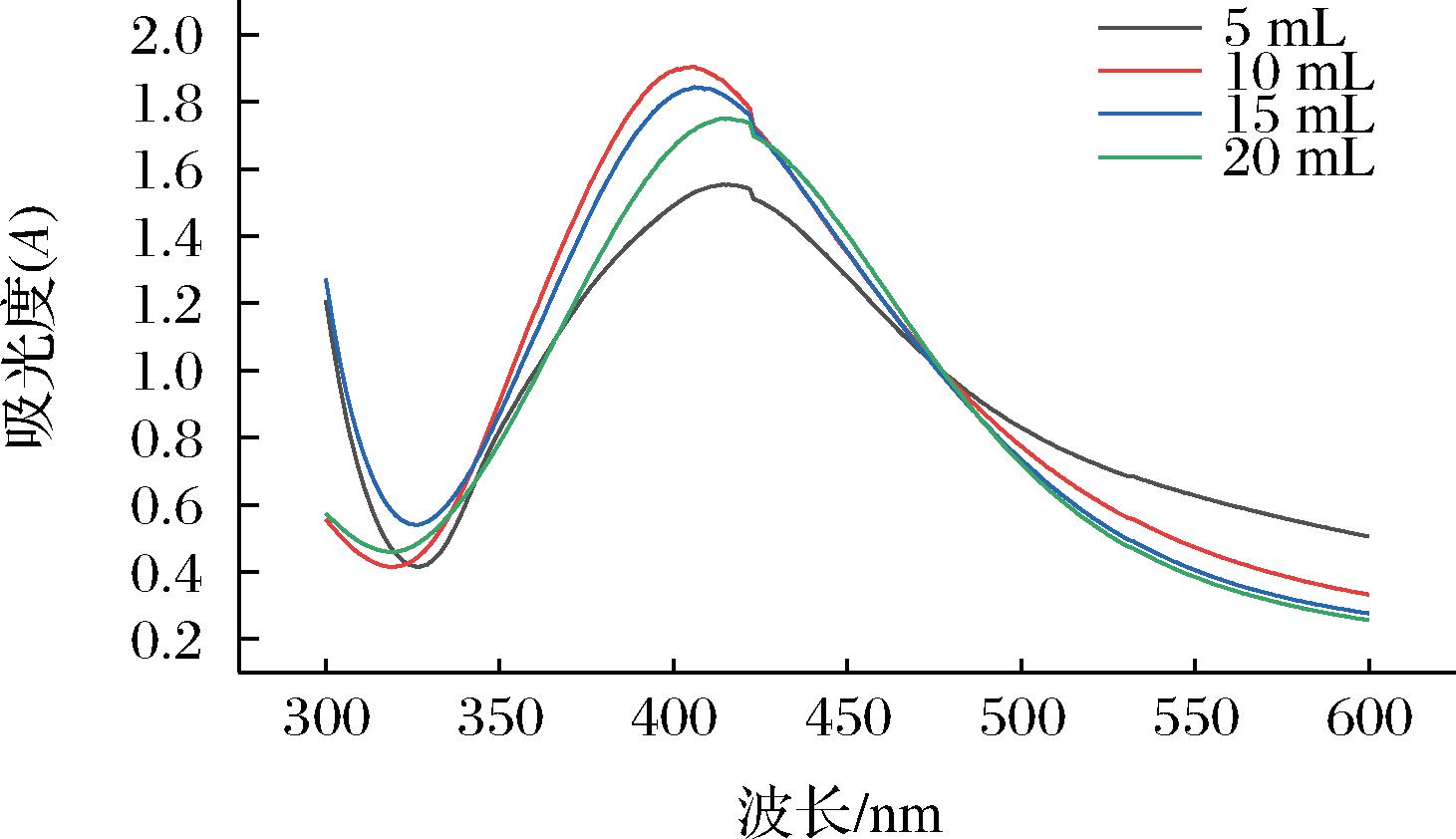
图1 不同提取液添加量AgNPs的紫外吸收光谱
Fig.1 Ultraviolet absorption spectra of AgNPs with different extracts supplemental levels
2.2 SEM、TEM及粒径分析
通过SEM和TEM观察银纳米粒子的表面形貌和尺寸。如图2-a和图2-b所示,纳米银粒子规则且均匀的结构,直径为10~15 nm的球形是银纳米粒子的特征,平均粒径为12.1 nm。BALCIUNAITIENE等[24]通过苦艾提取物合成的AgNPs主要为球形,平均粒径为50 nm;KHAN等[25]通过籼藻及其自然生长形式的细胞培养物的提取物合成的AgNPs的平均粒径为15 nm、19 nm。本实验结果比前人的研究结果具有更小的粒径。研究表明AgNPs的抑菌性能与其粒径呈反比,粒径越小,比表面积越大,越有利于更多的AgNPs与膜的结合,改变膜的通透性,通过使细胞内容物的泄漏发挥抑菌作用[24]。因此,百香果果皮提取物是合成形貌均匀、粒径小的银纳米粒子的高效载体。采用DLS进行粒径分布分析。如图2-d显示,AgNPs的平均粒径为43.25 nm,这证实了产物是纳米颗粒。多分散性指数(polymer dispersity index,PDI)是颗粒均匀性的度量指标,接近0.3的值表明已经形成了稳定的聚集体溶液。
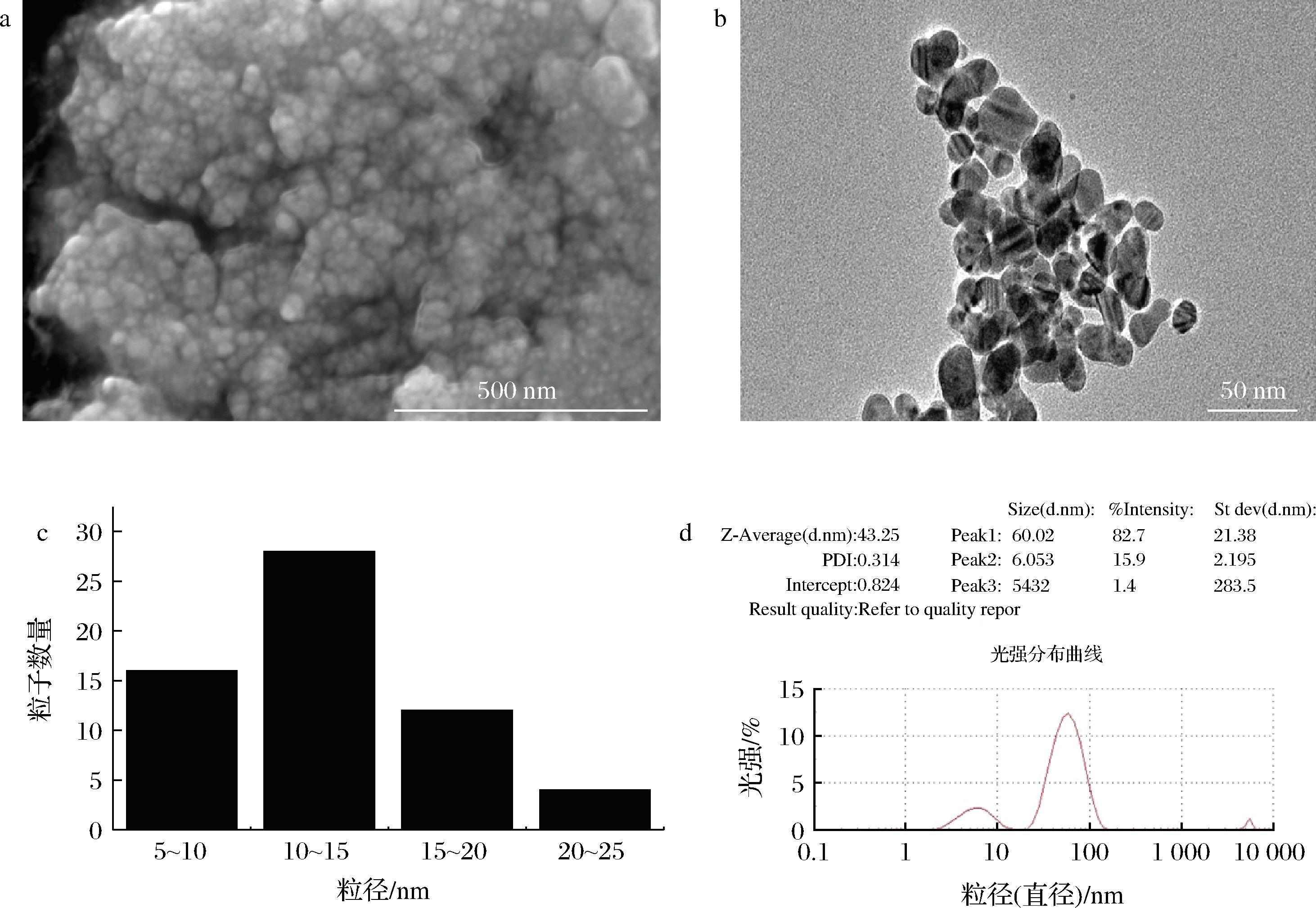
a-SEM;b-TEM图像;c-粒径分布;d-DLS
图2 AgNPs的SEM和TEM图像及粒径分布、DLS
Fig.2 SEM and TEM images,particle size distribution,and DLS of AgNPs
2.3 Zeta电位和热重TGA
电位分析是预测悬浮在胶体溶液中的颗粒稳定性的工具。以水为分散剂,测定了合成的银纳米粒子的Zeta电位,电位为-19.4 mV。如图3-a所示,结果表明银纳米粒子具有负电荷,说明提取物中的活性物质可能以带负电荷的形式吸附在AgNPs粒子的表面[26]。通过TGA直接测定纳米粒子和载体的稳定比。如图3-b所示,在160~500 ℃内,百香果提取物从AgNPs的表面分解和脱落,而在530~660 ℃的失重是由于果胶的燃烧所引起[27]。在整个燃烧过程中,AgNPs的质量损失很小,可表明AgNPs的热稳定性较好。
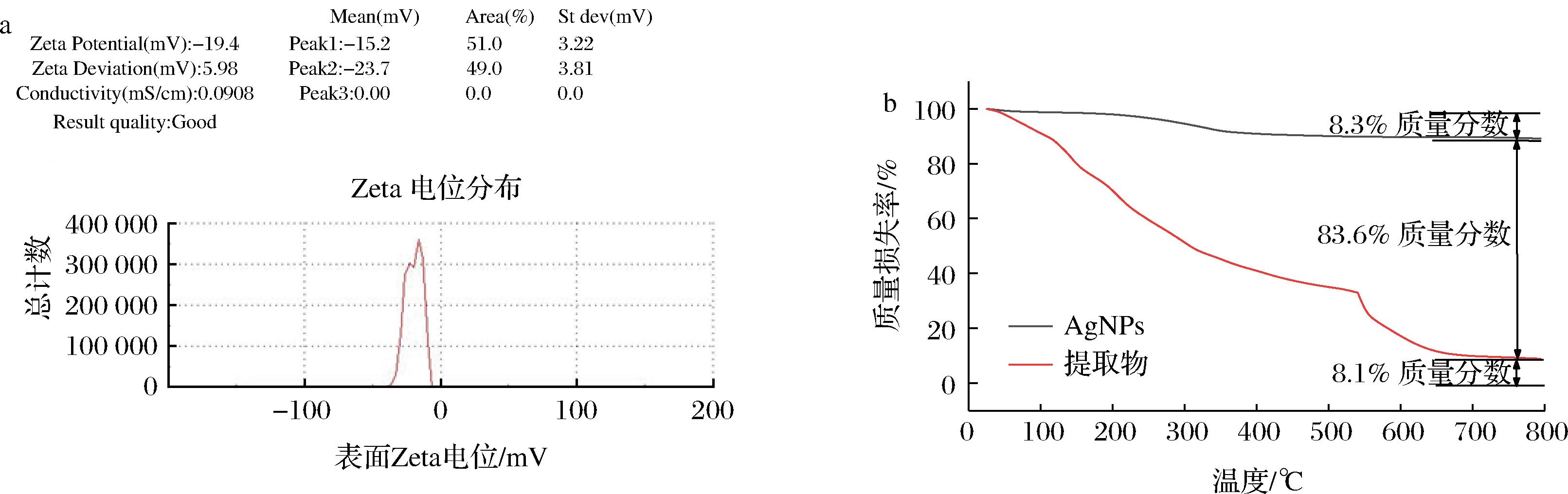
A-Zeta电位;b-热重TGA
图3 AgNPs的稳定性分析
Fig.3 Stability analysis of AgNPs
2.4 FTIR和拉曼散射光谱
红外光谱有助于探测银纳米粒子表面的化学成分和纳米粒子上封端剂的局部分子环境。银纳米粒子的红外光谱如图4-a所示,记录了400~4 000 cm-1的范围。出现在3 420 cm-1的宽带被指定为O—H振动,表明还原剂中存在羟基[28],在该处观察到了分子间氢键结合的酚羟基的存在。在银纳米粒子形成过程中,其强度降低并转移到3 460 cm-1,证明类黄酮(多酚)主要起还原剂作用。在2 930 cm-1处的吸收峰,是—OCH 3基团的不对称C—H拉伸,百香果果皮提取液在纳米银形成时,强度降低并移动到2 910 cm-1,该处峰强度的降低,表示Ag+取代了—CH3基团[29]。1 380 cm-1和1 640 cm-1处的强烈峰值对应于C—N拉伸振动以及百香果果皮提取物中蛋白质的酰胺I带。1 070 cm-1处的吸收峰代表的是C—OH的伸缩振动。使用拉曼散射技术来表征可被这些纳米粒子表面吸收的成分。银纳米粒子的拉曼光谱如图4-b所示,谱图记录了70~2 000 cm-1的范围。出现在750 cm-1处的N—H的平面弯曲振动。1 380 cm-1处的峰带归因于C—N以及百香果果皮提取物中蛋白质的酰胺I带,在形成纳米银时峰带向左偏移并且峰值明显增强,表明提取液中的蛋白质成分参与了纳米银的合成并吸附在纳米银表面。1 570 cm-1处的峰带是甲基的伞状拉伸[30]。FTIR和拉曼散射光谱研究的结果证实,百香果果皮提取物具有还原和稳定银纳米粒子的双重功能,纳米银粒子被百香果果皮提取物包覆。

a-FTIR;b-拉曼散射光谱
图4 AgNPs的红外和拉曼谱图分析
Fig.4 FTIR and Raman spectroscopy analysis of AgNPs
2.5 XRD、EDS和XPS分析
如图5-a所示的XRD图谱分析,证实了银纳米粒子的结晶性质。银纳米粒子的X光衍射图显示在整个XRD光谱上存在不同强度的各种峰,这些衍射峰分别与金属银晶态的[111]、[200]、[220]、[311]、[222]对应。同时表征了金属银的面心立方结构,与JCPDS数据库87-0717号相关联,这证实了合成了自然分散的银纳米粒子。这些衍射峰可能是由于封端剂稳定了纳米粒子而产生的。通常,固体的XRD图谱中峰的加宽归因于粒度效应。更宽的峰表示更小的颗粒尺寸,反映了实验条件对晶核成核和生长的影响[31]。在本研究结果中,更宽的峰表明百香果果皮提取物参与了晶核生长和颗粒形成[32]。

a-XRD;b-EDS;c-XPS
图5 AgNPs的物理化学表征
Fig.5 Physical-chemical characterization of AgNPs
利用硅片盛载纳米银样品进行能谱分析,谱图充分显示了样品中的金属银为主要成分,归一化质量银占比为91.15%。其他物质归因于百香果皮提取物附着在纳米银表面。由于表面等离子体共振,金属银纳米晶体在3 000 eV时表现出典型的光学吸收峰[33]。谱图显示有氮元素存在,结合红外和拉曼的结果分析,其来源为百香果果皮提取液中的蛋白质,验证了提取液成分包覆在纳米银表面。
为了揭示金属银的存在并获得其化学组成和氧化态的信息,对银纳米粒子进行了XPS研究。主导元素银在370 eV的强信号证实了银的三维状态的存在[34]。为了确定纳米银的价态,研究了Ag 3d的高分辨率单个XPS峰,其可以分为如图5-c所示的2个成分。由分离良好的双自旋轨道成分Ag 3d5/2和Ag 3d3/2在367.61 eV和373.61 eV的结合能表示的不对称XPS峰证实了金属Ag0的丰度[35]。XPS结果证明了Ag+还原为Ag0。
2.6 抑菌实验MIC
为定量研究抗菌作用,测定了AgNPs的最低抑菌浓度。如图6所示,对大肠杆菌的最低抑菌浓度为33.3 μg/mL,金黄色葡萄球菌的最低抑菌浓度为66.7 μg/mL。结果显示,金黄色葡萄球菌的最低抑菌浓度要高于大肠杆菌,因为它们的细胞相对较厚,肽聚糖较多。与之前报道的AgNPs[19]相比,百香果果皮提取物制备的银纳米粒子显示出更好的抗菌活性,这可能是由于百香果果皮提取物中多种活性物质的共同作用。银纳米粒子的抗菌能力还与其大小、形状和封端剂有关,大的纳米颗粒允许大的表面积接触细菌细胞,这意味着小的颗粒可能比大的颗粒有更高的相互作用[36-37]。本研究所制备的纳米银颗粒较小,可能是其抑菌性好的原因之一。此外,本研究所制备的AgNPs的抑菌效果要好于大多数使用植物提取物制备的AgNPs,这一原因可能是百香果果皮提取物中的活性物质与AgNPs协同抗菌作用。CHINNAPPAN等[38]利用紫荆花提取物制备了AgNPs,并对克雷伯氏菌和金黄色葡萄球菌进行了抑菌研究,其MIC约为432 μg/mL。MUTHUSAMY等[13]利用螺旋藻微藻绿色合成了AgNPs,并对克雷伯氏菌和金黄色葡萄球菌进行了抑菌研究,其MIC约为324 μg/mL。因此,利用百香果果皮提取物合成的银纳米粒子在临床和医学领域具有潜在的应用价值。

a-大肠杆菌;b-金黄色葡萄球菌
图6 不同质量浓度AgNPs下对大肠杆菌和金黄色葡萄球菌的生长曲线
Fig.6 E.coli and S.aureus growth curves at different concentrations of AgNPs
3 结论
本研究开发了一种新的简便的方法,利用百香果果皮提取物合成银纳米粒子。该方法快速、廉价且环保,在合成过程中不使用任何有害试剂。果皮提取物中的黄酮、多酚、果胶和蛋白质等生物活性成分作为还原剂和稳定剂。银纳米粒子对大肠杆菌(MIC为33.3 μg/mL)、金黄色葡萄球菌(MIC为66.7 μg/mL)具有有效的抗菌活性。通过多种表征方法对绿色合成的纳米银粒子进行分析。结果表明,合成的纳米银粒子被百香果果皮提取液包覆,具有均匀的球形形貌,粒径较小。本方法由于使用的是百香果果皮提取液制备纳米银,具有低成本和高效的优点,因而具有商业放大的前景。这些银纳米粒子有可能应用于制药和工业领域。
[1] AHMED S,AHMAD M,SWAMI B L,et al.A review on plants extract mediated synthesis of silver nanoparticles for antimicrobial applications:A green expertise[J].Journal of Advanced Research,2016,7 (1):17-28.
[2] AMEEN F,SRINIVASAN P,SELVANKUMAR T,et al.Phytosynthesis of silver nanoparticles using Mangifera indica flower extract as bioreductant and their broad-spectrum antibacterial activity[J].Bioorganic Chemistry,2019,88:102970.
[3] GOVARTHANAN M,CHO M,PARK J H,et al.Cottonseed oilcake extract mediated green synthesis of silver nanoparticles and its antibacterial and cytotoxic activity[J].Journal of Nanomaterials,2016,2016:7412431.
[4] LEE K J,PARK S H,GOVARTHANAN M,et al.Synthesis of silver nanoparticles using cow milk and their antifungal activity against phytopathogens[J].Materials Letters,2013,105:128-131.
[5] FOUDA M M G,ABDELSALAM N R,GOHAR I M A,et al.Utilization of High throughput microcrystalline cellulose decorated silver nanoparticles as an eco-nematicide on root-knot nematodes[J].Colloids and Surfaces B:Biointerfaces,2020,188:110805.
[6] VALARMATHI N,AMEEN F,ALMANSOB A,et al.Utilization of marine seaweed Spyridia filamentosa for silver nanoparticles synthesis and its clinical applications[J].Materials Letters,2020,263:127244.
[7] EL-NAGGAR M E,SHAARAWY S,HEBEISH A A.Bactericidal finishing of loomstate,scoured and bleached cotton fibres via sustainable in-situ synthesis of silver nanoparticles[J].International Journal of Biological Macromolecules,2018,106:1192-1202.
[8] CHOI M S,NA H G,SHIM G S,et al.Simple and scalable synthesis of urchin-like ZnO nanoparticles via a microwave-assisted drying process[J].Ceramics International,2021,47(10):14621-14629.
[9] ZHOU C H,ZHANG Y,YAN F H,et al.Vapor deposition synthesis of polypyrrole nanoparticles with a tunable photothermal conversion capacity[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2021,613:126073.
[10] ALI EBRAHIMZADEH M,MORTAZAVI-DERAZKOLA S,ALI ZAZOULI M.Eco-friendly green synthesis of novel magnetic Fe3O4/SiO2/ZnO-Pr6O11 nanocomposites for photocatalytic degradation of organic pollutant[J].Journal of Rare Earths,2020,38(1):13-20.
[11] MALATHI S,EZHILARASU T,ABIRAMAN T,et al.One pot green synthesis of Ag,Au and Au-Ag alloy nanoparticles using isonicotinic acid hydrazide and starch[J].Carbohydrate Polymers,2014,111:734-743.
[12] LALIWALA S K,MEHTA V N,ROHIT J V,et al.Citrate-modified silver nanoparticles as a colorimetric probe for simultaneous detection of four triptan-family drugs[J].Sensors and Actuators B:Chemical,2014,197:254-263.
[13] MUTHUSAMY G,THANGASAMY S,RAJA M,et al.Biosynthesis of silver nanoparticles from Spirulina microalgae and its antibacterial activity[J].Environmental Science and Pollution Research International,2017,24(23):19459-19464.
[14] ABDELGAWAD A M,EL-NAGGAR M E,EISA W H,et al.Clean and high-throughput production of silver nanoparticles mediated by soy protein via solid state synthesis[J].Journal of Cleaner Production,2017,144:501-510.
[15] GOVARTHANAN M,SEO Y S,LEE K J,et al.Low-cost and eco-friendly synthesis of silver nanoparticles using coconut (Cocos nucifera) oil cake extract and its antibacterial activity[J].Artificial Cells,Nanomedicine,and Biotechnology,2016,44(8):1878-1882.
[16] MYTHILI R,SELVANKUMAR T,KAMALA-KANNAN S,et al.Utilization of market vegetable waste for silver nanoparticle synthesis and its antibacterial activity[J].Materials Letters,2018,225:101-104.
[17] CAO Q Q,TENG J W,WEI B Y,et al.Phenolic compounds,bioactivity,and bioaccessibility of ethanol extracts from passion fruit peel based on simulated gastrointestinal digestion[J].Food Chemistry,2021,356:129682.
[18] ![]() F F,DE PAULO FARIAS D,NERI-NUMA I A,et al.Polyphenols and their applications:An approach in food chemistry and innovation potential[J].Food Chemistry,2021,338:127535.
F F,DE PAULO FARIAS D,NERI-NUMA I A,et al.Polyphenols and their applications:An approach in food chemistry and innovation potential[J].Food Chemistry,2021,338:127535.
[19] SU D L,LI P J,NING M,et al.Microwave assisted green synthesis of pectin based silver nanoparticles and their antibacterial and antifungal activities[J].Materials Letters,2019,244:35-38.
[20] LI P J,LIANG J Y,SU D L,et al.Green and efficient biosynthesis of pectin-based copper nanoparticles and their antimicrobial activities[J].Bioprocess and Biosystems Engineering,2020,43(11):2017-2026.
[21] DONG C F,ZHANG X L,CAI H.Green synthesis of monodisperse silver nanoparticles using hydroxy propyl methyl cellulose[J].Journal of Alloys and Compounds,2014,583:267-271.
[22] ZHA J L,DONG C F,WANG X J,et al.Green synthesis and characterization of monodisperse gold nanoparticles using Ginkgo Biloba leaf extract[J].Optik,2017,144:511-521.
[23] FATIMAH I,AFTRID Z H V I.Characteristics and antibacterial activity of green synthesized silver nanoparticles using red spinach (Amaranthus Tricolor L.) leaf extract[J].Green Chemistry Letters and Reviews,2019,12(1):25-30.
[24] BALCIUNAITIENE A,VISKELIS P,VISKELIS J,et al.Green synthesis of silver nanoparticles using extract of Artemisia absinthium L.Humulus lupulus L.and Thymus vulgaris L.physico-chemical characterization,antimicrobial and antioxidant Activity[J].Processes,2021,9(8):1304.
[25] KHAN T,ALI G S.Variation in surface properties,metabolic capping,and antibacterial activity of biosynthesized silver nanoparticles:Comparison of bio-fabrication potential in phytohormone-regulated cell cultures and naturally grown plants[J].RSC Advances,2020,10(64):38831-38840.
[26] EDISON T I,SETHURAMAN M G.Biogenic robust synthesis of silver nanoparticles using Punica granatum peel and its application as a green catalyst for the reduction of an anthropogenic pollutant 4-nitrophenol[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2013,104:262-264.
[27] ZHANG Y,JIANG J J,LI M,et al.Green synthesis of gold nanoparticles with pectinase:A highly selective and ultra-sensitive colorimetric assay for Mg2+[J].Plasmonics,2017,12(3):717-727.
[28] SINGH S,SAIKIA J P,BURAGOHAIN A K.A novel reusable PAni-PVA-Amylase film:Activity and analysis[J].Colloids and Surfaces.B,Biointerfaces,2013,106:46-50.
[29] SONG Z Y,WU Y,WANG H J,et al.Synergistic antibacterial effects of curcumin modified silver nanoparticles through ROS-mediated pathways[J].Materials Science &Engineering.C,Materials for Biological Applications,2019,99:255-263.
[30] DENDISOV -VYSKOVSK
-VYSKOVSK M,KOKAISLOV
M,KOKAISLOV A,
A,![]() M,et al.SERS and in situ SERS spectroscopy of riboflavin adsorbed on silver,gold and copper substrates.Elucidation of variability of surface orientation based on both experimental and theoretical approach[J].Journal of Molecular Structure,2013,1038:19-28.
M,et al.SERS and in situ SERS spectroscopy of riboflavin adsorbed on silver,gold and copper substrates.Elucidation of variability of surface orientation based on both experimental and theoretical approach[J].Journal of Molecular Structure,2013,1038:19-28.
[31] GOVARTHANAN M,SELVANKUMAR T,MANOHARAN K,et al.Biosynthesis and characterization of silver nanoparticles using panchakavya,an Indian traditional farming formulating agent[J].International Journal of Nanomedicine,2014,9:1593-1599.
[32] BECHERI A,DÜRR M,LONOSTRO P,et al.Synthesis and characterization of zinc oxide nanoparticles:Application to textiles as UV-absorbers[J].Journal of Nanoparticle Research,2008,10(4):679-689.
[33] HAGLAN A M,ABBAS H S,AKKÖZ C,et al.Characterization and antibacterial efficiency of silver nanoparticles biosynthesized by using green algae Enteromorpha intestinalis[J].International Nano Letters,2020,10(3):197-205.
[34] FERRARIS S,MIOLA M,COCHIS A,et al.In situ reduction of antibacterial silver ions to metallic silver nanoparticles on bioactive glasses functionalized with polyphenols[J].Applied Surface Science,2017,396:461-470.
[35] PRIETO P,NISTOR V,NOUNEH K,et al.XPS study of silver,nickel and bimetallic silver-nickel nanoparticles prepared by seed-mediated growth[J].Applied Surface Science,2012,258(22):8807-8813.
[36] BUSZEWSKI B,RAILEAN-PLUGARU V,POMASTOWSKI P,et al.Antimicrobial activity of biosilver nanoparticles produced by a novel Streptacidiphilus durhamensis strain[J].Journal of Microbiology Immunology and Infection,2018,51(1):45-54.
[37] HU G S,JIN W X,CHEN Q Y,et al.Antibacterial activity of silver nanoparticles with different morphologies as well as their possible antibacterial mechanism[J].Applied Physics A,2016,122(10):874.
[38] CHINNAPPAN S,KANDASAMY S,ARUMUGAM S,et al.Biomimetic synthesis of silver nanoparticles using flower extract of Bauhinia purpurea and its antibacterial activity against clinical pathogens[J].Environmental Science and Pollution Research International,2018,25(1):963-969.