在我国,小麦是仅次于稻谷的第二大谷物,小麦籽粒中富含人体所需的营养物质,淀粉是约占籽粒干质量的65%~70%[1],对小麦粉的加工特性有着重要的影响。淀粉是世界上最丰富的生物材料之一,常用作乳化剂、增稠剂、稳定剂、粘合剂和胶凝剂等[2]。由于天然淀粉易糊化老化,在冷水中溶解度低,耐热性和耐机械性能差等,限制了其在食品工业中的应用和某些加工工艺的实现。因此,人们使用各种物理、化学、酶、基因等方法改变淀粉颗粒的内部结构,以赋予其特别的加工应用特性[3]。
在食品加工技术领域,超高压(ultra-high pressure,UHP)是一种可用于淀粉改性典型的物理非热加工技术[4]。LI等[5]发现UHP处理可以促进水分子进入红小豆淀粉颗粒,破坏其结晶结构,使其热稳定性降低;不同结晶类型的淀粉在超高压处理后表现出不同的结果,A型淀粉对压力最敏感,其次是C型和B型淀粉[6]。高粱淀粉(A型)在480~600 MPa下完全凝胶化,绿豆淀粉(C型)在600 MPa下完全糊化,马铃薯淀粉(B型)在800 MPa下凝胶化。GUO等[7]发现UHP处理的莲子淀粉有利于淀粉聚集以及延缓老化速率;LARREA-WACHTENDORFF 等[8]通过UHP处理获得了结构优良、机械性能稳定的马铃薯淀粉水凝胶。这些研究表明,UHP处理可以改变淀粉的结构和理化性质,赋予淀粉新的功能性质。
“和尚头”小麦是甘肃等西北地区广泛栽培的旱地小麦品种,具有较高的面筋含量,其面团筋道,韧性强、延伸性好、面条断条率低,是品质俱佳的家庭食用面粉。UHP处理可以改变淀粉的结构和理化性质,赋予淀粉新的功能性质。目前鲜有关于UHP处理对“和尚头”小麦淀粉结构和理化特性影响的报道。因此,本文以甘肃产“和尚头”小麦粉为原料,通过UHP处理,探讨其对小麦淀粉结构和特性的影响,以期为UHP技术在小麦淀粉改性及小麦淀粉食品加工中更好的应用提供参考。
1 材料与方法
1.1 试验材料
“和尚头”小麦粉,甘肃省景泰县旱地春小麦。
1.2 仪器与设备
HHP.L2-600/1超高压设备,天津华泰森淼生物工程技术股份有限公司;X′Pert-Pro MPD多晶粉末X射线衍射仪,PANalytical公司;DSC2500差示扫描量热仪,美国TA仪器公司;JSM-6701F冷场发射型扫描电子显微镜,日本电子光学公司;NEXUS670傅里叶红外光谱仪,美国Thermo公司;Bettersize 2600激光粒度分析仪,丹东百特仪器有限公司;H-1850R台式高速冷冻离心机,湘仪离心机仪器有限公司;DHG-9070电热鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 小麦淀粉的制备
参考GB/T 14772—2008和孙小凡等[9]的方法。100 g脱脂面粉中加入2 g盐,60 mL蒸馏水,揉成面团,用保鲜膜包裹,在室温下静置20 min后用蒸馏水水和面液料比为8∶1或10∶1(mL∶g)洗涤,直至滤液遇碘液不变色为止。将得到的淀粉浆过100目筛,在室温下静置6~8 h后,弃去上清液,将余下的淀粉浆离心(3 000 r/min,15 min),刮去其上层黄色蛋白层,收集下层白色物质。用无水乙醇洗涤、抽滤,将抽滤后得到的淀粉置于35 ℃鼓风干燥机中干燥后,于样品袋中密封备用。
1.3.2 样品UHP处理
小麦淀粉加蒸馏水配制成150 g/mL)的淀粉乳悬浮液,摇匀后装入聚氯乙烯密封袋中,分别在100、200、300、400、500 MPa的压力下处理15 min。超高压处理完成后,将淀粉溶液抽滤,去除水分,湿淀粉在35 ℃鼓风干燥机中干燥,研碎后于样品袋中密封备用[10]。
1.3.3 扫描电镜测定
参照OVANDO-MART NEZ等[11]的方法。淀粉样品粉末黏在样品台上,于真空室中喷金。加速电压为5 kV,放大倍数5 000下观察样品的形状和表面特征。
NEZ等[11]的方法。淀粉样品粉末黏在样品台上,于真空室中喷金。加速电压为5 kV,放大倍数5 000下观察样品的形状和表面特征。
1.3.4 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)测定
采用碘化钾压片法测定,扫描范围为4 000~400 cm-1,分辨率为4 cm-1,扫描64次,以空气作为扫描背景[12]。
1.3.5 X-射线衍射的测定
参照WANG等[13]的方法。将淀粉样品置于铝板上的矩形槽中并压制。X-射线衍取的Cu-Ka射线在3 kV和20 mA下测量淀粉样品。测量范围为10°~40°(2θ),样品步长0.02°,扫描速率为1°/min,扫描方式为连续,重复1次,测定小麦淀粉的X-射线衍射图谱。
1.3.6 粒径测定
使用激光粒度分析仪评估淀粉样品的粒径分布。将小麦淀粉配制成20 g/L的淀粉乳悬浮液,并将淀粉乳悬浮液滴入激光粒度分析仪的样品池中,以蒸馏水做分散剂,超声波振荡3 min,使淀粉颗粒均匀分散。当遮光率达到15%时,通过3个平行实验确定平均粒径分布。淀粉和蒸馏水的折射率分别为1.52和1.33[14]。
1.3.7 溶解度和膨胀度的测定
准确称取0.5 g淀粉样品(干基),在离心管中加入25 mL蒸馏水,制备质量分数为2%的淀粉乳悬浮液。然后将离心管分别置于沸水中水浴搅拌30 min。冷却后离心(5 000 r/min,15 min),上清液倒入铝盒中,于105 ℃烘箱中烘干至恒重称量[15]。溶解度(S)和膨胀度(B)按公式(1)和公式(2)计算:
(1)
(2)
式中:A为上清液烘干至恒重后的质量,g;W为淀粉质量,g(干基重);P为离心后沉淀物质量,g。
1.3.8 冻融稳定性的测定
将小麦淀粉加蒸馏水配制成50 g/L的淀粉乳悬浮液,沸水浴30 min,随后装入离心管中,-20 ℃冷冻24 h后取出,30 ℃下解冻2 h后离心(3 000 r/min,15 min),弃去上清液,称取沉淀物的质量,反复冻融4次[16]。按公式(3)计算析水率,以析水率表征冻融稳定性:
析水率![]()
(3)
1.3.9 热特性的测定
称取3.0 mg样品置于铝质坩埚内,加入9 μL蒸馏水,密封压盖,室温下平衡过夜。以空铝质坩埚为对照,利用差示扫描量热仪进行测定。扫描温度从25~100 ℃,温度上升速率为10 ℃/min,氮气流量50 mL/min[17]。测定参数包括:起始糊化温度(onset temperature,TO)、最高温度(peak temperature,TP)、终止温度(conclusion temperature,TC)及热焓值(enthalpy of gelatinization,ΔH)。
1.4 数据分析
所有实验平行测定3次。采用Origin 8.0软件作图,通过SPSS 22.0软件中t检验进行显著性分析,结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 超高压处理对小麦淀粉颗粒形貌的影响
图1是小麦原淀粉(wheat starch,WS)和UHP处理淀粉5 000倍的扫描电镜图。由图1可知,WS表面光滑,颗粒完整无裂缝,压力为100 MPa时,淀粉颗粒无明显变化,200~300 MPa处理后,颗粒表面出现破损的痕迹,压力在400~500 MPa时,淀粉颗粒结构消失并出现崩解的现象。本实验观察到的结果和超高压处理糯小麦淀粉[18]和荞麦淀粉[19]的结果相似,但燕麦淀粉在400 MPa处理时依然有部分有规则颗粒[10],表明不同淀粉的耐压能力不同,其加工性能可能不同。淀粉吸收介质中的水分子进入其颗粒内部,颗粒发生溶胀,随着压力的增加,淀粉颗粒被挤压并超出其自身的承受范围,淀粉颗粒便会崩解产生结构消失情况。

a-WS;b-100 MPa;c-200 MPa;d-300 MPa;e-400 MPa;f-500 MPa
图1 不同超高压处理后小麦淀粉的微观结构图
Fig.1 Microstructure diagram of wheat starch after different UHP treatments
2.2 FT-IR分析
FT-IR是分析淀粉材料化学官能团及化学键强弱的有效工具,也能提供淀粉颗粒表面分子双螺旋的有序结构的信息[20]。950~1 065 cm-1是淀粉的红外指纹区域,如1 047 cm-1处的吸光度值表示淀粉的结晶区情况,1 022 cm-1处吸光度值可表示淀粉的无定型区情况,所以R1047/1022值能体现淀粉短程有序的程度[21]。实验结果显示,UHP处理的“和尚头”小麦淀粉的R1047/1022值从2.11(WS)下降到1.51(500 MPa),表明超高压破坏了淀粉的短程有序性,淀粉的晶体结构被破坏。王金荣[22]报道UHP处理后的扬麦15在1 047/1 022 cm-1的峰强度比值也显著降低。与天然淀粉相比,UHP处理后的FT-IR光谱没有发现新的吸收峰(图2),但不同波段的峰值强度不同,表明没有产生新的物质,UHP处理只使部分淀粉分子结构发生了变化,是一个物理改性的过程。该结果与ZHANG等[4]在百合淀粉中的研究结果一致。
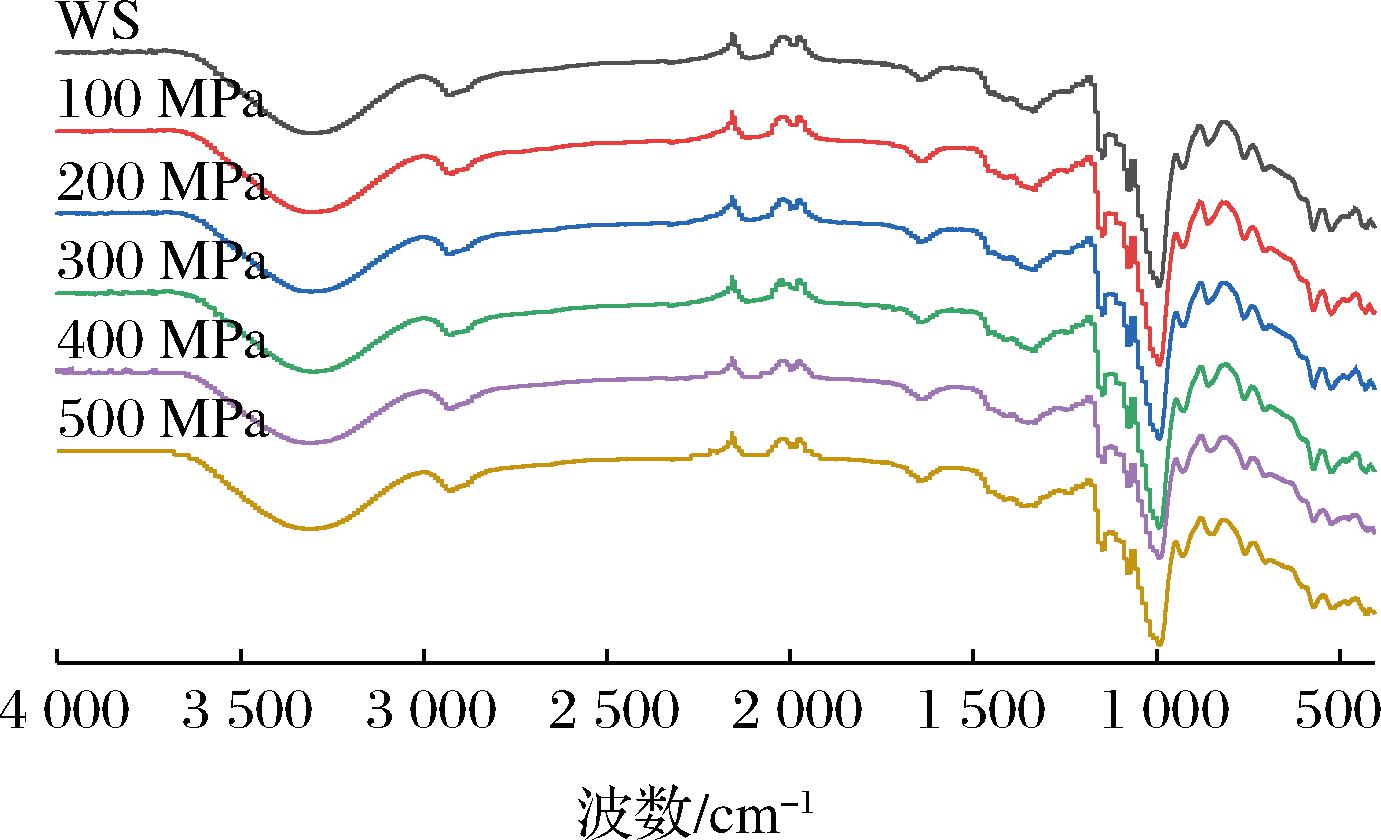
图2 不同超高压处理后小麦淀粉的傅里叶变换红外光谱图
Fig.2 Fourier transform infrared spectrum of wheat starch after different UHP treatments
2.3 X-射线衍射分析
WS在15.08°、22.98°处有衍射峰,在17.67°、18.01°处有双峰,在19.88°有一个小峰,是典型的A型淀粉[23]。100~300 MPa处理时,衍射图谱无明显变化,晶体类型仍为A型(图3),说明小麦淀粉没有发生凝胶化。当压力为400 MPa时,X-射线衍射图谱中的峰位置没有发生变化,但是衍射峰强度明显下降,从29.64%(WS)下降到13.43%(400 MPa)。当压力为500 MPa时,分别在17.66°和20.18°出现衍射峰,其余衍射峰消失(图3)。X-射线衍射图谱的变化说明当压力达到400 MPa时小麦淀粉开始出现凝胶化,随着压力的升高,淀粉完全凝胶化。这与HU等[18]对糯小麦淀粉中的研究结果一致。
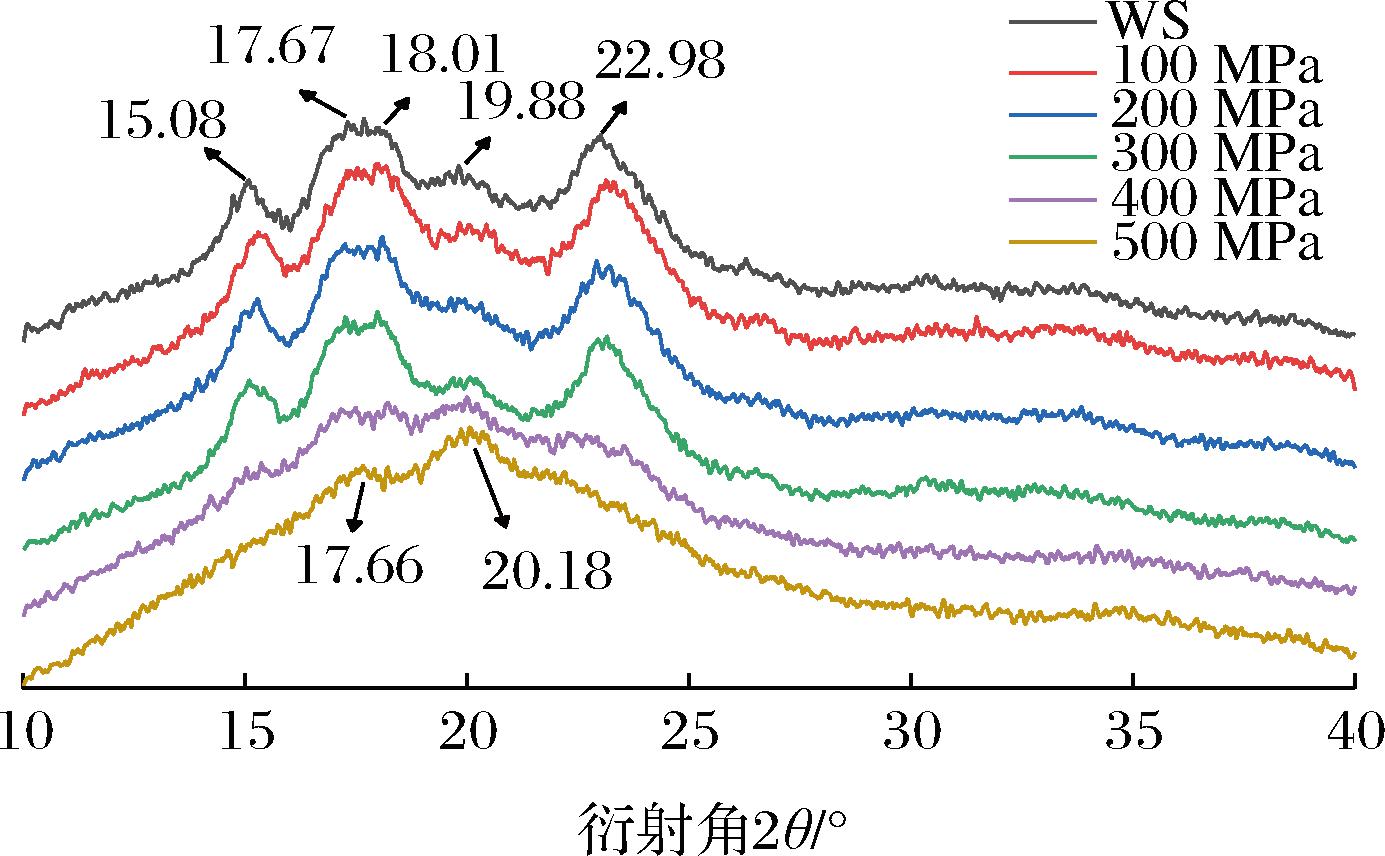
图3 不同超高压处理后小麦淀粉的X-射线衍射图
Fig.3 X-ray diffraction plot of wheat starch after different UHP treatments
2.4 超高压处理对小麦淀粉粒径分布的影响
小麦淀粉颗粒的平均粒径为19.62 μm,其颗粒体积呈双峰曲线分布,峰值出现在15 μm附近,属于中颗粒淀粉[24](图4)。100~300 MPa处理,体积分布图的峰向左移动,峰型变窄,D(4,3)和D50无明显差异(P<0.05)。随着处理压力升高(400~500 MPa),体积分布图峰值下降,范围缩小,D(4,3)和D50显著增加(P<0.05)(表1),UHP处理可使淀粉颗粒膨胀和聚集,表现出淀粉颗粒粒径的增加,在豌豆淀粉[25]中也观察到了类似的现象。UHP对淀粉颗粒形态的影响与压力有关,这一结果与扫描电子显微镜的观测和X-射线衍射实验结果一致,表明过高的处理压力则能使淀粉结构崩解,淀粉出现凝胶化现象。
表1 不同超高压处理后小麦淀粉颗粒的粒度分布特征 单位:μm
Table 1 Characteristics of the particle size distribution of wheat starch particles after different UHP treatments
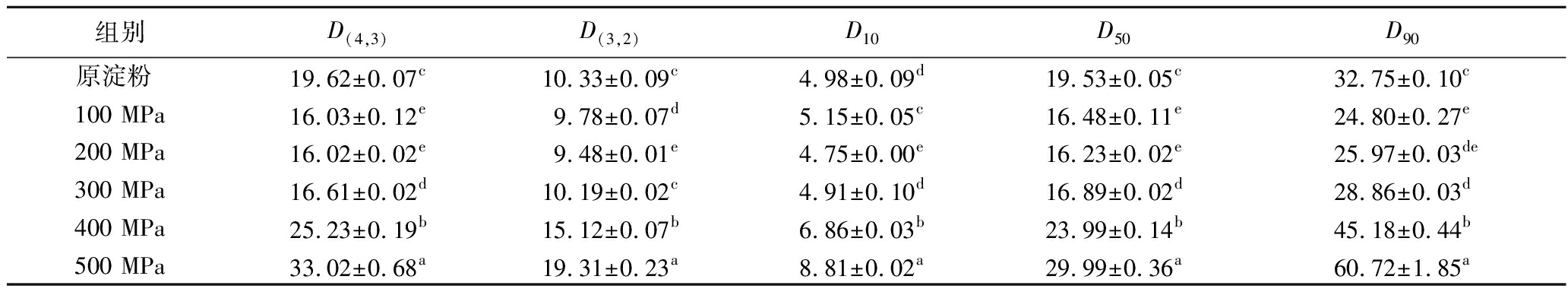
组别D(4,3)D(3,2)D10D50D90原淀粉 19.62±0.07c10.33±0.09c4.98±0.09d19.53±0.05c32.75±0.10c100 MPa16.03±0.12e9.78±0.07d5.15±0.05c16.48±0.11e24.80±0.27e200 MPa16.02±0.02e9.48±0.01e4.75±0.00e16.23±0.02e25.97±0.03de300 MPa16.61±0.02d10.19±0.02c4.91±0.10d16.89±0.02d28.86±0.03d400 MPa25.23±0.19b15.12±0.07b6.86±0.03b23.99±0.14b45.18±0.44b500 MPa33.02±0.68a19.31±0.23a8.81±0.02a29.99±0.36a60.72±1.85a
注:D(4,3)即颗粒体积平均粒径;D(3,2)即颗粒面积平均粒径;D10、D50、D90分别表示样品中粒径小于该直径的颗粒占颗粒总数的10%、50%和90%;同一列不同字母表示样品之间的差异显著性(P<0.05)(下同)。

图4 不同超高压处理后小麦淀粉的粒径分布图
Fig.4 Size distribution diagram of wheat starch after different UHP treatments
2.5 超高压处理对小麦淀粉溶解度和膨胀度的影响
淀粉的溶解度和膨胀度反映淀粉分子与水分子之间相互作用强度。不同UHP处理后的小麦淀粉在90 ℃下的溶解度和膨胀度如图5所示。与WS相比,UHP处理的小麦淀粉的溶解度和膨胀度变化更明显,呈显著下降的趋势。从溶解度看,更高的处理压力(500 MPa)使溶解度较原淀粉下降了27.32%,使膨胀度下降了8.84%。有研究认为是因为UHP处理切断了分子间与分子内的氢键,结晶区破坏程度加深,形成凝胶的网状结构受损所致[26],也可能是淀粉在这一过程中发生重结晶,所以溶解度和膨胀度有降低的趋势。
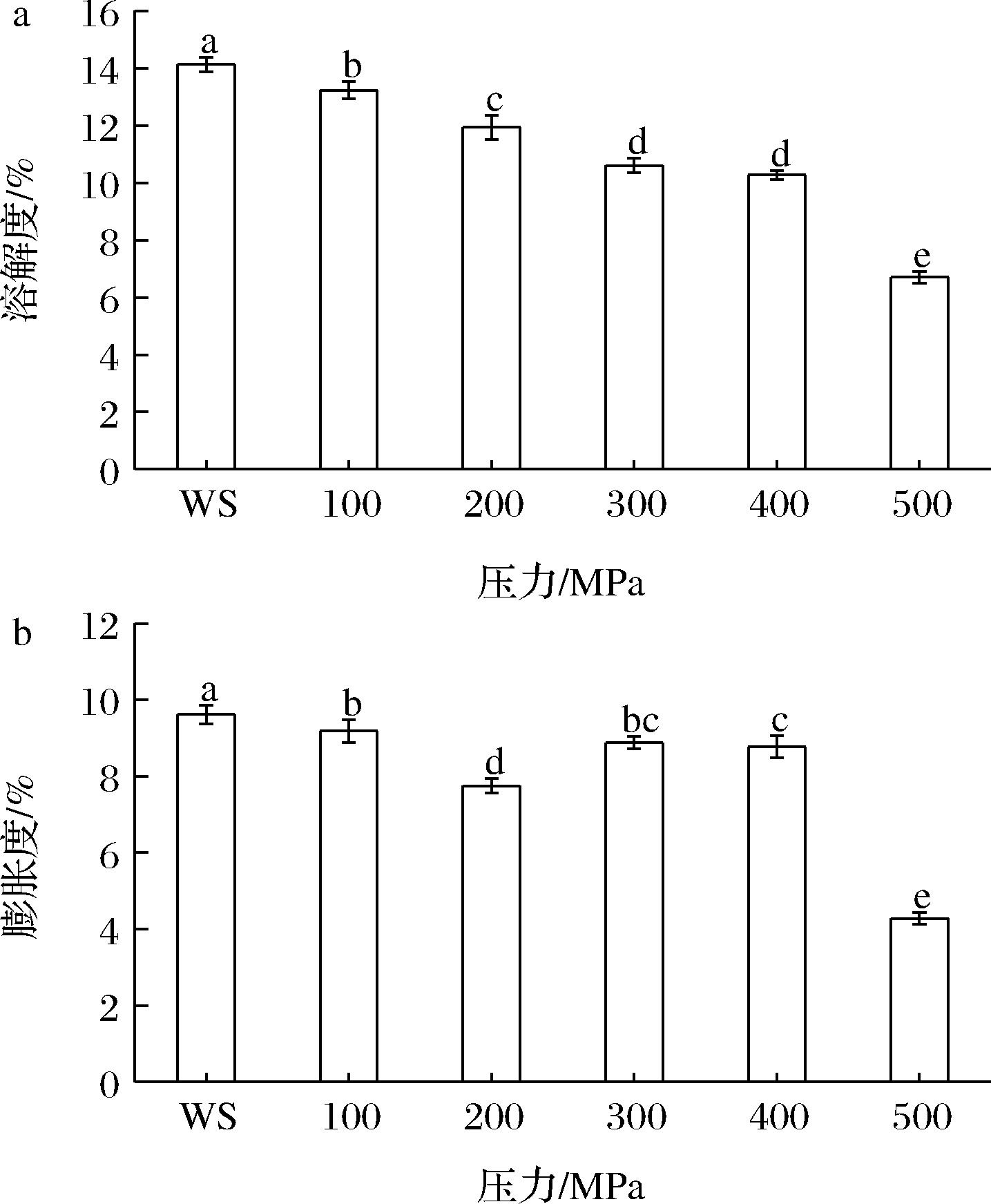
a-溶解度;b-膨胀度
图5 超高压处理对小麦淀粉溶解度和膨胀度的影响
Fig.5 Effect of UHP treatment on starch solubility and expansion in wheat
注:不同小写字母表示淀粉的溶解度和膨胀度在不同UHP处理后存在显著性差异(P<0.05)。
2.6 超高压处理对小麦淀粉冻融稳定性的影响
析水率与冻融过程中淀粉的凝胶稳定性成反比,析水率越小,冻融稳定性越好[27]。图6是不同UHP处理对小麦淀粉冻融稳定性的影响。淀粉糊冷冻过程中水的相变以及冰晶的形成容易破坏淀粉网络结构,导致淀粉凝胶强度减弱。从图中可以看出,随着冻融循环次数的增加,淀粉的析水率增加。第4次冻融循环后,WS的析水率从35.75%增加到56.28%,冻融稳定性变差。随着处理压力的增大,淀粉析水率呈现先降低后上升的趋势,200 MPa处理15 min后,淀粉的析水率最小,显示出较高的冻融稳定性,说明在此条件下对小麦淀粉的冻融稳定性有一定的改善作用;压力超过400 MPa时,析水率开始上升,冻融稳定性降低。该结果表明随着压力的增加,淀粉颗粒破坏程度增大,淀粉分子内部发生重排,导致水分分子与淀粉分子之间的结合能力降低,淀粉颗粒中的水分较容易析出[14]。
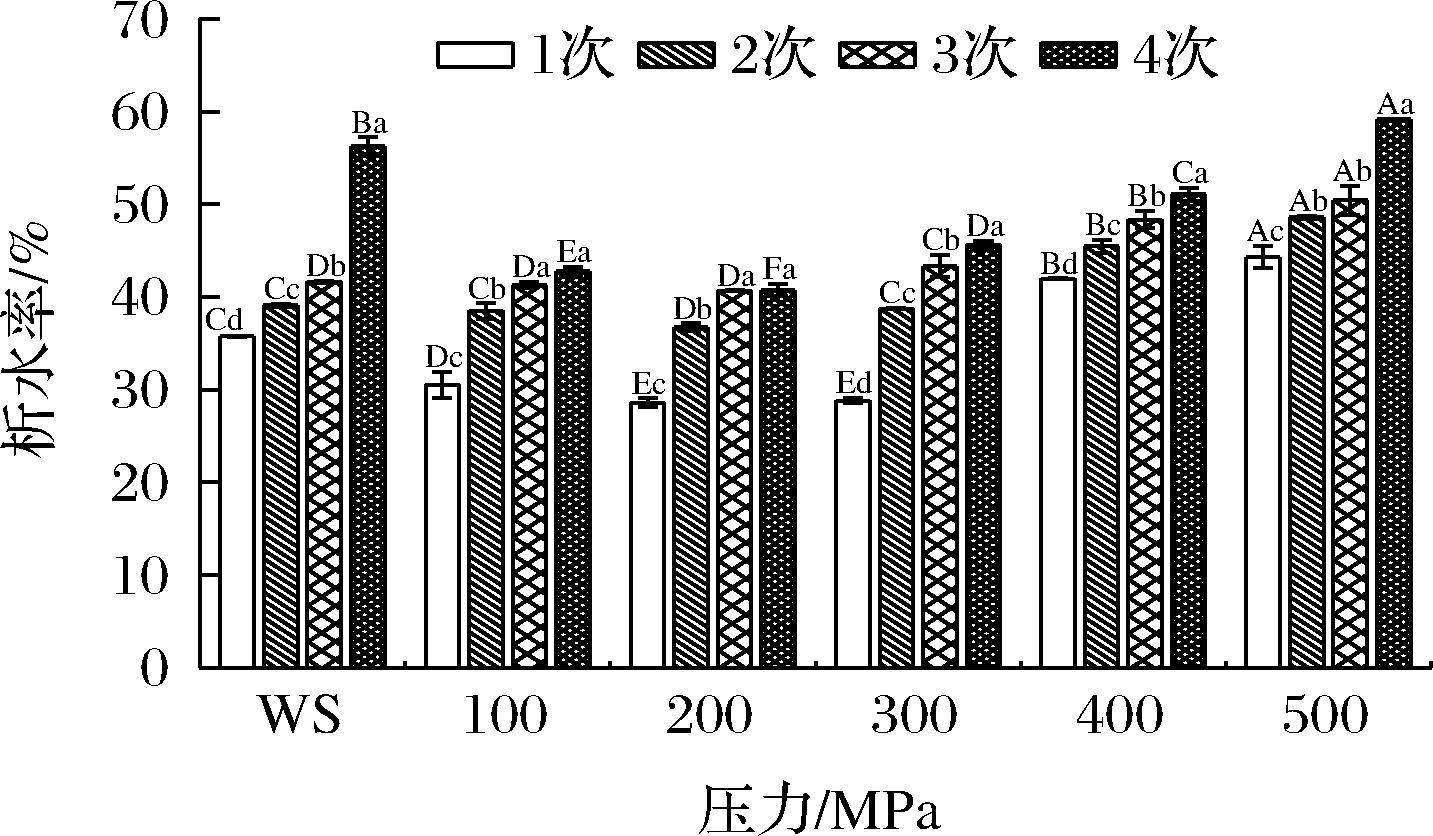
图6 不同超高压处理后小麦淀粉的冻融稳定性
Fig.6 Freeze-thaw stability of wheat starch after different UHP treatments
注:不同大写字母表示组内的显著差异(P<0.05),不同小写字母表示组间的显著差异(P<0.05)。
2.7 超高压处理对小麦淀粉热特性的影响
淀粉分子内部晶体结构的完整性与淀粉糊化温度呈正相关,分子内部晶体结构越完整,其淀粉糊化温度越高[28]。图7是WS和UHP处理小麦淀粉的差示扫描量热热图。随着处理压力增加,吸热峰逐渐向高温偏移,处理压力超过400 MPa时吸热峰消失,这一现象在莲子淀粉中也被观察到[6],由表2可知,100 MPa压力处理后,淀粉的TO、TP、TC及ΔH均显著下降(P<0.05),200~300 MPa处理时,热力学各参数变化不显著,处理压力达到400 MPa以上时,检测不到相关数据,这一实验结果表明,适当的压力处理(如100 MPa)可能首先改变淀粉非结晶区,表现在热力学参数上变化显著,淀粉结晶结构可承受100~300 MPa压力处理,超过400 MPa处理压力,淀粉的结晶结构已经完全被破坏,淀粉颗粒发生凝胶化[29]。这一结果在XRD结果也得到同样的验证,在加工工艺上有非常重要的意义。
表2 不同超高压处理后小麦淀粉的热力学特性参数
Table 2 Thermodynamic characteristic parameters of wheat starch after different UHP treatments

组别TO/℃TP/℃TC/℃ΔH/(J/g)原淀粉57.08±1.16a60.43±0.61a65.80±0.54a7.65±0.35a100 MPa55.01±0.09c59.83±0.27ab63.94±0.58b1.97±0.02b200 MPa55.28±0.30bc59.52±0.30b63.76±0.63b1.86±0.04b300 MPa56.29±0.12bc60.10±0.16ab64.26±0.50b2.14±0.59b400 MPa————500 MPa————
注:—表示未检出;不同小写字母表示淀粉的热力学参数在不同UHP处理后存在显著性差异(P<0.05)。

图7 不同超高压处理后小麦淀粉的差示扫描量热热图
Fig.7 Differential scanning calorimetry of wheat starch after different UHP treatments
3 结论
本文研究了UHP(100~500 MPa)处理对“和尚头”小麦淀粉结构和特性的影响。处理压力低于400 MPa时,随着压力的增加,淀粉颗粒被挤压并超出其自身的承受范围,发生淀粉颗粒崩解、结构消失现象;处理压力高于400 MPa时,随着压力的增加,淀粉凝胶化程度逐渐增加,粒径分析显示,更高的UHP处理可使淀粉颗粒膨胀和聚集,淀粉相对结晶度降低。FT-IR结果表明,UHP处理没有产生新的物质或化学键,淀粉分子结构的变化是一个物理改性的过程。与WS相比,UHP处理的淀粉的溶解度和膨胀度呈显著下降的趋势(P<0.05),100 MPa压力处理后,淀粉的TO、TP、TC及ΔH均显著下降(P<0.05),200~300 MPa处理时,热力学各参数变化不显著,当处理压力达到400 MPa以上时,检测不到相关热力学参数,表明淀粉结晶结构可承受100~300 MPa压力处理,超过此压力,淀粉分子顺序完全破坏、晶型结构丧失,这在指导UHP技术在淀粉加工应用上具有一定的参考价值,然而,UHP引起各种淀粉各参数变化的确切机制应进一步研究。
[1] LI W H,GAO J M,WU G L,et al.Physicochemical and structural properties of A-and B-starch isolated from normal and waxy wheat:Effects of lipids removal[J].Food Hydrocolloids,2016,60:364-373.
[2] KIM H S,HUBER K C.Simple purification (desalting) procedure to facilitate structural analysis of an alkali-solubilized/neutralized starch solution by intermediate-pressure size-exclusion chromatography[J].Journal of Agricultural and Food Chemistry,2007,55(13):4944-4948.
[3] PIECYK M,![]() B,O
B,O TARZEWSKA A,et al.Effect of hydrothermal modifications on properties and digestibility of grass pea starch[J].International Journal of Biological Macromolecules,2018,118:2113-2120.
TARZEWSKA A,et al.Effect of hydrothermal modifications on properties and digestibility of grass pea starch[J].International Journal of Biological Macromolecules,2018,118:2113-2120.
[4] ZHANG D L,XU H S,JIANG B,et al.Effects of ultra-high pressure on the morphological and physicochemical properties of lily starch[J].Food Science &Nutrition,2020,9(2):952-962.
[5] LI W H,TIAN X L,LIU L P,et al.High pressure induced gelatinization of red adzuki bean starch and its effects on starch physicochemical and structural properties[J].Food Hydrocolloids,2015,45:132-139.
[6] KIM S,YANG S Y,CHUN H H,et al.High hydrostatic pressure processing for the preparation of buckwheat and tapioca starch films[J].Food Hydrocolloids,2018,81:71-76.
[7] GUO Z B,ZENG S X,LU X,et al.Structural and physicochemical properties of lotus seed starch treated with ultra-high pressure[J].Food Chemistry,2015,186:223-230.
[8] LARREA-WACHTENDORFF D,TABILO-MUNIZAGA G,FERRARI G.Potato starch hydrogels produced by high hydrostatic pressure (HHP):A first approach[J].Polymers,2019,11(10):1673.
[9] 孙小凡,曾庆华.小麦淀粉实验室制备工艺研究[J].粮油加工,2008(1):96-98.
SUN X F,ZENG Q H.Study on laboratory preparation technology of wheat starch[J].Cereals and Oils Processing,2008(1):96-98.
[10] 张晶,张美莉.超高压处理对燕麦淀粉颗粒特性、热特性及流变学特性的影响[J].食品科学,2020,41(23):114-121.
ZHANG J,ZHANG M L.Effect of high hydrostatic pressure treatment on morphological,thermal and rheological properties of oat starch[J].Food Science,2020,41(23):114-121.
[11] OVANDO-MART NEZ M,OSORIO-D
NEZ M,OSORIO-D AZ P,WHITNEY K,et al.Effect of the cooking on physicochemical and starch digestibility properties of two varieties of common bean (Phaseolus vulgaris L.) grown under different water regimes[J].Food Chemistry,2011,129(2):358-365.
AZ P,WHITNEY K,et al.Effect of the cooking on physicochemical and starch digestibility properties of two varieties of common bean (Phaseolus vulgaris L.) grown under different water regimes[J].Food Chemistry,2011,129(2):358-365.
[12] ZHANG B J,LI X X,LIU J,et al.Supramolecular structure of A-and B-type granules of wheat starch[J].Food Hydrocolloids,2013,31(1):68-73.
[13] WANG S J,YU J L,ZHU Q H,et al.Granular structure and allomorph position in c-type Chinese yam starch granule revealed by SEM,13C CP/MAS NMR and XRD[J].Food Hydrocolloids,2009,23(2):426-433.
[14] 郭泽镔,曾绍校,郑宝东.超高压处理对莲子淀粉理化特性的影响[J].中国食品学报,2014,14(11):118-123.
GUO Z B,ZENG S X,ZHENG B D.Effect of ultra high pressure processing on the physicochemical properties of lotus-seed starch[J].Journal of Chinese Institute of Food Science and Technology,2014,14(11):118-123.
[15] ZHANG B,WU H,GOU M,et al.The comparison of structural,physicochemical,and digestibility properties of repeatedly and continuously annealed sweet potato starch[J].Journal of Food Science,2019,84(8):2050-2058.
[16] 张晶,张美莉.燕麦淀粉提取工艺优化及其相关特性研究[J].食品科技,2019,44(9):295-302.
ZHANG J,ZHANG M L.Extraction and related properties of oat starch[J].Food Science and Technology,2019,44(9):295-302.
[17] LI H,WANG R R,LIU J,et al.Effects of heat-moisture and acid treatments on the structural,physicochemical,and in vitro digestibility properties of lily starch[J].International Journal of Biological Macromolecules,2020,148:956-968.
[18] HU X P,ZHANG B,JIN Z Y,et al.Effect of high hydrostatic pressure and retrogradation treatments on structural and physicochemical properties of waxy wheat starch[J].Food Chemistry,2017,232:560-565.
[19] VALLONS K J R,ARENDT E K.Effects of high pressure and temperature on buckwheat starch characteristics[J].European Food Research and Technology,2009,230(2):343-351.
[20] FLORES-MORALES A,JIMÉNEZ-ESTRADA M,MORA-ESCOBEDO R.Determination of the structural changes by FT-IR,Raman,and CP/MAS 13C NMR spectroscopy on retrograded starch of maize tortillas[J].Carbohydrate Polymers,2012,87(1):61-68.
[21] YANG Y,ZHENG S S,LI Z,et al.Influence of three types of freezing methods on physicochemical properties and digestibility of starch in frozen unfermented dough[J].Food Hydrocolloids,2021,115:106619.
[22] 王金荣.退火及超高压对三种不同结晶类型的淀粉结构和功能性质的影响[D].天津:天津科技大学,2016.
WANG J R.The effect of annealing and ultra-high pressure treatment on structural and functional of three starches with different polymorphs[D].Tianjin:Tianjin University of Science and Technology,2016.
[23] ZHANG B J,CHEN L,LI X X,et al.Understanding the multi-scale structure and functional properties of starch modulated by glow-plasma:A structure-functionality relationship[J].Food Hydrocolloids,2015,50:228-236.
[24] LINDEBOOM N,CHANG P R,TYLER R T.Analytical,biochemical and physicochemical aspects of starch granule size,with emphasis on small granule starches:A review[J].Starch-Stärke,2004,56(3-4):89-99.
[25] ZHU F,LI H.Effect of high hydrostatic pressure on physicochemical properties of quinoa flour[J].LWT,2019,114:108367.
[26] LIU M,WU N N,YU G P,et al.Physicochemical properties,structural properties,and in vitro digestibility of pea starch treated with high hydrostatic pressure[J].Starch-Stärke,2018,70(1-2):1700082.
[27] YE J P,HU X T,ZHANG F,et al.Freeze-thaw stability of rice starch modified by improved extrusion cooking technology[J].Carbohydrate Polymers,2016,151:113-118.
[28] 缪铭.慢消化淀粉的特性及形成机理研究[D].无锡:江南大学,2009.
MIAO M.Characteristic and formation mechanism of slowly digestible starch[D].Wuxi:Jiangnan University,2009.
[29] LI W H,BAI Y F,MOUSAA S A S,et al.Effect of high hydrostatic pressure on physicochemical and structural properties of rice starch[J].Food and Bioprocess Technology,2012,5(6):2233-2241.