南美白对虾(Litopenaeus vannamei)壳薄体肥、营养丰富、易消化,深受消费者喜爱。然而对虾的高水分、高蛋白使得虾肉在贮藏过程中极易发生品质劣变。肌原纤维蛋白(myofibrillar protein,MP) 是构成虾肌肉中最主要的蛋白质,MP是肌肉组织的主要结构蛋白,约占蛋白质总量的40%~60%[1]。虾类变质主要是由结构蛋白的解构引起的,蛋白质的氧化是虾品质恶化的主要原因[2]。水产品保鲜一直是行业内的研究热点,保鲜方法大体可分为化学法、物理法和生物保鲜法。但这些方法都存在一定局限性,故多种保鲜方式结合,利用多个栅栏因子间的相互作用来提高水产品质量和保鲜技术水平是未来研究的发展趋势[3]。微冻是使水产品处于部分冻结状态的一种保藏方法,比冷藏大大延长了水产品的货架期,同时蛋白冷冻变性现象也没冻藏严重,因此微冻是一种短期内保持捕捞后水产品品质较好的保鲜方法[4]。抗冻保鲜剂是冷冻水产品保持品质的一种重要手段,磷酸盐类作为一种传统抗冻剂,过量摄入会对人体健康造成诸多不利影响[5]。因此,寻找天然、健康、高效的新型抗冻保鲜剂成了当前的研究热点。
坛紫菜多糖(polysaccharides derived from Porphyra haitanensis,PHP),国内外研究集中于抗氧化、免疫调节和降血糖血脂等生物活性方面,而将其应用于水产品抗冻保鲜的研究鲜有报导。基于本团队前期研究,发现5 mg/mL PHP浸泡处理可很好地维持微冻南美白对虾仁的品质,而蛋白质氧化与虾品质恶化有着密切联系。因此,本研究以微冻南美白对虾MP为研究对象,探究虾仁经PHP浸泡后在微冻过程中MP氧化特性和结构特性的变化规律,从蛋白质角度揭示PHP抗冻保鲜的潜在机制,以期为坛紫菜多糖在水产品保鲜应用方面提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活南美白对虾,广州市华润万家超市;坛紫菜,潮州市饶平县;DEAE-52、Sephadex G-100,北京索莱宝科技有限公司;微量总巯基测试盒、蛋白质羰基含量测试盒,南京建成生物工程研究所;Bradford蛋白浓度测定试剂盒,碧云天生物技术有限公司;焦磷酸钠(食品级),青岛博智汇力生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
H-1850R高速离心机,长沙湘仪离心机仪器公司;T25组织匀浆机,德国IKA公司;Sunrise-basic吸光度酶标仪,德国TECAN公司;Nano-ZS90纳米粒度分析仪,英国Malvern公司;Chirascan圆二色光谱仪,英国应用光学物理公司;Cary Eclipse荧光分光光度计,美国VARIAN公司;Pro高分辨率扫描电镜,荷兰Phenom公司。
1.3 实验方法
1.3.1 原料处理
原料处理工艺流程:
坛紫菜洗净烘干、粉碎过筛→95%(体积分数)乙醇脱脂和脂溶性色素、烘干→16 g坛紫菜干粉加1 L蒸馏水超声40 min→90 ℃振荡水浴浸提4 h、离心→上清液旋蒸浓缩、醇沉、离心→沉淀复溶、木瓜蛋白酶50 ℃酶解2.5 h、离心→Sevage法脱蛋白→透析、旋蒸、冻干→DEAE-52纯化→Sephadex G-100纯化→PHP。
鲜活南美白对虾,在冰温条件下清洗、去头去尾去壳。选取个体大小一致的完整虾仁(7~8 g),沥干后用滤纸轻擦去表面水分。然后将虾仁随机分成3组,分别与蒸馏水(空白对照),5 mg/mL PHP以及5 mg/mL焦磷酸钠(阳性对照)以料液比1∶2(g∶mL)混合,置于4 ℃冰箱中浸泡2 h,每隔20 min搅拌1次[6]。取出虾仁后,用滤纸拭去表面水分,装入封口袋中,置于-3 ℃微冻冰箱贮存,每隔5 d随机取样测定指标,每个指标做3个平行取平均值。值得一提的是,在各种磷酸盐中,焦磷酸钠对冷冻虾仁的抗冻和保水效果均较佳,为了减少多因素对冷冻虾仁抗冻保鲜特性的影响,本文选择单一的焦磷酸钠处理作为阳性对照。
1.3.2 MP提取
参考杨肖杰等[1]的方法并稍作修改,采用Bradford试剂盒检测提取的MP溶液质量浓度。整个提取过程蛋白溶液注意保持冰温。
1.3.3 总巯基含量的测定
采用微量总巯基测试盒,按照其说明书取MP原液对总巯基含量进行检测。
1.3.4 羰基含量的测定
采用蛋白质羰基含量测试盒,按照其说明书取MP原液对羰基含量进行检测。
1.3.5 表面疏水性的测定
参考CHIN等[7]的方法并稍作修改。将MP用0.02 mol/L的PBS缓冲液调整浓度到1 mg/mL,取1 mL与200 mL 1 mg/mL的溴酚蓝溶液室温漩涡15 min后于5 500 r/min转速下离心15 min,上清液稀释10倍后于595 nm波长处测定OD值。以PBS为对照,溴酚蓝结合量表示表面疏水性,计算如公式(1)所示:
溴酚蓝结合量![]()
(1)
式中:A0为空白对照吸光度;A1为样品吸光度。
1.3.6 粒径的测定
参考BELICIU等[8]的方法并稍作修改。粒径使用纳米粒度仪进行测定,用蒸馏水将MP溶液稀释到1 mg/mL,取适量于比色皿中,再放入测量池内,参数设定为平衡时间60 s,温度25 ℃,散射角90°。
1.3.7 Zeta电位的测定
参考BELICIU等[8]的方法并稍作修改。方法与粒径测定相同,MP溶液质量浓度同样是1 mg/mL,取适量于比色皿中并放入样品池,室温下使用纳米粒度仪测定Zeta电位。
1.3.8 圆二色光谱的测定
参考李可等[9]的方法并稍作修改,室温下使用圆二色光谱仪对MP二级结构进行分析。调节MP浓度到0.5 mg/mL,取适量置于1 mm比色皿中并放入样品池内。仪器参数:响应0.5 s、扫描范围190~260 nm、扫描步阶1 nm、缝宽1 nm,摩尔椭圆率表示圆二色性,CDNN软件计算二级结构含量。
1.3.9 内源荧光光谱的测定
参考SHI等[10]的方法并稍作修改,室温下使用荧光分光光度计对MP三级结构进行分析。用0.6 mol/L KCl-20 mmol/L Tris-马来酸(pH 7.0) 调节MP质量浓度为1 mg/mL,取适量置于比色皿中并放入样品池内。仪器参数:激发波长295 nm,发射波长范围300~400 nm,速率1 200 nm/min,狭缝宽5 nm。用Tris-马来酸溶液调零。
1.3.10 肌肉组织扫描电镜分析
参考颜龙杰等[11]的方法并稍作修改,用刀片平行于虾肌肉纹理切成米粒大小的组织样本,立即投入10倍以上体积的电镜固定液中,室温固定2 h,再转移至4 ℃固定24 h,0.2 mol/L PBS缓冲液(pH 7.2)漂洗2次,然后1% OsO4溶液室温浸泡1 h,使用不同梯度体积分数的乙醇脱水若干次后再用乙酸异戊酯置换乙醇,在样品表面溅射镀金后用扫描电镜拍摄。
1.4 数据处理
采用IBM SPSS Statistics 26软件进行数据分析,单因素方差分析中的邓肯模型,P<0.05表示数据间有显著性差异。使用Origin 2021以及GraphPad Prism 8.0进行图像绘制。
2 结果与分析
2.1 总巯基含量
总巯基含量是反映蛋白质氧化程度的指标之一,蛋白质氧化是蛋白质共价修饰的一种模式,在贮藏过程中巯基容易被氧化为二硫键,导致总巯基含量下降[12]。不同浸泡处理后的南美白对虾仁在微冻过程中的总巯基变化如图1所示,所有处理组的总巯基含量都随贮藏时间的推移呈显著下降趋势(P<0.05)。到贮藏末期,蒸馏水、PHP和焦磷酸钠处理组的总巯基含量相比初始值分别下降了61.51%、43.90%和55.75%。PHP处理组的总巯基含量显著高于对照组(P<0.05),结果表明PHP可以抑制MP中总巯基含量下降,这与袁悦[13]的研究结果一致。在微冻储存过程中,对照样品和PHP处理样品的巯基含量的显著性差异可能是由于MP的巯基对氧化敏感性的差异,掩蔽了肌动球蛋白分子的活性巯基[12]。另外,蛋白质聚集引起的SH基团的掩蔽也会导致SH含量的下降[14]。
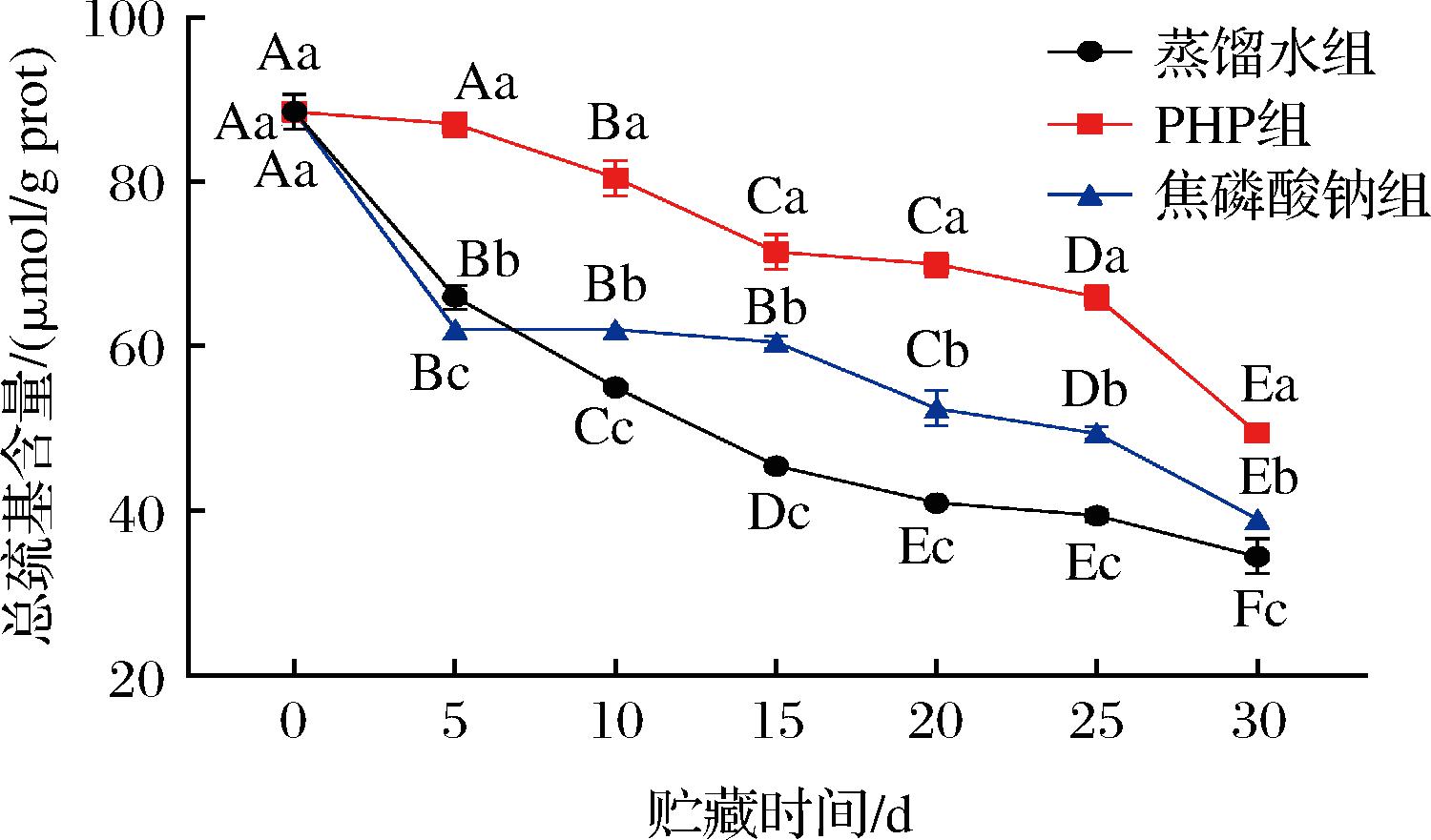
图1 PHP对微冻南美白对虾仁MP总巯基含量的影响
Fig.1 Effects of PHP on the sulfhydryl content of Litopenaeus vannamei MP during superchilled storage
注:不同小写字母表示微冻贮藏同一天不同浸泡处理组的数据存在显著差异,不同大写字母表示相同浸泡处理不同贮藏时间数据有显著差异(P<0.05)(下同)。
2.2 羰基含量
羰基是测定蛋白质氧化程度最常用的指标,主要由赖氨酸、脯氨酸、精氨酸等直接氧化生成,其含量变高表明蛋白质氧化程度增大。蛋白质羰基化是虾肌肉蛋白氧化最重要的变化之一,不同浸泡处理后的南美白对虾仁在微冻过程中的羰基含量变化如图2所示,各处理组的羰基含量在贮藏期内呈显著上升趋势(P<0.05)。肌原纤维的氧化导致大范围的氨基酸侧链修饰,形成了羰基化合物[12]。另外在长期微冻贮存过程中,冰晶的形成对肌肉细胞的超微结构造成损伤并释放自由基[15],同时脂肪氧化降解也会产生自由基,自由基攻击蛋白质氨基酸侧链、肽链骨架,导致氨基酸侧链暴露,发生蛋白质聚合、交联等反应,可能使蛋白质氧化程度增加,羰基含量增加[16]。PHP处理组的羰基含量在各贮藏时期都显著低于其他处理组(P<0.05),这表明PHP浸泡处理虾仁能有效抑制羰基的生成和MP的氧化,与相悦等[17]琼胶寡糖可延缓羰基含量上升的结果一致,这可能与PHP具有较强的清除自由基和金属离子螯合能力有关,另外PHP还可能与冰晶结合,通过抑制冰晶的生长来控制肌肉的机械损伤,和抑制脂肪氧化从而使蛋白质氧化变性的程度降低。蛋白质变性是指蛋白质在某些物理和化学因素作用下,次级键受到破坏其特定的空间构象发生改变,蛋白质氧化和变性都可导致蛋白结构的改变,蛋白质氧化和脂肪氧化都会在一定程度上诱导蛋白质发生变性[18]。
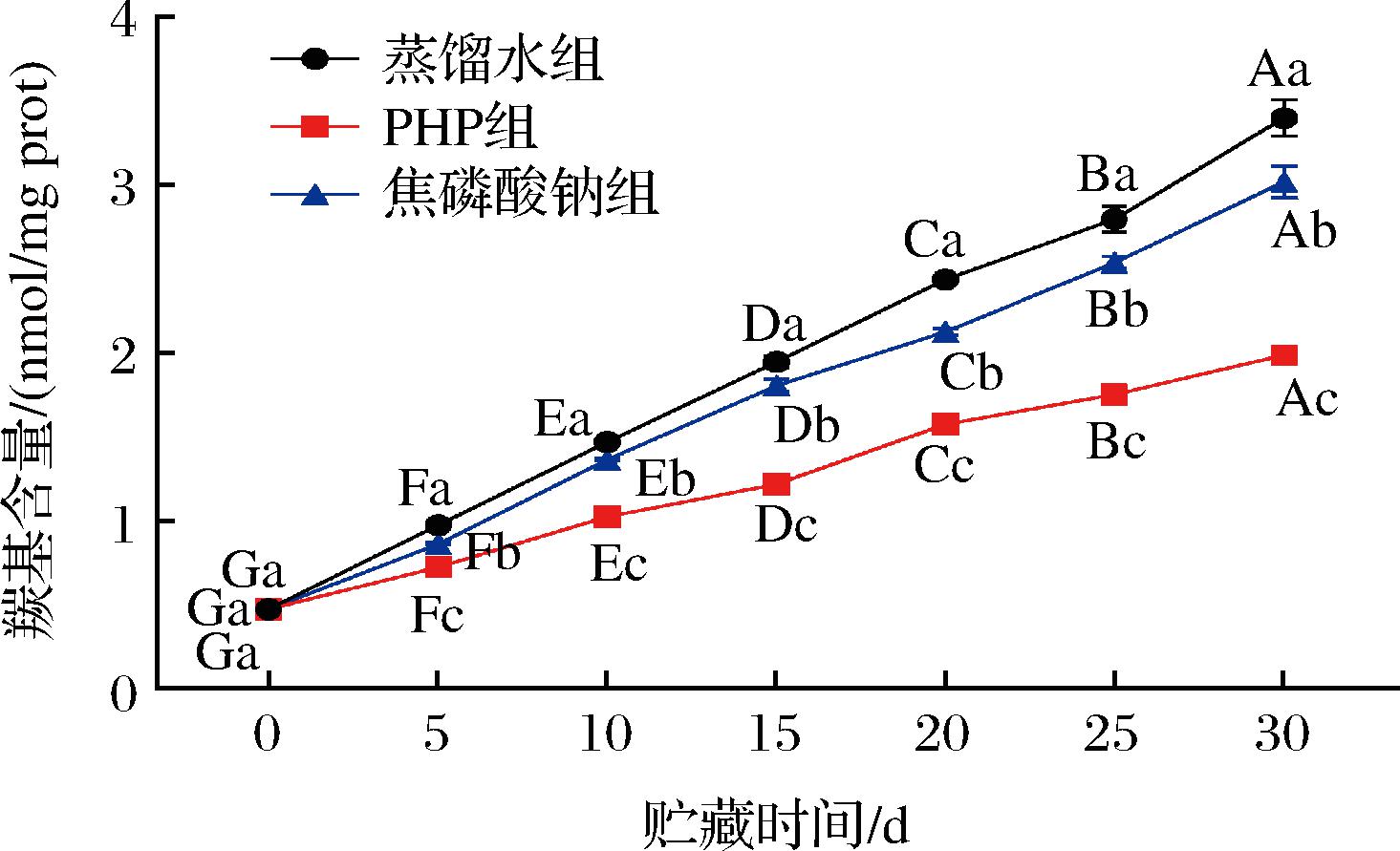
图2 PHP对微冻南美白对虾仁MP羰基含量的影响
Fig.2 Effects of PHP on the carbonyl content of Litopenaeus vannamei MP during superchilled storage
2.3 表面疏水性
表面疏水性与蛋白质分子氧化引起的结构变化有关[19],是判断蛋白三级结构变化的主要指标。它反映的是蛋白表面的疏水性氨基酸残基数目,根据氨基酸残基跟溴酚蓝结合量来表征蛋白质氧化变性程度[20]。不同浸泡处理后的南美白对虾仁在微冻过程中的表面疏水性变化如图3所示。各组样品的溴酚蓝结合量随贮藏时间延长而呈整体上升趋势,相比鲜虾有显著的增加(P<0.05)。蛋白质去折叠暴露在其表面的疏水性氨基酸残基增加,导致表面疏水性上升[20]。另外芳香族氨基酸的展开和暴露也可能是增加表面疏水性的主要因素[21]。虾仁贮存第15天后,PHP组的溴酚蓝结合量显著低于蒸馏水组和焦磷酸钠组(P<0.05),这说明PHP在一定程度上可以抑制MP表面疏水性的增加。ZHANG等[12]也发现卡拉胶可降低冷冻贮藏期间凡纳滨对虾MP的表面疏水性,与本研究结果类似。PHP分子含有羟基、氨基等亲水性基团,也包含大量氢键,可降低蛋白表面疏水性可能是由于蛋白质分子与PHP之间的亲水性相互作用。还可能通过抑制蛋白质的氧化和变性,限制了虾蛋白表面疏水性的增加。此外,PHP浸泡虾仁后在其表面形成的糖膜是一种防止氧化变化的保护屏障,延缓了表面疏水性的增加[19]。
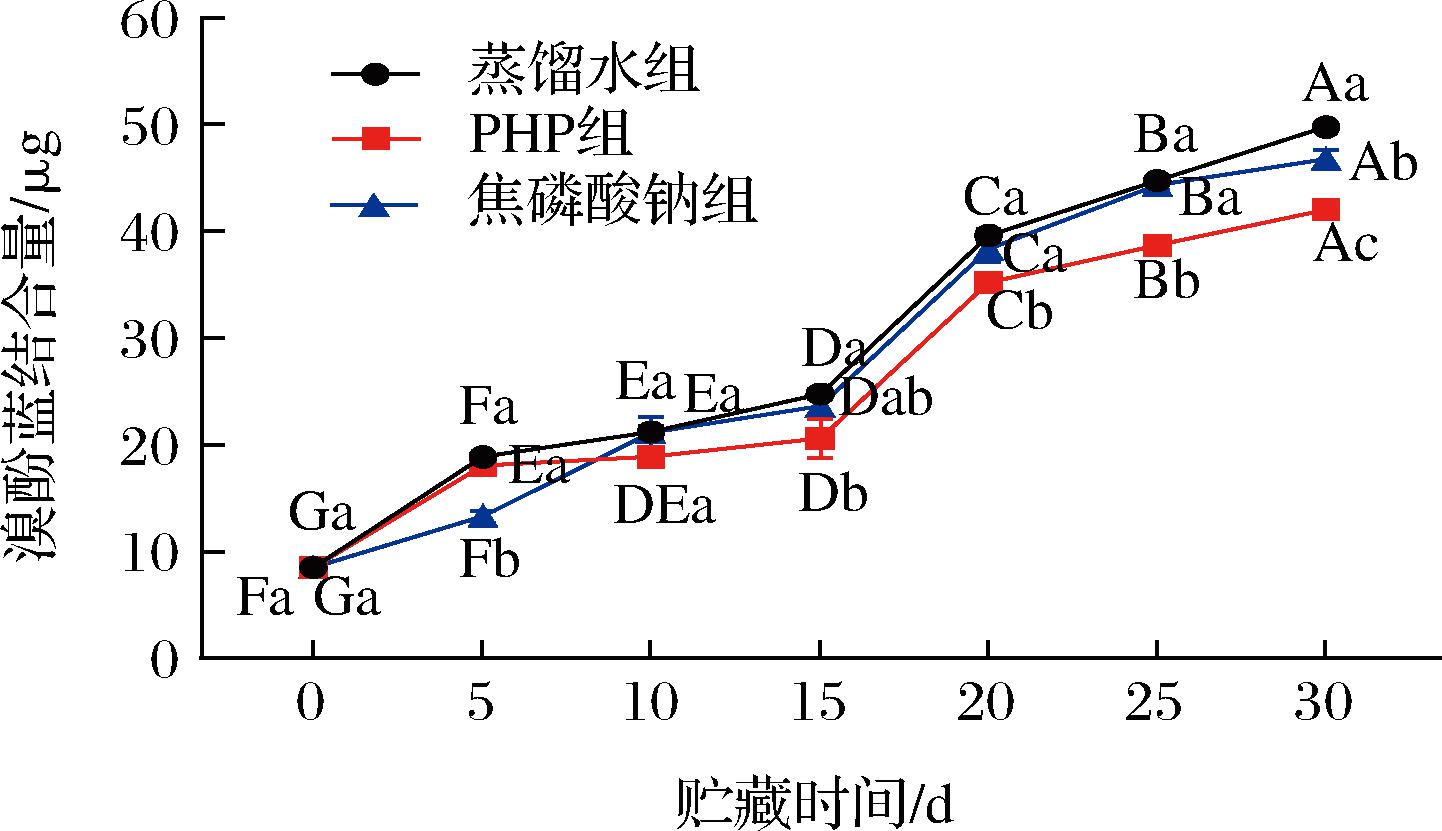
图3 PHP对微冻南美白对虾仁MP表面疏水性的影响
Fig.3 Effects of PHP on the surface hydrophobicity of Litopenaeus vannamei MP during superchilled storage
2.4 粒径
粒径可表征MP的聚集程度和聚集体的大小,反映蛋白质空间结构的变化[22]。用动态光散射法评估了各组浸泡处理和微冻贮存对南美白对虾仁MP聚集的影响,肌原纤维蛋白溶液的平均粒径(Z-Average值)越大,说明MP聚集越严重。粒径分布如图4所示,MP聚集体在测试范围内呈现单一粒径分布峰,说明各实验组的蛋白粒径分布是均匀和稳定的。随着贮藏时间的推移,各组粒径分布主峰位置逐渐向大粒径方向偏移,PHP组和焦磷酸钠组的粒径始终分布在100~1 000 nm内,而蒸馏水组粒径则在贮藏末期超出了2 000 nm。平均粒径变化如图5所示,所有样品的平均粒径在贮存过程中均显著增加(P<0.05)。平均粒径的变化主要是由于微冻过程中MP的展开和蛋白表面积的增加所致。此外,蛋白质间的二硫键、氢键和疏水相互作用也增强了,促进了MP的聚集[15];蛋白质氧化变性造成蛋白质骨架裂解、交联聚集絮凝,同时冰晶的生长促使肌原纤维蛋白分子之间形成非共价键,导致蛋白质链大量聚集,形成不溶性大分子凝集体使MP粒径增加[23]。结果还表明,与对照组相比,PHP和焦磷酸钠浸泡处理虾仁都可显著延缓微冻虾仁MP平均粒径的增加(P<0.05),即可有效抑制MP聚集。糖类含有大量游离羟基,可结合水分子,阻止冰晶的形成与生长,延缓了蛋白质聚集和变性,从而抑制了蛋白质聚集体的形成和粒径的增加[18]。而磷酸盐可以破坏MP大分子,阻碍其在低温下的聚集从而抑制MP粒径增加[24]。
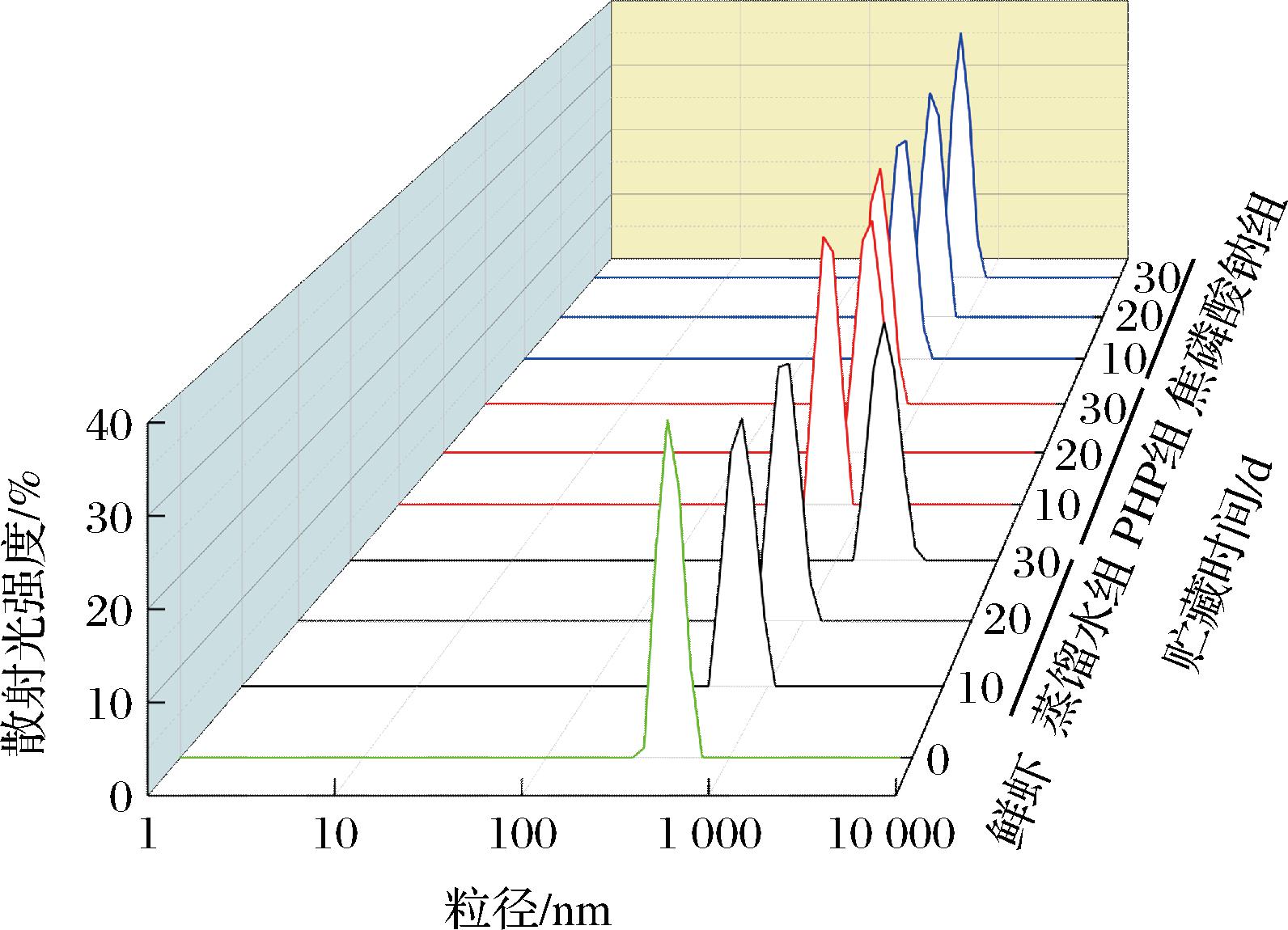
图4 PHP对微冻南美白对虾仁MP粒径分布的影响
Fig.4 Effects of PHP on the particle size distribution of Litopenaeus vannamei MP during superchilled storage
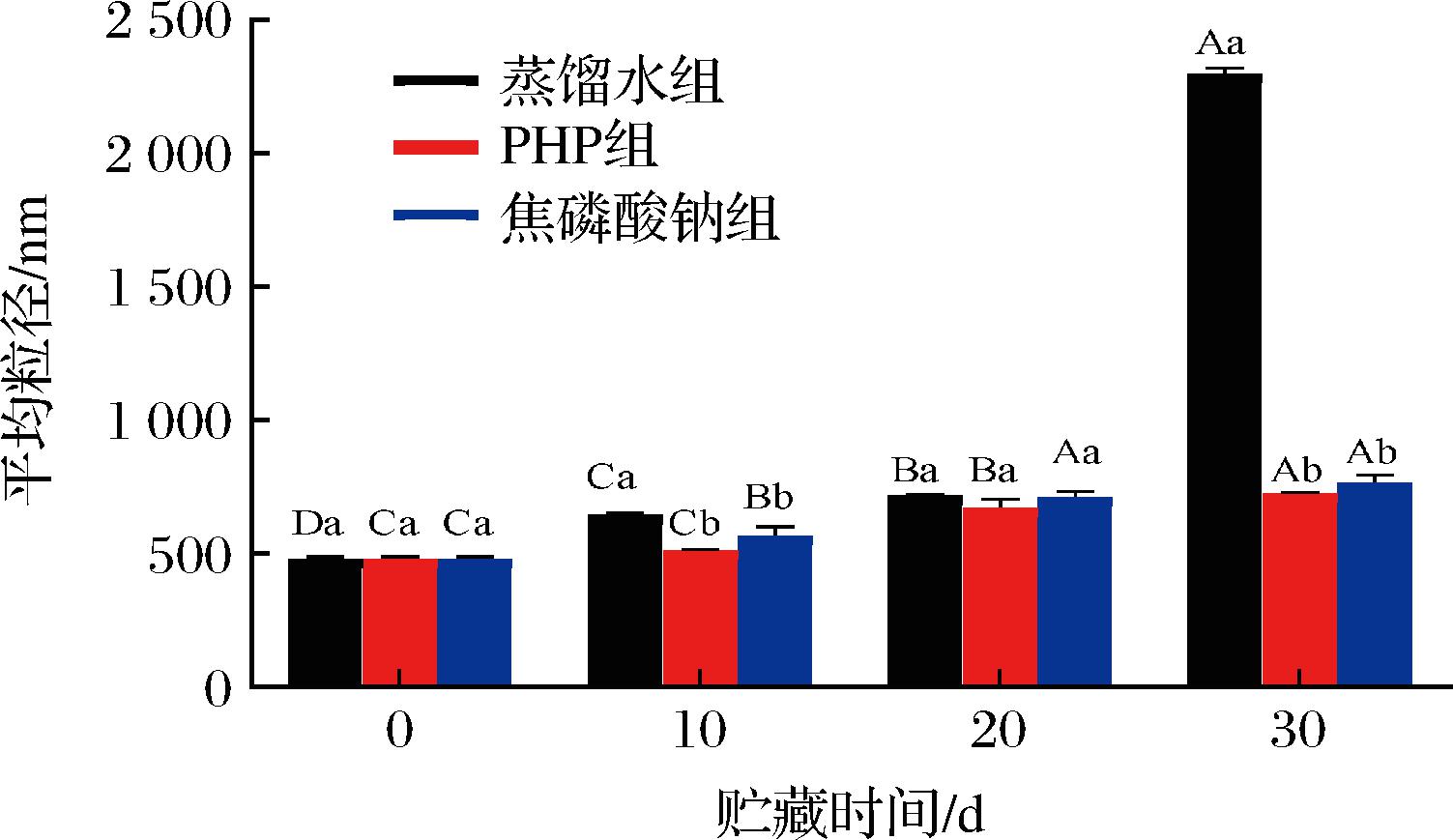
图5 PHP对微冻南美白对虾仁MP平均粒径的影响
Fig.5 Effects of PHP on the average particle size of Litopenaeus vannamei MP during superchilled storage
2.5 Zeta电位
Zeta电位表示蛋白表面的有效电荷,是MP稳定性的一个关键指标,可用于评估带电生物聚合物之间静电相互作用力的大小,反映蛋白质的分散和聚集[15]。Zeta电位绝对值变小,说明生物聚合物之间静电相互作用力变小、聚集程度增加。如图6所示,在贮藏初期,各组MP都具有相对较大的Zeta电位绝对值,随贮藏时间的延长,各组Zeta电位绝对值显著降低(P<0.05),这可能与部分蛋白变性和聚集体形成有关[25]。与对照组相比,PHP和焦磷酸钠浸泡处理均可显著延缓MP的Zeta电位绝对值的降低(P<0.05),意味着同性电荷的静电排斥更强,使蛋白质溶液更稳定,形成的分子或分散的颗粒更小[22]。结果说明PHP组和焦磷酸钠组的MP聚集和氧化变性程度较空白组低,从侧面说明它们的MP结构更稳定受破坏程度更低,这与后文的圆二色谱和荧光光谱结果前后保持一致。这可能是因为PHP抑制了冰晶的形成以及蛋白和脂肪氧化,从而降低了蛋白变性和聚集,有利于MP结构的稳定。GAO等[25]发现添加1%多糖(瓜尔胶和壳聚糖)结合高强度超声处理可减小粒径、影响Zeta电位,防止蛋白质聚集,协同提高了低盐MP乳液的稳定性。
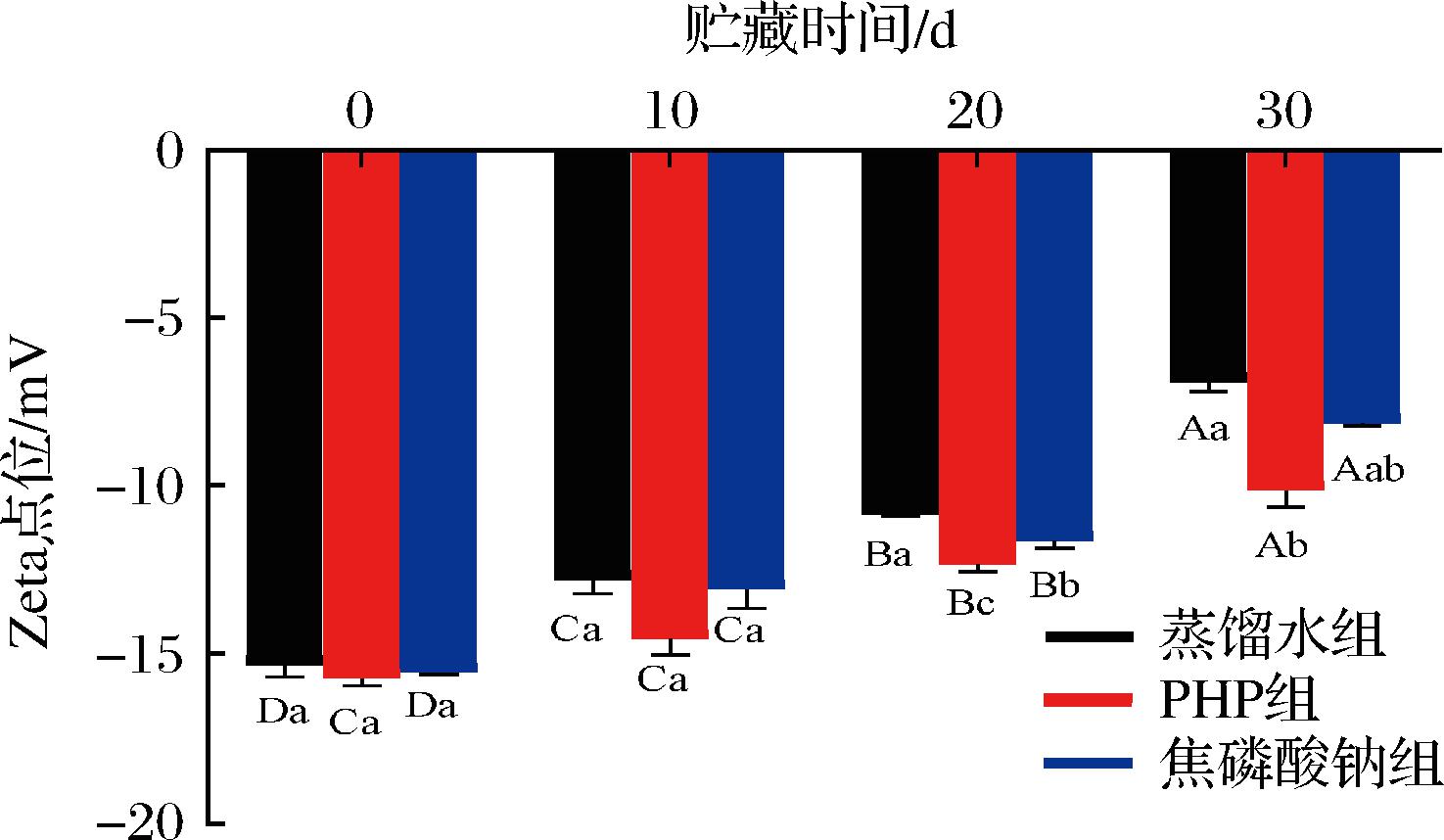
图6 PHP对微冻南美白对虾仁MP Zeta电位的影响
Fig.6 Effects of PHP on the Zeta potential of Litopenaeus vannamei MP during superchilled storage
2.6 圆二色光谱分析
α-螺旋结构的圆二色谱通常在192 nm处有1正峰,在208 nm和222 nm处有2个负峰[26]。图7所示表明南美白对虾仁肌原纤维蛋白是典型的以α-螺旋为主的二级结构。与鲜虾相比,各组贮藏末期的肌原纤维蛋白的圆二色光谱特征峰强度明显减小,尤其是蒸馏水组的α-螺旋特征负峰几乎趋平,而PHP组则能很好维持α-螺旋结构。图8所示是各组贮藏期内的蛋白二级结构相对含量变化,所有MP样品的二级结构性能均有所下降,α-螺旋大幅下降,β-折叠和β-转角略有增加,无规卷曲增加明显。与初始值相比,蒸馏水、PHP和焦磷酸钠处理组贮藏末期的α-螺旋结构相对含量比初始值分别下降了50.81%、15.96%和22.99%,说明PHP浸泡处理有利于维持微冻南美白对虾仁肌原纤维蛋白二级结构的稳定性。α-螺旋结构的下降说明疏水残基的暴露导致了肌球蛋白杆部的变化。此外,二硫键的形成也可能是肌球蛋白杆部氧化的关键原因,从而导致二级结构变化。PHP可能通过与α-螺旋形成复合物来防止肌球蛋白损伤,或者在蛋白质分子的功能位点上相互作用,阻碍了蛋白质与自由水分子的相互作用,因此对冰晶诱导的蛋白质变性有抑制作用,从而增加MP的结构稳定性。这与WALAYAT等[27]报道的低聚葡甘聚糖可提高鲢鱼鱼糜在波动冷冻期间α-螺旋含量稳定性的结果类似。
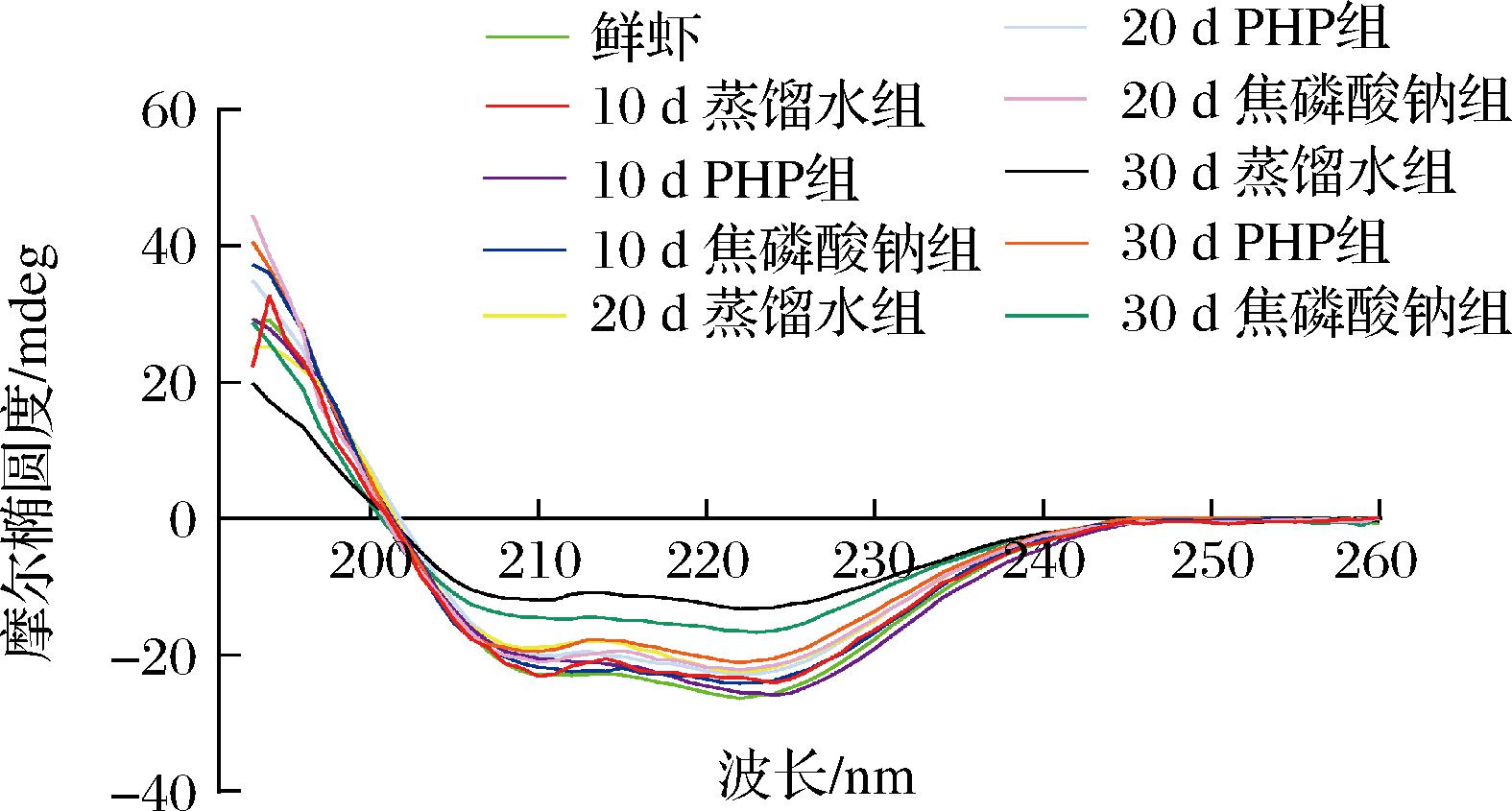
图7 PHP对微冻南美白对虾仁MP 圆二色光谱的影响
Fig.7 Effects of PHP on the circular dichroism spectra of Litopenaeus vannamei MP during superchilled storage
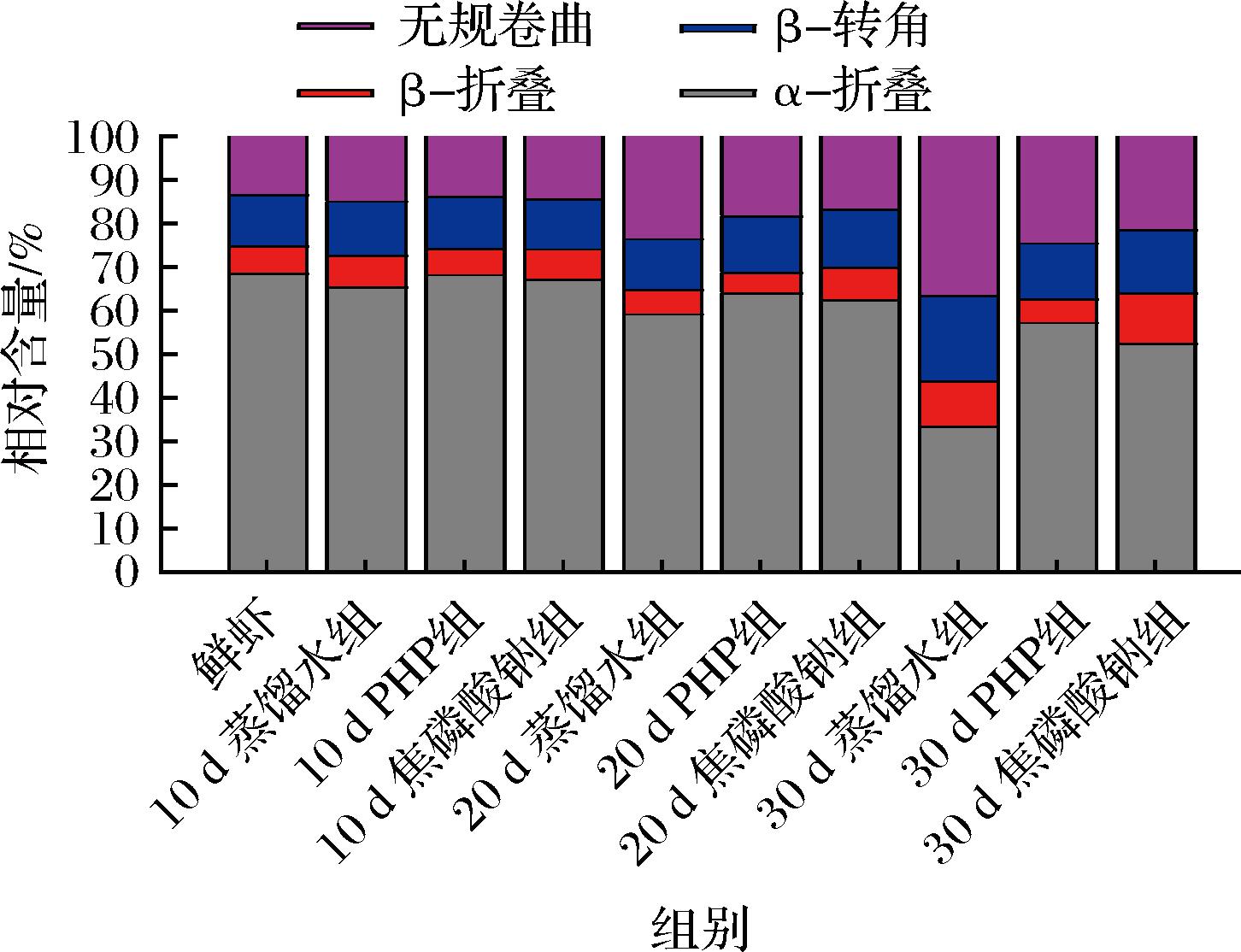
图8 PHP对微冻南美白对虾仁MP二级结构的影响
Fig.8 Effects of PHP on the secondary structural properties of Litopenaeus vannamei MP during superchilled storage
2.7 内源荧光光谱分析
蛋白质中的色氨酸残基能发射荧光,主要位于折叠状态的蛋白质内部疏水环境中,因此荧光光谱可以监测蛋白质中氨基酸残基及其微环境的变化[28]。各处理组MP内源荧光强度的变化如图9所示,虾仁经不同浸泡处理微冻贮藏后各组MP内源荧光强度随时间推移有不同程度的降低趋势。这可能是由于虾在微冻贮藏过程中水的结晶和再结晶所致的机械损伤以及蛋白氧化变性使MP结构逐渐展开,色氨酸残基暴露引起内源荧光强度降低。相比鲜虾,各处理组最大荧光峰位置出现了红移现象,说明MP分子内部极性变高,埋藏在蛋白质内部的疏水氨基酸逐渐暴露在分子表面使MP的表面疏水性增加[1]。PHP处理组的内源荧光强度变化最小,说明PHP浸泡处理有利于维持微冻南美白对虾仁MP三级结构的稳定性,与前文圆二色光谱分析得出的PHP能维持MP结构稳定结论保持一致。与ZHENG等[29]发现金针菇多糖处理冻融大黄鱼背肌可抑制其MP荧光强度降低的结果一致。
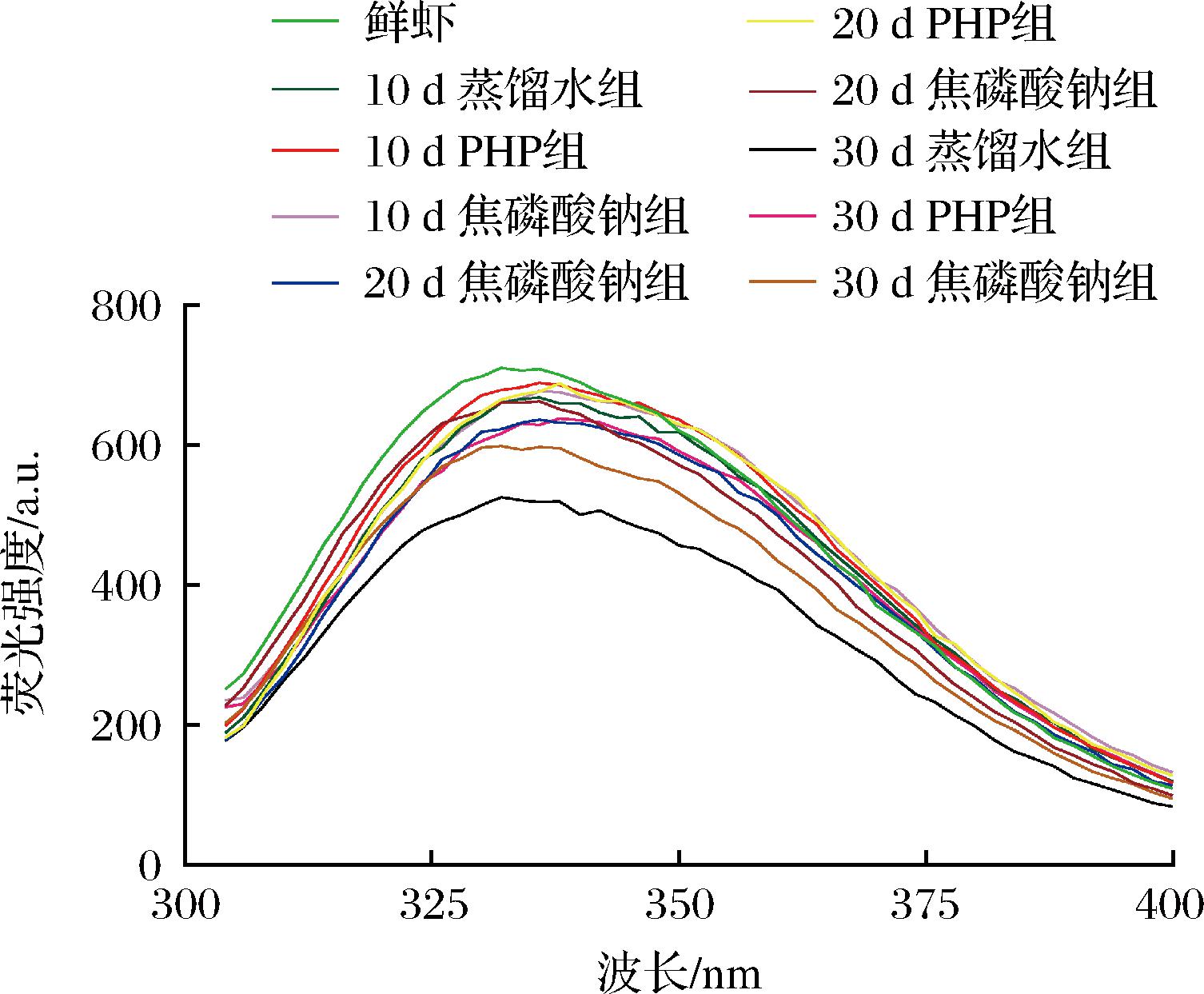
图9 PHP对微冻南美白对虾仁MP荧光光谱的影响
Fig.9 Effects of PHP on the fluorescence spectra of Litopenaeus vannamei MP during superchilled storage
2.8 扫描电镜分析
扫描电镜可用于观察虾肌肉组织微观结构的变化,虾仁微冻贮藏期间微观结构见图10。由图10可知,新鲜样品肌肉纤维结构彼此紧密相连,结构完整,成规则平行排列的束状。随着贮藏时间的延长,肌肉结构由致密逐渐散开,肌纤维因受冰晶挤压断裂,空隙增加,持水性下降。各处理组的样品组织微观结构外观有显著差异。蒸馏水处理的样品在微冻贮藏期间肌肉纤维逐渐收缩,水分流失,纤维断裂逐渐严重,且有片状化现象,结构被氧化破坏,肌肉失去了保水能力。另外,纤维结构有较多空隙,可能是由于冰晶形成的空隙。而PHP浸泡处理的样品,尽管其结构组织不如新鲜样品好,但纤维组织仅有较小的变化,肌肉纤维明显比其他两组结构更紧密完整,成束状平行排列更规则,无明显空隙,PHP组肌肉纤维断裂扭曲和片状化现象要明显少于蒸馏水组和焦磷酸钠组。结果表明,PHP组的肌肉结构受氧化的影响不大,说明PHP浸泡有利于维持微冻虾仁的肌肉结构稳定性和完整性。这可能是由于PHP可在虾仁表面形成糖膜而对肌肉组织具有保护和保水作用,此外PHP还可能通过抑制冰晶的形成而减小肌肉组织的机械损伤,从而维持虾肉组织的微观结构稳定性。这与武天昕[5]发现琼胶寡糖能有效地抑制冰晶的生长,维持冻藏南美白对虾仁微观结构的完整性结果一致。

X-新鲜虾仁;S-蒸馏水组;P-PHP组;J-焦磷酸钠组
图10 不同浸泡处理微冻南美白对虾仁扫描电镜图
Fig.10 Scanning electron microscopy of Litopenaeus vannamei with different soaking methods during superchilled storage
注:0~20 d:1 000×; 30 d:300×。
3 结论
通过研究PHP浸泡的南美白对虾仁在微冻过程中MP氧化和结构特性的变化,从蛋白质维度揭示了PHP抗冻保鲜机制。PHP浸泡处理虾仁能显著延缓MP总巯基含量的下降,有效抑制羰基含量生成和表面疏水性的增加。另外,PHP可能通过抑制冰晶的形成和抗氧化等作用,降低了MP的冷冻变性和聚集。由MP在贮藏期间的粒径分布、平均粒径和Zeta电位结果分析得出PHP处理后虾肉蛋白稳定性较空白组强,有效防止蛋白质聚集。蛋白结构分析表明,PHP有利于维持MP的α-螺旋结构,阻碍色氨酸荧光猝灭和MP空间结构展开,从而保持MP结构特性的稳定。扫描电镜结果证实PHP可抑制冰晶形成,防止肌原纤维扭曲断裂,维持肌肉组织微观结构完整性。综上,PHP可有效控制MP氧化和聚集并有利于蛋白空间结构和肌肉组织微观结构的稳定性,且效果优于焦磷酸钠。
[1] 杨肖杰,黄卉,李来好,等.预处理对南美白对虾剥壳效果和肌原纤维蛋白的影响[J].食品科学,2022,43(15):28-35.
YANG X J,HUANG H,LI L H,et al.Effect of pretreatment on the peeling and myofibrillar protein of pacific white shrimps[J].Food Science,2022,43(15):28-35.
[2] PAN C,SUN K T,YANG X Q,et al.Insights on Litopenaeus vannamei quality deterioration during partial freezing storage from combining traditional quality studies and label-free based proteomic analysis[J].Journal of Food Composition and Analysis,2022,112:104655.
[3] 李慧,包海蓉.天然多糖保鲜剂在水产品冷藏中的保鲜机理及应用形式[J].食品与发酵工业,2021,47(10):271-277.
LI H,BAO H R.Mechanism and application of natural polysaccharide preservatives in aquatic products refrigeration[J].Food and Fermentation Industries,2021,47(10):271-277.
[4] 谢晨,熊泽语,李慧,等.金针菇多糖对微冻大黄鱼及其鱼片品质变化的影响[J].食品科学,2021,42(13):215-222.
XIE C,XIONG Z Y,LI H,et al.Effect of polysaccharide from Flammulina velutipes on the quality of whole fish and fillets of large yellow croaker (Pseudosciaena crocea) during superchilled storage[J].Food Science,2021,42(13):215-222.
[5] 武天昕.琼胶寡糖对冻藏南美白对虾的品质保障作用及影响机制[D].舟山:浙江海洋大学,2022.
WU T X.Effect and influence mechanism of jonesin oligosaccharides on quality assurance of frozen Penaeus vannamei[D].Zhoushan:Zhejiang Ocean University,2022.
[6] 吴海潇,张宾,史周荣,等.卡拉胶寡糖对冷冻南美白对虾的抗冻保水作用[J].食品科学,2017,38(7):260-265.
WU H X,ZHANG B,SHI Z R,et al.Cryoprotective effects of carrageenan oligosaccharides on pacific white shrimp (Litopenaeus vannamei) during frozen storage[J].Food Science,2017,38(7):260-265.
[7] CHIN K B,GO M Y,XIONG Y L.Konjac flour improved textural and water retention properties of transglutaminase-mediated,heat-induced porcine myofibrillar protein gel:effect of salt level and transglutaminase incubation[J].Meat Science,2009,81(3):565-572.
[8] BELICIU C M,MORARU C I.The effect of protein concentration and heat treatment temperature on micellar casein-soy protein mixtures[J].Food Hydrocolloids,2011,25(6):1448-1460.
[9] 李可,李三影,扶磊,等.低频高强度超声波对鸡胸肉肌原纤维蛋白性质的影响[J].食品科学,2020,41(23):122-129.
LI K,LI S Y,FU L,et al.Effect of low-frequency and high-intensity ultrasound treatment on characteristics of chicken breast myofibrillar protein[J].Food Science,2020,41(23):122-129.
[10] SHI J,ZHANG L T,LU H,et al.Protein and lipid changes of mud shrimp (Solenocera melantho) during frozen storage:Chemical properties and their prediction[J].International Journal of Food Properties,2017:1-14.
[11] 颜龙杰,沈建东,张凌晶,等.凡纳滨对虾组织蛋白酶L性质分析及其对肌肉蛋白的降解[J].食品科学,2017,38(22):34-40.
YAN L J,SHEN J D,ZHANG L J,et al.Characterization of cathepsin L from Litopenaeus vannamei and its effect on muscular protein degradation[J].Food Science,2017,38(22):34-40.
[12] ZHANG B,FANG C D,HAO G J,et al.Effect of kappa-carrageenan oligosaccharides on myofibrillar protein oxidation in peeled shrimp (Litopenaeus vannamei) during long-term frozen storage[J].Food Chemistry,2018,245:254-261.
[13] 袁悦.新型冷冻罗非鱼鱼糜抗冻剂的筛选与作用机理研究[D].上海:上海海洋大学,2019.
YUAN Y.A novel cryoprotectants selection and its mechanism study of cryoprotectants for frozen nile tilapia (Oreochromis niloticus) surimi[D].Shanghai:Shanghai Ocean University,2019.
[14] GAO W H,HUANG Y P,ZENG X N,et al.Effect of soluble soybean polysaccharides on freeze-denaturation and structure of myofibrillar protein of bighead carp surimi with liquid nitrogen freezing[J].International Journal of Biological Macromolecules,2019,135:839-844.
[15] LI F F,DU X,REN Y M,et al.Impact of ice structuring protein on myofibrillar protein aggregation behaviour and structural property of quick-frozen patty during frozen storage[J].International Journal of Biological Macromolecules,2021,178:136-142.
[16] 张进伟,胡晓,陈胜军,等.腌制风干过程中卵形鲳鲹鱼肉性质、蛋白质氧化及游离氨基酸的变化[J].食品科学,2022,43(18):272-278.
ZHANG J W,HU X,CHEN S J,et al.Changes in physicochemical properties,protein oxidation and free amino acids of Trachinotus ovatus during curing and air-drying[J].Food Science,2022,43(18):272-278.
[17] 相悦,孙承锋,李来好,等.琼胶寡糖及EGCG对冰藏花鲈鱼片新鲜度与蛋白质生化特性的影响[J].水产学报,2021,45(7):1007-1020.
XIANG Y,SUN C F,LI L H,et al.Effects of agar-oligosaccharides and EGCG on the freshness and protein biochemical change of sea bass (Lateolabrax japonicus) fillets during ice storage[J].Journal of Fisheries of China,2021,45(7):1007-1020.
[18] 谢晶,程浩.冻藏水产品蛋白质变化与控制措施研究进展[J].上海海洋大学学报,2021,30(5):905-912.
XIE J,CHENG H.Effect of frozen storage on the myofibrillar protein of aquatic products[J].Journal of Shanghai Ocean University,2021,30(5):905-912.
[19] WALAYAT N,TANG W,WANG X P,et al.Effective role of konjac oligosaccharide against oxidative changes in silver carp proteins during fluctuated frozen storage[J].Food Hydrocolloids,2022,131:107761.
[20] 熊杰,伯朝英,常海军.甘草提取物对冷藏鸡肉糜脂肪和蛋白质氧化及品质特性的影响[J].食品工业科技,2021,42(1):75-81;88.
XIONG J,BO Z Y,CHANG H J.Effects of licorice extract on oxidation and quality characteristics of fat and protein in refrigerated chicken meat batter[J].Science and Technology of Food Industry,2021,42(1):75-81;88.
[21] LU H,ZHANG L T,LI Q Z,et al.Comparison of gel properties and biochemical characteristics of myofibrillar protein from bighead carp (Aristichthys nobilis) affected by frozen storage and a hydroxyl radical-generation oxidizing system[J].Food Chemistry,2017,223:96-103.
[22] 蔡路昀,许晴,曹爱玲.不同超声辅助解冻方式对海鲈鱼肌原纤维蛋白的影响[J].食品与发酵工业,2020,46(20):1-8.
CAI L Y,XU Q,CAO A L.Effects of different ultrasound-assisted thawing methods on the myofibrillar protein of the sea bass (Perca fluviatilis)[J].Food and Fermentation Industries,2020,46(20):1-8.
[23] 陈旭,余璐涵,蔡茜茜,等.低温冷链贮藏对鱼糜凝胶化学作用力和肌原纤维蛋白结构及功能特性的影响[J].食品科学,2022,43(23):194-201.
CHEN X,YU L H,CAI X X,et al.Effect of cold chain storage on chemical interactions of surimi gel and structural and functional properties of myofibrillar protein[J].Food Science,2022,43(23):194-201.
[24] LI J,FENG R N,SHEN J D,et al.Influence of sodium chloride and sodium pyrophosphate on the physicochemical and gelling properties of silver carp myofibrillar proteins sol subjected to freeze-thaw cycles[J].LWT,2022,170:114055.
[25] GAO T X,ZHAO X,LI R,et al.Synergistic effects of polysaccharide addition-ultrasound treatment on the emulsified properties of low-salt myofibrillar protein[J].Food Hydrocolloids,2022,123:107143.
[26] 邓思杨,王博,李海静,等.冻融次数对镜鲤鱼肌原纤维蛋白功能和结构特性变化的影响[J].食品科学,2019,40(11):95-101.
DENG S Y,WANG B,LI H J,et al.Effect of freeze-thaw cycles on changes in functional and structural properties of myofibrillar protein from mirror carp (Cyprinus carpio var.specularis)[J].Food Science,2019,40(11):95-101.
[27] WALAYAT N,TANG W,NAWAZ A,et al.Influence of konjac oligo-glucomannan as cryoprotectant on physicochemical and structural properties of silver carp surimi during fluctuated frozen storage[J].LWT,2022,164:113641.
[28] 常海霞,石燕,王辉,等.超声波对草鱼肌肉肌原纤维蛋白溶液理化特性的影响[J].食品科学,2015,36(5):56-60.
CHANG H X,SHI Y,WANG H,et al.Effect of ultrasonic treatment on physico-chemical properties of myofibrillar protein from grass carp[J].Food Science,2015,36(5):56-60.
[29] ZHENG Y,SHI Y Z,YANG X,et al.Flammulina velutipes polysaccharide improves the water-holding capacity in the dorsal muscle of freeze-thawed cultured large yellow croaker (Larimichthys crocea)[J].Food Chemistry,2023,403:134401.