牡丹籽为毛茛科、芍药属多年生落叶灌木牡丹(Paeonia suffruticosa Andr)的成熟种子,分为牡丹籽仁和牡丹籽壳两部分[1]。牡丹籽仁中可提取牡丹籽油,剩余物牡丹籽粕中还能够提取出蛋白质、黄酮等活性物质[2]。牡丹籽壳中也含有许多活性物质,如黄酮、茋类化合物、黑色素[3-5]等,李婉仪等[6]利用超声辅助提取出了黄酮化合物,发现其抗氧化活性与维生素C相当。短叶松素是黄酮类化合物的一种,具有抗氧化、抑菌等能力,BANG等[7]从蜂胶中分离出短叶松素并明确其抗血栓能力;JIA等[8]从新鲜杨桃检测出短叶松素。
大孔树脂是一种有机高聚吸附剂,具有吸附量大、选择性强、操作简便和成本低等特点,因此常常用于黄酮类化合物的分离纯化研究[9-10]。让凤菊等[11]利用AB-8大孔树脂分离纯化伊犁野核桃叶总黄酮,工艺优化后总黄酮回收率可达71.37%,纯度为79.58%。C18球形硅胶作为基质具有较高的机械强度、良好的物化性质,并且不受有机溶剂的影响,稳定性好[12]。利用其反相键合的特点,针对目标物的极性调整流动相的极性[13],这比传统的硅胶柱操作更简便,分离效果更好。
该研究将以牡丹籽壳粗黄酮(Mu Dan Ke Flavonoids,MDKF)的吸附和解析效果为指标,考察大孔树脂对牡丹籽壳黄酮的吸附和解析性能,筛选出最佳纯化工艺条件。用C18柱进行二次分离出短叶松素,并以清除DPPH自由基、羟自由基的能力为指标,借助分子对接实验短叶松素与超氧化物歧化酶(super oxide dimutese,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的结合能力预测短叶松素抗氧化机制,为牡丹籽壳资源开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
牡丹籽壳,江苏国色天香油用牡丹科技发展有限公司;1,10-菲啰啉、三(羟甲基)氨基甲烷(Tris)、磷酸二氢钾(分析纯),国药集团化学试剂有限公司;抗坏血酸(维生素C)、DPPH、氯化硝基四氮唑蓝、还原性辅酶(分析纯),阿拉丁试剂(上海)有限公司;S-8大孔树脂,东鸿化工有限公司;C18球形硅胶柱,常州三泰科技有限公司。
1.2 仪器与设备
SHB-ⅢA环水式真空泵,上海聚昆仪器设备有限公司;UV-3600紫外可见近红外分光光度计,岛津企业管理(中国)有限公司;Tissuelyser-48高通量组织破碎仪,上海净信实业发展有限公司;Q Exactive质谱仪、Reacti-thermo氮气吹扫仪,美国Thermo公司;Acquity高效液相色谱仪,美国Waters公司;XH-T漩涡混合器,新宝仪器有限公司。
1.3 实验方法
1.3.1 实验流程
实验流程如图1所示。

图1 实验流程图
Fig.1 Experimental flowchart
1.3.2 牡丹籽壳黄酮粗提物的制备与黄酮浓度的测定
称取牡丹籽壳粉末200 g,在70 ℃水浴中用70%(体积分数)乙醇回流提取2次,第一次料液比为1∶25(g∶mL),第二次料液比为1∶10(g∶mL),抽滤得到MDKF提取液,旋蒸浓缩,冷冻干燥后得到MDKF粗提物粉末。标准曲线的建立及黄酮浓度的测定方法参照文献[14]。
1.3.3 大孔树脂和C18柱预处理
根据文献[15]所述的方法将AB-8、S-8、DM301、HPD600、HPD100和D101大孔树脂用95%(体积分数)乙醇浸泡24 h,过滤后反复用去离子水冲洗至无乙醇味;接着用5%(质量分数)NaOH浸泡24 h,去离子水冲洗至中性后用5%(体积分数)HCl浸泡24 h,去离子水冲洗至中性后60 ℃烘干备用。采用乙醇湿法装柱后继续用95%乙醇淋洗至流出液与水1∶5(体积比)混合无白色浑浊,用大量去离子水淋洗至无乙醇味后即可上样。C18柱上样前用60 mL起始流动相润洗激活柱体。
表1 六种不同大孔树脂的性质比较
Table 1 Comparison of properties of six different macroporous resins
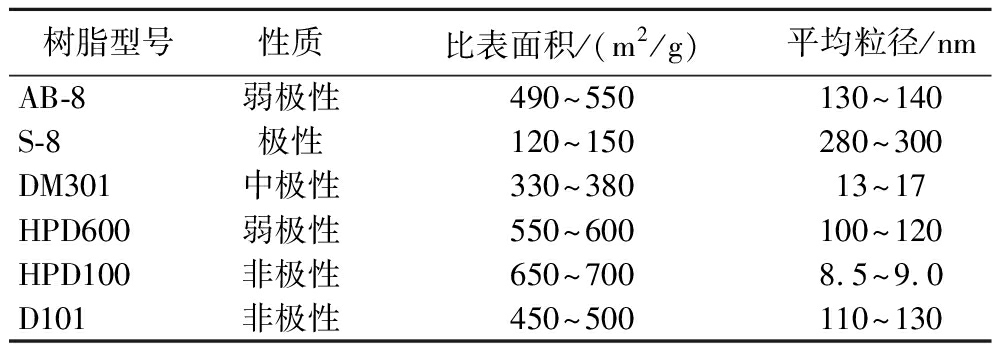
树脂型号性质比表面积/(m2/g)平均粒径/nmAB-8弱极性490~550130~140S-8极性120~150280~300DM301中极性330~38013~17HPD600弱极性550~600100~120HPD100非极性650~7008.5~9.0D101非极性450~500110~130
1.3.4 大孔树脂的筛选
称取经过预处理的AB-8、S-8、DM301、HPD600、HPD100和D101大孔树脂5.0 g置于250 mL锥形瓶中,加入50 mL质量浓度为1.067 mg/mL MDKF粗提液,放入恒温摇床中在25 ℃、150 r/min条件下静态吸附12 h,过滤出样液,计算样液黄酮含量以及每种大孔树脂吸附率(E);将树脂转移至锥形瓶,加入50 mL 60%乙醇,置于恒温摇床中相同条件下解析7 h,计算黄酮含量及解析率(D),筛选出吸附和解析效果最好的大孔树脂进行MDKF的初步分离。吸附率E、吸附量Q和解析率D的计算如公式(1)~公式(3)所示:
(1)
(2)
(3)
式中:c0为吸附前样液黄酮质量浓度,mg/mL;c1为吸附平衡时黄酮质量浓度,mg/mL;V为提取液体积,mL;m为树脂质量,g;c2为解析平衡时黄酮质量浓度,mg/mL。
1.3.5 大孔树脂动态吸附、解析条件的确定
根据文献所述的方法稍作修改如下:称取MDKF粗提物用95%乙醇溶解配制成质量浓度为0.4、0.8、1.2、1.6、2.0、2.4 mg/mL的样液,进行湿法上样,设置上样流速为0.5、1.0、1.5、2.0、2.5、3.0 mL/min,分别计算E和Q,考察样液质量浓度和上样液流速对大孔树脂吸附率的影响;然后分别用50%、60%、70%、80%和90%乙醇水溶液进行洗脱,设置洗脱液流速为0.5、1.0、1.5、2.0、2.5、3.0 mL/min,洗脱体积为40、60、80、100、120 mL,分别计算D,考察洗脱液浓度、流速和体积对大孔树脂解析率的影响。确定大孔树脂分离实验的最佳工艺条件[16-17]。
1.3.6 C18反相键合硅胶柱层析分离
将经过大孔树脂分离后的样液冷冻干燥后95%(体积分数)甲醇溶液1 mL溶解,上C18硅胶层析柱(SW-5223-012-SP,40~60 mm,120 Å,20 g),用50 mL 55%(体积分数)乙腈-水溶液进行梯度洗脱,收集各流出部分,经旋蒸浓缩、冷冻干燥得到MDKF纯化物粉末。
1.3.7 抗氧化能力分析
DPPH自由基清除能力参照文献[18]所述方法测定;
羟自由基清除能力参照文献[19]所述方法测定。
1.3.8 牡丹籽壳黄酮化合物组分分析
1.3.8.1 色谱条件
仪器采用Thermo Vanquish,使用ACQUITY UPLC® BEH C18 1.7 mm(2.1 mm×100 mm)色谱柱,自动进样器温度设为8 ℃,以0.25 mL/min的流速,40 ℃的柱温,进样2 mL进行梯度洗脱,流动相为0.1%甲酸水(A2)-0.1%甲酸乙腈(B2)。梯度洗脱程序为0~1 min,20% B2;1~9 min,20%~50% B2;9~12 min,50%~98% B2;12~13.5 min,98% B2;13.5~14 min,98%~20% B2;14~17 min,20% B2。紫外检测波长扫描范围为200~400 nm。
1.3.8.2 质谱条件
仪器使用Thermo Q Exactive,电喷雾离子源,正负离子电离模式,正离子喷雾电压为3.50 kV,负离子喷雾电压为2.50 kV,鞘气30,辅助气10。毛细管温度325 ℃,以分辨率70 000进行全扫描,扫描范围150~1 000,并采用HCD进行二级裂解,碰撞电压为10、50、60 eV,同时采用动态排除去除无必要的MS/MS信息。
1.3.9 分子对接
PDB数据库下载SOD(PDB ID:1E9O)、CAT(PDB ID;3QJ4)、POD(PDB ID;1M9Q)、GPX(PDB ID;6ELW)。使用Pymol 2.3.0去除蛋白结晶水、原始配体等,将蛋白结构导入AutoDocktools(v1.5.6)进行加氢、计算电荷、分配电荷、指定原子类型并保存为“pdbqt”格式。使用POCASA 1.1预测蛋白结合位点,采用AutoDock Vina1.1.2进行对接,SOD相关参数[20]设置为:center_x=16.3,center_y=28.4,center_z=74.9;搜索空间:size_x:50,size_y:50,size_z:50(每个格点的间距为0.375Å),exhaustiveness:10,其余参数为默认设置。
1.4 数据处理
试验重复3次,数据采用Origin 9.0进行分析处理,分子对接部分采用Pymol 2.3.0进行处理。
2 结果与分析
2.1 大孔树脂的筛选
根据所述的方法获得线性回归方程为y=0.027 9x+0.016 6,R2=0.995 97,黄酮溶液在0~50 mg/mL具有良好的线性关系。此时的MDKF得率最高,为(10.54±0.13)%。
如图2所示,吸附效果最好的为S-8,吸附率达到83.47%,最差的HPD100吸附率为52.8%;解析效果最好的为S-8,解析率为84.46%,最差的HPD600解析率为69.89%。综合吸附和解析情况选择S-8大孔树脂作为初步分离柱层析填料。

图2 不同大孔树脂对MDKF静态吸附和解析效果比较
Fig.2 Comparison of static adsorption and analysis effects of different macroporous resins on MDKF
2.2 大孔树脂动态吸附、解析条件的确定
2.2.1 样液质量浓度对大孔树脂吸附能力的影响
如图3所示,当MDKF样液质量浓度从0.4 mg/mL上升到2.4 mg/mL时,吸附量逐渐增大,而吸附率呈下降趋势。当样液质量浓度为0.4 mg/mL时,S-8大孔树脂吸附率最打为83.65%,但吸附量只有5.12 mg/g,树脂的吸附能力并没有得到充分利用;当样液质量浓度为2.4 mg/mL时,此时S-8大孔树脂吸附量最大为13.19 mg/g,但吸附率却只有51.98%最低,这说明大量的黄酮化合物没有被吸附,会造成大量的浪费。只有当样液质量浓度为1.6 mg/mL时大孔树脂的吸附率和吸附量均在中等适宜的水平,因此固定上样液质量浓度为1.6 mg/mL。

图3 样液质量浓度对大孔树脂吸附能力的影响
Fig.3 Effect of mass concentration on adsorption capacity of macroporous resin
2.2.2 上样液流速对大孔树脂吸附能力的影响
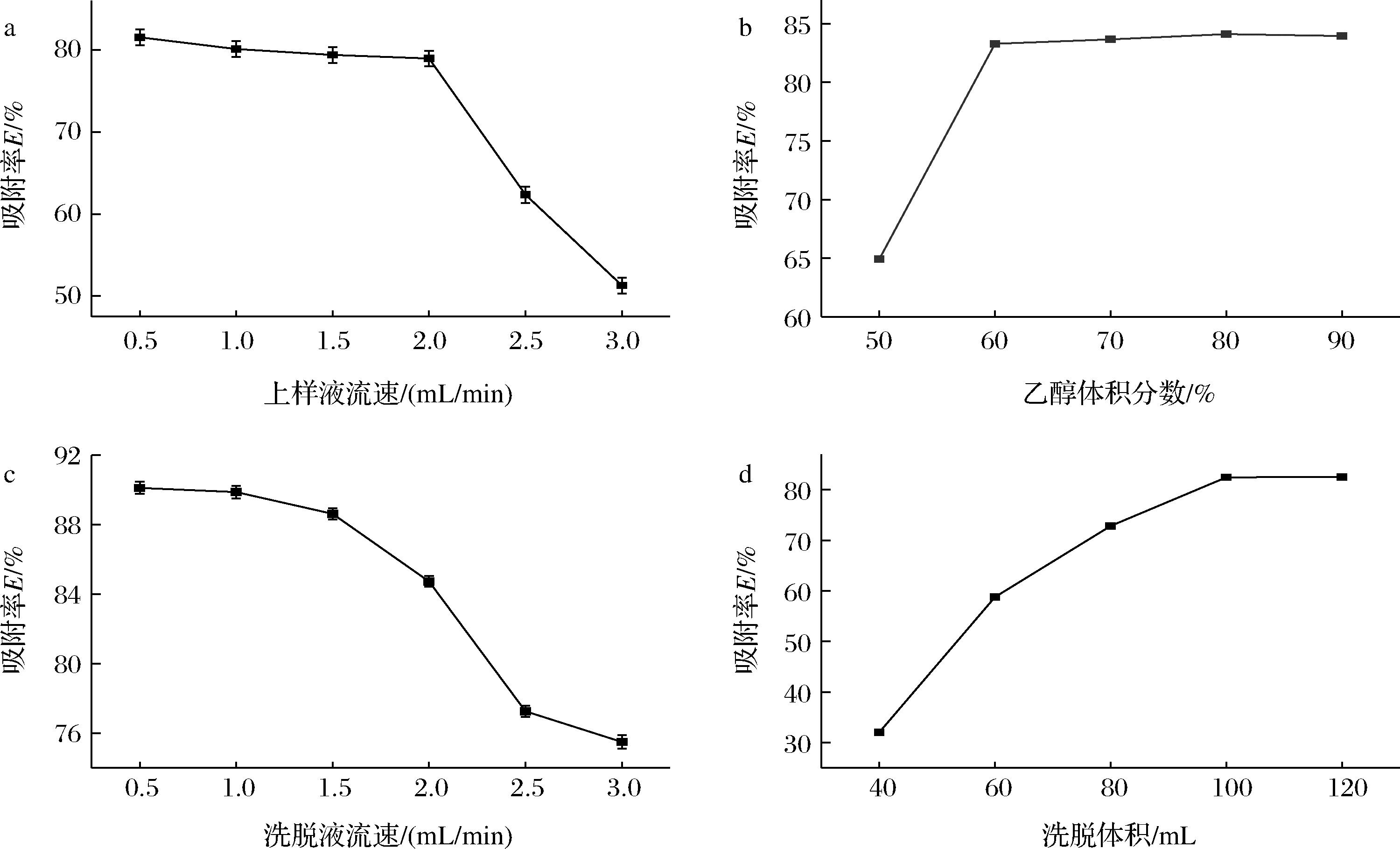
如图4-a所示为不同上样液流速对S-8大孔树脂吸附率的影响,可见随着样液流速的增加,大孔树脂的吸附率整体呈下降趋势,当样液流速为0.5~2.0 mL/min时,S-8大孔树脂的吸率变化不大,均在80%左右;当样液流速大于2.0 mL/min时,大孔树脂吸附率骤然降低,可能由于样液在大孔树脂中快速通过,导致大孔树脂没有足够的时间进行吸附[21]。综合考虑S-8大孔树脂的性能和实验效率,固定上样液的流速为2.0 mL/min。
a-上样液流速;b-洗脱剂体积分数;c-洗脱液流速;d-洗脱液体积
图4 大孔树脂动态吸附和解析条件筛选
Fig.4 Dynamic adsorption and analytical conditions screening of macroporous resins
2.2.3 洗脱剂浓度对大孔树脂解析能力的影响
如图4-b所示,洗脱剂乙醇的浓度对S-8大孔树脂解析能力的影响,总的来看解析率随着乙醇体积分数的增加呈现上升趋势。而当乙醇体积分数大于60%以后,S-8大孔树脂的解析率的变化趋势变得平缓,说明此时S-8大孔树脂的解析能力已经得到充分发挥[22]。为了节省试剂和提高实验效率,固定洗脱剂乙醇的体积分数为60%。
2.2.4 洗脱液流速对大孔树脂解析能力的影响
如图4-c所示,随着洗脱液流速增大,S-8大孔树脂的解析率逐渐减小。当洗脱液流速为0.5~1.5 mL/min时,解析率的下降趋势较平缓,说明在此区间内S-8大孔树脂的解析率受流速影响不大;当洗脱液流速大于1.5 mL/min时,解析率骤然减小,这可能由于洗脱剂与被洗脱成份没有充分接触,导致部分黄酮化合物无法洗脱下来,这将大大降低分离效率[23]。综上固定1.5 mL/min为洗脱液流速最佳条件。
2.2.5 洗脱液体积对大孔树脂解析能力的影响
为了提高分离效率,考察洗脱液乙醇的体积对S-8大孔树脂动态解析的影响。如图4-d所示,随着洗脱液体积的增加,S-8大孔树脂的解析率也逐渐增加,当洗脱体积大于100 mL时解析率为82.46%,并趋于平衡。因此固定洗脱液体积为100 mL为最佳条件。
2.2.6 S-8大孔树脂分离
按照筛选的S-8大孔树脂最佳条件进行上样分离;上样液质量浓度1.6 mg/mL,上样液流速2.0 mL/min,洗脱剂乙醇体积分数60%,洗脱液流速1.5 mL/min,洗脱液体积100 mL。由图5可知,经过S-8大孔树脂初步分离后的组分相较于MDKF分离度得到改善。
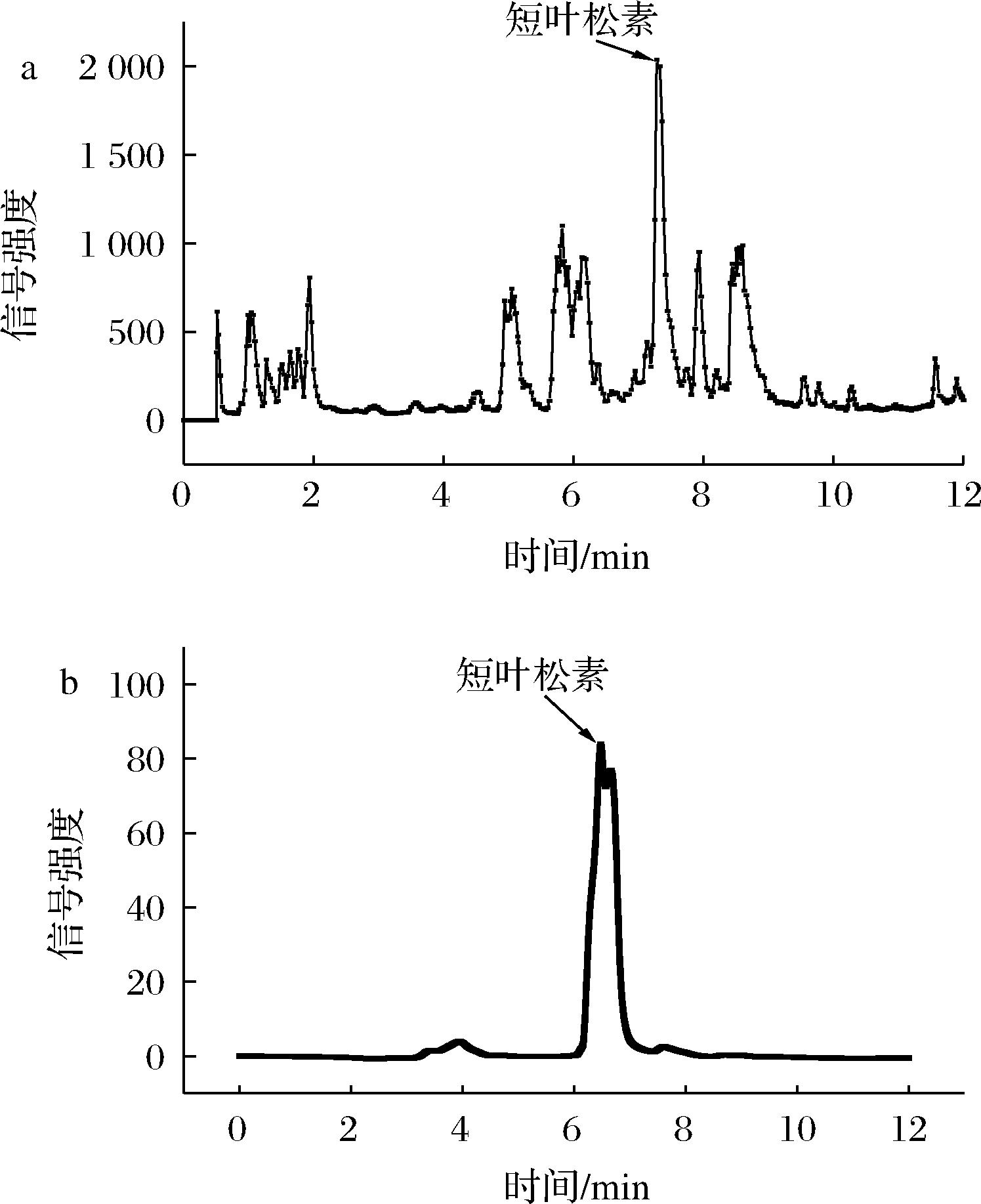
a-MDKF液相;b-S-8大孔树脂分离液相
图5 MDKF液相图与S-8大孔树脂分离液相图
Fig.5 Liquid phase diagram of separation of MDKF and S-8 macroporous resin
2.3 C18硅胶柱分离
将经S-8大孔树脂分离过的MDKF利用C18硅胶柱进行二次分离。如图6所示为分离后F55的液相图,F55组分可见一个峰强高于225的强峰,且峰形单一,可能为某种或某一类黄酮化合物,经质谱检测且与标品对比(图6-b)分析后确定为短叶松素。短叶松素为黄酮化合物的一种(图6-c),其分子式为C15H12O5,分子质量为272.25 Da,保留时间为6.82 min。通过分析3个不同阶段的短叶松素含量,发现经S-8大孔树脂-C18柱联用的短叶松素含量为(98.33±0.64)%,较MDKF中的(25.42±2.51)%有较明显提升,说明分离效果显著。
表2 短叶松素的得率对比
Table 2 Comparison of the yield of pinobanksin
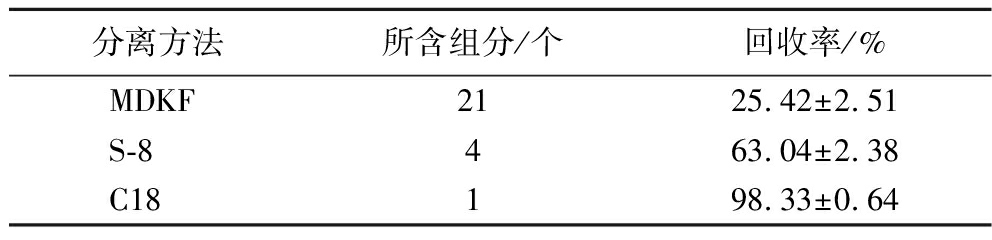
分离方法所含组分/个回收率/%MDKF2125.42±2.51S-8463.04±2.38C18198.33±0.64

a-F55组分液相图;b-短叶松素质谱对比图;c-短叶松素分子结构
图6 C18柱分离短叶松素及质谱图
Fig.6 C18 column separation and mass spectrum of pinobanksin
2.4 牡丹籽壳黄酮化合物抗氧化能力分析
如图7所示为MDKF对DPPH自由基(图7-a)和羟自由基(图7-b)清除率曲线图,分别测定了MDKF粗提物、S-8大孔树脂纯化物、C18纯化物的抗氧化能力。由图7可得出,4个组分的抗氧化能力均随着浓度的升高而提高,最后趋于平衡;综合抗氧化能力:C18纯化物>S-8大孔树脂纯化物>MDKF粗提物,短叶松素纯度越高,抗氧化能力越强,这是因为黄酮化合物种类繁多且结构相似,各个酚羟基之间会形成作用力从而影响其抗氧化能力。

a-DPPH自由基清除率;b-羟自由基清除率
图7 MDKF抗氧化能力分析
Fig.7 Analysis of antioxidant activity of MDKF
2.5 分子对接
短叶松素是黄酮化合物的一种,经抗氧化能力测试后发现具有较强的抗氧化能力。生物体内的抗氧化能力多为具有抗氧化能力的小分子化合物与SOD、CAT、POD、GPX结合后发挥作用,为明确短叶松素的抗氧化能力,采用分子对接的方法,将短叶松素分别与SOD、CAT、POD、GPX进行分子对接。(黄色线表示氢键作用,灰色虚线表示疏水作用。)由图8可知,短松叶素与SOD的HIS-163、ASN-30、LYS-29形成氢键,与LYS-29、ALA-33形成疏水作用;短松叶素与SOD的HIS-163、ASN-30、LYS-29形成氢键,与LYS-29、ALA-33形成疏水作用,结合能为-6.3 kcal/mol;短松叶素与CAT的THR-160、THR-12、MET-11、ARG-42、MET-43形成氢键,与ARG-42、MET-43形成疏水作用,结合能为-9.1 kcal/mol;短松叶素与POD的MET-358形成氢键,与PRO-334、VAL-336形成疏水作用,结合能为-8.5 kcal/mol;短松叶素与GPX的GLY-154、ILE-129形成氢键,与ILE-129、LYS-135形成疏水作用,结合能为-6.7 kcal/mol。由此可见,短叶松素与CAT的预测结合能力最强,猜测与CAT结合使其发挥抗氧化能力。
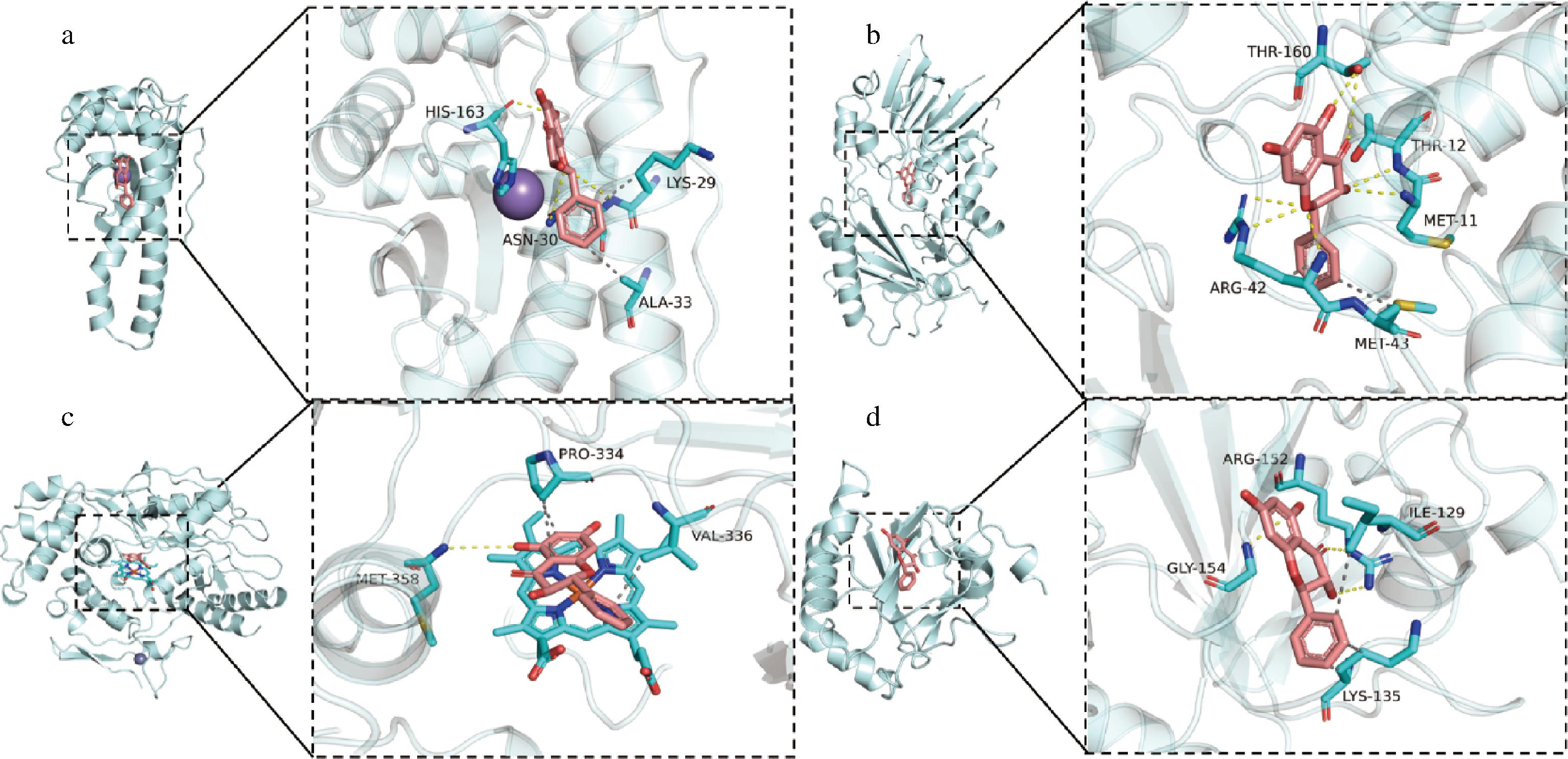
a-SOD;b-CAT;c-POD;d-GPX
图8 短松叶素分子对接
Fig.8 Molecular docking of pinobanksin
3 结论
该研究以牡丹籽壳为原料,利用大孔树脂和C18硅胶柱联合分离MDKF中的短叶松素,LC-MS对分离后的组分进行鉴定,同时测定分离前后黄酮化合物的抗氧化能力,并以清除DPPH自由基、羟自由基的能力为指标,借助分子对接实验短叶松素与SOD、CAT、POD、GPX的结合能力预测短叶松素的抗氧化机制,为牡丹籽壳资源开发利用提供理论依据。
[1] 王高潮,刘仲健.中国牡丹:培育与鉴赏及文化渊源[M].北京:中国林业出版社,2000.
WANG G C,LIU Z J.Chinese Peony:Cultivation and Appreciation and Cultural Origins[M].Beijing:China Forestry Publishing House,2000.
[2] 周逢旭,闫小满.油用牡丹的应用和研究现状及发展对策[J].山东农业工程学院学报,2018,35(6):3-4.
ZHOU F X,YAN X M.Application and research status and development countermeasures of oil peony[J].The Journal of Shandong Agriculture and Engineering University,2018,35(6):3-4.
[3] 张海丽,毕珂,陈长坤,等.牡丹籽壳黑色素应用研究[J].菏泽学院学报,2021,43(5):89-93.
ZHANG H L,BI K,CHEN C K,et al.On the application of melanin in peony seed shell[J].Journal of Heze University,2021,43(5):89-93.
[4] 吴永玲,王静怡,李俊伟,等 响应面法优化牡丹籽壳黄酮提取及抑菌活性[J].陕西农业科学,2021,67(11):57-62.
WU Y L,WANG J Y,LI J W,et al.Optimal extraction of flavonoids from peony seed husk and its antifungal activity by response surface methodology[J].Shaanxi Journal of Agricultural Sciences,2021,67(11):57-62.
[5] 刘丹丹,郑旭煦,殷钟意,等.响应面法优化超声提取牡丹籽壳低聚茋类化合物的工艺研究[J].中国油脂,2017,42(12):108-112.
LIU D D,ZHENG X X,YIN Z Y,et al.Optimization of ultrasound-assisted extraction of oligomeric stilbene compound from peony seed shell by response surface methodology[J].China Oils and Fats,2017,42(12):108-112.
[6] 李婉仪,吉文丽,李蕊,等.响应面优化牡丹籽壳总黄酮超声波提取工艺及抗氧化活性研究[J].中国油脂,2018,43(4):114-118.
LI W Y,JI W L,LI R,et al.Optimization of ultrasound extraction of total flavonoids from peony seed shell by response surface methodology and its antioxidant activity[J].China Oils and Fats,2018,43(4):114-118.
[7] BANG H J,AHN M R.Antiangiogenic effect of pinobanksin on human umbilical vein endothelial cells[J].Journal of Functional Foods,2021,79:104408.
[8] JIA X C,XIE H H,JIANG Y M,et al.Flavonoids isolated from the fresh sweet fruit of Averrhoa carambola,commonly known as star fruit[J].Phytochemistry,2018,153:156-162.
[9] TRAN T N T,TRUONG T M H,NGUYEN T D P,et al.Enrichment of soy isoflavone extracts through macroporous resin for characterization of toxicity and estrogenic activities[J].Journal of Food Science and Technology,2023,60(3):1097-1106.
[10] YAO H L,LI H H.Extraction and purification process optimization and antioxidant activity in vitro of flavonoids in Amaranthus caudatus L[J].Medicinal Plant,2020,11(4):48-53.
[11] 让凤菊,刘伟,欧阳艳.大孔树脂分离纯化伊犁野核桃叶总黄酮的工艺研究[J].伊犁师范学院学报(自然科学版),2017,11(4):62-67.
RANG F J,LIU W,OUYANG Y.Separation and purification of flavonoids from Yili hickory leaves by macroporous adsorption resin[J].Journal of Yili Normal University (Natural Science Edition),2017,11(4):62-67.
[12] 李金祥,于雪,王梦阳.硅胶颗粒担载的C18毛细管液相色谱整体柱的评价[J].鲁东大学学报(自然科学版),2016,32(1):61-65.
LI J X,YU X,WANG M Y.Silica-particle-supported C18 polymeric monolithic column forcapillary liquid chromatography[J].Journal of Ludong University (Natural Science Edition),2016,32(1):61-65.
[13] JANJIC T J,VUCKOVIC G,CELAP M B.Application of the C18 column chromatography mobile phase polarity parameter PmN to thin layer chromatography[J].Journal of the Serbian Chemical Society,1997,62(8):683-686.
[14] 张岩,曹国杰,张燕,等.黄酮类化合物的提取以及检测方法的研究进展[J].食品研究与开发,2008,29(1):154-158.
ZHANG Y,CAO G J,ZHANG Y,et al.Research on the extraction and identification of flavonoids[J].Food Research and Development,2008,29(1):154-158.
[15] ZHANG Y,WANG B Y,JIA Z,et al.Adsorption/desorption characteristics and enrichment of quercetin,luteolin and apigenin from Flos populi using macroporous resin[J].Revista Brasileira De Farmacognosia,2019,29(1):69-76.
[16] LIU H A,WANG B C,DAI C Y,et al.Optimization of preparative separation and purification of total flavonoids from Radix puerariae by macroporous resin method[J].Journal of Chinese Pharmaceutical Sciences,2006,15(2):121-126.
[17] 于智峰,王敏,张家峰.大孔树脂精制苦荞总黄酮工艺条件的优化研究[J].农业工程学报,2007,23(4):253-257.
YU Z F,WANG M,ZHANG J F.Optimization of purifying technology of tartary buckwheat total flavonoids with macroporous resin[J].Transactions of the Chinese Society of Agricultural Engineering,2007,23(4):253-257.
[18] BRAND-WILLIAMS W,CUVELIER M E,BERSET C.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[19] BANGAR S P,SANDHU K S,TRIF M,et al.The effect of mild and strong heat treatments on in vitro antioxidant properties of barley (Hordeum vulgare) cultivars[J].Food Analytical Methods,2022,15(8):2193-2201.
[20] YANG M H,CHE T,LI Z X,et al.Identification,taste properties and molecular docking of novel umami peptides from Butyriboletus roseoflavus[J].European Food Research and Technology,2022,248(11):2665-2677.
[21] 吴金义,李兴杰,陈雪松,等.大孔树脂纯化苦碟子总黄酮的工艺条件和参数[J].吉林大学学报(医学版),2011,37(5):792-796.
WU J Y,LI X J,CHEN X S,et al.Process conditions and parameters of purification of total flavonoid of China ixeris by macroporous resin[J].Journal of Jilin University (Medicine Edition),2011,37(5):792-796.
[22] 钱慧碧,辛秀兰,兰蓉,等.大孔吸附树脂分离纯化越橘果渣总黄酮的研究[J].吉林农业大学学报,2009,31(5):611-615.
QIAN H B,XIN X L,LAN R,et al.Studies on purification of total flavonoids from the Marc of blueberry by macroporous resins[J].Journal of Jilin Agricultural University,2009,31(5):611-615.
[23] 林燕如,曹迁永.大孔树脂纯化金毛狗脊叶黄酮的工艺研究[J].湖北农业科学,2011,50(3):583-586.
LIN Y R,CAO Q Y.Study on the purification of flavonoid from the leaves of Cibotium barometz(L)J.Sm.by macroporous resin[J].Hubei Agricultural Sciences,2011,50(3):583-586.