马铃薯(Solanum tuberosum L.),别名洋山芋、洋芋头、土豆等,属茄科,一年生草本植物,马铃薯具有较高的产量和营养价值,已成为继水稻、小麦、玉米后的全球第四大粮食作物。我国社会目前正处于营养健康转变的发展阶段,马铃薯主粮化是改善居民膳食营养结构的关键举措[1]。2015年,我国提出马铃薯主粮化战略,标志着我国马铃薯产业已进入跨越式发展的新阶段。2021年,我国马铃薯种植面积为545.61万 hm2,马铃薯产量为12 200万 t,种植面积和产量已达世界第一[2]。
马铃薯在采后贮藏过程中会出现失重、腐烂、发芽及生理病害等各种问题,这严重影响了马铃薯产业链的延伸和产品附加值的提升,所以高品质贮藏马铃薯一直是采后处理技术领域的研究热点。马铃薯与其他作物产品相比贮藏难度更大,因其有水分含量大、代谢旺盛的特点,贮藏温度过高极易出现失水、腐烂、发芽、营养物质消耗过快、品质劣变迅速等现象[3];而温度过低则会引起马铃薯块茎淀粉向可溶性糖转化,发生“低温糖化”现象,也容易引起块茎生理代谢失调和腐烂发生,因此适宜的贮藏温度是维持马铃薯采后贮藏品质的关键。研究发现,果蔬采后贮藏品质与能量代谢也密切相关,能量代谢是维持植物生理活动的重要代谢途径,王静等[4]认为能量亏缺会导致果蔬采后组织衰老,表现为呼吸代谢异常、活性氧代谢失调、细胞膜系统伤害等。目前我国对马铃薯的研究仍以采后生理、品质变化为主[5],对贮藏期间马铃薯能量代谢与贮藏品质的相关性研究较少。本文研究比较了不同贮藏温度下马铃薯生理、品质变化与能量代谢相关酶及产物的内在联系,以期从能量代谢的角度出发揭示马铃薯品质劣变规律,为马铃薯采后贮藏技术的提升提供理论支撑。
1 材料与方法
1.1 材料与试剂
试验用“青薯9号”马铃薯采自山西农业大学(山西省农科院)高寒区作物研究所毛皂试验基地,于13~18 ℃避光通风条件下愈伤10 d,随后选择成熟度一致、大小形状基本均一、无病虫害、无机械伤、无裂皮、不发青的块茎。
三羟甲基氨基甲烷[Tris(hydroxymethyl)aminomethane,Tris]、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、无机磷试剂盒、琥珀酸脱氢酶(succinate dehydrogenase,SDH)试剂盒、考马斯亮蓝、牛血清蛋白、细胞色素C氧化酶(cytochrome C oxidase,CCO),北京索莱宝公司;硫酸镁(Mg2SO4)、氯化钾(KCl)、硝酸钠(NaNO3)、硝酸钾(KNO3),天津市凯通化学试剂有限公司;D-甘露醇、钒酸钠(Na3VO4)、对苯二胺、磷酸氢二钾(K2HPO4)、磷酸二氢钾(KH2PO4),麦克林公司;钼酸铵、乙二胺四乙酸(EDTA),天津市风船化学试剂科技有限公司;蔗糖、三氯乙酸,购于天津市光复科技发展有限公司;ATP、ADP、AMP标准品、甲醇,Sigma公司。
1.2 仪器及设备
1260高效液相色谱仪(配有四元泵、二极管阵列检测器),美国安捷伦公司;Allegra X-30R冷冻高速离心机,贝克曼库尔特有限公司;Ultrospec 2000紫外分光光度计,美国Pharmacia Biotech公司;PHS-25 pH计,上海雷磁有限公司;Ming-Ch24uv超纯水机,默克密理博公司;HHS电热恒温水浴锅,上海博讯实业有限公司;Texture Analyser XTplus,英国Stable Micro Systems公司;F-900 Portable Ethylene Analyzer,美国Felix公司。
1.3 实验方法
分别于0 ℃、4 ℃和20 ℃(相对湿度85%~90%)条件下进行贮藏试验,每个处理3次重复。在第0、7、14、28、56、84、112、140、168天时进行相关指标的测定。
1.4 分析方法
1.4.1 马铃薯茎肉硬度及呼吸强度测定
使用质构仪在马铃薯赤道两面平坦处进行茎肉硬度测定。参数设置为:测试前速度2 mm/s,测试中速度为1 mm/s,测试后速度为10 mm/s,穿刺深度为10 mm,触发力为5 g。
将1 kg马铃薯置于5.5 L改良乐扣箱中于试验温度下密封1 h后使用F-900 Portable Ethylene Analyzer 测定马铃薯呼吸强度,设定连续模式,流速180 mL/min。
1.4.2 马铃薯发芽率及发芽级数测定
选择54个马铃薯,芽长超过2 mm时即为发芽,发芽率计算如公式(1)[6]所示:
发芽率![]()
(1)
选择固定的54个马铃薯进行发芽级数测定,计算如公式(2)[7]所示,判别标准见表1。
表1 个体发芽级数
Table 1 Individual germination progression

发芽数/芽眼数发芽等级X<1/411/4≤X≤1/22X>1/23
发芽级数![]()
(2)
1.4.3 马铃薯中可溶性糖含量测定
马铃薯中可溶性糖利用高效液相色谱法测定,参照杨志国等[8]的方法。
色谱条件:流动相为乙腈与超纯水(体积比为75∶25),流速0.6 mL/min;柱温35 ℃,示差检测器。
样品处理:称取2 g马铃薯样品置于50 mL离心管中,加入10 mL超纯水后超声提取30 min,然后在10 000 r/min的条件下离心20 min,取上清液后在残渣中继续加入10 mL超纯水重复上述超声、离心步骤,最后合并上清液定容于25 mL容量瓶中,经0.45 μm滤膜过滤后待测。
1.4.4 ATP、ADP、AMP含量及能荷测定
马铃薯中ATP、ADP、AMP的提取和测定参考张晓寒[9]和刘晶[10]的方法略作修改。精确称取2 g经液氮冷冻研磨的马铃薯样品置于50 mL离心管中,加入6 mL 0.6 moL/L高氯酸提取液静置20 min,然后用0.1 moL/L氢氧化钾(KOH)溶液调节pH值至6.5~6.8,静置20 min。取上清液,在4 ℃、10 000 r/min的条件下离心15 min,经0.45 μm水系滤膜过滤后待测。
色谱条件:ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相A(0.06 mol/L磷酸氢二钾与0.04 mol/L磷酸二氢钾),pH 7.0,流动相B为甲醇,柱温35 ℃,检测波长254 nm,进样量20 μL,流速0.9 mL/min,梯度洗脱,洗脱比例见表2。根据标准品的出峰时间对样品中ATP、ADP、AMP定性,通过外标法对这3种物质进行定量分析,能荷计算如公式(3)[11]所示:
(3)
表2 能量测定梯度洗脱比例
Table 2 Energy determination of gradient elution ratio
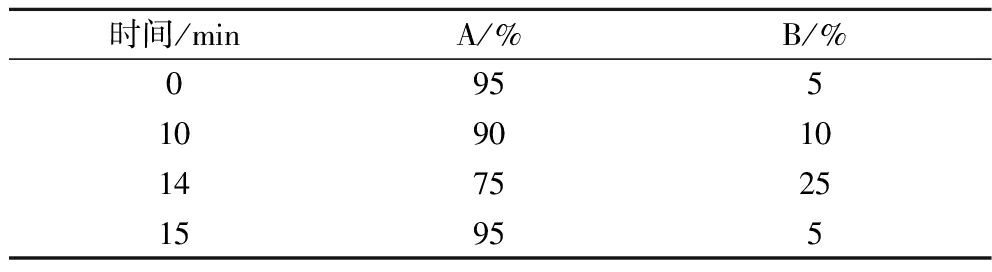
时间/minA/%B/%095510901014752515955
1.4.5 马铃薯线粒体提取
马铃薯样品中线粒体提取参照张群[12]的方法。准确称取经液氮冷冻后研磨成粉末的马铃薯样品10 g于50 mL离心管中,加入25 mL提前在4 ℃冰箱中预冷好的50 mmol/L的Tris-HCL提取液(pH 7.5,内含0.25 mol/L蔗糖,0.3 moL/L甘露醇,1 mmol/L EDTA,0.5% PVP),后将其放在4 ℃冰箱中静置15 min,然后用5层纱布过滤并转移到50 mL离心管中,在4 ℃、10 000 r/min的条件下离心20 min,弃去上清液,向沉淀中加入5 mL洗涤液(10 mmol/L Tris-HCL,pH 7.2,内含0.25 mol/L蔗糖,0.3 mol/L甘露醇,1 mmol/L EDTA),在上述离心条件下再次离心后弃去上清液,向最终的沉淀中加入2 mL洗涤液(10 mmol/L Tris-HCL)即得到线粒体粗提液。
1.4.6 线粒体中H+-ATPase与Ca2+-ATPase酶测定
线粒体中H+-ATPase与Ca2+-ATPase酶活力测定参照张群[13]和赵颖颖等[14]的方法。吸取0.1 mL线粒体制备液向其中加入0.7 mL缓冲液(30 mmol/L pH 7.2的Tris-HCL溶液,内含3 mmol/L硫酸镁,50 mmol/L硝酸钠,0.1 mmol/L钒酸钠,0.1 mmol/L钼酸铵,50 mmol/L氯化钾),混匀后再向其中加入0.1 mL 反应启动溶液(pH为8.0的30 mmol/L ATP-Tris溶液),然后将其放入37 ℃的恒温水浴锅中20 min,之后迅速向其中加入0.1 mL质量分数为55%的三氯乙酸溶液使其停止反应。反应释放的无机磷含量用无机磷试剂盒测定。以无机磷含量表示H+-ATPase活力(μmol/g)。
Ca2+-ATPase酶活力以是否添加3 mmol/L硝酸钙Ca(NO3)2引起的酶活力之差表示。步骤同H+-ATPase活性测定一致。
1.4.7 SDH活力测定
琥珀酸脱氢酶活力测定参照JIN等[15]的方法,以每克组织在反应体系中每分钟消耗1 nmoL 2,6-二氯酚靛酚定义为一个酶活力单位U,SDH活力以U/g表示。
1.4.8 CCO活力测定
线粒体中CCO活力测定参照陈京京等[16]的方法。吸取0.1 mL线粒体粗提液向其中加入0.5 mL 0.04%细胞色素C水溶液和2 mL蒸馏水,在37 ℃的水浴锅中放置2 min,再向其中加入0.5 mL 0.4%的对苯二胺溶液混匀后再次放到37 ℃恒温水浴锅中反应10 min至出现红色,在510 nm下测定其吸光度值,每克鲜重每分钟变化0.01为一个酶活力单位U,CCO活力以U/g表示。
1.5 数据处理
每个指标测定3次,取其平均值作为实验数据。利用软件Origin 2019对文章中图表进行绘制,使用SPSS软件进行差异性分析和相关性分析。
2 结果与分析
2.1 贮藏过程中马铃薯茎肉硬度及呼吸强度变化
马铃薯茎肉硬度是衡量马铃薯贮藏品质的一个重要标准。由图1-a可知,3个贮藏温度下马铃薯茎肉硬度在贮藏过程中均呈下降趋势,0 ℃和4 ℃处理的马铃薯茎肉硬度下降幅度显著低于20 ℃处理的马铃薯,贮藏168 d,20 ℃处理的马铃薯茎肉硬度下降最明显,由初始的4 378.90 g/cm2下降至2 335.47 g/cm2,下降了46.66%,而0 ℃和4 ℃分别下降了18.23%和17.81%;贮藏28 d后,4 ℃处理的马铃薯茎肉硬度始终高于0 ℃,说明适宜的低温(4 ℃)可有效减缓马铃薯贮藏过程中茎肉硬度的下降速率,从而较好地维持马铃薯的贮藏品质。
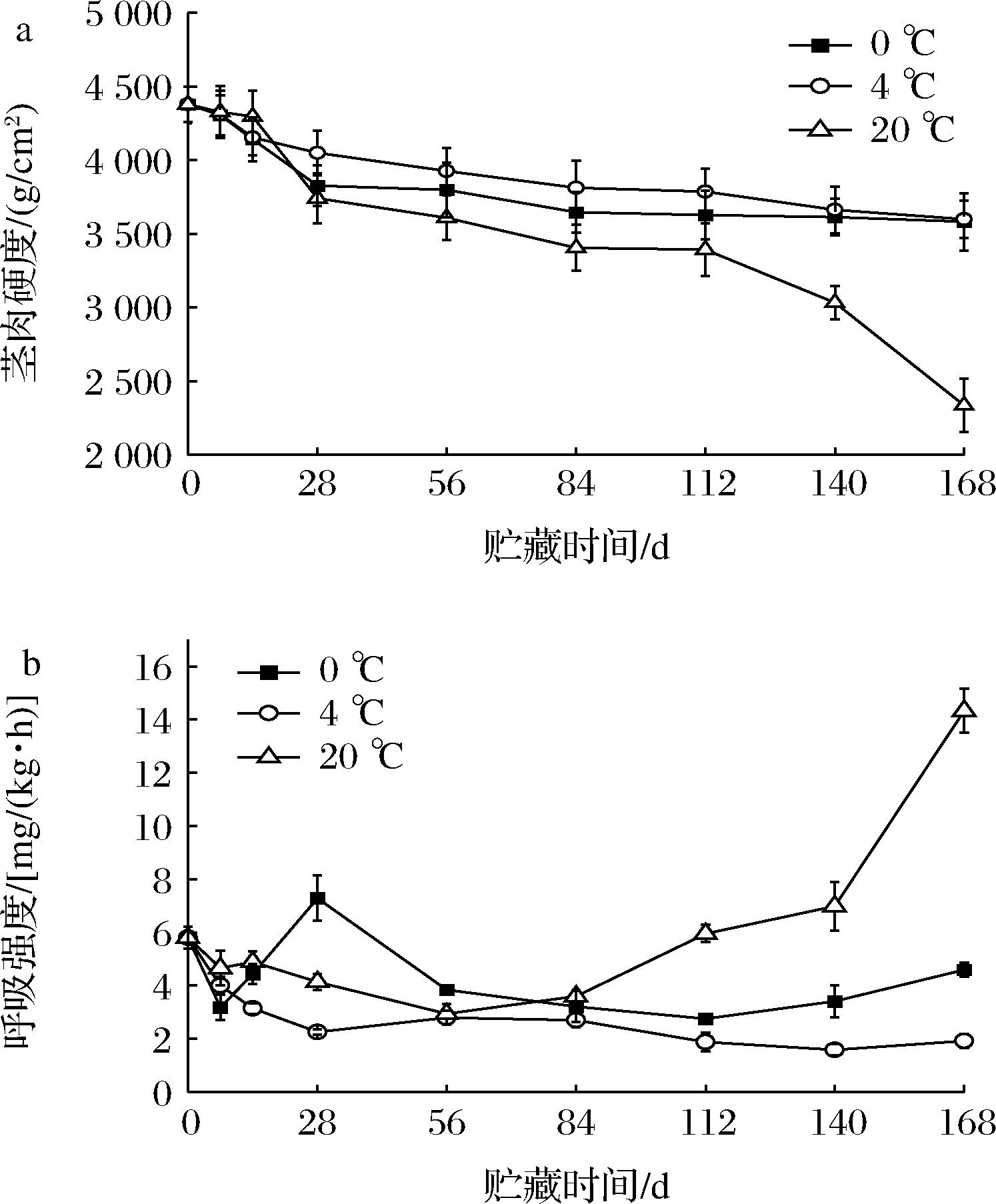
a-茎肉硬度;b-呼吸强度
图1 贮藏过程中马铃薯茎肉硬度及呼吸强度的变化
Fig.1 Changes of hardness and respiration rated of potatoes during storage
呼吸强度也是反映马铃薯贮藏效果的重要指标之一,呼吸强度的上升不仅说明马铃薯块茎代谢速率加快,还加速了营养物质的消耗,导致马铃薯品质下降。从图1-b可知,4 ℃处理的马铃薯块茎始终保持着较低的呼吸强度,且趋势平稳,始终低于0 ℃和20 ℃处理,有效抑制块茎内营养物质的损失。贮藏28 d时,0 ℃处理的马铃薯块茎呼吸强度出现最大值,较初始值上升了25.58%,这可能与马铃薯抵御低温胁迫,增加能量消耗有关;56 d前后20 ℃处理的马铃薯块茎呼吸强度呈先缓慢降低后快速上升趋势。贮藏至84 d后,不同处理间马铃薯块茎呼吸强度呈极显著差异,从高到底依次为:20 ℃处理>0 ℃处理>4 ℃处理(P<0.01)。说明4 ℃贮藏条件可有效降低马铃薯块茎的呼吸强度,块茎代谢速率维持较低水平,有利于块茎贮藏期的延长。
2.2 贮藏过程中马铃薯发芽率及发芽级数变化
马铃薯发芽后不仅影响感官品质,还会产生有毒物质龙葵素,因此在贮藏过程应防止马铃薯块茎发芽带来的商品价值降低。由图2-a可知,0 ℃处理的马铃薯块茎始终未发芽;贮藏至112 d时,4 ℃处理的马铃薯块茎结束休眠进入萌发期,贮藏168 d时块茎发芽率高达25.15%,说明4 ℃低温仅延长了马铃薯块茎的休眠期,并不影响块茎正常发芽。20 ℃处理的马铃薯贮藏初期就开始发芽,84 d时所有块茎全部发芽,极显著高于其他两处理组(P<0.01)。可见,低温是抑制马铃薯块茎的萌发的关键因素。发芽级数与发芽率趋势变化规律基本一致(图2-b),贮藏结束时,20 ℃处理的马铃薯发芽级数出现下降,这可能是马铃薯侧芽生长受抑制的结果。
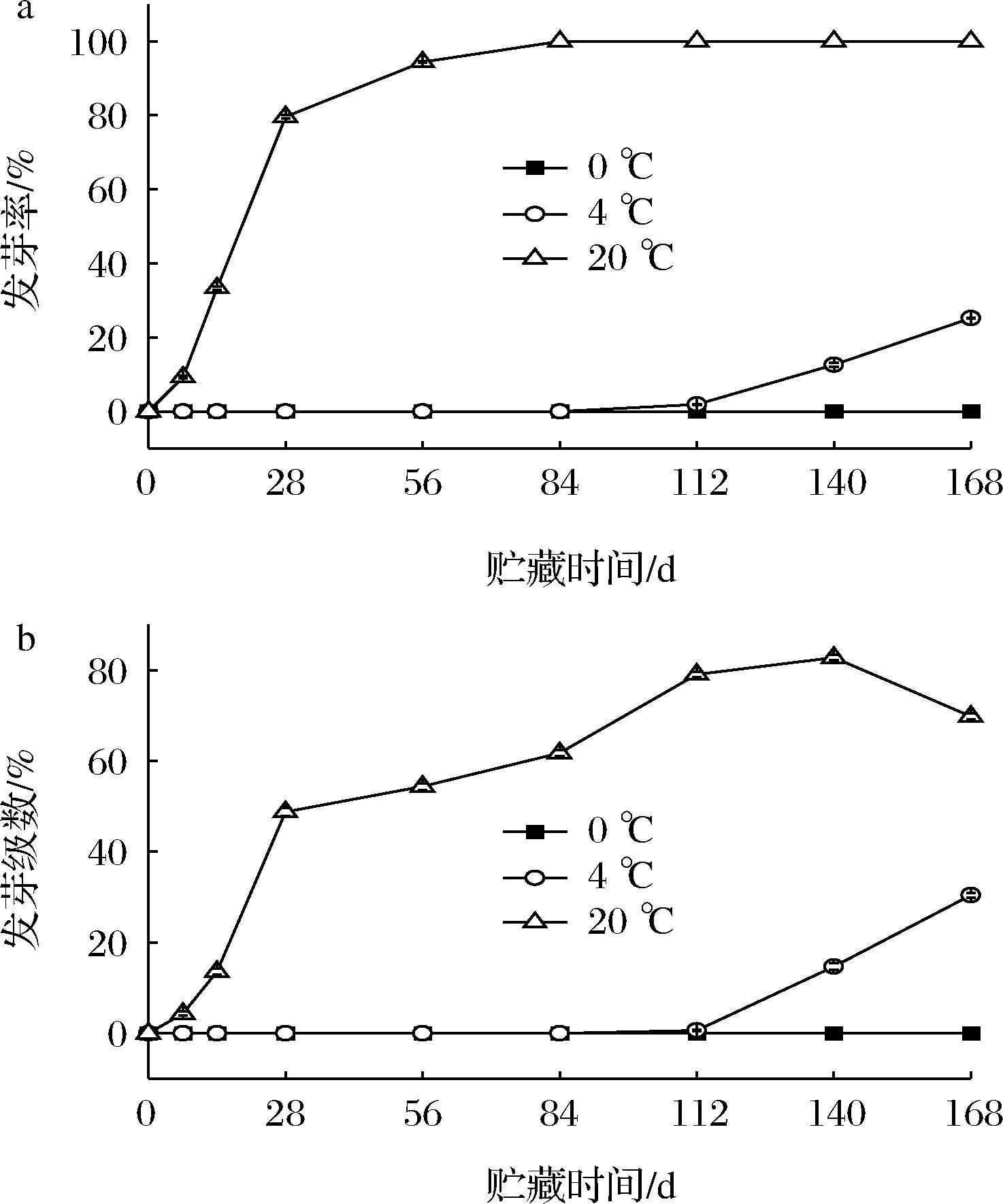
a-发芽率;b-发芽级数
图2 贮藏过程中马铃薯发芽率及发芽级数变化
Fig.2 Changes of germination rate and germination progression of potatoes during storage
2.3 贮藏过程中马铃薯发芽状况比较
马铃薯块茎发芽时会引起块茎中水分和营养物质的消耗,使马铃薯块茎表面皱缩,严重影响感官品质与商品价值。从图3中可看出,20 ℃处理中马铃薯块茎较早出现明显的发芽现象,在贮藏112 d,马铃薯块茎发芽、表面皱缩严重,完全失去商品价值。与之相对,0 ℃和4 ℃处理可有效抑制马铃薯块茎的发芽,但在贮藏168 d时,0 ℃处理的马铃薯外观新鲜度明显低于4 ℃处理,且马铃薯表面已出现凹陷褐斑,可能与过低的贮藏温度引起的代谢失调,发生冷害有关。可见,4 ℃的贮藏温度是维持马铃薯营养和外观品质的适宜条件。
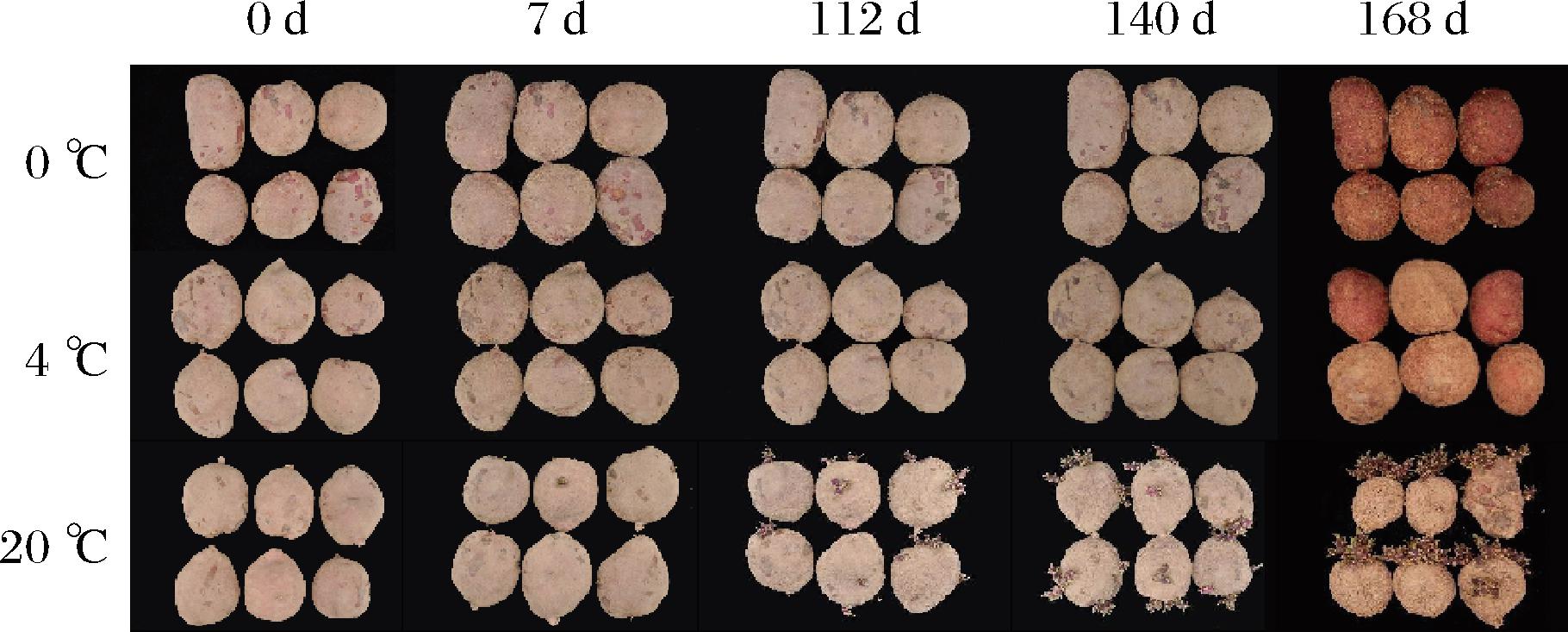
图3 贮藏过程中马铃薯发芽状况比较
Fig.3 Comparison of potato germination during storage
2.4 贮藏过程中马铃薯可溶性糖的变化
从表3中可以看出,马铃薯的可溶性糖以果糖、葡萄糖、蔗糖为主。贮藏期间,0 ℃和4 ℃处理的马铃薯果糖和葡萄糖含量呈上升趋势,20 ℃处理呈先降后升趋势,贮藏140 d时,20 ℃处理的马铃薯果糖和葡萄糖含量出现最大值,较初始值分别升高了97.86%和164.45%,且20 ℃处理的马铃薯在整个贮藏过程中可溶性糖含量均显著低于0 ℃和4 ℃处理的马铃薯,这可能是由于在较高温度下马铃薯块茎生理代谢旺盛,加速了可溶性糖的降解。贮藏28 d后,马铃薯块茎中果糖、葡萄糖、蔗糖含量从高到低依次为:0 ℃处理>4 ℃处理>20 ℃处理(P<0.05),总糖含量与之相似。
表3 贮藏过程中马铃薯可溶性糖含量变化 单位:g/kg
Table 3 Changes of soluble sugar content of potatoes during storage
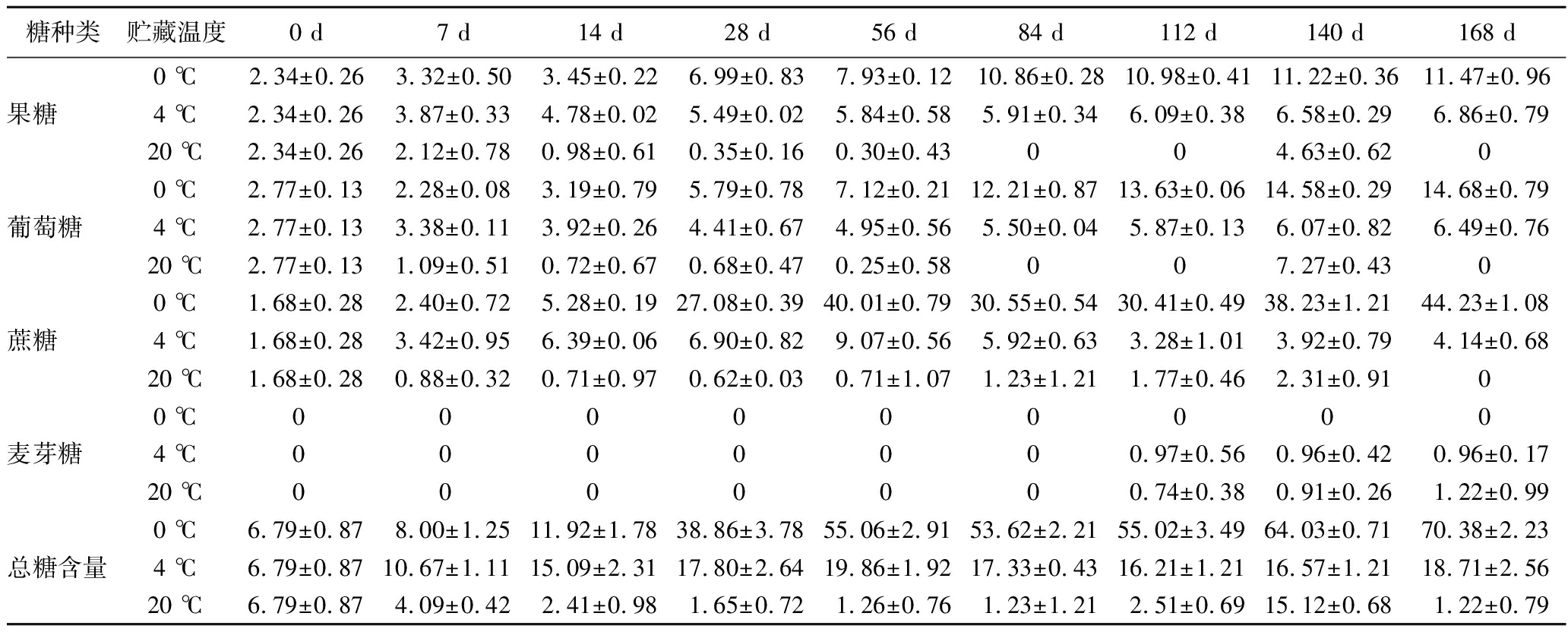
糖种类贮藏温度0 d7 d14 d28 d56 d84 d112 d140 d168 d0 ℃2.34±0.263.32±0.503.45±0.226.99±0.837.93±0.1210.86±0.2810.98±0.4111.22±0.3611.47±0.96果糖4 ℃2.34±0.263.87±0.334.78±0.025.49±0.025.84±0.585.91±0.346.09±0.386.58±0.296.86±0.7920 ℃2.34±0.262.12±0.780.98±0.610.35±0.160.30±0.430 0 4.63±0.620 0 ℃2.77±0.132.28±0.083.19±0.795.79±0.787.12±0.2112.21±0.8713.63±0.0614.58±0.2914.68±0.79葡萄糖4 ℃2.77±0.133.38±0.113.92±0.264.41±0.674.95±0.565.50±0.045.87±0.136.07±0.826.49±0.7620 ℃2.77±0.131.09±0.510.72±0.670.68±0.470.25±0.580 0 7.27±0.430 0 ℃1.68±0.282.40±0.725.28±0.1927.08±0.3940.01±0.7930.55±0.5430.41±0.4938.23±1.2144.23±1.08蔗糖4 ℃1.68±0.283.42±0.956.39±0.066.90±0.829.07±0.565.92±0.633.28±1.013.92±0.794.14±0.6820 ℃1.68±0.280.88±0.320.71±0.970.62±0.030.71±1.071.23±1.211.77±0.462.31±0.910 0 ℃0 0 0 0 0 0 0 0 0 麦芽糖4 ℃0 0 0 0 0 0 0.97±0.560.96±0.420.96±0.1720 ℃0 0 0 0 0 0 0.74±0.380.91±0.261.22±0.990 ℃6.79±0.878.00±1.2511.92±1.7838.86±3.7855.06±2.9153.62±2.2155.02±3.4964.03±0.7170.38±2.23总糖含量4 ℃6.79±0.8710.67±1.1115.09±2.3117.80±2.6419.86±1.9217.33±0.4316.21±1.2116.57±1.2118.71±2.5620 ℃6.79±0.874.09±0.422.41±0.981.65±0.721.26±0.761.23±1.212.51±0.6915.12±0.681.22±0.79
此外,研究发现麦芽糖只在贮藏112 d后的4 ℃和20 ℃处理中出现,这可能与块茎进入萌发期有关。在贮藏28 d后,0 ℃处理的马铃薯可溶性糖含量显著高于其他两组,明显出现“低温糖化”现象,这可能是一种马铃薯块茎自我保护机制,为抵御外界低温胁迫块茎内淀粉转化为可溶性糖,从而增加组织内可溶性糖含量,避免冷害和冻害的发生。因此,在4 ℃条件下更有利于马铃薯块茎的贮藏,该温度既不会导致可溶性糖消耗过快,也不会发生明显的低温糖化效应。
2.5 ATP、ADP、AMP标准品与马铃薯样品高效液相色谱图分析
将ATP、AMP、ADP的混合标准溶液及1.3.4节中制备好的马铃薯样品溶液注入高效液相色谱仪中进行分析,得到标准品及马铃薯样品高效液相色谱图(图4、图5)。
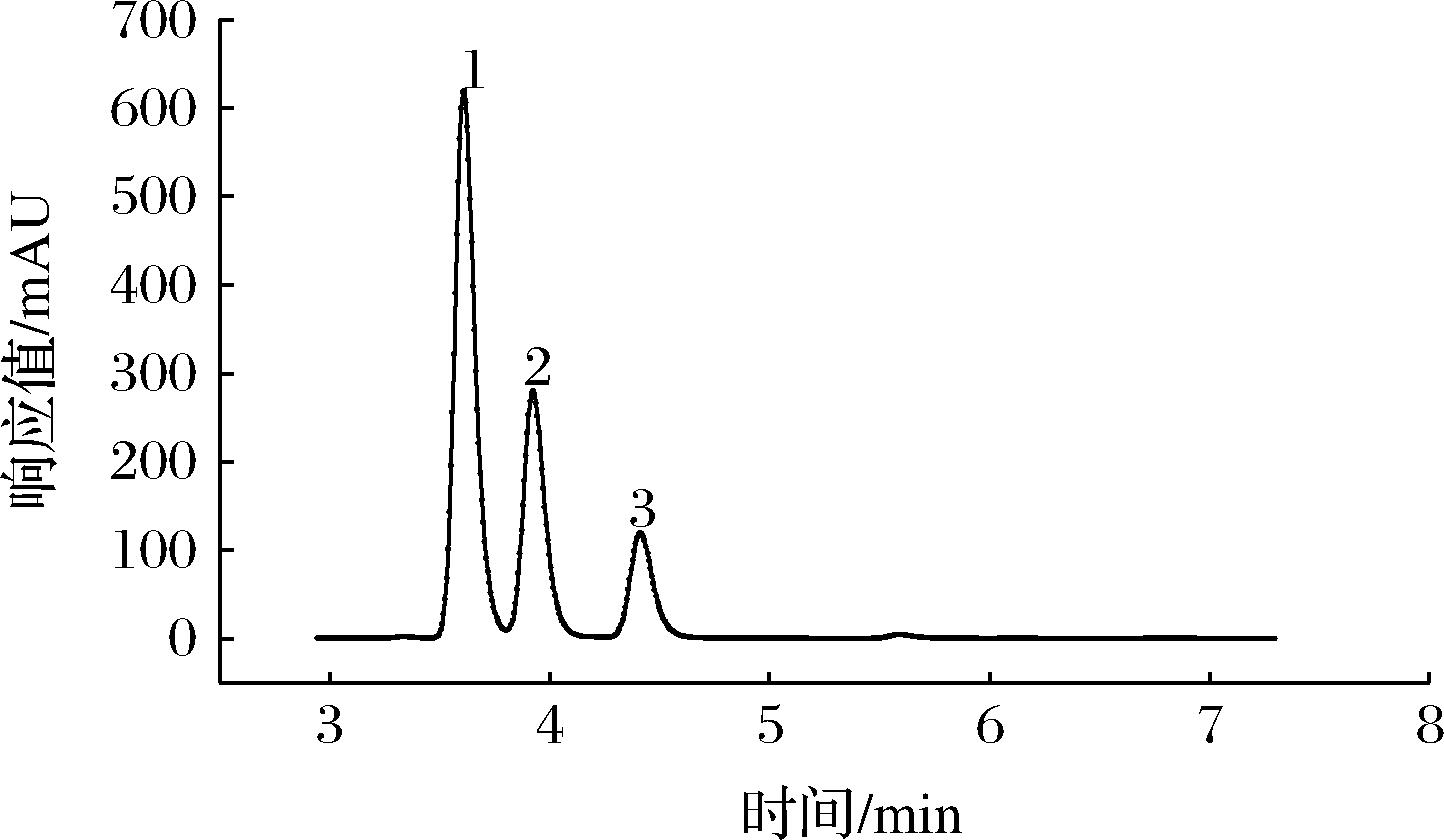
图4 ATP、ADP、AMP标准品高效液相色谱图
Fig.4 HPLC of ATP,ADP and AMP standards
注:“1”为ATP吸收峰;“2”为ADP吸收峰;“3”为AMP吸收峰(下同)。
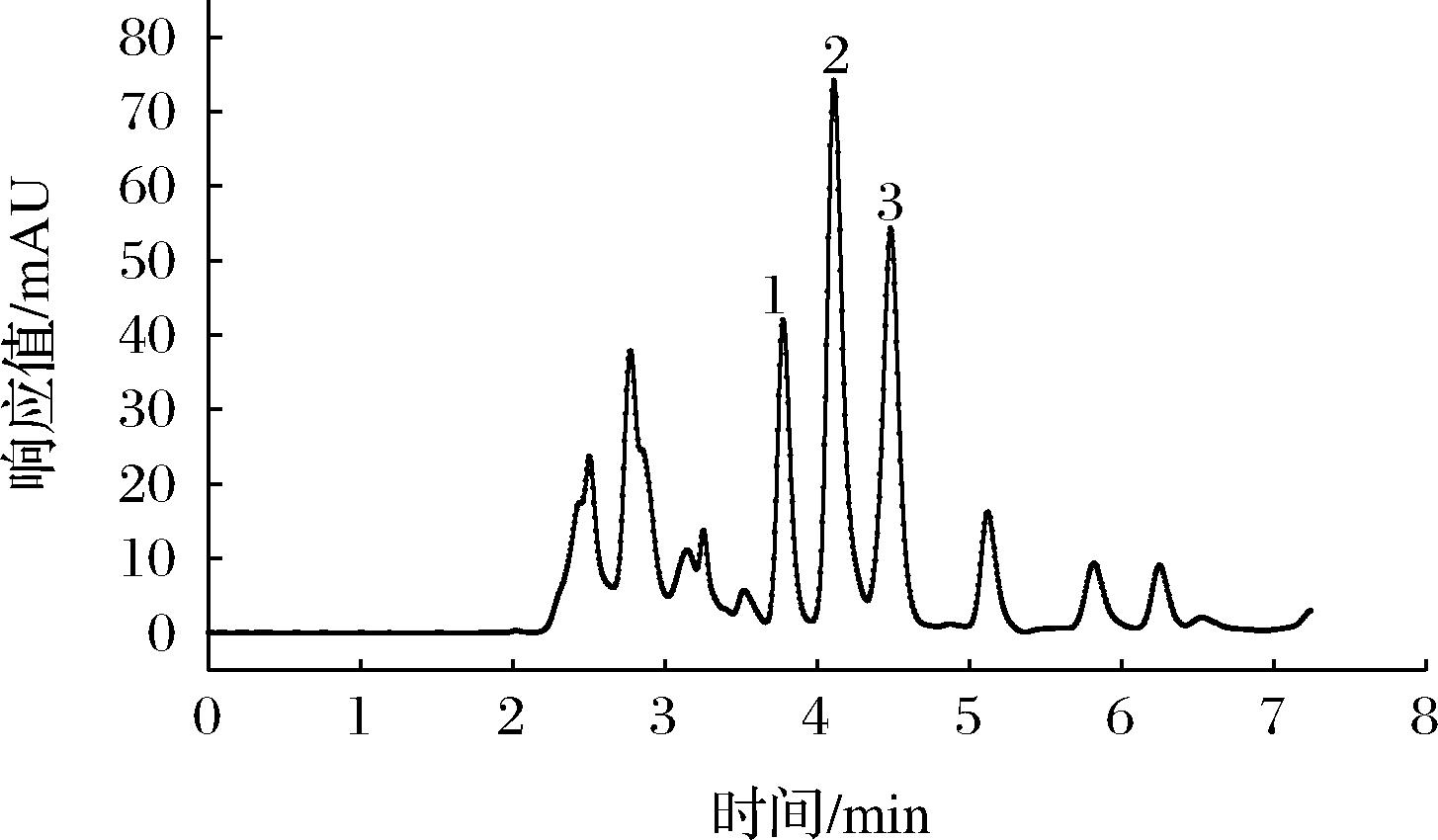
图5 马铃薯样品高效液相色谱图
Fig.5 HPLC of potatoes sample
从图4和图5中可以看出,在该色谱条件下ATP、ADP、AMP均得到良好的分离,标准品中ATP、ADP、AMP的出峰时间为3.784、4.109和4.588 min,而马铃薯样品中ATP、ADP、AMP的出峰时间为3.801、4.216和4.590 min,样品出峰时间较标品略晚,但基本保持一致,说明利用该条件对样品中ATP、ADP、AMP含量进行测定的方法可行。
2.6 贮藏过程中马铃薯ATP、ADP、AMP含量及能荷变化
ATP主要分布在线粒体、叶绿体和细胞质基质中,是代谢调节的主要能量来源。同时ATP在能量代谢中也起着核心作用,生物体合成代谢和分解代谢都需要ATP的参与。从图6-a中可以看出,马铃薯块茎中ATP含量呈先上升后下降趋势。贮藏0~56 d,20 ℃处理条件下马铃薯块茎中ATP含量显著高于0 ℃和4 ℃处理(P<0.05);贮藏168 d时,ATP含量从高到低依次为:4 ℃处理>0 ℃处理>20 ℃处理。20 ℃处理的马铃薯在贮藏28 d后便出现ATP含量急剧下降的现象,这说明马铃薯块茎在贮藏28 d后细胞开始出现衰老情况,细胞衰老时线粒体功能会出现失调现象,主要表现为氧化磷酸化反应减少,ATP生成总量减少。而4 ℃贮藏温度可保持马铃薯细胞在整个贮藏过程中保持较高水平的ATP含量,较高水平的ATP含量可保持植物细胞膜的完整性,延缓马铃薯衰老进程。
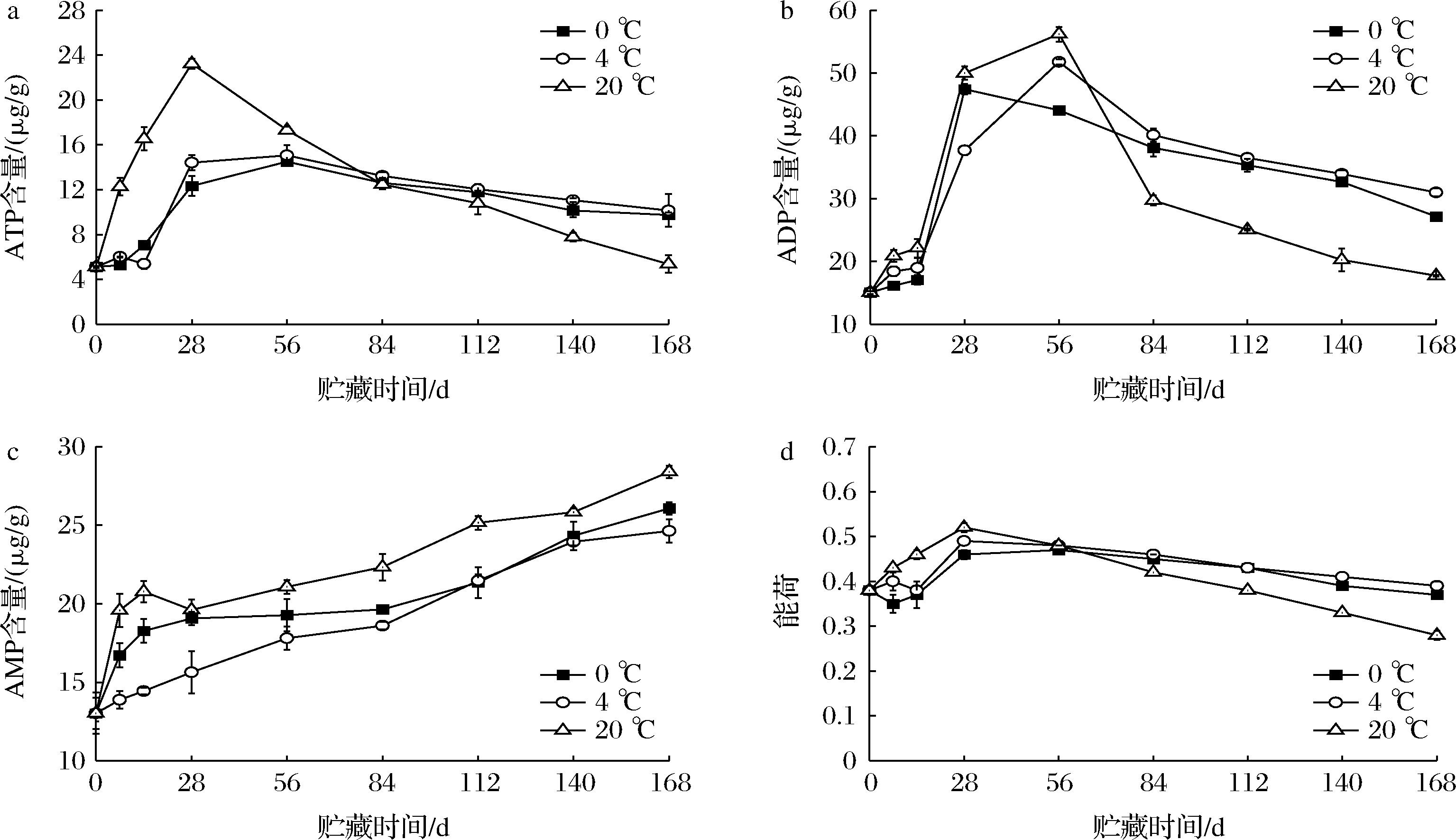
a-ATP含量;b-ADP含量;c-AMP含量;d-能荷
图6 贮藏过程中马铃薯ATP、ADP、AMP含量及能荷变化
Fig.6 Changes of ATP,ADP,and AMP content and energy charge of potatoes during storage
由图6-b可知,马铃薯块茎中ADP含量呈先上升后下降趋势,贮藏56~168 d,20 ℃处理的马铃薯块茎中ADP含量显著低于其他两处理组(P<0.05)。马铃薯块茎中的AMP含量大体呈上升趋势(图6-c),贮藏84 d前,4 ℃处理AMP含量显著低于0 ℃和20 ℃处理(P<0.05),在整个贮藏过程中AMP含量上升顺序依次为:20 ℃处理>0 ℃处理>4 ℃处理,说明4 ℃贮藏温度可有效抑制马铃薯块茎AMP含量的上升及ADP含量的下降。
保持较高能荷水平对维持果蔬细胞膜完整性、减缓组织衰老并增强其抗病性具有积极作用。从图6-d中可以看出,在整个贮藏过程中马铃薯块茎中的能荷呈先上升后下降的趋势,20 ℃处理的马铃薯块茎在贮藏56 d后能荷值快速下降,说明马铃薯块茎中能量出现亏损现象,马铃薯开始衰老,从图6可以看出能荷下降速率依次为:20 ℃处理>0 ℃处理>4 ℃处理,说明4 ℃贮藏温度可维持较高的能荷水平和能荷稳定性。
2.7 贮藏过程中马铃薯H+-ATPase和Ca2+-ATPase活力的变化
H+-ATPase是植物中的质子泵,泵出H+从而在膜内外建立起了用于营养转运的电化学梯度,从而催化ATP的生成,维持细胞质相对稳定的pH。由图7-a可知,马铃薯块茎的H+-ATPase活力在贮藏28 d后整体呈下降趋势。且4 ℃处理的马铃薯块茎在贮藏28 d后H+-ATPase活力显著高于其他两组处理,说明4 ℃可有效保持H+-ATPase在贮藏过程中的活力。H+-ATPase活力的大小与线粒体功能密切相关,若H+-ATPase活力较低则会影响马铃薯块茎中ATP生成速率,造成细胞内能量合成不足从而加速马铃薯块茎的衰老。
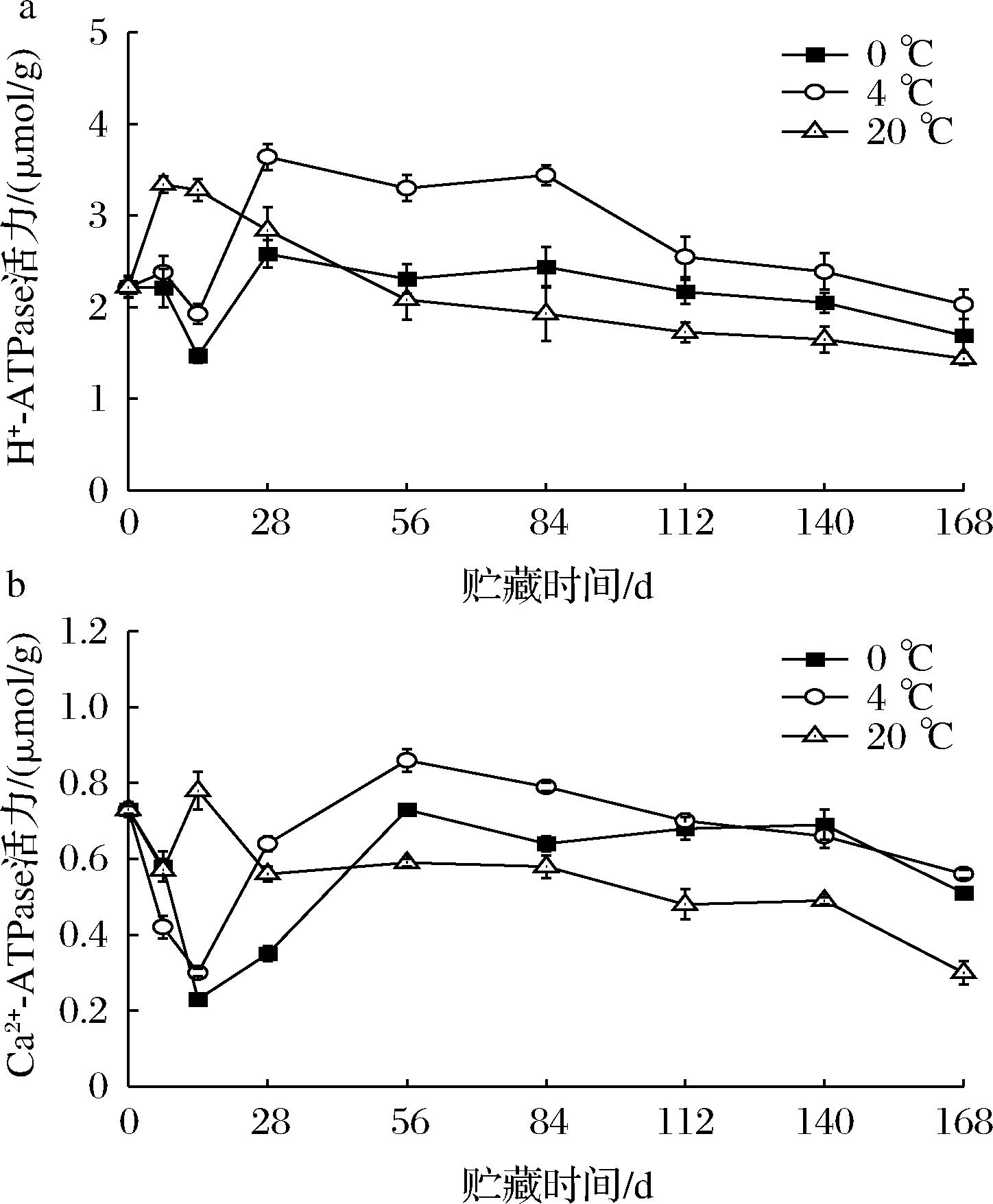
a-H+-ATPase活力变化;b-Ca2+-ATPase活力变化
图7 贮藏过程中马铃薯H+-ATPase和Ca2+-ATPase活力变化
Fig.7 Changes of H+-ATPase and Ca2+-ATPase activities in potatoes during storage
Ca2+-ATPase是细胞器膜上的钙离子泵,是维持细胞稳态的重要机制之一,其作用是将植物细胞质内的钙离子运送到线粒体内参与线粒体中的各种调节。当Ca2+-ATPase酶活力太低时,细胞质内的Ca2+浓度便会升高,而线粒体内Ca2+浓度便会降低,从而导致线粒体功能受损,细胞衰老进程加快。从图7-b中可看出在贮藏28 d后4 ℃处理的马铃薯块茎中Ca2+-ATPase活力高于其他两组,且20 ℃处理的马铃薯块茎Ca2+-ATPase活力在整个贮藏过程中下降速率最快,与初始值相比下降了58.90%,贮藏结束时,0 ℃、4 ℃和20 ℃条件下Ca2+-ATPase活力依次为:0.51、0.56和0.30 μmol/g。这表明4 ℃贮藏可提高贮藏过程中(28~168 d)的Ca2+-ATPase活性,减少马铃薯块茎的衰老。
2.8 贮藏过程中马铃薯SDH和CCO活力变化
SDH是三羧酸循环中的关键酶,可催化琥珀酸脱氢转化成延胡素酸,脱下的H+最后会生成ATP,为生命活动提供能量。SDH活力的高低直接影响ATP的生成。由图8-a可知,0 ℃处理下的马铃薯块茎中SDH活力在14 d时出现最低值,为21.24 U/g;20 ℃和4 ℃处理在7 d和14 d时出现最高值,分别为50.20 U/g和44.67 U/g,说明贮藏初期SDH活力随贮藏温度的升高呈上升趋势。而贮藏56 d后,各处理中SDH活力变化趋于平缓,但处理之间差异显著(P<0.05),由高到低排列为:4 ℃处理>0 ℃处理>20 ℃处理。可见,适宜的低温(4 ℃)可有效维持贮藏中后期马铃薯块茎中SDH高活力。
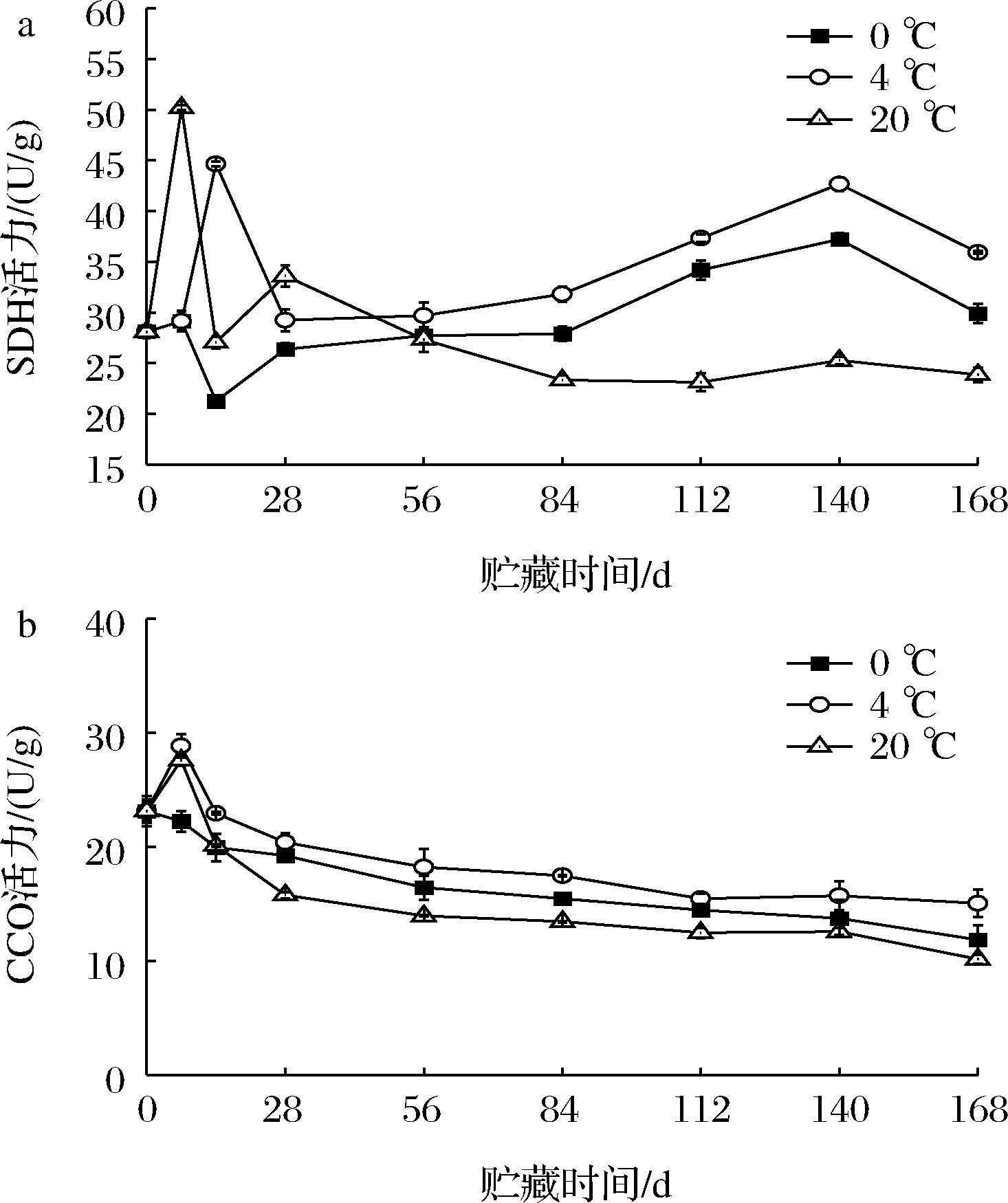
a-SDH活力;b-CCO活力
图8 贮藏过程中马铃薯SDH和CCO活性变化
Fig.8 Changes in the activities of SDH and CCO during potatoes storage
CCO是线粒体电子传递链末端氧化酶,其作用是为氧化磷酸化提供能量,它可以将电子传递给O2,若CCO活力降低或缺失,将会中断线粒体呼吸链电子的传递,从而减少ATP的生成,ATP减少会造成细胞能量的亏损导致细胞死亡。图8-b中显示,总体上马铃薯块茎中CCO活力随着贮藏时间的延长呈缓慢下降趋势,20 ℃处理的马铃薯块茎CCO活力下降速率最快,下降了56.14%,而4 ℃处理的下降速率最慢,下降了34.96%。贮藏至168 d时,0 ℃、4 ℃和20 ℃处理CCO活力分别为11.85、15.05、10.15 U/g。可见,4 ℃贮藏条件可更好地维持了贮藏过程中马铃薯块茎内CCO高活力,有利于ATP的生成。
2.9 能量水平与相关酶活力及主要生理指标之间的相关性分析
由表4可以看出,ADP含量、能荷及H+-ATPase酶活力与ATP含量均呈极显著正相关(r=0.965**,r=0.898**,r=0.811**),Ca2+-ATPase酶活力与ATP含量呈显著相关性(r=0.681*);ADP含量与能荷呈极显著正相关(r=0.842**),与H+-ATPase及Ca2+-ATPase酶活力显著相关(r=0.732*,r=0.692*);AMP含量与CCO酶活力呈极显著负相关(r=-0.864**);而能荷与H+-ATPase酶活力呈极显著正相关(r=0.967**)。说明马铃薯块茎组织能量水平的高低与相关酶(H+-ATPase、Ca2+-ATPase及CCO)活力关系密切,相关酶活力降低将会使细胞能量供应不足,从而引起细胞膜系统的破坏,导致植物细胞衰老。
表4 能量水平与相关酶活力的相关性分析
Table 4 Pearson correlation analysis among energy levels and enzyme activity
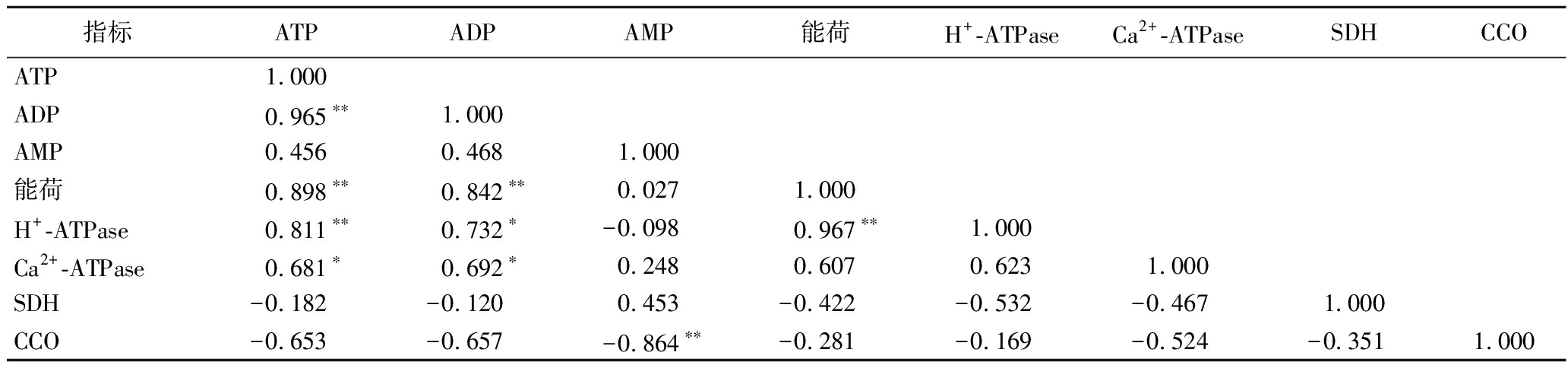
指标ATPADPAMP能荷H+-ATPaseCa2+-ATPaseSDHCCOATP1.000ADP0.965∗∗1.000AMP0.4560.4681.000能荷0.898∗∗0.842∗∗0.0271.000H+-ATPase0.811∗∗0.732∗-0.0980.967∗∗1.000Ca2+-ATPase0.681∗0.692∗0.2480.6070.6231.000SDH-0.182-0.1200.453-0.422-0.532-0.4671.000CCO-0.653-0.657-0.864∗∗-0.281-0.169-0.524-0.3511.000
注:**表示在P<0.01水平显著相关,*表示在P<0.05水平显著相关(下同)。
由表5可知,ATP含量与可溶性糖含量呈极显著负相关(r=-809**),与呼吸强度呈显著负相关(r=-0.667*);ADP含量与可溶性糖之间呈极显著正相关(r=0.835**);AMP含量与果实硬度呈极显著负相关(r=-0.961**),与呼吸强度呈显著负相关(r=-0.790*);果实硬度与呼吸强度之间呈极显著正相关(r=0.871**),与可溶性糖之间呈显著负相关(r=-0.782*);呼吸强度与可溶性糖之间呈极显著负相关(r=-0.872**)。说明马铃薯块茎在贮藏过程中的能量变化与质量品质之间存在一定的相关性,马铃薯细胞中能量水平的高低会直接影响块茎品质。
表5 能量水平与主要生理指标的相关性分析
Table 5 Pearson correlation analysis among energy levels and physiological indicators of quality
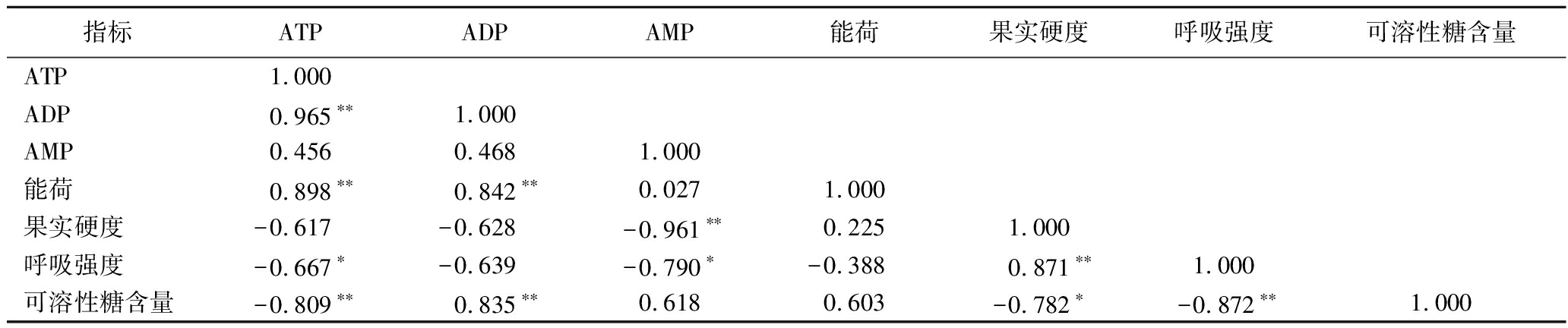
指标ATPADPAMP能荷果实硬度呼吸强度可溶性糖含量ATP1.000ADP0.965∗∗1.000AMP0.4560.4681.000能荷0.898∗∗0.842∗∗0.0271.000果实硬度-0.617-0.628-0.961∗∗0.2251.000呼吸强度-0.667∗-0.639-0.790∗-0.3880.871∗∗1.000可溶性糖含量-0.809∗∗0.835∗∗0.6180.603-0.782∗-0.872∗∗1.000
注:**表示在P<0.01水平显著相关,*表示在P<0.05水平显著相关。
3 讨论
本研究发现,4 ℃贮藏条件可有效抑制贮藏过程马铃薯呼吸代谢水平,减缓了马铃薯贮藏过程中茎肉硬度的下降速率,较好地维持马铃薯的贮藏品质。而0 ℃处理虽然抑芽效果明显,但马铃薯块茎呼吸代谢水平高于4 ℃处理,并出现生理代谢失调,表皮出现明显凹陷褐斑,有明显冷害迹象。20 ℃处理的马铃薯块茎呼吸强度在贮藏84 d后明显升高,加快了马铃薯代谢底物的消耗从而导致马铃薯衰老[17],导致贮藏结束时块茎发芽、失水皱缩严重,完全丧失食用和商品价值。笔者所在研究团队在前期研究过程中已经对不同温度下马铃薯块茎的相关生理变化进行研究[3],在4~5 ℃、10~12 ℃和15~18 ℃贮藏温度下,马铃薯块茎随贮藏温度的上升,块茎的呼吸强度、失重率、腐烂率以及发芽率也呈上升趋势,与本试验中20 ℃温度条件下的生理及品质变化规律相似。低温贮藏马铃薯块茎在贮藏前期总糖含量显著上升,且0 ℃处理总糖含量显著高于4 ℃处理,这与姚桂枝[18]的研究结果相似,说明0 ℃低温条件对马铃薯块茎形成胁迫,加速了淀粉的分解,使大量淀粉转化为蔗糖,进一步分解为果糖和葡萄糖,最终导致“低温糖化”现象[19],并且随温度下降 “低温糖化”呈加重趋势,这可能与马铃薯块茎组织通过提高组织内液体含糖量对抗低温胁迫的自我保护机制有关。此外,本研究还在贮藏112 d后4 ℃和20 ℃处理的马铃薯块茎中检测出麦芽糖;而0 ℃处理块茎中始终未检测出麦芽糖,这可能与贮藏后期4 ℃和20 ℃处理的马铃薯进入萌发期有关,其深层次原因还需进一步研究。能量对于果实贮藏期间细胞各项生理功能的维持具有极其重要的作用[20],能量供应不足会导致细胞功能紊乱和代谢失调、细胞膜被破坏、功能丧失,同时导致防御系统无法清除多余的活性氧,进而加速果蔬衰老[21],并且保持较高的能量水平是植物细胞抵御外源微生物侵染的关键。可见,能量水平的高低也是评价果蔬耐贮性的重要指标之一。由于马铃薯块茎也是其生殖器官,贮藏后期块茎会进入萌发期,较之其他果蔬产品,其能量水平与能量代谢相关酶及贮藏品质之间也呈现更加复杂的关系。本研究相关性分析发现,能荷与ATP含量和ADP含量均呈极显著正相关(r=0.898**,r=0.842**),说明马铃薯组织主要靠ATP和ADP供能。ATP含量与H+-ATPase、Ca2+-ATPase酶活力均呈正相关关系(r=0.811**,r=0.681*),并且ADP含量与H+-ATPase、Ca2+-ATPase酶活力也均呈正相关关系(r=0.732*,r=0.692*)说明,H+-ATPase和Ca2+-ATPase是马铃薯块茎产生ATP和ADP的直接关键酶。AMP含量与CCO酶活力呈极显著负相关(r=-0.864**),说明CCO酶活力的上升加速了AMP向ADP的转化,从而降低了AMP的含量。ATP含量与可溶性糖含量呈极显著负相关(r=-809**),与呼吸强度呈显著负相关(r=-0.667*),说明ATP的产生需要消耗可溶性糖,并且ATP含量上升会抑制呼吸代谢速率;ADP含量与可溶性糖之间呈极显著正相关(r=0.835**),可溶性糖含量上升会促进AMP向ADP转化,促进ADP的上升;AMP含量与茎肉硬度与呼吸强度呈显著负相关(r=-0.790*),呈极显著负相关(r=-0.961**),说明AMP的积累是能量亏缺的表现,块茎的生理代谢受到抑制和贮藏品质下降。
线粒体是生物能量代谢的主要细胞器,其中的H+-ATPase、Ca2+-ATPase、SDH、CCO是线粒体呼吸代谢的关键酶,其活力的高低与线粒体功能密切相关。本研究发现,4 ℃处理可提高贮藏过程中马铃薯块茎中H+-ATPase和Ca2+-ATPase活力,并有效维持贮藏过程中SDH和CCO的高活力,这有利于细胞中ATP的产生,避免细胞代谢能量亏缺发生,从而有效维持线粒体功能和膜完整性,并延缓细胞衰老[15,22-24]。这与王志华等[25]得出的适宜的低温贮藏可有效提高苹果中能荷水平的研究结果相似。与之相对,在0 ℃和20 ℃条件下,马铃薯块茎中这些线粒体呼吸代谢的关键酶活力,出现不同程度的下降,会导致线粒体功能受损,从而使植物细胞能量合成受阻,造成细胞内能量的亏缺,进而加速了块茎细胞膜系统破坏,发生品质劣变。
综上所述,马铃薯块茎组织能量水平的高低与相关酶(H+-ATPase、Ca2+-ATPase及CCO)活力关系密切,相关酶活力下降引起ATP、ADP含量下降,发生细胞代谢能量亏缺,从而引起其生理代谢失调,加速了块茎营养物质的消耗和品质劣变。
4 结论
研究结果表明,马铃薯块茎组织能量水平的高低与相关酶(H+-ATPase、Ca2+-ATPase及CCO)活力关系密切,相关酶活力下降引起ATP、AMP含量下降,发生细胞代谢能量亏缺,从而引起其生理代谢失调,加速了块茎营养物质的消耗和品质劣变。适宜的低温(4 ℃)条件下马铃薯块茎中能量代谢相关酶(Ca2+-ATPase、H+-ATPase、CCO和SDH)均表现出较高的活力,保持较高的能荷、ATP含量和ADP含量,并能有效减缓马铃薯茎肉硬度的下降,抑制马铃薯块茎萌发,从而较好的维持马铃薯品质。
[1] 庞泽,田国奎,王海艳,等.我国马铃薯产业发展现状及展望[J].中国瓜菜,2023,36(7):148-154.
PANG Z,TIAN G K,WANG H Y,et al.Present situation and prospect of potato industry in China[J].China Cucurbits and Vegetables,2023,36(7):148-154.
[2] 卢肖平.马铃薯主粮化战略的意义、瓶颈与政策建议[J].华中农业大学学报(社会科学版),2015(3):1-7.
LU X P.Strategy of potato as staple food:Significance,bottlenecks and policy suggestions[J].Journal of Huazhong Agricultural University (Social Sciences Edition),2015(3):1-7.
[3] 王亮,张新宪,李超,等.不同贮藏温度对晋薯16号马铃薯采后生理及品质变化的影响[J].保鲜与加工,2020,20(5):34-39.
WANG L,ZHANG X X,LI C,et al.Effects of different storage temperatures on post-harvest physiology and quality of potato ‘Jinshu 16’[J].Storage and Process,2020,20(5):34-39.
[4] 王静.能量亏缺对果蔬采后组织衰老、褐变与病害的影响[J].保鲜与加工,2020,20(1):237-242.
WANG J.Effects of energy deficiency on tissue senescence,browning and diseases of postharvest fruits and vegetables[J].Storage and Process,2020,20(1):237-242.
[5] 季超.贮藏温度对不同淀粉含量马铃薯品种加工品质的影响[D].张家口:河北北方学院,2020.
JI C.Effects of storage temperature on processing quality of potato varieties with different starch conten[D].Zhangjiakou:Hebei North University,2020.
[6] MAHTO R,DAS M.Effect of gamma irradiation on the physico-mechanical and chemical properties of potato (Solanum tuberosum L.),cv.‘Kufri Sindhuri’,in non-refrigerated storage conditions[J].Postharvest Biology and Technology,2014,92:37-45.
[7] 袁丽雪,赵愉涵,孙斐,等.香茅精油处理对马铃薯的抑芽作用研究[J].食品与发酵工业,2022,48(23):256-263.
YUAN L X,ZHAO Y H,SUN F,et al.Inhibition effect of citronella essential oil on potato tuber sprout[J].Food and Fermentation Industries,2022,48(23):256-263.
[8] 杨志国,李彩林,王亮.基于高效液相色谱法分析不同品种马铃薯中可溶性糖含量[J].食品研究与开发,2022,43(22):174-181.
YANG Z G,LI C L,WANG L.Soluble sugar content in different varieties of potatoes based on high performance liquid chromatography[J].Food Research and Development,2022,43(22):174-181.
[9] 张晓寒.低氧对采后草莓果实能量代谢和香气物质生物合成的影响[D].锦州:渤海大学,2020.
ZHANG X H.Effects of low oxygen on postharvest energy metabolism and aroma biosynthesis in strawberry fruits[D].Jinzhou:Bohai University,2020.
[10] 刘晶.采后亚硒酸钠处理对菠菜品质和贮藏特性的影响[D].太谷:山西农业大学,2019.
LIU J.Effect of postharvest Na2SeO3 on the quality and storage characteristics in spinach[D].Taigu:Shanxi Agricultural University,2019.
[11] 汪永红,温佳艺,刘顺枝,等.红肉蜜柚果实采后贮藏过程中果皮与汁胞能量代谢的差异[J].食品科学,2022,43(5):235-243.
WANG Y H,WEN J Y,LIU S Z,et al.Difference in energy metabolism between the peel and juice sac of red-fleshed pomelo fruit[J].Food Science,2022,43(5):235-243.
[12] 张群.欧亚种提子类葡萄贮藏期间果实能量亏损与品质劣变机理研究[D].长沙:中南林业科技大学,2018.
ZHANG Q.Study on mechanism of energy loss on quality deterioration of Vitis vinifera L.grape fruit during storage[D].Changsha:Central South University of Forestry &Technology,2018.
[13] 张群,周文化,黄绿红,等.葡萄果实衰老与线粒体内能量和酚类代谢的关系[J].中国食品学报,2017,17(2):160-172.
ZHANG Q,ZHOU W H,HUANG L,et al.Relationship of senescence between mitochondria energy metabolism and phenolic metabolism in post-harvest ‘red globe’ grapes[J].Journal of Chinese Institute of Food Science and Technology,2017,17(2):160-172.
[14] 赵颖颖,陈京京,金鹏,等.低温预贮对冷藏桃果实冷害及能量水平的影响[J].食品科学,2012,33(4):276-281.
ZHAO Y Y,CHEN J J,JIN P,et al.Effect of low temperature conditioning on chilling injury and energy status in cold-stored peach fruit[J].Food Science,2012,33(4):276-281.
[15] JIN P,ZHU H,WANG J,et al.Effect of methyl jasmonate on energy metabolism in peach fruit during chilling stress[J].Journal of the Science of Food and Agriculture,2013,93(8):1827-1832.
[16] 陈京京,金鹏,李会会,等.低温贮藏对桃果实冷害和能量水平的影响[J].农业工程学报,2012,28(4):275-281.
CHEN J J,JIN P,LI H H,et al.Effects of low temperature storage on chilling injury andenergy status in peach fruit[J].Transactions of the Chinese Society of Agricultural Engineering,2012,28(4):275-281.
[17] AAYUSH K,MCCLEMENTS D J,SHARMA S,et al.Innovations in the development and application of edible coatings for fresh and minimally processed Apple[J].Food Control,2022,141:109188.
[18] 姚桂枝.不同处理方式对马铃薯冷害发生影响的研究[D].太谷:山西农业大学,2019.
YAO G Z.Effects of various treatments on chilling injury of potato[D].Taigu:Shanxi Agricultural University,2019.
[19] 解雅晶.马铃薯低温糖化及其机理研究[D].北京:中国农业科学院,2018.
XIE Y J.Mechanism of cold-induced sweetening in potato during postharvest storage[D].Beijing:Chinese Academy of Agricultural Sciences,2018.
[20] LI D,LI L,XIAO G N,et al.Effects of elevated CO2 on energy metabolism and γ-aminobutyric acid shunt pathway in postharvest strawberry fruit[J].Food Chemistry,2018,265:281-289.
[21] 李美玲,林育钊,王慧,等.能量状态在果蔬采后衰老中的作用及其调控研究进展[J].食品科学,2019,40(9):290-295.
LI M L,LIN Y Z,WANG H,et al.Recent advances in the role and regulation of energy status in senescence of harvested fruits and vegetables[J].Food Science,2019,40(9):290-295.
[22] ZHAO H D,JIAO W X,CUI K B,et al.Near-freezing temperature storage enhances chilling tolerance in nectarine fruit through its regulation of soluble sugars and energy metabolism[J].Food Chemistry,2019,289:426-435.
[23] VICHAIYA T,UTHAIBUTRA J,SAENGNIL K.Gaseous chlorine dioxide increases energy status and energy metabolism-related enzyme activities leading to reduction in pericarp browning of longan fruit during storage[J].Scientia Horticulturae,2020,263:109118.
[24] WANG D,MA Q,LI D,et al.Moderation of respiratory cascades and energy metabolism of fresh-cut pear fruit in response to high CO2 controlled atmosphere[J].Postharvest Biology and Technology,2021,172:111379.
[25] 王志华,贾朝爽,王文辉,等.低温贮藏对‘金红’苹果能量代谢和品质的影响[J].园艺学报,2020,47(12):2277-2289.
WANG Z H,JIA C S,WANG W H,et al.Effects of low temperature storage on energy metabolism,related physiology and quality in ‘Jinhong’ apple fruit[J].Acta Horticulturae Sinica,2020,47(12):2277-2289.