罗非鱼营养丰富、肉质鲜嫩、味道鲜美,广受消费者喜爱,但因内源蛋白酶活性较强,在加工、运输、贮藏等过程中易水解和氧化[1]。传统的低温保鲜技术易出现冰晶堆积,造成肌肉收缩及蛋白聚集变性等,导致鱼肉品质变差[2]。通过添加天然抗氧化剂是抑制鱼肉脂肪和蛋白质氧化的有效方法,但一些水溶性天然活性物质(如茶多酚)难以直接添加到油脂食品体系中,限制了其应用[3],为此,各种新型活性包装膜应运而生。研究者们将天然抗氧化剂与可食性包装膜结合制备活性包装膜,可达到有效的抗氧化浓度阈值,并在食品与膜界面实现抗氧化、抑菌作用,保持食品新鲜度,延长货架期[4]。传统方法制备活性包装膜主要以单一抗氧化剂为主,因其时效短、广谱性差以及合成复杂等问题,使用过程中无法达到理想的效果。研究表明,通过将不同抗菌、抗氧化剂复配可得到兼具安全性、广谱性、稳定性和高效抗菌性的复合型保鲜剂[2]。
葡萄籽提取物(grape seed extraction,GSE)是食品加工过程中的副产品,含丰富的酚类物质[5],其抗氧化能力分别是维生素E的20倍、维生素C的50倍,是廉价的天然抗氧化剂来源[6]。GSE抗氧化活性的多重机制主要表现在清除自由基的能力、金属螯合作用以及与其他抗氧化剂的协同作用等方面。茶多酚(tea polyphenols,TP)类物质是茶叶中多羟基酚类化合物的总称,具有抗氧化、抗辐射等多种功能,是一种新型的天然抗氧化、抗菌剂[7]。二者均在食品保鲜领域具有较高的应用价值。许宝琛等[5]在牛肉馅中添加茶多酚、葡萄籽提取物和海藻糖提高了肉馅的保水性,质构变化程度小,抑制了感官品质劣变。余小亮等[8]以茶多酚、肉桂精油复配,所制备出的复合保鲜剂具较强抗氧化活性,并对金黄色葡萄球菌有较好抑菌效果。都津铭等[9]将丁香精油和茶多酚复合得到复合抗菌液,结果表明二者以一定比例的复配具有协同抑菌效果。
目前,关于GSE和TP两者复配制备可食性活性包装膜的研究鲜有报道。基于此,本文以海藻酸钠(sodium alginate,SA)、纳米纤维(nanofiber,NCC)作为膜基材,GSE、TP复合制备可食性活性包装用于罗非鱼保鲜,研究贮藏过程中鱼肉品质指标及肌原纤维蛋白氧化指标的变化,并分析复合膜对鱼肉的保鲜效果,为新型可食性活性包装膜的开发及鱼肉的贮藏保鲜提供新途径。
1 材料与方法
1.1 材料与试剂
新鲜罗非鱼,云南省昆明市盘龙区农贸市场;葡萄籽提取物(食品级),西安齐岳生物科技有限公司;纳米纤维(20~50 nm),中山纳纤丝新材料有限公司;茶多酚(HPLC≥97%)、海藻酸钠、硫代巴比妥酸(thiobarbituric acid,TBA)、2,4-二硝基苯肼、2-二硝基苯甲酸、溴酚蓝、盐酸胍、考马斯亮蓝、酒石酸钾钠、乙酸乙酯、三氯乙酸、乙二胺四乙酸二钠均为分析纯,上海麦克林生化科技有限公司;丙三醇、磷酸氢二钠、磷酸二氢钾、氯化钠、甲基红、亚甲基蓝均为分析纯,广东光华科技股份有限公司;平板计数琼脂,国药集团化学试剂有限公司。
1.2 仪器与设备
FJ200-SH高速分散均质机,上海沪析实业有限公司;A300Plus电子搅拌器,上海欧河机械设备有限公司;HSP-80B恒温恒湿箱,上海坤天实验室仪器有限公司;101-2AB电热鼓风干燥箱,天津市泰斯特仪器有限公司;TGL16M离心机,上海赫田科学仪器有限公司;UV-2600紫外可见分光光度计,日本岛津公司。
1.3 实验方法
1.3.1 可食性活性包装膜的制备
取4.5 g NCC于烧杯中,加入50 mL蒸馏水,450 W超声20 min得NCC悬浮液;同时取1.0 g SA于50 mL蒸馏水中,60 ℃,1 200 r/min搅拌均匀得SA溶液。将上述2种溶液以等体积比混匀后加入0.8% (质量分数)的复合保鲜溶液[m(GSE)∶m(TP)=2∶1,后文简称为GT],1 200 r/min磁力搅拌至混合均匀,超声30 min并静置消泡得成膜液。取15.0 g成膜液倒入9 cm聚四氟乙烯(poly tetra fluoroethylene,PTFE)皿中流延成膜,置于45 ℃烘箱干燥15 h得GT-SA-NCC复合膜。干燥后的膜样品置于恒温恒湿培养箱(25 ℃、相对湿度50%)平衡48 h。以相同方法制备不含复合保鲜液的NCC-SA膜。
1.3.2 样品预处理
将新鲜罗非鱼宰杀,去除头、鳞、内脏(“三去”),切片后洗净,置于紫外超净工作台上,用无菌水洗涤,并用滤纸沥干。称取40.0 g鱼肉装于70 mm×40 mm称量皿中,用复合膜密封皿口,4 ℃冰箱贮藏8 d,每隔2 d测定鱼肉各项生理指标的变化。试验设3个处理,分别为对照(CK)组(无密封,敞口保存)、SA-NCC膜处理组以及GT-SA-NCC膜处理组。
1.3.3 鱼肉持水力的变化
鱼肉持水力根据贮藏期间质量差按公式(1)计算[3]:
持水力![]()
(1)
式中:m1为贮藏后鱼肉重量,g;m2为新鲜鱼肉重量,g。
1.3.4 鱼肉pH值的测定
鱼肉pH值测定参考GB 5009.237—2016《食品pH值的测定》。准确称取5 g鱼肉绞碎后置于锥形瓶中,加入45 mL蒸馏水,静置30 min后测定pH值。
1.3.5 鱼肉TBA值的测定
TBA值的测定参考窦川林[3]的方法。准确称取10 g鱼肉样品,绞碎,加入25 mL 200 g/L三氯乙酸溶液,20 mL蒸馏水,10 000 r/min匀质60 s,4 ℃离心10 min(5 500 r/min)。吸取2.00 mL上清液于25 mL比色管中,加入2 mL TBA溶液(0.02 mol/L),沸水浴20 min,冷却至室温,532 nm和600 nm处测定吸光值。以2 mL三氯乙酸-水(体积比为1∶1)为空白。TBA值按公式(2)计算:
(2)
式中:A532为待测液在532 nm处的吸光值;A600为待测液在600 nm处的吸光值;155为丙二醛摩尔消光系数,L/(mol·cm);72.6为丙二醛相对分子质量;10为样品质量,g。
1.3.6 鱼肉挥发性盐基氮(total volatile basic nitrogen,TVB-N)的测定
TVB-N测定参考GB 5009.228—2016《食品中挥发性盐基氮的测定》。准确称取10 g鱼肉搅碎,加入100 mL 20 g/L三氯乙酸溶液(2%),摇匀并静置15 min,8 000 r/min离心10 min,取上清液备用。测定时安装好半微量凯式定氮装置,清洗并做好密封性检查。准确吸取10 mL样品液注入反应室,以10 mL蒸馏水洗涤管壁,再注入5 mL 10 g/L氯化镁混悬液,塞紧棒状玻塞,玻杯内注入少量水以防漏气。接收瓶内加入10 mL硼酸溶液(2%,体积分数)及3~5滴甲基红-亚甲基蓝混合指示剂,冷凝管下端插入液面下,夹紧螺旋夹,开始蒸馏,5 min后移动接收瓶,使冷凝管离开液面,继续蒸馏1 min。少量水冲洗冷凝管下端,取下接收瓶,以0.01 mol/L盐酸标准滴定液滴定至蓝紫色。鱼肉TVB-N含量按公式(3)计算:
(3)
式中:V1为测定样液消耗盐酸标准液的体积,mL;V2为空白消耗盐酸标准液的体积,mL;c为盐酸标准液的浓度,mol/L;m为试样质量,g;14为与1 mL盐酸标准滴定溶液相当的氮的含量,mg;10为样品质量,g;100为三氯乙酸溶液体积,100 mL。
1.3.7 鱼肉菌落总数的测定
鱼肉菌落总数的测定参考GB 4789.2—2016《食品微生物学检验菌落总数测定》。称取10 g鱼肉绞放于灭菌烧杯中并加入90 mL灭菌生理盐水,均质30 s,以10倍梯度依次稀释,选择3个适宜的稀释度,用移液枪各取1 mL稀释液分别涂布于已灭菌的计数琼脂平板,36 ℃恒温培养48 h,平板计数法测定菌落总数。以灭菌的生理盐水做空白对照实验。
1.3.8 鱼肉肌原纤维蛋白的提取
取5 g鱼肉绞碎样品,加入20 mL Tris-HCl缓冲提取液(20 mmol/L,pH 7.2),高速均质2 min,4 ℃冷冻离心20 min(8 000 r/min),去上清液。沉淀与20 mL提取液混合,离心,重复2次。取沉淀加入15 mL含0.6 mol/L NaCl的Tris-HCl缓冲液(20 mmol/L,pH 7.2),4 ℃静置提取60 min后,冷冻离心20 min(8 000 r/min),上清液即为鱼肉纤维蛋白溶液[10-11]。
肌原纤维蛋白含量的测定:取1 mL肌原纤维蛋白溶液于10 mL比色管中,加入4 mL双缩脲试剂,混匀,室温静置30 min,540 nm处测定吸光值。参照蛋白标准曲线(Y=0.048 5X+0.118 4,R2=0.999 3)计算其肌原纤维蛋白溶液浓度。
1.3.9 鱼肉肌原纤维蛋白溶解度的测定
溶解度的测定参考蓝蔚青等[12]的方法。准确称取1 g肌原纤维蛋白,加入20 mL含0.6 mol/L NaCl的Na2HPO4缓冲液(50 mmol/L,pH 6.25),混匀使其充分溶解,测定蛋白溶液浓度,4 ℃冷冻离心15 min(5 000 r/min),取上清液测定蛋白溶液质量浓度。鱼肉肌原纤维蛋白溶解度按公式(4)计算:
溶解度![]()
(4)
式中:A1为离心前鱼肉蛋白溶液质量浓度,mg/mL;A2为离心后蛋白溶液质量浓度,mg/mL。
1.3.10 鱼肉肌原纤维蛋白巯基含量的测定
巯基含量的测定参考WANG等[13]的方法,略作修改。取1 mL肌原纤维蛋白溶液(含量为5 mg/g)于25 mL比色管中,加入9 mL含0.6 mol/L KCl,10 mmol/L EDTA,8 mol/L尿素的磷酸盐缓冲液(50 mmol/L,pH 7.0),旋涡振荡摇匀,取5 mL于10 mL比色管中,加入0.5 mL DTNB溶液(准确称取396 mg DTNB,用0.1 mol/L,pH 7.0的磷酸盐缓冲液定容至100 mL),25 ℃静置25 min,412 nm处测定吸光值。鱼肉肌原纤维蛋白巯基含量按公式(5)计算:
巯基含量![]()
(5)
式中:A为吸光值;ε为巯基浓度的摩尔吸光系数,13 600 L/(mol·cm);C为肌原纤维蛋白质量浓度,5 mg/mL。
1.3.11 鱼肉肌原纤维蛋白羰基含量的测定
羰基含量的测定参考张慧芸等[14]的方法,略作修改。取1 mL肌原纤维蛋白溶液(质量浓度为2 mg/mL)于10 mL比色管中,加入1 mL DNPH溶液(10 mmol/L),旋涡振荡摇匀,室温避光静置60 min,加入1 mL 200 g/L三氯乙酸溶液,12 000 r/min冷冻离心3 min,去上清液,沉淀用1 mL等体积比混合的乙酸乙酯-乙醇溶液洗涤3次,加入3 mL盐酸胍溶液(6 mol/L),37 ℃水浴15 min使沉淀溶解,12 000 r/min离心3 min,取上清液370 nm处测定吸光值。鱼肉肌原纤维蛋白羰基含量按公式(6)计算:
羰基含量![]()
(6)
式中:A为吸光值;ε为羰基浓度的摩尔吸光系数,22 000 L/(mol·cm);B为吸收池光程长度,10 mm。
1.3.12 鱼肉肌原纤维蛋白表面疏水性的测定
表面疏水性的测定参考张雪春等[15]的方法,略作修改。取1 mL肌原纤维蛋白样液于25 mL比色管中,加入200 μL溴酚蓝溶液(1 mg/mL),旋涡振荡摇匀,8 000 r/min离心10 min,取上清液稀释10倍,595 nm处测定吸光值A1,磷酸盐缓冲液代替样液测定吸光值A2。鱼肉肌原纤维蛋白表面疏水性按公式(7)计算:
溴酚蓝![]()
(7)
1.4 数据处理
所有试验均设3组平行,利用软件IBM SPSS Statistics 26进行数据分析,软件GraphPad Prism 9.3.1进行绘图。
2 结果与分析
2.1 贮藏过程中鱼肉的品质特性
2.1.1 贮藏过程中鱼肉持水力的变化
贮藏时间内CK组、SA-NCC组、GT-SA-NCC组鱼肉持水率的变化如图1所示。随着贮藏时间的延长,鱼肉持水率均持续降低。主要是因为随着时间的延长,鱼肉体内微生物的生长繁殖及复杂的生化反应,导致鱼肉蛋白氧化分解,肌肉组织结构破坏,鱼肉弹性、持水力降低[16]。与CK组相比,SA-NCC组、GT-SA-NCC组持水力的下降趋势较慢。贮藏初期(0 d),CK组、SA-NCC组、GT-SA-NCC组持水率均为100%,贮藏第8天分别降至66.19%、80.70%、85.18%。原因为膜具有一定阻隔性能,可有效减少水蒸气、氧气透过率。GT-SA-NCC组由于GSE、TP具有一定的抗氧化、抗菌能力,可延缓鱼肉脂质和蛋白氧化分解的速度,延缓了持水率的下降。

图1 贮藏过程中鱼肉持水力的变化
Fig.1 Changes of water holding capacity of fish during storage
2.1.2 贮藏过程中鱼肉pH值的变化
贮藏时间内CK组、SA-NCC组、GT-SA-NCC组鱼肉pH值的变化如图2所示。随着贮藏时间的延长,鱼肉pH值均呈先减小后增加的趋势。贮藏初期(0~2 d),由于鱼肉体内糖原无氧酵解产生乳酸,以及腺苷三磷酸(adenosine triphosphoric acid,ATP)经三羧酸循环产生的有机酸,导致pH值下降[17]。贮藏后期(2~8 d),蛋白质在内源酶的作用下分解为小分子肽和碱性氨基酸,后又因微生物作用分解为氨与三甲胺等碱性物质,导致pH上升,加速鱼体腐败[18]。与CK组相比,SA-NCC组pH值上升缓慢,贮藏8 d后pH值为6.69低于CK组(6.96)。原因为经膜覆盖可有效降低氧气与鱼体的接触,延缓鱼体腐败。GT-SA-NCC组缓慢下降第4天时pH达到最低,且上升速度最慢,贮藏8 d后pH值为6.58。原因为TP、GSE的加入可抑制糖原酵解中磷酸化酶的酶活,降低乳酸的生成。此外,TP、GSE具有抗菌、抗氧化作用,有利于抑制微生物生长繁殖,延缓鱼体蛋白及脂质氧化,从而降低碱性物质的生成。

图2 贮藏过程中鱼肉pH值的变化
Fig.2 Changes of pH value of fish during storage
2.1.3 贮藏过程中鱼肉TBA值的变化
鱼肉在贮藏过程中由于微生物、酶、空气等因素导致不饱和脂肪酸氧化,产生油脂氧化产物,并进一步降解为醛、酮等物质,导致鱼肉酸败、TBA值上升[19]。因此,TBA值是评价脂肪氧化程度的重要指标。贮藏过程中CK组、SA-NCC组、GT-SA-NCC组鱼肉TBA值的变化如图3所示。随着贮藏时间的延长,所有鱼肉处理组TBA值均持续上升。CK组鱼肉的TBA上升最快,经膜覆盖处理鱼肉的TBA上升速度明显减缓。新鲜鱼肉的TBA值为2.38 mg/100 g,CK组贮藏8 d后TBA值上升至18.14 mg/100 g,此时鱼体已经腐败,不可食用。而其他处理组贮藏期间TBA值均低于CK组,GT-SA-NCC组始终保持最低(2.38~11.37 mg/100 g)。分析认为,GSE、TP加入使膜具有抗氧化和抗菌性能,能抑制鱼体内脂肪的氧化,抑制鱼肉变质腐败,保证鱼肉的优良品质,延长其货架期。
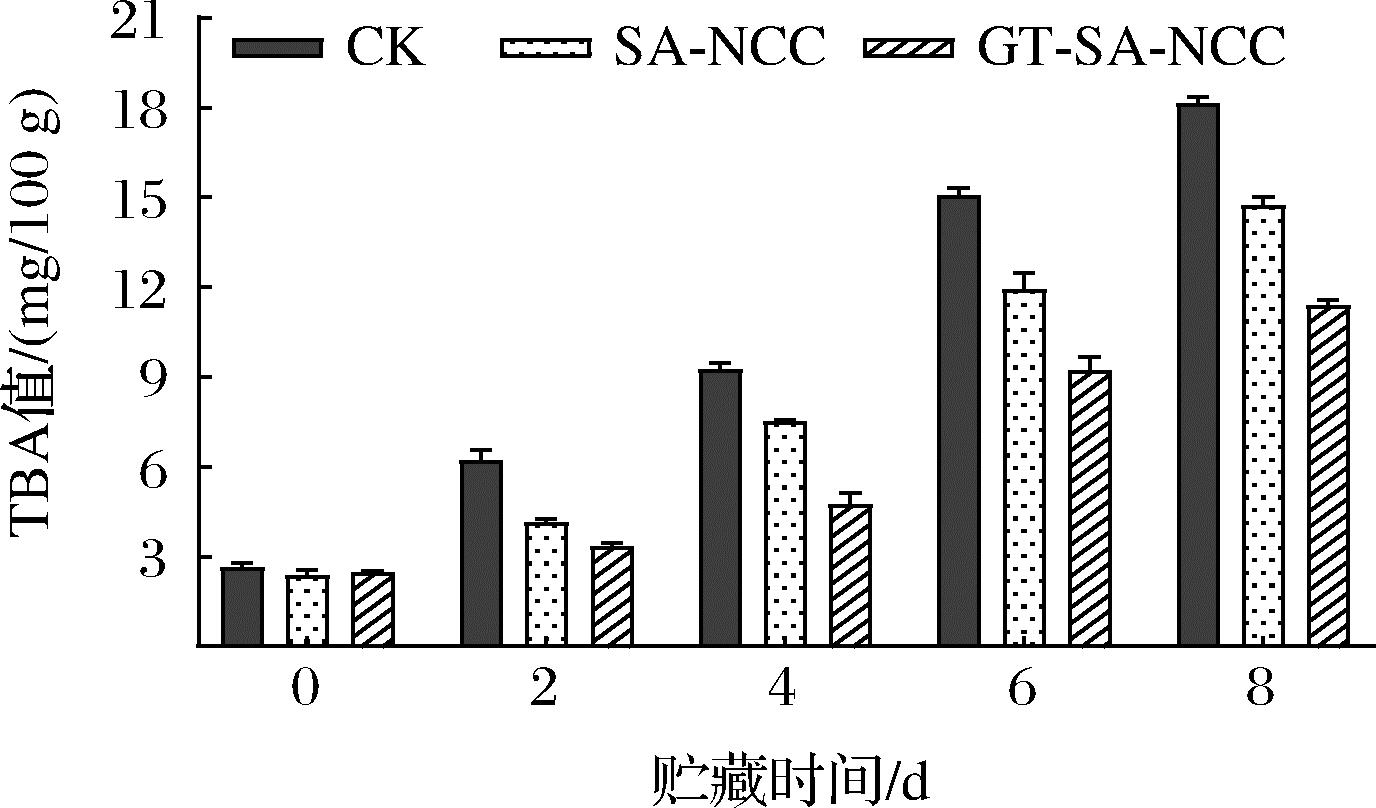
图3 贮藏过程中鱼肉TBA值的变化
Fig.3 Changes of TBA value of fish during storage
2.1.4 贮藏过程中鱼肉TVB-N值的变化
贮藏过程中,由于微生物及内源酶作用,鱼体蛋白氧化分解为氨与胺类化合物,即TVB-N,其含量变化与新鲜度相关性较高,已被用于我国水产品新鲜度的鉴定标准[1]。GB/T 18108—2019《食品安全国家标准 鲜海水鱼通则》指出,鲜海水鱼肉TVB-N值≤15 mg/100 g时为优级品,合格品不超过30 mg/100 g。贮藏时间内CK组、SA-NCC组、GT-SA-NCC组鱼肉TVB-N值的变化如图4所示。新鲜鱼肉的TVB-N值为5.367 mg/100 g,为优级品。随着贮藏时间的延长,所有处理组鱼肉的TVB-N均呈上升趋势。贮藏第8天,CK组TVB-N值接近合格品限值,有明显的胺臭味,说明鱼体已腐败变质失去食用价值。SA-NCC组、GT-SA-NCC组TVB-N值仍维持在优级品限值内,GT-SA-NCC组TVB-N值上升最慢。主要是由于TP、GSE的加入使膜具有一定的抑菌和抗氧化作用,在一定时间内能有效抑制微生物的生长代谢及鱼体蛋白的氧化分解,延缓鱼体品质的劣变。

图4 贮藏过程中鱼肉TVB-N的变化
Fig.4 Changes of TVB-N of fish during storage
2.1.5 贮藏过程中鱼肉菌落总数的变化
菌落总数是用来判定食品被细菌污染的程度及卫生质量的一个重要参数,它能够反映食品在生产过程中是否符合卫生要求,以便对食品做出适当的卫生学评价。在水产品中菌落总数是判断新鲜程度的一个重要指标。贮藏时间内CK组、SA-NCC组、GT-SA-NCC组鱼肉菌落总数的变化如图5所示,随着贮藏时间的延长,所有处理组的鲢鱼肉的菌落总数呈上升趋势,且各组在0~4 d上升缓慢,4~8 d上升幅度较大。CK组、SA-NCC组在贮藏4 d时菌落总数分别达到7.46、6.79 lg CFU/g,均超过SC/T 3117—2006中规定菌落总数限值(4 lg CFU/g),鱼肉已经失去食用价值。GT-SA-NCC组在贮藏6 d后菌落总数仅4.08 lg CFU/g。由菌落总数这一指标可判定,普通冷藏鱼肉的贮藏期限为3~4 d,GT-SA-NCC膜包封处理后贮藏期限为5~6 d。说明GSE和TP在一定时间内能有效抑制微生物的生长繁殖,延缓鱼体品质的劣变。对比其他理化指标,SA-NCC组菌落总数与CK组区别不大,这是因为SA-NCC膜具有一定阻隔作用,可一定程度延缓鱼肉因环境造成的氧化变质,但本身无抗菌作用,对微生物的抑制作用较小。
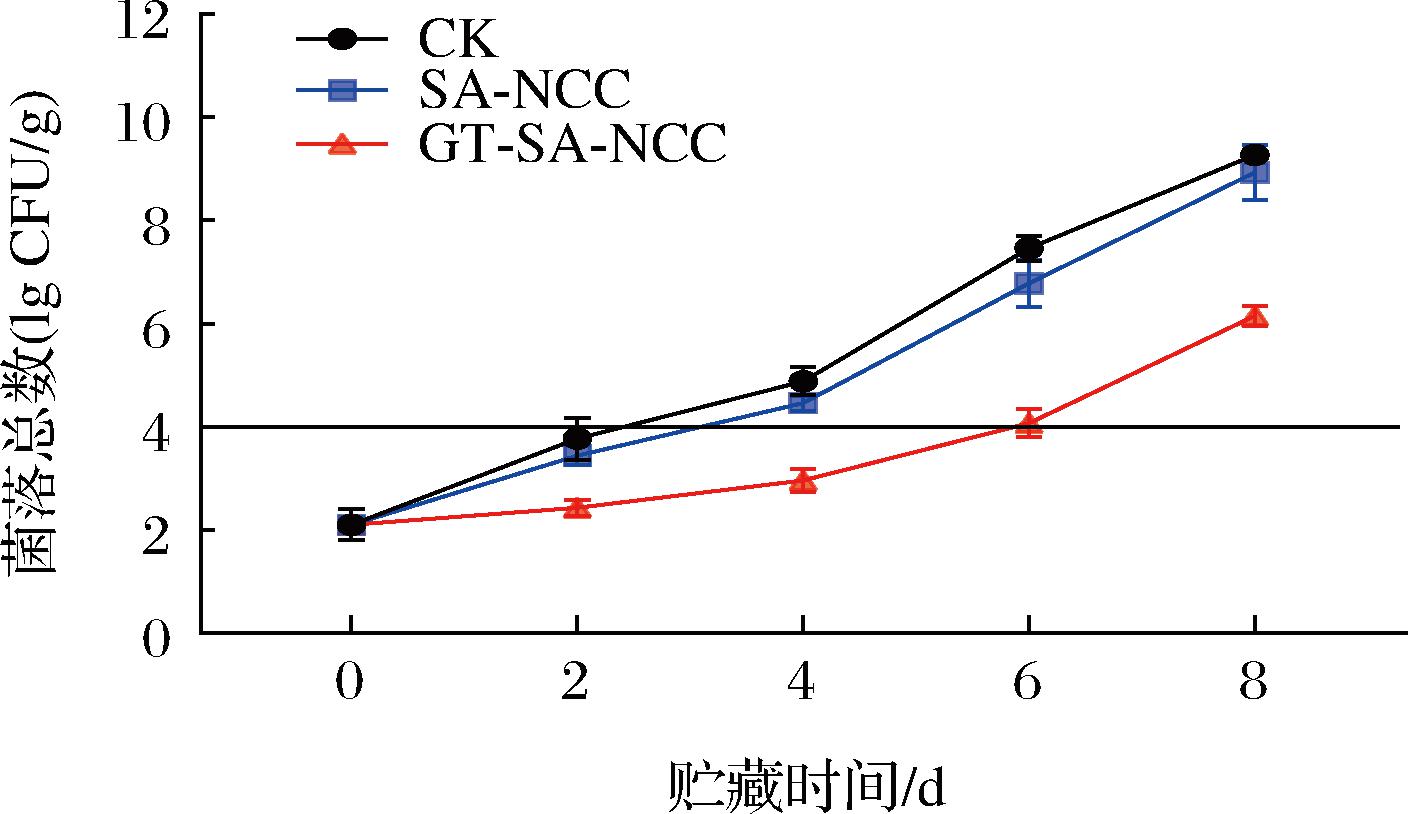
图5 贮藏过程中鱼肉菌落总数的变化
Fig.5 Changes of total bacteria count of fish during storage
2.2 贮藏过程中鱼肉肌原纤维蛋白的氧化变性
2.2.1 贮藏过程中鱼肉肌原纤维蛋白溶解度的变化
鱼肉蛋白质的功能性质主要由肌原纤维蛋白决定,其溶解度的变化可一定程度反映鱼肉蛋白变性的情况。贮藏时间内CK组、SA-NCC组、GT-SA-NCC组肌原纤维蛋白溶解度的变化如图6所示。随着贮藏时间的延长,鱼肉肌原纤维蛋白溶解度均持续下降。其原因为,贮藏过程中,鱼肉肌原纤维蛋白氧化变性形成碱溶性大分子蛋白聚集体,这些大分子蛋白在高离子的微环境作用下溶解度降低。同时,由于蛋白氧化,巯基形成二硫键导致肌球蛋白重链聚合,降低其溶解度[20]。此外,在冷藏过程中,蛋白质与结合水间的结合状态被破坏,蛋白质分子间作用增强,蛋白质与水间的相互作用减弱,导致蛋白质疏水基团暴露,疏水相互作使其产生凝聚和沉淀,导致溶解度降低。贮藏期间,SA-NCC组、GT-SA-NCC组溶解度均低于CK组,GT-SA-NCC组始终保持最低。贮藏8 d后,CK组、SA-NCC组、GT-SA-NCC组溶解度分别为40.54%、43.96%、49.31%,分别下降了25.59%、22.17%、16.82%。说明活性物质GSE、TP的加入,使膜本身具有一定的抗氧化和抑菌作用,对抑制鱼体自身氧化及微生物的生长有较好的效果,从而延缓鱼肉肌原纤维蛋白溶解度的降低。
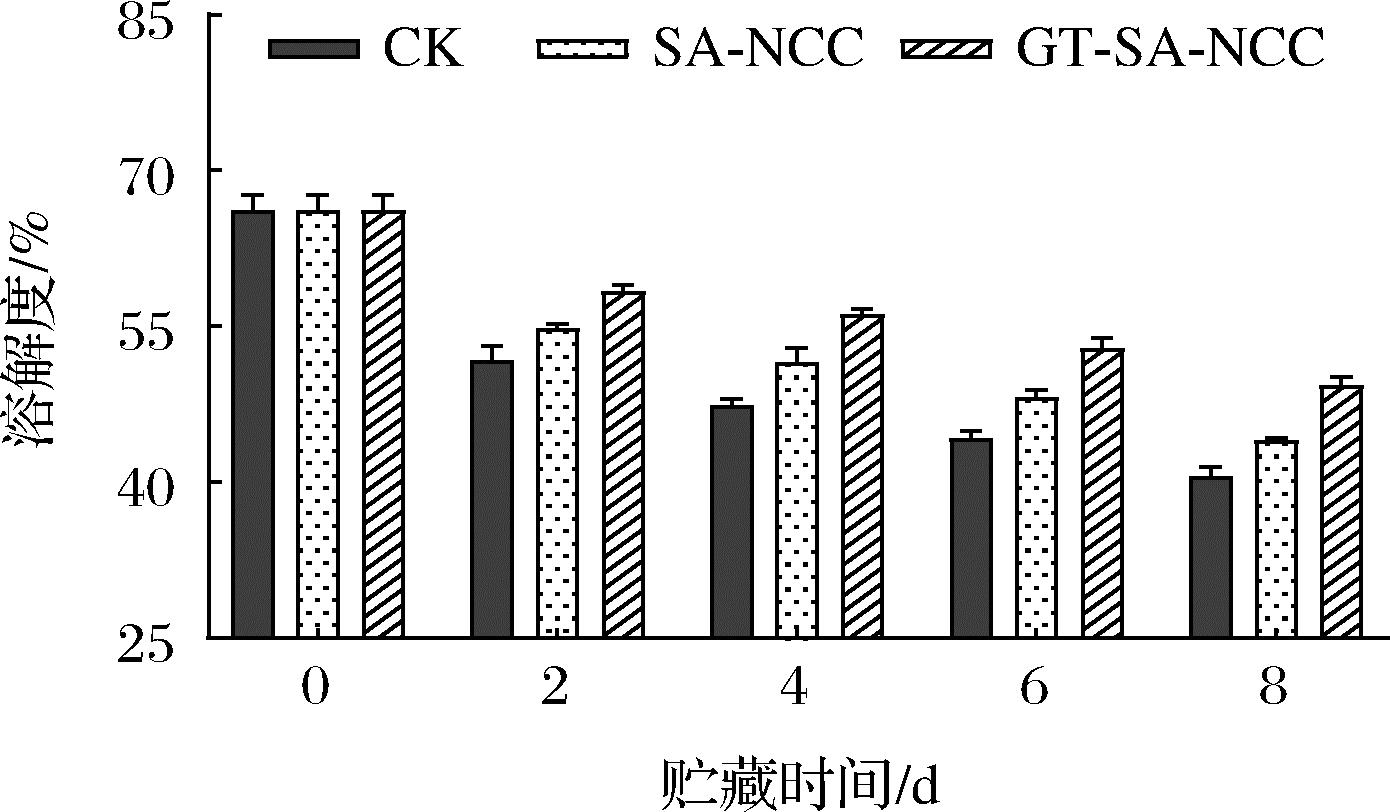
图6 贮藏过程中鱼肉肌原纤维蛋白的变化
Fig.6 The solubility changes of myogenic fibrillar protein from fish during storage
2.2.2 贮藏过程中鱼肉肌原纤维蛋白巯基含量的变化
巯基是鱼肉蛋白质分子中反应活性较高的基团之一,蛋白质巯基上的硫外层具有较多的孤对电子,亲核性很强,对氧化反应较为敏感。此外,巯基还与ATPase活性、肌球蛋白重链的氧化、二聚物的形成、以及蛋白质的聚合和变性关系密切。因此,巯基含量的变化是反映鱼肉肌原纤维蛋白氧化变性程度的一个重要指标。贮藏时间内CK组、SA-NCC组、GT-SA-NCC组鱼肉肌原纤维蛋白巯基含量的变化如图7所示。随着贮藏时间的延长,肌原纤维蛋白中巯基含量均呈不同程度的下降趋势。这是因为贮藏期间,鱼肉因体内微生物生长代谢及自溶酶作用,促使蛋白空间构象变化,隐藏在分子内部及分布在肌球蛋白头部的巯基暴露并氧化形成二硫键[21]。贮藏期间,SA-NCC组、GT-SA-NCC组巯基含量均低于CK组,GT-SA-NCC组疏基含量始终保持最低。原因为经膜密封处理后,可一定程度隔绝氧气、水蒸气延缓鱼体自身蛋白氧化。贮藏8 d后,CK组、SA-NCC组、GT-SA-NCC组巯基含量分别为5.70、8.09、11.35 nmol/mg,分别降低了15.33、11.95、15.33 nmol/mg。说明活性物质GSE、TP的加入,使膜本身具有一定的抗氧化和抑菌作用,同时随着贮藏时间的延长,活性物质缓慢释放,可一定程度抑制鱼体自身氧化及微生物的生长,从而延缓鱼体巯基氧化。
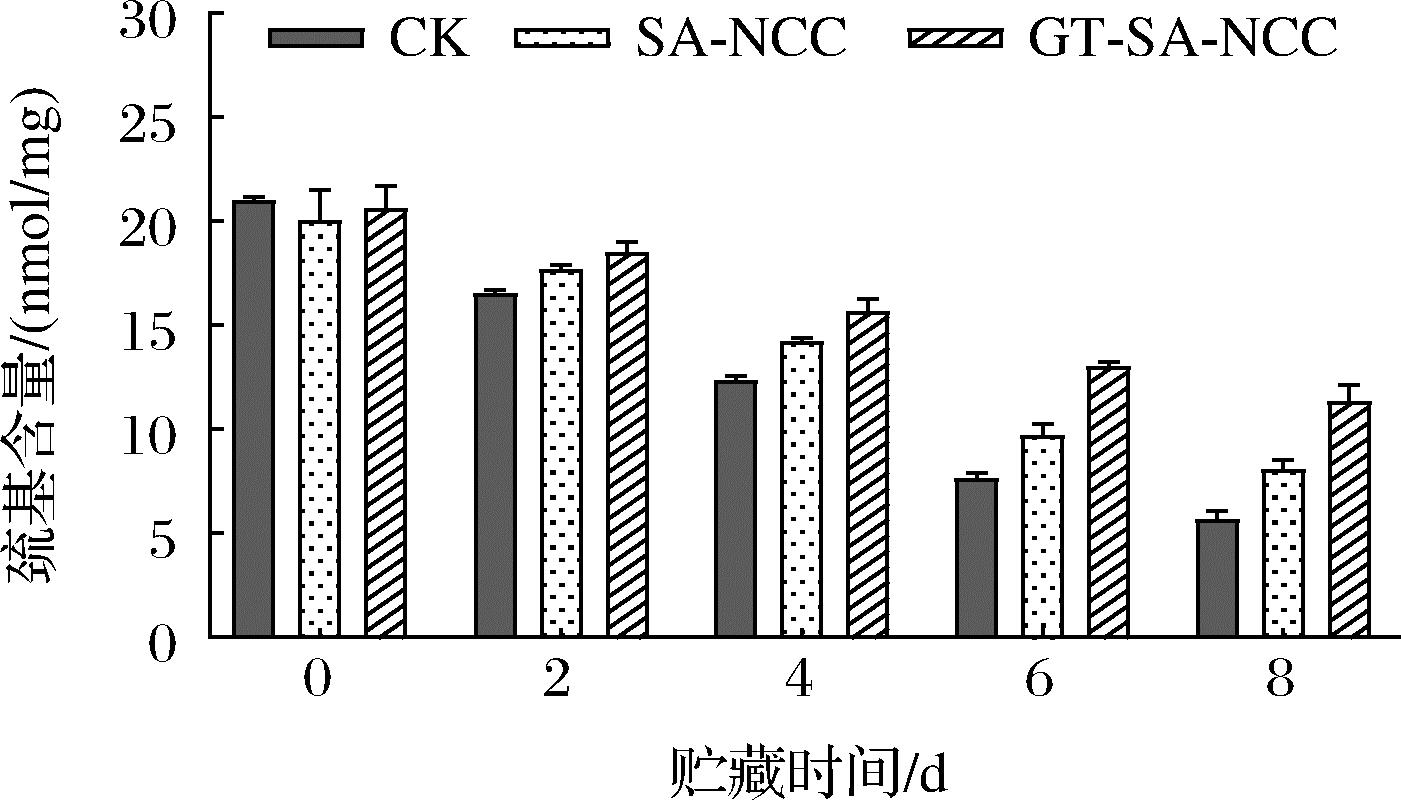
图7 贮藏过程中鱼肉肌原纤维蛋白巯基含量的变化
Fig.7 Changes in myogenic fibronectin sulfhydryl content of fish during storage
2.2.3 贮藏过程中鱼肉肌原纤维蛋白羰基含量的变化
羰基化反应是蛋白质发生的一种不可逆非酶修饰,其中氧化应激和其他机制也能诱导羰基分子的形成。羰基含量变化也是用来反映蛋白氧化变性程度的重要指标之一[14]。贮藏时间内CK组、SA-NCC组、GT-SA-NCC组鱼肉肌原纤维蛋白羰基含量的变化如图8所示。随着贮藏时间的延长,所有处理组肌原纤维蛋白中羰基含量均呈不同程度的上升趋势。原因主要是随着贮藏时间的延长,氨基酸侧链直接氧化、氨基酸与次级氧化产物如丙二醛共价结合以及多肽骨架的氧化断裂等多种脱氨反应途径生成羰基化合物(醛和酮)[13]。贮藏期间,SA-NCC组、GT-SA-NCC组羰基含量均低于CK组,GT-SA-NCC组羰基含量始终保持最低。贮藏8 d后,CK组、SA-NCC组、GT-SA-NCC组羰基含量分别为29.39、26.40、23.86 μmol/L,分别增加了14.12、11.16、8.62 μmol/L。说明膜的阻隔性能可以有效延缓鱼体自身蛋白氧化,同时活性物质GSE、TP的加入,使膜本身具有一定的抗氧化和抑菌作用,同时随着贮藏时间的延长,活性物质缓慢释放,可一定程度抑制鱼体自身氧化及微生物的生长,从而延缓羰基化合物的生成。
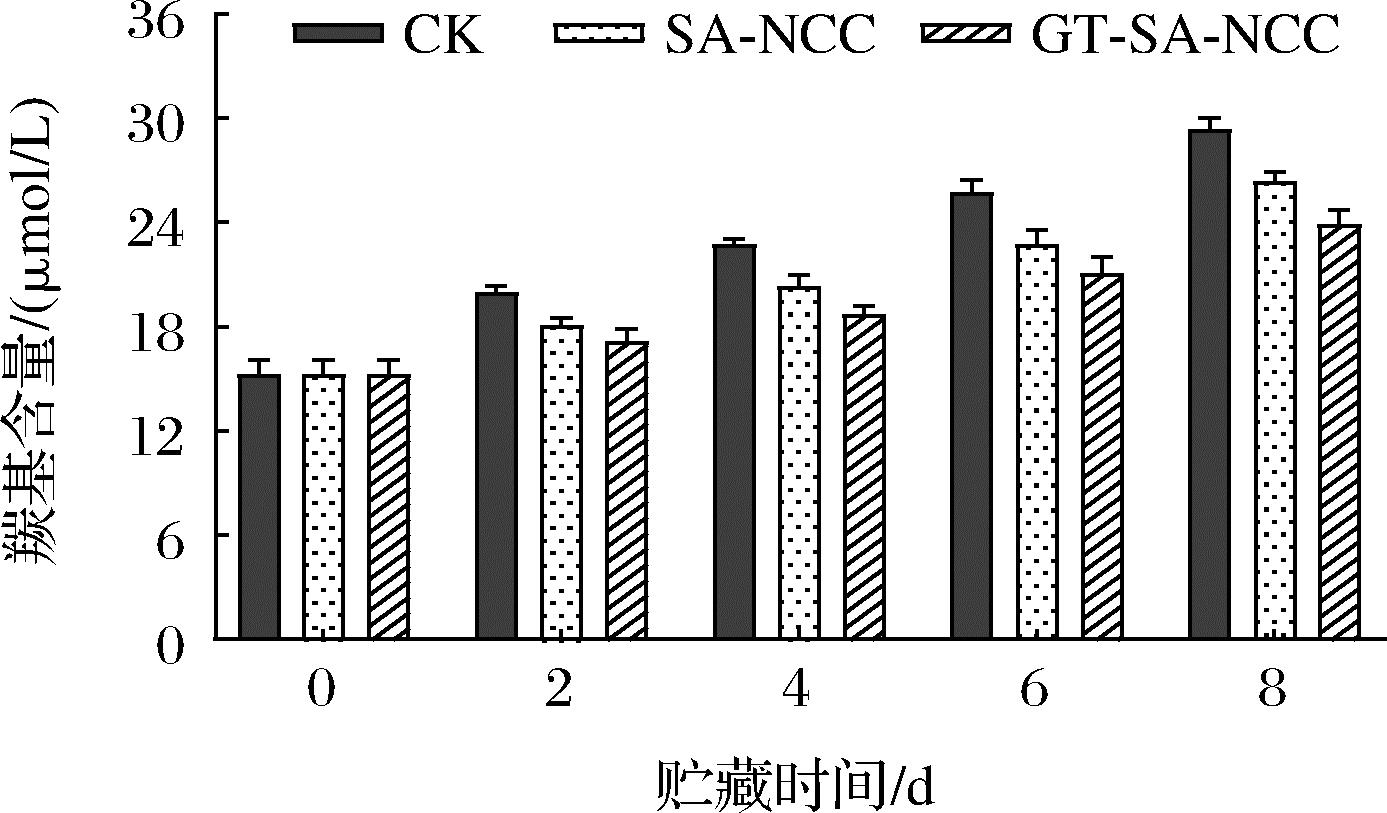
图8 贮藏过程中鱼肉肌原纤维蛋白羰基含量的变化
Fig.8 Changes in the carbonyl content of myofibrillar protein in fish during storage
2.2.4 贮藏过程中鱼肉肌原纤维蛋白表面疏水性的变化
表面疏水性是指蛋白质分子内部疏水性氨基酸聚集所形成的疏水力。研究指出,因蛋白质变性致使空间构象改变,原先隐藏于蛋白质分子内部的疏水性氨基酸暴露在分子表面,导致蛋白质表面疏水性变化[22]。因此,表面疏水性可用于表征蛋白的构象和氧化变性程度。贮藏时间内CK组、SA-NCC组、GT-SA-NCC组鱼肉肌原纤维蛋白表面疏水性的变化如图9所示。随着贮藏时间的延长,所有处理组鱼肉肌原表面疏水性均持续上升。这可能是由于在冷藏过程中,鱼肉蛋白氧化引起分子内部空间构想改变,隐藏于蛋白质分子内部的疏水性氨基酸持续暴露引起。这与卢涵[23]研究的鳙鱼肌原纤维蛋白表面疏水性变化趋势一致。CK组上升最快,GT-SA-NCC组较为缓慢,且贮藏期间表面疏水性保持最低。贮藏8 d后,CK组、SA-NCC组、GT-SA-NCC组溴酚蓝结合量分别为64.61、58.63、64.61 μg,分别增加了37.35、31.37、24.01 μg。说明GSE、TP的加入使膜有效抑制蛋白氧化变性,减少内部的疏水性氨基酸的暴露,延缓蛋白表面疏水性上升,延长了产品货架期。
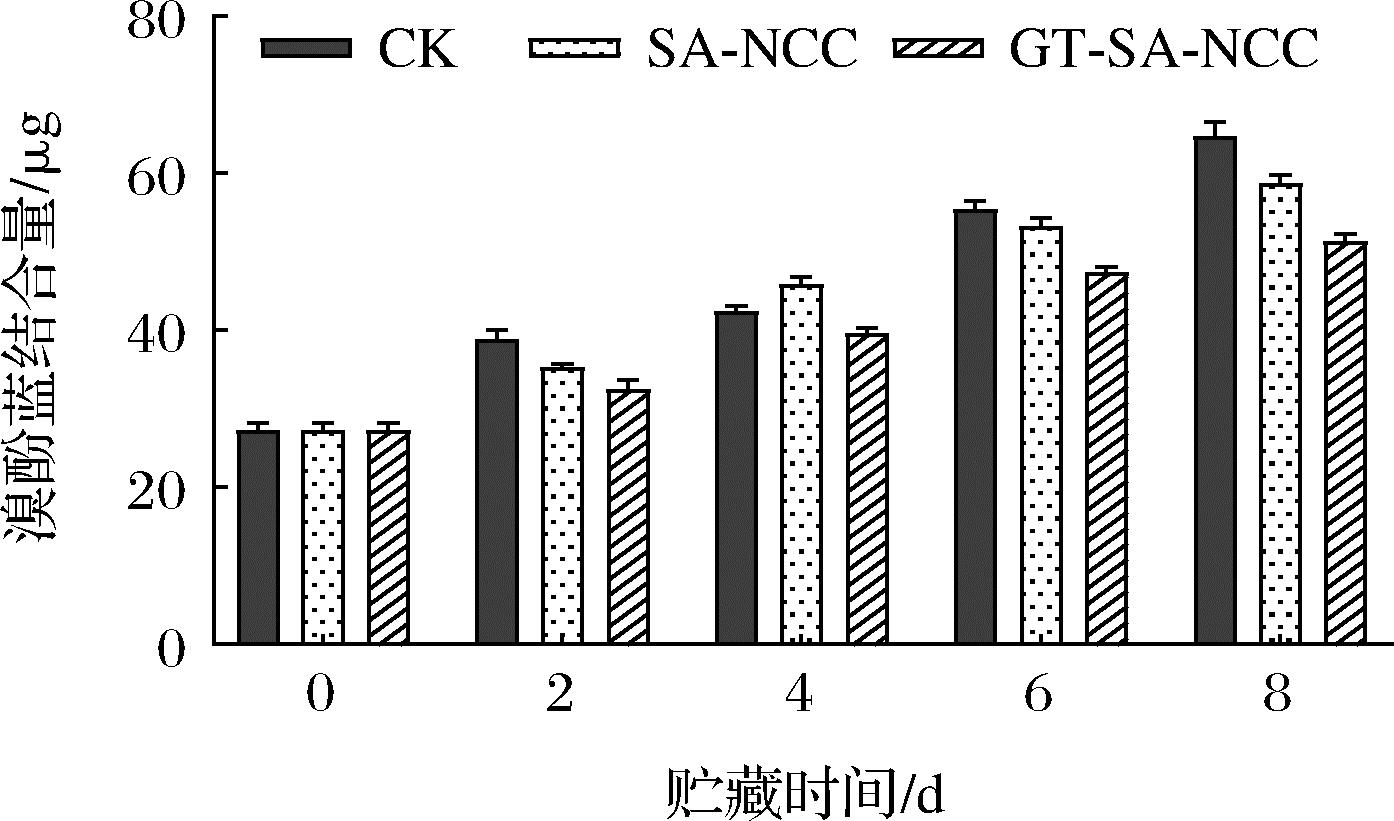
图9 贮藏过程中鱼肉肌原纤维蛋白表面疏水性的变化
Fig.9 Changes in hydrophobicity of fish myofibrillar protein surface during storage
3 结论
本试验以海藻酸钠(SA)、纳米纤维(NCC)为基材,添加葡萄籽提取物(GSE)、茶多酚(TP)复合保鲜剂制备活性包装膜用于罗非鱼保鲜。结果表明,与CK、SA-NCC组相比,GT-SA-NCC处理有利于保持鱼肉水分,抑制pH值、TBA值、TVB-N值升高,降低鱼肉的菌落总数;同时,抑制鱼肉肌原纤维蛋白地氧化变性、延缓溶解度、抑制巯基含量的降低以及羰基含量、表面疏水性的增加。说明添加GSE、TP所制备的活性包装膜有利于延缓罗非鱼脂质及蛋白氧化,对维持鱼肉贮藏过程中的品质特性及蛋白的功能性质具有较理想的效果,在水产品及肉制品加工贮藏过程中具有一定的运用潜力。
[1] 单梦圆,宋琳璐,胡奇杰,等.基于鱼鳞明胶的可食性保鲜膜对金枪鱼肉的保鲜作用研究[J].核农学报,2019,33(6):1137-1145.
SHAN M Y,SONG L L,HU Q J,et al.Effect of fish scale gelatin-based films on the preservation of fresh tuna meat[J].Journal of Nuclear Agricultural Sciences,2019,33(6):1137-1145.
[2] 曲宝宝.应用茶多酚和葡萄籽提取物提高速冻水饺牛肉馅品质的技术研究[D].泰安:山东农业大学,2020.
QU B B.Technical study on improving the quality of beef stuffing of quick-frozen dumplings by using tea polyphenols and grape seed extract[D].Taian:Shandong Agricultural University,2020.
[3] 窦川林.鼠尾草提取物对鲢鱼肉保鲜效果的研究[D].重庆:西南大学,2019.
DOU C L.Study on the fresh-keeping effect of sage extract on silver carp meat[D].Chongqing:Southwest University,2019.
[4] 王明.丁香酚及其复合保鲜剂对调理海鲈鱼片贮藏品质的影响及其抗菌机理研究[D].锦州:渤海大学,2019.
WANG M.Effects of eugenol and its compound preservative on the storage quality of seasoned Lateolabrax japonicus fillets and their antibacterial mechanis[D].Jinzhou:Bohai University,2019.
[5] 许宝琛,张一敏,罗欣,等.葡萄籽提取物和茶多酚抑制高氧气调包装牛肉饼的提前褐变现象[J].现代食品科技,2022,38(1):181-187;344.
XU B C,ZHANG Y M,LUO X,et al.Inhibition of grape seed extract and tea polyphenols on the premature browning of beef patties under high oxygen modified packaging[J].Modern Food Science and Technology,2022,38(1):181-187;344.
[6] ROSALES SOTO M U,BROWN K,ROSS C F.Antioxidant activity and consumer acceptance of grape seed flour-containing food products[J].International Journal of Food Science &Technology,2012,47(3):592-602.
[7] ZHOU F B,JONGBERG S,ZHAO M M,et al.Antioxidant efficiency and mechanisms of green tea,rosemary or mate extracts in porcine Longissimus dorsi subjected to iron-induced oxidative stress[J].Food Chemistry,2019,298:125030.
[8] 余小亮,陈舜胜,贠三月,等.茶多酚-肉桂精油复合保鲜剂抗氧化活性及抑菌作用[J].食品工业科技,2017,38(22):226-230;245.
YU X L,CHEN S S,YUN S Y,et al.Antioxidant activity and antimicrobial effect of tea polyphenols-cinnamon essential oil compound preservatives[J].Science and Technology of Food Industry,2017,38(22):226-230;245.
[9] 都津铭.具有协同抑菌作用的丁香精油/茶多酚/纳米纤维素涂膜保鲜液的制备及其对带鱼涂膜保鲜效果的研究[D].杭州:浙江大学,2021.
DU J M.Preparation of clove essential oil/tea polyphenols/nano-cellulose coating preservative solution with synergistic bacteriostasis and its fresh-keeping effect on hailtail films[D].Hangzhou:Zhejiang University,2021.
[10] 李玲,季慧,段家玉.绿原酸抑制猪肉肌原纤维蛋白氧化及NDEA生成的作用研究[J].食品工业科技,2018,39(8):29-33.
LI L,JI H,DUAN J Y.The inhibition study of chlorogenic acid on the oxidation and N-nitrosodiethylamine (NDEA) formation in pork myofibrillar protein[J].Science and Technology of Food Industry,2018,39(8):29-33.
[11] JIANG X J,ZHANG Z J,CAI H N,et al.The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of crucian carp[J].Food Chemistry,2006,94(4):498-503.
[12] 蓝蔚青,陈梦玲,孙晓红,等.超高压结合竹醋液处理对冷藏鲈鱼片品质和蛋白特性的影响[J].高压物理学报,2019,33(1):166-174.
LAN W Q,CHEN M L,SUN X H,et al.Effects of high hydrostatic pressure (HHP) with bamboo vinegar on the quality and protein characteristics of perch (Lateolabrax japonicus) fillets during refrigerated storage[J].Chinese Journal of High Pressure Physics,2019,33(1):166-174.
[13] WANG Z M,HE Z F,GAN X,et al.Effect of peroxyl radicals on the structure and gel properties of isolated rabbit meat myofibrillar proteins[J].International Journal of Food Science &Technology,2018,53(12):2687-2696.
[14] 张慧芸,吴静娟,郭新宇.多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响[J].食品科学,2016,37(21):43-47.
ZHANG H Y,WU J J,GUO X Y.Effect of polyphenols on the oxidation and gel properties of pork myo brillar protein[J].Food Science,2016,37(21):43-47.
brillar protein[J].Food Science,2016,37(21):43-47.
[15] 张雪春,黄鑫,沈明娟,等.3种多酚干预过氧自由基诱导核桃蛋白氧化的研究[J].食品科技,2022,47(4):261-266.
ZHANG X C,HUANG X,SHEN M J,et al.Intervention of three polyphenols on walnut protein oxidation induced by peroxy radical[J].Food Science and Technology,2022,47(4):261-266.
[16] 刘明爽,李婷婷,马艳,等.真空包装鲈鱼片在冷藏与微冻贮藏过程中的新鲜度评价[J].食品科学,2016,37(2):210-213.
LIU M S,LI T T,MA Y,et al.Freshness evaluation of vacuum packaged perch fillets during refrigeration and partial freezing[J].Food Science,2016,37(2):210-213.
[17] MUELA E,SA UDO C,CAMPO M M,et al.Effect of freezing method and frozen storage duration on instrumental quality of lamb throughout display[J].Meat Science,2010,84(4):662-669.
UDO C,CAMPO M M,et al.Effect of freezing method and frozen storage duration on instrumental quality of lamb throughout display[J].Meat Science,2010,84(4):662-669.
[18] MANJU S,JOSE L,SRINIVASA GOPAL T K,et al.Effects of sodium acetate dip treatment and vacuum-packaging on chemical,microbiological,textural and sensory changes of Pearlspot (Etroplus suratensis) during chill storage[J].Food Chemistry,2007,102(1):27-35.
[19] 向思颖,谢君,徐芊,等.中性氧化电解水对冷鲜草鱼肉品质及质构的影响[J].食品科学,2017,38(3):239-244.
XIANG S Y,XIE J,XU Q,et al.Effect of neutral electrolyzed water on quality and textural characteristics of chilled fresh grass carp[J].Food Science,2017,38(3):239-244.
[20] WU X J,LI F,WU W.Effects of rice bran rancidity on the oxidation and structural characteristics of rice bran protein[J].LWT,2020,120:108943.
[21] LUND M N,HEINONEN M,BARON C P,et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition &Food Research,2011,55(1):83-95.
[22] 李钊,李宁宁,刘玉,等.超高压对肌原纤维蛋白结构及其凝胶特性影响的研究进展[J].食品与发酵工业,2020,46(21):304-309.
LI Z,LI N N,LIU Y,et al.Advances on the effects of ultra-high pressure on myofibrillar protein structure and its gel properties[J].Food and Fermentation Industries,2020,46(21):304-309.
[23] 卢涵.鳙鱼肉低温贮藏过程中蛋白氧化、组织蛋白酶活性与品质变化规律的研究[D].北京:中国农业大学,2017.
LU H.Protein oxidation,cathepsins activity and the quality changes of bighead carp (Aristichtbys nobilis) during low-temperature storage[D].Beijing:China Agricultural University,2017.