海蒿子是一种可食用的高品质海洋资源,其广泛种植于我国辽宁和山东等地区。据《中国传统医学词典》记载,海蒿子可用于治疗痰浊、内热、高血压等疾病[1]。多酚是海蒿子中重要的功能活性成分,其具有抗氧化、抗炎、抗肿瘤和增强免疫力等活性[2]。目前关于海蒿子多酚提取的研究较少,课题组前期采用70%(体积分数)甲醇、70%乙醇和70%丙酮水溶液对海蒿子多酚进行了常温浸提,其多酚含量为2.12~6.25 mg GAE/g E[3][没食子酸(gallic acid,GAE),E表示提取物]。YE等[4]用乙醇对海蒿子多酚进行浸提,其多酚含量为5.34 mg CHA/g E[绿原酸(chlorogenic acid,CHA)]。YU等[5]以甲醇-氯仿(体积比2∶1)为溶剂对海蒿子多酚进行了浸提,获得的多酚含量为6.54 mg GAE/g E。综上所述,现有提取海蒿子多酚的方法均为常温浸提,且得率较低,限制了海蒿子多酚的进一步开发和利用,亟需开发一种高效提取海蒿子多酚的方法。常温浸提等传统多酚提取方法的缺点在于时间长、有机溶剂的使用量大和能耗高,而超声提取作为一种绿色高效的提取方法,具有使用溶剂少、溶剂兼容性强和多酚得率高等优点[6]。林枞雨等[7]研究了浸提法、超声和微波辅助提取对玉米芯多酚得率的影响,结果表明超声辅助提取法效果最好。另外,与丙酮、氯仿和甲醇等有机溶剂相比,乙醇具有毒性低、对环境影响小和价格便宜等优势,是植物中提取多酚最常用的溶剂[8]。因此,以乙醇作为溶剂超声优化提取海蒿子多酚对其开发具有重要的意义。
糖尿病是全球四大慢性疾病之一,会造成机体代谢紊乱并引发糖尿病并发症[9]。截止2021年,全球糖尿病患者已达5.37亿,中国的糖尿病患者居世界首位。α-葡萄糖苷酶抑制剂(α-glucosidase inhibitors,AGIs)是临床上预防和治疗Ⅱ型糖尿病的一线药物。二肽基肽酶4(dipeptidyl peptidase 4,DPP-Ⅳ)抑制剂可提高肠胰高血糖素样肽-1和葡萄糖依赖性促胰岛素分泌多肽的能力,增加胰岛素的释放,起到抗糖尿病的作用[10]。氧化应激会造成机体产生过量的自由基,引起胰岛素的敏感性降低,加重胰岛素抵抗的程度[11]。强抗氧化活性的抗糖尿病活性成分更有助于糖尿病的防治。然而,常用的合成类抗糖尿病药物如阿卡波糖和沙格列汀等具有严重的副作用,如肠胃道胀气、腹部不适和恶心等[12]。多酚,作为可食用植物中的主要活性成分,是抗糖尿病剂和抗氧化剂的潜在来源,具有高效、安全和副作用小的特点,也是当前的研究热点。因此,评价海蒿子多酚的抗氧化、α-葡萄糖苷酶和DPP-Ⅳ酶抑制活性对其作为多靶点抗糖尿病药物或者膳食添加剂进行应用具有重要的指导作用。
本论文首先采用响应面优化超声辅助提取海蒿子多酚,获得最佳提取工艺;然后分别运用二氯甲烷、乙酸乙酯和正丁醇对最佳工艺提取的多酚进行富集,得到不同的萃取组分并测定其总酚含量;通过DPPH自由基和ABTS阳离子自由基清除能力实验评价海蒿子多酚及其萃取组分的抗氧化活性;采用α-葡萄糖苷酶和DPP-Ⅳ酶抑制活性评估其抗糖尿病活性,旨在促进海蒿子多酚的高值化利用。
1 材料与方法
1.1 材料与试剂
海蒿子,山东省青岛市;无水乙醇、福林酚、乙酸乙酯、正丁醇等,天津市大茂化学试剂厂;槲皮素、DPPH、ABTS、阿卡波糖、4-硝基苯基-β-D-葡萄糖酸、α-葡萄糖苷酶、DPP-Ⅳ酶、Gly-Pro-PNA等,美国Sigma公司。
1.2 仪器与设备
RE-52型旋转蒸发仪,上海荣生有限公司;Varioskam Flash型酶标仪,美国Thermo公司;KQ-300DE超声仪,昆山市超声仪器公司;KA-1000型高速离心机,上海安亭仪器厂。
1.3 实验方法
1.3.1 海蒿子多酚的超声提取工艺
称取5 g海蒿子粉末于250 mL的锥形瓶中,以料液比1∶30(g∶mL)加入乙醇溶液,混匀后按照设定的参数进行超声提取,所得提取液于5 000 r/min下离心5 min,收集上清液,在50 ℃下减压浓缩,用50%(体积分数)乙醇溶液定容到50 mL,得到海蒿子提取物,置于-20 ℃冰箱保存备用。
1.3.2 单因素试验
称取5 g海蒿子粉末,按照1.3.1节的方法进行超声提取,分析乙醇体积分数、提取时间、提取温度和超声功率对海蒿子中多酚提取得率的影响。乙醇体积分数:0%、10%、20%、30%、50%、70%、90%;提取时间:30、50、70、90、110 min;提取温度:20、30、40、50、60 ℃;超声功率为:280、420、490、560、700 W。
1.3.3 响应面优化实验
在单因素试验基础上,采用Box-Behnken中心试验设计对海蒿子超声提取工艺进行4因素3水平的响应面优化(表1)。
表1 响应面实验因素水平
Table 1 Response surface design factor level

水平因素乙醇体积分数(X1)/%提取时间(X2)/min提取温度(X3)/℃超声功率(X4)/ W-10303042001050404901207050560
1.3.4 不同溶剂萃取物的制备
称取20 g海蒿子粉末于锥形瓶中,用响应面法优化的最佳条件进行提取,离心后收集提取液,减压浓缩至干,获得海蒿子多酚提取物。用尽量少的水溶解海蒿子多酚提取物,依次用2倍体积的二氯甲烷、乙酸乙酯和正丁醇萃取3次,收集萃取液,用旋转蒸发仪进行浓缩,冻干,获得不同溶剂萃取物。以50%乙醇作为溶剂配制不同溶剂萃取液,置于-20 ℃冰箱保存备用。
1.3.5 海蒿子总酚含量的测定
参考谢星等[13]测定海蒿子样品的总酚含量(total phenolics content,TPC)。以蒸馏水代替体系中的福林酚试剂为样品空白,用没食子酸(10~70 μg/mL)做为标准品制作曲线,实验结果表示为毫克没食子酸当量每克褐藻提取物(mg GAE/g E)。
1.3.6 DPPH自由基清除能力测定
参考彭春彦等[14]的方法测定海蒿子样品的DPPH自由基清除能力。取100 μL不同浓度的海蒿子样品于96孔酶标板上,加入100 μL 0.15 mmol/L DPPH溶液,混匀后在常温避光的条件下反应30 min,于510 nm下测量混合物吸光值。以50%乙醇溶液代替体系中的DPPH溶液为空白对照组,不加海蒿子样品为控制组。以水溶性维生素E(Trolox)为标准品制作曲线,实验结果表示为微摩尔Trolox每克提取物(μmol TE/g E)。
1.3.7 ABTS阳离子自由基清除能力测定
参考彭春彦等[14]的方法测定海蒿子样品的ABTS阳离子自由基清除能力。ABTS工作液用7 mmol/L ABTS和2.45 mmol/L过硫酸钾溶液进行配制,配制完成后在常温下避光反应12~16 h,将其稀释至在765 nm下的吸光值为0.7±0.2后备用。将50 μL不同浓度的海蒿子样品加入到96孔酶标板上,再加入150 μL ABTS工作液进行混匀,在常温下反应6 min后于765 nm下检测吸光值。以蒸馏水代替体系中的ABTS工作液作为海蒿子样品空白,不添加海蒿子样品为控制组。ABTS阳离子自由基清除率的计算如公式(1)所示:
ABTS阳离子自由基清除率/%=[1-(AS-AB)/AC]×100
(1)
式中:AC、AS和AB分别表示反应体系中控制组、海蒿子样品组和空白组的吸光值,实验结果用IC50表示。
1.3.8 α-葡萄糖苷酶抑制活性测定
参考ZHANG等[15]的方法测定海蒿子样品的α-葡萄糖苷酶抑制活性。将50 μL不同浓度的海蒿子样品和50 μL α-葡萄糖苷酶溶液于96孔酶标板上混匀,常温下反应10 min,再加入50 μL 5.0 mmol/L的对硝基苯基-D-吡喃葡萄糖苷溶液,反应10 min后添加100 μL 0.2 mol/L Na2CO3终止反应,于405 nm下测定样品的吸光值。以蒸馏水代替α-葡萄糖苷酶溶液为空白对照组,不加海蒿子样品为控制组。α-葡萄糖苷酶抑制率的计算如公式(2)所示:
α-葡萄糖苷酶抑制率/%=[1-(Asa-Abl)/Aco]×100
(2)
式中:Aco、Asa和Abl分别为反应体系中控制组、海蒿子样品组和空白组的吸光值,实验结果用IC50表示。
1.3.9 DPP-Ⅳ酶抑制活性测定
参考LI等[16]的方法测定海蒿子样品的DPP-Ⅳ酶抑制能力。将50 μL海蒿子样品或者阳性对照品加入到96孔酶标板中,再添加40 μL DPP-Ⅳ酶(2.5 mg/mL,0.1 mol/L pH 8.0 Tris-HCl buffer配制),混匀后于37 ℃下孵育10 min,添加20 μL 5 mmol/L Gly-Pro-PNA(0.1 mol/L pH 8.0 Tris-HCl buffer配制)溶液,反应30 min,再加入100 μL 0.1 mol/L NaHCO3溶液终止反应,在405 nm下测定样品的吸光值。以0.1 mol/L pH 8.0 Tris-HCl buffer代替DPP-Ⅳ酶为样品空白,Sitagliptin为阳性对照品。DPP-Ⅳ酶抑制率的计算公式同公式(2),实验结果用IC50表示。
1.4 数据分析
所有的实验重复3次,结果表示为平均值±标准差。通过方差分析和Scheffe Test检验(P<0.05)确定海蒿子样品总酚含量和生物活性之间的差异性。运用Origin软件对数据进行作图,采用Pearson相关性系数分析海蒿子样品中多酚与抗氧化和抗糖尿病活性的相关性。
2 结果与分析
2.1 不同单因素条件对海蒿子多酚含量的影响
2.1.1 超声时间
如图1-A所示,海蒿子的多酚含量在50 min的时候达到峰值。随着时间的延长,海蒿子的多酚含量有所降低,但是在90 min后趋于稳定。这主要是由于长时间超声会产生大量的热量,从而造成部分多酚的降解。因此,海蒿子多酚超声提取时间选择30~70 min比较适宜。
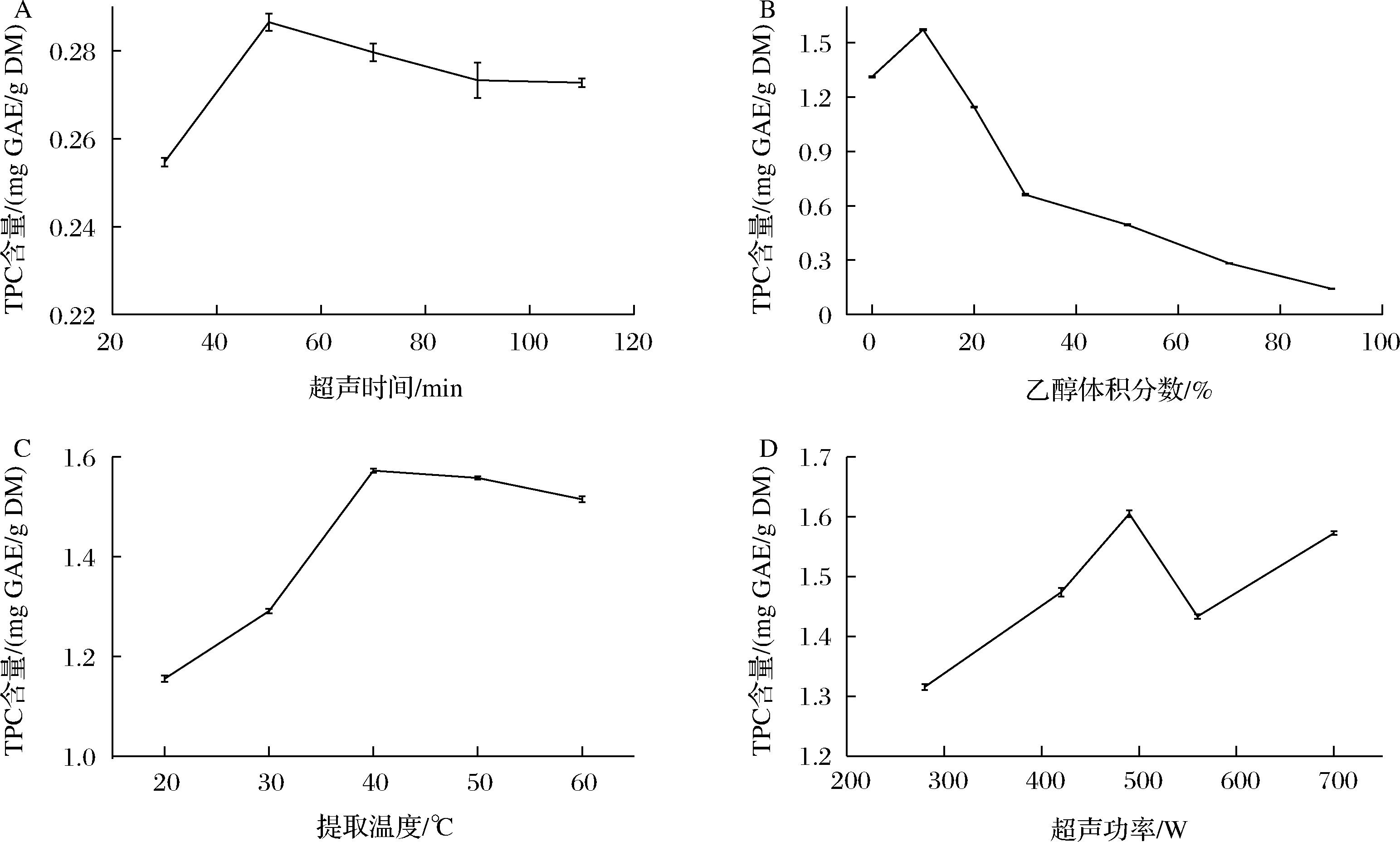
A-超声时间;B-乙醇体积分数;C-提取温度;D-超声功率
图1 超声时间、乙醇体积分数、提取温度和超声功率对海蒿子多酚含量的影响
Fig.1 Effect of ultrasonic time,ethanol concentration,temperature,and ultrasonic power on the total phenolic content of Sargassum pallidium
2.1.2 乙醇体积分数
如图1-B所示,海蒿子多酚含量在乙醇体积分数为10%时达到最高值,随着乙醇体积分数的增加而不断下降。这表明低体积分数的乙醇水溶液更容易提取海蒿子中的多酚。因此,超声提取海蒿子多酚的乙醇体积分数控制在0%~20%比较合适。
2.1.3 提取温度
如图1-C所示,海蒿子多酚含量随提取温度的升高而显著增加,在40 ℃的时候达到最高值,而后随着温度升高有所下降。高温会促进多酚类化合物的降解,使其分解成其他化合物[17]。因此,海蒿子提取温度控制在30~50 ℃较为适宜。
2.1.4 超声功率
如图1-D所示,海蒿子多酚含量随着超声功率的增加出现先增加再减少后增加的趋势。这主要是由于在超声功率低于1 000 W时,超声波空穴效应和热效应会促进植物细胞壁中多酚的溶出,而过大的功率会破坏多酚的分子结构[18]。因此,超声提取海蒿子多酚的功率控制在420~560 W比较合适。
2.2 超声辅助提取海蒿子多酚的响应面优化工艺
2.2.1 模型拟合与数据分析
为进一步优化4个单因素的海蒿子多酚提取工艺,选用响应面设计进行了29组实验,其实验结果见表2,方差分析见表3。采用Design experts version软件对表2的数据进行了响应面回归拟合分析,得到的回归方程如下:
表2 BBD 设计和总酚含量的实验及预测结果
Table 2 BBD design and experimental and predicted results of TPC
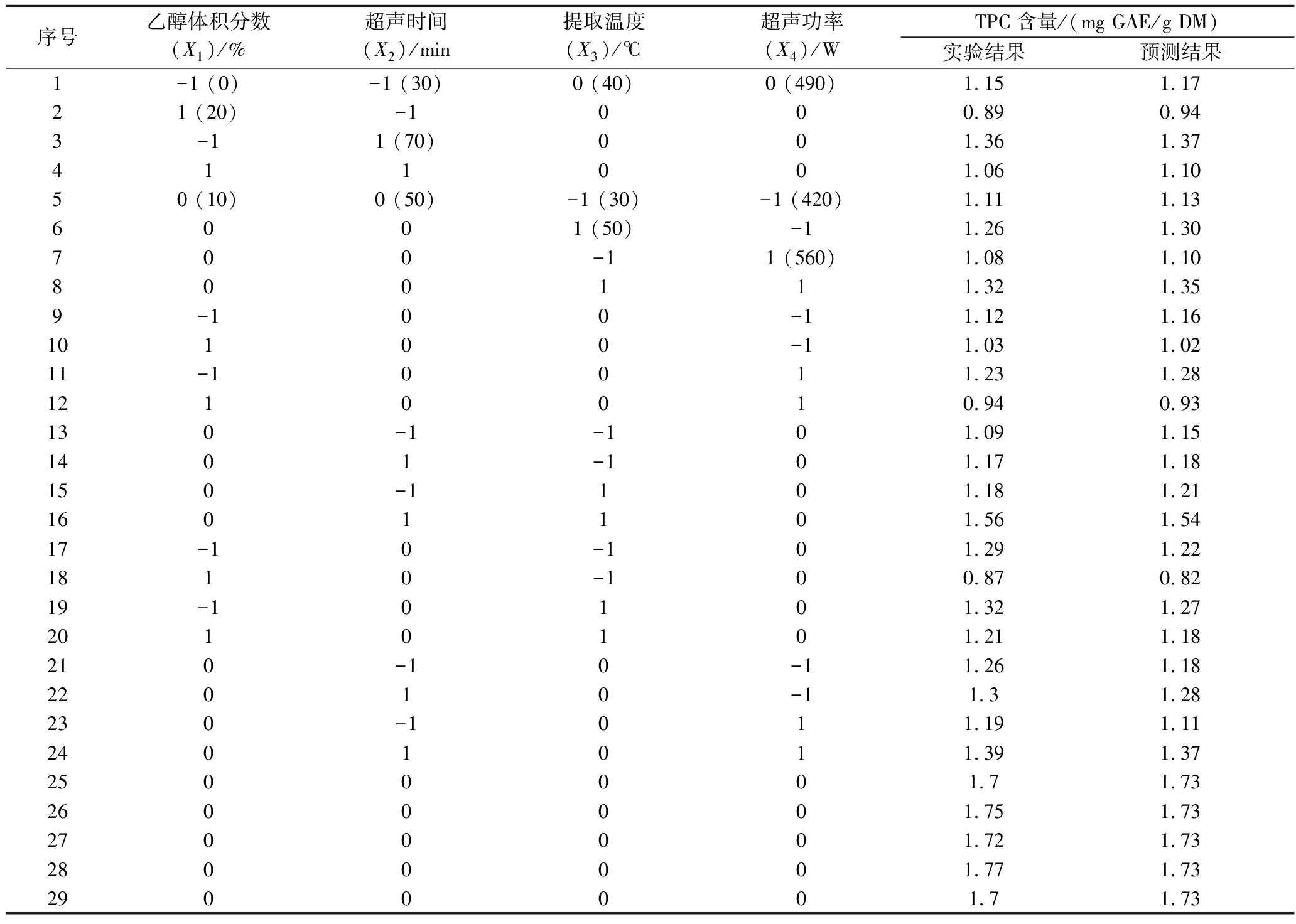
序号乙醇体积分数(X1)/%超声时间(X2)/min提取温度(X3)/℃超声功率(X4)/WTPC含量/(mg GAE/g DM)实验结果预测结果1-1 (0)-1 (30)0 (40)0 (490)1.151.1721 (20)-1000.890.943-11 (70)001.361.37411001.061.1050 (10)0 (50)-1 (30)-1 (420)1.111.136001 (50)-11.261.30700-11 (560)1.081.108001 11.321.359-100-11.121.1610100-11.031.0211-10011.231.281210010.940.93130-1-101.091.151401-101.171.18150-1101.181.211601101.561.5417-10-101.291.221810-100.870.8219-10101.321.272010101.211.18210-10-11.261.1822010-11.31.28230-1011.191.112401011.391.372500001.71.732600001.751.732700001.721.732800001.771.732900001.71.73
表3 方差分析表
Table 3 ANOVA analysis of regression equations
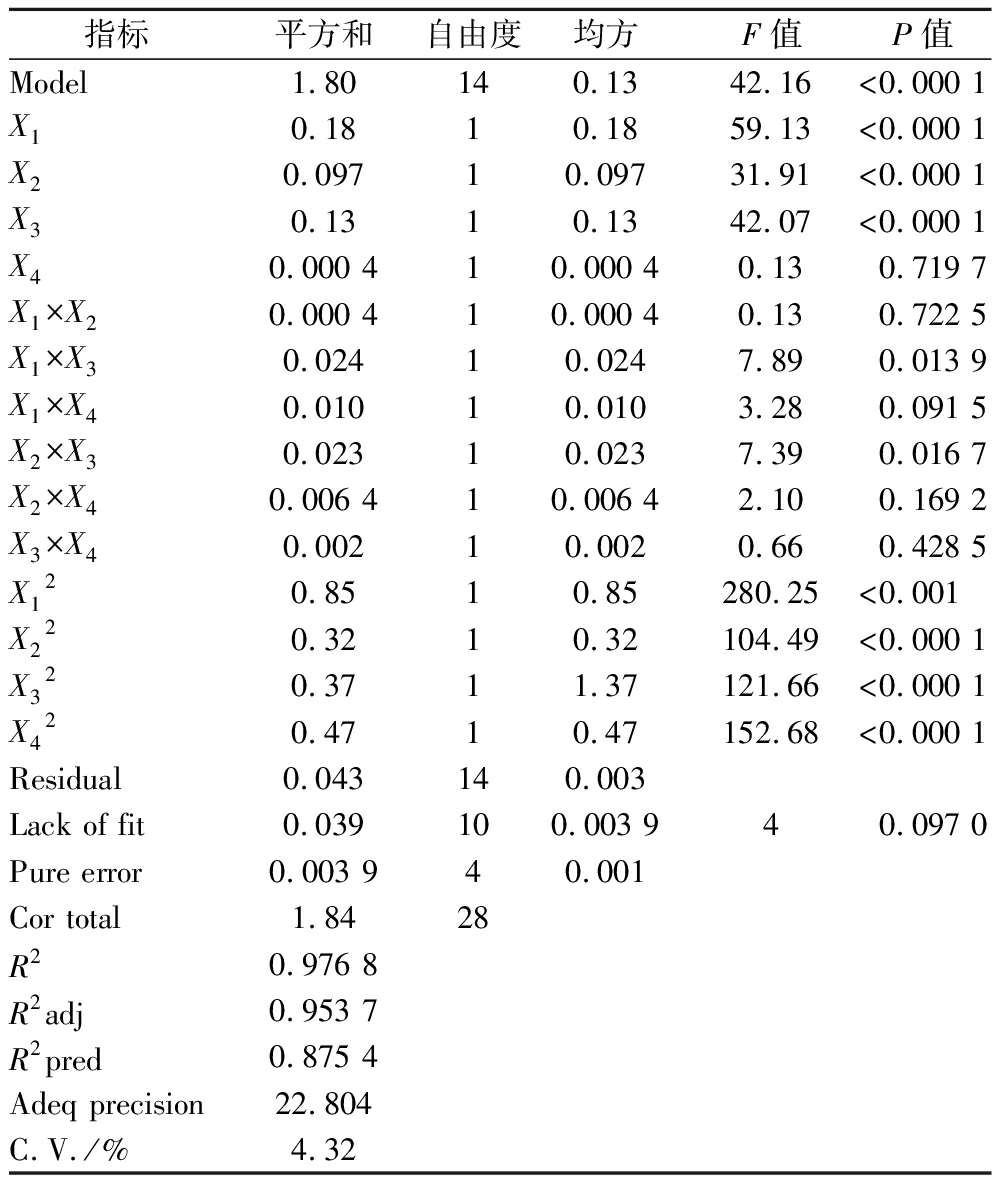
指标平方和自由度均方F值P值Model1.80140.1342.16<0.000 1X10.1810.1859.13<0.000 1X20.09710.09731.91<0.000 1X30.1310.1342.07<0.000 1X40.000 410.000 40.130.719 7X1×X20.000 410.000 4 0.130.722 5X1×X30.02410.0247.890.013 9X1×X40.01010.0103.280.091 5X2×X30.02310.0237.390.016 7X2×X40.006 410.006 42.100.169 2X3×X40.00210.0020.660.428 5X120.8510.85280.25<0.001X220.3210.32104.49<0.000 1X320.3711.37121.66<0.000 1X420.4710.47152.68<0.000 1Residual0.043140.003Lack of fit0.039100.003 940.097 0Pure error0.003 940.001Cor total1.8428R20.976 8R2adj0.953 7R2pred0.875 4Adeq precision22.804C.V./%4.32
Y=1.73-0.12X1+0.09X2+0.10X3+0.005 8X4-0.10X1X2+0.077X1X3-0.05X1X4+ 0.075X2X3+0.04X2X4+0.022X3X4-0.36X12-0.22X22-0.24X32-0.27X42
由表3可知,F值为42.16,且P<0.000 1,表明模型合理;海蒿子多酚含量的失拟项P=0.097>0.05,表明失拟不显著。回归模型决定系数R2=0.976 8,表明该回归模型与实际情况拟合程度较好;R2adj=0.953 7,表明该回归模型能反映95.37%响应值的变化;C.V.=4.32%,说明该回归模型可靠,可用于预测海蒿子多酚含量的实验结果。另外,该回归模型中的一次项X1、X2和X3对海蒿子多酚含量极显著,交互项X1×X3和X2×X3对海蒿子多酚含量显著,X12、X22、X32和X42对海蒿子多酚含量极显著。
2.2.2 响应面交互作用分析
等高线图和曲面图能反应因素之间的交互作用,图形越陡峭表明两者之间的交互作用越显著[19]。由图2可以看出,乙醇体积分数与提取时间和超声功率的交互作用均不显著(P>0.05);超声功率与提取温度和提取时间的交互作用也均不显著(P>0.05)。随着乙醇体积分数和提取温度的升高,海蒿子多酚含量呈现先增加后减少的趋势,且图形陡峭程度明显。此外,海蒿子多酚含量随着超声时间的延长和提取温度的提高也出现了同样的现象。因此,以上结果表明提取温度与乙醇体积分数和提取时间的交互作用显著(P<0.05)。

图2 因素间相互作用对海蒿子总酚含量影响的响应面曲面图
Fig.2 Response surface map of the influence of factors interaction on the TPC of Sargassum pallidium
2.2.3 模型验证
经过Design experts version软件计算得到响应面超声优化提取海蒿子中多酚类化合物的最佳工艺:乙醇体积分数8.5%;提取时间55 min;提取温度42 ℃;超声功率494 W。在此优化条件下得到的海蒿子多酚含量为1.81 mg GAE/g DM,与理论预测值很接近,因此该响应面优化模型得到的海蒿子多酚最佳提取条件准确且有效。
2.3 粗提物和不同萃取组分总酚含量分析
海蒿子多酚粗提物及其萃取组分的总酚含量如图3所示,正丁醇相的总酚含量最高,为24.45 mg GAE/g E;乙酸乙酯相的总酚含量最低,为6.05 mg GAE/g E。相比于粗提物,二氯甲烷相、正丁醇和水相的总酚含量分别提高了0.27、0.47和0.37倍,且它们之间无显著性差异。以上结果表明,正丁醇对海蒿子中多酚的富集效果最佳。根据超声提取优化结果可知,海蒿子中水溶性多酚含量较高,这可能是造成正丁醇和水相中总酚含量较高的主要原因。TANNA等[20]测定了4种褐藻的总酚含量,其值为9~15 mg GAE/g,显著低于本研究结果。
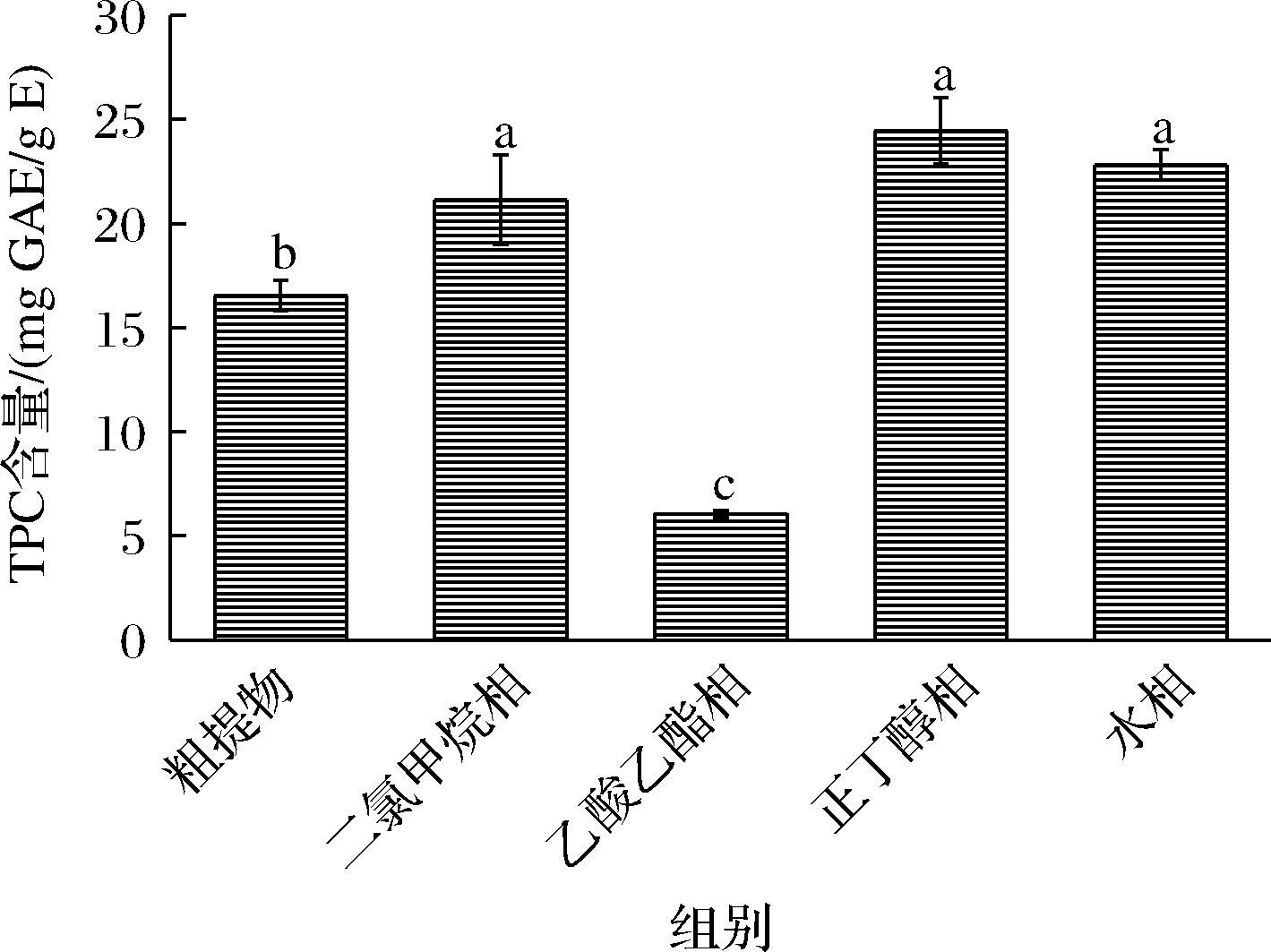
图3 海蒿子多酚粗提物及其萃取组分的总酚含量
Fig.3 Total phenolics content of crude polyphenol extracts and its fractions from Sargassum pallidium
注:不同字母表示数据间存在显著性差异(P<0.05)(下同)。
2.4 粗提物和不同萃取组分的抗氧化活性分析
DPPH自由基和ABTS阳离子自由基清除能力是评价多酚提取物抗氧化活性最常用的指标。如图4-A所示,海蒿子多酚粗提取及其萃取组分的ABTS阳离子自由基清除能力随着质量浓度的升高不断增强,呈现出明显的剂量效应。二氯甲烷相(249.22 μg/mL)表现出最强的ABTS阳离子自由基清除能力,其次为正丁醇相(374.15 μg/mL)和水相(422.47 μg/mL),乙酸乙酯相(1 303.68 μg/mL)的ABTS阳离子自由基清除能力最低。其中,二氯甲烷相的ABTS阳离子自由基清除能力分别是乙酸乙酯相和粗提物的5.23和2.72倍。另外,阳性对照组抗坏血酸的IC50为11.76 μg/mL,其值显著低于海蒿子多酚提取物及其萃取组分,表现出更强的ABTS阳离子自由基清除能力。如图4-B所示,以标准品Trolox的当量评价海蒿子粗提物及其萃取组分的DPPH自由基清除能力,其DPPH值为18.79~49.34 μmol TE/g,其活性的强弱顺序为:二氯甲烷相>正丁醇相>粗提物>水相=乙酸乙酯相。同ABTS阳离子自由基清除能力的结果一致,二氯甲烷相有最强DPPH自由基清除能力,其值是粗提物的1.53倍。以上结果表明二氯甲烷对海蒿子中抗氧化活性成分具有最好的富集效果。
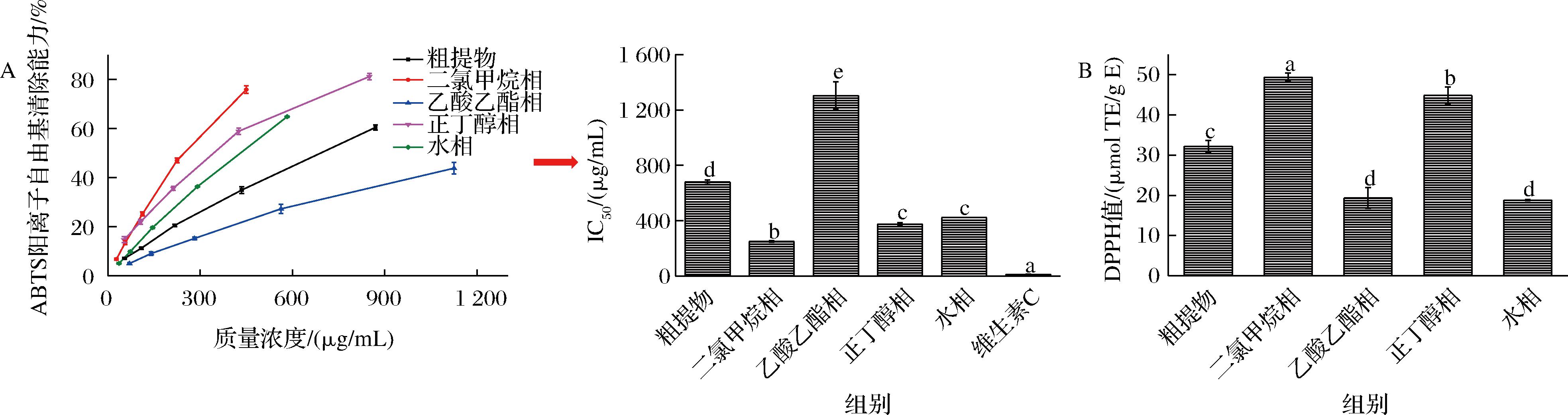
A-海蒿子多酚粗提物及其萃取组分的ABTS阳离子自由基清除能力;B-海蒿子多酚粗提物及其萃取组分的DPPH自由基清除能力
图4 海蒿子多酚粗提物及其萃取组分的ABTS阳离子自由基和DPPH自由基清除能力
Fig.4 The ABTS cationic radical and DPPH free radical scavenging ability of crude polyphenol extracts and its fractions from Sargassum pallidium
皮尔森相关性分析表明,海蒿子多酚粗提取及其萃取组分的总酚含量与DPPH自由基和ABTS阳离子自由基清除能力的相关性系数分别为0.526和-0.963,说明多酚是海蒿子中主要的抗氧化成分。这与2.3节的分析结果是一致的,二氯甲烷和正丁醇相均有较高的总酚含量。研究已表明海蒿子中的多酚如槲皮素糖苷、咖啡酸衍生物具有较高的响应值,且研究发现这些化合物具有较强的抗氧化活性,这可能是海蒿子多酚萃取组分活性较好的原因[3,21]。
2.5 粗提物和不同萃取组分的α-葡萄糖苷酶抑制活性分析
α-葡萄糖苷酶能催化二糖(麦芽糖和蔗糖)水解为单糖(葡萄糖和果糖),抑制其活性可显著降低餐后和空腹血糖,达到预防和治疗糖尿病的目的[22]。本论文采用了α-葡萄糖苷酶抑制活性评估海蒿子多酚提取物及其萃取组分的抗糖尿病活性,其结果见图5。随着海蒿子多酚粗提物及其萃取组分浓度的增加,其α-葡萄糖苷酶抑制活性不断增强,且活性均强于阳性对照组阿卡波糖。二氯甲烷和乙酸乙酯相的IC50最低,为84.83、91.21 μg/mL;正丁醇相的IC50最高,为617.07 μg/mL。粗提物和水相的α-葡萄糖苷酶抑制活性无显著性差异,其IC50分别为106.87、127.68 μg/mL。海蒿子多酚粗提物及其萃取组分的活性约为阿卡波糖的1.42~10.33倍,二氯甲烷和乙酸乙酯对α-葡萄糖苷酶抑制剂的富集效果最佳。以上结果表明海蒿子粗提物和萃取组分均是优质的α-葡萄糖苷酶抑制剂,可作为抗糖尿病药物的替代品进行开发。相关性分析表明,α-葡萄糖苷酶抑制活性和总酚含量呈中度相关(r=0.489)。前期研究发现槲皮素-3-O-葡萄糖醛酸是海蒿子中主要成分,且有很强的α-葡萄糖苷酶抑制能力,其可能对海蒿子多酚提取物及其萃取组分的活性起到重要的作用[23]。

图5 海蒿子多酚粗提物及其萃取组分的α-葡萄糖苷酶抑制活性
Fig.5 The α-glucosidase inhibitory of crude polyphenol extracts and its fractions from Sargassum pallidium
2.6 粗提物和不同萃取组分的DPP-Ⅳ酶抑制活性分析
DPP-Ⅳ是人体组织中的一种代谢酶,抑制其活性可延长胰高血糖素样肽-1和促胰岛素多肽的作用并稳定血糖水平,达到抗糖尿病的效果[24]。由图6可知,海蒿子多酚粗提物3个萃取相抑制DPP-Ⅳ酶活性呈现出浓度依赖性,但其活性低于阳性对照西他列汀。乙酸乙酯相的DPP-Ⅳ酶抑制活性最强,其IC50为25.83 μg/mL;二氯甲烷相和正丁醇相次之,其IC50分别为210.67、667.61 μg/mL;其中乙酸乙酯相的活性为正丁醇相的25.85倍。海蒿子粗提物和水相的DPP-Ⅳ酶抑制活性均较弱,其IC50均高于5 mg/mL。以上结果表明,乙酸乙酯对海蒿子多酚提取物中的DPP-Ⅳ酶抑制剂富集效果最好。与α-葡萄糖苷酶的结果一致,乙酸乙酯相是海蒿子多酚提取物萃取组分中抗糖尿病活性成分的最佳来源。相关性分析也表明,海蒿子样品的α-葡萄糖苷酶和DPP-Ⅳ酶抑制活性呈高度相关(r=0.956)。据文献报道,围式马尾藻和匍枝马尾藻均是马尾藻属的褐藻,和海蒿子为同一个种属,其甲醇提取物抑制DPP-Ⅳ酶活性的IC50为38.27、36.94 μg/mL,显著高于海蒿子多酚提取物乙酸乙酯相[25]。研究表明黄酮和酚酸等多酚均是优质DPP-Ⅳ酶抑制剂的良好来源,海蒿子多酚可能对DPP-Ⅳ酶抑制活性具有很大的贡献[26]。
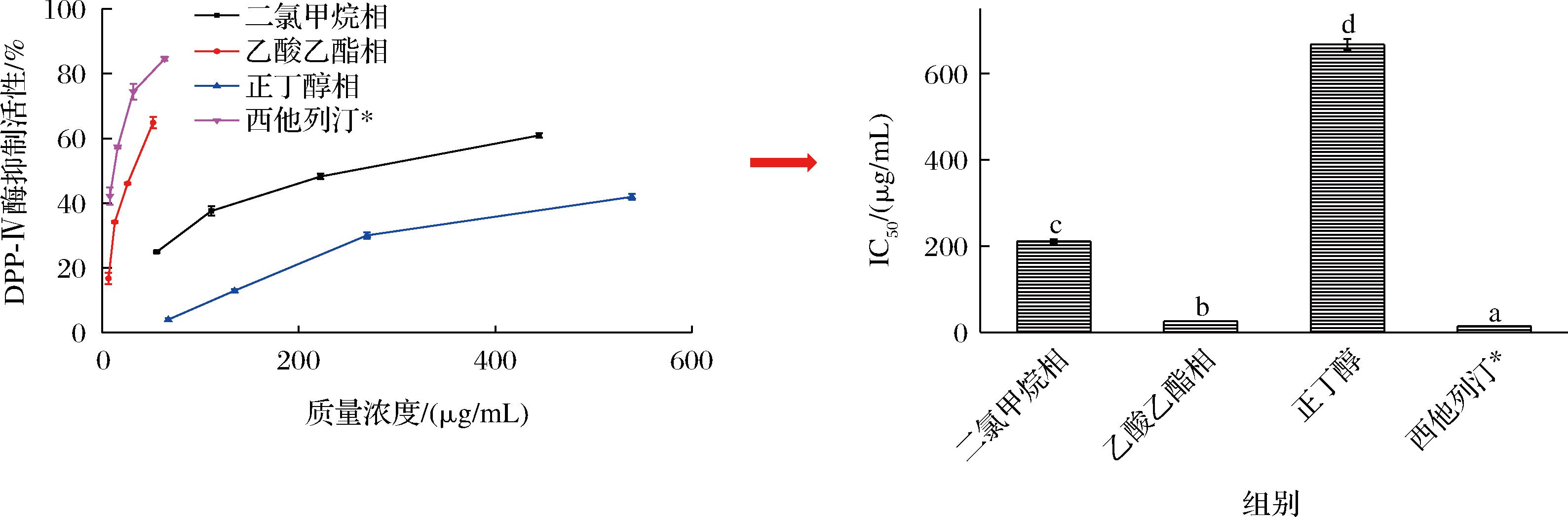
图6 海蒿子多酚粗提物及其萃取组分的DPP-Ⅳ酶抑制活性
Fig.6 The DPP-Ⅳ inhibitory of crude polyphenol extracts and its fractions from Sargassum pallidium
注:*表示单位为ng/mL。
3 结论
本研究得到了响应面超声辅助提取海蒿子多酚的最佳工艺,并分析了海蒿子多酚粗提物及其萃取组分的抗氧化和抗糖尿病活性。本研究获得的海蒿子多酚的最佳提取工艺如下:乙醇体积分数为8.5%,提取时间为55 min,提取温度为42 ℃,超声功率为494 W,得到的海蒿子多酚含量为1.81 mg GAE/g DM,与理论预测值很接近,表明该模型可用于预测海蒿子多酚得率。海蒿子粗提物正丁醇相有最高的总酚含量(24.45 mg GAE/g E)。抗氧化分析结果表明,二氯甲烷相的DPPH自由基和ABTS阳离子自由基清除能力最强,分别是粗提物的1.53和2.72倍。抗氧化活性和总酚含量呈现出高度的相关性,表明多酚是海蒿子中主要的抗氧化成分。海蒿子粗提物和萃取组分的α-葡萄糖苷酶抑制活性均强于阿卡波糖,二氯甲烷和乙酸乙酯相的活性最好。乙酸乙酯相的DPP-Ⅳ酶抑制活性最强,该溶剂萃取海蒿子中抗糖尿病活性成分的效果最佳。综上所述,海蒿子多酚是抗氧化剂和抗糖尿剂的潜在来源,超声辅助提取能显著提高海蒿子多酚的得率,本研究可为其作为预防和治疗糖尿病的药物或健康食品开发提供科学依据。
[1] YUAN D,LI C,HUANG Q,et al.Ultrasonic degradation effects on the physicochemical,rheological and antioxidant properties of polysaccharide from Sargassum pallidum[J].Carbohydrate Polymers,2020,239:116230.
[2] MANSAUDA M M,RIANI K L,ANWAR E,et al.Antioxidant and anti-collagenase activity of Sargassum plagyophyllum extract as an anti-wrinkle cosmetic ingredient[J].Pharmacognosy Journal,2018,10(5):932-936.
[3] XIE X,CHEN C,FU X.Screening α-glucosidase inhibitors from four edible brown seaweed extracts by ultra-filtration and molecular docking[J].LWT,2021,138:110654.
[4] YE H,ZHOU C H,SUN Y,et al.Antioxidant activities in vitro of ethanol extract from brown seaweed Sargassum pallidum[J].European Food Research and Technology,2009,230(1):101-109.
[5] YU L H,BIN W,GUANG Y C,et al.Evaluation of antioxidant activities of five selected brown seaweeds from China[J].Journal of Medicinal Plants Research,2010,4(23):2557-2565.
[6] SAFDAR M N,KAUSAR T,JABBAR S,et al.Extraction and quantification of polyphenols from kinnow (Citrus reticulate L.) peel using ultrasound and maceration techniques[J].Journal of Food and Drug Analysis,2017,25(3):488-500.
[7] 林枞雨,马永强,王鑫,等.不同方法提取甜玉米芯多酚对比研究[J].食品研究与开发,2016,37(24):58-63.
LIN C Y,MA Y Q,WANG X,et al.Comparison of polyphenols of sweet corn cob extracted by different methods[J].Food Research and Development,2016,37(24):58-63.
[8] BRGLEZ MOJZER E,KNEZ ![]() M,
M, KERGET M,et al.Polyphenols:Extraction methods,antioxidative action,bioavailability and anticarcinogenic effects[J].Molecules,2016,21(7):901.
KERGET M,et al.Polyphenols:Extraction methods,antioxidative action,bioavailability and anticarcinogenic effects[J].Molecules,2016,21(7):901.
[9] GOYAL R,JIALAL I.Diabetes Mellitus Type 2[M].Treasure Island (FL):StatPearls Publishing,2022.
[10] 金泽彬,贺颖,李正祎,等.二肽基肽酶-4抑制剂治疗Ⅱ型糖尿病研究进展[J].吉林医药学院学报,2021,42(4):308-310.
JIN Z B,HE Y,LI Z Y,et al.Research progress of dipeptidyl peptidase 4 inhibitors in the treatment of type 2 diabetes mellitus[J].Journal of Jilin Medical University,2021,42(4):308-310.
[11] YARIBEYGI H,SATHYAPALAN T,ATKIN S L,et al.Molecular mechanisms linking oxidative stress and diabetes mellitus[J].Oxidative Medicine and Cellular Longevity,2020,2020:8609213.
[12] ZHANG Y Y,YANG Z L,LIU G G,et al.Inhibitory effect of chestnut (Castanea mollissima Blume) inner skin extract on the activity of α-amylase,α-glucosidase,dipeptidyl peptidase IV and in vitro digestibility of starches[J].Food Chemistry,2020,324:126847.
[13] 谢星,涂宗财,王辉,等.野生和种植藜蒿不同部位提取物的抗氧化活性和酶抑制活性[J].中国食品学报,2020,20(3):58-65.
XIE X,TU Z C,WANG H,et al.Antioxidant and enzyme inhibitory activities of extracts from various parts of wild and cultivated Artemisia selengensis Turcz[J].Journal of Chinese Institute of Food Science and Technology,2020,20(3):58-65.
[14] 彭春彦,谢星,李一华,等.海带、坛紫菜和裙带菜游离和结合酚抗氧化和酶抑制活性比较[J].食品与发酵工业,2023,49(4):110-116.
PENG C Y,XIE X,LI Y H,et al.Antioxidant and enzyme inhibition activities of free and bound phenolics of Laminaria japonica,Porphyra haitanensis,and Undaria pinnatifida[J].Food and Fermentation Industries,2023,49(4):110-116.
[15] ZHANG J T,SUN L J,DONG Y S,et al.Chemical compositions and α-glucosidase inhibitory effects of anthocyanidins from blueberry,blackcurrant and blue honeysuckle fruits[J].Food Chemistry,2019,299:125102.
[16] LI M Q,BAO X,ZHANG X T,et al.Exploring the phytochemicals and inhibitory effects against α-glucosidase and dipeptidyl peptidase-IV in Chinese pickled chili pepper:Insights into mechanisms by molecular docking analysis[J].LWT,2022,162:113467.
[17] ![]() A,
A,![]() I E,et al.Comparison of different extraction methods for the recovery of olive leaves polyphenols[J].Processes,2020,8(9):1008.
I E,et al.Comparison of different extraction methods for the recovery of olive leaves polyphenols[J].Processes,2020,8(9):1008.
[18] PANDEY A,BELWAL T,SEKAR K C,et al.Optimization of ultrasonic-assisted extraction (UAE) of phenolics and antioxidant compounds from rhizomes of Rheum moorcroftianum using response surface methodology (RSM)[J].Industrial Crops and Products,2018,119:218-225.
[19] 刘晓珍,李福香,祝兆亮,等.芒果核多酚超声辅助提取工艺优化及抑菌活性研究[J].食品研究与开发,2021,42(14):56-60;70.
LIU X Z,LI F X,ZHU Z L,et al.Optimization of ultrasound-assisted extraction and antimicrobial activity of polyphenols from mango core[J].Food Research and Development,2021,42(14):56-60;70.
[20] TANNA B,CHOUDHARY B,MISHRA A,et al.Antioxidant,scavenging,reducing,and anti-proliferative activities of selected tropical brown seaweeds confirm the nutraceutical potential of Spatoglossum asperum[J].Foods,2021,10(10):2482.
[21] TAJNER-CZOPEK A,GERTCHEN M,RYTEL E,et al.Study of antioxidant activity of some medicinal plants having high content of caffeic acid derivatives[J].Antioxidants,2020,9(5):412.
[22] DENG N,GUO R X,ZHENG B S,et al.IRS-1/PI3K/Akt pathway and miRNAs are involved in whole grain highland barley (Hordeum vulgare L.) ameliorating hyperglycemia of db/db mice[J].Food &Function,2020,11(11):9535-9546.
[23] XIE X,CHEN C,HUANG Q,et al.Investigation into the mechanisms of quercetin-3-O-glucuronide inhibiting α-glucosidase activity and non-enzymatic glycation by spectroscopy and molecular docking[J].Food &Function,2021,12(17):7825-7835.
[24] KONG X Z,ZHANG L N,SONG W G,et al.Separation,identification and molecular binding mechanism of dipeptidyl peptidase IV inhibitory peptides derived from walnut (Juglans regia L.) protein[J].Food Chemistry,2021,347:129062.
[25] KAZEEM M,BANKOLE H,OGUNRINOLA O,et al.Functional foods with dipeptidyl peptidase-4 inhibitory potential and management of type 2 diabetes:A review[J].Food Frontiers,2021,2(2):153-162.
[26] SHAIKH S,LEE E J,AHMAD K,et al.A comprehensive review and perspective on natural sources as dipeptidyl peptidase-4 inhibitors for management of diabetes[J].Pharmaceuticals,2021,14(6):591.