金荞麦,属蓼科荞麦属,又名天荞麦、野荞麦、荞麦三七、金锁银开,常以根入药,主要成分为金荞麦黄酮,其具有良好的自由基清除能力,有助于减少免疫细胞释放促炎细胞因子,改善肠黏膜屏障的受损,刺激动物免疫器官的生长发育,提高巨噬细胞的吞噬功能,降低机体血糖和血脂水平,有效缓解关节炎症[1-4]。随着人类生活水平的日益提高以及亚健康状态的长期维持,保健食品的重要性愈发突出,金荞麦作为中国重要的传统中草药,其块根中的活性提取物可作为绿色保健食品之一,其富含的多种营养成分及功效在未来的市场中具有巨大的潜力。
急性肺损伤(acute lung injury,ALI)是由多种内源性和外源性刺激引起肺部出现以炎症反应、肺水肿和肺泡毛细血管屏障损伤为病理特征,以呼吸衰竭综合症和进行性低氧血症为临床特征的综合病征[5-6]。大量研究表明,氧化应激和过度炎症是急性肺损伤发生发展的2个重要因素,是急性呼吸窘迫综合征、肺炎、急性呼吸衰竭、脓毒症等的轻度病理阶段[7-8]。脂多糖(lipopolysaccharide,LPS)是大多数食源性致病菌如大肠杆菌的主要毒性成分,广泛用于诱导细菌感染引起的ALI[9]。当肺部识别到病原体入侵时,先天免疫系统启动,RAW 264.7 细胞作为肺远端最丰富的先天免疫细胞被激活,细胞膜受体识别病原体引发强烈的免疫应答,活性氧(reactive oxygen,ROS)产生,RAW 264.7 细胞向 M1 极化从而分泌促炎介质,调控机体免疫系统[10-11]。因此,本研究拟通过 LPS 建立 RAW 264.7 细胞损伤模型及小鼠急性肺损伤模型,探究天然金荞麦总黄酮对食源性致病菌诱发 RAW 264.7 细胞损伤和小鼠急性肺损伤的作用,为开发其作为有效抑制肺部炎症的保健食品提供实验依据。
1 材料与方法
1.1 材料与试剂
雄性昆明小鼠[(20±2) g]购自珠海百试通生物科技有限公司,实验动物许可证号为SCXK(粤)2020-0051,伦理审查批准文号为GDOU-LAE-2022-014;RAW 264.7小鼠单核巨噬细胞株,上海信裕生物科技有限公司;金荞麦药材,产地贵州;DMEM基础培养基,美国GIBCO公司;胎牛血清,Clark;青-链霉素,美国GIBCO公司;脂多糖,美国Sigma公司;CCK-8活细胞检测试剂盒,Abmole公司;白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor,TNF-α)和白细胞介素18(interleukin-18,IL-18)、白细胞介素 1β(interleukin-1β,IL-1β)和白介素18(IL-18) ELISA 试剂盒,北京奇松生物科技有限公司;乳酸脱氢酶(dehydrogenase,LDH)活性检测试剂盒、丙二醛(malonaldehyde,MDA)含量检测试剂盒、过氧化氢(H2O2)测定试剂盒,北京索莱宝科技有限公司;活性氧(reactive oxygen,ROS)、CuZn/Mn-SOD活性检测试剂盒、总谷胱甘肽(glutathione,GSH)检测试剂盒,上海碧云天生物技术有限公司;总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、过氧化氢酶(catalase,CAT)测定试剂盒,南京建成生物工程研究所;无水乙醇、NaNO2、AlNO3、NaOH,均为分析纯,广州科诚生物有限公司;甲醇(LC-MS级)、乙腈(LC-MS级),美国Honeywell公司;甲酸(LC-MS级),美国Sigma公司。
1.2 仪器与设备
TU-1800紫外分光光度计,北京普析通用仪器有限责任公司;SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;DF-1集热式搅拌器,金坛市虹盛仪器厂;多功能粉碎机,萊芙LFP-800T;电子天平,上海越平科学仪器有限公司;二氧化碳细胞培养箱,美国Thermo公司;超净工作台,苏州安泰科技有限公司;OLYMPUSBX40光学显微镜,日本OLYMPUS公司;高速台式离心机,安徽中科中佳科学仪器有限公司;高速冷冻离心机,德国Eppendorf公司;恒温水浴箱CU600,上海一恒公司;超低温冰箱,青岛海尔股份有限公司;酶标仪,美国Bio-Tek公司;超高效液相色谱仪,AB Sciex公司;高灵敏度质谱,AB Sciex公司;纯水仪,Merck Millipore;C18色谱柱,Waters公司。
1.3 研究方法
1.3.1 金荞麦总黄酮的提取及鉴定
将块状的金荞麦根茎粉碎,60 ℃热风干燥至恒重,取金荞麦药材20 g浸泡17 h后,用75%乙醇浸泡提取3次,真空抽滤,弃去残渣,合并3次提取液于同一烧瓶。将提取液分次加入到旋转蒸发仪中进行浓缩,浓缩温度为70 ℃,浓缩至药液不再沸腾倒出浓缩液。利用超高效液相色谱-四极杆-飞行时间质谱鉴定金荞麦总黄酮的成分。
1.3.2 金荞麦总黄酮对LPS诱导RAW 264.7细胞损伤的影响
1.3.2.1 供试样品的制备与处理
金荞麦总黄酮溶液:称量干燥的金荞麦总黄酮,在无菌条件下,以DMSO为溶剂,制备成5 mg/mL母液,并过0.22 μm微孔滤膜过滤,分装后置于4 ℃保存。
LPS溶液:在无菌条件下,精确称取脂多糖粉末用PBS制备成1 mg/mL母液,并用0.22 μm滤膜过滤除菌,分装后置于4 ℃保存。
1.3.2.2 细胞培养
细胞复苏:37 ℃水浴融化冻存管,加入1 mL培养基离心,1 000 r/min离心5 min,弃上清,加入5 mL完全培养基转移到细胞瓶。
细胞培养:RAW 264.7细胞(小鼠单核巨噬细胞)用含10%胎牛血清和100 μg/mL链霉素和100 U/mL青霉素的DMEM培养基,在含有5% CO2的培养箱里37 ℃培养。
细胞传代:待细胞密度达到90%左右弃上清,加入PBS清洗培养瓶内细胞1~2次,加入1 mL胰酶,37 ℃消化1~2 min后加入2 mL完全培养基终止消化,5 mL离心管收集细胞悬液,1 000 r/min离心5 min,弃掉上清液,加2 mL完全培养基,吹打均匀,各吸取1 mL到细胞培养瓶中,补加4 mL完全培养基,放入培养箱培养。
细胞冻存:待细胞贴壁生长到90%左右传代,PBS洗2遍,然后加2 mL完全培养基轻轻吹打,转移到离心管里,1 000 r/min离心5 min,弃掉上清液,加入1 mL的细胞冻存液吹打均匀,将其程序降温后移入液氮。
1.3.2.3 细胞分组和模型建立
将细胞分为5组:正常组(细胞不经处理)、LPS组(仅用20 μg/mL LPS刺激12 h)、金荞麦总黄酮低浓度组(用10 μg/mL金荞麦总黄酮处理细胞9 h后用20 μg/mL LPS刺激12 h)、金荞麦总黄酮中浓度组(用20 μg/mL金荞麦总黄酮处理细胞9 h后用20 μg/mL LPS刺激12 h)、金荞麦总黄酮高浓度组(用30 μg/mL金荞麦总黄酮处理细胞9 h后用20 μg/mL LPS刺激12 h)。
1.3.2.4 RAW 264.7细胞生存能力分析
将RAW 264.7细胞以1×105cell/mL接种于96孔板中,在含有5% CO2的培养箱里37 ℃继续培养12 h后,依次加入不同浓度的药物,采用CCK-8法检测RAW 264.7的细胞活力。
LPS对RAW 264.7细胞活力检测:将0、5、10、20、30、40 μg/mL LPS溶液取100 μL加入96孔培养板中,培养12 h,加入10 μL CCK-8溶液,在培养箱中孵育1 h,用酶标仪检测450 nm处的吸光度。
金荞麦总黄酮对RAW 264.7的细胞活力检测:将0、12.5、25、50、100、150 μg/mL金荞麦总黄酮取100 μL加入96孔板中培养12 h,加入10 μL CCK-8溶液,在培养箱中孵育1 h后用酶标仪检测450 nm处的吸光度。
金荞麦总黄酮对炎症状态下RAW 264.7的细胞活力检测:按照1.3.2.3节步骤进行,最后加入10 μL CCK-8溶液,在培养箱中孵育1 h后用酶标仪检测450 nm处的吸光度。
细胞活力计算如公式(1)所示:
细胞活力![]()
(1)
注:A(加药):含有细胞、CCK-8和不同浓度金荞麦总黄酮溶液孔的吸光度;A(空白):含有培养基和CCK-8的细胞孔吸光度;A(0加药):含有细胞、CCK-8溶液,不含药物溶液孔的吸光度。
1.3.2.5 RAW 264.7细胞中LDH活力测定
RAW 264.7细胞按照1.3.2.3节步骤进行处理,收集细胞,按比例加入提取液,超声波破碎细胞后8 000×g离心10 min,取上清后,按LDH活性检测试剂盒说明书测定。
1.3.2.6 2,7-二氯荧光素二乙酸酯(2,7-dichlorofluorescein diacetate,DCFH-DA)荧光探针检测RAW 264.7细胞内ROS水平
RAW 264.7细胞按照1.3.2.3节步骤在6孔板中分组处理。在黑暗环境中,弃去细胞培养液,加入1 mL 用无血清培养液稀释的DCFH-DA,37 ℃细胞培养箱内孵育20 min。用PBS洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。在荧光显微镜下观察荧光强度,实验每组设定3个平行孔,用Image J软件分析荧光强度的平均值。
1.3.2.7 RAW 264.7细胞中MDA水平、GSH含量、SOD和CAT活性
收集各处理组的细胞于离心管中,加入相应的提取液,采用MDA、SOD、GSH、CAT商业试剂盒检测RAW 264.7细胞中MDA水平、GSH含量以及SOD和CAT活性。
1.3.2.8 ELISA法检测RAW 264.7细胞上清液中TNF-α、IL-6、IL-1β和IL-18含量
收集各细胞处理组的上清培养基于离心管中,1 000 r/min离心5 min,将上清转移至新的EP管中备用,从4 ℃冰箱取出ELISA试剂盒平衡至室温,按试剂盒中说明书进行操作,每孔加入不同浓度的标准品或上清液,反应终止后,在30 min之内,使用酶标仪测定450 nm最大吸收波长,并计算出TNF-α、IL-6、IL-18和IL-1β的含量。
1.3.2.9 Hoechst 33342/PI双染色检测RAW 264.7细胞凋亡水平
将RAW 264.7细胞接种于24孔细胞培养板中,分组处理,加入含有10 μL Hoechst 33342和5 μL PI染色液的新鲜培养基共计1 mL,混匀,37 ℃避光孵育30 min。染色后用PBS洗涤2~3次,使用荧光显微镜观察细胞凋亡水平。
1.3.3 金荞麦总黄酮对LPS诱导小鼠急性肺损伤的影响
1.3.3.1 小鼠急性肺损伤(acute lung injury,ALI)模型的建立及治疗
选取5~6周龄的SPF级雄性昆明小鼠[(20±2) g],标准条件下饲养,温度为(22±2) ℃。实验小鼠安放在可自由进食和饮水的鼠笼,适应性生长7 d。将小鼠随机分为5组,每组6只,分别为对照组、LPS组、金荞麦总黄酮低浓度组、金荞麦总黄酮中浓度组、金荞麦总黄酮高浓度组。金荞麦总黄酮低中高浓度组分别按照25、50、100 mg/kg的剂量灌胃金荞麦总黄酮,对照组和LPS组灌胃等体积的生理盐水。饲养12 d后,ALI组、金荞麦总黄酮低中高浓度组小鼠用乙醚麻醉,鼻内给予1 mg/kg LPS处理12 h以建立急性肺损伤模型,对照组滴鼻同等体积的双蒸水。
1.3.3.2 标本采集及肺干湿比重(W/D)检测
LPS给药12 h后,以乙醚气体麻醉小鼠后处死,分别收集外周血、肺组织等标本。将收集的血液于常温静置1 h后,于4 ℃以3 500 r/min离心15 min,收集上层血清,保存在-80 ℃中备用。分离双肺,左右肺剪开,取出左肺,用PBS冲洗,吸干表面水分并称重,在80 ℃烘箱中烘烤36 h,称其干重,计算W/D。
1.3.3.3 肺组织病理学变化
小鼠右肺组织置于4%的多聚甲醛中固定48 h后,进行以下步骤:
修块→洗涤→脱水→透明→透蜡→包埋→切片→展片→烘片→脱蜡→脱苯→水洗→苏木素染色→水洗→分化→水洗→返蓝→水洗→伊红染色→水洗→脱色→透明→封片
在光学显微镜下观察,以HE染色评价各组小鼠肺部病理学变化。
1.3.3.4 小鼠血清中H2O2、MDA和CAT测定
使用活性试剂盒测定血清中MDA、H2O2含量和CAT活性,并使用96孔板读数器测量对应波长处的吸光度变化。
1.3.3.5 ELISA测定炎症因子IL-6、TNF-α和IL-1β浓度测定
根据小鼠IL-6、TNF-α和IL-1β ELISA试剂盒说明书测定血清中IL-6、TNF-α和IL-1β的浓度。
1.4 统计学处理
采用GraphPad Prism 8.0软件进行统计学分析,数据以“均数±标准差”表示,使用One-way ANOVA对结果进行分析,对照组和实验组之间*表示差异显著(P<0.05),**表示差异极显著(P<0.01);LPS组与实验组之间“#”表示差异显著(P<0.05),“##”表示差异极显著(P<0.01)。
2 结果与分析
2.1 金荞麦总黄酮的提取及鉴定
金荞麦提取得到的总黄酮含量为51.646 3 mg/g,提取率高达5.16%。经超高效液相色谱-四极杆飞行时间质谱鉴定得63种黄酮成分。超高效液相色谱-四极杆飞行时间质谱正离子模式共检测出48种黄酮成分,分别是芦丁、原花青素B2、表儿茶素、原儿茶醛、柚皮苷查尔酮、柚皮素、儿茶素、异甘草素、二氢槲皮素/紫杉叶素、草酚、木犀草素、异槲皮苷、葛根素、山奈酚、异鼠李素、川橙皮素、芒柄花苷、乔松素、桔皮素、芹菜素、甜橙黄酮、芹菜素-7-葡萄甙、紫云英苷、地奥司明、芫花素、异荭草素、染料木素、根皮素、野漆树苷、黄豆黄素、羟基芫花素、穗花杉双黄酮、荭草苷、大豆苷、淫羊藿苷、牡荆素、杨芽黄素、黄芩苷、白杨素、银椴苷、异樱花亭、夏佛塔苷、金松双黄酮、射干苷元、表没食子儿茶素、光甘草定、牡荆素鼠李糖苷、(+)-没食子儿茶素。超高效液相色谱-四极杆飞行时间质谱负离子模式共检测出15种黄酮成分,分别是表儿茶素没食子酸酯、槲皮素、异鼠李素-3-O-新橙皮苷、槲皮苷、落新妇苷、斯皮诺素、甘草苷、芸香柚皮苷、黄杞苷、表没食子儿茶素没食子酸酯、新橙皮苷、圣草次苷、扁蓄苷、没食子儿茶素没食子酸酯、枸橘苷。
2.2 金荞麦总黄酮对LPS诱导RAW 264.7细胞损伤的影响
2.2.1 RAW 264.7细胞炎症模型的建立
由于LPS暴露的RAW 264.7巨噬细胞表现出显著的细胞活力下降是评估细胞氧化和炎症损伤的常用模型[12]。为了筛选LPS建立RAW 264.7细胞炎症及氧化应激模型的最适作用浓度,选择0、5、10、20、40 μg/mL的LPS处理RAW 264.7细胞12 h。如图1结果表明,LPS浓度低于10 μg/mL时,RAW 264.7的细胞活力与对照组相比没有统计学差异,但在20、40 μg/mL LPS存在下,RAW 264.7的细胞活力显著降低(P<0.01)。因此,选择20 μg/mL LPS为建立RAW 264.7细胞炎症模型的染毒浓度。
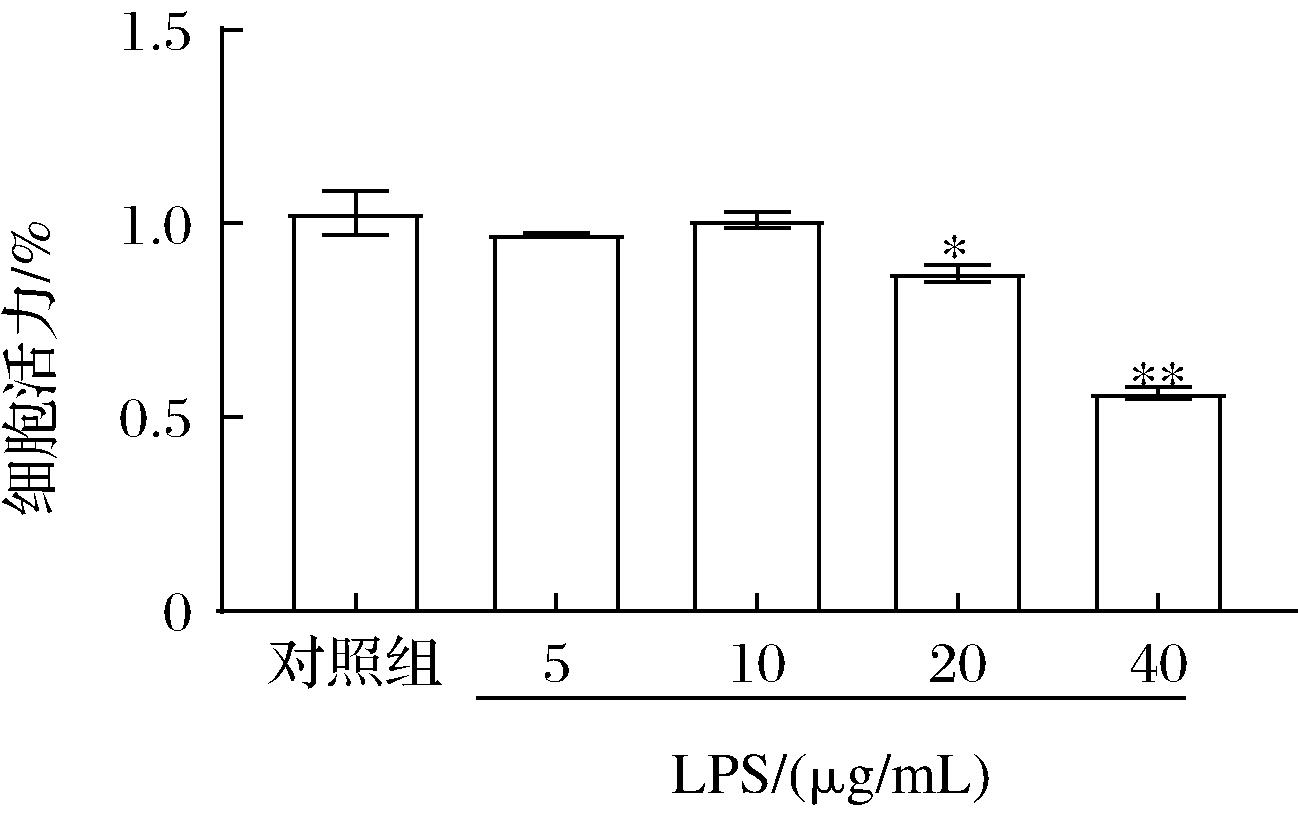
图1 LPS诱导的细胞炎症对RAW 264.7细胞活力的影响
Fig.1 Effect of LPS-induced cellular inflammation on the viability of RAW 264.7 cells
2.2.2 金荞麦总黄酮对RAW 264.7细胞活力的影响
将不同浓度0、25、50、100、200 μg/mL及不同时间9、12、24 h的金荞麦总黄酮作用于RAW 264.7细胞。结果发现,随着各处理组药物浓度的增加,不同处理时间下RAW 264.7细胞的存活率逐渐降低。金荞麦总黄酮浓度为0、25、50 μg/mL作用细胞9、12、24 h后,细胞活力与对照组均无统计学差异(P>0.05)。金荞麦总黄酮处理RAW 264.7细胞9 h时,细胞存活率较12、24 h明显升高,不同浓度下的细胞活力分别为108.66%、104.82%、88.15%、67.87%(图2-a、图2-b、图2-c)。这表明,金荞麦总黄酮处理24 h内的最大安全浓度为50 μg/mL,在此剂量内金荞麦总黄酮的药理活性不受细胞活力的影响(图2-d)。

a-金荞麦总黄酮处理9h对RAW 264.7细胞活力的影响;b-金荞麦总黄酮处理12 h对RAW 264.7细胞活力的影响;c-金荞麦总黄酮处理24 h对RAW 264.7细胞活力的影响;d-金荞麦总黄酮对RAW 264.7细胞活力的剂量和时间依赖性影响
图2 金荞麦总黄酮对RAW 264.7细胞活力的影响
Fig.2 Effects of total flavonoids from Fagopyrum dibotrys on the viability of RAW 264.7 cells
2.2.3 金荞麦总黄酮改善LPS诱导的RAW 264.7细胞损伤
LPS干预使RAW 264.7的细胞存活率显著降低,LDH含量明显增加;而金荞麦总黄酮有效逆转LPS对RAW 264.7细胞活力的抑制以及LDH的释放。这种趋势在金荞麦总黄酮浓度为0~30 μg/mL时呈现剂量依赖性升高,在40 μg/mL时显著降低(P<0.05)。与对照组相比,30 μg/mL金荞麦总黄酮预保护后的细胞活力和LDH释放量无统计学差异(P>0.05,图3-a和图3-b)。综合以上考虑,最终确定金荞麦总黄酮预保护LPS诱导的RAW 264.7细胞的时间为9 h,浓度梯度为10、20、30 μg/mL。
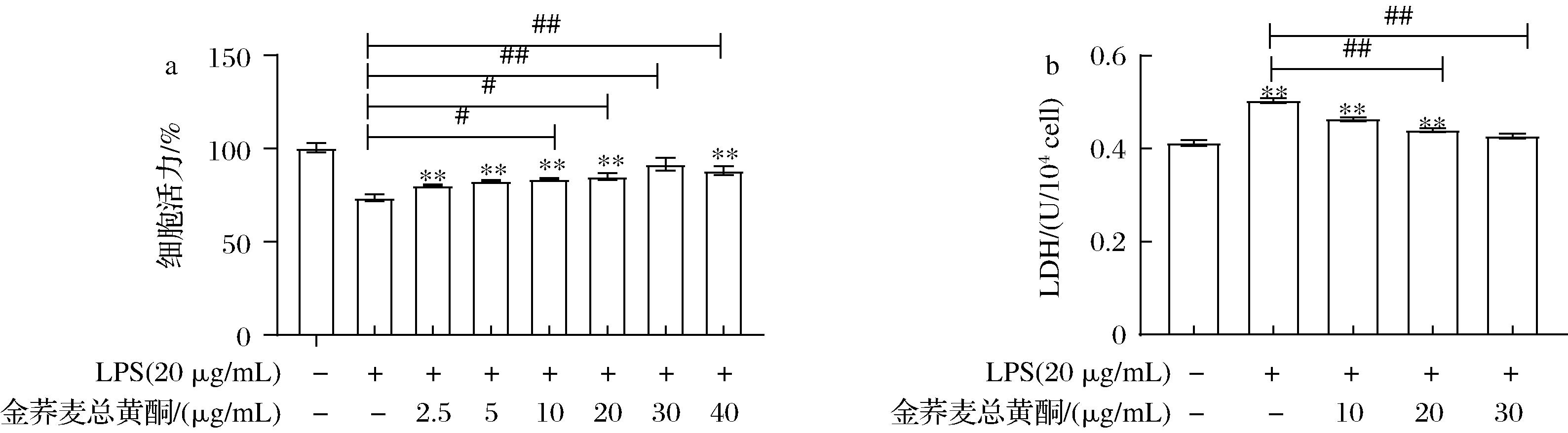
a-金荞麦总黄酮对LPS诱导RAW 264.7细胞活力的影响;b-金荞麦总黄酮对LPS诱导RAW 264.7细胞LDH含量的影响
图3 金荞麦总黄酮对LPS干预RAW 264.7细胞的影响
Fig.3 Effect of total flavonoids of Fagopyrum dibotrys on RAW 264.7 cells induced by LPS
2.2.4 金荞麦总黄酮对LPS诱导的RAW 264.7细胞炎症因子表达的影响
如图4所示,LPS刺激可显著增加巨噬细胞M1极化分泌TNF-α、IL-1β、IL-6和IL-18(P<0.01),而金荞麦总黄酮可有效降低LPS给药的RAW 264.7细胞中促炎M1介质TNF-α、IL-1β、IL-6和IL-18的表达,显著逆转了LPS刺激的作用(P<0.05)。以上结果表明,金荞麦总黄酮可通过抑制巨噬细胞M1极化,从而降低细胞中炎性因子的含量减轻LPS诱导RAW 264.7细胞的炎症反应。

a-IL-6含量;b-IL-18含量;c-IL-1β含量;d-TNF-α含量
图4 金荞麦总黄酮对LPS诱导的RAW 264.7细胞炎症因子表达的影响
Fig.4 Effect of total flavonoids of Fagopyrum dibotrys on the LPS-induced expression of inflammatory factors in RAW 264.7 cells
2.2.5 金荞麦总黄酮对LPS诱导的RAW 264.7细胞氧化应激的影响
如图5所示,与对照组相比,LPS可导致RAW 264.7细胞总ROS产生以及MDA含量明显升高(P<0.05),而GSH、SOD、CAT的表达水平显著降低(P<0.05)。经过金荞麦总黄酮干预后,巨噬细胞产生总ROS和MDA水平呈剂量依赖性降低,LPS诱导的GSH、SOD、CAT的表达逆转(图4-a、图4-b、图4-c、图4-d和图4-e)。以上结果表明,金荞麦总黄酮能有效上调RAW 264.7细胞中GSH与SOD和CAT的表达(P<0.01),清除RAW 264.7细胞内过量的ROS(P<0.01),进而减少由ROS积累诱发多不饱和脂肪酸过氧化产生的MDA。
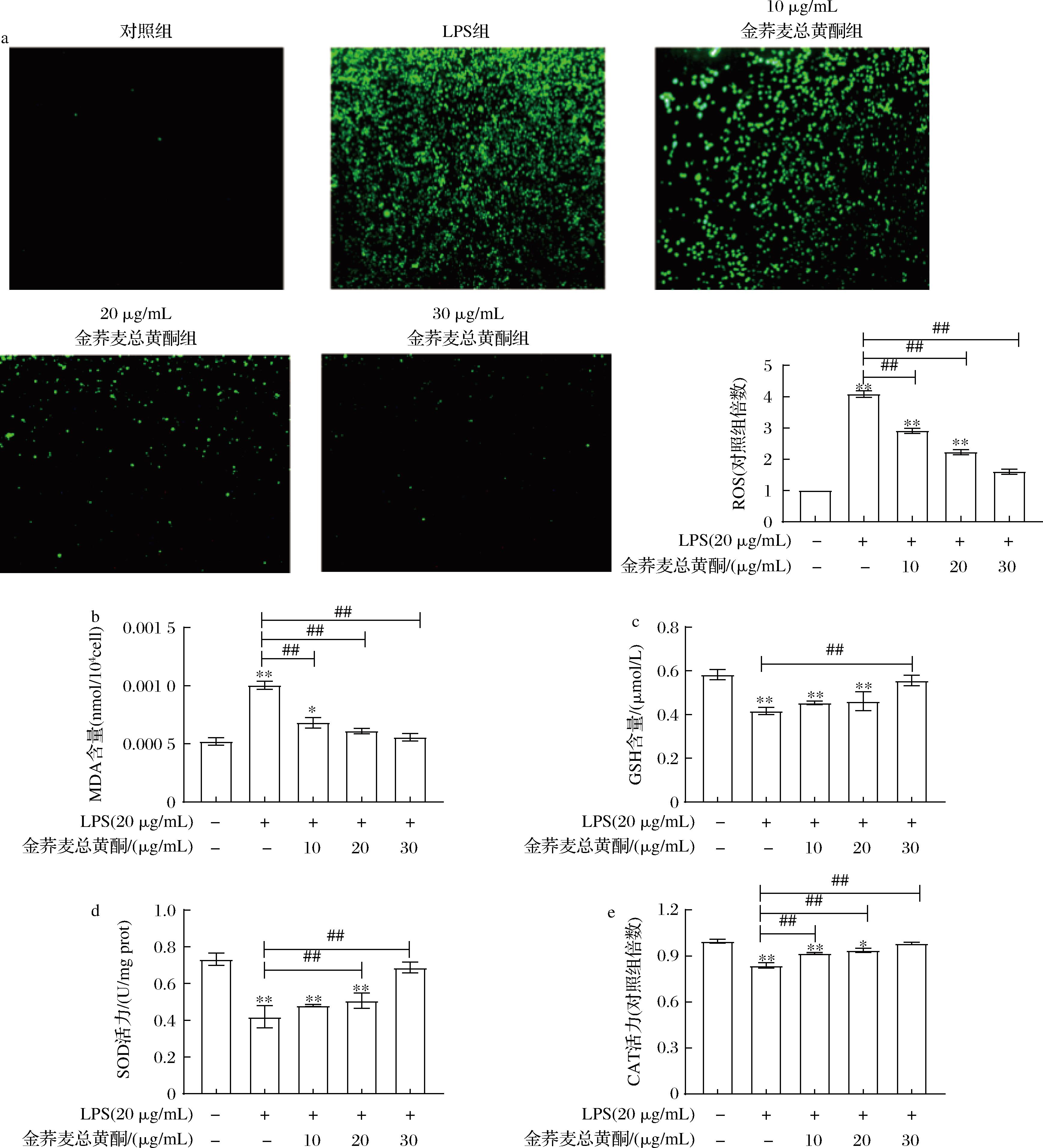
a-ROS水平(×200);b-MDA含量;c-GSH水平;d-SOD活力;e-CAT活力
图5 金荞麦总黄酮对LPS诱导的RAW 264.7细胞氧化应激的影响
Fig.5 Effects of total flavonoids of Fagopyrum dibotrys on oxidative stress induced by LPS in RAW 264.7 cells
2.2.6 金荞麦总黄酮对LPS诱导的RAW 264.7细胞凋亡的影响
如图6所示,LPS组的Hoechst 33342和PI阳性率较对照组显著升高,表明RAW 264.7细胞质膜的完整性严重受损(图6-b)。与LPS组相比,金荞麦总黄酮可有效降低LPS诱导的RAW 264.7细胞Hoechst 33342和PI阳性率,且随着金荞麦给药剂量的升高,活细胞染色的阳性率逐渐降低(图6-c、图6-d和图6-e)。这表明,金荞麦总黄酮可有效对抗LPS干预诱发的RAW 264.7细胞凋亡。

a-对照组;b-LPS组;c-10 μg/mL金荞麦总黄酮组;d-20 μg/mL金荞麦总黄酮组;e-30 μg/mL金荞麦总黄酮组
图6 金荞麦总黄酮对LPS诱导的RAW 264.7细胞凋亡的影响
Fig.6 Effect of total flavonoids of Fagopyrum dibotrys on apoptosis of RAW 264.7 cells induced by LPS
2.3 金荞麦总黄酮对LPS诱导小鼠急性肺损伤的影响
2.3.1 LPS构建小鼠急性肺损伤模型
小鼠肺组织观察大体表现为对照组小鼠肺组织外观正常,肺叶轮廓清晰,质软且富有弹性,表面未见明显出血点;LPS组小鼠肺组织塌陷,表面可见条状性出血及弥漫性出血;金荞麦总黄酮处理组可明显减轻LPS滴鼻造成的肺组织肺充血及结构损伤程度,且呈现剂量依赖性(图7-a)。HE染色结果表明(图7-b),对照组小鼠肺泡结构完整,肺泡壁薄,肺泡腔内少见红细胞和炎性浸润;LPS滴鼻引起小鼠肺泡塌陷结构紊乱,肺泡间隔增厚,肺泡间质和肺泡腔内可见大量红细胞及明显炎性细胞浸润,而金荞麦总黄酮可明显减轻肺组织充血及炎性渗出,且呈剂量依赖性。根据美国胸科协会2010年推出的实验性ALI的标准判断,LPS构建小鼠急性肺损伤模型成功。
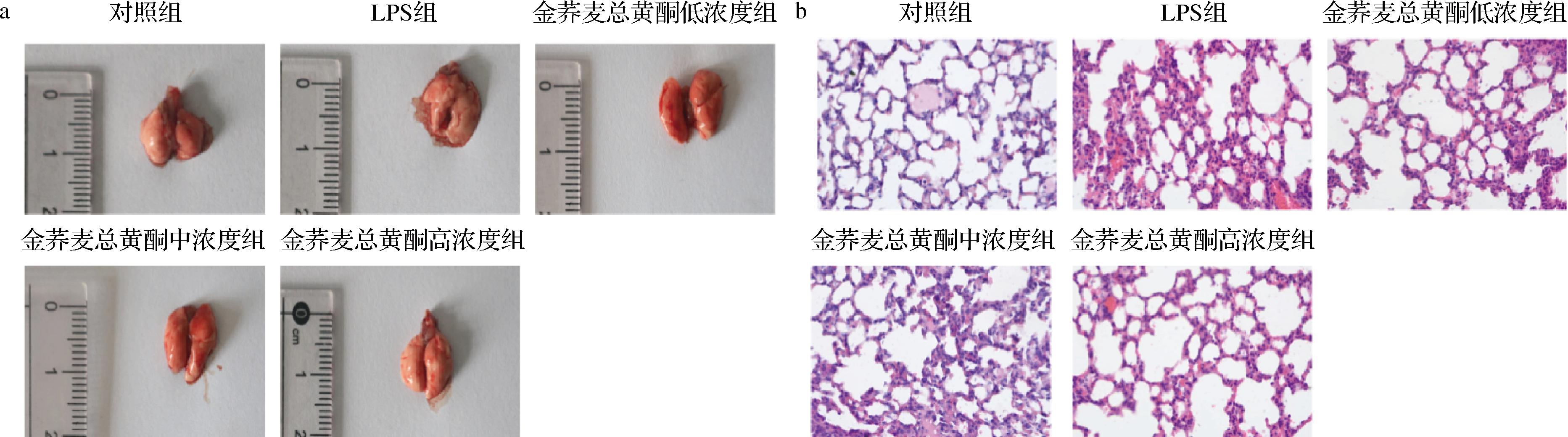
a-肺组织大体观察;b-肺组织HE染色(×400)
图7 小鼠急性肺损伤模型的建立
Fig.7 Establishment of acute lung injury model in mice
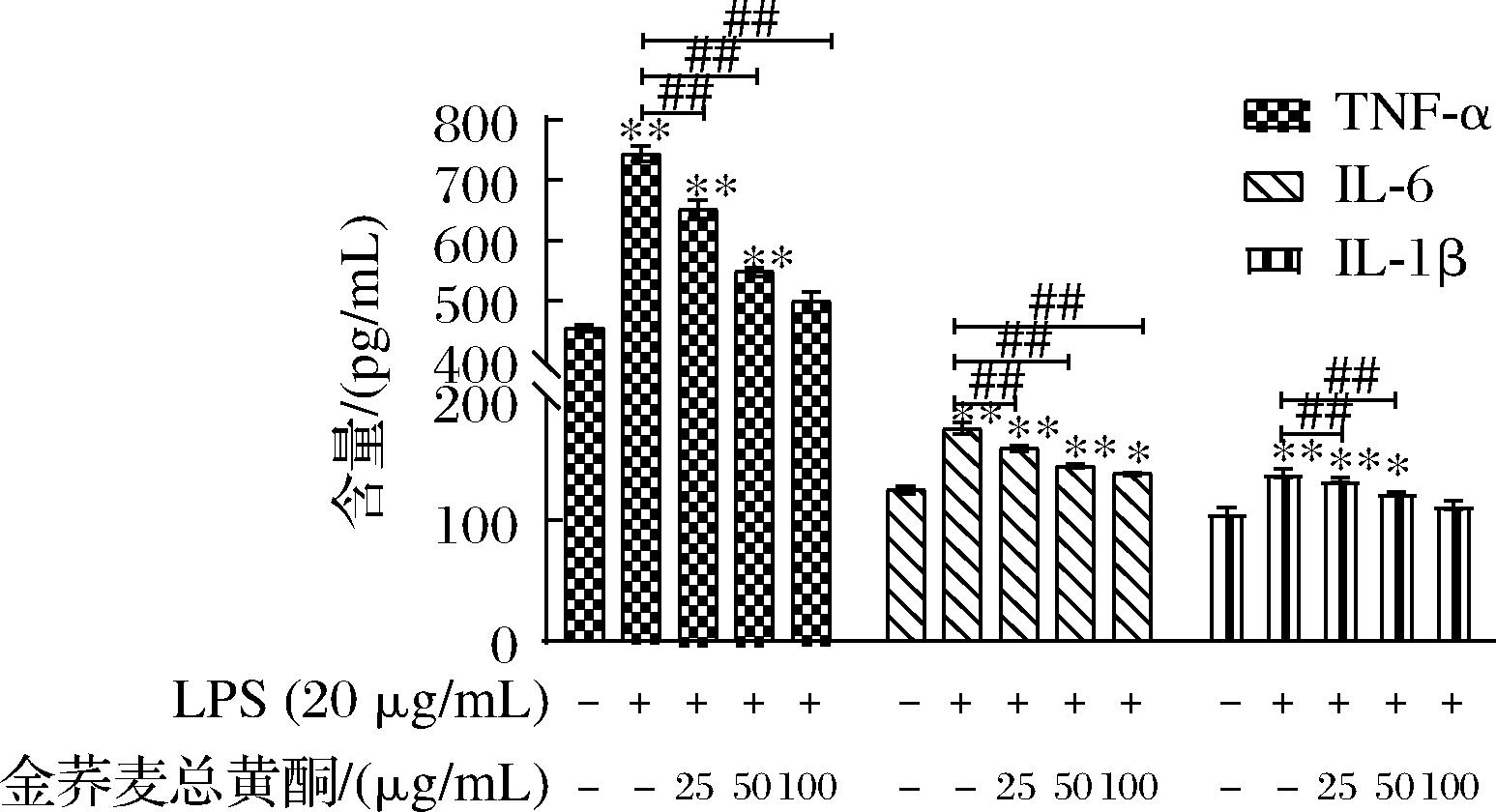
图8 金荞麦总黄酮对LPS诱导急性肺损伤小鼠血清中炎性因子的影响
Fig.8 The influence of total flavonoids of Fagopyrum dibotrys on serum inflammatory factors in LPS-induced ALI mice
2.3.2 金荞麦总黄酮对LPS诱导的急性肺损伤小鼠肺组织湿干重比(W/D)的影响
肺湿干重比(W/D)用于评估肺水肿的程度。如表1所示,与对照组相比,LPS组的肺干湿重量比显著升高(P<0.05),用金荞麦总黄酮(25、50和100 mg/kg) 可有效缓解小鼠肺组织的水肿程度,且W/D以剂量依赖性方式显著降低。这表明,金荞麦总黄酮可有效缓解LPS干预诱发的小鼠肺组织水肿。
表1 金荞麦总黄酮对小鼠肺组织湿干重比(W/D)的影响
Table 1 Effects of total flavonoids of Fagopyrum dibotrys on wet-dry weight ratio of lung tissue in mice
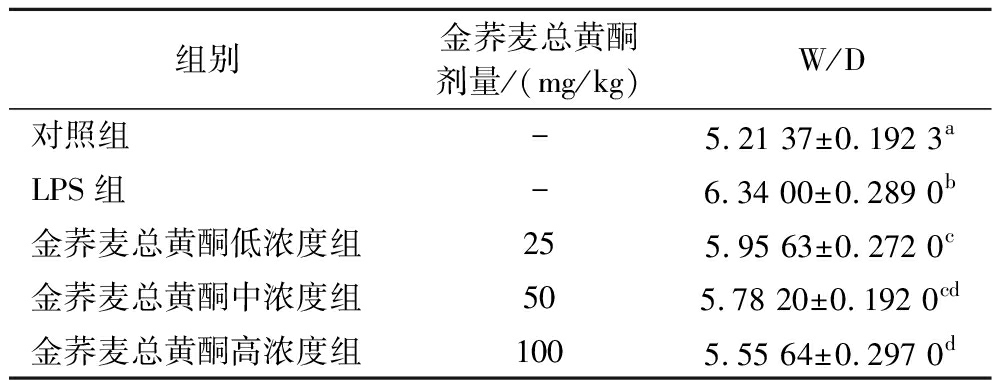
组别金荞麦总黄酮剂量/(mg/kg)W/D对照组-5.21 37±0.192 3aLPS组-6.34 00±0.289 0b金荞麦总黄酮低浓度组255.95 63±0.272 0c金荞麦总黄酮中浓度组505.78 20±0.192 0cd金荞麦总黄酮高浓度组1005.55 64±0.297 0d
注:-表示未加入金荞麦总黄酮;abcd标记的各平均数间,凡有一个相同标记字母的即为差异不显著,凡具不同标记字母的即为差异显著(下同)。
2.3.3 金荞麦总黄酮对LPS诱导的急性肺损伤小鼠血清中炎性因子的影响
如图7所示,LPS滴鼻给药可显著增加小鼠血清中TNF-α、IL-1β和IL-6的含量(P<0.01),而金荞麦总黄酮可有效降低LPS刺激引起的小鼠血清中促炎介质TNF-α、IL-1β和IL-6的分泌(P<0.01),显著逆转了LPS干预的作用。结果表明,金荞麦总黄酮可通过减少小鼠血中炎性因子的分泌减轻LPS诱导小鼠肺组织炎症反应。
2.3.4 金荞麦总黄酮对LPS诱导的急性肺损伤小鼠血清中氧化应激标志物的影响
如表2所示,与对照组相比,LPS可导致小鼠血清中H2O2和MDA含量明显升高,而CAT的活性显著降低(P<0.01)。经过金荞麦总黄酮干预后,小鼠血清中产生H2O2和MDA水平呈剂量依赖性降低CAT活力水平呈现逆转(P<0.01)。以上结果表明,金荞麦总黄酮能有效上调小鼠血清中抗氧化酶CAT的表达,减少由活性氧积累产生的MDA和H2O2,从而减轻LPS干预诱发的小鼠肺组织氧化应激反应。
表2 金荞麦总黄酮对LPS诱导的急性肺损伤小鼠血清中氧化应激标志物的影响
Table 2 Effects of total flavonoids of Fagopyrum dibotrys on serum oxidative stress factors in LPS-induced ALI mice
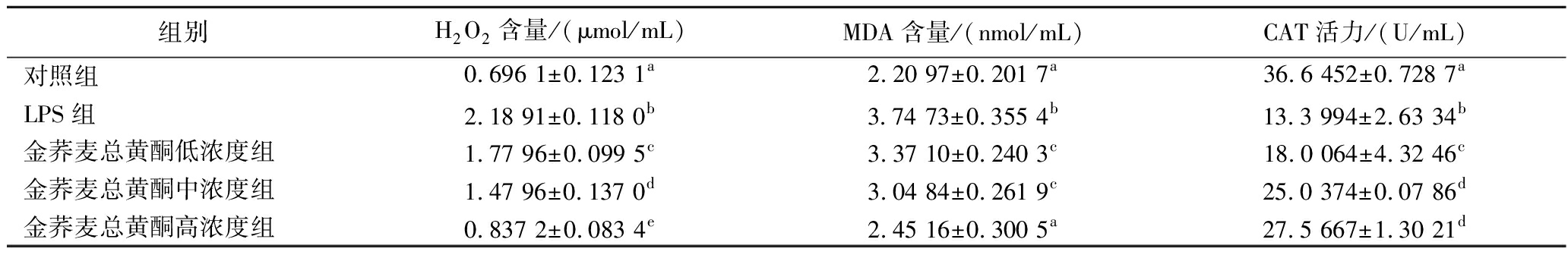
组别H2O2含量/(μmol/mL)MDA含量/(nmol/mL)CAT活力/(U/mL)对照组0.696 1±0.123 1a2.20 97±0.201 7a36.6 452±0.728 7aLPS组2.18 91±0.118 0b3.74 73±0.355 4b13.3 994±2.63 34b金荞麦总黄酮低浓度组1.77 96±0.099 5c3.37 10±0.240 3c18.0 064±4.32 46c金荞麦总黄酮中浓度组1.47 96±0.137 0d3.04 84±0.261 9c25.0 374±0.07 86d金荞麦总黄酮高浓度组0.837 2±0.083 4e2.45 16±0.300 5a27.5 667±1.30 21d
2.4 讨论
急性肺损伤是临床上常见的危重症之一,主要发病机制为肺部或全身不可控的炎症,可发生于动物生长的各个阶段,患病率和死亡率居高不下[13]。巨噬细胞是急性肺损伤发病机制中的关键协调者,是抵御空气传播颗粒和微生物的第一道防线,其功能传统上被认定为“M1经典活化巨噬细胞(CAM)”与“M2替代活化巨噬细胞(AAM)”,M1巨噬细胞的特征是分泌促炎因子,如IL-1β、IL-6、IL-18和TNF-α等促进自身免疫性疾病[14-15]。异常的巨噬细胞极化是氧化应激和炎症反应之间的中心联系,能引起微环境中的ROS与DNA、脂质(包括磷脂)以及抗氧化系统的分子相互作用,破坏氧化还原平衡,导致免疫系统对功能程序、分泌产物和周围组织微环境的错误调节[16]。研究表明,多形核中性粒细胞的外泌体miR-30 d-5p静脉注射可显著降低盲肠结扎和穿刺(CLP)诱导的ALI小鼠肺中M1巨噬细胞活化和巨噬细胞死亡[17];宣肺白汤通过下调LPS诱导的急性肺损伤小鼠中促炎细胞因子如IL-6、TNF-α和IL-1β的表达以及巨噬细胞和中性粒细胞浸润来改善肺损伤[18]。因此,调节巨噬细胞的异常极化可能是改善急性肺损伤的重要途径。
由多种致病性病原菌经摄食进入人体内引起以炎症为主的急性肺损伤,已成为危害人类健康安全的世界性难题。大量研究表明,革兰氏阴性菌外膜的脂多糖滴鼻或气管滴注可有效增加ROS的产生以及炎症因子的释放,可有效模拟急性肺损伤的发病过程[19-20]。因此,本研究利用LPS建立RAW 264.7细胞损伤模型和小鼠急性肺损伤模型,结果表明,20 μg/mL LPS处理RAW 264.7细胞,可诱导RAW 264.7向M1状态极化分泌IL-1β、IL-6、IL-18和TNF-α等促炎细胞因子,产生ROS,诱发氧化应激和炎症反应,炎性因子的大量释放进一步加剧了活性氧的累积,细胞质膜完整性受损,将LDH迅速释放至细胞外,导致细胞大量死亡;昆明小鼠以1 mg/kg LPS滴鼻给药,可诱导小鼠肺组织湿干重比升高呈现肺水肿,大量释放促炎细胞因子和氧化应激产物,降低抗氧化酶的活性。这提示,LPS成功建立小鼠体内外急性肺损伤模型。
金荞麦是我国首先发掘的一种新型抗感染药物,能安全及有效地提升呼吸系统健康,具有多种有益机体健康的药理活性,其中黄酮类成分具有极高的抗炎与抗氧化能力[21-27]。据报道,黄酮类成分可通过降低M1巨噬细胞比例和增加M2巨噬细胞比例来发挥抗炎作用[28-29]。研究表明,表没食子儿茶素-3-没食子酸酯调节巨噬细胞向M2状态极化,降低LPS给药的肺微环境中促炎M1介质iNOS、TNF-α、IL-1β和IL-6的表达,减轻了8-羟基脱氧鸟苷(8-OHdG)、硝基酪氨酸的表达,表明其抗炎和抑制氧化损伤的能力[30];鸢尾黄酮可抑制LPS诱导的内皮细胞损伤和M1极化,减少肾组织中巨噬细胞浸润和M1极化来抑制肾脏炎症[31]。以上研究表明,抑制巨噬细胞的M1极化可有效调节炎症损伤。因此,我们推测金荞麦黄酮可作为一种绿色保健食品预防人类和动物急性肺损伤的发生。本实验发现,金荞麦总黄酮能通过上调RAW 264.7细胞和小鼠血清中抗氧化酶的活力,提高抗氧化基因的表达,进而清除LPS积累的ROS和H2O2,减少ROS氧化多不饱和脂肪酸产生的MDA,继而减轻小鼠肺组织和RAW 264.7细胞氧化应激损伤。金荞麦总黄酮还可有效抑制RAW 264.7细胞M1极化,从而减少小鼠血清和细胞上清液中IL-1β、IL-6和TNF-α等的过度分泌;通过抵御LPS对RAW 264.7细胞质膜完整性的破坏,减少LDH以及促炎因子释放至胞外。这表明,金荞麦总黄酮发挥其抗炎、抗氧化及抗凋亡的作用向巨噬细胞M1状态极化、保护细胞质膜的完整性从而缓解LPS诱导的小鼠急性肺损伤。
3 结论
本研究采用LPS构建小鼠急性肺损伤及RAW 264.7细胞损伤模型,通过观察氧化生物标志物、炎性因子指标的变化及细胞凋亡率,探讨金荞麦总黄酮对LPS诱导小鼠急性肺损伤的影响。研究发现,金荞麦总黄酮能有效升高LPS诱导的抗氧化酶SOD和CAT的活力,提高抗氧化基因GSH的表达,进而清除积累的ROS、MDA和H2O2抵御氧化损伤;金荞麦总黄酮能明显抑制巨噬细胞向M1极化,减少促炎介质的分泌,从而减轻炎症损伤;金荞麦总黄酮通过保障细胞活力、减少LDH的释放并保护细胞膜的完整性,从而抑制细胞凋亡;金荞麦总黄酮通过降低小鼠肺干湿比重从而缓解肺组织水肿。综上表明,金荞麦总黄酮具有抗炎、抗氧化及抗凋亡作用,能缓解LPS诱导的小鼠急性肺损伤,为金荞麦总黄酮作为功能性食品、绿色保健品的开发提供实验依据和新思路。
[1] YANG Q,LUO C L,ZHANG X M,et al.Tartary buckwheat extract alleviates alcohol-induced acute and chronic liver injuries through the inhibition of oxidative stress and mitochondrial cell death pathway[J].American Journal of Translational Research,2020,12(1):70-89.
[2] 谭娅,甘麦邻,范源,等.金荞麦对脂多糖诱导小鼠小肠炎症的保护作用[J].中国畜牧兽医,2020,47(2):597-604.
TAN Y,GAN M L,FAN Y,et al.Protective effects of Fagopyrum dibotrys on lipopolysaccharide-induced intestinal inflammation in mice[J].China Animal Husbandry &Veterinary Medicine,2020,47(2):597-604.
[3] 张冰坤,沈永强,卢寿运,等.金荞麦粗提物对三黄母仔鸡生长性能和免疫功能的影响[J].广东饲料,2020,29(11):21-25.
ZHANG B K,SHEN Y Q,LU S Y,et al.Effects of crude extract of Fagopyrum dibotrys on growth performance and immune function of Sanhuang hens[J].Guangdong Feed,2020,29(11):21-25.
[4] 张兆远.改善2型糖尿病金荞麦活性部位筛选及其药理作用研究[D].黑龙江:黑龙江八一农垦大学,2017.
ZHANG Z Y.Study on screening the active fractionatin and pharmacological action of Fagopyri dibotryris Rhizomam in improving T2DM[D].Heilongjiang:Heilongjiang Bayi Agricultural University,2017.
[5] 卢俊英.二氢欧山芹醇对脂多糖诱导小鼠急性肺损伤的保护作用与机制研究[D].吉林:吉林大学,2019.
LU J Y.Protective Effects and mechanisms of columbianetin on lipopolysaccharide-induced acute lung injury in mice[D].Jilin :Jilin University,2019.
[6] ZHAO X,YU Z Z,LYU Z,et al.Activation of alpha-7 nicotinic acetylcholine receptors (α7nAchR) promotes the protective autophagy in LPS-induced acute lung injury (ALI) in vitro and in vivo[J].Inflammation,2019,42(6):2236-2245.
[7] LEI J J,WEI Y L,SONG P C,et al.Cordycepin inhibits LPS-induced acute lung injury by inhibiting inflammation and oxidative stress[J].European Journal of Pharmacology,2018,818:110-114.
[8] WU H C,ZHAO G,JIANG K F,et al.Plantamajoside ameliorates lipopolysaccharide-induced acute lung injury via suppressing NF-κB and MAPK activation[J].International Immunopharmacology,2016,35:315-322.
[9] HE W,KAPATE N,SHIELDS C W 4th,et al.Drug delivery to macrophages:A review of targeting drugs and drug carriers to macrophages for inflammatory diseases[J].Advanced Drug Delivery Reviews,2020,165-166:15-40.
[10] JOSHI N,WALTER J M,MISHARIN A V.Alveolar macrophages[J].Cellular Immunology,2018,330:86-90.
[11] BAZZAN E,TURATO G,TIN M,et al.Dual polarization of human alveolar macrophages progressively increases with smoking and COPD severity[J].Respiratory Research,2017,18(1):40.
M,et al.Dual polarization of human alveolar macrophages progressively increases with smoking and COPD severity[J].Respiratory Research,2017,18(1):40.
[12] HO E,KARIMI GALOUGAHI K,LIU C C,et al.Biological markers of oxidative stress:Applications to cardiovascular research and practice[J].Redox Biology,2013,1(1):483-491.
[13] JANZ D R,WARE L B.Biomarkers of ALI/ARDS:Pathogenesis,discovery,and relevance to clinical trials[J].Seminars in Respiratory and Critical Care Medicine,2013,34(4):537-548.
[14] HE W,KAPATE N,SHIELDS C W 4th,et al.Drug delivery to macrophages:A review of targeting drugs and drug carriers to macrophages for inflammatory diseases[J].Advanced Drug Delivery Reviews,2020,165-166:15-40.
[15] GEA-SORL S,GUILLAMAT R,SERRANO-MOLLAR A,et al.Activation of lung macrophage subpopulations in experimental acute pancreatitis[J].The Journal of Pathology,2011,223(3):417-424.
S,GUILLAMAT R,SERRANO-MOLLAR A,et al.Activation of lung macrophage subpopulations in experimental acute pancreatitis[J].The Journal of Pathology,2011,223(3):417-424.
[16] TIAN S Y,WANG J,GAO R,et al.Galacto-oligosaccharides directly attenuate lipopolysaccharides-induced inflammatory response,oxidative stress and barrier impairment in intestinal epithelium[J].Journal of Functional Foods,2022,91:105006.
[17] JIAO Y,ZHANG T,ZHANG C M,et al.Exosomal miR-30d-5p of neutrophils induces M1 macrophage polarization and primes macrophage pyroptosis in sepsis-related acute lung injury[J].Critical Care,2021,25(1):356.
[18] WANG Y Y,WANG X,LI Y X,et al.Xuanfei Baidu Decoction reduces acute lung injury by regulating infiltration of neutrophils and macrophages via PD-1/IL17A pathway[J].Pharmacological Research,2022,176:106083.
[19] LIU P F,FENG Y T,LI H W,et al.Ferrostatin-1 alleviates lipopolysaccharide-induced acute lung injury via inhibiting ferroptosis[J].Cellular &Molecular Biology Letters,2020,25:10.
[20] SHI J,YU J B,ZHANG Y,et al.PI3K/Akt pathway-mediated HO-1 induction regulates mitochondrial quality control and attenuates endotoxin-induced acute lung injury[J].Laboratory Investigation,2019,99(12):1795-1809.
[21] LI X,LIU J L,CHANG Q X,et al.Antioxidant and antidiabetic activity of proanthocyanidins from Fagopyrum dibotrys[J].Molecules,2021,26(9):2417.
[22] JIN Y J,JANG M G,KIM J W,et al.Anti-obesity effects of polymethoxyflavone-rich fraction from jinkyool (Citrus sunki hort.ex Tanaka) leaf on obese mice induced by high-fat diet[J].Nutrients,2022,14(4):865.
[23] 侯振平,郑霞,陈青,等.金荞麦的营养价值、提取物生物活性及其在动物生产中的应用[J].动物营养学报,2021,33(6):3019-3027.
HOU Z P,ZHENG X,CHEN Q,et al.Nutritional value,bioactivity of extract and application in animal production of Fagopyrum dibotrys[J].Chinese Journal of Animal Nutrition,2021,33(6):3019-3027.
[24] 王璐瑗,黄娟,陈庆富,等.金荞麦的研究进展[J].中药材,2019,42(9):2206-2208.
WANG L Y,HUANG J,CHEN Q F,et al.Research progress of Fagopyrum cymosum[J].Journal of Chinese Medicinal Materials,2019,42(9):2206-2208.
[25] 罗庆林,周美亮,陈松树,等.金荞麦的活性成分和药用价值研究进展[J].山地农业生物学报,2020,39(2):1-13.
LUO Q L,ZHOU M L,CHEN S S,et al.Research progress of active components and medicinal value of Fagopyrum cymosum[J].Journal of Mountain Agriculture and Biology,2020,39(2):1-13.
[26] 王璐瑗.金荞麦根茎药用品质及其遗传研究[D].贵阳:贵州师范大学,2020.
WANG L Y.Medicinal quality and genetic research of golden buckwheat (Fagopyrum cymosum) rhizome[D].Guizhou:Guizhou Normal University,2020.
[27] JING R,LI H Q,HU C L,et al.Phytochemical and pharmacological profiles of three Fagopyrum buckwheats[J].International Journal of Molecular Sciences,2016,17(4):589.
[28] WANG Y R,XU Y,ZHANG P P,et al.Smiglaside A ameliorates LPS-induced acute lung injury by modulating macrophage polarization via AMPK-PPARγ pathway[J].Biochemical Pharmacology,2018,156:385-395.
[29] SHABANI M,SADEGHI A,HOSSEINI H,et al.Resveratrol alleviates obesity-induced skeletal muscle inflammation via decreasing M1 macrophage polarization and increasing the regulatory T cell population[J].Scientific Reports,2020,10:3791.
[30] ALMATROODI S A,ALMATROUDI A,ALSAHLI M A,et al.Epigallocatechin-3-gallate (EGCG),an active compound of green tea attenuates acute lung injury regulating macrophage polarization and Krüpple-like-factor 4 (KLF4) expression[J].Molecules,2020,25(12):2853.
[31] YANG S,MA C R,WU H,et al.Tectorigenin attenuates diabetic nephropathy by improving vascular endothelium dysfunction through activating AdipoR1/2 pathway[J].Pharmacological Research,2020,153:104678.