致泻大肠埃希氏菌(diarrheagenic Escherichia coli,DEC)是全球范围内引起腹泻的重要食源性致病菌,对食品安全、人类健康和社会经济造成了严重的影响[1]。常见的引起人类发病的DEC有5种,包括肠道致病性大肠埃希氏菌(enteropathogenic Escherichia coli,EPEC)、肠道侵袭性大肠埃希氏菌(enteroinvasive Escherichia coli,EIEC)、产肠毒素大肠埃希氏菌(enterotoxigenic Escherichia coli,ETEC)、产志贺毒素大肠埃希氏菌(shiga toxin-producing Escherichia coli,STEC)或称为肠道出血性大肠埃希氏菌(enterohemorrhagic Escherichia coli,EHEC)与肠道聚集性大肠埃希氏菌(enteroaggregative Escherichia coli,EAEC)[2]。DEC感染后,不仅会导致人腹泻,还会引起恶心、发热及溶血性尿毒综合征等症状,甚至导致死亡[3-6]。DEC在自然界分布广泛,极易污染食品,GB 29921—2021《食品安全国家标准 预包装食品中致病菌限量》规定在牛肉制品、即食生肉制品、发酵肉制品及去皮或预切的水果与蔬菜食品中5份25 g样本中均不可检出。但DEC型别多样,检测上易与无害的普通大肠埃希氏菌混淆[7]。因此,建立适用现场、快速且同时能实现DEC检测与分型的方法对快速确定DEC污染来源、保障食品安全具有重要意义。
近年来,随着对DEC致病机制的深入研究和分子生物技术的不断发展,DEC的检测已经由分子分型检测法代替了传统免疫分型检测法[8]。目前常用的分型DEC方法,如国标法GB 4789.6—2016《食品安全国家标准 食品微生物学检验 致泻大肠埃希氏菌检验》采用PCR扩增待检菌携带的不同目标基因,结合琼脂糖电泳方法来鉴定其具体型别,但此方法操作繁琐,工作量巨大。多重核酸扩增通过向同一反应体系中加入多对引物可实现同时对多个目标基因的检测,如胡安妥等[9]和袁慕云等[10]构建的多重荧光PCR方法,可以节约时间并有效判定样本中大肠埃希氏菌的致病型,但也需依赖专业的场所及昂贵的仪器设备。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)在2000年被日本学者NOTOMI等[11]首次提出,是一种不依赖专业设备、适用于现场和基层的核酸扩增方法。该方法利用具有高链置换活性的DNA聚合酶(Bst DNA polymerase)和4~6条特异性引物识别目标DNA上6个区域来进行扩增,在短时间(15~60 min)、恒温条件下可将有限的初始DNA拷贝数实现109~1010倍的扩增。LAMP目前已在食品安全[12-13]、临床诊断[14]与法医鉴定[15]等方面得到了广泛应用。
本研究针对DEC的8段特征毒力基因pic、aggR、lt、st、stx1、stx2、escV、invE及大肠埃希氏菌属特异性基因uidA设计LAMP引物,构建实时荧光LAMP方法,实现对DEC的快速检测及分型。该方法简化了操作步骤,降低了设备门槛,提高了分型速度,为DEC的检测及防控提供了重要技术支持,有利于保障食品安全,促进公众健康。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株信息
菌株及编号见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.036329),由江西省疾病预防控制中心提供。
表1 实时荧光LAMP方法与国标法各特征基因检出限
Table 1 Detection limits comparison between this method and national standard method

方法pic (EAEC)aggR(EAEC)lt(ETEC)st(ETEC)sth(ETEC)stx1(STEC)stx2(STEC)escV(EPEC)invE(EIEC)uidA本方法1 ng/μL100 pg/μL10 pg/μL10 pg/μL100 pg/μL10 pg/μL1 ng/μL100 pg/μL100 pg/μL国标法10 ng/μL10 ng/μL10 ng/μL1 ng/μL1 ng/μL1 ng/μL10 ng/μL10 ng/μL10 ng/μL
1.1.2 试剂
营养琼脂(nutrient agar,NA)、营养肉汤(nutrient broth,NB),青岛高科技工业园海博生物技术有限公司;10×LAMP缓冲溶液、Bst DNA聚合酶(Bst Ⅱ DNA Polymerase),翌圣生物科技(上海)股份有限公司;dNTP Mix,南京诺唯赞生物科技有限公司;SYBR Green Ⅰ,北京金博益生物科技有限公司;引物(HPLC级),上海生工生物有限公司。
1.1.3 仪器与设备
QT-1旋涡混合器,中国上海琪特分析仪器有限公司;QuantStudio 12K荧光扩增平台,美国ABI公司;Synergy超纯水系统,德国Merck Millipore公司;ZWYR-4912恒温振荡培养箱,中国上海智城分析仪器制造有限公司;1-16K冷冻离心机,德国Sigma Laborzentrifugen公司;LTI-1200 W生化培养箱,日本东京理化公司;AC2-6S1生物安全柜,新加坡ESCO公司;QIAxcel Advanced全自动实时毛细管电泳仪,德国QIAGEN公司;K5500Plus超微量分光光度计,中国北京凯奥科技发展有限公司。
1.2 实验方法
1.2.1 检测目标基因的选择及引物设计
DEC根据其致病机制、血清学及毒力因子等特征主要被分为5种类型,分别为EAEC、ETEC、EPEC、STEC和EIEC。其中,escV为EPEC特征性毒力基因;stx1与stx2为STEC特征性毒力基因;invE为EIEC特征性毒力基因,aggR与pic为EAEC特征性毒力基因。热稳定性肠毒素基因(st)[16]和lt为ETEC特征性毒力基因。此外,uidA为大肠埃希氏菌属特异性基因,所以研究根据上述9段基因序列设计LAMP引物。
根据NCBI数据库中公布的pic(登录号:AF097644.1)、aggR(登录号:Z18751)、lt(登录号:EU113250)、st(登录号:AJ868113.1)、stx1(登录号:AE005174.2)、stx2(登录号:AE005174.2)、escV(登录号:FM180568.1)、invE(登录号:AF283289.1)及uidA(登录号:S69414.1)的基因序列,利用Primer Explorer V5软件进行引物设计,引物序列见附表2(https://doi.org/10.13995/j.cnki.11-1802/ts.036329)。
表2 实时荧光LAMP的特异性评价
Table 2 Specificity evaluation of the real-time fluorescent LAMP
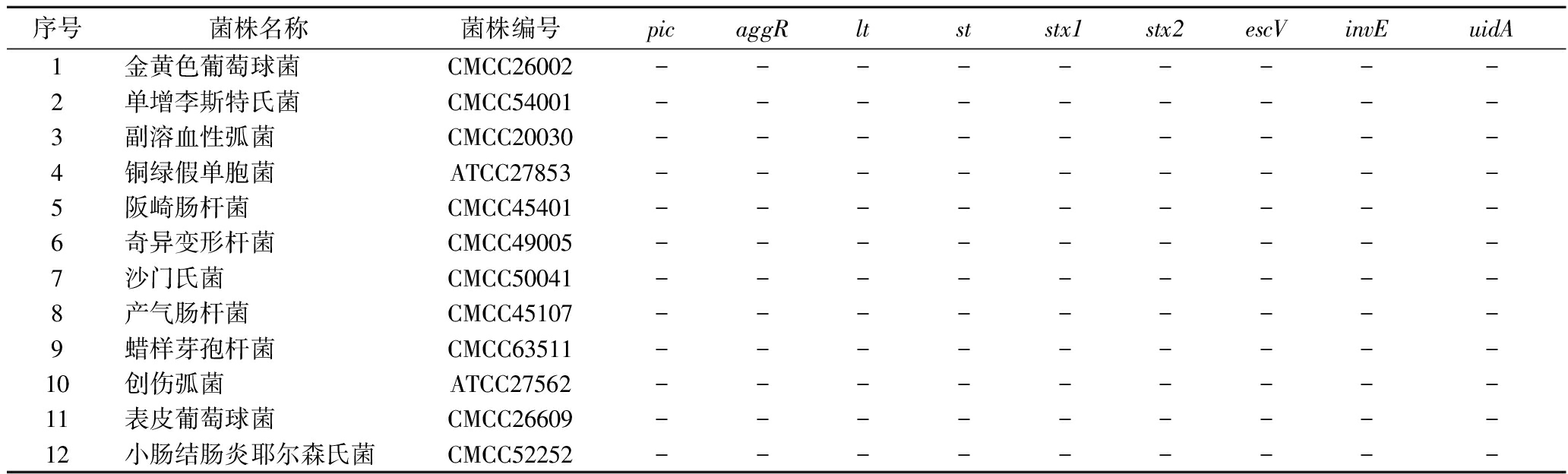
序号菌株名称菌株编号picaggRltststx1stx2escVinvEuidA1金黄色葡萄球菌CMCC26002---------2单增李斯特氏菌CMCC54001---------3副溶血性弧菌CMCC20030---------4铜绿假单胞菌ATCC27853---------5阪崎肠杆菌CMCC45401---------6奇异变形杆菌CMCC49005---------7沙门氏菌CMCC50041---------8产气肠杆菌CMCC45107---------9蜡样芽孢杆菌CMCC63511---------10创伤弧菌ATCC27562---------11表皮葡萄球菌CMCC26609---------12小肠结肠炎耶尔森氏菌CMCC52252---------
注:“+”表示扩增出曲线,“-”表示没有扩增出曲线(下同)。
1.2.2 细菌培养和DNA提取
菌株接种于10 mL NB培养基中,37 ℃振荡(160 r/min)活化培养12 h后,菌液划线于NA培养基平板,置于37 ℃培养12 h,再挑取单菌落接种于10 mL NB培养基,37 ℃振荡(160 r/min)培养12 h。采用煮沸法提取菌株DNA,步骤如下:取1 mL液体培养基,置于冷冻离心机中离心5 min(4 ℃,9 000 r/min),弃上清液。然后用1 mL超纯水清洗菌体沉淀,在4 ℃条件下离心5 min(9 000 r/min),弃上清液。再向离心管中加入200 μL超纯水复溶,在100 ℃的恒温金属浴锅中煮沸裂解10 min后,迅速冰浴5 min,离心5 min(4 ℃,9 000 r/min),保留上清液,作为DNA粗提物,用超微量分光光度计检测DNA浓度。
1.2.3 LAMP引物的验证及反应体系的优化
LAMP基础反应体系为:10×LAMP缓冲溶液(含80 mmol/L MgSO4)2.5 μL;dNTP Mix(10 mmol/L)3.5 μL;内引物(FIP/BIP,40 μmol/L)1 μL;外引物(F3/B3,5 μmol/L)1 μL;环引物(LF/LB,10 μmol/L)1 μL;Bst DNA聚合酶(8 U/μL)1 μL;SYBR Green I(10×)1 μL及DNA模板(10 ng/μL)1 μL,按顺序依次添加,最后超纯水补齐至25 μL。将配制后的LAMP体系置于65 ℃加热1 h,利用毛细管电泳仪分析扩增产物,对引物的扩增能力进行验证。
在基础反应体系的基础上对部分条件进行优化:SYBR Green I(10×)添加量为0.5、1、1.5、2.5 μL;环引物(LF/LB,10 μmol/L)添加量为0、0.5、1、2 μL;Bst DNA聚合酶(2、4、6、8 U/μL)1 μL;根据优化的结果确定各特征基因的最优反应体系。
1.2.4 实时荧光LAMP分型DEC方法的建立
以1 μL 10 ng/μL的EAEC、ETEC、EPEC、STEC、EIEC及普通大肠埃希氏菌标准菌株的DNA为阳性模板,分别加入对应的优化好的LAMP反应体系,通过荧光扩增曲线判断该方法是否能实现对5种DEC及普通大肠埃希氏菌的快速分型。
1.2.5 实时荧光LAMP方法检出限的评价及与国标方法的对比
将标准菌株粗提取得到的DNA模板质量浓度调整为:100 ng/μL、10 ng/μL、1 ng/μL、100 pg/μL与10 pg/μL,用上述DNA对本方法的检出限进行评价,通过荧光扩增曲线判断各特征基因的检出限。同时,用国标法GB 4789.6—2016中的PCR扩增结合电泳法进行对比,以比较2种方法在检出限上的差异。
1.2.6 实时荧光LAMP方法的特异性评价
采用12株非大肠埃希氏菌标准菌株,评价该方法特异性(排他性)。包括金黄色葡萄球菌、单增李斯特氏菌、副溶血性弧菌、铜绿假单胞菌、阪崎肠杆菌、奇异变形杆菌、沙门氏菌、产气肠杆菌、蜡样芽孢杆菌、创伤弧菌、表皮葡萄球菌及小肠结肠炎耶尔森氏菌。
1.2.7 实际菌株的验证
采用从食源性疾病患者粪便样本中分离出的23株临床株对本研究构建的实时荧光LAMP方法进行验证。分离株包括:5株EAEC、5株ETEC、5株EPEC、5株STEC、1株EIEC及2株普通大肠埃希氏菌。与实际结果对比,评价本方法对DEC的检出灵敏度(包容性)及分型DEC的准确性。
2 结果与分析
2.1 LAMP引物扩增能力的验证
利用设计好的LAMP引物,构建LAMP反应体系。分别以EAEC、ETEC、STEC、EPEC和EIEC为阳性模板,超纯水作为阴性对照,对pic、aggR、lt、st、stx1、stx2、escV、invE以及uidA的LAMP引物扩增能力进行验证。利用毛细管电泳仪对每组基因的LAMP扩增产物进行检测。结果如图1所示,添加了对应目标菌DNA的阳性组(+)其扩增产物都显示出了弥散性的梯状条带,每种基因的阴性组(-)均未见条带产生,结果表明,本文设计的LAMP引物具有良好的扩增能力,且特异性强。
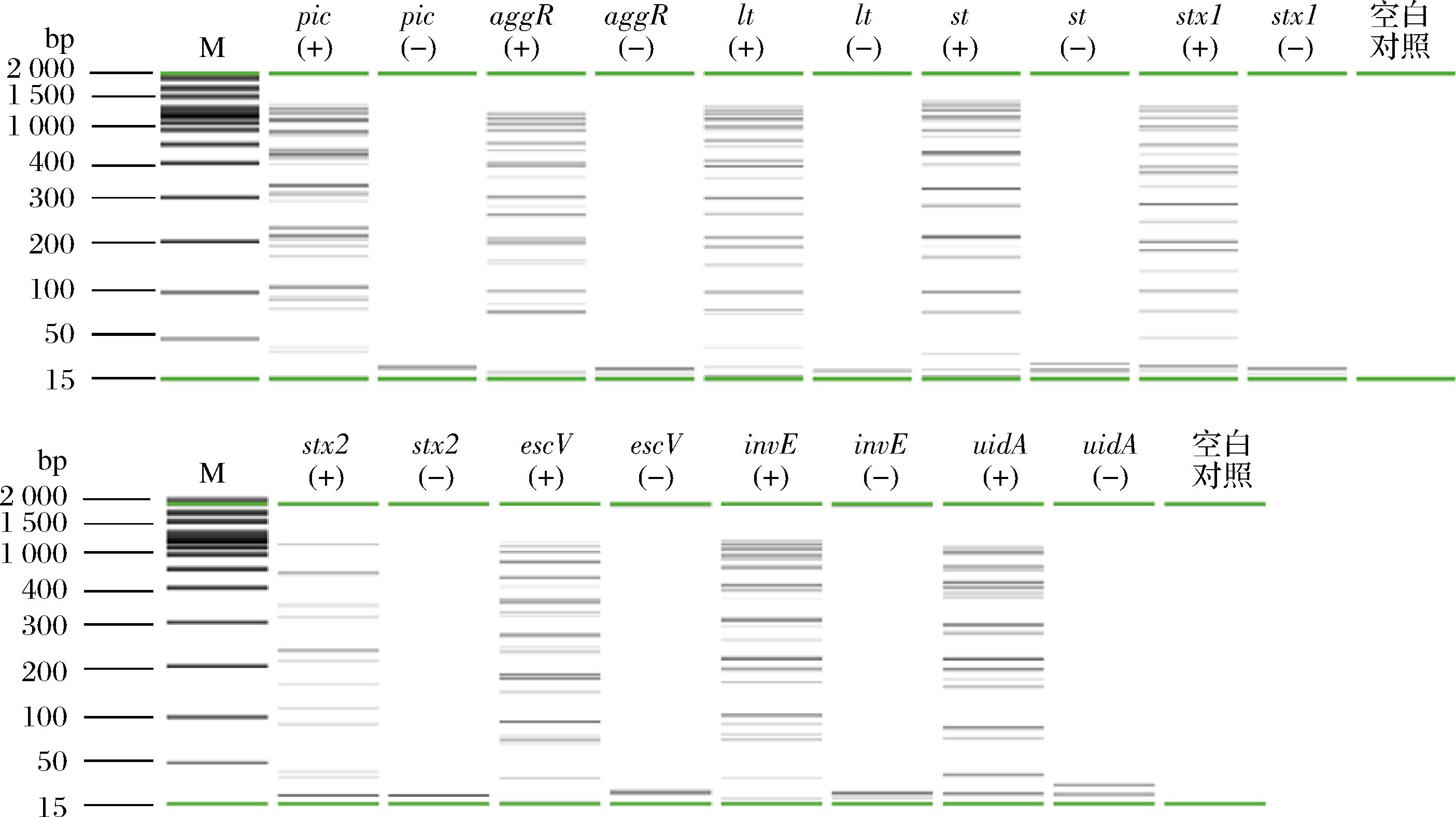
图1 不同基因LAMP扩增产物毛细管电泳图
Fig.1 Capillary electrophoresis of LAMP amplification products for different genes
2.2 SYBR Green Ⅰ添加量的优化及反应时间的确定
以大肠埃希氏菌属特异性基因uidA为待检基因,在LAMP反应体系中调整SYBR Green Ⅰ的添加量,阳性(+)以10 ng/μL EAEC为模板,以超纯水为阴性(-)对照,利用荧光扩增平台采集荧光信号。如图2所示,SYBR Green Ⅰ的添加量越多阳性与阴性峰值差值越大。但是SYBR Green Ⅰ添加量过多会导致扩增速度慢,起峰时间晚。综上所述,选取SYBR Green Ⅰ(10×)的最优添加量为1.5 μL。反应40 min以后,扩增曲线的荧光值平稳,所以实时荧光LAMP分型DEC的检出时间设为40 min。
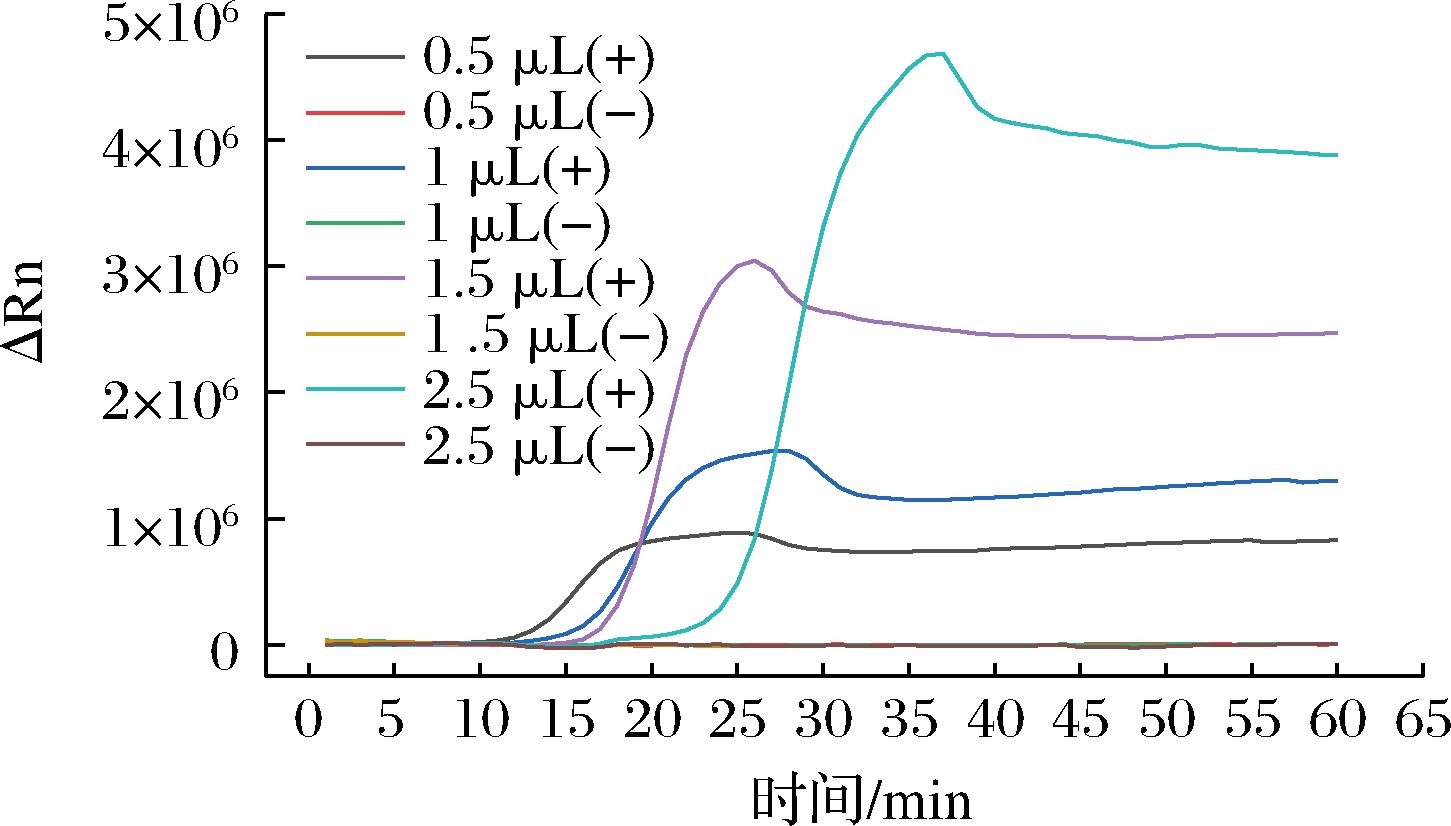
图2 SYBR Green Ⅰ添加量对实时荧光LAMP的影响
Fig.2 Effect of SYBR Green Ⅰ addition on real-time fluorescent LAMP
2.3 Bst DNA聚合酶添加量对实时荧光LAMP扩增效率的影响
Bst DNA聚合酶的添加量是影响LAMP扩增效率的关键。实验结果表明(图3),Bst DNA聚合酶添加量越多扩增速度越快。但是相关研究结果显示,过量的Bst DNA聚合酶不仅会增加反应成本,还会使引物形成二聚体,降低扩增效率[17]。综上,确定每段基因实时荧光LAMP体系中Bst DNA聚合酶的最优添加量分别是:pic与escV添加量为2 U,aggR、lt、stx1与stx2添加量为4 U,st与uidA添加量为6 U,invE添加量为8 U。

A-pic;B-aggR;C-lt;D-st;E-stx1;F-stx2;G-escV;H-invE;I-uidA
图3 Bst DNA聚合酶添加量对实时荧光LAMP的影响
Fig.3 Effect of Bst DNA polymerase addition on real-time fluorescent LAMP
2.4 环引物添加量对实时荧光LAMP扩增效率的影响
图4表明在LAMP体系中,环引物的添加能大大加快目标基因的扩增速度。不加环引物,pic、lt、escV及uidA基因在40 min内都不能发生扩增。但是,环引物添加量过多可能会造成引物之间的错配,影响扩增效率,如stx2、invE的阴性组会起峰。综上,确定每段基因实时荧光LAMP体系中最优的环引物(10 μmol/L)添加量,除uidA添加量为1 μL,其余的pic、aggR、lt、st、stx1、stx2、escV与invE添加量均为0.5 μL。
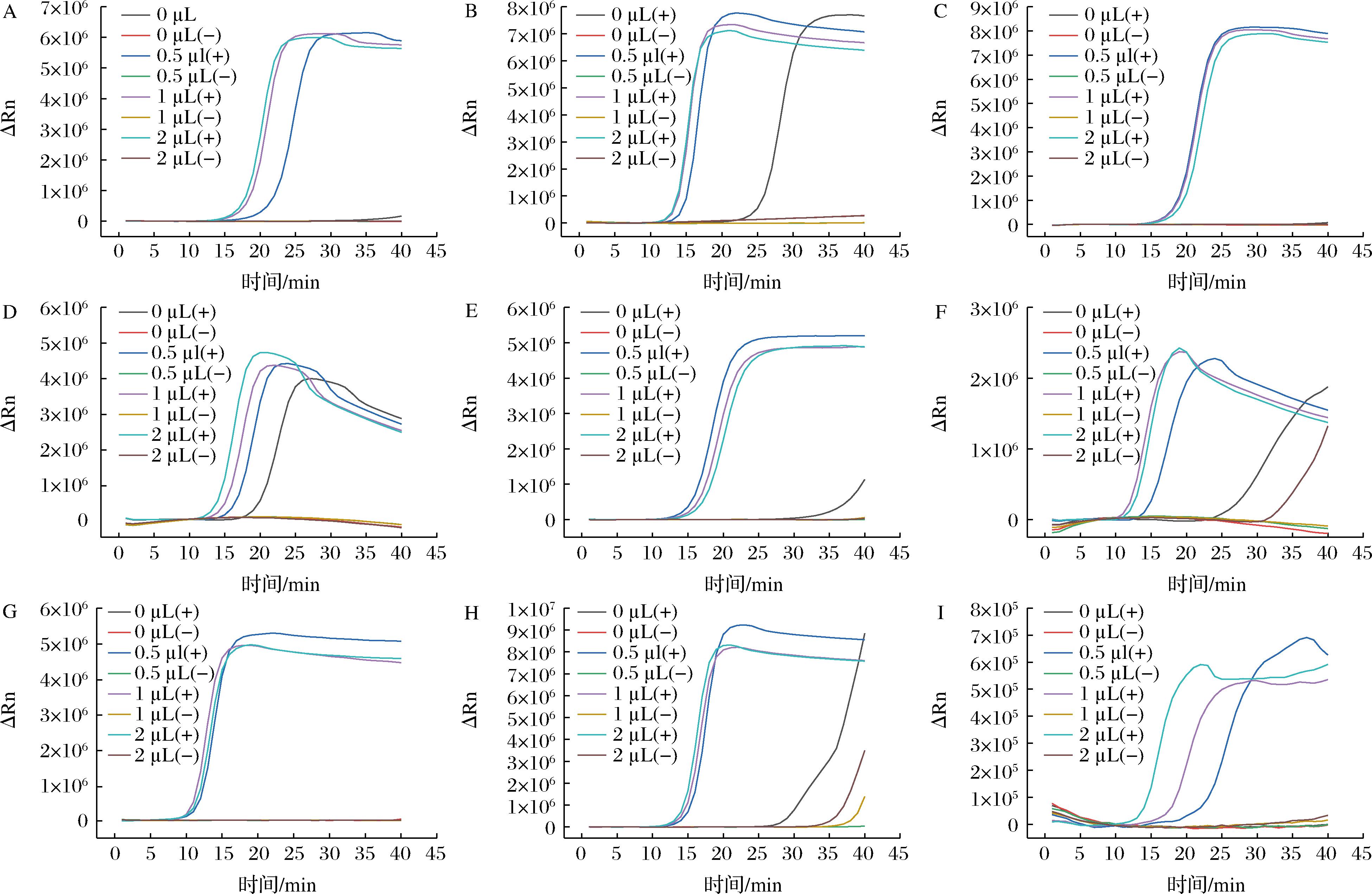
A-pic;B-aggR;C-lt;D-st;E-stx1;F-stx2;G-escV;H-invE;I-uidA
图4 环引物添加量对实时荧光LAMP的影响
Fig.4 Effect of loop primer addition on real-time fluorescent LAMP
2.5 实时荧光LAMP分型DEC结果
利用所建立实时荧光LAMP方法对EAEC、ETEC、STEC、EPEC、EIEC和普通大肠埃希氏菌标准菌株进行检测,结果如图5所示,该方法可检出6株大肠埃希氏菌的菌属特异性基因uidA。DEC的标准菌株对应的各特征基因均呈现明显地扩增,标准菌株的基因组也并未造成其余基因扩增管的交叉反应。
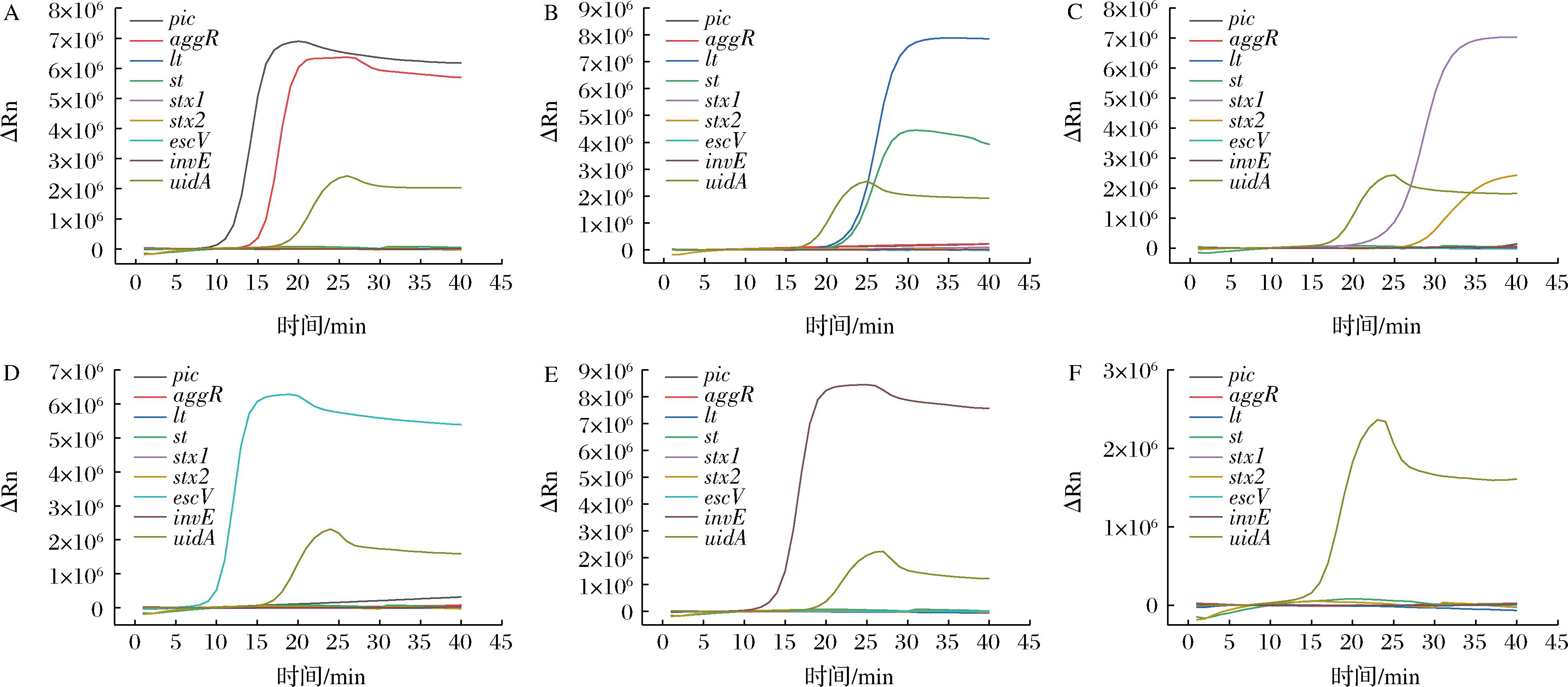
A-EAEC;B-ETEC;C-STEC;D-EPEC;E-EIEC;F-普通大肠埃希氏菌
图5 实时荧光LAMP分型DEC的荧光扩增曲线
Fig.5 Fluorescence amplification curve of real-time fluorescent LAMP for DEC subtyping
2.6 实时荧光LAMP方法检出限的确定及与国标方法的比对
以粗提取得到的不同浓度的目标菌DNA评价方法的检出限。结果如图6所示,pic和escV的检出限是1 ng/μL,aggR、stx1、invE和uidA的检出限是100 pg/μL,lt、st和stx2的检出限是10 pg/μL。同时,用国标法对相同浓度的DNA模板进行检测作为对比,结果如表1所示,本研究构建的实时荧光LAMP方法对各特征基因的检出限均低于国标法。
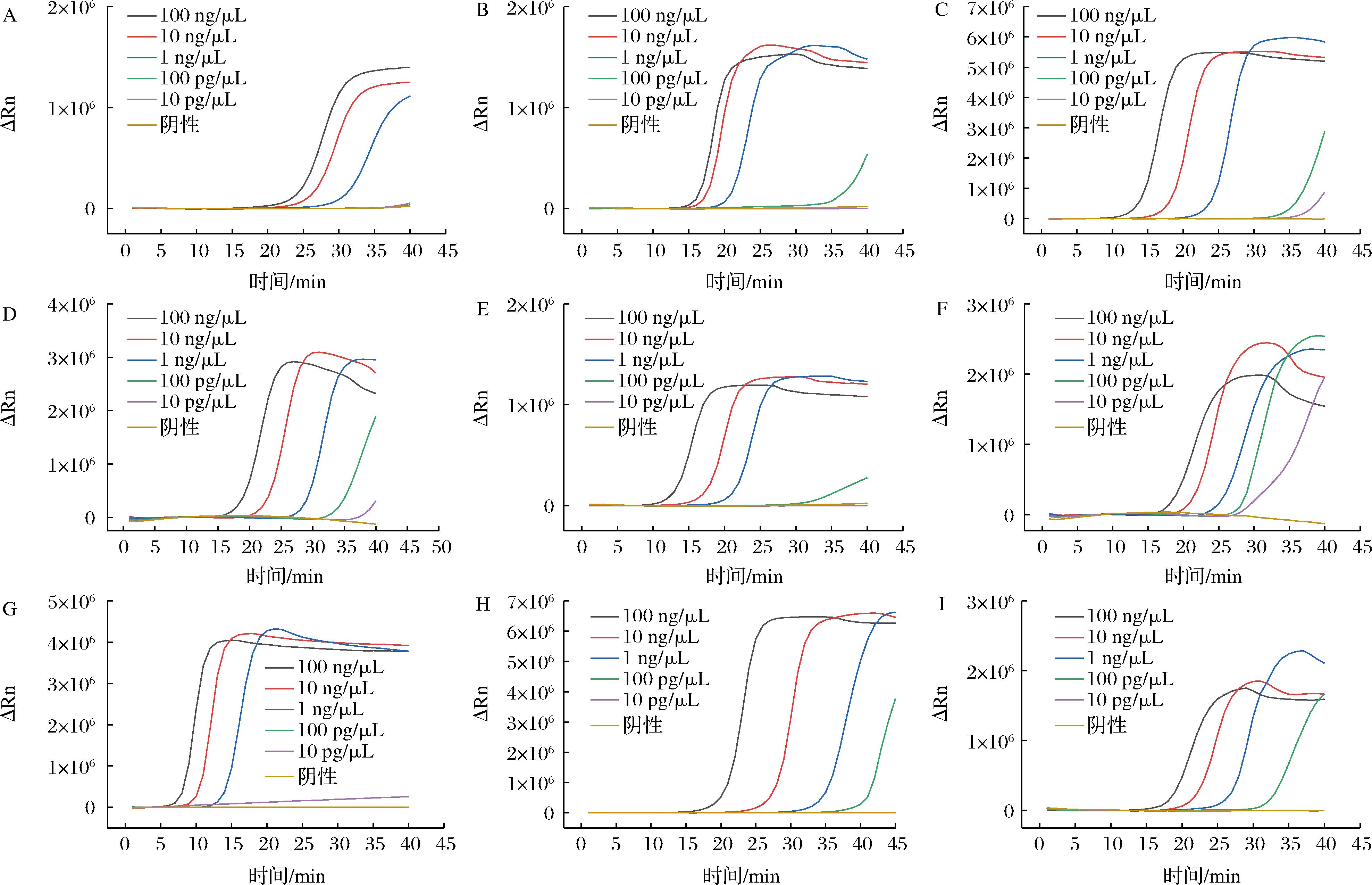
A-pic;B-aggR;C-lt;D-st;E-stx1;F-stx2;G-escV;H-invE;I-uidA
图6 各特征基因检出限结果
Fig.6 Detection limit results of each target gene
2.7 实时荧光LAMP方法的特异性评价
利用本文构建的方法对12株已知菌型的非大肠埃希氏菌进行检测,结果如表2所示,9段基因均未被检出,表明本文所建立的方法对DEC进行检测和分型时特异性好,不受其他致病菌的干扰,方法特异度为100%(12/12)。
2.8 临床菌株的验证结果
利用本文构建的方法对腹泻患者粪便样本中分离的23株临床株进行检测,结果见表3,所有菌株均可检出大肠埃希氏菌属特异性基因uidA,并可准确检测出21株DEC的毒力基因进行分型,与实际结果一致,且型间无相互交叉反应,该方法检出DEC灵敏度为100%(21/21)。
表3 临床菌株的验证结果
Table 3 Verification results of clinical strain
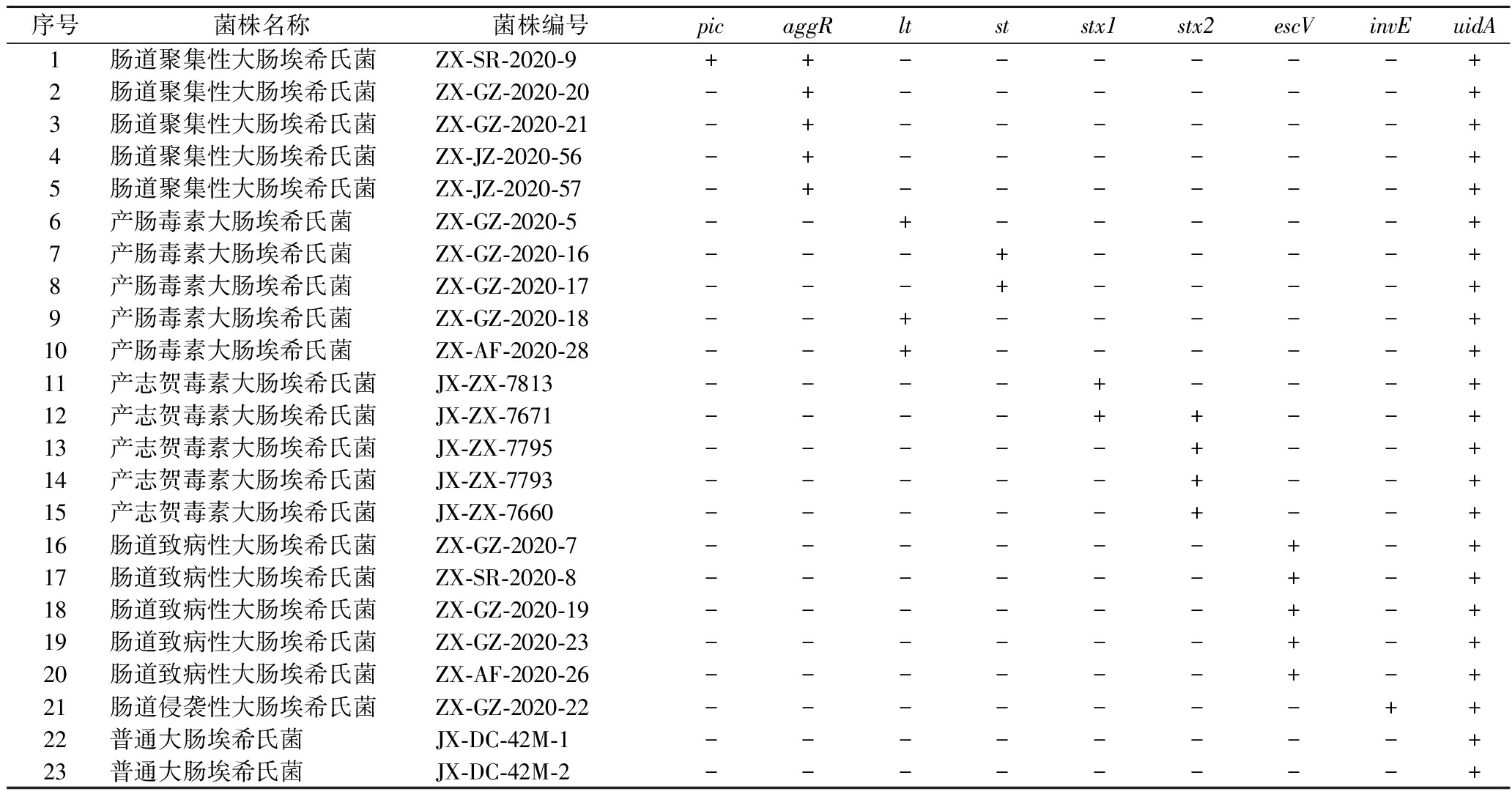
序号菌株名称菌株编号picaggRltststx1stx2escVinvEuidA1肠道聚集性大肠埃希氏菌ZX-SR-2020-9++------+2肠道聚集性大肠埃希氏菌ZX-GZ-2020-20-+------+3肠道聚集性大肠埃希氏菌ZX-GZ-2020-21-+------+4肠道聚集性大肠埃希氏菌ZX-JZ-2020-56-+------+5肠道聚集性大肠埃希氏菌ZX-JZ-2020-57-+------+6产肠毒素大肠埃希氏菌ZX-GZ-2020-5--+-----+7产肠毒素大肠埃希氏菌ZX-GZ-2020-16---+----+8产肠毒素大肠埃希氏菌ZX-GZ-2020-17---+----+9产肠毒素大肠埃希氏菌ZX-GZ-2020-18--+-----+10产肠毒素大肠埃希氏菌ZX-AF-2020-28--+-----+11产志贺毒素大肠埃希氏菌JX-ZX-7813----+---+12产志贺毒素大肠埃希氏菌JX-ZX-7671----++--+13产志贺毒素大肠埃希氏菌JX-ZX-7795-----+--+14产志贺毒素大肠埃希氏菌JX-ZX-7793-----+--+15产志贺毒素大肠埃希氏菌JX-ZX-7660-----+--+16肠道致病性大肠埃希氏菌ZX-GZ-2020-7------+-+17肠道致病性大肠埃希氏菌ZX-SR-2020-8------+-+18肠道致病性大肠埃希氏菌ZX-GZ-2020-19------+-+19肠道致病性大肠埃希氏菌ZX-GZ-2020-23------+-+20肠道致病性大肠埃希氏菌ZX-AF-2020-26------+-+21肠道侵袭性大肠埃希氏菌ZX-GZ-2020-22-------++22普通大肠埃希氏菌JX-DC-42M-1--------+23普通大肠埃希氏菌JX-DC-42M-2--------+
3 结论
研究构建了实时荧光LAMP方法,实现了等温条件下5种DEC的快速准确分型。不同基因的扩增速率差异是多基因的扩增检测方法构建过程的难点问题。研究为了实现特定结果判读时间点(本文为40 min)所有靶基因检测结果的统一、准确判读,需保证所有靶基因扩增速率相对一致且均不发生非特异性扩增。研究发现Bst DNA聚合酶和环引物的添加量是影响LAMP扩增效率的关键因素,通过合理调整Bst DNA聚合酶的添加量,可保证LAMP扩增效率的同时提高方法的经济性。环引物的添加对LAMP扩增有明显的“促进效应”,本研究发现,若不加环引物,pic、lt、escV及uidA在40 min内不能开始扩增。然而,相比“添加与否”,环引物的“添加量”对LAMP扩增速度影响不大,添加量过多还会导致LAMP的非特异性扩增,降低扩增准确度,这些发现与其他研究者研究结果[18-20]一致。此外,研究还发现SYBR Green Ⅰ添加量对LAMP扩增有显著的影响,SYBR Green Ⅰ添加量过少会导致阴阳性峰值相差较小,过多则会对扩增有抑制作用,导致扩增速度变慢。
综上,研究根据DEC的pic、aggR、lt、st、escV、stx1、stx2、invE基因及大肠埃希氏菌属特异性基因uidA构建了实时荧光LAMP方法,实现了等温条件下对DEC快速检测与分型。方法对pic和escV的检出限是1 ng/μL,对aggR、stx1、invE和uidA的检出限是100 pg/μL,对lt、st和stx2的检出限是10 pg/μL,非DEC的标准菌株评价结果表明,方法特异度为100%(12/12),临床菌株验证结果显示,方法对临床DEC检出灵敏度为100%(21/21),分型结果也与实际结果完全符合。本方法简便、经济、高效,对设备要求低,能将检测时间缩短至40 min内,适合基层机构使用,有利于食源性疾病的早发现、早诊断、及时对症治疗,对保障食品安全和维护公众健康有积极意义。
[1] ROTH G A,ABATE D,ABATE K H,et al.Global,regional,and national age-sex-specific mortality for 282 causes of death in 195 countries and territories,1980-2017:A systematic analysis for the Global Burden of Disease Study 2017[J].Lancet,2018,392(10159):1736-1788.
[2] JESSER K J,LEVY K.Updates on defining and detecting diarrheagenic Escherichia coli pathotypes[J].Current Opinion in Infectious Diseases,2020,33(5):372-380.
[3] KOTLOFF K L,NATARO J P,BLACKWELDER W C,et al.Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study,GEMS):A prospective,case-control study[J].Lancet,2013,382(9888):209-222.
[4] ZHOU S X,WANG L P,LIU M Y,et al.Characteristics of diarrheagenic Escherichia coli among patients with acute diarrhea in China,2009-2018[J].Journal of Infection,2021,83(4):424-432.
[5] 王超,王同瑜,姜金茹,等.2015-2019年北京市食源性致泻大肠埃希氏菌感染病例流行特征分析[J].实用预防医学,2022,29(6):689-692.
WANG C,WANG T Y,JIANG J R,et al.Epidemic characteristics of cases of food-borne diarrheagenic Escherichia coli infection in Beijing,2015-2019[J].Practical Preventive Medicine,2022,29(6):689-692.
[6] 石奔,赵薇,孙景昱,等.吉林省致泻大肠埃希氏菌分子分型与耐药性研究[J].中国实验诊断学,2020,24(10):1697-1702.
SHI B,ZHAO W,SUN J Y,et al.Molecular typing and drug resistance of diarrheagenic Escherichia coli in Jilin Province[J].Chinese Journal of Laboratory Diagnosis,2020,24(10):1697-1702.
[7] LLORENTE M T,ESCUDERO R,RAMIRO R,et al.Enteroaggregative Escherichia coli as etiological agent of endemic diarrhea in Spain:A prospective multicenter prevalence study with molecular characterization of isolates[J].Frontiers in Microbiology,2023,14:1120285.
[8] 周杨,万强,蔡芷荷,等.3种致泻大肠埃希氏菌多重PCR检测试剂盒的研制与效用评价[J].现代食品科技,2020,36(12):243-251.
ZHOU Y,WAN Q,CAI Z H,et al.Development and evaluation of multiplex PCR detection kit for detection of three types of diarrheagenic Escherichia coli[J].Modern Food Science and Technology,2020,36(12):243-251.
[9] 胡安妥,王娉,张彩霞,等.5类致泻性大肠埃希氏菌多重荧光PCR检测方法的建立[J].食品科学,2018,39(22):249-255.
HU A T,WANG P,ZHANG C X,et al.Establishment of multiplex real-time PCR assay to detect five strains of diarrheagenic Escherichia coli[J].Food Science,2018,39(22):249-255.
[10] 袁慕云,许龙岩,柯碧霞,等.基于TaqMan探针荧光PCR检测致泻性大肠埃希氏菌[J].中国食品学报,2021,21(3):274-281.
YUAN M Y,XU L Y,KE B X,et al.Detection for diarrheagenic Escherichia coli (DEC) by real-time PCR with TaqMan probe[J].Journal of Chinese Institute of Food Science and Technology,2021,21(3):274-281.
[11] NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):E63.
[12] HUANG T Z,LI L Z,LIU X,et al.Loop-mediated isothermal amplification technique:Principle,development and wide application in food safety[J].Analytical Methods,2020,12(46):5551-5561.
[13] DOMESLE K J,YOUNG S R,YANG Q R,et al.Loop-mediated isothermal amplification for screening Salmonella in animal food and confirming Salmonella from culture isolation[J].Journal of Visualized Experiments-JoVE,2020(159):159.
[14] JOSHI S,DIXIT K K,SHARMA V,et al.Rapid multiplex loop-mediated isothermal amplification (m-LAMP) assay for differential diagnosis of leprosy and post-kala-azar dermal leishmaniasis[J].The American Journal of Tropical Medicine and Hygiene,2021,104(6):2085-2090.
[15] CENTENO-CUADROS A,TELLA J L,DELIBES M,et al.Validation of loop-mediated isothermal amplification for fast and portable sex determination across the phylogeny of birds[J].Molecular Ecology Resources,2018,18(2):251-263.
[16] TOBIAS J,VON MENTZER A,LOAYZA FRYKBERG P,et al.Stability of the encoding plasmids and surface expression of CS6 differs in enterotoxigenic Escherichia coli (ETEC) encoding different Heat-Stable (ST) Enterotoxins (STh and STp)[J].PLoS One,2016,11(4):e0152899.
[17] HU Y Q,HUANG X H,GUO L Q,et al.Rapid and visual detection of Vibrio parahaemolyticus in aquatic foods using bla (CARB-17) gene-based loop-mediated isothermal amplification with lateral flow dipstick (LAMP-LFD)[J].Journal of Microbiology and Biotechnology,2021,31(12):1672-1683.
[18] 李阳.环介导等温扩增技术检测沙门氏菌方法的建立[D].保定:河北农业大学,2018.
LI Y.Development of a loop-mediated isothermal amplification for detection on salmonella[D].Baoding:Hebei Agricultural University,2018.
[19] 史磊波.西安周边地区鸽Ⅰ型腺病毒感染情况调查及可视化LAMP检测方法的建立[D].西安:西北农林科技大学,2021.
SHI L B.Investigation on the infection of pigeon adenovirus type I in surrounding areas of Xi′an and establishment of LAMP detection method[D].Xi′an:Northwest A&F University,2021.
[20] LI C,SHI Y Q,YANG G Y,et al.Establishment of loop-mediated isothermal amplification for rapid detection of Pseudomonas aeruginosa[J].Experimental and Therapeutic Medicine,2019,17(1):131-136.

