洋葱(Allium cepa L.)是百合科、葱属多年生草本植物,原产中亚和地中海沿岸,现在世界各地都有种植[1]。中国洋葱总产量位居世界前列,洋葱的产量在我国各类蔬菜产量排名中位居第六,占据重要地位[2]。洋葱是传统的药食两用植物,营养成分丰富,含有槲皮素、黄酮[3]、有机硫化物[4]等多种对人体有益的活性功能性物质,驱散人体内寒气、预防季节性感冒、促进肠胃蠕动而有利于消化,并且具有利尿等功效[5],同时洋葱有抗氧化[6-11]、抗肿瘤[12]、降血糖血脂[13-14]、免疫力调节[15]、抑菌[16-17]等生理作用,是一种美味又健康的蔬菜。
硫化丙烯是洋葱、蒜等植物的鳞茎中含有的挥发物,对病原菌和寄生虫都有良好的杀灭作用,可预防感冒,减轻发烧、咳嗽、喉痛及鼻塞等感冒症状。除对人体有益外,硫化丙烯还能有效地抑制空气中的多种病原菌传播、浸染或杀死病原菌,使蔬菜植株的发病率明显下降[18]。烯丙基硫醚存在于葱类、大蒜等蔬菜及十字科植物果实中,是大蒜提取液中的主要成分,具有较强的抗菌、抗病毒、抗癌活性,并能抑制血小板凝聚、增强机体免疫力[19-21],广泛应用在医疗卫生药物研发上[22]。
专门针对洋葱中硫化丙烯和烯丙基硫醚的研究极少,主要是洋葱中挥中发性物质的研究,提取方法主要有离子液体超声-微波协同法[23]、超临界CO2萃取[24]、亚临界水提取法[25]、超声波辅助提取[26],检测方法主要有气相色谱法[27]、气相色谱-质谱联用法[28-33]。很少有采用液相色谱法对硫化丙烯和烯丙基硫醚进行分析检测的相关文献报道,而目前尚未有关于采用液相色谱法对洋葱中硫化丙烯和烯丙基硫醚分析检测的相关报道。为了研究出更加科学、简便、低成本的分析方法,实验采用了有机溶剂超声提取和高效液相色谱-二极管阵列检测器法分析检测。
本研究在归纳现有国内外文献资料后,研究出了采用加入稳定剂丁硫醇后用乙腈提取,用无水硫酸钠吸收多余的水分后离心的更加科学的提取方法,采用高效液相色谱-二极管阵列检测器法进行分析检测,该方法操作简便、灵敏度高、稳定性好,为测定洋葱中硫化丙烯和烯丙基硫醚含量提供了科学依据。
1 材料与方法
1.1 材料与试剂
洋葱,市购。
甲醇、乙腈、乙酸乙酯(色谱纯),默克集团股份有限公司;甲酸(色谱纯)、无水硫酸镁、无水硫酸钠(分析纯)、乙醇(色谱纯),天津市科密欧化学试剂有限公司;丁硫醇(C4H10S,CAS号:109-79-5,纯度:99%),西亚试剂;烯丙基硫醚(C6H10S,CAS号:592-88-1,纯度≥98.0%),CNW Technologies;硫化丙烯(C3H6S,CAS号:1072-43-1,纯度>98.0%),东京化成工业株式会社。
1.2 仪器与设备
安捷伦1260型液相色谱仪,安捷伦科技有限公司;艾柯DISCV-IV-24M型超纯水机,成都唐氏康宁科技有限公司;SB25-12DTD型超声波清洗器,宁波新芝生物科技有限公司;泰斯特DK-98-IIA恒温水浴锅,天津泰斯特仪器有限公司;TG16C型离心机,长沙英泰仪器有限公司;Vortex-Genie2型涡旋混合器,美国Scientific Industries公司;MS105型十万分之一电子天平、ME203/02型千分之一天平,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 试样前处理
用制样机将样品充分打碎混匀,装在自封袋中,冷冻存放。称取样品2 g(精确至0.001 g)于50 mL具塞离心管中,之后准确加入10 mg/mL稳定剂丁硫醇1.0 mL,并准确加入乙腈9.0 mL,涡旋1 min之后,放入超声波仪器中,于室温超声提取20 min,超声完毕向离心管中加入2.0 g无水硫酸钠,振摇1 min,后涡旋1 min,将离心管置于离心机中,12 000 r/min离心3 min,取上清液过滤膜(0.22 μm,聚四氟乙烯),上机测定。
1.3.2 标准系列的配制
准确称取10 mg硫化丙烯和烯丙基硫醚于50 mL烧杯中用少量乙腈溶解后立即转移至10 mL容量瓶中,加入10 mg/mL稳定剂丁硫醇1.0 mL之后用乙腈定容至刻度,配制成1.0 mg/mL的标准混合储备液;取适量标准混合储备液于容量瓶中用乙腈逐级稀释成1、5、10、20、50、100 mg/L的标准混合系列溶液。
1.3.3 高效液相色谱仪条件
色谱柱:Thermo Hypersil GOLD液相色谱柱(150 mm×4.6 mm,5 μm);流动相:水(60%)+乙腈(40%);流速1.0 mL/min,柱温35 ℃,进样量10 μL,波长200 nm。
1.3.4 定性、定量方法
通过硫化丙烯和烯丙基硫醚保留时间定性分析,以外标法对硫化丙烯和烯丙基硫醚进行定量分析。
2 结果与分析
2.1 提取方式的选择
洋葱中硫化丙烯和烯丙基硫醚的尝试提取方法有水提法、乙醇法、甲醇法、乙酸乙酯法、乙腈法等,虽然均能不同程度地提取,从表1可以看出乙腈有最佳提取效果,但是提取效果不能达到最佳理想状态,并且回收率不稳定。考虑到洋葱中含有大量的水影响了提取效果。因而本研究先加乙腈提取,用加入的无水硫酸钠或无水硫酸镁除去提取中多余的水,最后在高速离心机上离心,发现加入无水硫酸钠离心后的样液清澈并沉淀紧密,而无水硫酸镁离心后的样液浑浊且沉淀松散,从表2可以看出,加入无水硫酸钠后加标回收率较高,说明无水硫酸钠有更强的吸水能力,提取的效果更佳。
表1 不同试剂提取的差异性 单位:mg/kg
Table 1 Differences in extraction with different reagents

名称乙腈提取的含量甲醇提取的含量乙醇提取的含量乙酸乙酯提取的含量水提取的含量硫化丙烯 4.954.064.532.512.45烯丙基硫醚5.805.684.812.624.56
表2 不同脱水剂对提取效果的影响 单位:%
Table 2 Effect of different dehydrating agents on extraction effect

名称乙腈+无水硫酸钠提取的加标回收率乙腈+无水硫酸镁提取的加标回收率乙腈提取的加标回收率硫化丙烯 96.488.381.7烯丙基硫醚106.392.187.8
表3 硫化丙烯和烯丙基硫醚的线性方程、相关系数(R)、及其方法检出限
Table 3 Linear equation,correlation coefficient (R),and method detection limit of propylene sulfide and diallyl sulfide

化合物保留时间/min线性方程相关系数R硫化丙烯 4.600y=20.168 240 7x+0.462 347 50.999 97烯丙基硫醚12.716y=25.430 215 6x-0.766 464 80.999 98
2.2 稳定剂的选择
硫化丙烯不稳定容易被氧化而分解,一般的硫化丙烯贮存过程中均加入一定浓度的稳定剂,丁硫醇是硫化丙烯中常见加入的稳定剂,试验表明在分析检测中不加入稳定剂丁硫醇,硫化丙烯的标准色谱图就会出现双头峰,说明硫化丙烯易分解成2种性质相近的物质,致使无法准确分析。通过分别向同一浓度的硫化丙烯标准溶液和同一洋葱样品中加入0.5、1.0、2.0、5.0、10.0、12、15 mg/mL质量浓度的丁硫醇通过液相色谱分析,加入10.0 mg/mL及以上质量浓度的丁硫醇,硫化丙烯的峰型最佳且稳定,所以试验方法均以加入10.0 mg/mL质量浓度的丁硫醇为基础。同时,试验表明加入稳定剂丁硫醇对烯丙基硫醚的分析检测无任何影响。
2.3 色谱条件的选择
2.3.1 检测波长的选择
通过在190~810 nm内对硫化丙烯和烯丙基硫醚进行全波长扫描,表明硫化丙烯和烯丙基硫醚在200 nm处均有最强的紫外吸收,且基线噪音低,故确定200 nm作为该方法的检测波长,标准品色谱图见图1,硫化丙烯保留时间为4.332 min,烯丙基硫醚的保留时间为11.823 min。
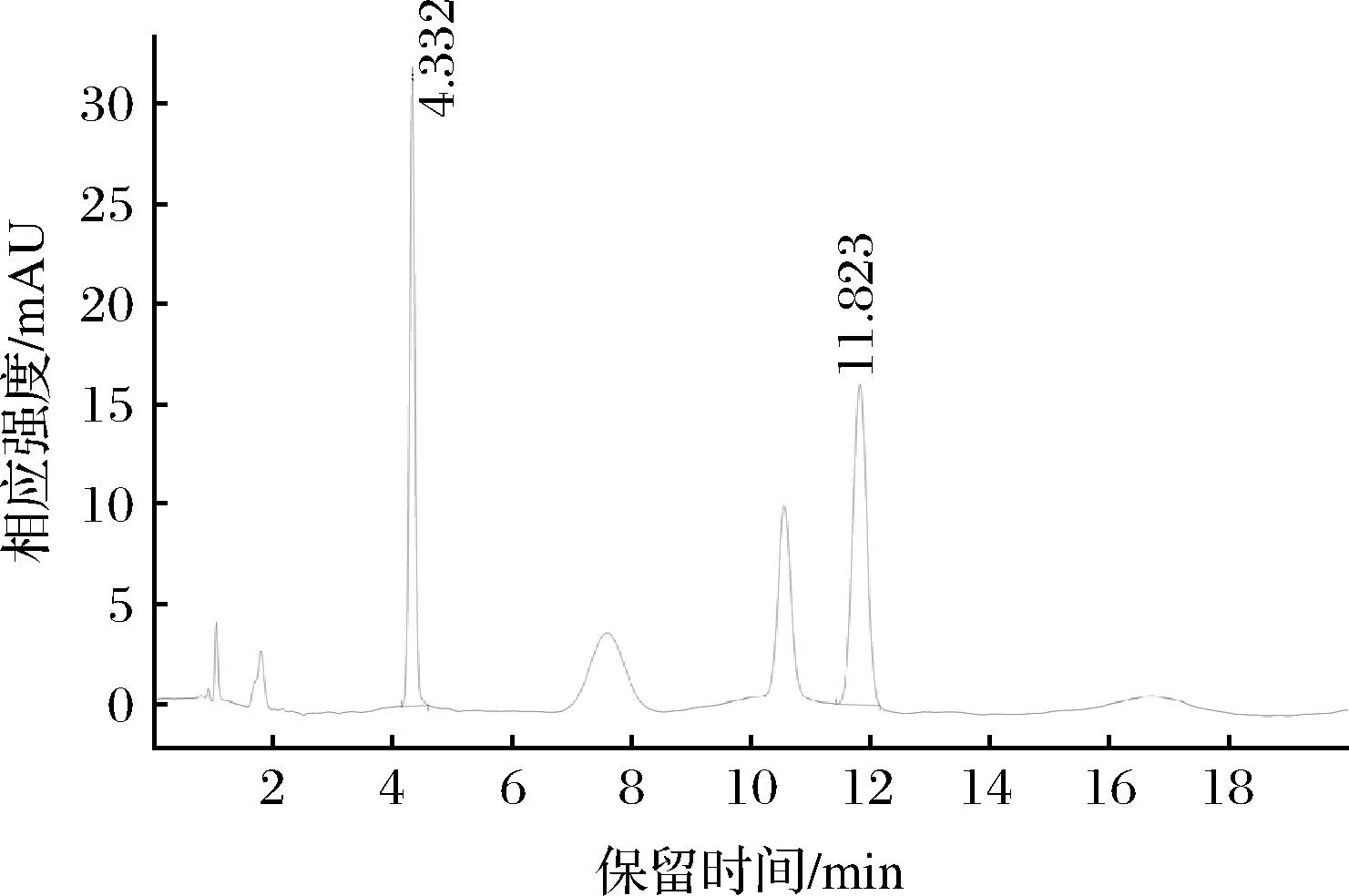
图1 硫化丙烯和烯丙基硫醚的标准色谱图
Fig.1 Standard chromatogram of propylene sulfide and diallyl sulfide
2.3.2 色谱柱的选择
液相色谱法常用的为色谱C18柱,但是由于硫化丙烯和烯丙基硫醚具有疏水性和特殊的结构,一般的C18柱会有拖尾峰形而影响准确定量,所以本方法采用了Thermo Hypersil GOLD液相色谱柱(150 mm×4.6 mm,5 μm),该色谱柱集先进的高纯硅胶技术、键合技术和烷基键合相的封端技术于一身。普通色谱柱由于分析物与硅基表面酸性的硅醇基会存在二次或三次吸附作用,从而导致峰形变差,Hypersil GOLD因在生产过程中对填料表面进行了处理,减少这些不理想的相互作用,明显改善了色谱峰拖尾。结果表明Thermo Hypersil GOLD液相色谱柱(150 mm×4.6 mm,5 μm)分离、检测硫化丙烯和烯丙基硫醚效果良好,基线稳定漂移小。
2.3.3 流动相的选择
选取水+甲醇体系、水+乙腈尝试检测硫化丙烯和烯丙基硫醚,通过比较发现乙腈在低波长更适用,具有比甲醇更小的基线噪音,因此,选用水+乙腈的体系来检测硫化丙烯和烯丙基硫醚。
2.3.4 流动相洗脱程序的选择
硫化丙烯和烯丙基硫醚通过色谱柱分离出的间隔时间较长,流动相采用梯度洗脱时对分析并没有取得更好的效果,反而是基线漂移较大不利于准确定量,尤其是对烯丙基硫醚检测的误差较大。而采用等度洗脱时,流动相体系的压力稳定,能够准确地检测硫化丙烯和烯丙基硫醚,硫化丙烯和烯丙基硫醚出峰时间合适并且没有杂质干扰(图2)。
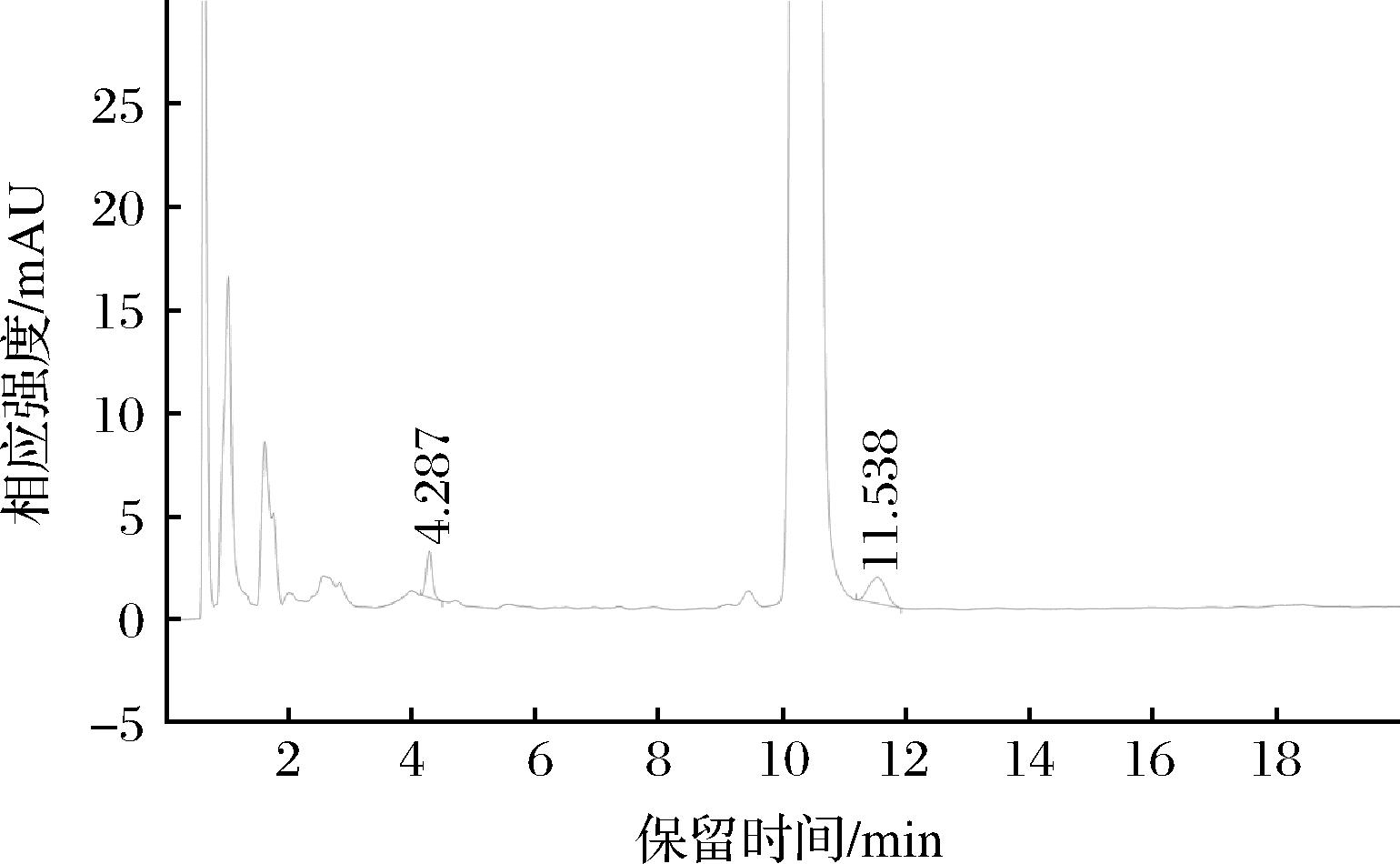
图2 洋葱中硫化丙烯和烯丙基硫醚的色谱图
Fig.2 Chromatogram of propylene sulfide and diallyl sulfide in onion
2.4 标准曲线
标准曲线以质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标绘制标准曲线,硫化丙烯和烯丙基硫醚的线性方程及其相关系数见表2,在质量浓度1~100 μg/mL时,标准曲线的相关系数(R)为0.999 97~0.999 98,硫化丙烯和烯丙基硫醚的线性关系良好,完全可以满足定量分析的要求。
2.5 检出限和定量限
在洋葱空白基质中加入低浓度的硫化丙烯和烯丙基硫醚,通过试验研究得出硫化丙烯和烯丙基硫醚的方法检出限为0.5 mg/kg,定量限为1.5 mg/kg,可见本方法有很高的灵敏度。
2.6 回收率、精密度
在未检出硫化丙烯和烯丙基硫醚的洋葱空白基质中添加5.0、10.0、15.0 μg/mL 3个浓度水平的硫化丙烯和烯丙基硫醚混合标准溶液,按照以上试验方法提取,并且每个加标水平的样品平行测定6次,本实验中硫化丙烯和烯丙基硫醚的加标回收率为96%~103%,相对标准偏差(relative standard deviation,RSD)为0.28%~0.49%(表4),试验表明本方法的准确度和精密度很高,能够准确地分析检测洋葱中的硫化丙烯和烯丙基硫醚。
表4 硫化丙烯和烯丙基硫醚的回收率和精密度
Table 4 Recoveries and RSDs of propylene sulfide and diallyl sulfide
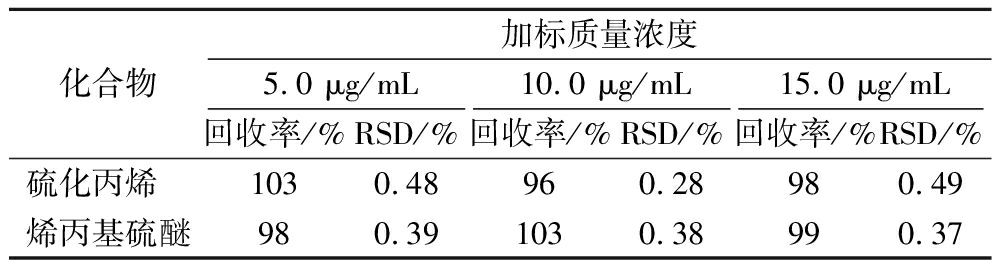
化合物加标质量浓度5.0 μg/mL10.0 μg/mL15.0 μg/mL回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%硫化丙烯 1030.48960.28980.49烯丙基硫醚980.391030.38990.37
2.7 洋葱样品分析
用本方法对不同颜色品种的洋葱检测分析,从检测结果可看出,不同洋葱中硫化丙烯和烯丙基硫醚含量差别较大(图3和图4),黄皮洋葱中的硫化丙烯和烯丙基硫醚含量均最高,红皮洋葱中的硫化丙烯和烯丙基硫醚含量均略比黄皮洋葱中的含量低但也属于较高,硫化丙烯在白皮洋葱中的含量总体比在紫皮洋葱中的含量高,烯丙基硫醚在紫皮洋葱中含量总体比在白皮洋葱中高。黄皮洋葱中的硫化丙烯含量可达4.47 mg/kg,白皮洋葱中的硫化丙烯含量最低为2.79 mg/kg,黄皮洋葱中的烯丙基硫醚含量可达6.71 mg/kg,白皮洋葱中的硫化丙烯含量最低为3.33 mg/kg。黄皮洋葱和红皮洋葱中的硫化丙烯和烯丙基硫醚含量相较于紫皮洋葱和白皮洋葱中的含量高,这也就是黄皮洋葱和红皮洋葱比紫皮洋葱和白皮洋葱在口味和气味上更为辛辣的原因,同时说明黄皮洋葱和红皮洋葱比紫皮洋葱和白皮洋葱的抗菌效果更好。
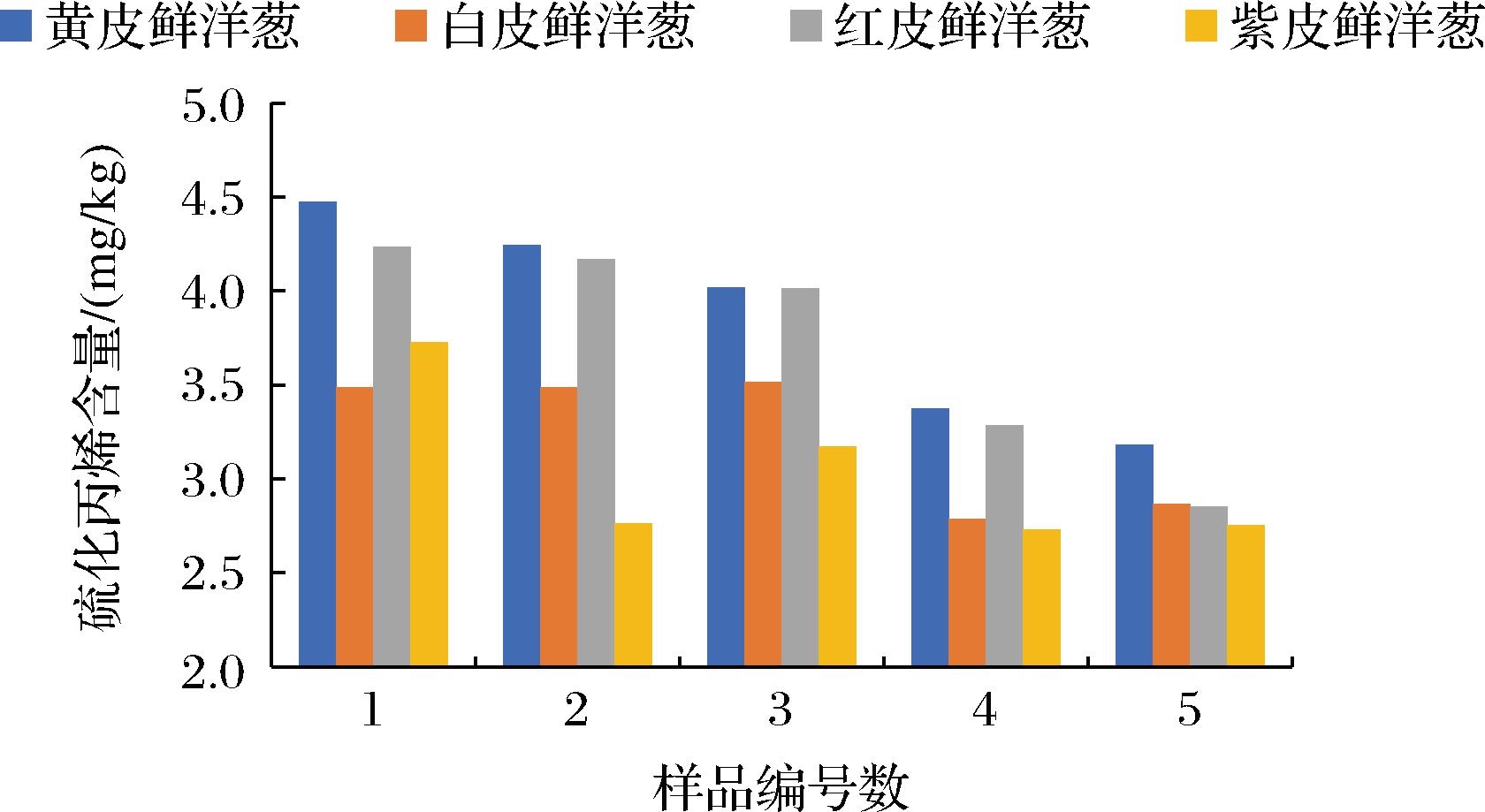
图3 不同颜色品种洋葱中的硫化丙烯含量
Fig.3 Content of propylene sulfide in different color varieties of onions
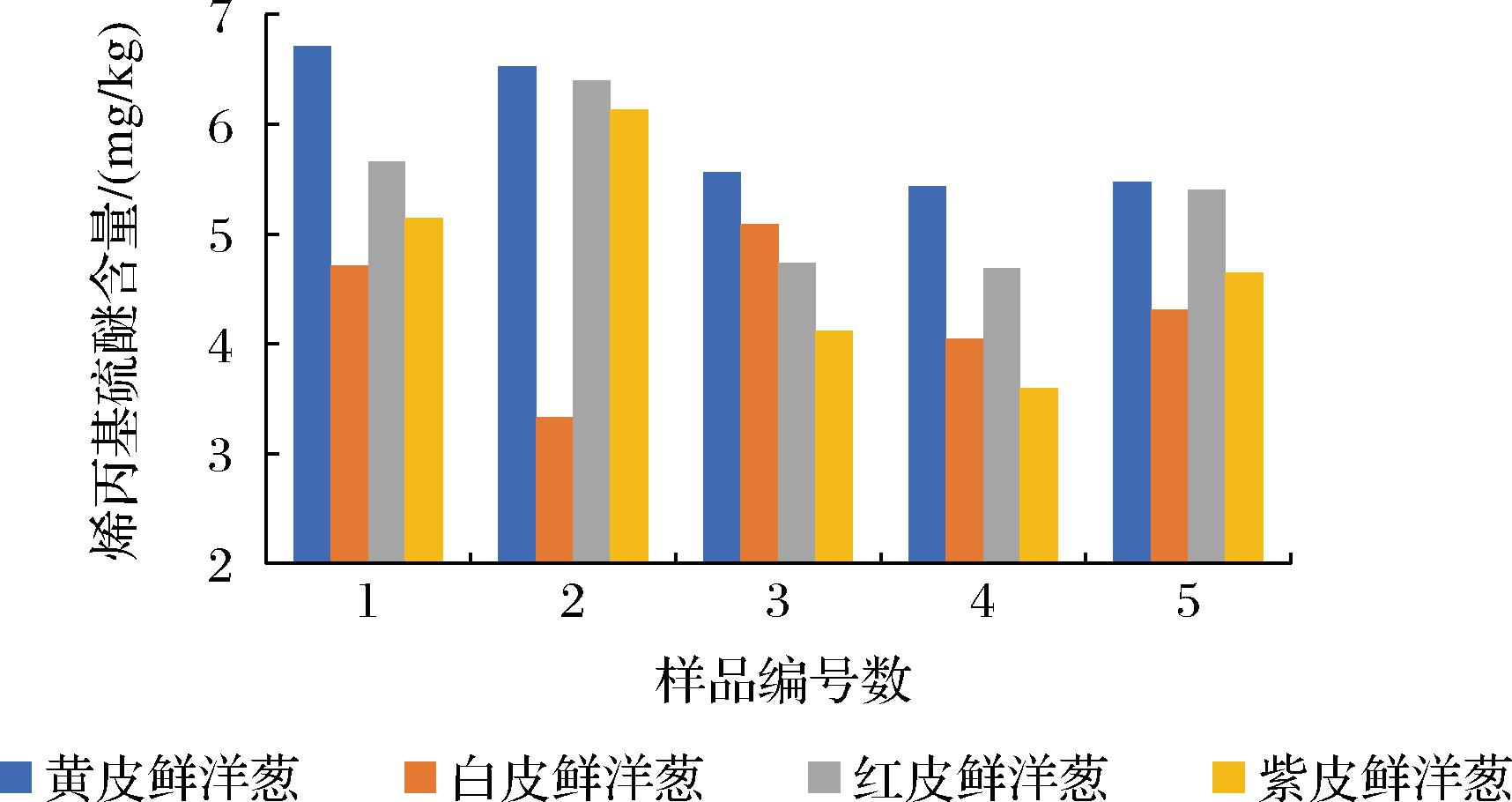
图4 不同颜色品种洋葱中的烯丙基硫醚含量
Fig.4 Content of diallyl sulfide in different color varieties of onions
2.8 对不同主产区洋葱中硫化丙烯和烯丙基硫醚的分析研究
我国的南北均盛产洋葱,但是因为不同地域的地理环境不同而差别比较大,通过对相近皮色品种的洋葱分析检测也确实证明了不同地域的洋葱中硫化丙烯和烯丙基硫醚含量有很大差异,其中新疆石河子、甘肃酒泉、吉林延吉、内蒙通辽、黑龙江齐齐哈尔产的洋葱中的硫化丙烯和烯丙基硫醚含量较高,两物质含量之和均在9.0 mg/kg以上,河南新乡、山东潍坊、四川西昌、云南元谋产的洋葱中硫化丙烯和烯丙基硫醚含量比较接近并且比北方产的低,不同地域的洋葱中硫化丙烯和烯丙基硫醚的含量见图5。北方产的洋葱中的硫化丙烯和烯丙基硫醚含量普遍较高,应该与北方普遍气候干燥、昼夜温差大有一定的关联。
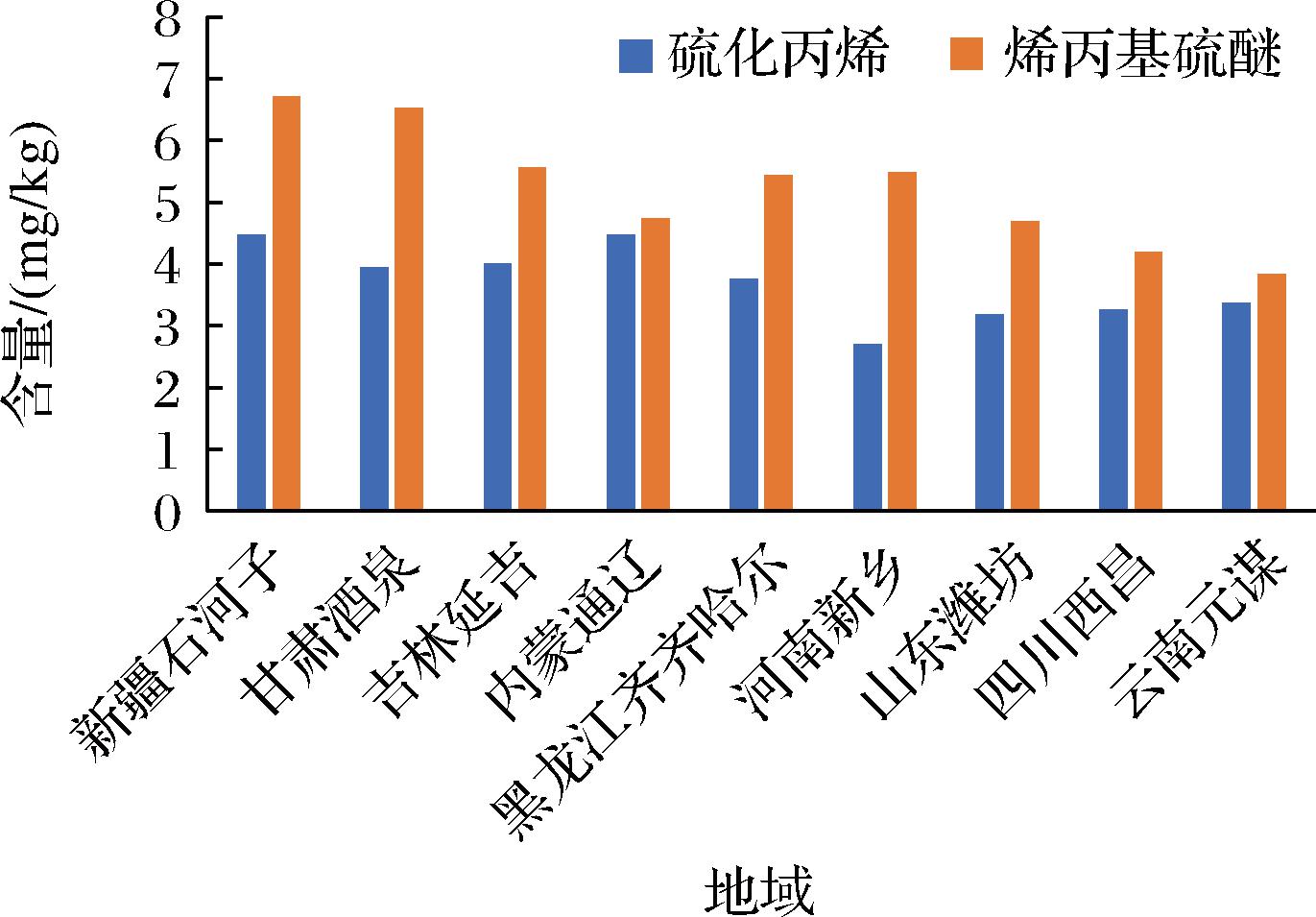
图5 不同区域洋葱中硫化丙烯和烯丙基硫醚的含量
Fig.5 Content of propylene sulfide and diallyl sulfide in onion from different regions
3 结论
本研究建立了高效液相色谱-二极管阵列检测器法测定洋葱中硫化丙烯和烯丙基硫醚的方法。利用稳定剂丁硫醇防止了硫化丙烯的分解,用乙腈超声提取,除水和离心后,以高效液相色谱-二极管阵列检测器法进行定性定量的分析,有效填补了现有国内外采用液相色谱法分析检测硫化丙烯和烯丙基硫醚的技术空白。该方法操作简便,科学性、准确性、重现性、精密性好,非常适合洋葱中硫化丙烯和烯丙基硫醚含量的分析,为洋葱的的成分研究分析提供了有效科学技术依据。
[1] 康美玲.洋葱抑菌作用研究[J].安徽农业科学,2012,40(5):2604-2607.
KANG M L.Study on bacteriostasis of onion[J].Journal of Anhui Agricultural Sciences,2012,40(5):2604-2607.
[2] 周琬颜.中国洋葱国际竞争力研究[D].保定:河北农业大学,2019.
ZHOU W Y.Research on the international competitiveness of Chinese onion[D].Baoding:Hebei Agricultural University,2019.
[3] TAKAHAMA U,HIROTA S.Deglucosidation of quercetin glucosides to the aglycone and formation of antifungal agents by peroxidase-dependent oxidation of quercetin on browning of onion scales[J].Plant &Cell Physiology,2000,41(9):1021-1029.
[4] BYSTRICKA J,MUSILOVA J,VOLLMANNOVA A,et al.Bioactive components of onion(Allium cepa L.)-A review[J].Acta Alimentaria,2013,42(1):11-22.
[5] 冯长根,吴悟贤,刘霞,等.洋葱的化学成分及药理作用研究进展[J].上海中医药杂志,2003(7):63-64; F003.
FENG C G,WU W X,LIU X,et al.Research advancement of onion’s chemical ingredient and pharmaceutical action[J].Shanghai Journal of Traditional Chinese Medicine,2003(7):63-64; F003.
[6] PANCHE A N,DIWAN A D,CHANDRA S R.Flavonoids:An overview[J].Journal of Nutritional Science,2016,5:e47.
[7] PÉREZ-GREGORIO M R,REGUEIRO J,SIMAL-G NDARA J,et al.Increasing the added-value of onions as a source of antioxidant flavonoids:A critical review[J].Critical Reviews in Food Science and Nutrition,2014,54(8):1050-1062.
NDARA J,et al.Increasing the added-value of onions as a source of antioxidant flavonoids:A critical review[J].Critical Reviews in Food Science and Nutrition,2014,54(8):1050-1062.
[8] 王彩虹,刘玉洁,曹欢,等.洋葱总黄酮的提取及抗氧化活性研究[J].阜阳师范大学学报(自然科学版),2020,37(4):44-50.
WANG C H,LIU Y J,CAO H,et al.Extraction of total flavonoids from onion and its in vitro antioxidant activity[J].Journal of Fuyang Normal University (Natural Science),2020,37(4):44-50.
[9] 刘世馨.洋葱皮多酚、黄酮提取及其体外抗氧化等活性研究[D].北京:中国农业科学院,2018.
LIU S X.Extraction of polyphenols and flavonoids from onion peel and their antioxidant activities in vitro[D].Beijing:Chinese Academy of Agricultural Sciences,2018.
[10] 李佩儒,周春阳,张译,等.洋葱醇提物总多酚含量及其抗氧化活性研究[J].中国药业,2019,28(9):21-24.
LI P R,ZHOU C Y,ZHANG Y,et al.Study on total polyphenol content of the ethanol extract from Allium cepa and its antioxidant activity[J].China Pharmaceuticals,2019,28(9):21-24.
[11] 唐祥,欧学兰,张世鹏,等.洋葱皮醇提物不同部位总多酚含量及其降脂和抗氧化活性研究[J].食品科技,2019,44(2):245-251.
TANG X,OU X L,ZHANG S P,et al.Lipid-lowering,antioxidant activities and total polyphenol content in different parts of ethanol extract from Allium cepa peel[J].Food Science and Technology,2019,44(2):245-251.
[12] ABOTALEB M,SAMUEL S M,VARGHESE E,et al.Flavonoids in cancer and apoptosis[J].Cancers,2018,11(1):28.
[13] MARRELLI M,AMODEO V,STATTI G,et al.Biological properties and bioactive components of Allium cepa L.:Focus on potential benefits in the treatment of obesity and related comorbidities[J].Molecules,2018,24(1):119.
[14] LI Q L,WANG Y H,MAI Y X,et al.Health benefits of the flavonoids from onion:Constituents and their pronounced antioxidant and anti-neuroinflammatory capacities[J].Journal of Agricultural and Food Chemistry,2020,68(3):799-807.
[15] TESHIKA J D,ZAKARIYYAH A M,ZAYNAB T,et al.Traditional and modern uses of onion bulb (Allium cepa L.):A systematic review[J].Critical Reviews in Food Science and Nutrition,2019,59(sup1):S39-S70.
[16] 吴悠.洋葱有效成分的提取及生物活性研究[D].武汉:武汉工程大学,2017.
WU Y.Study on Extraction and Biological Activity of Onion Active Ingredients[D].Wuhan:Wuhan Institute of Technology,2017.
[17] VARGAS F,ROMEC N P,GARC
N P,GARC A-GUILLÉN A I,et al.Flavonoids in kidney health and disease[J].Frontiers in Physiology,2018,9:394.
A-GUILLÉN A I,et al.Flavonoids in kidney health and disease[J].Frontiers in Physiology,2018,9:394.
[18] 王琪.温室蔬菜可利用大葱除菌防病[J].北方园艺,2009(11):56.
WANG Q.Green onion can be used for sterilization and disease prevention in greenhouse vegetables[J].Northern Horticulture,2009(11):56.
[19] 冯少龙.大蒜提取物中有机硫化物对阪崎克罗诺杆菌的抑菌活性与抑菌机理的研究[D].天津:天津科技大学,2014.
FENG S L.Investigating the antimicrobial activity and mechanism of garlic-derived organosulfur compounds to Cronobacter sakazakji[D].Tianjin:Tianjin University of Science &Technology,2014.
[20] 杨粟艳.大葱提取物抑菌活性及作用机制研究[D].兰州:兰州大学,2009.
YANG S Y.Studies on antibacterial activity and the inhibition mechanism of welsh onion extracts[D].Lanzhou:Lanzhou University,2009.
[21] 王安可,毕毓芳,温星,等.4种芳香植物精油对竹林病原真菌的抗菌性[J].林业科学,2020,56(6):59-67.
WANG A K,BI Y F,WEN X,et al.Antifungal activity of 4 kinds of aromatic essential oil derived from plants to pathogenic fungi of bamboo[J].Scientia Silvae Sinicae,2020,56(6):59-67.
[22] PEREZ-VIZCAINO F,FRAGA C G.Research trends in flavonoids and health[J].Archives of Biochemistry and Biophysics,2018,646:107-112.
[23] 曹红,段海燕,李春,等.离子液体超声-微波协同制取洋葱精油[J].化工学报,2012,63(3):826-833.
CAO H,DUAN H Y,LI C,et al.Preparation and extraction of onion essential oil by ionic liquid and ultrasound-microwave-assisted method[J].CIESC Journal,2012,63(3):826-833.
[24] 石鑫光,廖传华,陈海军,等.超临界 CO2萃取洋葱精油的试验研究[J].中国调味品,2016,41(3):11-16.
SHI X G,LIAO C H,CHEN H J,et al.Experimental study on the extraction process for onion essential oil by supercritical CO2[J].China Condiment,2016,41(3):11-16.
[25] 郭娟,丘泰球,杨日福,等.洋葱精油的亚临界水提取[J].华南理工大学学报(自然科学版),2009,37(4):143-148.
GUO J,QIU T Q,YANG R F,et al.Subcritical water extraction of onion essential oil[J].Journal of South China University of Technology (Natural Science Edition),2009,37(4):143-148.
[26] 龙明华,张鹏,王智民.超声波辅助提取洋葱精油的工艺优化[J].贵州农业科学,2016,44(11):149-151.
LONG M H,ZHANG P,WANG Z M.Optimization of ultrasonic assisted extracting of onion essential oil[J].Guizhou Agricultural Sciences,2016,44(11):149-151.
[27] 刘梓建,袁先铃,张镨予,等.洋葱品种制调味汁的适宜性评价[J].中国调味品,2022,47(1):46-51.
LIU Z J,YUAN X L,ZHANG P Y,et al.Evaluation on the suitability of onion varieties for making sauce[J].China Condiment,2022,47(1):46-51.
[28] 张旭.不同种源香椿风味分析及香气指纹图谱的构建[D].天津:天津科技大学,2020.
ZHANG X.Flavor analysis and aroma fingerprint construction of Toona sinensis from different provenances[D].Tianjin:Tianjin University of Science &Technology,2020.
[29] 李文清,周美云,彭楚婷,等.顶空气相色谱法测定大蒜主要含硫化合物在烹饪后油脂中的含量[J].分析测试学报,2013,32(10):1266-1269.
LI W Q,ZHOU M Y,PENG C T,et al.Determination of main sulfur-contained compounds in cooked oil by headspace gas chromatographic method[J].Journal of Instrumental Analysis,2013,32(10):1266-1269.
[30] 刘雪花.新型烯丙基硫醚、砜的合成方法及反应研究[D].太原:山西大学,2018.
LIU X H.New strategy for the preparation of allylic sulfides and sulfones towards its application in organic synthesis[D].Taiyuan:Shanxi University,2018.
[31] 周江菊.顶空固相微萃取气质联用分析大蒜挥发性风味成分[J].中国调味品,2010,35(9):95-99.
ZHOU J J.HP-SPME-GC-MS analysis of volatile flavor components of garlic[J].China Condiment,2010,35(9):95-99.
[32] 奚星林,周舒瑜,张嘉俊,等.SPME-GC-MS法分析大蒜粉中挥发性风味物质[J].中国食品添加剂,2022(3):14-20.
XI X L,ZHOU S Y,ZHANG J J,et al.Analysis of volatile flavor compounds in garlic powder by SPME-GC-MS analysis[J].China Food Additives,2022(3):14-20.
[33] 杨亮.大蒜辣素及相关硫醚化合物分析方法的建立与应用研究[D].乌鲁木齐:新疆师范大学,2019.
YANG L.Study on the establishment and application of analysis methods for allicin and related sulfide compounds[D].Urumqi:Xinjiang Normal University,2019.