随着国家经济的快速发展与人们健康意识的不断提高,食品安全问题越来越受到人们的重视,在众多食品微生物污染相关报道中,大肠菌群超标占比较高[1]。大肠菌群作为一类卫生指标菌,是食品安全微生物检测中的主要检测项目之一[2]。食品中大肠菌群的检测方法主要依据为GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》,其中平板计数法 (以下简称国标方法),是在结晶紫中性红胆盐培养基(violet red bile agar,VRBA)培养基初筛后挑取典型与可疑菌落进行确证,检测周期长,可疑菌落的选择较难把握[3],另外对于产气能力较弱的大肠菌群,检出率略低。随着GB 4789.3—2016标准修订,大肠菌群测试片也将获得更高的接受度和更广的实际应用。当前大肠菌群测试片相关研究报导主要集中在测试片方法与国标方法的性能比对上[4-5],对于如何增强测试片对弱产气型大肠菌群的检出能力尚无明确报道。本文针对此问题进行了重点研究,以期进一步完善大肠菌群测试片技术。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂
结晶紫中性红胆盐培养基(violet red bile agar,VRBA)、结晶紫中性红肉汤、脑心浸液肉汤(brain heart infusion broth,BHI)、胰酪大豆胨琼脂培养基(tryptic soy agar,TSA),北京陆桥技术股份有限公司;瓜尔胶、海藻酸钠、黄原胶、卡拉胶、乳糖、胆盐、乳酰基-N脂酰基鞘氨醇、正丙基-ß乳糖苷、正辛基-β-D-乳糖苷,均为分析纯,阿拉丁试剂有限公司;聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)膜,上海晶华胶粘新材料股份有限公司;纸基胶板,上海金标生物科技有限公司。
1.1.2 菌株
目标菌:弗氏柠檬酸杆菌ATCC43864、大肠埃希氏菌ATCC25922、肺炎克雷伯氏菌ATCC13882、产气克雷伯菌ATCC13048;革兰氏阳性菌非目标菌:粪肠球菌ATCC29212、金黄色葡萄球菌ATCC6538;革兰氏阴性菌非目标菌:鼠伤寒沙门氏菌ATCC14028、铜绿假单胞菌ATCC10104;均购自美国菌种保藏中心。
1.2 仪器与设备
ME104电子天平,瑞士梅特勒-托利多公司;SG604-INT生物安全柜,美国Baker公司。
1.3 实验方法
1.3.1 菌悬液的制备
分别挑取上述试验菌株的单菌落接种于BHI中,36 ℃培养24 h。取1 mL菌液加入9 mL无菌生理盐水中混合均匀,即为10-1稀释液,重复上述操作将菌液稀释至适宜稀释度,其中目标菌、革兰氏阴性非目标菌得到菌落总数处于102 CFU/mL的菌悬液;革兰氏阳性菌非目标菌得到菌落总数处于106 CFU/mL的菌悬液;将4株目标菌的菌悬液各取2 mL混合,得到混合菌液。
1.3.2 测试片的制备
大肠菌群测试片的基材选用菌落总数测试片研究[6]时所使用的基材,即上层覆膜为厚度为0.22 mm PET塑料膜,底板为200 g防水型背胶相纸,将培养基组分混合均匀后添加于测试片底板培养区域。
1.3.3 测试片载体的筛选
参照REN等[7]研究的相关信息,选择瓜尔胶、海藻酸钠、黄原胶、卡拉胶进行试验,筛选可应用于大肠菌群测试片的载体。分别将15 g/L瓜尔胶、海藻酸钠、黄原胶、卡拉胶,与15 g/L结晶紫中性红肉汤培养基、10 g/L乳糖和1.2 g/L三号胆盐混合均匀后,添加至测试片培养区域制备为测试片,每种测试片分别接种1 mL目标菌混合菌液,于37 ℃培养24 h观察菌落状态,同时接种TSA培养基作为对照,计算回收率。本研究中各试验均设置3组平行。
1.3.4 单因素-正交试验确定培养基关键组分添加量
1.3.4.1 冷水可溶凝胶添加量
分别将9、12、15、18、21 g/L卡拉胶,与15 g/L结晶紫中性红肉汤培养基、10 g/L乳糖和1.2 g/L三号胆盐混合均匀后,添加至测试片培养区域制备为测试片,每种测试片分别接种1 mL目标菌混合菌液,于37 ℃培养24 h观察菌落状态,同时接种TSA培养基作为对照。
1.3.4.2 乳糖添加量
分别将4、6、8、10、12 g/L乳糖,与15 g/L结晶紫中性红肉汤培养基、1.2 g/L三号胆盐和15 g/L卡拉胶混合均匀后,添加至测试片培养区域制备为测试片,每种测试片分别接种1 mL目标菌混合菌液,于37 ℃培养24 h观察菌落状态,同时接种TSA培养基作为对照。
1.3.4.3 胆盐添加量
分别将胆盐按0.8、1.0、1.2、1.4、1.6、1.8 g/L,与15 g/L结晶紫中性红肉汤培养基、10 g/L乳糖和15 g/L卡拉胶混合均匀后,添加至测试片培养区域制备为测试片,每种测试片分别接种1 mL目标菌混合菌液与非目标菌液,于37 ℃培养24 h观察菌落状态,同时接种TSA培养基作为对照。
1.3.4.4 最优组合的确定
根据上述实验中确定的各关键组分的添加水平范围,将卡拉胶(12、15、18 g/L)、乳糖(6、8、10 g/L)与胆盐(1.2、1.4、1.6 g/L)进行三因素三水平正交试验,确定关键组分最优组合。
1.3.5 针对特殊大肠菌群的优化-诱导剂的筛选
将乳酰基-N脂酰基鞘氨醇、正丙基-ß乳糖苷、正辛基-ß-D-乳糖苷3种结构类似物,按50~350 mg/L添加量分别设置试验组,与15 g/L结晶紫中性红肉汤培养基、10 g/L乳糖、1.2 g/L三号胆盐和15 g/L卡拉胶混合均匀后,添加至测试片培养区域制备为测试片,接种1 mL目标菌混合菌液后于37 ℃培养24 h观察菌落形态。同时设置阴性对照组,将每个试验组均做去除乳糖组分的处理,混合均匀后添加至测试片培养区域制备为测试片,接种1 mL弱产气型菌株产气克雷伯菌菌液后于37 ℃培养24 h观察菌落形态。
1.3.6 大肠菌群测试片性能验证
1.3.6.1 标准菌株验证
参照GB 4789.28—2013《食品安全国家标准 食品微生物学检验培养基和试剂的质量要求》中VRBA培养基质控方法,使用标准菌株对本文研制的大肠菌群测试片进行性能验证,将菌液接种至大肠菌群测试片上,于37 ℃ 培养24 h。其中目标菌验证回收率,统计测试片上四周有气泡菌落的数量,同时接种TSA培养基作为对照,计算回收率;非目标菌验证抑制性,观察测试片上是否有菌落生长;特异性验证,观察测试片上鼠伤寒沙门氏菌和铜绿假单胞菌的菌落形态。
1.3.6.2 实际样品验证
选取50份不同基质类型的市售食品样品,梯度稀释后分别使用测试片方法与国标方法进行大肠菌群计数。建立测试片法-国标方法检测结果的标准曲线,采用线性回归分析以检验不同方法检测结果的一致性。
1.4 数据统计与分析
试验数据使用SPSS 20.0软件进行统计分析,显著水平设定P<0.05,各组试验重复3次,取平均值。
2 结果与分析
2.1 测试片载体的确定
大肠菌群测试片中载体除固化粘合,为培养体系提供一个与固体培养基较近的生长环境外,还需有利于微生物发酵乳糖产生气泡并将其有效截留。常规培养基载体琼脂在冷水中不可溶,脆性易收缩[8],琼脂颗粒间空隙较多,无法有效截留微生物发酵产生的气泡;测试片研究涉及到的载体包括无纺布,纸基与冷水可溶凝胶,其中无纺布与纸基载体均无此特性[9],唯有冷水可溶凝胶遇冷水即水化形成黏稠半流体状态,分子间阻力更小,有利于气泡的产生与保留,符合大肠菌群测试片对载体的要求[10-11]。
不同结构的冷水可溶凝胶物理与化学特性也有不同[12-13],如黏稠度、扩散阻力等,会对微生物生长、色素阻隔、气泡截留等测试片关键指标产生影响。海藻酸钠为一种天然线性多糖[14],生物相容性好[15-16],作为载体培养后有较多区域被微生物液化,此状态下的测试片载体阻力小,气泡整体直径较大,但可能对气泡有一定的吸收能力,测试片上气泡数偏少且几乎没有较小气泡,同时载体已经失去了对色素的阻隔性,无法准确计数;黄原胶化学结构稳定[17-18],作为载体培养后基本无液化情况,但阻力过大,气泡直径均偏小,菌落数量偏少,实际检测时可能导致漏检;瓜尔胶遇水后形成胶状物[19],作为载体无明显液化现象,但由于其阻力小且结构松散,气泡均较大,多个气泡会扩散融合为一个大气泡,无法准确进行计数;卡拉胶是一种提取自藻类的多糖,亲水无毒[20],作为载体制备的测试片在上述各项指标中均有良好的表现,气泡截留率略低原因为混菌中产气克雷伯菌产气能力较差,过小气泡未统计,此问题可通过组分优化进行改进。
4种冷水可溶凝胶特性归纳见表1,制备的测试片在接种目标菌培养后状态见图1。
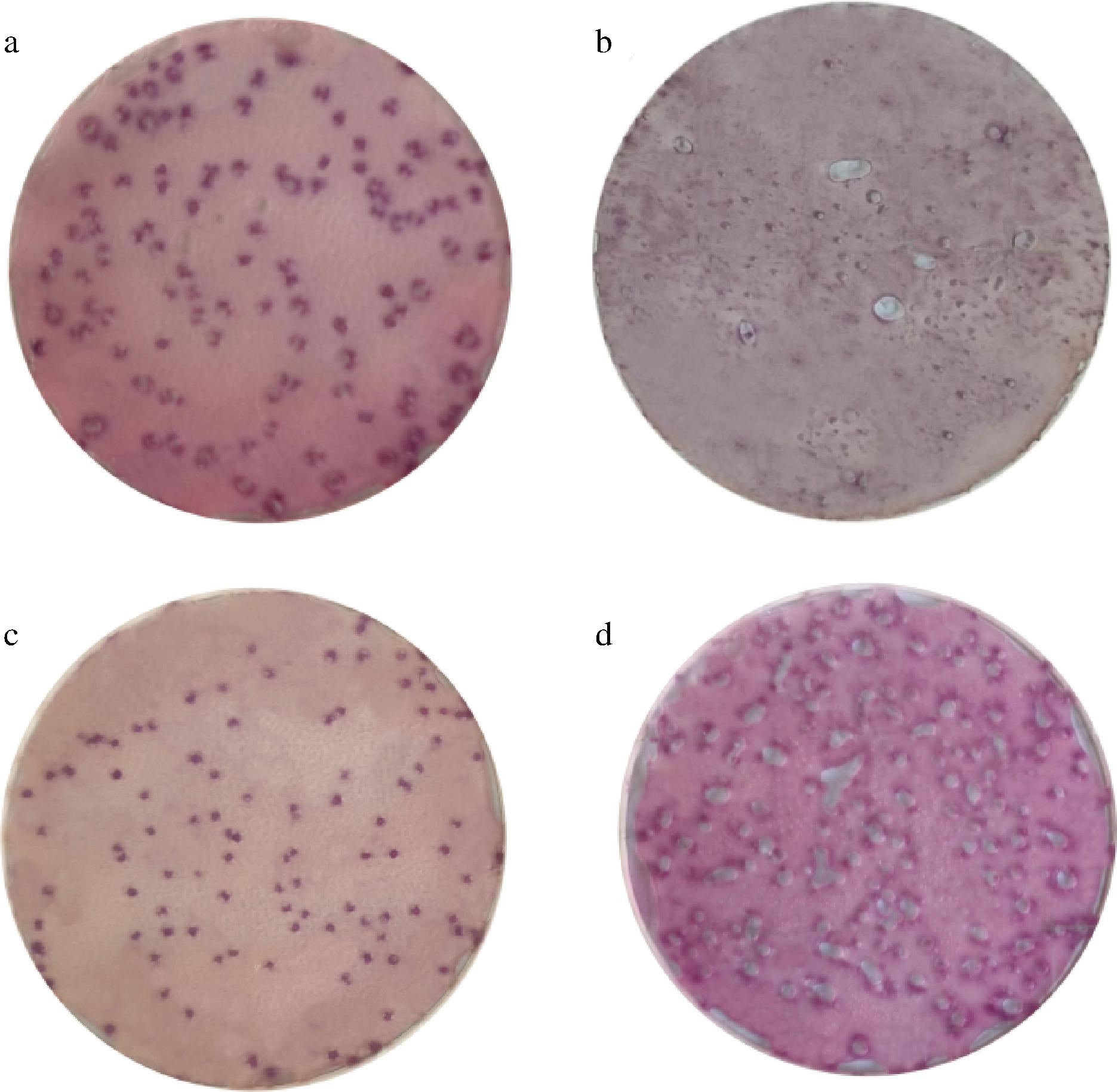
a-卡拉胶;b-海藻酸钠;c-黄原胶;d-瓜尔胶
图1 不同凝胶制备测试片的菌落形态
Fig.1 Colony morphology of test strip prepared by different gel
表1 四种冷水可溶性凝胶性能比对
Table 1 Comparison of different gel

卡拉胶海藻酸钠黄原胶瓜尔胶菌落数量/CFU 98±5.36无法计数72±6.7986±7.71气泡截留率∗/%68±4.22—53±3.91气泡连片液化程度轻微严重无无气泡直径范围/mm0.3~1.30.4~1.8≤0.2—
注:*气泡截留率,为测试片上周围有气泡的菌落数量占测试片上所有菌落数量的比例;—表示无法检测。
2.2 培养基关键组分添加量
2.2.1 冷水可溶凝胶添加量范围
不同卡拉胶添加量对测试片回收率的影响相对较小,气泡截留率以及测试片强度则有明显差异,添加量低于9 g/L时培养基强度弱,接种时易被菌液冲散,培养后不同菌落产生的气泡有扩散融合的情况;增加到12 g/L时强度明显改善,继续增加至21 g/L后,体系凝胶强度过大,气泡形态整体变弱,部分菌株产生的气泡过小易被漏检。卡拉胶添加量在12~18 g/L测试片气泡形态易于观察,气泡截留率较高。
不同卡拉胶添加量制备的测试片培养后统计结果见表2。
表2 卡拉胶添加量对测试片性能影响
Table 2 Effect of carrageenan addition on the performance of test strip
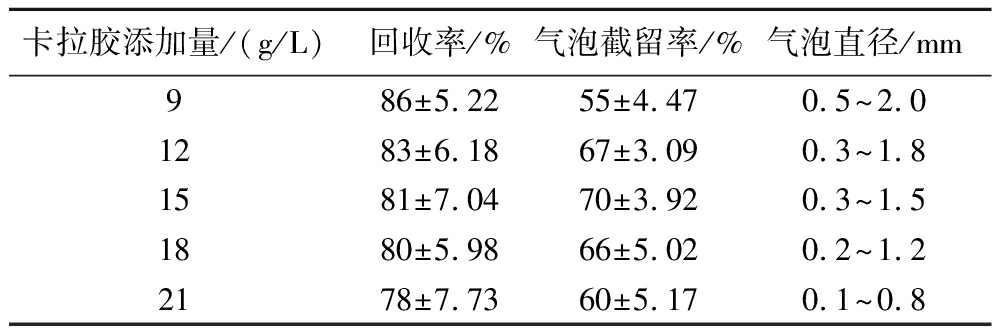
卡拉胶添加量/(g/L)回收率/%气泡截留率/%气泡直径/mm9 86±5.2255±4.470.5~2.01283±6.1867±3.090.3~1.81581±7.0470±3.920.3~1.51880±5.9866±5.020.2~1.22178±7.7360±5.170.1~0.8
2.2.2 乳糖添加量范围
大肠菌群国标方法中以乳糖发酵产气对菌株是否为大肠菌群进行确认,需在大肠菌群测试片体系中添加适宜含量的乳糖以实现菌株确认功能。乳糖添加量4 g/L时含量偏低,微生物之间竞争作用导致部分微生物无法有效发酵乳糖产气,气泡整体偏小;随着乳糖添加量增加此问题得到明显改善,但当乳糖添加量达到12 g/L时,由于其发酵产物乳酸对微生物的抑制作用[21],活性较弱或存在损伤的微生物被抑制,回收率下降明显,仅活性较高的微生物生长并发酵产气,导致整体气泡偏大,气泡截留率异常升高。乳糖添加量在6~10 g/L较为适宜。不同乳糖添加量制备的测试片培养后统计结果见表3。
表3 乳糖添加量对测试片性能影响
Table 3 Effect of lactose addition on the performance of test strip
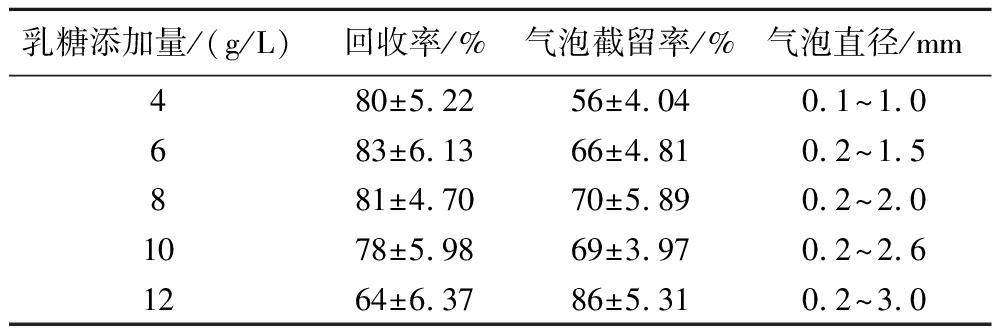
乳糖添加量/(g/L)回收率/%气泡截留率/%气泡直径/mm4 80±5.2256±4.040.1~1.0683±6.1366±4.810.2~1.5881±4.7070±5.890.2~2.01078±5.9869±3.970.2~2.61264±6.3786±5.310.2~3.0
2.2.3 胆盐添加量
胆盐对革兰氏阳性菌有较强的抑制作用,可降低其细胞膜表面张力,使细胞膜破坏或菌体裂解,对革兰氏阴性菌可能有诱导细胞膜多聚糖重塑等作用[22-24],抑制作用较轻微,但添加量过多时弱产气型目标菌产气性能受影响较为明显;另一方面胆盐内内既含亲水性的羟基和羧基,又含疏水性的甲基及烃核,主要构型具有亲水和疏水两个侧面,使分子具有界面活性分子的特征,能降低亲水和疏水两相之间的表面张力[25],即具备表面活性剂功能。由于测试片培养基中凝胶虽为冷水可溶且亲水,但在无表面活性剂的情况下稀释液并不能在培养基表面分散完全,一定添加量的胆盐对于保证稀释液在测试片培养区域的水扩散性能有着重要影响,在测试片体系下需对胆盐的添加量进行优化。不同胆盐添加量制备的测试片性能见表4。
表4 胆盐添加量对测试片性能影响
Table 4 Effect of bile salt addition on the performance of test strip

胆盐添加量/(g/L)回收率/CFU非目标菌生长情况气泡截留率/%水扩散效果0.887±4.25少量菌落74±5.77 不完全1.085±7.36抑制72±4.19不完全1.281±8.53抑制69±6.703~5 s分散完全1.479±6.82抑制67±4.533~4 s分散完全1.682±7.38抑制66±5.341~2 s分散完全1.880±3.99抑制57±4.061 s分散完全
胆盐添加量过低时,无法有效抑制革兰氏阳性菌的生长,测试片培养基表面水扩散性能差,稀释液无法自由扩散满整个培养区域,见图2,此种情况增加测试片局部稀释液溢出的风险;添加量达到1.2 g/L时,水扩散性能已较理想,继续增加胆盐添加量,水扩散速度虽继续增加,但幅度已不大,虽不影响回收率,但添加量达到1.8 g/L时气泡截留率明显降低,说明随着胆盐添加量的增加,弱产气型目标菌的产气性能开始被抑制,综合抑制性、水扩散性能与对目标菌产气性能的影响,胆盐添加量确定为1.2~1.6 g/L。

图2 试验组诱导剂诱导效果
Fig.2 Induction effect of inducers in test group
2.2.4 最优组合的确定
根据1.3.4节中确定的3种关键组分添加量范围进行了三因素三水平正交试验,结果见表5。
表5 关键组分正交试验结果
Table 5 Orthogonal test results of the key components

试验编号因素卡拉胶/(g/L)乳糖/(g/L)胆盐/(g/L)气泡截留率/%11261.270.321281.468.2312101.666.841561.469.751581.664.9615101.271.371861.663.181881.272.2918101.468.9K1205.3203.1213.8K2205.9205.3206.8K3204.2207.0200.6K168.467.771.7K268.668.468.9K368.169.066.9R0.51.34.8
3种关键组分对测试片气体截留性能的影响程度主次顺序为胆盐>乳糖>卡拉胶,最优配比为卡拉胶15 g/L,乳糖10 g/L,胆盐1.2 g/L,经过验证在此配比下,气泡截留率为78.7%。
2.3 诱导剂的筛选
微生物菌株在测试片上产生气泡的大小取决于菌株乳糖利用能力,自然界中存在一定比例的弱产气型大肠菌群菌株,即使在营养充足,菌株未受损伤时产气量仍很少甚至不产气[26],另外产气能力较强的菌株在活性不佳时产气性能也会受到影响,在实际检测过程中易被漏检。相关研究中尚无对此问题改进的报道,为提高测试片对此类菌株的检出能力,本文参考本单位多年微生物快检产品研发经验,尝试添加少量无抑菌性的乳糖结构类似物作为发酵诱导剂,在不产生假阳性气泡的前提下增加弱产气型目标菌的产气量,本研究中选择乳酰基-N脂酰基鞘氨醇、正丙基-ß乳糖苷、正辛基-ß-D-乳糖苷3种组分作为诱导剂进行试验。
培养基中分别加入乳酰基-N脂酰基鞘氨醇(添加量达到250 mg/L)或正丙基-ß乳糖苷(添加量达到200 mg/L)后,气泡截留率可得到提升;添加正丙基-β乳糖苷的对照试验中,在100 mg/L添加量时阴性对照已有明显产气情况,此结构类似物在诱导菌株发酵乳糖的过程中自身也被分解产生气泡,在检测过程中可能导致非目标菌被误判为大肠菌群;乳酰基-N脂酰基鞘氨醇在添加量为250 mg/L时有良好的诱导效果,且对照组添加量为350 mg/L时阴性对照仍未发现产气菌落,此结构类似物在诱导微生物发酵乳糖的过程中应发挥了类似催化剂的作用,或即使在诱导过程中被消耗也不会发生产气效应。
使用含有250 mg/L乳酰基-N脂酰基鞘氨醇组分的测试片,与未添加该组分的测试片对混合菌液进行比对验证,共进行10次检测,使用SPSS软件进行配对t检验,P<0.05,添加诱导剂测试片产气菌落数平均为94.6 CFU/片,未添加诱导剂测试片产气菌落平均数为81.1 CFU/片,说明在测试片中添加250 mg/L乳酰基-N脂酰基鞘氨醇作为诱导剂,对测试片产气泡菌的检出率能有显著提升。
3种结构类似物诱导效果见图2,对照试验结果见图3,验证数据统计分析见表6。
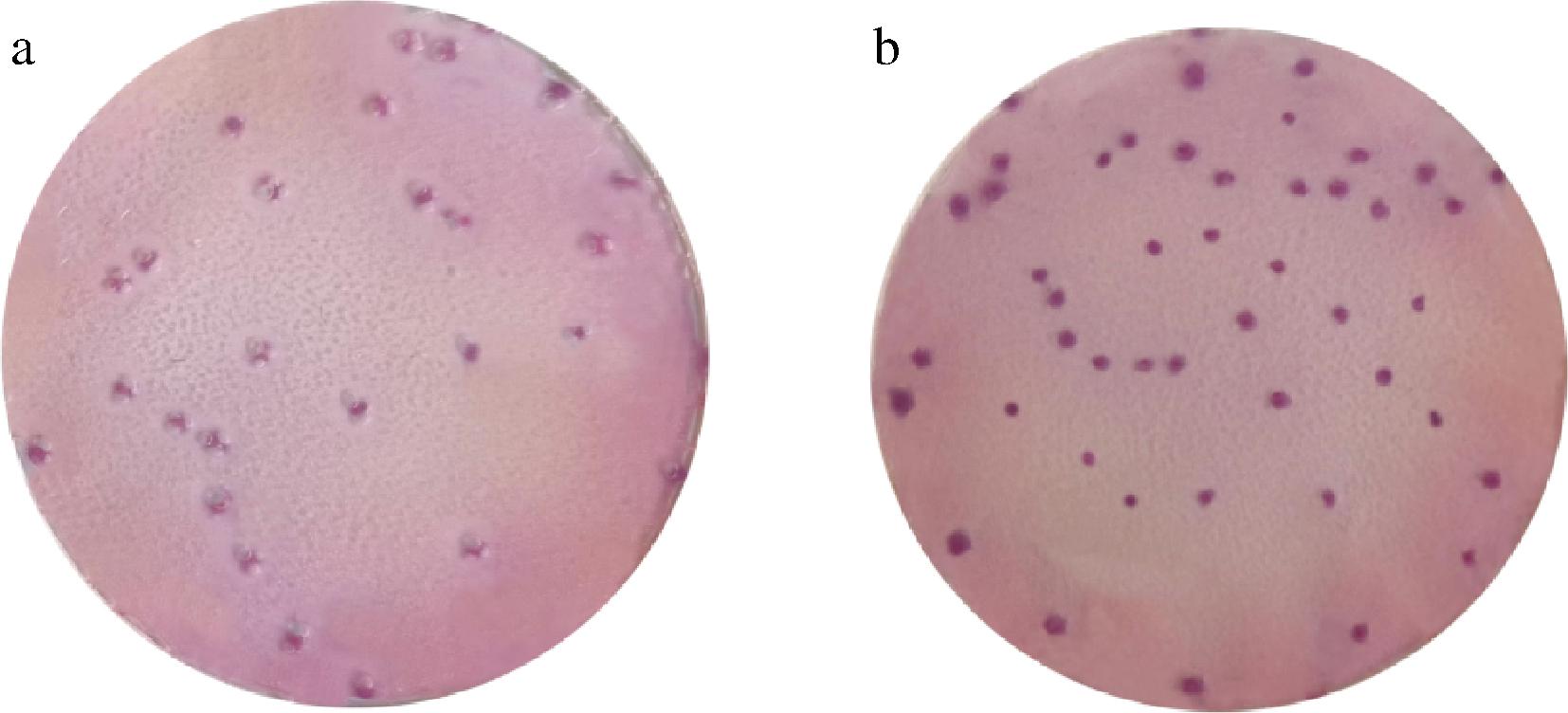
a-100 mg/L正丙基-ß乳糖苷对照;b-350 mg/L乳酰基-N脂酰基鞘氨醇对照
图3 诱导剂对照组结果
Fig.3 Comparison test results of two inducers
注:100 mg/L正丙基-ß乳糖苷阴性对照菌落四周存在气泡;350 mg/L乳酰基-N脂酰基鞘氨醇阴性对照菌落四周无气泡。
表6 标准菌株验证结果
Table 6 Validation results of standard strains

菌株产气泡菌落数量/CFUTSA菌落数量/CFU回收率/%弗氏柠檬酸杆菌73±4.1796±5.3376.0大肠埃希氏菌66±5.5782±6.2680.5产气克雷伯菌59±3.2977±5.3976.6肺炎克雷伯氏菌73±4.3082±3.7789.0粪链球菌无菌落生长多不可计完全抑制金黄色葡萄球菌无菌落生长多不可计完全抑制鼠伤寒沙门氏菌0——铜绿假单胞菌0——
注:—表示无需检测。
2.4 标准菌株验证
4株大肠菌群标准菌株在测试片形成四周有明显气泡的菌落,回收率均达到75%以上,满足现行国标方法GB 4789.28—2013中VRBA培养基生长率(回收率)达到70%即满足要求的评判标准,革兰氏阳性非目标菌均被完全抑制,沙门氏菌等在国标方法检测时易与目标菌混淆的干扰菌,在测试片上形成四周无气泡的菌落,可直接与目标菌进行区分,显示出测试片在特异性与便捷性上的优势,测试片标准菌株验证结果见表6与图4。

a-弗氏柠檬酸杆菌;b-铜绿假单胞菌
图4 标准菌株在大肠菌群测试片上菌落形态
Fig.4 Colony morphology of standard strains on coliform test strip
2.5 实际样品验证
使用大肠菌群测试片与国标方法对50份市售食品样本进行检测,2种检测方法的线性相关曲线见图5(未检出大肠菌群的样品,结果记为1 CFU/g),2种方法R2达到0.98。对于少部分的样品,2种方法计数结果存在少许偏差,原因为国标方法在挑取典型菌落进行确证的步骤中操作人员主观因素对结果有影响,同时测试片方法补充了诱导剂成分,加强了对样本中弱产气目标菌的检测能力,部分样品计数结果较国标方法略高。本次验证国标方法检测为阴性的11份样品中,有1份使用测试片法检测出少量产气量较少的菌落,经国标方法验证确定为大肠菌群,另有5份测试片检验结果较国标方法偏高的样品,于每张测试片上挑取10个气泡偏小的菌落用国标方法确证后均判定为大肠菌群。去除掉上述6个样品后,使用SPSS将2种方法检测结果进行配对t检验,P>0.05,无明显差异。说明对于常规样品,测试片与国标方法检测结果无明显差异,对于少量含有弱产气目标菌的样品,使用测试片法可提升检出率。
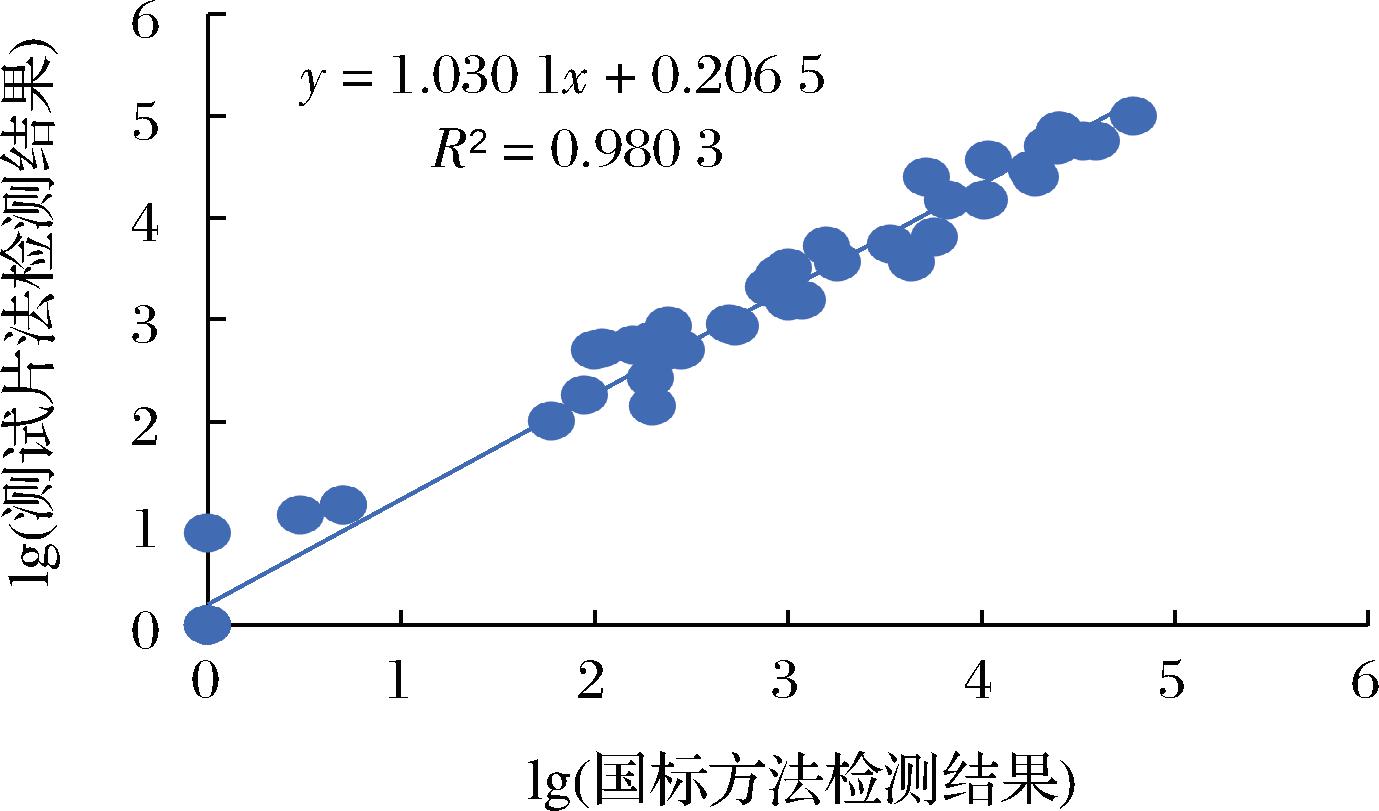
图5 大肠菌群测试片法与国标法检测结果相关曲线
Fig.5 Linear correlation curve of test results between coliform test strip method and national standard method
3 结论与讨论
本文以大肠菌群国标检测方法检测流程为参照,将VRBA体系与发酵验证体系相结合研制出大肠菌群测试片,可在一张测试片上同时实现选择性分离与产气验证。测试片关键环节为培养基组分研制,VRBA培养基中的琼脂在冷水中不可溶,在测试片形式下无法作为载体,本研究引入冷水可溶凝胶作为培养体系载体,为微生物提供与固体培养基类似的生长环境,同时利用其成胶性收集截留大肠菌群在培养过程中产生的气体,实现于测试片上同时进行菌落形态与发酵产气2种性状的观察。在实际研究过程中通过理化性能筛选出卡拉胶作为测试片载体,并通过正交试验确定卡拉胶15 g/L、乳糖10 g/L、胆盐1.2 g/L的最优添加量组合;最后本研究筛选出乳酰基-N脂酰基鞘氨醇作为乳糖发酵诱导剂,添加量为250 mg/L时,可显著提升特殊弱产气型目标菌产气率,最大程度避免对此类微生物的漏检。标准菌株进行性能验证中,测试片回收率及革兰氏阳性菌抑制性均满足GB 4789.3—2013中对VRBA培养基的评判标准,同时沙门氏菌等革兰氏阴性非目标菌无气泡生成,特异性良好;实际样品检测中,测试片与国标中平板计数法计数结果一致性良好,说明本文研制的大肠菌群测试片在应用于实际食品微生物检测时结果与国标方法结果无明显差异,并且在一定程度上解决了当前国标方法在实际检测过程中对部分弱产气型大肠菌群检出能力略低的问题。
大肠菌群测试片在进行样本检测时相对于国标方法具有明显的优势,使用便捷,结果读取环节相比于国标方法需依靠经验挑取典型菌与可疑菌,进行产气验证的判读方式,测试片只需对四周有气泡的菌落进行计数即可,结果获取更为客观便捷,同时测试片最大优势分离确认同时进行,将检测时间由48 h缩短为24 h,对于食品行业意义重大。在菌落总数测试片已经进入国家标准的背景下,大肠菌群测试片产品作为食品行业快速检测的解决方案,将有更大的发挥空间。一款成熟的产品包括技术性能与批量化的生产工艺2个环节,本文仅在技术可行性上进行了尝试,如何实现测试片批量化生产是后续研究重点,本研究所做工作可为从事大肠菌群测试片研究的行业人员提供思路,为测试片产品的商品化积累经验。
[1] 张文佳.不同检验方法检验食品中大肠菌群[J].食品安全导刊,2021(35):131-133.
ZHANG W J.Detection of coliform in food by different test methods[J].China Food Safety Magazine,2021(35):131-133.
[2] 延进霞.基于快速纸片法的餐(饮)具消毒效果监测结果分析[J].质量安全与检验检测,2021,31(6):18-20.
YAN J X.Analysis of monitoring results of disinfection effect of tableware (drinking) based on fast paper method[J].Quality Safety Inspection and Testing,2021,31(6):18-20.
[3] 许金榜.VRBA和3M PetrifilmTM快速测试片定量检测大肠菌群的性能比较研究[J].质量技术监督研究,2021(1):17-22.
XU J B.Comparative study of performance of violet red bile agar (VRBA) and 3M PetrifilmTM coliform rapid test strip on quantitative detection of coliforms[J].Quality and Technical Supervision Research,2021(1):17-22.
[4] 韩朝国,董炜峰,杨毕铖,等.高灵敏度大肠菌群测试片法与多管发酵法检测海水中粪大肠菌群的比较研究[J].海洋开发与管理,2017,34(10):68-71.
HAN C G,DONG W F,YANG B C,et al.A Comparative study on the detection of fecal coliform in seawater by high sensitivity Coliform sest slice method and multi-tube fermentation method[J].Ocean Development and Management,2017,34(10):68-71.
[5] 范蕊,王文文,卢彬,等.食品中菌落总数、大肠菌群的检测技术探讨[J].现代食品,2021,7(4):212-214.
FAN R,WANG W W,LU B,et al.Discussion on the detection technology of the total number of bacterial colonies and coliform in food[J].Modern Food,2021,7(4):212-214.
[6] 王杰伟,吴艳辉,孙万东,等.凝胶型菌落总数测试片的研制[J].现代食品科技,2021,37(5):325-331.
WANG J W,WU Y H,SUN W D,et al.Preparation of gel bacterial testing plate[J].Modern Food Science and Technology,2021,37(5):325-331.
[7] REN D Y,CHEN P,WANG Y R,et al.Research and application on the characteristics of compound cold water soluble gel in petrifilm aerobic count plates[J].LWT,2017,82:335-341.
[8] 于凌云,孙策.琼脂-瓜尔胶复合凝胶理化性能测试及其凝胶骨架材料缓释性能[J].当代化工,2022,51(7):1620-1623;1628.
YU L Y,SUN C.Physical and chemical properties of agar-guar composite gel and sustained-release property of its gel framework material[J].Contemporary Chemical Industry,2022,51(7):1620-1623;1628.
[9] 刘爽,刘桐,苑帅,等.以无纺布为载体的菌落总数测试片的研究[J].现代食品科技,2018,34(5):209-214;266.
LIU S,LIU T,YUAN S,et al.Study on the petrifilm aerobic count plates with non-woven fabric as carrier[J].Modern Food Science and Technology,2018,34(5):209-214;266.
[10] 贾振华,沈黎,凡敏,等.大肠菌群冷水凝胶快速检测试纸片的研发[J].湖北农业科学,2015,54(17):4281-4283.
JIA Z H,SHEN L,FAN M,et al.Study of quick detection of Escherichia coli by detective slips[J].Hubei Agricultural Sciences,2015,54(17):4281-4283.
[11] 吴许文,吴清平,张淑红,等.细菌测试片的冷水可凝凝固剂初步研究和应用[J].微生物学通报,2009,36(11):1783-1788.
WU X W,WU Q P,ZHANG S H,et al.Preliminary study and application on cold water gelling agent for bacterial testing slip[J].Microbiology,2009,36(11):1783-1788.
[12] PRAJAPATI V D,JANI G K,MORADIYA N G,et al.Locust bean gum:A versatile biopolymer[J].Carbohydrate Polymers,2013,94(2):814-821.
[13] BARAK S,MUDGIL D.Locust bean gum:Processing,properties and food applications—A review[J].International Journal of Biological Macromolecules,2014,66:74-80.
[14] 高宇,邵盛培.海藻酸钠复合水凝胶的制备及其细菌检测应用研究[J].中国海洋药物,2022,8(6):49-56.
GAO Y,SHAO S P.Preparation of sodium alginate composite hydrogel for bacterial detection[J].Chinese Journal of Marine Drugs,2022,8(6):49-56.
[15] ADERIBIGBE B A,BUYANA B.Alginate in wound dressings[J].Pharmaceutics,2018,10(2):42.
[16] ZHANG M,ZHAO X.Alginate hydrogel dressings for advanced wound management[J].International Journal of Biological Macromolecules,2020,162:1414-1428.
[17] 邱嘉辉,何亚文.微生物胞外多糖黄原胶的应用与研究进展[J].激光生物学报,2019,28(5):385-393;409.
QIU J H,HE Y W.Advances in applications and research of xanthan gum[J].Acta Laser Biology Sinica,2019,28(5):385-393;409.
[18] BABBAR S B,JAIN R.Xanthan gum:An economical partial substitute for agar in microbial culture media[J].Current Microbiology,2006,52(4):287-292.
[19] JAIN R,BABBAR S B.Guar gum and isubgol as cost-effective alternative gelling agents for in vitro multiplication of an orchid,Dendrobium chrysotoxum[J].Current Science,2005,88(2):292-295.
[20] 郑瑞峰,王晓娟,吴秋艳,等.卡拉胶凝胶保水机理及其应用研究[J].食品安全导刊,2022(8):186-188.
ZHENG R F,WANG X J,WU Q Y,et al.Study on water retention mechanism of carrageenan gel and its application[J].China Food Safety Magazine,2022(8):186-188.
[21] 吴丽娜,刘昀阁,张一敏,等.乳酸和过氧乙酸对大肠杆菌O157∶H7生物膜的抑制作用及其机制[J].食品科学,2022,43(9):10-18.
WU L N,LIU Y G,ZHANF Y M,et al.Inhibitory effects and mechanisms of lactic acid and peracetic acid on Escherichia coli O157∶H7 biofilm formation[J].Food Science,2022,43(9):10-18.
[22] HERN NDEZ S B,CAVA F,PUCCIARELLI M G,et al.Bile-induced peptidoglycan remodelling in Salmonella enterica[J].Environmental Microbiology,2015,17(4):1081-1089.
NDEZ S B,CAVA F,PUCCIARELLI M G,et al.Bile-induced peptidoglycan remodelling in Salmonella enterica[J].Environmental Microbiology,2015,17(4):1081-1089.
[23] DELMAS J,GIBOLD L,FAÏS T,et al.Metabolic adaptation of adherent-invasive Escherichia coli to exposure to bile salts[J].Scientific Reports,2019,9(1):2175.
[24] ONAL DARILMAZ D,BEYATLI Y.Bile salt deconjugation activity of Propionibacterium strains and their cholesterol co-precipitation abilities[J].International Journal of Dairy Technology,2019,72(4):551-558.
[25] MALDONADO-VALDERRAMA J,MUROS-COBOS J L,HOLGADO-TERRIZA J A,et al.Bile salts at the air-water interface:Adsorption and desorption[J].Colloids and Surfaces.B,Biointerfaces,2014,120:176-183.
[26] 刘腊兰,刘子音,卓一鸣,等.一株发酵乳糖不产气大肠埃希氏菌的分离与鉴定[J].湖南农业科学,2023(2):7-11.
LIU L L,LIU Z Y,ZHUO Y M,et al.Isolation and identi cation of an Escherichia coli strain fermenting lactose without gas production[J].Hunan Agricultural Sciences,2023(2):7-11.
cation of an Escherichia coli strain fermenting lactose without gas production[J].Hunan Agricultural Sciences,2023(2):7-11.