早在20世纪60年代,科学家们就观察到了海洋中的费氏弧菌(Vibrio fischeri)的发光现象,并发现其发光强度与种群密度密切相关[1]。随后,在1994年,“群体感应(quorum sensing,QS)”这一术语由FUQUA等[2]首次提出,用来描述细菌中依赖于细胞密度的细胞间信号传递,并表现出细菌群体的合作行为模式。目前已发现许多受到QS调控的微生物群体行为,如生物发光、生物膜的形成、毒力因子的表达、次级代谢产物的生成和抵抗恶劣环境的能力等[3]。
QS不仅仅只存在于单种微生物间,在复杂微生物群落中,QS也发挥着积极的调控作用。发酵食品就是由微生物群落在适宜的条件下,食品基质经过特定代谢途径产生风味得到的一类食品。发酵食品的风味、质地和安全性极大程度上取决于发酵过程中微生物群落的代谢活性和相互作用,除营养代谢产物的交换外,基于QS的细胞-细胞交流是另一微生物互作的重要方式。研究QS有助于建立发酵食品中微生物化学信号物质与其生理行为之间的联系,还能通过人为干扰或促进特定微生物的发酵性能,使其具有实际应用价值[4]。本文综述了近些年发酵系统中微生物QS的研究进展,以期为拓展QS在食品发酵工业中的开发和应用提供参考。
1 群体感应信号分子的定义及分类
微生物间的信号传递是指群体感应信号分子(quorum sensing molecules,QSMs)的浓度积累到一定阈值时,能被胞内的目标受体识别,进而触发同步的相关基因的表达,更好地适应生长过程中的环境条件的变化[5]。因此,QSMs是触发微生物群体行为的关键。但事实上,在生长过程中任何细胞内或细胞间的代谢物都有可能是潜在的QSMs,QSMs的产生是否只用于细胞间的信号传递,而区别于维持生命活动的代谢物?首先,QSMs应能被细胞识别,且细胞内存在对其特定的感知和响应机制;其次,细胞积累的QSMs对其本身无毒害作用,并能在达到阈值后诱导同步的群体行为,外源添加的QSMs能以同样的方式实现调控作用;最后,QSMs应更适应于群体进化,群体行为将更利于群体发展而非单个细胞[6-9]。
1.1 细菌群体感应信号分子
1.1.1 细菌种内信号分子
N-酰基高丝氨酸内酯类(acyl-homoserine lactones,AHLs)是革兰氏阴性菌中最常见的一种信号分子。基于AHLs的QS系统是第一个被发现的QS系统[10],最早对它的研究是费氏弧菌中的生物发光现象,LuxI是胞内调节AHLs合成的一种蛋白酶,由于AHLs是一类水溶性的小分子,因此可跨越细胞膜分泌至细胞外环境中,随着种群密度的增加,AHLs的浓度也随之达到阈值,并能与胞内的LuxR蛋白形成AHL-LuxR复合物,该复合物将与下游的荧光素酶基因簇luxCDABE基因的启动子结合,激活转录过程,由此诱导费氏弧菌的生物发光现象[11]。
自诱导肽类(autoinducing peptides,AIPs)只存在于革兰氏阳性菌中,是一类氨基酸和寡肽类信号分子。由于AIPs分子不能通过自由扩散的方式跨越细胞膜,因此需要ATP binding cassette(ABC)转运系统才能被释放至胞外并发挥作用。以金黄色葡萄球菌(Staphylococcus aureus)中的Agr QS系统为例,积累的信号分子将激活双组分系统(two component signaling system,TCS),并与组氨酸激酶AgrC结合随后进行磷酸化,磷酸联级反应使得调控因子AgrA也发生磷酸化,磷酸化后的产物将与主要靶启动子P2和P3结合,激活下游基因RNA II和RNA III转录,这些基因的表达将参与金黄色葡萄球菌自身QS系统的循环和毒力因子的产生[12-13]。
1.1.2 细菌种间信号分子
自诱导物-2(autoinducer-2,AI-2),广泛存在于革兰氏阳性和阴性菌中,是一类种间信号分子。AI-2主要由LuxS蛋白催化合成,因此AI-2介导的QS系统又常被称为LuxS/AI-2 QS系统。与AIPs类似,AI-2在细胞中的调控作用也需要TCS和ABC转运蛋白的参与。以哈氏弧菌(Vibrio harveyi)响应AI-2介导的QS系统为例,在高种群密度时,信号分子与受体蛋白LuxP结合并被检测到,再与传感器激酶LuxQ作用,进一步促进磷酸转移蛋白LuxU和LuxO的磷酸联级反应以调控QS系统所介导的各种功能基因的表达[14-15]。
自诱导物-3(autoinducer-3,AI-3)被认为是一类维持种间交流的QSM[14]。有研究证实了肠出血性大肠杆菌(Enterohemorrhagic Escherichia coli,EHEC)中的存在AI-3介导的QseBC QS系统,且肾上腺素(epinephrine,Epi)和去甲肾上腺素(norepinephrine,NE)能行使AI-3的功能。qseBC基因形成的操纵子所表达QseB和QseC形成了一个TCS。胞外的AI-3会首先被TCS识别,与细胞膜上的QseC蛋白结合后,导致其自磷酸化,紧接着QseB被激活并引发下游复杂的传导通路[15]。
此外,哈氏弧菌产生的第三类QSM霍乱自诱导物-1(cholerae autoinducer-1,CAI-1)[4]和黄单胞菌(Xanthomonas spp.)产生的扩散信号因子(diffusible signaling factor,DSF)[16]也参与细菌的种间交流。
1.1.3 细菌其他信号分子
其他QSMs还包括喹诺酮类(pseudomonas quinolone signal,PQS)和二酮哌嗪类(diketopiperazines,DKPs)等[17]。随着细菌QS研究的深入,新的QSMs将在不同物种中被进一步挖掘。
1.2 真菌群体感应信号分子
真菌作为发酵食品中一类重要的微生物,随着近些年来对真菌中QS系统研究的深入,也发现了众多真菌中的QSMs(表1),已有的QSMs主要分为醇类、脂氧合物、α-(1,3)-葡聚糖、信息素和挥发性化合物及气体等[18],其中又以法尼醇、酪醇和苯乙醇研究得最为深入。法尼醇作为真菌的QSMs对其他微生物和宿主也存在作用及联系[19],但真菌的QSMs种类繁杂,且真菌的QS研究仍处于起步阶段,具体的信号合成及传导机制尚未有较为详尽及全面的研究。
表1 真菌的群体感应信号分子
Table 1 Quorum sensing molecules of fungi
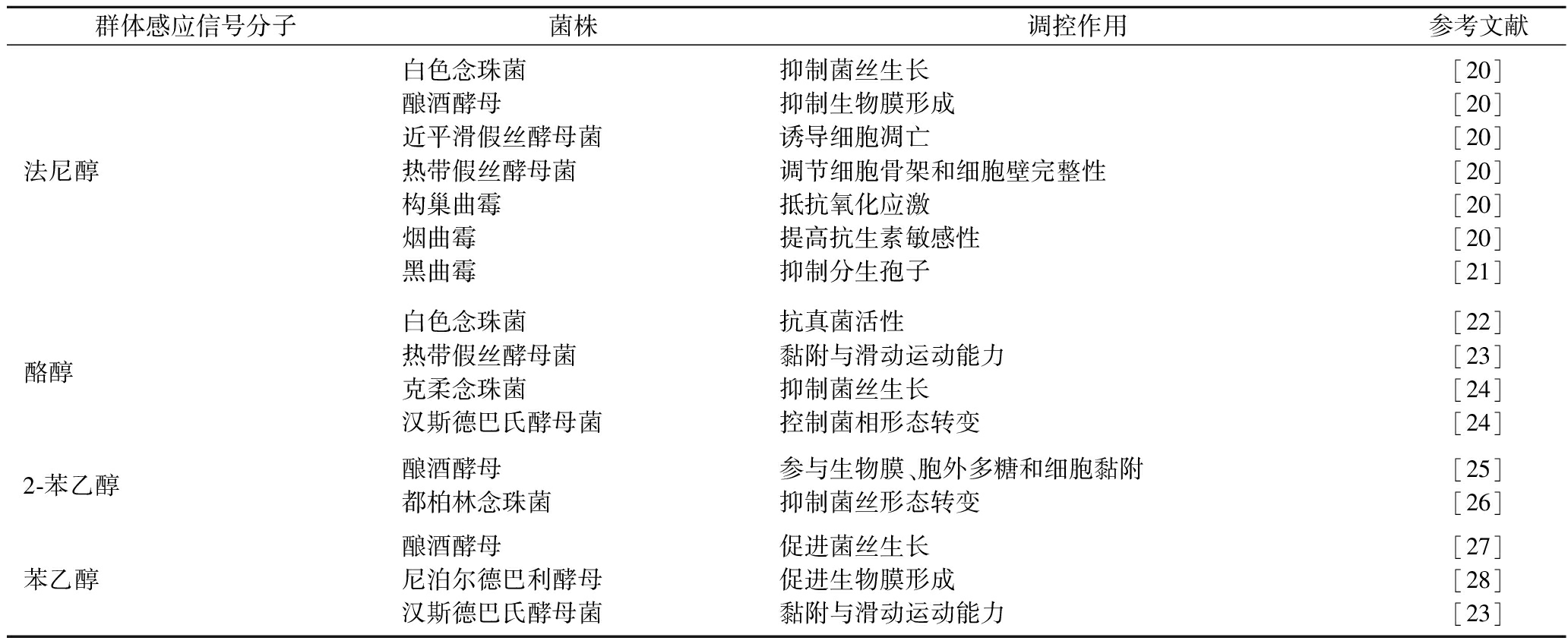
群体感应信号分子菌株调控作用参考文献法尼醇白色念珠菌酿酒酵母近平滑假丝酵母菌热带假丝酵母菌构巢曲霉烟曲霉黑曲霉抑制菌丝生长抑制生物膜形成诱导细胞凋亡调节细胞骨架和细胞壁完整性抵抗氧化应激提高抗生素敏感性抑制分生孢子[20][20][20][20][20][20][21]酪醇白色念珠菌热带假丝酵母菌克柔念珠菌汉斯德巴氏酵母菌抗真菌活性黏附与滑动运动能力抑制菌丝生长控制菌相形态转变[22][23][24][24]2-苯乙醇酿酒酵母都柏林念珠菌参与生物膜、胞外多糖和细胞黏附抑制菌丝形态转变[25][26]苯乙醇酿酒酵母尼泊尔德巴利酵母汉斯德巴氏酵母菌促进菌丝生长促进生物膜形成黏附与滑动运动能力[27][28][23]
续表1

群体感应信号分子菌株调控作用参考文献异戊醇白色念珠菌都柏林念珠菌控制菌相形态转变[26]氧脂素构巢曲霉土霉菌新型隐球菌黄曲霉影响真菌霉素生成和孢子繁殖类型(有性或无性)刺激洛伐他汀生物合成影响毒力因子表达影响菌体密度、激活分生孢子的形成[29][30][31][32]α-(1,3)-葡聚糖荚膜组织胞浆菌控制菌相形态转变影响菌株致病性和毒力保护细胞免受宿主吞噬溶酶体的伤害[33][34][35]信息素酿酒酵母参与胞质融合和核融合[36]色氨酸酿酒酵母影响细胞黏附和絮凝[37]γ-丁内酯土霉菌菌核青霉菌刺激洛伐他汀生物合成刺激核丛青霉素生物合成[30][38]6-戊基-α-吡喃酮木霉菌属抗真菌活性[39]二氧化碳黑曲霉白色念珠菌新型隐球菌诱导孢子萌发控制菌相形态转变在有性生殖中抑制细胞融合[40][41][42]3-辛酮3-辛醇1-辛烯-3-醇木霉菌属黑暗环境下诱导产孢[43]
2 群体感应对发酵体系微生物的调控
发酵食品作为复杂体系,是多种微生物共同作用的产物,因此,为探究QS对发酵食品的调控作用,应先明晰QS对单个微生物各类性状的调控作用,尤其应关注发酵体系中的优势菌种。根据近几年相关文献研究,QS对微生物的调控作用可大致归为以下四类:细胞行为(生物膜、运动性能、黏附、菌丝形态变化等),应激耐受性(耐酸、耐盐、耐乙醇等),次级代谢物如细菌素、胞外多糖(exopolysaccharide,EPS)等的生成和与其他微生物及宿主间的相互作用。
2.1 细胞行为
生物膜的形成对于绝大多数微生物来说是面临复杂环境的一种最有利的生活策略,它们常常出现于固态食品基质和食品加工环境中。ZHANG等[44]在内蒙古发酵乳制品中筛选出了一株旧金山乳杆菌(Lactobacillus sanfranciscensis)并比较了不同浓度的内源性AI-2和外源合成AI-2对其生物膜形成能力的影响,实验结果表明外源合成的AI-2在40 μmol/L的添加量下,表现出最为显著的促进效果,同时生物膜相关基因ftsH的表达量也增加。2-苯乙醇(2-phenylethanol,2-PE)被认为是酿酒酵母(Saccharomyces cerevisiae)中的QSMs,ZHANG等[25]通过构建ARO8、ARO9和ARO10基因的敲除菌株来研究合成2-PE的关键基因对酿酒酵母生物膜形成的影响,发现ΔARO8和ΔARO9菌株在发酵前期2-PE含量减少,EPS的形成和参与细胞黏附的FLO基因家族的表达显著降低,从而影响了生物膜的形成能力。这些结果都证实了QS对微生物生物膜形成有积极的影响。
QS对细胞运动性能的影响在哈氏弧菌[45]、大肠杆菌(Escherichia coli)[46]和铜绿假单胞菌(Pseudomonas aeruginosa)[47]中均有报道,这主要依赖于调控鞭毛蛋白相关基因的表达。在变形链球菌(Streptococcus mutans)中,外源添加AI-2能影响其黏附相关基因spaP的表达[48];在真核生物中,苯乙醇作为QSMs同样促进了柠檬形克勒克酵母(Kloeckera apiculate)的黏附特性[28]。在酵母菌和霉菌中,常常发生QS诱导的菌丝形态变化,以人类条件致病菌白色念珠菌(Candida albicans)为例,法尼醇作为在真菌中最早被发现的QSMs,其能够控制白色念珠菌酵母相和菌丝相形态的转换[18]。
从以上结果中可以看出,QS对细胞行为的调控极大程度上与细胞的运动能力及其代谢活性相关。而对于发酵体系而言,细胞行为又意味着菌株在发酵过程中的主要作用和功能,与食品的发酵周期、感观品质、细菌毒素的产生和腐败菌控制密切相关[49]。
2.2 应激耐受性
应激耐受性是微生物应对环境变化的适应性反应,DENG等[50]通过对比鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG,LGG)野生型和luxS敲除菌株,发现LGG敲除株几乎不产生AI-2,且在pH 3的培养基中,敲除株的存活率显著低于野生型。这一结论与JIA等[51]的研究结果类似,后者发现植物乳杆菌KLDS1.0391(Lactobacillus plantarum KLDS1.0391)在缺失luxS基因后,AI-2的产量明显减少,对酸、胆盐和胃肠道模拟消化液的耐受性也显著降低。以上结果表明,luxS基因不仅参与AI-2的合成,还与某些乳酸菌的耐受特性存在密切的关系。LIU等[52]的研究发现,引起食品腐败的荧光假单胞菌(Pseudomonas fluorescens)rpoS突变株会引起AHL产量的减少,5个AHL相关基因的转录水平和胞外蛋白酶活性也显著降低;在10 mmol/L H2O2、47 ℃高温和12%(体积分数)乙醇条件的处理下,ΔrpoS菌株的存活率明显低于野生型菌株,由此看来,RpoS是荧光假单胞菌抗逆性、QS和腐败性的关键调控因子,未来可作为食品加工中的控制靶点。此外,也有研究聚焦于QS在醋酸菌酸胁迫[53]和酿酒酵母重金属胁迫[54]下发挥的重要作用,这为酿造微生物的选育和发酵工艺的优化提供了重要参考。在发酵食品中,随着有机酸、乙醇等代谢产物的积累,微生物往往面临各类不利环境,因此,QS对益生菌、腐败菌和致病菌的不同调控机制将直接影响发酵过程中微生物群落的演替过程和产品的感官品质。
2.3 次级代谢产物的生成
细菌素是由包括乳酸菌在内的多种细菌产生的具有抑菌作用的多肽或蛋白质,基于其稳定性和安全性,细菌素可作为天然的食品防腐剂拮抗多种病原体[55]。乳酸乳球菌(Lactococcus lactis)分泌的乳链菌肽(Nisin)是目前研究最多的一类细菌素,有趣的是,Nisin自身可作为QSMs被TCS识别,诱导自身细菌素相关基因的表达[56]。在WANG等[57]的研究中,共培养的植物乳杆菌KX041和面包乳杆菌MN047(Companilactobacillus crustorum MN047)表现出增强的抑菌活性,但敲除2株乳杆菌的luxS基因后,共培养条件下其对大肠杆菌的抑菌活性减弱,RNA测序结果进一步揭示luxS基因的缺失影响了QS相关基因的表达,这表明luxS基因及QS对某些乳酸菌抗菌物质的生成具有调控作用。
EPS是细菌分泌到细胞外环境中的糖类化合物,也是生物膜组成的主要成分,它与细菌抵抗各类环境应激有关,同时很多细菌的EPS有抗氧化和抗肿瘤的生理活性[58]。纪亚楠[59]发现在面对不同酸胁迫、高温胁迫和渗透胁迫时,植物乳杆菌5-4-1和乳酸片球菌TG1-1-10(Pediococcus acidilactici TG1-1-10)EPS和AI-2的分泌呈现出相同的趋势。GU等[60]研究进一步发现在植物乳杆菌培养基中添加不同浓度的AI-2能显著提高EPS的产量。因此,这些研究表明AI-2作为QSMs所引起的QS调控也参与了细菌EPS的生成。
在发酵体系中,微生物的次级代谢产物之间往往存在各种交换和利用,如EPS就可充当营养物质作为食品基质中的碳源,又如细菌素可抑制其他微生物的生长,因此,QS调控下的次级代谢物的生产与复杂体系中菌群的活动与变化有直接联系。
2.4 与其他微生物及宿主间的相互作用
发酵食品中微生物之间的共存和相互作用普遍存在,在可可豆自发发酵的过程中,ALMEIDA等[61]通过宏基因组学分析发现可可发酵过程中微生物的演替由酵母开始,随后转向乳酸菌,最后以醋酸菌为优势菌株,其中QS可能是微生物面临恶劣环境时保持相对丰度较高的策略之一。宏基因组学分析结果发现菌群间既存在种间QS信号,也存在种内QS信号,这表明QS在复杂生态群落中承担重要的调控角色,且维持了不同时间节点微生物种间的交互共生。GU等[62]发现酸马奶酒中筛选出的酿酒酵母YE4的无细胞上清液(cell-free supernatant,CFS)虽然抑制了粪肠球菌8-3(Enterococcus faecium 8-3)和发酵乳杆菌2-1(Lactobacillus fermentum 2-1)的生长、生物膜形成和产酸性能,却促进了其AI-2的分泌和QSMs相关基因的表达;当酿酒酵母YE4与乳酸菌共培养时,YE4又分别抑制了粪肠球菌8-3 luxS和pfs基因的表达和发酵乳杆菌2-1 luxS基因的表达,这说明无论是酵母菌代谢产物的刺激或是与乳酸菌的直接接触,都可能诱发QS系统的响应,乳酸菌也会通过分泌AI-2来调节生理行为以应对此类环境刺激。
此外,肠道菌群与宿主之间也可能存在QS调控下的潜在关系,FU等[63]探究了AI-2与坏死性小肠结肠炎(necrotizing enterocolitis,NEC)之间的联系,发现NEC急性期的AI-2水平却显著降低,因此提出AI-2可作为早期发现和预防NEC的潜在生物标志物。大量研究表明,QS可调节大肠杆菌ETEC、沙门氏菌(Salmonella)、霍乱弧菌(Vibrio cholerae)、艰难梭菌(Clostridium difficile)和铜绿假单胞菌等肠道致病菌对肠道健康的影响[64-68],主要表现在增强其肠道定殖的能力和毒力因子的表达。而对益生菌而言,QS的调控似乎是有利的。DENG等[69]发现,野生型鼠李糖乳杆菌LGG与luxS敲除株相比,前者能更好的维持肠道组织形态和促进肠道黏液分泌,因此能更有效地缓解新生仔猪由断奶引起的肠道损伤,这些研究结果意味着通过控制QS来治疗宿主某些顽固性疾病和肠道菌群失衡存在一定潜力。
3 群体感应在食品发酵过程中的调控作用
发酵食品在我国历史悠久,品类众多,其复杂的微生物群落成员之间的生态分布、代谢活性和相互作用赋予了发酵食品独特的风味及口感。目前,人们对发酵食品中QS作用的分子机制知之甚少,但QS作为微生物种内和种间的交流方式,无疑在发酵过程中发挥着举足轻重的作用。研究发酵过程及发酵微生物不仅能选育优良菌种更好的应用于发酵工业,还为积极控制发酵过程和食品质量提供了重要参考(图1)。
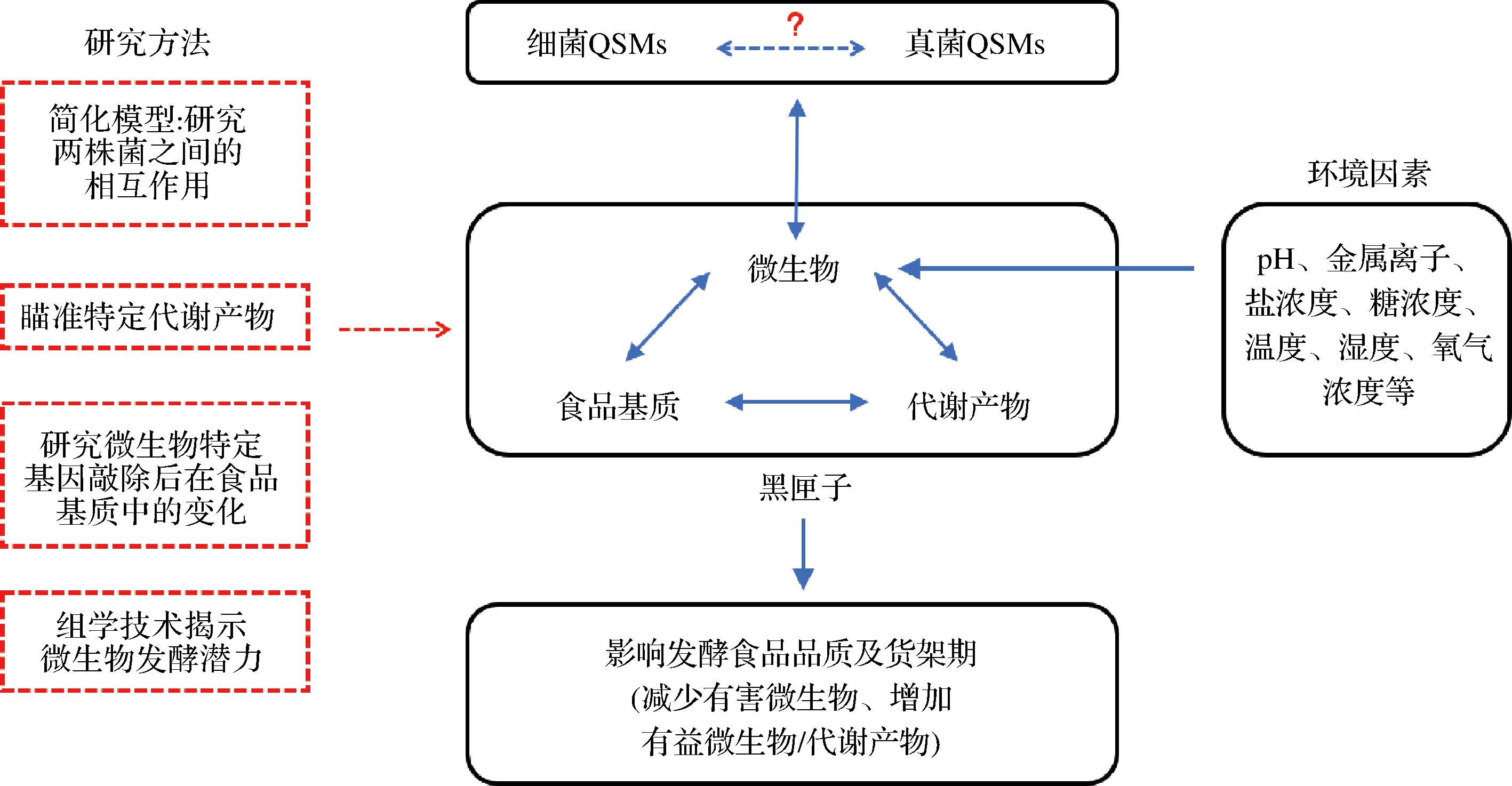
图1 微生物群体感应与发酵食品的关系及研究方法
Fig.1 Relationship and methodologies between microbial quorum sensing and fermented foods
3.1 泡菜
泡菜是我国最知名的一类传统发酵食物,主要由乳酸菌发酵而来。LIU等[70]研究了泡菜样品在第4、31、79天的感官品质、菌落组成和QSMs。在发酵前期,泡菜的pH值降到最低,乳杆菌属为优势菌属,其中,产AI-2的细菌经鉴定为植物乳杆菌;发酵中期pH值保持在3.5以下,此时仍是乳杆菌属为优势菌属,但片球菌属(Pediococcus)的相对丰度显著增加,植物乳杆菌、短乳杆菌(Lactobacillus brevis)、片球菌(Pediococcus sp.)、肠杆菌(Enterobacter sp.)和巨大芽孢杆菌(Bacillus megaterium)都被检测到具有产AI-2的能力;而发酵后期,随着乳酸菌代谢分解有机酸和腐败菌生长繁殖,发酵液的pH值逐渐上升至6.14,此时,肠杆菌属成为了优势菌属,并能检测到其AHL活性。3个时间点提取的RNA中均能扩增出植物乳杆菌luxS基因片段,但只能在第79天的样品中成功扩增出AHL相关基因片段,这表明,在泡菜发酵的全过程中,乳杆菌可能一直通过AI-2进行交流;当腐败发生时,以肠杆菌为主的细菌还能通过AHL进行交流。PARK等[71]报道了从不同泡菜样品中AI-2的强度,为了追踪AI-2的产生和来源,又从泡菜样品中分离出了229株乳酸菌。他们进一步检测这些乳酸菌的AI-2信号强度,发现乳杆菌属、魏斯氏菌属(Weissella)和明串珠菌属(Leuconostoc)作为其中优势菌属既能产生又能抑制AI-2信号。以上研究表明,AI-2很可能是泡菜发酵的全过程中最活跃的一类的QSMs,乳酸菌作为代表菌种,对AI-2信号的产生和抑制也具有菌种特异性,泡菜的变质过程可能受到AI-2/QS和AHLs/QS的共同调节,但具体作用机制仍不明晰。
3.2 酒
酒类酿造已持续几千年,发酵过程主要依赖于酵母菌生成乙醇。在酒体的风味形成方面,酿酒酵母中芳香醇的生物合成受到细胞密度的调控,高细胞密度会上调ARO9和ARO10基因的表达,刺激芳香醇的产生,此外,芳香醇的产生也可受到的自调控,通过激活转录因子Aro80p,进一步激活和芳香族转氨酶ARO9和脱羧酶ARO10的表达,从而形成正反馈循环。因此,酿酒酵母在较高种群密度时会产生更多的2-PE和色氨酸[72-73]。事实上,CHEN等[74]对酿酒酵母中ARO基因进行了开创性的研究,他们表明ARO基因控制QSMs 2-PE、色氨酸和酪醇的生物合成,并将QS通路与环境感知联系起来(细胞密度和营养环境对酿酒酵母细胞形态改变的影响)。在此基础上,AVBELJ等[75]对葡萄酒发酵过程中QS动力学和ARO基因表达进行了研究,初步证实了QSMs 2-PE、色氨酸和酪醇的峰值产量与负责合成的基因ARO8、ARO9和ARO10的峰值表达之间的相关性,芳香醇的浓度也依赖于细胞密度和生长阶段。在啤酒酿造中,酵母絮凝现象十分常见,但这似乎也与QS有关。一项研究调查了2-PE、色氨酸和酪醇对二倍体酵母EM93絮凝行为的影响,结果表明,与对照组相比,不同浓度的QSMs对酵母絮凝有显著影响。作者认为,细胞间的相互黏附决定了絮凝体的形成,且只有当微生物种群足够大时,絮凝现象才会发生,而Flo黏附蛋白仅在较高种群密度下才能行使其功能,因此,酿酒酵母的絮凝行为很可能受到QSMs的调控[37]。在实际生产中,酵母过早絮凝可能会影响发酵周期、乙醇生产和啤酒风味等[76],对QS的进一步研究可以揭示酵母酿造过程中的行为变化,为众多工业问题提供参考依据。
3.3 乳制品
乳制品在全球食品消费中占有重要的份额,也是蛋白质来源的重要途径。GORI等[77]从成熟干酪表面分离出多株细菌被证明具有AI-2活性,此外,研究者还探讨了低pH和高NaCl胁迫下,微生物产AI-2活性的变化,发现Corynebacterium casei、Microbacterium gubbeenense和Staphylococcus equorum subsp.linens细胞外AI-2活性增加,这表明AI-2在这些细菌应激适应过程具有重要调控作用,同时,作为一种参与环境胁迫调控的非特异性的QSMs,AI-2很可能参与奶酪表面微生物的群落的演替过程。在另一项研究中,宏基因组和功能分析确定了来自智利的开菲尔乳品中存在编码QSMs的基因和生物膜形成与扩散的基因[78],此情况下,还需进一步证实开菲尔中QSMs的存在。
在发酵乳贮藏问题上,由嗜冷菌繁殖引起的腐败变质为乳制品行业带来了极大的挑战。YUAN等[79]认为细菌产生的腐败酶、生物膜和QS作用是牛奶腐败的主要因素,这三者之间又存在紧密联系。QS能积极调控生物膜的产生,基于生物膜的特定形态和屏障保护功能,酶的产生和热稳定性在生物膜中又进一步得到了增强。随后,YUAN等[80]对30份AHLs处理的牛奶样品进行了RNA测序,结果表明,外源AHLs的添加可增加牛奶粒径和牛奶中的酸含量,转录组分析显示,AHLs可能调节453个基因的表达,大多数与细菌生长代谢、酶生成、胁迫反应相关的基因显著上调,这一结果表明了AHLs在嗜冷菌QS引起的牛奶腐败中的潜在参与。目前,乳制品行业保证产品质量安全和保质期的首选方法仍然是严格遵循卫生标准,防止腐败菌的污染,但随着QS的深入研究,这将为控制乳制品腐败的新策略提供线索。
3.4 肉制品
发酵肉制品是一类利于长期贮藏的肉制品,在微生物及酶的发酵作用下,原料肉中的蛋白和脂肪会发生一系列的生物化学变化,使肉制品形成独特的色泽和风味,香肠和火腿就是最经典的两类发酵肉制品。LIN等[81]从中国发酵肉制品中分离了沙克乳杆菌(Lactobacillus sakei)、Lactobacillus sp.和植物乳杆菌并发现它们具有AI-2活性,为进一步研究高亚硝酸盐发酵环境下对AI-2活性的影响,研究者检测了3株乳杆菌的luxS基因的转录水平,发现对于菌株而言,亚硝酸盐浓度越高,luxS基因的表达量越高。尽管亚硝酸盐作为食品添加剂在肉制品生产中的应用极其重要,但同时它也具有很强的毒性,过量食用会对人体健康产生影响,此外,肉制品中微生物产生的肠毒素和生物胺也是潜在的毒性物质。SUSILO等[82]比较了金黄色葡萄球菌RKI1野生型菌株和Δagr菌株在火腿表面固定化生长过程中的细胞生长、肠毒素D的形成和sed的表达,结果表明,缺失agr不影响火腿上金黄色葡萄球菌RKI1的生长速度和最大细胞密度,但在生长前期至中期对肠毒素的生成有显著影响。ZHANG等[83]从云南的三川火腿中分离出了产酪胺的粪肠球菌,发现高温和低盐条件都能增加了粪肠球菌酪胺的产量,随后利用代谢组学工具鉴定出了粪肠球菌合成生物胺的QSMs——丙氨酰亮氨酸。这为减少火腿中生物胺的积累提供了理论依据,有利于今后生产工业中对火腿中生物胺含量的控制。QS在肉制品中的调控作用不止于此,也有研究发现QS还参与发酵肉制品风味物质的产生和发酵进程的调控[84-85]。
3.5 其他发酵食品
除以上四类常见的发酵食品外,在一些调味品、发酵面团和果蔬表面的微生物群落中也存在QS现象[15]。在西班牙绿橄榄发酵过程中,与单独接种植物乳杆菌NC8相比,RUIZ-BARBA等[86]发现NC8与2种特定的细菌素产生诱导菌株粪肠球菌6T1a-20和戊糖片球菌FBB63(Pediococcus pentosaceus FBB63)共接种后,其在橄榄发酵中的生长和存活率大大提高。由此推测,特定细菌的存在可能会被植物乳杆菌NC8等菌株识别为一种环境刺激,以启动特定的适应性反应。RIPARI等[87]在测定意大利酸面团中微生物产挥发性化合物能力时,发现了酵母的QSMs,且绝大多数风味活性化合物是由酵母和乳酸菌产生。鱼露是我国华南地区传统的调味品,因其独特的咸鲜风味,受到众多消费者的喜爱,但生产过程常常因为生物胺的积累受到制约。吴哲铭[88]从鱼露发酵液中筛选出一株降解生物胺的嗜盐四联球菌MJ4(Tetragenococcus halophilus MJ4),并探究了外源添加AI-2对嗜盐四联球菌MJ4在发酵过程中对挥发性物质和生物胺降解的影响,发现不同浓度AI-2的添加能够增强其脂肪酶、氨肽酶、淀粉酶的活性、耐盐性和生物胺降解能力,对相关基因的表达也有上调的作用。值得注意的是,当嗜盐四联球菌MJ4与其他产胺菌株共培养时,AI-2的添加能进一步抑制生物胺的积累,可见QS也在鱼露发酵过程中起着积极的调控作用。
4 结语
食品相关微生物中QS系统和QSMs的存在已被证实,大多数研究都围绕QS对单一菌种的行为调控,尽管许多发酵食品中也已发现QSMs的存在,而QS在发酵食品中的研究仍处于探索阶段。发酵食品可以被看作是一个复杂多变的代谢系统,不同食品基质和外部环境的变化推动了微生物群落自发式演变,目前,较新的研究常用组学技术来鉴定发酵食品中微生物组成及功能潜力,挖掘QS相关基因及其表达情况,或揭示QSMs对不同菌株代谢的影响。此外,QS领域仍存在许多亟待解决的问题,如寻找更多天然的QS系统以扩宽在不同菌株间的利用;了解QSMs在复杂环境中的分子调控机制及在细胞进化方面所发挥的作用;未来还应着眼于QS对发酵过程的影响,研究可能存在于商业相关酿造菌株种内或种间行为与QS之间的联系,为QS在产业化中的利用奠定基础。
[1] KEMPNER E S,HANSON F E.Aspects of light production by Photobacterium fischeri[J].Journal of Bacteriology,1968,95(3):975-979.
[2] FUQUA W C,WINANS S C,GREENBERG E P.Quorum sensing in bacteria:The LuxR-LuxI family of cell density-responsive transcriptional regulators[J].Journal of Bacteriology,1994,176(2):269-275.
[3] MUKHERJEE S,BASSLER B L.Bacterial quorum sensing in complex and dynamically changing environments[J].Nature Reviews.Microbiology,2019,17(6):371-382.
[4] 李彩艳,梁志宏.细菌和真菌群体感应研究进展[J].延安大学学报(自然科学版),2016,35(2):39-44.
LI C Y,LIANG Z H.Research progress on quorum sensing in bacteria and fungi[J].Journal of Yanan University (Natural Science Edition),2016,35(2):39-44.
[5] BAI A J,RAI V R.Bacterial quorum sensing and food industry[J].Comprehensive Reviews in Food Science and Food Safety,2011,10(3):183-193.
[6] ALBUQUERQUE P,CASADEVALL A.Quorum sensing in fungi-a review[J].Medical Mycology,2012,50(4):337-345.
[7] MONDS R D,O’TOOLE G A.Metabolites as Intercellular Signals for Regulation of Community-Level Traits[M].Washington,DC,USA:ASM Press,2014:105-129.
[8] WINZER K,HARDIE K R,BURGESS N,et al.LuxS:Its role in central metabolism and the in vitro synthesis of 4-hydroxy-5-methyl-3(2H)-furanone[J].Microbiology,2002,148(Pt 4):909-922.
[9] WINTERS M,ARNEBORG N,APPELS R,et al.Can community-based signalling behaviour in Saccharomyces cerevisiae be called quorum sensing? A critical review of the literature[J].FEMS Yeast Research,2019,19(5):foz046.
[10] NEALSON K H,PLATT T,HASTINGS J W.Cellular control of the synthesis and activity of the bacterial luminescent system[J].Journal of Bacteriology,1970,104(1):313-322.
[11] KUMAR L,PATEL S K S,KHARGA K,et al.Molecular mechanisms and applications of N-acyl homoserine lactone-mediated quorum sensing in bacteria[J].Molecules,2022,27(21):7584.
[12] MCBRAYER D N,CAMERON C D,TAL-GAN Y.Development and utilization of peptide-based quorum sensing modulators in Gram-positive bacteria[J].Organic &Biomolecular Chemistry,2020,18(37):7273-7290.
[13] PENG P,BALDRY M,GLESS B H,et al.Effect of co-inhabiting coagulase negative staphylococci on S. aureus agr quorum sensing,host factor binding,and biofilm formation[J].Frontiers in Microbiology,2019,10:2212.
[14] 韩翔鹏,上官文丹,李尧,等.细菌群体感应系统调控及淬灭机制研究进展[J].中国食品学报,2022,22(2):390-401.
HAN X P,SHANGGUAN W D,LI Y,et al.Research progress on the regulation and quenching mechanisms of bacterial quorum sensing system[J].Journal of Chinese Institute of Food Science and Technology,2022,22(2):390-401.
[15] JOHANSEN P,JESPERSEN L.Impact of quorum sensing on the quality of fermented foods[J].Current Opinion in Food Science,2017,13:16-25.
[16] HE Y W,DENG Y Y,MIAO Y S,et al.DSF-family quorum sensing signal-mediated intraspecies,interspecies,and inter-Kingdom communication[J].Trends in Microbiology,2023,31(1):36-50.
[17] 励建荣,李婷婷,王当丰.微生物群体感应系统及其在现代食品工业中应用的研究进展[J].食品科学技术学报,2020,38(1):1-11.
LI J R,LI T T,WANG D F.Research progress on microbial quorum sensing system and its application in modern food industry[J].Journal of Food Science and Technology,2020,38(1):1-11.
[18] 高婧,彭梦雪,梁志宏.真菌群体感应信号分子及群体感应猝灭的研究进展[J].生物加工过程,2020,18(2):214-223.
GAO J,PENG M X,LIANG Z H.Research progress of quorum sensing signal molecules and quorum sensing quenching in fungi[J].Chinese Journal of Bioprocess Engineering,2020,18(2):214-223.
[19] 柯慧慧,牛永武,顾頔,等.真菌群体感应分子法尼醇及其作用机制[J].食品安全质量检测学报,2017,8(3):862-868.
KE H H,NIU Y W,GU D,et al.Quorum sensing molecule,farnesol and its action mechanism in fungi[J].Journal of Food Safety & Quality,2017,8(3):862-868.
[20] AHMAD PADDER S,PRASAD R,SHAH A H.Quorum sensing:A less known mode of communication among fungi[J].Microbiological Research,2018,210:51-58.
[21] LOREK J,PÖGGELER S,WEIDE M R,et al.Influence of farnesol on the morphogenesis of Aspergillus niger[J].Journal of Basic Microbiology,2008,48(2):99-103.
[22] DE A CORDEIRO R,TEIXEIRA C E C,BRILHANTE R S N,et al.Exogenous tyrosol inhibits planktonic cells and biofilms of Candida species and enhances their susceptibility to antifungals[J].FEMS Yeast Research,2015,15(4):fov012.
[23] GORI K,KNUDSEN P B,NIELSEN K F,et al.Alcohol-based quorum sensing plays a role in adhesion and sliding motility of the yeast Debaryomyces hansenii[J].FEMS Yeast Research,2011,11(8):643-652.
[24] CHEN H,FUJITA M,FENG Q H,et al.Tyrosol is a quorum-sensing molecule in Candida albicans[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(14):5048-5052.
[25] ZHANG D L,WANG F J,YU Y,et al.Effect of quorum-sensing molecule 2-phenylethanol and ARO genes on Saccharomyces cerevisiae biofilm[J].Applied Microbiology and Biotechnology,2021,105(9):3635-3648.
[26] MARTINS M,HENRIQUES M,AZEREDO J,et al.Morphogenesis control in Candida albicans and Candida dubliniensis through signaling molecules produced by planktonic and biofilm cells[J].Eukaryotic Cell,2007,6(12):2429-2436.
[27] CHEN W Y,LI C,ZHANG B Y,et al.Advances in biodetoxification of ochratoxin A-a review of the past five decades[J].Frontiers in Microbiology,2018,9:1386.
[28] LIU P,FANG J F,CHEN K,et al.Phenylethanol promotes adhesion and biofilm formation of the antagonistic yeast Kloeckera apiculata for the control of blue mold on citrus[J].FEMS Yeast Research,2014,14(4):536-546.
[29] TSITSIGIANNIS D I,ZARNOWSKI R,KELLER N P.The lipid body protein,PpoA,coordinates sexual and asexual sporulation in Aspergillus nidulans[J].Journal of Biological Chemistry,2004,279(12):11344-11353.
[30] SORRENTINO F,ROY I,KESHAVARZ T.Impact of linoleic acid supplementation on lovastatin production in Aspergillus terreus cultures[J].Applied Microbiology and Biotechnology,2010,88(1):65-73.
[31] SEBOLAI O M,POHL C H,BOTES P J,et al.3-hydroxy fatty acids found in capsules of Cryptococcus neoformans[J].Canadian Journal of Microbiology,2007,53(6):809-812.
[32] HOROWITZ BROWN S,ZARNOWSKI R,SHARPEE W C,et al.Morphological transitions governed by density dependence and lipoxygenase activity in Aspergillus flavus[J].Applied and Environmental Microbiology,2008,74(18):5674-5685.
[33] KÜGLER S,SCHURTZ SEBGHATI T,GROPPE EISSENBERG L,et al.Phenotypic variation and intracellular parasitism by histoplasma Capsulatum[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(16):8794-8798.
[34] SPRAGUE G F Jr,WINANS S C.Eukaryotes learn how to count:Quorum sensing by yeast[J].Genes &Development,2006,20(9):1045-1049.
[35] RAPPLEYE C A,EISSENBERG L G,GOLDMAN W E.Histoplasma capsulatum alpha-(1,3)-glucan blocks innate immune recognition by the beta-glucan receptor[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(4):1366-1370.
[36] SMUKALLA S,CALDARA M,POCHET N,et al.FLO1 is a variable green beard gene that drives biofilm-like cooperation in budding yeast[J].Cell,2008,135(4):726-737.
[38] RAINA S,ODELL M,KESHAVARZ T.Quorum sensing as a method for improving sclerotiorin production in Penicillium sclerotiorum[J].Journal of Biotechnology,2010,148(2-3):91-98.
[39] COONEY J M,LAUREN D R.Trichoderma/pathogen interactions:Measurement of antagonistic chemicals produced at the antagonist/pathogen interface using a tubular bioassay[J].Letters in Applied Microbiology,1998,27(5):283-286.
[40] VAKIL J R,RAGHAVENDRA RAO M R,BHATTACHARYYA P K.Effect of CO2 on the germination of conidiospores of Aspergillus niger[J].Archiv Für Mikrobiologie,1961,39(1):53-57.
[41] AHMAD KHAN M S,AHMAD I,AQIL F,et al.Virulence and Pathogenicity of Fungal Pathogens with Special Reference to Candida albicans[M].Berlin,Heidelberg:Springer Berlin Heidelberg,2010:21-45.
[42] BAHN Y S,COX G M,PERFECT J R,et al.Carbonic anhydrase and CO2 sensing during Cryptococcus neoformans growth,differentiation,and virulence[J].Current Biology,2005,15(22):2013-2020.
[43]![]() M,JAKUB
M,JAKUB KOV
KOV L,V
L,V DEN I,et al.Induction of conidiation by endogenous volatile compounds in Trichoderma spp[J].FEMS Microbiology Letters,2008,284(2):231-236.
DEN I,et al.Induction of conidiation by endogenous volatile compounds in Trichoderma spp[J].FEMS Microbiology Letters,2008,284(2):231-236.
[44] ZHANG Y,GU Y,WU R,et al.Exploring the relationship between the signal molecule AI-2 and the biofilm formation of Lactobacillus sanfranciscensis[J].LWT,2022,154:112704.
[45] YANG Q,DEFOIRDT T.Quorum sensing positively regulates flagellar motility in pathogenic Vibrio harveyi[J].Environmental Microbiology,2015,17(4):960-968.
[46] YU T,MA M Y,SUN Y X,et al.The effect of sublethal concentrations of benzalkonium chloride on the LuxS/AI-2 quorum sensing system,biofilm formation and motility of Escherichia coli[J].International Journal of Food Microbiology,2021,353:109313.
[47] ROBITAILLE S,GROLEAU M C,DÉZIEL E.Swarming motility growth favours the emergence of a subpopulation of Pseudomonas aeruginosa quorum-sensing mutants[J].Environmental Microbiology,2020,22(7):2892-2906.
[48] WANG X,LI X L,LING J Q.Streptococcus gordonii LuxS/autoinducer-2 quorum-sensing system modulates the dual-species biofilm formation with Streptococcus mutans[J].Journal of Basic Microbiology,2017,57(7):605-616.
[49] 朱寒剑,李雷兵,郑心,等.乳酸菌生物膜形成调控及在食品中的应用研究进展[J].食品科学,2021,42(5):296-304.
ZHU H J,LI L B,ZHENG X,et al.Recent progress in understanding the formation and regulation of lactic acid bacteria biofilm and its application in foods[J].Food Science,2021,42(5):296-304.
[50] DENG Z X,HOU K W,VALENCAK T G,et al.AI-2/LuxS quorum sensing system promotes biofilm formation of Lactobacillus rhamnosus GG and enhances the resistance to enterotoxigenic Escherichia coli in germ-free zebrafish[J].Microbiology Spectrum,2022,10(4):e0061022.
[51] JIA F F,ZHENG H Q,SUN S R,et al.Role of luxS in stress tolerance and adhesion ability in Lactobacillus plantarum KLDS1.0391[J].BioMed Research International,2018,2018:4506829.
[52] LIU X X,JI L,WANG X,et al.Role of RpoS in stress resistance,quorum sensing and spoilage potential of Pseudomonas fluorescens[J].International Journal of Food Microbiology,2018,270:31-38.
[53] QIU X M,ZHANG Y,HONG H S.Classification of acetic acid bacteria and their acid resistant mechanism[J].AMB Express,2021,11(1):29.
[54] NATH B J,DAS K K,TALUKDAR R,et al.Tyrosols retrieved from traditionally brewed yeasts assist in tolerance against heavy metals and promote the growth of cells[J].FEMS Microbiology Letters,2022,368(21-24):152.
[55] PEREZ R H,ZENDO T,SONOMOTO K.Multiple bacteriocin production in lactic acid bacteria[J].Journal of Bioscience and Bioengineering,2022,134(4):277-287.
[56] CHIKINDAS M L,WEEKS R,DRIDER D,et al.Functions and emerging applications of bacteriocins[J].Current Opinion in Biotechnology,2018,49:23-28.
[57] WANG P P,YI Y L,LÜ X.CRISPR/Cas9-based genome editing platform for Companilactobacillus crustorum to reveal the molecular mechanism of its probiotic properties[J].Journal of Agricultural and Food Chemistry,2021,69(50):15279-15289.
[58] DEO D,DAVRAY D,KULKARNI R.A diverse repertoire of exopolysaccharide biosynthesis gene clusters in Lactobacillus revealed by comparative analysis in 106 sequenced genomes[J].Microorganisms,2019,7(10):444.
[59] 纪亚楠.环境胁迫对乳酸菌产生物膜、信号分子Al-2及胞外多糖的影响[D].呼和浩特:内蒙古农业大学,2020.
JI Y N.The effects of environmental stress on the production of biofilm,signal molecule AI-2 and EPS in lactic acid bacteria[D].Hohhot:Inner Mongolia Agricultural University,2020.
[60] GU Y,TIAN J J,ZHANG Y,et al.Dissecting signal molecule AI-2 mediated biofilm formation and environmental tolerance in Lactobacillus plantarum[J].Journal of Bioscience and Bioengineering,2021,131(2):153-160.
[61] ALMEIDA O G G,PINTO U M,MATOS C B,et al.Does qorum snsing play a role in microbial shifts along spontaneous fermentation of cocoa beans? An in silico perspective[J].Food Research International,2020,131:109034.
[62] GU Y,TIAN J J,ZHANG Y,et al.Effect of Saccharomyces cerevisiae cell-free supernatant on the physiology,quorum sensing,and protein synthesis of lactic acid bacteria[J].LWT,2022,165:113732.
[63] FU C Y,LI L Q,YANG T,et al.Autoinducer-2 may be a new biomarker for monitoring neonatal necrotizing enterocolitis[J].Frontiers in Cellular and Infection Microbiology,2020,10:140.
[64] STURBELLE R T,DA COSTA DE AVILA L F,ROOS T B,et al.The role of quorum sensing in Escherichia coli (ETEC) virulence factors[J].Veterinary Microbiology,2015,180(3-4):245-252.
[65] ZHANG X J,LIU B B,DING X Y,et al.Regulatory mechanisms between quorum sensing and virulence in Salmonella[J].Microorganisms,2022,10(11):2211.
[66] JUGDER B E,BATISTA J H,GIBSON J A,et al.Vibrio cholerae high cell density quorum sensing activates the host intestinal innate immune response[J].Cell Reports,2022,40(12):111368.
[67] DARKOH C,DUPONT H L,NORRIS S J,et al.Toxin synthesis by Clostridium difficile is regulated through quorum signaling[J].mBio,2015,6(2):e02569.
[68] REZZOAGLI C,GRANATO E T,KÜMMERLI R.In-vivo microscopy reveals the impact of Pseudomonas aeruginosa social interactions on host colonization[J].The ISME Journal,2019,13(10):2403-2414.
[69] DENG Z X,DAI J Y,WEI Y S,et al.Comparison between Lactobacillus rhamnosus GG and LuxS-deficient strain in regulating gut barrier function and inflammation in early-weaned piglets[J].Frontiers in Immunology,2022,13:1080789.
[70] LIU L,TAO Y F,LI Y F,et al.Isolation and characterization of bacteria that produce quorum sensing molecules during the fermentation and deterioration of pickles[J].International Journal of Food Microbiology,2022,379:109869.
[71] PARK H,SHIN H,LEE K,et al.Autoinducer-2 properties of kimchi are associated with lactic acid bacteria involved in its fermentation[J].International Journal of Food Microbiology,2016,225:38-42.
[72] IRAQUI I,VISSERS S,ANDRÉ B,et al.Transcriptional induction by aromatic amino acids in Saccharomyces cerevisiae[J].Molecular and Cellular Biology,1999,19(5):3360-3371.
[73] IRAQUI I,VISSERS S,CARTIAUX M,et al.Characterisation of Saccharomyces cerevisiae ARO8 and ARO9 genes encoding aromatic aminotransferases I and II reveals a new aminotransferase subfamily[J].Molecular and General Genetics MGG,1998,257(2):238-248.
[74] CHEN H,FINK G R.Feedback control of morphogenesis in fungi by aromatic alcohols[J].Genes &Development,2006,20(9):1150-1161.
[75] AVBELJ M,ZUPAN J R,KRANJC L,et al.Quorum-sensing kinetics in Saccharomyces cerevisiae:A symphony of ARO genes and aromatic alcohols[J].Journal of Agricultural and Food Chemistry,2015,63(38):8544-8550.
[76] BRITTON S J,NEVEN H,MASKELL D L.Microbial small-talk:Does quorum sensing play a role in beer fermentation?[J].Journal of the American Society of Brewing Chemists,2021,79(3):231-239.
[77] GORI K,MOSLEHI-JENABIAN S,PURROTTI M,et al.Autoinducer-2 activity produced by bacteria found in smear of surface ripened cheeses[J].International Dairy Journal,2011,21(1):48-53.
[78] IBACACHE-QUIROGA C,GONZ LEZ-PIZARRO K,CHARIFEH M,et al.Metagenomic and functional characterization of two Chilean kefir beverages reveals a dairy beverage containing active enzymes,short-chain fatty acids,microbial β-amyloids,and bio-film inhibitors[J].Foods,2022,11(7):900.
LEZ-PIZARRO K,CHARIFEH M,et al.Metagenomic and functional characterization of two Chilean kefir beverages reveals a dairy beverage containing active enzymes,short-chain fatty acids,microbial β-amyloids,and bio-film inhibitors[J].Foods,2022,11(7):900.
[79] YUAN L,SADIQ F A,BURMØLLE M,et al.Insights into bacterial milk spoilage with particular emphasis on the roles of heat-stable enzymes,biofilms,and quorum sensing[J].Journal of Food Protection,2018,81(10):1651-1660.
[80] YUAN L,WANG N,SADIQ F A,et al.RNA sequencing reveals the involvement of quorum sensing in dairy spoilage caused by psychrotrophic bacteria[J].LWT,2020,127:109384.
[81] LIN M,ZHOU G H,WANG Z G,et al.Functional analysis of AI-2/LuxS from bacteria in Chinese fermented meat after high nitrate concentration shock[J].European Food Research and Technology,2015,240(1):119-127.
[82] SUSILO Y B,SIHTO H M,RÅDSTRÖM P,et al.Reduced enterotoxin D formation on boiled ham in Staphylococcus aureus δagr mutant[J].Toxins,2017,9(9):263.
[83] ZHANG Y H,SHAN B,GONG J S,et al.Mechanism of biogenic amine synthesis of Enterococcus faecium isolated from Sanchun ham[J].Food Science &Nutrition,2022,10(6):2036-2049.
[84] 李军,张旭,马长伟,等.群体感应信号肽介导的产细菌素乳杆菌在发酵肠中的应用[J].中国农业大学学报,2015,20(6):256-262.
LI J,ZHANG X,MA C W,et al.Lactobacillus paraplantarum producing AIP-regulated bacteriocin as starter cultures for fermented sausages[J].Journal of China Agricultural University,2015,20(6):256-262.
[85] 黎凡.基于AI-2/LuxS群体感应系统金华火腿优势菌群风味形成机制的研究[D].杭州:浙江工商大学,2020.
LI F.The mechanism of volatile compounds formation associated with predominant microbial community in Jinhua ham based on AI-2/LuxS quorum sensing system[D].Hangzhou:Zhejiang Gongshang University,2020.
[86] RUIZ-BARBA J L,CABALLERO-GUERRERO B,MALDONADO-BARRAG N A,et al.Coculture with specific bacteria enhances survival of Lactobacillus plantarum NC8,an autoinducer-regulated bacteriocin producer,in olive fermentations[J].Food Microbiology,2010,27(3):413-417.
N A,et al.Coculture with specific bacteria enhances survival of Lactobacillus plantarum NC8,an autoinducer-regulated bacteriocin producer,in olive fermentations[J].Food Microbiology,2010,27(3):413-417.
[87] RIPARI V,CECCHI T,BERARDI E.Microbiological characterisation and volatiles profile of model,ex-novo,and traditional Italian white wheat sourdoughs[J].Food Chemistry,2016,205:297-307.
[88] 吴哲铭.基于luxS/AI-2群体感应系统对鱼露发酵过程中增香降胺调控机理的研究[D].杭州:浙江工商大学,2020.
WU Z M.Study on the regulation mechanism of aromatizing and reducing amine in fishweed fermentation process based on luxS/AI-2 quorum sensing system[D].Hangzhou:Zhejiang Gongshang University,2020.