香气作为果实采后品质的重要评价指标之一[1],在很大程度上影响消费者的购买欲望。乙醇已在众多果实中被认为是一种重要的香气物质,不仅能改善果实的口感和香气,还能促进果实涩味[2]。外源ATP处理增强丙酮酸脱羧酶(pyruvate decarboxylase,PDC)、乙醇脱氢酶(ethanol dehydrogenase,ADH)活性,促进了果实中乙醛和乙醇的含量[3]。另外,乙醇也可作为其他香气物质合成的前体。乙醇与酰基辅酶A(acyl-CoA)结合,在醇酰基转移酶(alcohol acyltransferase,AAT)的催化下生成乙酯[4]。外源乙醇处理增加蓝莓果实中可溶性固形物、可滴定酸和香气物质的含量,特别是乙酯来改善果实的风味[5]。
葡萄(Vitis vinifera L.)因其口感甜美、香气多样而受到消费者的青睐。然而,随着贮藏时间的延长,葡萄易出现香气丧失的现象,这大大降低了其商业价值和食用品质。因此,寻找一种维持葡萄采后香气的方法一直是生产者和经销商长期追求的目标。近年来,已有研究通过UV[6]、1-甲基环丙烯(1-methylcyclopropene,1-MCP)[7]和水分胁迫[8]等技术方法维持葡萄采后的香气。虽然这些方法对维持葡萄采后香气有潜在的作用,但仅限于实验室规模的实验,还未以商业化规模应用。到目前为止,SO2仍是葡萄采后运输和长期贮藏的主要手段。
SO2已被证实保持了葡萄采后品质,对延缓鲜食葡萄衰老过程具有潜在的生物学效应。SO2激活了与次级代谢相关的防御反应和PR蛋白,增强了果实的抗病能力,从而延缓了葡萄的采后衰老[9]。之前的研究表明,SO2通过促进抗坏血酸谷胱甘肽循环,下调过氧化氢传感器表达,减轻采后葡萄的氧化损伤,进而保持果实采后品质[10-11]。然而,SO2处理是否能够通过调节乙醇代谢,维持葡萄采后的香气物质尚未得到充分证实。本研究旨在分析SO2处理对葡萄采后香气的影响。评价乙醇代谢中的含量、酶活性和基因的表达水平,为SO2在果实保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
木纳格 (Vitis vinifera cv.‘Munage’)于2021年10月12日在新疆阿图什市商业果园采收。采收后立即运回新疆农业科院农产品贮藏加工研究所在4 ℃预冷12 h。挑选大小均一、果梗鲜绿、无机械损伤的葡萄果实进行后续试验。
SO2,北京兆格气体科技有限公司;TRNZOL Universal总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂盒,天根生化科技(北京)有限公司。
1.2 仪器与设备
GCMS-QP2020 NX型气相色谱-质谱仪、UV-2600型紫外可见分光光度计,日本岛津公司;5810R型高速冷冻离心机,德国Eppendorf公司;DYY-6型核酸电泳仪,北京六一生物科技有限公司;TPfofessional Standard梯度PCR仪,德国Biometra公司;NAS-99型微量核酸分光光度计,Avans公司;凝胶成像系统,英国Uvitec公司;LightCycler® 96实时定量荧光PCR仪,Roche公司。
1.3 实验方法
将葡萄串装进塑料框架中(35 cm×25 cm×20 cm,里面含有无纺布袋)。葡萄随机分为2组,每组24筐。随后,将其置于熏蒸箱(100 cm×75 cm×75 cm)中,分别用1 000 μL/L SO2和空气(对照)在(0±1) ℃下熏蒸2 h。熏蒸后,每筐葡萄用聚乙烯袋进行包装(聚乙烯袋周身设置留有直径5 mm的透气孔),双向折叠,轻微收口,在(0±1) ℃和90%~95%相对湿度下保存44 d。整个试验共进行了3次生物重复。分别于0、2、9、16、23、30、37、44 d从每个处理中随机抽取果实,用液氮冷冻并在-80 ℃下保存,以进一步分析香气成分、酶活性和基因表达水平。
1.3.1 测定指标与方法
1.3.1.1 SO2残留量的测定
参照GB 5009.34—2022《食品安全国家标准 食品中二氧化硫的测定》。
1.3.1.2 香气物质的测定
采用顶空固相微萃取(solid-phase microextraction,SPME)提取葡萄挥发性化合物进行GC-MS分析。参考FENG等[12]的方法,略有改动。选用50/30 μm DVB/CAR/PDMS SPME萃取头提取葡萄香气物质。称取3.0 g冷冻样品、加入1 g NaCl和5 μL/L 2-辛醇内标品(53.84 mg/L)混合到40 mL顶空烧瓶中。将样品瓶放置在70 ℃恒温水浴锅中平衡20 min。随后将萃取头(50/30 μm DVB/CAR/PDMS SPME纤维)插入顶空瓶中,与样品保持1.5 cm距离,萃取温度为70 ℃,提取30 min。每个处理3个重复,结果取平均值。根据保留时间和质谱库NIST 11.1鉴定香气化合物(国家标准与技术研究院 11.1)。香气物质的相对量按内标浓度计算。
GC-MS条件:使用SH-WAX色谱柱(30 m×0.32 mm×0.25 μm);载气He>99.99%,流速为1.2 mL/min;检测器温度250 ℃,进样口温度220 ℃,不分流;程序升温:40 ℃,保持3 min,以3 ℃/min升至70 ℃,在以3 ℃/min升至120 ℃,再在5 ℃/min升至220 ℃,保持2 min。采用EI 70 eV;离子源温度230 ℃;质谱仪界面温度280 ℃;扫描模式50~550 m/z。
1.3.1.3 丙酮酸、乙醛、乙醇含量的测定
丙酮酸、乙醛、乙醇含量的测定,参照LI等[3]的方法。称取5.0 g冷冻样品,加入5.0 mL 8%(体积分数)三氯乙酸,研磨均浆后。在4 ℃提取3 min,于10 000×g离心20 min,收集3.0 mL上清液,用8%三氯乙酸定容至10 mL,即为提取液。然后,依次加入1.0 mL提取液,2.0 mL 8%三氯乙酸,1.0 mL 0.1%(体积分数)2,4-二硝基苯肼溶液,摇匀,再加5.0 mL 1.5 mol/L氢氧化钠。将溶液混合后,进行显色反应10 min。在520 nm处比测定吸光值的变化,丙酮酸含量以 mg/kg FW表示。
乙醛、乙醇含量的测定,称取1.0 g冷冻样品加入5 mL饱和氯化钠中并均质。在85 ℃下孵育0.5 h后,取1 mL的气体样品,并使用气相色谱仪进行测定并配备了DB-WAX柱(30 m×0.32 mm×0.25 μm)。
GC条件:进样和检测器温度分别保持在160 ℃和200 ℃。加热程序如下:初始温度35 ℃保持1 min,以1 ℃/min升至45 ℃保持1 min,再以5 ℃/min升至80 ℃。分流比10∶1;空气、氢气、氮气的流速分别为300、40、30 mL/min。乙醛和乙醇含量以 mg/kg FW表示。
1.3.1.4 ADH、PDC、AAT活性的测定
参照LI等[3]的方法,略有改动。称取3.0 g果蔬组织样品,置于经预冷的研钵中,加入5.0 mL提取缓冲液(含2 mmol/L二硫苏糖醇和40 g/L交联聚乙烯吡咯烷酮),研磨匀浆,于4 ℃、10 000×g离心30 min。
测定ADH活性的反应溶液包括,2.0 mL 100 mmol/L 2-吗啉乙磺酸缓冲液(pH=6.5);100 μL 1.6 mmol/L 还原型辅酶Ⅰ溶液;200 μL 80 mmol/L乙醛溶液和200 μL粗酶液。在340 nm处测定吸光值的变化,酶活性单位以U/g FW表示。
PDC活力的测定,加入1.5 mL 100 mmol/L;pH=6.5 2-吗啉乙磺酸缓冲液;0.2 mL 5 mmol/L焦磷酸硫胺素溶液;0.2 mL 50 mmol/L 氯化镁溶液;100 μL 1.6 mmol/L 还原型辅酶Ⅰ溶液;0.2 mL 10 U 乙醇脱氢酶;200 μL 50 mmol/L丙酮酸和200 μL粗酶提取液。在UV 340 nm处测定吸光度值的变化,酶活性单位以 U/g FW表示。
测定AAT活性,参照SHI等[13]的方法。将2.0 g样品在20 mL 0.1 mol/L三羟甲基氨基甲烷盐酸盐[pH=8.0,含有0.1%(体积分数)曲拉通X-100,1 mol/L氯化钾和1%(体积分数)交联聚乙烯吡咯烷酮]中匀浆。将匀浆在4 ℃下以10 000×g离心20 min,收集上清液。
反应体系由2 mL 5 mmol/L氯化镁;150 μL 5 mmol/L乙酰辅酶A;50 μL 200 mmol/L丁醇;100 μL 10 mmol/L 5,5′-二硫代双(2-硝基苯甲酸)和 200 μL粗酶提取物混合。在412 nm处测量吸光度值的变化。AAT活性以 U/g FW表示。
1.3.1.5 实时荧光定量PCR(qRT-PCR)分析
分别使用多糖多酚植物总RNA提取试剂盒(DP441)提取葡萄总RNA,并使用FastKing RT试剂盒(含gDNase)合成第一链cDNA。
根据从NCBI上获得的各个基因的序列,设计荧光引物(表1),以Actin为内参基因。按照SuperReal荧光定量预混试剂盒说明书进行qPCR仪分析。测定其Ct值,采用2-ΔΔCT法计算相对表达量。
表1 研究所用引物
Table 1 Primer sequences used in this study
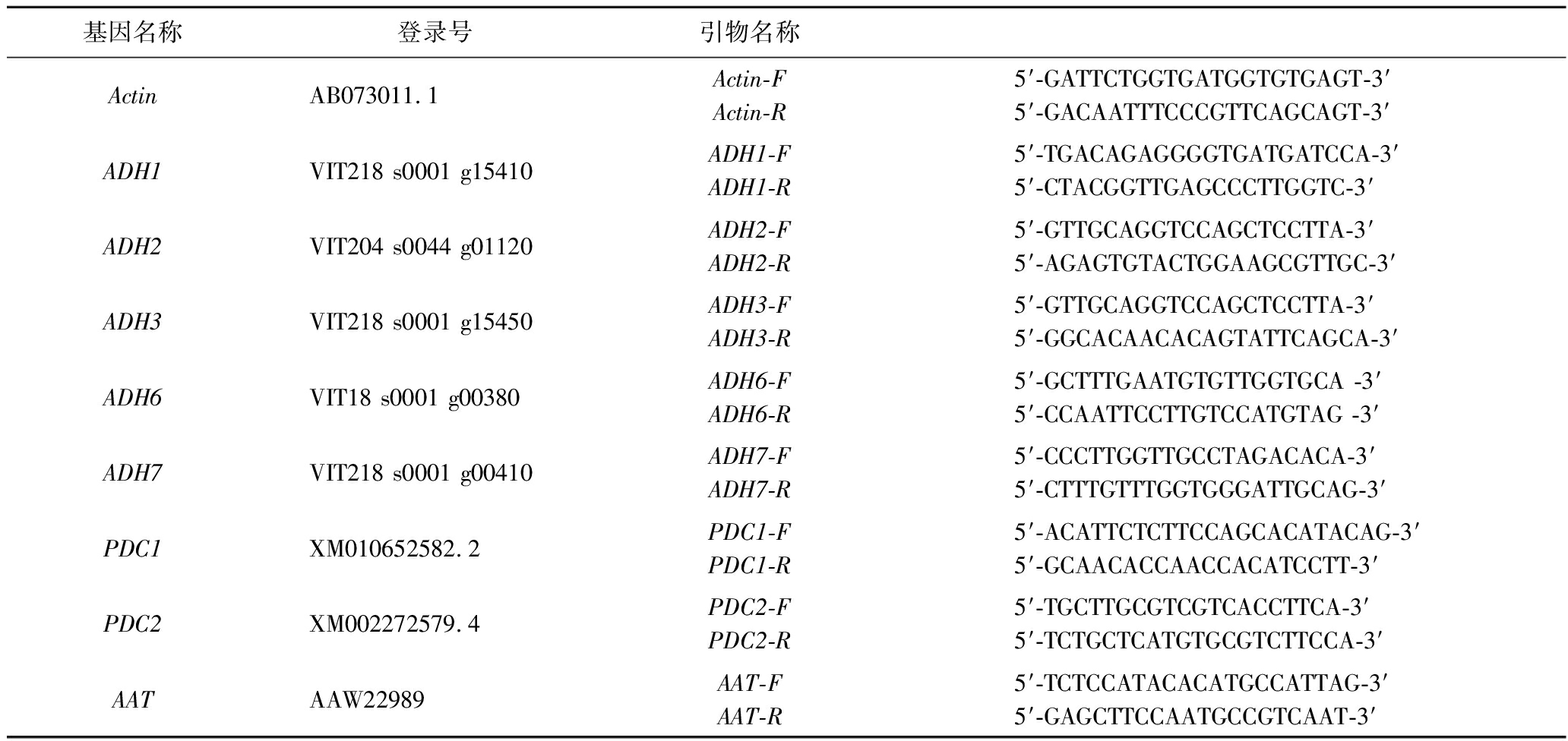
基因名称登录号引物名称ActinAB073011.1Actin-FActin-R5′-GATTCTGGTGATGGTGTGAGT-3′5′-GACAATTTCCCGTTCAGCAGT-3′ADH1VIT218 s0001 g15410ADH1-FADH1-R5′-TGACAGAGGGGTGATGATCCA-3′5′-CTACGGTTGAGCCCTTGGTC-3′ ADH2VIT204 s0044 g01120ADH2-FADH2-R5′-GTTGCAGGTCCAGCTCCTTA-3′5′-AGAGTGTACTGGAAGCGTTGC-3′ADH3VIT218 s0001 g15450ADH3-FADH3-R5′-GTTGCAGGTCCAGCTCCTTA-3′5′-GGCACAACACAGTATTCAGCA-3′ADH6VIT18 s0001 g00380ADH6-FADH6-R5′-GCTTTGAATGTGTTGGTGCA -3′5′-CCAATTCCTTGTCCATGTAG -3′ADH7VIT218 s0001 g00410ADH7-FADH7-R5′-CCCTTGGTTGCCTAGACACA-3′5′-CTTTGTTTGGTGGGATTGCAG-3′PDC1XM010652582.2PDC1-FPDC1-R5′-ACATTCTCTTCCAGCACATACAG-3′5′-GCAACACCAACCACATCCTT-3′PDC2XM002272579.4PDC2-FPDC2-R5′-TGCTTGCGTCGTCACCTTCA-3′5′-TCTGCTCATGTGCGTCTTCCA-3′AATAAW22989AAT-FAAT-R5′-TCTCCATACACATGCCATTAG-3′5′-GAGCTTCCAATGCCGTCAAT-3′
1.4 数据处理
试验过程完全是随机进行的。每个处理由3个重复组成,结果表示为平均值±标准误差。使用GraphPad Prism 8.0.2软件作图,SPSS 20.0和LSD测试进行统计分析。结果图中*表示差异显著(P<0.05)。
2 结果与分析
2.1 SO2处理对葡萄采后SO2残留的影响
SO2残留通常以亚硫酸盐的形式存在,美国食品药品监督管理局规定果蔬中SO2残留量不得超过10 mg/kg。由图1可知,整个贮藏期间,SO2残留量呈下降趋势,且低于国家食品添加剂的限量标准。贮藏至44 d时,SO2残留量为4.5 mg/kg,未达到限量标准,表明1 000 μL/L SO2处理葡萄果实较为合适。

图1 SO2处理对葡萄采后SO2残留的影响
Fig.1 Effect of SO2 treatment on residual SO2 in postharvest grapes
2.2 SO2处理对葡萄采后酯类香气物质的影响
如图2所示,随着贮藏时间的延长,对照与SO2处理组果实中的总酯类物质的含量呈不断上升趋势。贮藏9 d后,SO2处理组中总酯类物质的含量显著高于对照组(P<0.05)。直到贮藏结束,SO2处理组总酯类物质比对照提高了30.83%。
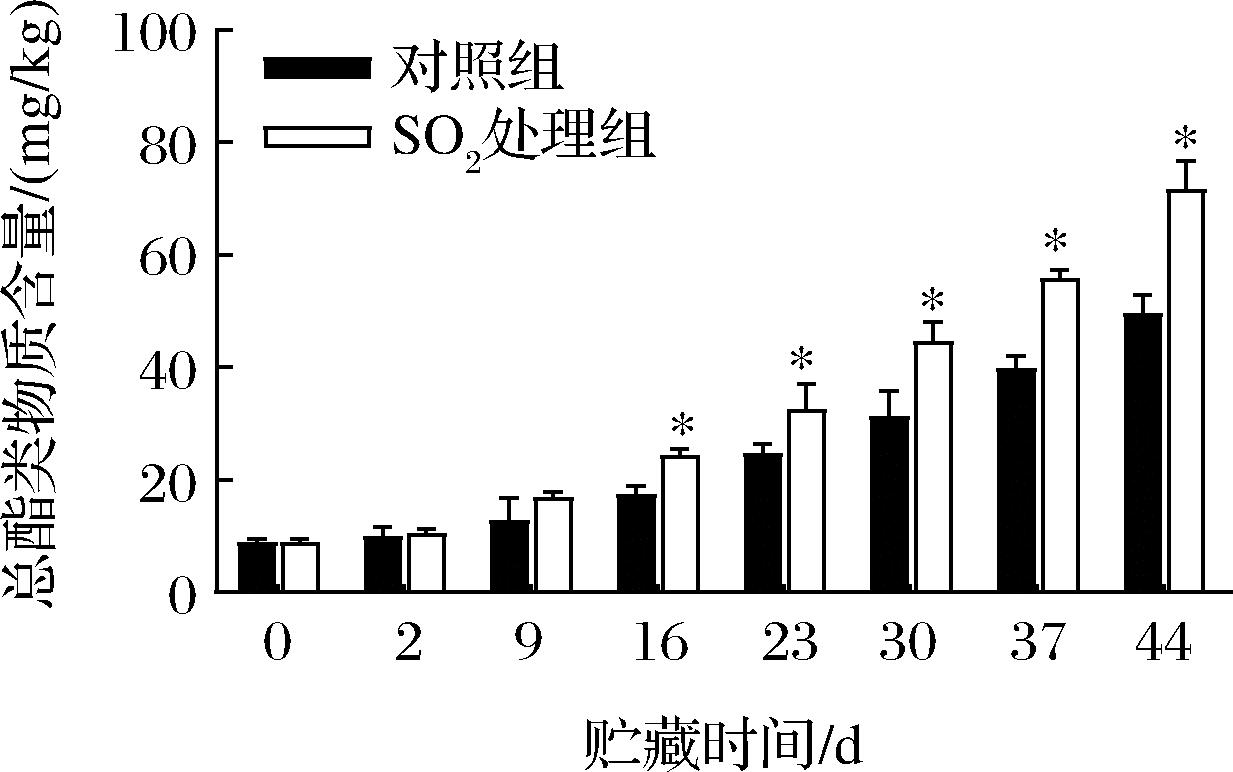
图2 SO2处理对葡萄采后总酯类物质含量的影响
Fig.2 Effect of SO2 treatment on the content of total esters substance in postharvest grapes
由图3可知,贮藏第0天,在木纳格果实中共检测出5种酯类物质。44 d时,对照与SO2处理组检测到了7种酯类物质,表明SO2处理加快了2-甲基丁酸甲酯和γ-十一内酯合成。与对照相比,SO2处理提高了2-甲基丁酸甲酯的含量。贮藏第16 d时,对照与SO2处理组均检测出γ-十一内酯,且SO2显著提高了γ-十一内酯含量(P<0.05)。贮藏37 d后,SO2处理γ-十一内酯含量比对照组高25.45%和19.27%。

图3 SO2处理对葡萄采后酯类物质含量的影响
Fig.3 Effect of SO2 treatment on the content of esters substance in postharvest grapes
注:香气物质含量以mg/kg表示。
丁酸乙酯是葡萄果实中最丰富的酯类物质(图3)。从第9天开始,SO2处理显著提高了丁酸乙酯的含量(P<0.05)。贮藏结束时,SO2处理组丁酸乙酯的含量与对照相比提高了15.58%。
SO2处理果实中苯甲酸乙酯和γ-癸内酯均在贮藏后期显著高于对照组(P<0.05)。第30 天时,SO2处理果实中苯甲酸乙酯、γ-癸内酯含量分别比对照组提高了34.31%和59.34%(图3)。贮藏44 d时,SO2处理组己酸乙酯、3-羟基丁酸乙酯、2-甲基丁酸甲酯含量分别比对照高64.04%、24.98%和57.08%。
2.3 SO2处理对葡萄采后丙酮酸、乙醛和乙醇含量的影响
对照与SO2处理组丙酮酸含量在前16 d均呈上升趋势,随后不断下降(图4-A)。与对照组相比,SO2处理显著提高了16~37 d丙酮酸含量(P<0.05)。第16天时,对照与SO2处理组丙酮酸含量均达到最大值。此时,SO2处理组比对照提高了16.55%。
贮藏期间,对照和SO2处理组果实乙醛含量的变化趋势一致(图4-B),但SO2处理组中的乙醛含量显著高于对照组(P<0.05)。直到贮藏结束,SO2处理组果实中乙醛含量比对照提高了61.38%。
果实中乙醇含量随着贮藏时间的延长不断下降(图4-C)。除2 d外,SO2处理显著提高了乙醇的含量(P<0.05)。贮藏前16 d,对照组中乙醇的含量极速下降,而同期SO2处理组延缓了其含量的下降速率。第44天时,SO2处理组果实中乙醇含量比对照组提高了36.39%。
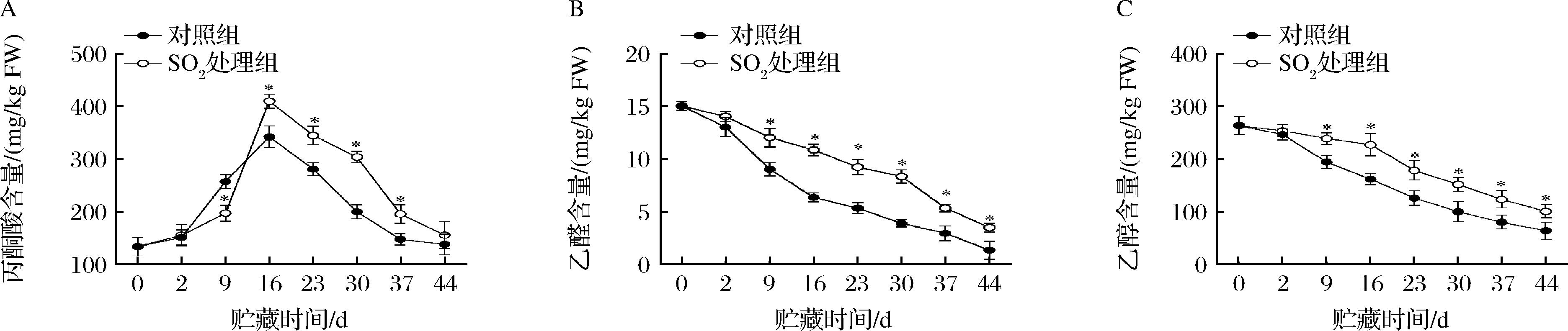
A-丙酮酸;B-乙醛;C-乙醇
图4 SO2处理对葡萄采后丙酮酸、乙醛和乙醇含量的影响
Fig.4 Effects of SO2 treatment on the contents of pyruvic acid,acetaldehyde,and ethanol in postharvest grapes
2.4 SO2处理对葡萄采后PDC、ADH和AAT活性的影响
2组果实中的PDC活性整体呈下降趋势(图5-A)。从第9天开始,SO2处理果实中PDC活性显著高于对照组(P<0.05)。贮藏至44 d时,SO2处理果实中PDC活性为初始值的53.27%,仅是对照的71.40%。表明SO2处理有效提高了贮藏期间PDC的活性。
随着贮藏时间的延长,对照与SO2处理组果实中ADH活性不断下降(图5-B)。贮藏前9 d,对照与SO2处理组果实中ADH活性无显著差异。此后,SO2处理组显著提高了ADH活性(P<0.05)。贮藏结束时,SO2处理果实中ADH活性比对照提高了67.87%。
AAT活性的变化模式与ADH相反,AAT活性逐渐增加(图5-C)。除2 d和9 d外,SO2处理组显著提高果实中AAT的活性(P<0.05),且在44 d时达到峰值。此时,SO2处理组果实AAT活性比对照高19.64%。

A-丙酮酸脱羧酶;B-乙醇脱氢酶;C-醇酰基转移酶
图5 SO2处理对葡萄采后丙酮酸脱羧酶、乙醇脱氢酶和醇酰基转移酶活性的影响
Fig.5 Effects of SO2 treatment on activities of pyruvate decarboxylase,alcohol dehydrogenase,and alcohol acyltransferase in postharvest grapes
2.5 SO2处理对葡萄采后乙醇代谢及AAT相关基因表达量的影响
果实中VvPDC1呈先上升后下降趋势(图6-A)。对照与SO2处理组VvPDC1的表达峰值有所差别。对照果实中VvPDC1表达峰值出现在23 d,而SO2处理不仅显著诱导了VvPDC1的表达(P<0.05),且延缓了峰值的出现。贮藏期间,果实VvPDC2相对表达量不断下降(图6-B)。在前30 d,对照组中VvPDC2表达量是SO2处理的1.25倍、1.12倍、1.22倍、1.95倍和1.44倍,并存在显著差异(P<0.05)。
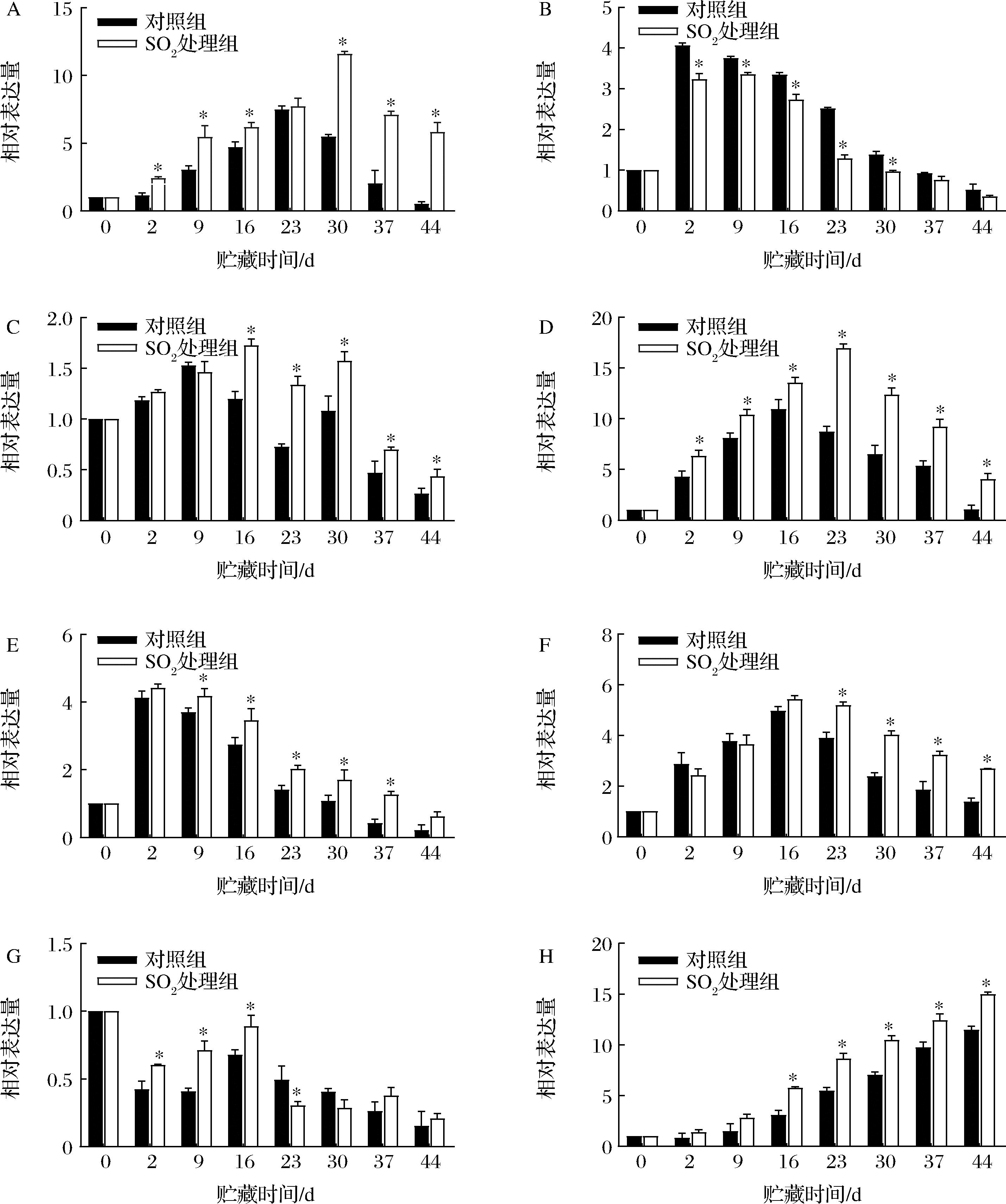
A-VvPDC1;B-VvPDC2;C-VvADH1;D-VvADH2;E-VvADH3;F-VvADH6;G-VvADH7;H-VvAAT
图6 SO2处理对葡萄采后乙醇代谢及AAT相关基因表达量的影响
Fig.6 Effects of SO2 treatment on alcohol metabolism and AAT related gene expression in postharvest grapes
VvADHs在果实中的表达模式有所不同。虽对照与SO2处理组果实中VvADH1的表达在贮藏前9 d无显著差异(图6-C),但SO2处理组从16 d开始被上调,并在16 d达到峰值。此时,SO2处理组VvADH1表达量是对照组的1.45倍。2组间果实中VvADH2的表达呈先上升后下降(图6-D)。整个贮藏期间,SO2处理组显著提高了VvADH2表达水平(P<0.05)。SO2处理组VvADH2表达峰值是对照16 d最大值的1.55倍。对照与SO2处理组VvADH3的表达呈不断下降(图6-E)。除2 d和44 d外,SO2处理诱导了VvADH3的表达。对照与SO2处理组同在第2天出现表达峰值。此时,SO2处理组是对照的1.07倍。SO2处理组VvADH6的表达量从16 d开始上升,并达到峰值(图6-F)。SO2处理显著诱导了贮藏后期VvADH6表达量(P<0.05)。至44 d时,SO2处理组是对照的1.94倍。而SO2处理显著上调了贮藏前16 d VvADH7的表达水平(图6-G)。对照与SO2处理VvADH7的表达量均在16 d达到峰值。此时,SO2处理组VvADH7表达量是对照的1.31倍。
整个贮藏期间,对照与SO2处理组VvAAT表达水平随着贮藏时间的延长不断上升(图6-H)。贮藏16 d后,SO2处理显著增强了VvAAT表达(P<0.05)。直到贮藏结束,SO2处理组VvAAT表达水平是对照的1.31倍。
3 讨论
鉴于香气是影响消费者偏好的重要因素,本研究分析了SO2处理对酯类香气物质的影响。1-MCP处理提高了酯、醛、醇的含量,增加了香气种类,从而有利于果实的香气[14]。本研究中,SO2处理促进了酯类物质含量,赋予了果实果香和花香[15]。贮藏前期在木纳格果实中共检测出5种酯类物质。有趣的是,贮藏末期出现了7种,其中4种是乙酯类,占总酯类香气物质的57.14%。有研究表明,乙酯的形成速率与乙醇的积累有关[16]。同时,乙醇和乙酰酯之间良好的相关性在苹果中也得到了证实[17]。因此,推测丁酸乙酯、己酸乙酯、3-羟基丁酸乙酯、苯甲酸乙酯可能是乙醇的酯化产物。乙醇的生成主要是通过乙醇代谢途径[18]。因此,需进一步明确SO2处理对葡萄采后乙醇代谢的影响。
丙酮酸作为糖酵解的最终产物,也能够参与乙醇代谢和三羧酸循环[3]。丙酮酸水平的升高与乙醛和乙醇积累存在联系[16]。SO2处理提高了葡萄果实中丙酮酸的含量。由于糖酵解的激活或是乙醇代谢的抑制,导致葡萄中丙酮酸含量在贮藏前期积累。而丙酮酸后期迅速降低,可能是它作为底物被不断消耗并转化为乙醇。这在冬枣果实中也得到了类似的结果[19]。PDC、ADH作为乙醇代谢的关键酶,其活性的增强促进了果实中乙醛、乙醇浓度的增加[3]。SO2处理提高了PDC和ADH活性,并促进了乙醛和乙醇的含量。CmPDC1不仅参与了乙醛的合成,且CmPDC1可能对果实香气的形成也有所贡献[20]。SO2处理差异诱导了VvPDCs的表达。SO2处理上调了VvPDC1的表达,下调了VvPDC2的表达水平。值得注意的是,VvPDCs表达水平与PDC活性变化趋势有所不同,造成上述结果的原因可能是由于蛋白质合成与基因表达之间发生不同的转换。此外,可能还存在基因表达的反馈调节机制,反过来影响细胞中PDC蛋白数量[21]。减压包装处理诱导了MrADH1和MrADH3表达,导致杨梅果实中乙醛和乙醇含量的增加[22]。在本研究中,SO2处理上调了VvADH1、VvADH2、VvADH3、VvADH6和VvADH7的表达。其中,VvADH3和ADH活性存在明显的对应关系,并与乙醇含量的变化趋势相同。因此,说明VvADH3的翻译后修饰可能在调节ADH活性和乙醇含量的积累发挥着重要作用。
乙醇不仅是香气的直接来源,其后续参与酯化反应也可能更为重要。乙醇经AAT催化生成乙酯[23]。褪黑素处理提高AAT活性,增强了乙酸丙酯和乙酸己酯的含量[23]。同时,酯的增加与VvAAT的表达呈正相关[24]。本试验中,SO2处理提高了AAT活性,诱导了VvAAT表达的上调,从而加速了香气的积累。贮藏末期,酯化产物的快速合成可能是由于SO2处理通过激活乙醇代谢加速了乙酯的合成。
综上所述,贮藏过程中,乙醇代谢对木纳格葡萄采后香气的合成具有重要贡献。SO2通过提高乙醇代谢中丙酮酸、乙醛和乙醇的含量,提高ADH、PDC和AAT的活性,诱导VvPDC1、VvADH1、VvADH2、VvADH3、VvADH6、VvADH7和VvAAT的上调表达,从而加速了果实采后的酯类香气物质的合成,可为深入解析SO2在葡萄采后生物学调控机制的研究提供科学依据。
[1] MAYUONI-KIRSHINBAUM L,DAUS A,PORAT R.Changes in sensory quality and aroma volatile composition during prolonged storage of ‘Wonderful’ pomegranate fruit[J].International Journal of Food Science Technology,2013,48(8):1569-1578.
[2] 陈敬鑫,张德梅,李永新,等.低氧贮藏对采后果实风味的影响研究进展[J].食品科学,2021,42(13):273-280.
CHEN J X,ZHANG D M,LI Y X,et al.Progress toward understanding the effect of low-oxygen storage on the flavor of postharvest fruits[J].Food Science,2021,42(13):273-280.
[3] LI D,LI L,XU Y Q,et al.Exogenous ATP attenuated fermentative metabolism in postharvest strawberry fruit under elevated CO2 atmosphere by maintaining energy status[J].Postharvest Biology and Technology,2021,182:111701.
[4] WEI S W,QIN G H,ZHANG H P,et al.Calcium treatments promote the aroma volatiles emission of pear (Pyrus ussuriensis ‘Nanguoli’) fruit during post-harvest ripening process[J].Scientia Horticulturae,2017,215:102-111.
[5] JI Y R,HU W Z,JIANG A L,et al.Effect of ethanol treatment on the quality and volatiles production of blueberries after harvest[J].Journal of the Science of Food and Agriculture 2019,99(14):6296-6306.
[6] 阮仙睿.UV减弱处理对赤霞珠葡萄果实发育过程中脂肪酸组分及特征香气的影响[D].杨凌:西北农林科技大学,2016.
RUAN X R.The effect of UV radiation reduction on fatty acids components and volatile compounds in Cabernet Sauvignon grapes during ripening[D].Yangling:Northwest A &F University,2016.
[7] 颜廷才,邵丹,李江阔,等.1-MCP对葡萄货架期间品质及挥发性物质的影响[J].食品科学 2015,36(20):258-263.
YAN T C,SHAO D,LI J K,et al.Effects of 1-MCP on quality and volatile components of grapes during shelf life[J].Food Science,2015,36(20):258-263.
[8] 校诺娅.水分胁迫对‘玫瑰香’葡萄果实挥发性化合物及相关基因表达的影响[D].银川:宁夏大学,2020.
XIAO N Y.Effect of water stress on volatile compounds and expression of related genes fruiting branches in Muscat Hamburg grape[D].Yinchuan:Ningxia University,2020.
[9] XUE M Z,YI H L.Induction of disease resistance providing new insight into sulfur dioxide preservation in Vitis vinifera L.[J].Scientia Horticulturae,2017,225:567-573.
[10] ZHANG Z,WEI J,WANG M,et al.Induced sulfur metabolism by sulfur dioxide maintains postharvest quality of 'Thompson Seedless′ grape through increasing sulfite content[J].Journal of the Science of Food and Agriculture,2022,102(3):1174-1184.
[11] ZHANG Z,WU Z H,YUAN Y Y,et al.Sulfur dioxide mitigates oxidative damage by modulating hydrogen peroxide homeostasis in postharvest table grapes[J].Postharvest Biology and Technology,2022,188:111877.
[12] FENG M X,JIN X Q,YAO H,et al.Evolution of volatile profile and aroma potential of ‘Gold Finger’ table grapes during berry ripening[J].Journal of the Science of Food and Agriculture,2022,102(1):291-298.
[13] SHI F,ZHOU X,ZHOU Q,et al.Membrane lipid metabolism changes and aroma ester loss in low-temperature stored ‘Nanguo’ pears[J].Food Chemistry,2018,245:446-453.
[14] 张鹏,邵丹,李江阔,等.1-MCP对硬肉型葡萄货架期间品质及挥发性物质的影响[J].中国食品学报,2018,18(4):219-227.
ZHANG P,SHAO D,LI J K,et al.Effects of 1-MCP on quality and volatile components of hard meat-type grapes during shelf life[J].Journal of Chinese Institute of Food Science and Technology.2018,18(4):219-227.
[15] LU H Y,LUO Z S,LI D,et al.FaMYB11 promotes the accumulation of volatile esters by regulating FaLOX5 during strawberry (Fragaria×ananassa) ripening[J].Postharvest Biology and Technology,2021,178:111560.
[16] UMMARAT N,ARPAIA M L,OBENLAND D.Physiological,biochemical and sensory characterization of the response to waxing and storage of two mandarin varieties differing in postharvest ethanol accumulation[J].Postharvest Biology and Technology,2015,109:82-96.
[17] ORTIZ A,GRAELL J,LARA I.Preharvest calcium sprays improve volatile emission at commercial harvest of ‘Fuji Kiku-8’ apples[J].Journal of Agricultural and Food Chemistry,2011,59(1):335-341.
[18] SHI J X,GOLDSCHMIDT E E,GOREN R,et al.Molecular,biochemical and anatomical factors governing ethanol fermentation metabolism and accumulation of off-flavors in mandarins and grapefruit[J].Postharvest Biology and Technology,2007,46(3):242-251.
[19] SUN L H,LIU M C,ZHU S H,et al.Effect of nitric oxide on alcoholic fermentation and qualities of chinese winter jujube during storage[J].Agricultural Sciences in China,2007,6(7):849-856.
[20] WANG M M,ZHANG L,BOO K H,et al.PDC1,a pyruvate/alpha-ketoacid decarboxylase,is involved in acetaldehyde,propanal and pentanal biosynthesis in melon (Cucumis melo L.) fruit[J].Plant,2019,98(1):112-125.
[21] CIRILLI M,BELLINCONTRO A,DE SANTIS D,et al.Temperature and water loss affect ADH activity and gene expression in grape berry during postharvest dehydration[J].Food Chemistry,2012,132(1):447-454.
[22] 黄小榕,薛蕾,张泽煌,等.PDC和ADH基因家族成员在杨梅果实成熟和包装处理期间的表达及其与乙醛和乙醇积累的关系[J].果树学报,2022,39(10):1 784-1 797.
HUANG X R,XUE L,ZHANG Z H,et al.Expression analysis of PDC and ADH gene family members and their re-lationship with the accumulation of acetaldehyde and ethanol during fruit ripening and packaging treatments of Chinese bayberry[J].Journal of Fruit Trees,2022,39(10):1784-1797.
[23] LIU J L,LIU H T,WU T,et al.Effects of melatonin treatment of postharvest pear fruit on aromatic volatile biosynthesis[J].Molecules,2019,24(23):4233.
[24] JI X H,WANG B L,WANG X D,et al.Effects of different color paper bags on aroma development of ‘Kyoho’ grape berries[J].Journal of Integrative Agriculture,2019,18(1):70-82.