阿魏酸(ferulic acid,FA),能够抗氧化和抗自由基活性,是较多物质的前体物质。其中阿魏酸钠作为药物或制剂的辅料组成,通常被用来治疗心脑血管,具有抗炎、护肝等功效。而阿魏酸在中草药及天然食品中含量更高,在不转化为其他物质时,阿魏酸是否具有其他的生理学功效同样值得深入研究。阿魏酸用途广泛,是传统发酵食品如白酒、醋中的典型风味物质[1]。尽管阿魏酸得到了广泛的应用,但其对细胞生理活性的影响及分子机理目前尚不十分明确。
CT-26细胞系培养条件简单,无需特殊培养基,且具有造模成瘤快的特点[2]。利用CT-26细胞系构建BALB/c小鼠直肠癌模型已经成为一种通用的小鼠模型[3]。目前,CT-26细胞系已经被应用到新药开发、细胞代谢通路研究、毒理学[4]和免疫应答[5]等研究中。因此,该细胞系也被用来考察生物活性物质对细胞生理活性影响和生物活性物质筛选的一种手段。
细胞凋亡(apoptosis)是细胞自主的死亡,在多数疾病中发挥作用,针对细胞凋亡能够改善疾病的发生[6-7]。同样,细胞自噬也是维持细胞稳态所必需的,它对于肿瘤等疾病的病理生理过程具有一定的调控作用[8-9]。细胞凋亡和细胞自噬是2种显著不同的细胞形式,两者紧密结合,密切相关[10-14]。两者的动态平衡对细胞的生理活性至关重要。细胞自噬能够将受损的细胞内物质转化为细胞所需的营养;此外,自噬能够调控细胞凋亡,当自噬使细胞内蛋白和细胞器过量消耗,致使细胞无法继续生存时,即影响细胞的死亡[15-17]。因此,深入研究阿魏酸对细胞凋亡和细胞自噬的影响有利于明晰其对细胞生理的作用机制。
基于此,本研究利用不同浓度阿魏酸处理CT-26细胞系,考察阿魏酸对细胞生理活性影响的分子机理,在分子生物学角度揭示阿魏酸的生物活性物质作用。
1 材料与方法
1.1 材料与试剂
CT-26.WT(ATCC CRL-2638)、RPMI-1640培养基,普诺赛公司;阿魏酸,99%,阿拉丁公司; BCAkit,索莱宝公司;胎牛血清、胰蛋白酶、青链霉素,Hyclone公司;cck8,日本同仁公司;一抗LC3,PM036,P62,PM045,MBL公司; Bcl-2(15071S)、Bax(2772S)、GAPDH(5174S)、二抗(anti-rabbit,7074S;anti-Mouse,7076S),美国CST公司;caspase 3(19677-1-AP,一抗),三鹰生物公司。
1.2 仪器与设备
Mini-PROTEAN Tetra,Bio-Rad公司;SpectraMax® iD3,Molecular Devices公司;ChemiScope 6000 Exp,中国勤翔公司;7500 Fast/7500(qRT-PCR)系统,Thermo Fisher公司。
1.3 实验方法
1.3.1 细胞培养
CT-26细胞培养于RPMI-1640培养液中,添加胎牛血清和青链霉素,正常培养。当细胞生长至80%~90%左右融合度时,胰蛋白酶传代处理。
1.3.2 细胞存活率实验
接种CT-26细胞,每孔2.0×104,96孔板,24 h后细胞贴壁,用阿魏酸分别处理24 h和48 h。使用CCK-8检测细胞[18]。细胞存活率的计算如公式(1)所示:
细胞存活率![]()
(1)
式中:A处理组为不同萜烯类化合物测定的吸光度;A对照组为正常培养基测定的吸光度。
1.3.3 细胞划痕实验
CT-26细胞提前铺板,正常生长后将移液枪头垂直于孔板进行平稳竖直划线,弃旧培养液,用PBS清洗2次。空白组加入无血清培养液,实验组加入无血清培养液配制的不同浓度阿魏酸,置于培养箱培养。在显微镜下观察大约同一位置,不同时间点(0、12、24、48 h)的状态,并拍照计算[19],细胞迁移率的计算如公式(2)所示:
细胞迁移率/%=
(2)
1.3.4 Western blotting试验
将CT-26细胞按照1.6×105/孔放置6孔板中,阿魏酸处理24 h后,用蛋白质裂解液裂解CT-26细胞,添加裂解液后放置在冰箱在4 ℃中10 min,并离心15 min,以10 000×g。对总蛋白质浓度定量。加5× sample buffer制样。样品在98 ℃下加热10 min,然后以12 000×g离心。将10 μL上清液加到10% SDS-PAGE凝胶上。电泳约1 h,观察溴酚蓝位置,停止电泳,通过湿转法将蛋白质转至膜上,转膜条件为120 V、60 min,并用封闭缓冲液室温封闭1 h,添加不同一抗4 ℃孵育过夜。过夜后用TBST洗膜3次5 min,对应二抗孵育1 h后,继续洗膜,显色后定量分析。
1.3.5 数据分析
用SPSS 23.0软件对数据进行多组间方差分析和T检验,所有实验数据均为3个平行试验的平均值。用平均值±标准误(standard error,SE)表示;图表由Origin 2018绘制;半定量分析和比较由ImageJ软件进行。
2 结果与分析
2.1 阿魏酸对细胞存活率的影响
本研究首先考察了阿魏酸浓度对细胞活力的影响,用以筛选处理细胞的最适阿魏酸浓度,研究结果见图1。研究结果表明,与对照组比较,在使用阿魏酸处理CT-26细胞24 h和48 h[20]后,各组细胞的活力均受到显著抑制,且抑制率呈显出浓度和时间依赖性,阿魏酸处理浓度越大,细胞存活率越低;处理时间越长,细胞存活率越低。但在阿魏酸处理浓度为100 μmol/L时,处理时间为24 h与48 h,反而会在一定程度上促进CT-26细胞的增殖;同时,在阿魏酸处理浓度为800 μmol/L时,处理时间(24 h或48 h)对CT-26细胞存活率没有明显区别。采用SPSS 23.0软件分析的结果表明,阿魏酸作用24和48 h的IC50均在800 μmol/L以上,阿魏酸浓度为0~400 μmol/L时,对细胞增殖没有明显影响。因此,后续研究中选用阿魏酸浓度为0~400 μmol/L,处理时间为24 h作为细胞的处理条件。

图1 不同浓度阿魏酸对细胞活力的影响
Fig.1 The effect of FA on the viability of CT-26 cells
2.2 阿魏酸对细胞迁移能力的影响
迁移能力也是癌症细胞活力的重要指标,抑制癌症细胞的迁移能力能够一定程度地缓解癌症进程[21]。然而,阿魏酸是否会对癌症细胞的迁移能力产生影响尚不清楚。本研究采用细胞划痕实验对阿魏酸对癌症细胞迁移能力进行了初步研究。细胞划痕实验结果表明(图2),与对照组相比较,不同浓度的阿魏酸可显著抑制CT-26细胞的迁移,降低了结肠癌细胞CT-26的迁移能力;而且,随着药物浓度增加,作用时间延长,细胞迁移速率降低越显著(P<0.05)。该结果与阿魏酸对细胞存活率的影响基本一致。同时,该结果提示细胞存活率与细胞迁移速率呈正相关。
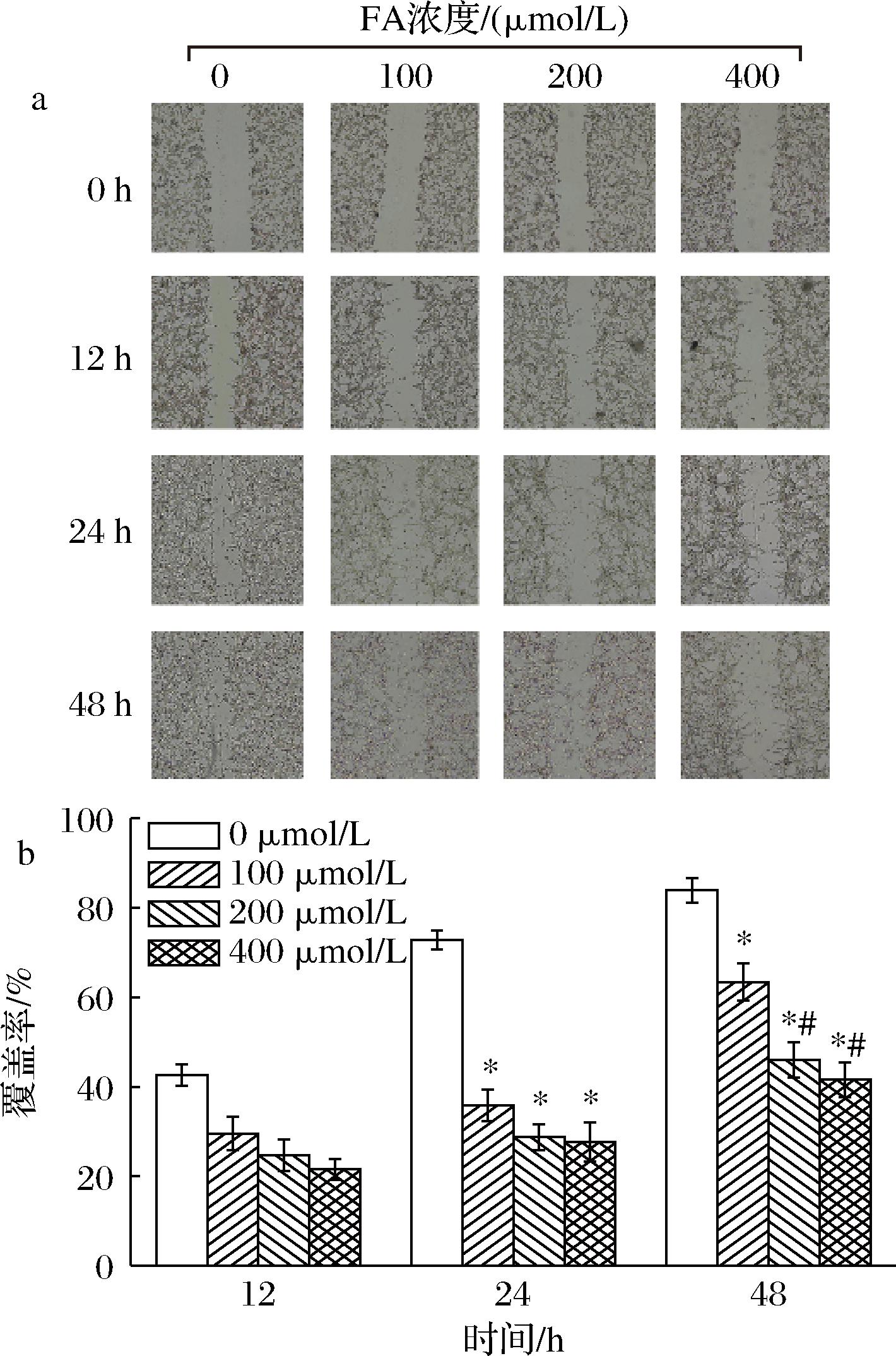
a-划痕实验结果;b-划痕实验半定量结果
图2 不同浓度阿魏酸对细胞迁移能力(划痕实验)影响结果分析
Fig.2 Analysis of the effect of FA on CT-26 cells by Wound-Healing test
注:与阿魏酸无处理组相比,“*”表示差异显著(P<0.05),与阿魏酸100 μmol/L处理组相比,“#”表示差异显著(P<0.05)。
2.3 阿魏酸对细胞凋亡关键信号通路Bcl-2/Bax的影响
细胞凋亡是由自我控制的细胞死亡,对肿瘤的抑制有积极作用。其中Bcl-2/Bax通路是影响细胞凋亡的关键通路之一[22-23]。研究中使用磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,使用不同浓度(0~400 μmol/L)阿魏酸处理来考察阿魏酸对细胞凋亡的影响。研究结果见图3。图3中的结果显示,与0 μmol/L处理组相比较,在GAPDH(内参)表达量基本一致的情况下,随着阿魏酸处理浓度的增加,抑制凋亡的关键蛋白Bcl-2的表达量呈现逐渐降低的趋势,而促凋亡关键蛋白Bax的表达量则逐渐增加。虽然在100 μmol/L处理后,抑制凋亡关键蛋白Bcl-2相比200 μmol/L处理组其灰度值反而有一定程度的减少,但并不影响随阿魏酸浓度增加Bcl-2蛋白表达量降低的整体趋势。同时,半定量结果也表明,阿魏酸可能是通过调控Bcl-2/Bax途径对细胞凋亡进行调控的,阿魏酸能够在一定程度上促进细胞凋亡并导致细胞存活率下降。
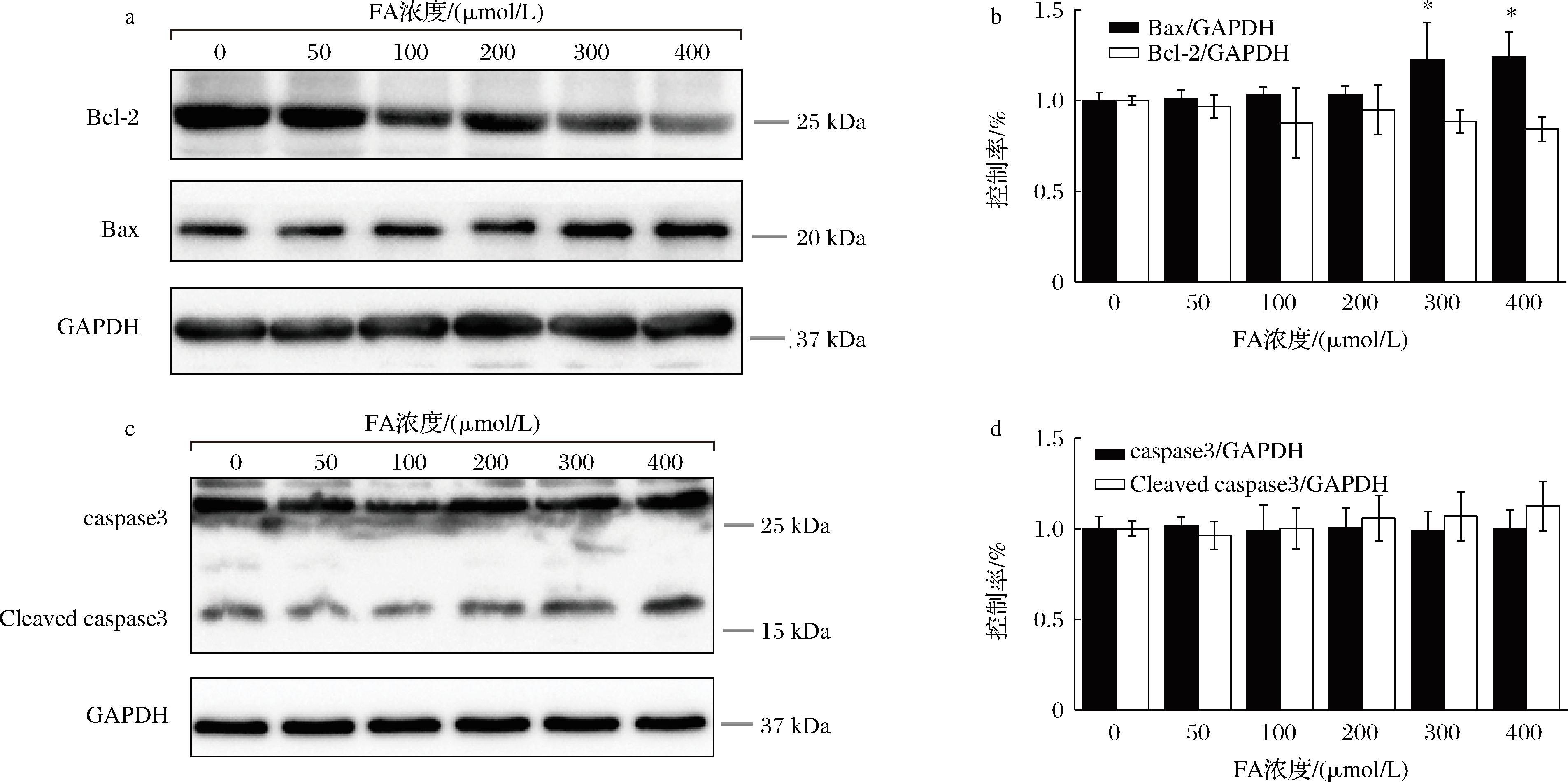
a-凋亡关键通路蛋白Bcl-2、Bax免疫印迹结果;b-凋亡关键通路蛋白Bcl-2、Bax灰度值分析;c-凋亡关键通路蛋白caspase3免疫印迹结果;d-凋亡关键通路蛋白caspase3灰度值分析
图3 不同浓度阿魏酸处理结肠癌CT-26细胞对细胞凋亡关键蛋白的影响
Fig.3 The effect of FA on key proteins of apoptosis in CT-26 cells
注:与阿魏酸无处理组相比,“*”表示差异显著(P<0.05)(下同)。
半胱氨酸蛋白酶(caspases)属于半胱氨酸蛋白酶家族,它是细胞凋亡的关键[24]。本研究对凋亡通路上游的Cleaved caspase3和caspase3的蛋白表达情况也进行了考察。研究结果表明(图3-c、图3-d,半定量分析),在GAPDH(内参)表达量没有受到影响的情况下,随着阿魏酸处理浓度的增加,caspase3被切割为Cleaved caspase3蛋白的量也在增加,从而进一步导致更多的Cleaved caspase3蛋白聚集和表达。该研究结果提示,阿魏酸在一定程度上通过caspase3通路对细胞凋亡进行调控。
2.4 阿魏酸对细胞自噬调控关键蛋白的影响
LC3和P62是调控细胞自噬的关键蛋白[25]。研究中以GAPDH为内参,通过阿魏酸处理,考察其对结肠癌CT-26细胞中LC3和P62蛋白的表达影响。如图4-a所示,内参GAPDH的表达量一致,LC3Ⅱ的表达量随着阿魏酸处理浓度的增加而增加,400 μmol/L阿魏酸处理组LC3II表达量最高;同时,P62的表达水平则随随着阿魏酸处理浓度的增加具有略微下降的趋势。半定量分析结果(图4-b)提示,低浓度的阿魏酸(<100 μmol/L)对CT-26细胞细胞自噬没有造成显著影响;而较高浓度的阿魏酸能够促进细胞自噬。

a-自噬关键蛋白免疫印迹结果;b-自噬关键蛋白灰度值分析
图4 不同浓度阿魏酸对结肠癌CT-26细胞细胞自噬关键蛋白的影响
Fig.4 The effect of FA on key proteins of autophagy in CT-26 cells
3 结论与讨论
为探究在传统发酵食品及中草药中含量更多的阿魏酸具体作用,以阿魏酸为研究对象,通过不同浓度的阿魏酸对CT-26细胞进行处理,考察在不同浓度处理条件下,阿魏酸对CT-26细胞的增殖情况和迁移能力等细胞生理活性的影响。研究表明,在同一处理浓度下,细胞存活率随时间的延长而减少,但这种减少不是无限制的,在高浓度阿魏酸处理48 h和24 h时,其细胞存活率基本一致。而当处理时间相同时,随着阿魏酸处理浓度增大,细胞存活率逐渐降低。虽然本研究在使用100 μmol/L阿魏酸处理时,结果提示阿魏酸在一定程度上对CT-26细胞的增殖有一定促进作用(图1),但并不影响随着阿魏酸浓度增加,细胞存活率降低的趋势。同时阿魏酸对CT-26细胞的迁移能力影响的研究结果表明,阿魏酸对细胞迁移能力具有抑制作用。
细胞凋亡在生物体中的作用主要是维持稳定,生物体主要依靠凋亡作用对癌细胞进行清除,一旦这种凋亡作用紊乱将导致细胞异常增殖[26]。凋亡通路上游主要受到caspase家族的调控,在细胞凋亡出现后,caspase3蛋白被激活,同时被切割并活化促进Cleaved caspase3发挥生物学作用。本研究结果表明,随着阿魏酸处理浓度的增加,造成了Cleaved caspase3蛋白积累增加,达到调控细胞凋亡的目的。
研究表明,细胞自噬和细胞凋亡通路相互关联,互为调控。细胞自噬能够抑制细胞凋亡,进行细胞的正常生命活动;二者会相互调控,相互作用[27-28]。细胞自噬也是维持生命稳态的重要生命活动,而控制细胞自噬的主要标志蛋白为LC3和P62。当细胞自噬流增大的时候,LC3Ⅱ蛋白增多,而P62蛋白减少。本研究通过不同浓度阿魏酸对结肠癌细胞处理后发现,低浓度阿魏酸对细胞自噬没有明显影响,在高浓度条件下,能够一定程度上促进细胞自噬的发生。该结果提示,在低浓度阿魏酸条件下,CT-26细胞可能能够通过细胞自噬维持正常生理活动,甚至促进细胞的增殖,而在高浓度条件下,一旦超过临界点,细胞自噬与细胞凋亡进行协同作用,抑制细胞的存活,导致细胞程序性死亡。
综上所述,一定浓度的阿魏酸可能通过细胞自噬及细胞凋亡通路中关键信号蛋白的表达量抑制CT-26细胞的增殖和迁移,并导致CT-26细胞死亡。该结果表明,作为阿魏酸钠等功能成分的前体物质阿魏酸具有本身特色生物活性,能够对细胞生理产生一定的影响。后续将围绕中草药及食品中不同阿魏酸衍生物的具体含量及功能作用进行深入研究,明晰其具体协同关系及功能作用之间的强弱关系。
[1] ZHENG Y H,YOU X R,CHEN L,et al.Biotherapeutic nanoparticles of poly (ferulic acid) delivering doxorubicin for cancer therapy[J].Journal of Biomedical Nanotechnology,2019,15(8):1734-1743.
[2] PEARLSTEIN E,AMBROGIO C,KARPATKIN S.Effect of antiplatelet antibody on the development of pulmonary metastases following injection of CT26 colon adenocarcinoma,Lewis lung carcinoma,and B16 amelanotic melanoma tumor cells into mice[J].Cancer Research,1984,44(9):3884-3887.
[3] HUANG H Z,HUANG Y X,CHEN Y A,et al.A novel immunochemotherapy based on targeting of cyclooxygenase and induction of immunogenic cell death[J].Biomaterials,2021,270(3):120708.
[4] SHOKRZADEH M,AZADBAKHT M,AHANGAR N,et al.Cytotoxicity of hydro-alcoholic extracts of Cucurbita pepo and Solanum nigrum on HepG2 and CT26 cancer cell lines[J].Pharmacognosy Magazine,2010,6(23):176-179.
[5] LEE K W,CHOI B,KIM Y M,et al.Major histocompatibilty complex-restricted adaptive immune responses to CT26 colon cancer cell line in mixed allogeneic Chimera[J].Transplantation Proceedings,2017,49(5):1153-1159.
[6] KERR J F R,WYLLIE A H,CURRIE A R.Apoptosis:A basic biological phenomenon with wide-ranging implications in tissue kinetics[J].British Journal of Cancer,1972,26(4):239-257.
[7] FESIK S W.Promoting apoptosis as a strategy for cancer drug discovery[J].Nature Reviews Cancer,2005,5(11):876-885.
[8] MATHEW R,KARANTZA-WADSWORTH V,WHITE E.Role of autophagy in cancer[J].Nature Reviews Cancer,2007,7(12):961-967.
[9] YUE Z Y,JIN S K,YANG C,et al.Beclin 1,an autophagy gene essential for early embryonic development,is a haploinsufficient tumor suppressor[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(25):15077-15082.
[10] MAIURI M M C,ZALCKVAR E,KIMCHI A,et al.Self-eating and self-killing:Crosstalk between autophagy and apoptosis[J].Nature Reviews Molecular Cell Biology,2007,8(9):741-752.
[11] PATTINGRE S,TASSA A,QU X P,et al.Bcl-2 antiapoptotic proteins inhibit beclin 1-dependent autophagy[J].Cell,2005,122(6):927-939.
[12] LUM J J,BAUER D E,KONG M,et al.Growth factor regulation of autophagy and cell survival in the absence of apoptosis[J].Cell,2005,120(2):237-248.
[13] BOYA P,GONZ LEZ-POLO R A,CASARES N,et al.Inhibition of macroautophagy triggers apoptosis[J].Molecular and Cellular Biology,2005,25(3):1025-1040.
LEZ-POLO R A,CASARES N,et al.Inhibition of macroautophagy triggers apoptosis[J].Molecular and Cellular Biology,2005,25(3):1025-1040.
[14] GOZUACIK D,KIMCHI A.Autophagy as a cell death and tumor suppressor mechanism[J].Oncogene,2004,23(16):2891-2906.
[15] DEGENHARDT K,MATHEW R,BEAUDOIN B,et al.Autophagy promotes tumor cell survival and restricts necrosis,inflammation,and tumorigenesis[J].Cancer Cell,2006,10(1):51-64.
[16] SACILOTO B,NICOLETTI N I F,PELETTI-FIGUEIR M,et al.Crosstalk between autophagy and apoptosis in intervertebral disc degeneration[J].Journal of Bioscience and Medicines,2021,9(12):15-29.
M,et al.Crosstalk between autophagy and apoptosis in intervertebral disc degeneration[J].Journal of Bioscience and Medicines,2021,9(12):15-29.
[17] MOHAMED S M,MOHAMMED D S,ELHALIEM N G A,et al.Mangosteen can improve steatohepatitis through modulating inflammatory and autophagy/apoptosis cell injury:An animal model study[J].Cytology and Genetics,2021,55(5):480-490.
[18] KAWAGUCHI Y,KOVACS J J,MCLAURIN A,et al.The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress[J].Cell,2003,115(6):727-738.
[19] RODRIGUEZ L G,WU X Y,GUAN J L.Wound-healing assay[J].Methods in Molecular Biology,2005,294(3):23-29.
[20] ![]() U,DODURGA Y,ELMAS L,et al.Ferulic acid decreases cell viability and colony formation while inhibiting migration of MIA PaCa-2 human pancreatic cancer cells in vitro[J].Gene,2016,576(1):476-482.
U,DODURGA Y,ELMAS L,et al.Ferulic acid decreases cell viability and colony formation while inhibiting migration of MIA PaCa-2 human pancreatic cancer cells in vitro[J].Gene,2016,576(1):476-482.
[21] KOLLMAR O,RUPERTUS K,SCHEUER C,et al.CXCR4 and CXCR7 regulate angiogenesis and CT26.WT tumor growth independent from SDF-1[J].International Journal of Cancer,2010,126(6):1302-1315.
[22] KORSMEYER S J,SHUTTER J R,VEIS D J,et al.Bcl-2/Bax:A rheostat that regulates an anti-oxidant pathway and cell death[J].Seminars in Cancer Biology,1993,4(6):327-332.
[23] YANG J,LIU X,BHALLA K,ET AL.Prevention of apoptosis by Bcl-2:Release of cytochrome c from mitochondria blocked[J].Science,1997,275(5303):1129-1132.
[24] GOWN A M,WILLINGHAM M C.Improved detection of apoptotic cells in archival paraffin sections:Immunohistochemistry using antibodies to cleaved caspase 3[J].The Journal of Histochemistry and Cytochemistry:Official Journal of the Histochemistry Society,2002,50(4):449-454.
[25] PANKIV S,CLAUSEN T H,LAMARK T,et al.p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J].Journal of Biological Chemistry,2007,282(33):24131-24145.
[26] WANG J,HE J,SU F,et al.Repression of ATR pathway by miR-185 enhances radiation-induced apoptosis and proliferation inhibition[J].Cell Death &Disease,2013,4(6):e699.
[27] ZHANG S S,NIE S P,HUANG D F,et al.Immunomodulatory effect of Ganoderma atrum polysaccharide on CT26 tumor-bearing mice[J].Food Chemistry,2013,136(3-4):1213-1219.
[28] ZHANG K,ZHOU X T,WANG J Q,et al.Dendrobium officinale polysaccharide triggers mitochondrial disorder to induce colon cancer cell death via ROS-AMPK-autophagy pathway[J].Carbohydrate Polymers,2021,264:118018.